Распознание поражения палитоксином
Реферат. Палитоксин (palytoxin, РТХ; вещество ЕА 3940) — сильнейший геморрагический зоотоксин небелковой природы, обладающий кардиотоксическим и гемолитическим действием, поражающий сердечнососудистую и респираторную системы, желудочно-кишечный тракт и почки человека. Рассматривается специалистами как агент для осуществления террористических актов, диверсий и действий криминального характера. Цель работы — анализ и обобщение подходов к распознанию поражений РТХ. PTX и его аналоги содержатся в зоонтариях Palythoa spp., красных водорослях Chondria crispus, донных динофлагеллятах Ostreopsis spp. и в ассоциированных с ними морских животных и бактериях. Кораллы P. toxica содержат до 300 мкг/г PTX. Отравления людей происходят в результате употребления в пищу морских животных (крабы, сардины, анчоусы, сельди, кузовки и др.), реже через кожу при контакте кораллами Polithoa. Механизм действия PTX на субклеточном уровне проявляется в блокировании работы Na+/K+-насоса клеток мышц сердца, эритроцитов и нервной системы, и поддерживающего физиологический градиент Na+ и K+ внутри и снаружи клетки. При остром отравлении PTX смерть человека наступает в течение нескольких часов вследствие тяжелой коронарной вазоконстрикции и последующей сердечной недостаточности. При раннем начале реанимационных мероприятий или недостаточной для острого отравления дозы токсина, летальный исход возможен на вторые-третьи сутки из-за развития кардиопульмонарного шока, возникающего вследствие: рабдомиолиза дыхательных мышц; поражения стволовой части мозга; инфаркта мозга; прямого повреждения миокарда. Начиная с третьих-четвертых суток после отравления PTX, смерть наступает вследствие острой почечной недостаточности, вызванной рабдомиолизом. Летальность среди людей при неумышленных энтеральных отравлениях РТХ достигает 8%. Летальная доза PTX для человека лежит в пределах (1,0–2,0)10–5 мг/кг. Диагноз подтверждается обнаружением PTX (и его аналогов) в крови и моче пациента с помощью жидкостной хроматографии-масс-спектрометрии и биопробами. Лечение симптоматическое и патогенетическое.
Супотницкий М.В. Распознание поражения палитоксином // Жизнь без опасностей. — 2013. — № 3. — С. 56–67.
Тhe article deals with expanded analysis of approaches to recognition of palitoxin affect. The epidemiology of poisoning, the molecular structure and mechanism of action as well as toxic and injurious action are shown. The article also focuses on clinic of food intoxication, contact and inhalational affects, the recommendation on treatment.
Supotnitskiy М.V. The recognition of defeat by palitoxine // Life without dangers — 2013. — № 3. — P. 56–67.
Палитоксин (palytoxin, РТХ) — сильнейший геморрагический зоотоксин небелковой природы, обладающий кардиотоксическим и гемолитическим действием, поражающий сердечнососудистую и респираторную системы, желудочно-кишечный тракт и почки человека. Как поражающий агент химического оружия РТХ детально исследован в Эджвудском арсенале армии США под шифром «вещество ЕА 3940». Рассматривается специалистами как агент для осуществления террористических актов, диверсий и действий криминального характера [2]. В тоже время в отечественной литературе РТХ уделено мало внимания. Цель работы — анализ и обобщение подходов к распознанию поражений РТХ.
Естественная эпидемиология отравления РТХ. Впервые РТХ выделен в 1971 г. из мягких кораллов Polithoa учеными Гавайского университета (University of Hawaii) R. E. Moore и P. J. Scheuer [15]. Токсические свойства этих кораллов были издавна известны аборигенам Таити и Гавайских островов, которые их использовали для приготовления отравленного оружия. Места обитания ядовитых кораллов туземцами держались в секрете.
РТХ и его аналоги обнаружены в зоонтариях Palythoa spp. (P. toxica, P. tuberculosa, P. carbacorum, P. mammillosa, P. vestitus, P. aff. Margaritae), красных водорослях Chondria crispus и донных динофлагеллятах Ostreopsis spp. (Ostreopsis siamensis, O. mascarenensis, O. ovata). Их так же находят у организмов, живущих в тесной ассоциации с колониями зоантарий. Активность PTX обнаружена у бактерий рода Pseudomonas (Alteromonas), ассоциированных с динофлягеллятами Ostreopsis lenticularis [5]; у бактерий B. cereus, бактерий родов Brevibacterium и Acinetobacter, выделенных из зоонтарий Palythoa caribaeorum [20].
По пищевым цепям РТХ проникает в организм животных, питающихся зоонтариями, либо живущих с ними в ассоциациях животными (губки, моллюски, ракообразные, горгонии, многощетинковые черви, морские звезды Acanthaster planci и др.). Те, в свою очередь, поедаются более крупными хищниками — рыбами (сардины, анчоусы, сельди и др.), морскими ежами, крупными крабами, обитающими в тропических морях. Человек — конечное звено этой пищевой цепи (таблица 1).
Таблица 1. Случаи отравления людей морепродуктами, контаминированными РТХ*
|
География, год |
Источник РТХ |
Количество отравленных |
Симптомы и клинические данные |
Лечение |
Исход |
Другие токсины |
|
Филиппины, 1984 |
Краб Demania reynaudii |
1 |
Через несколько минут после употребления в пищу: головокружение, тошнота, усталость, металлический привкус во рту, понос, онемение конечностей, беспокойство, рвота. После госпитализации: чередование периодов тяжелой брадикардии, дыхательной недостаточности, цианоз, почечная недостаточность, анурия |
Атропин, димедрол, адреналин |
Смерть через 15 ч после отравления |
ТТХ и STX не обнаружены |
|
Япония, 1986 |
Рыба Scarus ovifrons |
2 |
Боль в мышцах, одышка, судороги. Миоглобинурия, высокие сывороточные уровни КФК, АСТ, ЛДГ |
Неописано |
Смерть (1/2) |
Найдены небольшие количества ТТХ и его аналогов |
|
Мадагаскар, 1994 |
Рыба Herklotsichtys quadrimaculatus |
1 |
Металлический вкус мяса. Через 0–2 ч после приема внутрь: общее недомогание, неконтролируемые рвота, диарея. Следующие 4,5 ч до смерти: чувство покалывание конечностей, бред |
То же |
То же |
Неописано |
|
Япония, 2000 |
Рыбы Epinephelus bruneus, E. fuscogattus |
11 |
3–36 ч после приема внутрь: миалгия, черный цвет мочи (гемоглобинурия), плечи боль. Повышенный уровень сывороточной креатинфосфатазы |
То же |
Выздоровление (11/11) |
Сигуатоксин не обнаружен |
* По [27].
Отравления людей в основном происходят в результате употребления в пищу морских животных, содержащих РТХ, реже через кожу при контакте кораллами Polithoa [2, 3, 18].
Риск неумышленного отравления РТХ в последние годы значительно повысился за пределами традиционного ареала зоантарий. Установлено, что динофлагелляты Ostreopsis, местом обитания, которых ранее считались рифы тропических и субтропических морей, распространились в Средиземном море, особенно у берегов Туниса, Испании, Франции, Италии, Монако и Греции [4]. В моря умеренных широт они попадают с балластными водами грузовых судов, и активно размножаются вследствие прогрева морской воды, вызванного глобальным потеплением климата [21].
По оценке Z. Amzil et al. [4], фильтрующие двустворчатые моллюски (мидии) и травоядные иглокожие (морские ежи), обитающие в водах Средиземного моря вблизи побережья Франции, способны за летний период накопить большие количества РТХ и его аналогов. Однако случаи отравления РТХ у людей, употреблявших в пищу моллюски, не описаны (рисунок 1).
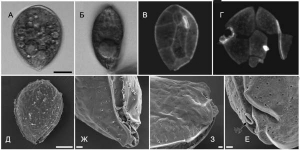 Рисунок 1. Морфология Ostreopsis spр. А и Б. Световая микроскопия. В и Г. Световая эпифлуоресцентная микроскопия. Д и Е. Сканирующая электронная микроскопия. В и Д. Эпитекальная область. Г. Гипотекальная область. Ж. Деталь вентральной области (вид сбоку) с вентральной порой (Vp). З и Е: Детали вентральной области. Полоса на фотографиях А–Д соответствует 10 мкм, Ж–Е — 1 мкм. По [19]
Рисунок 1. Морфология Ostreopsis spр. А и Б. Световая микроскопия. В и Г. Световая эпифлуоресцентная микроскопия. Д и Е. Сканирующая электронная микроскопия. В и Д. Эпитекальная область. Г. Гипотекальная область. Ж. Деталь вентральной области (вид сбоку) с вентральной порой (Vp). З и Е: Детали вентральной области. Полоса на фотографиях А–Д соответствует 10 мкм, Ж–Е — 1 мкм. По [19]
По данным А.В. Андрианова [1] на морских водорослях прибрежья Владивостока обнаружены Ostreopsis ovata и O. siamensis, являющиеся продуцентами РТХ и его аналогов, а также сигуатоксина, вызывающего отравление сигуатеру. Их численность превышает 10 тыс. клеток на один грамм сухого веса макрофита, что соответствует максимальным значениям плотности этих видов. Ранее эти водоросли находили только в тропических водах.
Естественные отравления РТХ могут проходить под маской пищевого отравления, названного клипеотоксизмом (clupeotoxism), либо массового ингаляционного отравления, известного как «синдром водорослей» («algal syndrome»). Симптомы клипеотоксизма включают тошноту, рвоту, металлический вкус во рту, диарею, неострое развитие летаргического состояния. Через несколько часов у отравленного появляется ощущение сильного жжения вокруг рта и в конечностях; мышечные спазмы, сопровождающиеся сильными мышечными болями; отдышка, дисфония. Возможна смерть вследствие развития острой сердечной недостаточности. Вспышки заболевания, которому ставят диагноз «клипеотоксизм», обычно фиксируются в бассейнах Карибского моря и Индийского океана. «Синдром водорослей» пока зафиксирован в летние месяцы на итальянском побережье Средиземного моря (Тирренское море) в периоды цветения Ostreopsis sр. Отравление проявляет себя клиникой, сходной с ОРЗ [27].
A. S. Kerbrat et al. [12] обнаружили РТХ и его аналог 42-гидроксипалитоксин у морских диазотрофных цианобактерий Trichodesmium (порядок Oscillatoriales), широко распространенных в тропиках и субтропиках, и особенно в водах Новой Каледонии. По мнению авторов работы, случаи клипеотоксизма у местных жителей, вызванные употреблением в пищу планктоноядных рифовых рыб, связаны с вовлечением в пищевую цепь цианобактерий Trichodesmium.
РТХ и его аналоги обнаружены у коралловых полипов (Anthozoa, Hexacorallia), помещенных в домашние аквариумы, и вызвавшие контактные и ингаляционные отравления у людей. В отдельных образцах кораллов количество токсина достигало 0,5–3,5 мг/г [7]. В описанном K. Hoffmann et al. [9] случае отравления, РТХ проник в кровь пациента через поврежденную кожу пальца при контакте с кораллами Parazoanthus sрp., находящимися в аквариуме. Клинические симптомы включали отек, парестезию и онемение вокруг места повреждения, распространившиеся по руке; и признаки системного отравления, такие как головокружение, общая слабость, боль в мышцах, нарушения на ЭКГ и рабдомиолиз[1]. Анализ показал чрезвычайно высокую концентрацию палитоксина в тканях кораллов (между 2 и 3 мг/г), вызвавших отравление.
Молекулярная структура и механизм действия РТХ. Химическая структура РТХ установлена в 1981 г. двумя группами исследователей. В 1994 г. E. M. Suh и Y. Kishi впервые синтезировали РТХ химическим путем [24]. PTX представляет собой большую сложную молекулу с длинным полигидроксилированным (polyhydroxylated) и частично ненасыщенным алифатическим остовом, содержащим и как липофильные, так и гидрофильные участки, и 64 хиральных центра. Последняя особенность включает наличие 8 двойных групп, способных к cis/trans-изомеризации, благодаря чему PTX может иметь более чем 1021 стереоизомеров [11]. Идентифицировано, по крайней мере, 14 аналогов PTX. Гомопалитоксин (homopalytoxin), бисгомопалитоксин (bishomopalytoxin), неопалитоксин (neopalytoxin), деопалитоксин (deopalytoxin) и 42-гидроксипалитоксин (42-hydroxypalytoxin) были обнаружены в тропических Palythoa. Остреоцин-D (ostreocin-D, 42-hydroxy-3,26-didemethyl-19,44-dideoxypalytoxin, OSD), оватоксин-А, -B, -C, -D и –E (ovatoxin-A, -B, -C, -D и –E), маскаренотоксин-А, -B и -С (mascarenotoxin-A, -B и -С), обнаружены у бентосных динофлагеллят Ostreopsis. Наиболее хорошо изучена химическая структура палитоксина и остреоцина-D (рисунок 2)
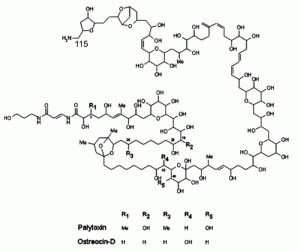 Рисунок 2. Структура палитоксина и остреоцина-D. По [13]
Рисунок 2. Структура палитоксина и остреоцина-D. По [13]
R. E. Moore и P. J. Scheuer [14] экстрагировали PTX из необработанных сырых кораллов P. toxica водным раствором 70 % этанола. Затем обращено-фазовой хроматографией на колонке с порошкообразным полиэтиленом они отделили токсин от неорганических солей и полярных органических соединений, используя для элюции 50 % водный раствор этанола. Чистый PTX они получили путем ионообменной гельфильтрации элюата сначала на DEAE-Sephadex при рН 7,0, затем на CM-Sephadex при рН 4,5. Выход PTX составил 0,027 % от массы сырых кораллов. По данным R. E. Moore et al. кораллы P. toxica могут содержать до 300 мкг/г PTX [14].
Очищенный PTX представляет собой белый аморфный гигроскопичный порошок. В кристаллической форме токсин и его аналоги пока получены не были. Брутто-формула (система Хилла) PTX: C129H223N3O54. ММ PTX укладывается в пределы от 2659 до 2680 кДа (что в 19 раз больше, чем у зарина), в зависимости от вида Palythoa, из которого он был получен. ММ остеоцина-D — 2635 кДа. ММ маскаренотоксина-А и маскаренотоксина-В находятся в пределах от 2500 до 2535 кДа, оватоксина-А — 2648 кДа. Водный раствор PTX в ультрафиолетовом спектре дает два пика поглощения: 233 и 263 нм. PTX термостабилен, температура разложения 300 0С. Он не инактивируется кипячением, стабилен в нейтральных водных растворах в течение нескольких месяцев, однако быстро разрушается под воздействием кислой и щелочной среды. Растворим в диметилсульфоксиде и пиридине, но не растворим в эфире, ацетоне и хлороформе, плохо растворим в спиртах. При растворении в воде PTX образует стойкую пену [2, 11].
Механизм действия PTX на субклеточном уровне проявляется в блокировании Na+/K+-АТФазы, лежащей в основе работы Na+/K+-насоса клеток мышц сердца, эритроцитов и нервной системы, и поддерживающего физиологический градиент Na+ и K+ внутри и снаружи клетки. Та часть белков Na+/K+-канала, которая погружена в цитоплазму клетки, имеет повышенное сродство к ионам натрия. Поверхность белков, обращенных во внеклеточное пространство, имеет повышенное сродство к калию. Внутренние сайты связывания работают тогда, когда внешние не связаны с ионами калия. Na+/K+-насос выкачивает ионы натрия из клетки, одновременно накачивая ионы калия внутрь клетки. Он транспортирует три иона Na+ из клетки и два иона К+ в клетку используя гидролиз АТФ в качестве источника энергии. Таким образом, обеспечивается низкая внутриклеточная концентрация ионов натрия и высокая — калия. Градиент концентрации ионов натрия на мембране имеет специфические функции, связанные с передачей информации в виде электрических импульсов, а также с поддержанием других активных транспортных механизмов и регулирования объема внутреннего пространства клетки.
Рецептором для PTX является транспортный белок Na+/K+-АТФаза. На внутренней поверхности мембраны она расщепляет АТФ на АДФ и фосфат. На транспортировку трех ионов натрия из клетки и одновременно двух ионов калия в клетку используется энергия одной молекулы АТФ, т. е. суммарно за один цикл работы насоса из клетки удаляется один положительный заряд. Таким образом, Na+/K+-насос является электрогенным (создает электрический ток через мембрану), что приводит к увеличению электроотрицательности мембранного потенциала приблизительно на 10 мВ. Транспортный белок выполняет эту операцию с высокой скоростью: от 150 до 600 ионов натрия в секунду. Поэтому неудивительно, что более 1/3 энергии, потребляемой клеткой, расходуется на работу Na+/K+-насоса, а в некоторых наиболее активных клетках на его работу расходуется до 70% энергии.
Молекулы PTX подавляют активный транспорт Na+ и K+ через клеточные мембраны, связываясь с внеклеточным участком Na+/K+-АТФазы. Na+/K+-насос превращается в неспецифический постоянно открытый ионный канал. Мембрана деполяризуется и в цитозоле происходит накопление Са2+. Изменение концентрации внутриклеточных катионов, в частности, увеличение кальция, как правило, вызывает гибель клеток. Внутриклеточной мишенью PTX является цитоскелет. Показано, что сигнальный каскад, индуцированный PTX и остреоцин-D, приводит к деформации нитей актина, формирующих цитоскелет. В условиях in vitro токсическое действие PTX проявляется осмотическим лизисом эритроцитов с деструкцией клеточной мембраны и высвобождением гемоглобина. Гемолиз эритроцитов можно ингибировать добавление сердечного гликозида квибаина (ouabain, g-strophanthin) — специфического ингибитора мембранной Na+/K+-АТФазы. Однако терапевтический эффект от применения квибаина при экспериментальном отравлении животных PTX, не наблюдается [16].
В условиях in vivo PTX вызывает широкий спектр вторичных фармакологических эффектов. Они включают спастическое сокращение скелетных, гладких и сердечных мышц и другие сердечнососудистые эффекты, так как высвобождение нейротрансмиттеров из терминалей нервов приводит к сокращению миоцитов. Спазм гладких мышц сосудов вызывает инфаркт миокарда, мозга и некрозы кишечника. Прямое действие PTX на клетки вызывает разрушение мышечного волокна (и, как следствие, рабдомиолиз), гемолиз эритроцитов, выброс гистамина, простагландинов, норадреналина, агрегацию тромбоцитов, костную резорбцию и ингибирование подвижности сперматозоидов. PTX является промотором опухолей, но сам мутагенных действием не обладает.
PTX вызывает необратимое увеличение цитозольной концентрации кальция в первичных культурах клеток мозжечковых гранулярных клеток (cerebellar granule cells, CGC), составляющих почти половину всех нейронов ЦНС [28].
Летальность среди людей при неумышленных энтеральных отравлениях РТХ достигает 8% (6 погибших из 75 отравленных в 20 инцидентах) [26]. Смерть при отравлении PTX наступает от разных причин в зависимости от дозы токсина, способа его введения, проводимых лечебных и реанимационных мероприятий. При остром отравлении PTX (большая доза токсина при пищевом отравлении или в/в введение) смерть наступает вследствие тяжелой коронарной вазоконстрикции (спазма коронарных сосудов) и последующей сердечной недостаточности. Изменения ЭКГ у собак и кошек после в/в введения PTX показали выраженную ишемию миокарда, ассоциированную с прекращением коронарного кровообращения. Респираторная недостаточность не является при остром отравлении PTX основной причиной смерти. Искусственная вентиляция легких у отравленных PTX животных не увеличивала дозу токсина, необходимую для летального исхода. Расширение правого желудочка у мышей, отравленных PTX, показывает выраженную легочную гипертензию, следующую за коронарнарной вазоконстрикцией [16]. При раннем начале реанимационных мероприятий или недостаточной для острого отравления дозы токсина, летальный исход возможен на вторые-третьи сутки из-за кардиопульмонарного шока (cardiopulmonary arrest), возникающего вследствие: 1) рабдомиолиза дыхательных мышц; 2) поражения стволовой части мозга, вызванного прямым действием PTX на мозжечковые гранулярные клетки; 3) инфаркта мозга, вызванного спазмом сосудов; 4) прямым повреждением PTX миокарда. Начиная с третьих-четвертых суток после отравления PTX, основную роль в летальном исходе начинает играть острая почечная недостаточность, вызванная рабдомиолизом [22].
Токсические и поражающие свойства PTX. Острая токсичность PTX для млекопитающих в основном зависит от пути его проникновения в организм. Крайне низкие летальные дозы отмечаются в случае внутривенного введения токсина. При внутривенном введении PTX примерно в 20 раз токсичнее STX и более чем в 3 тыс. раз токсичнее стрихнина. Кролики, собаки, обезьяны-резусы, крысы наиболее чувствительны к PTX при данном пути введения. Во всех случаях смерть наступает в течение нескольких минут. Токсичность PTX при трахеальном введении почти такая же, как и при внутривенном введении. Токсичность PTX при внутрибрюшинном ведении ниже, чем при внутривенном. Даже при 5 LD50 летальный исход наблюдается не ранее 1 ч после введения токсина. При дозе, приближающейся к LD50, мыши погибают в течение 12–40 ч после инъекции PTX. Летальные дозы PTX при внутримышечных и подкожных инъекциях сходы с теми, что получены при внутрибрюшинном введении. Еще менее токсичен PTX при энтеральном введении (таблица 2).
Таблица 2. Острая токсичность PTX для животных*
|
Вид |
Штамм |
Способ введения PTX |
Источник PTX |
Параметр токсичности |
Время наблюдения, ч |
Токсичность, (мкг/кг) |
|
Мышь |
ICR |
В/в |
P. vestitus |
LD50 |
24 |
0,45 (0,33–0,62) |
|
? |
P. tuberculosa |
LD50 |
? |
0,53 (0,38–0,73) |
||
|
? |
P. toxicus |
LD50 |
? |
0,15 |
||
|
Крыса |
Wistar–Sprague Dawley гибрид |
P. toxicus |
LD50 |
24 |
0,089 (0,080–0,098) |
|
|
Морская свинка |
Mongrel |
P. vestitus |
LD50 |
24 |
0,11 (0,070–0,170) |
|
|
Кролик |
NZ White |
P. vestitus |
LD50 |
24 |
0,025 (0,024–0,026) |
|
|
Собака |
Mongrel |
P. vestitus |
LD50 |
24 |
0,033 (0,026–0,041) |
|
|
P. tuberculosa |
LD50 |
? |
0,05–0,06 |
|||
|
Кошка |
? |
P. tuberculosa |
LD50 |
? |
Около 0,2 |
|
|
Обезьяна резус |
– |
P. vestitus |
LD50 |
24 |
0,078 (0,060–0,090) |
|
|
Мышь
|
ICR |
В/б |
Demania alcalai |
LD50 |
24 |
1,0–1,5 |
|
? |
? |
LD50 |
? |
0,5 |
||
|
? |
Palythoa toxica |
LD50 |
? |
0,4 |
||
|
Swiss-Webster |
Palythoa caribaeorum |
LD |
? |
0,05–0,10 |
||
|
NMRI |
P. tuberculosa |
LD50 |
48 |
0,31 (0,26–0,37) |
||
|
? |
MLD |
? |
0,6 |
|||
|
Swiss |
LD50 |
48 |
0,72 (0,64–0,80) |
|||
|
Крыса |
Wistar–Sprague Dawley гибрид |
P. vestitus |
LD50 |
? |
0,63 (0,44–0,91) |
|
|
Кролик |
Wistar–Sprague Dawley гибрид |
Через зонд |
P. vestitus |
LD50 |
72 |
>40 |
|
Мышь |
Swiss |
P. tuberculosa |
LD50 |
24 |
510 (311–809) |
|
|
CD-1 |
P. tuberculosa |
LD50 |
24 |
767 (549–1039) |
||
|
Swiss |
Вместе с пищей |
P. tuberculosa |
LD |
24 |
>2500 |
|
|
ICR |
Сублингвально |
P. tuberculosa |
LD50 |
24 |
>235 |
|
|
Крыса |
Wistar–Sprague Dawley гибрид |
В/м |
P. vestitus |
LD50 |
24 |
0,24 (0,.21–0,28) |
|
Собака |
Mongrel |
P. vestitus |
LD50 |
24 |
0,08 (0,05–0,14) |
|
|
Крыса |
Wistar–Sprague Dawley гибрид |
П/к |
P. vestitus |
LD50 |
24 |
0,40 (0,29–0,54) |
|
Мышь |
ICR |
P. vestitus |
LD50 |
24 |
1,39 (1,07–1,80) |
|
|
Крыса |
Wistar–Sprague Dawley гибрид |
Интратрахеально
|
P. vestitus |
LD50 |
5 сут |
0,31 (0,17–0,54) |
|
Крыса |
Wistar–Sprague Dawley гибрид |
P. vestitus |
LD50 |
10 сут |
0,18 (0,09–0,38) |
|
|
Мышь
|
ICR |
P. tuberculosa |
LD |
? |
>2 |
|
|
Крыса |
Wistar |
P. tuberculosa |
LD |
? |
5,0–7,5 |
|
|
Мышь |
CD-1 |
П/к |
P. tuberculosa |
LD |
? |
400–1700 |
|
Крыса |
Wistar–Sprague Dawley гибрид |
Интратрахеально |
P. vestitus |
LD |
24 |
>10 |
*По обзорной работе Munday R. [16].
Клинические наблюдения, сделанные после однократного внутривенного введения летальной дозы токсина кошкам и собакам, показали следующее. Со стороны ЭКГ — развитие брадикардии, эктопические систолы, вентрикулярная аритмия. В последующем происходит остановка дыхания. Атаксия и пилоэрекция (сокращение мышц, поднимающих волосы) наблюдаются вскоре после внутрибрюшинного введения мышам смертельной дозы PTX. Через 30–60 мин, в зависимости от дозы, у животных наступал паралич задних конечностей. Частота дыхания постепенно снижалась, паралич распространялся на все тело. Животные не реагировали на внешние раздражители, незадолго до смерти у них наблюдался цианоз и экзофтальмия. В плазме крови — повышенный уровень креатинкиназы [16].
После введения PTX через желудочный зонд (300–1697 мкг/кг) мыши линии CD-1 погибали в течение 24 ч на фоне развития дыхательной недостаточности и паралича (LD50 767 мкг/кг). В плазме крови — повышение уровней креатинфосфокиназы и лактатдегидрогеназы (при дозе токсина 600 мкг/кг и выше), и аспартаттрансаминаз (848 мкг/кг и выше) [23].
Самое заметное макроскопическое посмертное изменение при внутривенном введении PTX — выраженное расширение правого желудочка. При внутрибрюшинном — спайки брюшины, асцит и расширение тонкого кишечника: при энтеральном — гиперемия нежелезистой части желудка. После нанесения PTX на кожу у животных развивались тяжелое местное воспаление, отек и некроз. Попадание PTX в глаз индуцировало тяжелый конъюнктивит, отек, помутнение и язвы роговицы. Внутрикожное введение приводило к выраженной бледности кожи в участке введения, что объясняется сосудосуживающим действием PTX [16].
У мышей, погибших в результате интраперитонеального введения PTX, наблюдали признаки некроза отдельных клеток сердечной мышцы, некроз лимфоцитов в тимусе и селезенке. В тонком кишечнике имелись признаки кровотечения, отека и некроза. Электронная микроскопия обнаружила грубые изменения митохондрий и отдельных органелл миоцитов, утрату микроворсинок в дистальном и проксимальном отделах почечных канальцев и вакуолизацию ацинарных (секреторных) клеток поджелудочной железы. В световой микроскоп патологические изменения в клетках мышц сердца и в скелетных мышцах (soleus) мышей, отравленных введением токсина в желудок, за исключением агрегаций митохондрий и дегенерации волокон, обнаружить не удавалось. В нежелезистой части желудка наблюдалось воспаление слизистой поверхности, в почках — расширение почечных канальцев, в печени — гепатоцеллюлярная вакуолизация, в поджелудочной железе — истощение секретирующих клеток [16, 23].
Попадание PTX в трахею вызывало альвеолярное кровотечение (alveolar haemorrhage), легочный отек, эрозию слизистой желудка и кишечника, и атрофию почечных клубочков. Сходный токсический эффект был получен в результате сублингвального введения токсина в количестве 200 мкг/кг [10].
Острая токсичность аналогов PTX — остреоцина D, N-ацетилпалитоксина и 42-гидроксипалитоксина при энтеральном введении несколько меньше чем у PTX, но разница в токсичности не существенна. LD50 остероцина-D для мышей при внутрибрюшинном введении составляет 0,00075 мг/кг. При энтеральном введения летальная доза остреоцина-D вызывает у мышей эрозию желудки и кишечника. Но в отличие от PTX он не вызывает развития перитонита. Наиболее токсичным аналогом является оватоксин-А [16]. По данным E. Ito и T. Yasumoto [10] (2009) при интратрахеальном введении мышам PTX, смертельной была доза 2 мкг/кг, при том же пути введения остреоцина D его смертельная доза 11 мкг/кг.
Данных по токсичности аэрозолированного PTX в открытых источниках не обнаружено. При интратрахеальном введении летальная доза PTX лишь в четыре раза превышает таковую при внутривенном введении (см. таблицу 2), что позволило Н. С. Антонову [2] сделать вывод о высокой поражающей способности палитоксина при воздействии ингаляционным путем.
Накопленные в опытах на животных экспериментальные данные позволяют сделать весьма достоверный прогноз уровня внутривенной токсичности для человека. Согласно прогнозу Н. С. Антонова [2] летальная доза PTX при внутривенном введении человеку лежит в пределах (1,0–2,0)10–5 мг/кг.
PTX может переводиться в аэрозольное состояние из растворов с помощью распылителей или взрывом заряда взрывчатого вещества. О возможности получения аэрозолей этого токсина путем термической возгонки не сообщалось. PTX вряд ли может эффективно применяться террористами в виде заблаговременно приготовленного тонкодисперсного порошка из-за его гигроскопичности. Недостаток PTX как потенциального поражающего агента в том, что он является твердым веществом, в связи с чем существуют проблемы перевода его в аэрозольное состояние. По той же причине уровень кожно-резорбтивной токсичности не может быть столь высок по сравнению с ингаляционной токсичностью. Практически при обычных температурных условиях PTX не образует пар в концентрациях, при которых возможны поражения, из-за чего сковывающее действие PTX проявляется в значительно меньшей мере, чем у жидких отравляющих веществ. PTX, по крайней мере в настоящее время, не может производиться в количествах, необходимых для того, чтобы им снаряжали боеприпасы. Не исключено, что в будущем PTX получит производственную базу и будет представлять опасность при применении в смесях с жидкими отравляющими веществами [2].
Клиника пищевого отравления. В таблице 1 приводится описание нескольких случаев отравления людей PTX, содержащимся в морепродуктах. У рыб PTX аккумулируется в основном кишечнике и печени. Симптомы отравления у человека появляются через несколько минут после употребления в пищу отравленных морепродуктов. Они включают общее недомогание, чувство усталости, тошноту, рвоту, понос, боли в мышцах (в основном плеча и предплечья), мышечные спазмы, сердечную и легочную недостаточность. Морепродукты на вкус кажутся пациенту горькими или обладающими металлическим привкусом. Для отравления PTX типично сочетание этих симптомов с увеличением в сыворотке крови уровня креатинфосфокиназы (до 180 тыс. МЕ/л на третьи сутки болезни) и других ферментов, характерных для рабдомиолиза. При поступлении в стационар температура тела пациента может быть нормальной или пониженной (35,5 Со), АД повышенно или в норме, нарушений сенсорной чувствительности и других неврологических симптомов не бывает. В течение суток АД у пациента падает, развивается брадикардия, нарастают симптомы сердечнососудистой и легочной недостаточности. Лабораторные анализы показывают лейкоцитоз, в сыворотке повышение уровня креатинфосфокиназы, аспартатаминотрансферазы (повреждение мышечной ткани и печени), аланинаминотрансферазы (повреждение печени), лактатдегидрогеназы (разрушение любых тканей), миоглобина (повреждение мышечной ткани сердца), альдолазы (повреждение скелетной мускулатуры и печени) и С-реактивного белка (повреждение любых тканей — обычно плохой прогностический признак). В моче макрогематурия (заметное на глаз покраснение мочи), но эритроциты в осадке не находят. В последующем появляется миоглобинурия. Появление в сыворотке крови и в моче миоглобина свидетельствует о поражении сердечной мышцы. Количество миоглобина зависит от степени повреждения миокарда. Выздоровление пациента, отравленного PTX, идет медленно (более месяца). Наиболее частая причина смерти в первые несколько часов после отравления — сердечная недостаточность, вызванная коронароспазмом и прямым повреждением миокарда PTX. На вторые-третьи сутки летальный исход возможен вследствие развития кардиопульмонарного шока. В более позднем периоде опасность пациенту представляет почечная недостаточность. У пациентов, находящихся на искусственной вентиляции легких и гемодиализе, возможна смерть мозга [17, 22, 27].
В описанном T. Shinzato [22] случае отравления PTX, содержащемся в печени скаровой рыбы (parrot fish, Scarus, рыбы-попугаи), у пациента на третьи сутки после отравления развился кардиопульмонарный шок, он впал в кому, после чего находился на механической вентиляции легких до остановки сердца. С появлением признаков рабдомиолиза (вторые сутки госпитализации) ему проводили непрерывную гемодиафильтрацию (continuous hemodiafiltration, CHDF). Но так как гиперкалиемию и гиперфосфатемию (признаки почечной недостаточности) не удалось взять под контроль, на 4-е сутки госпитализации CHDF заменили на гемодиафильтрацию (hemodiafiltration, HDF) с 10 л замещающего раствора. На 9-у сутки госпитализации у пациента диагностирована смерть мозга (cerebral death). На 11-е сутки объем мочи стал увеличиваться и к 14-м суткам достиг 1300 мл/сут, что свидетельствовало о снятии состояния острой почечной недостаточности. Родственники попросили отключить диализ, что и было сделано на 11 сутки госпитализации. У пациента развилось состояние тяжелой гиперкалиемии, на 16 сутки госпитализации он умер от сердечной недостаточности, вызванной гиперкалиемией.
Посмертные патологические изменения у людей, погибших от острого энтерального отравления PTX, включают наличие геморрагических уплотнений на слизистой тонкого кишечника и в проксимальном участке толстой кишки. В этих же участках кишечника патологоанатомы обнаруживают скопление геморрагического выпота [25].
Клиника ингаляционного поражения. Со средины прошлого десятилетия вдоль итальянской, французской и испанской береговой линии наблюдается цветение Ostreopsis sрр. Одновременно с цветением новых для этих мест динофлагеллят, врачи стали отмечать новую массовую патологию, развивающуюся у людей, находящихся на берегу моря во время шторма, либо участвовавших в спортивных соревнованиях, сопровождающихся образованием брызг воды. Новая болезнь была клинически сходна с ОРЗ, но развивалась летом и имела более тяжелое течение. Так как болезнь ассоциировалась с цветением моря, ее назвали «синдром водорослей». Исследование воды в периоды массовых вспышек «синдрома водорослей», показало высокое содержание PTX и его аналогов, среди которых преобладал оватоксин-А — основной токсин, продуцируемый Ostreopsis ovata [8]. В таблице 3 приведены данные по двум вспышкам, вызванным вдыханием частиц морского аэрозоля, содержащего PTX.
Таблица 3. Вспышки ингаляционного отравления PTX на морском побережье
|
География, год |
Источник токсина** |
Количество случаев отравления |
Симптомы и клинические данные |
Лечение |
Последствия |
|
Италия, Тирренское море, лето 2005 |
O. ovata |
209 |
Лихорадка, воспаление гортани, кашель, отдышка, головная боль, тошнота, слезотечение, обильный насморк, рвота, дерматиты. Умеренный лейкоцитоз, нейтрофилия |
Ингаляция кортикостероидов и бета-агонистов, нестероидные противовоспалительные препараты, кислородная терапия отдельным госпитализированным пациентам |
Выздоровление в течение трех сут |
|
То же, лето 2006 |
O. ovata |
19 |
Лихорадка, воспаление гортани, кашель, отдышка, головная боль, тошнота, слезотечение, риноррея, рвота |
* По [27].
** Обнаружение PTX и его аналогов в микроводорослях выполнено с помощью LC-MS.
Большинство эпизодов отравления, вызванного ингаляцией PTX, приходится на средину лета — пик цветения O. ovate. Диагноз «синдром водорослей» ставят на основании анамнеза пациента и клиники болезни. В анамнезе таких пациентов имеются указания на посещение морского курорта, и их присутствие на берегу моря не далее 90 м от воды, контаминированной цветущими водорослям Ostreopsis sp. Клинически у пациента находят в различных сочетаниях симптомы раздражения верхних и нижних дыхательных путей (иногда сопровождающиеся бронхоспазмом), конъюнктивит, отдышку, воспаление гортани, обильный насморк, лихорадку (до 38 0С), слезотечение, тошноту и рвоту, дерматит. От экспонирования к аэрозолю, содержащему PTX, до развития первых симптомов отравления, проходит 3–4 ч. До 20 % отравленных нуждались в госпитализации продолжительностью до трех суток. При поступлении в стационар у них обнаруживали умеренный лейкоцитоз и нейтрофилез. Биохимия крови была норме. ЭКГ и рентгенограммы грудной клетки также оставались в норме, что позволяет классифицировать эти отравления PTX как легкие [27].
Клиника контактного поражения. PTX обладает раздражающим действием на кожу и слизистые поверхности. Тяжесть симптомов зависит от продолжительности контакта с кораллами, содержащими PTX, и от наличия повреждений кожи, которые могли бы облегчить проникновения токсина в кровь. При локальном воздействии PTX вызывает онемение участка кожи, контактировавшего с кораллом, эритему, отек и даже некроз кожи. При попадании в глаз токсин вызывает лакримацию, раздражение и конъюнктивит. Через сутки происходит помутнение и изъявление роговицы, пораженный глаз закрывается. При тяжелых отравлениях добавляются общие симптомы: металлический привкус во рту, боли в груди, в брюшной полости, головокружение, слабость, сильные мышечные боли и спазмы мышц, парестезии. Биохимия крови показывает развитие умеренного рабдомиолиза. ЭКГ в начальной стадии отравления демонстрирует синусовую тахикардию без ишемии или с ишемией миокарда, в зависимости от полученной пациентом дозы PTX.
Диагностика поражения PTX. Естественные отравления PTX возможны: 1) пероральным путем при употреблении в пищу морепродуктов (крабы, сардины, анчоусы, сельди, кузовки и др.). Как правило, такие отравления происходят в тропических и субтропических регионах, но с потеплением климата их география может расшириться; 2) чрезкожно, при соприкосновениями с кораллами Palythoa spp. в тропических и субтропических регионах, а так же в домах, где есть аквариумы с представителями зоантарий, содержащих PTX. Отравление обычно происходит в результате соприкосновения с зоонтарими во время чистки аквариума; 3) ингаляционно в прибрежной морской полосе и не далее 90 м от воды, контаминированной цветущими водорослям Ostreopsis spр. Естественные чрезкожные и пищевые отравления PTX носят единичный характер. Естественные ингаляционные отравления могут быть массовыми, но, как правило, такие отравления протекают в легкой форме и сопровождаются в основном поражением верхних дыхательных путей, так как при таком способе образовании аэрозоля не создается высоких концентраций частиц аэрозоля PTX с размером дисперсной фазы 1–5 мкм.
Дифференциальная диагностика пищевого отравления PTX проводится с отравлениями, вызванными сигуатоксином (сигуатера), STX и TTX. Отравление сигуатоксином происходит при потреблении крупной рифовой рыбы и, в отличие от PTX, приводит к более тяжелым симптомам со стороны желудочно-кишечного тракта (тошнота, рвота, диарея) и к специфичному обратному восприятию температуры: горячее кажется холодным, а холодное — горячим.
Дифференциальная диагностика с отравлениями, вызванными паралитическими токсинами STX и TTX, основывается на отсутствии у пациента симптомов вялого паралича скелетных мышц и поражения периферических нервов (парестезии). Для отравления PTX будет характерна боль в мышцах и мышечные спазмы при отсутствии параличей и парезов на начальном этапе отравления, острое развитие сердечной недостаточности, биохимические признаки рабдомиолиза, длительный период выздоровления. Кроме того, отравление TTX обычно происходит при употреблении в пищу продуктов, полученных из рыб рода скалозубов (Sphaeroides, Fugu, рыбы-собаки) и рода тетраодонов (Tetraodon) из семейства иглобрюховых (Tetraodontidae) и морских брюхоногих моллюсков. Отравления STX обычно связаны с употреблением в пищу мяса мидий, крабов, лобстеров, отдельных пород рыб (рыбы-собаки, японская скумбрия и др.), обитающих на коралловых рифах. Сигуатоксин, STX и TTX не вызывают рабдомиолиза.
При искусственном ингаляционном поражении PTX первые симптомы буду сходны с теми, что наблюдаются при «синдроме водорослей» (воспаление гортани, кашель, отдышка, головная боль, тошнота, слезотечение, риноррея, рвота), однако вследствие большей концентрации токсина в аэрозоле они будут носить более выраженный характер и сопровождаться симптомами острой легочно-сердечной недостаточности. Летальные исходы возможны в течение от нескольких минут до нескольких часов после нападения на фоне острой легочно-сердечной недостаточности, в зависимости от ингалируемой дозы PTX.
«Патология мелкодисперсного аэрозоля», т.е. характерное поражение легочной ткани, возникающее после экспонирования к аэрозолю поражающего агента с дисперсностью частиц 1–5 мкм, для PTX не описано ни у людей, ни у экспериментальных животных. Но из тех лаконичных описаний экспериментов, выполненных на животных, что есть в доступной литературе, и данных по механизму действия PTX, можно предположить, что у пациентов, проживших более суток от момента экспонирования к аэрозолю PTX, «патология мелкодисперсного аэрозоля» будет сходна с аналогичной патологией, вызванной поражением мелкодисперсным аэрозолем рицина. Наиболее тяжелые видимые и микроскопические поражения будут обнаружены в нижнем респиратором тракте. В легочных долях — мультифокальный сливающийся некроз и воспалительные изменения эпителия воздушных путей, перибронховаскулярный отек, альвеолярное затопление (alveolar flooding), фибринозногнойные альвеолиты (fibrinopurulent alveolitis), интерстициальная пневмония с участками некроза и некротизацией терминальных бронхиол [8, 29].
Отличия при ингаляционном поражении PTX от аналогичного поражения рицином будут состоять в большей выраженности симптомов острой сердечной недостаточности и развитием рабдомиолиза у экспонированных к PTX лиц, не погибших в первые сутки от острой коронарной недостаточности. Искусственные ингаляционные поражения PTX будут носить характер групповых вспышек, и эти группы будет объединять какой-то общий географический фактор (аэропорт, кинотеатр, метро, учреждение и др.), но без указаний на прием общей пищи. Чем ближе расстояние до источника аэрозоля PTX, тем больше может оказаться пациентов острой коронарной недостаточностью, с поражением глаз, ринореей, дерматитами, воспалением верхних дыхательных путей и «патологией мелкодисперсного аэрозоля».
Диагноз отравления РТХ подтверждается обнаружением РТХ (и его аналогов) в крови и моче пациента с помощью LC-MS и биопробами. Об источнике PTX может многое рассказать сравнительное исследование его аналогов.
Иммунопрофилактика. Не разработана. В условиях эксперимента специфические антитела нейтрализуют активность STX.
Лечение. Симптоматическое и патогенетическое. После перорального попадания токсина в организм человека, следует применять стандартные меры для пищевого отравления, включая промывание желудка и введение в ЖКТ суперактивированного угля. В легких случаях отравления применяют ингаляционно кортикостероидные препараты и нестероидные противовоспалительные препараты. При бронхоспазме пациентам назначают ингаляционно бета2-агонисты (бета2-адреномиметики) вместе с кислородной терапией. В остром периоде отравления эффективно введение вазодилататоров непосредственно в сердце. В случае появления признаков легочно-сердечной недостаточности необходимо перейти на контролируемую механическую вентиляцию легких. При развитии рабдомиолиза и угрозе развития почечной недостаточности использовать CHDF или HDF с постоянным контролем активности мозга.
Список сокращений, нераскрытых в тексте
LC-MS (liquid chromatography–mass spectrometry) — жидкостная хроматография-масс-спектрометрия.
LD50 — (lethal dose, 50%) — средняя доза вещества, вызывающая гибель половины членов испытуемой группы.
spp. (speciales) — виды.
STX (saxitoxin) — сакситоксин.
TTX (tetrodotoxin) — тетродотоксин.
АД — артериальное давление.
АДФ — аденозиндифосфат.
АТФ — аденозинтрифосфат.
ЖКТ — желудочно-кишечный тракт.
кДа — килодальтон.
мВ — милливольт.
МЕ — международная единица.
мкм — микрон.
ММ — молекулярная масса.
нм — нанометр.
ОРЗ — острое респираторное заболевание.
ЭКГ — электрокардиограмма.
Список использованных источников
1. Андрианов А.В. Экологическая безопасность дальневосточных морей России. Владивосток, 2009 (электронный ресурс —http://www.biosoil.ru/hydro/Xmeet/05.pdf).
2. Антонов Н. С. Химическое оружие на рубеже двух столетий. — М., 1994.
3. Орлов Б. Н., Гелашвили Д. Б. Зоотоксинология (ядовитые животные и их яды). М., 1985.
4. Amzil Z., Sibat M., Chomerat N. et al. Ovatoxin-a and palytoxin accumulation in seafood inrelation to Ostreopsis cf. ovata blooms on the french mediterranean coast // Mar. Drugs. — 2012. — Vol. 10. — P. 477–496.
5. Carballeira N. M., Emiliano A., Sostre A. et al. Fatty acid composition of bacteria associated with the toxic dinoflagellate Ostreopsis lenticularis and with Caribbean Palythoa species // Lipids. — 1998. —Vol. 33. — P. 627–632.
6. Ciminiello P., Dell'Aversano C., Fattorusso E. et al. Putative palytoxin and its newanalogue, ovatoxin-A in Ostreopsis ovata collected along the Ligurian coasts during the 2006 toxic outbreak // J. Am. Soc. Mass Spectrom. — 2008. — Vol. 19. — P. 111–120.
7. Deeds J. R., Handy S., White K. et al. Palytoxin found in Palythoa sp. zoanthids (Anthozoa, Hexacorallia) sold in the home aquarium trade // PLoS ONE. — 2011. — Vol. 6 (e18235. doi:10.1371/journal.pone.0018235).
8. Franz D., Jaax N. Ricin toxin // Medical aspects of Chemical and Biological Warfare / Ed. F. R. Sidell, E. T. Tafuqi, D. R. Franz. — Washington, 1997. — P. 631–642.
9. Hoffmann K., Hermanns-Clausen M., Buhl C. et al. A case of palytoxin poisoning due to contact with zoanthid corals through a skin injury // Toxicon. —2008. — Vol. 51, № 8. — P. 1535–1537.
10. Ito E., Yasumoto T. Toxicological studies on palytoxin and ostreocin-D administered to mice by three different routes // Toxicon. — 2009. — Vol. 54. — P. 244–251.
11. Katikou P. Chemistry of palytoxins and ostreocins // In Phycotoxins, Chemistry and Biochemistry; Botana L.M., Ed.; Blackwell Publishing: Ames, IA, USA. — 2007. — P. 75–93.
12. Kerbrat A. S., Amzil Z., Pawlowiez R. et al. First evidence of palytoxin and 42-hydroxy-palytoxin in the marine cyanobacterium Trichodesmium // Mar. Drugs. — 2011. — Vol. 9. — P. 543–560.
13. Louzao M., Ares I., Cagide E. Marine toxins and the cytoskeleton: a new view of palytoxin toxicity // FEBS Journal. — 2008. — Vol. 275. — P. 6067–6074.
14. Moore R. E., Helfrich P., Patterson G. M. L. The deadly seaweed of Hana. Oceanus. — 1982. — Vol. 25. P. — 54–63.
15. Moore R. E., Scheuer P.J. Palytoxin: a new marine toxin from a coelenterate // Science. — 1971. — Vol. 172. — P. 495–498.
16. Munday R. Palytoxin toxicology: Animal studies // Toxicon. — 2011. — Vol. 57. — P. 470–477.
17. Okano H., Masuoka H., Kamei S. et al. Rhabdomyolysis and myocardial damage induced by palytoxin, a toxin of blue humphead parrotfish // Int. Med. — 1998. — Vol. 37. — P. 330–333.
18. Ramos V., Vasconcelos V. Palytoxin and analogs: biological and ecological effects // Mar. Drugs. — 2010. — Vol. 8. — P. 2021–2037.
19. Sato S., Nishimura T., Uehara K. et al. Phylogeography of Ostreopsis along West pacific coast, with special reference to a novel clade from Japan // PLoS ONE. — 2011. — Vol. 6, № 12 (e27983. doi:10.1371/journal.pone.0027983).
20. Seemann P., Gernert C., Schmitt S. et al. Detection of hemolytic bacteria from Palythoa caribaeorum (Cnidaria, Zoantharia) using a novel palytoxin-screening assay // Anton. Leeuw. Int. J. G. — 2009. — (doi:10.1007/s10482-009-9353-4).
21. Shears N. T., Ross P. M. Blooms of benthic dinoflagellates of the genus Ostreopsis; an increasing and ecologically important phenomenon on temperate reefs in New Zealand and worldwide // Harmful Algae. — 2009. — Vol. 8. — P. 916–925.
22. Shinzato T., Furusu A., Nishino T. et al. Cowfish (Umisuzume, Lactoria diaphana) poisoning with rhabdomyolysis // Inter. Med. — 2008. — Vol. 47. — P. 853–856.
23. Sosa S., Del Favero G., De Bortoli Met. al. Palytoxin toxicity after acute oral administration in mice // Toxicol. Lett. — 2009. — Vol. 191 (2–3). —P. 253–259.
24. Suh E. M., Kishi Y. Synthesis of palytoxin from palytoxin carboxylic acid // J. Am. Chem. Soc. — 1994. — Vol. 116. — P. 11205–11206.
25. Tan C. T. T., Lee E. J. D. A fatal case of crab toxin (Lophozozymus pictor) poisoning // Asia Pac. J. Pharmacol. — 1988. — Vol. 3. — P. 7–9.
26. Taniyama S., Arakawa O., Terada M. et al. Ostreopsisspa possible origin of palytoxin (PTX) in parrotfish Scarus ovifrons // Toxicon. — 2003. — Vol. 42. — P. 29–33.
27. Tubaro A., Durando P., Del Favero G. et al. Case definitions for human poisonings postulated to palytoxins exposure // Toxicon. — 2011. — Vol. 57. — P. 478–495.
28. Vale-Gonzalez C., Gomez-Limia B., Vieytes M. R. et al. Effects of the marine phycotoxin palytoxin on neuronal pH in primary cultures of cerebellar granule cells // J. Neurosci. Res. — 2007. — Vol. 85. — P. 90–98.
29. Wilhelmseann C., Pitt L. Lesions of acute inhaled lethal ricin intoxication in Rhesus monkeys // Vet. Pathol. — 1996. — Vol. 33. — P. 296–302.
Библиографическое описание:
Супотницкий М.В. Распознание поражения палитоксином // Жизнь без опасностей. — 2013. — № 3. — С. 56–67.
Supotnitskiy М.V. The recognition of defeat by palitoxine // Life without dangers — 2013. — № 3. — P. 56–67.
Ссылки по теме:
Супотницкий М.В. Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений. М., 2013.
Супотницкий М.В. Распознание поражений рицином // Прикладная токсикология. — 2013. — № 1 (9). — № 44–49.
Супотницкий М.В. Нанообъекты как новая биологическая угроза // Нанотехнологии и охрана здоровья. — 2013. — № 4. — С. 22–41.
Супотницкий М.В. Эпидемиология искусственных эпидемических процессов как третий раздел эпидемиологии // Новости медицины и фармации. — 2013. — № 5 (449).
Супотницкий М. В. Развитие биологического оружия еще не начиналось. Беседа с журналистом Иваном Ленцевым (полная версия) // Солдаты России. — 2009. — № 7–9. — С. 76–86.
Цикл статей по истории биологического оружия
I. Боги-«биотеррористы» и древние отравители // Офицеры. — 2011. — № 5. — С. 56-61.
II. Средневековые «сеятели чумы» // Офицеры. — 2011. — № 6. — С. 56-61.
III. Бактериологические диверсии Первой мировой // Офицеры. — № 1. — С. 58–63.
V. Крах «отряда 731» // Офицеры. — 2012 — № 3. — С. 62–67.
VI. Повелители эпидемий // Офицеры. — 2012 — № 5. — С. 56–61.
VII. Бактериологическая война в Корее // Офицеры — 2013. — № 1. — С. 58–63.
VIII. От расцвета до запрета // Офицеры — 2013. — № 3. — С. 58–61.
ЗАБЫТАЯ ХИМИЧЕСКАЯ ВОЙНА 1915-1918 гг.
(цикл статей о применении химического оружия в годы Первой мировой войны):
IV. Химическая война в России // Офицеры. — 2010. — № 6 (50). — С. 52–57.
VI. Адское пламя. Огнеметы Первой мировой войны // Офицеры. — 2011. — № 2 (52). — С. 56–61.
VII. Отложенный апокалипсис. Почему Вторая мировая война не стала химической // Офицеры. — 2011. — № 3 (53). — С. 56–61.
[1] Рабдомиолиз — синдром, представляющий собой крайнюю степень миопатии и характеризующийся разрушением клеток мышечной ткани, резким повышением уровня креатинкиназы и миоглобина, миоглобинурией, развитием острой почечной недостаточности.

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2013, палитоксин

