Эпидемиология искусственных эпидемических процессов как третий раздел эпидемиологии
Цель данной работы — обоснование третьего раздела эпидемиологии — эпидемиологии искусственных эпидемических процессов и других умышленно вызванных биологических поражений (неправильной эпидемиологии). В статье приведены доказательства того, что эпидемиология, этиология и клиника естественных и искусственно вызванных эпидемий (вспышек) и других массовых искусственных поражений населения биологической природы, имеют принципиальные отличия. И если не будет своевременно выявлен искусственный характер эпидемии (вспышки) инфекционной болезни, то попытки ее прерывания за счет воздействия на звенья классической триады эпидемического процесса, окажутся неэффективными. Поэтому искусственные эпидемические процессы и другие, умышленно вызванные биологические поражения должны рассматриваться как самостоятельные объекты эпидемиологического исследования. Неправильная эпидемиология — это система научных знаний, обосновывающих распознание искусственно вызванных вспышек (эпидемий) инфекционных болезней, поражений биологическими токсинами, искусственными генетическими конструкциями и наночастицам, а также устранение (минимизацию) их последствий и оказание содействия правоохранительным органам в выявлении организаций и преступников, осуществивших применение биологических агентов для поражения людей. В отличие от общей и частной эпидемиологии, в компетенцию неправильной эпидемиологии не входит предотвращение вспышек (эпидемий) инфекционных болезней и поражений другими биологическими агентами. Их предотвращение является задачей правоохранительных органов.
Супотницкий М.В. Эпидемиология искусственных эпидемических процессов как третий раздел эпидемиологии // Новости медицины и фармации. — 2013. — № 5 (449).
Современное деление эпидемиологии на общий и частный разделы сложилось более чем 100 лет назад, когда была установлена роль микроорганизмов в развитии эпидемических процессов, и еще не существовало угрозы искусственных эпидемий, вызванных применением биологического оружия (БО) или актами биотеррора. Однако за прошедшие годы эпидемические угрозы качественно изменились. Во-первых, начавшаяся в 1930-х гг. гонка биологических вооружений дала возможность ряду развитых стран накопить опыт по созданию и применению БО. Во-вторых, так называемая «почтовая эпидемия сибирской язвы», вспыхнувшая осенью 2001 г. в США, показала, что в мире имеются силы, способные профессионально осуществлять биотеррористические акты в рамках стратегий непрямых действий, оставаясь при этом неустановленными[1]. В третьих, в настоящее время способы и средства биологического поражения людей по своим возможностям, вышли далеко за пределы эпидемических процессов, которые являются объектами изучения общей и частной эпидемиологии. Поэтому цель данной работы состоит в обосновании нового раздела эпидемиологии — эпидемиологии искусственных эпидемических процессов и других, умышленно вызванных биологических поражений (неправильной эпидемиологии)[2], способного разрабатывать подходы к их распознанию и устранению последствий.
Ограниченность общей и частной эпидемиологии при описании новых средств биологического поражения людей. Биологические поражающие агенты — это Кантовская «Вещь в себе» («Ding an sich»). Обычно специалисты, пишущие на темы биологических угроз, перечисляют в табличной форме десятки микроорганизмов и токсинов, способных вызывать поражения людей (см. работу [7]). Но оценить по формальным признакам потенциальную опасность какого-то конкретного из них, и сказать, что биологический агент, прописанный под № 5, опасней того, что прописан под № 10, будет серьезным упрощением проблемы противодействия актам биотеррора и биодиверсий. Основное преимущество преступников перед системой здравоохранения и правоохранительными органами государства — фактор внезапности. Именно преступники, сообразуясь с обстоятельствами, будут выбирать время и место совершения преступления. Например, секта раджинишистов, умело используя отсутствие контроля за продуктами в салат-барах городка Даллас (штат Орегон, США), добилась инкапситации 751 человека возбудителем сальмонеллеза, не рассматриваемого в качестве потенциального агента БО из-за низкой летальности среди заболевших [66]. Возбудитель сибирской язвы вызвал панику в 2001 г. в США не количеством жертв, а уже своим появлением в почтовых рассылках известным политикам и журналистам [25, 41].
На момент подписания ведущими государствами в 1972 г. «Конвенции о запрещении разработки, производства и накопления запасов бактериологического (биологического) и токсинного оружия и их уничтожении», в качестве биологических поражающих агентов рассматривались только микроорганизмы и бактериальные токсины. Вызываемые ими эпидемические процессы и поражения (токсины) формально попадали в компетенцию общей и частной эпидемиологии. Но за сорок лет ситуация в военной биологии сильно изменилась. К уже имевшимся биологическим агентам добавились принципиально новые, не вызывающие инфекционный процесс (т. е. репликации микроорганизма в организме человека) у человека. Их применение не проявляет себя эпидемиями в их традиционном понимании. К таким биологическим агентам L. Black [16][3] относит искусственные (химерные) генетические конструкции, разрабатывающиеся в рамках технологии соматической генной терапии наследственных и инфекционных болезней, а D. M. Goncalves с соавт. [32] — нанообъекты. Последние авторы заявляют о необходимости формирования новой ветви токсикологии — нанотоксикологии, т. е. науки, изучающей потенциальную опасность наноструктур и наномеханизмов[4]. Искусственные генетические конструкции и нанообъекты воздействуют на клетку через специфические рецепторы, т.е. обладают биологической специфичностью. Поэтому к биологическим поражающим агентам в настоящее время следует относить не только специально отобранные возбудители инфекционных болезней и вещества биологического происхождения, но и вещества, действующие как молекулы биологического происхождения, способные при умышленном применении вызывать массовые поражения людей, животных и растений.
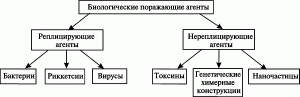
Вследствие этого, как первый шаг к созданию современной классификация биологических поражающих агентов для третьего раздела эпидемиологии, их целесообразно разделить по способности к репликации в организме человека на две группы: реплицирующиеся и нереплицирующиеся агенты. Такая классификация не учитывает «рейтинги» предыдущих, но является удобной для медицинских работников и сотрудников правоохранительных органов при установлении факта совершенного преступления (рис. 1).
Рис. 1. Классификация биологических поражающих агентов.
Группа реплицирующихся агентов представлена живыми организмами (бактерии, риккетсии, вирусы). Их поражающее действие зависит от способности агента вызывать специфический инфекционный процесс у человека. Установление факта преступления с использованием агентов данной группы, начинается с выявления инфицированных ими людей, т. е. случаев инфекционных заболеваний. Группа нереплицирующихся агентов представлена химическими соединениями и макромолекулами разной сложности организации (токсины, генетические конструкции) и наночастицами. Их поражающее действие проявляется способностью специфическим образом воздействовать на определенные мишени в организме человека. Установление факта преступления, совершенного с использованием агентов данной группы, начинается с выявления людей, специфическое поражение[5] которых произошло без развития инфекционного процесса
Для понимания объекта, цели и задач неправильной эпидемиологии, сопоставим эпидемиологический, этиологический и клинический аспекты искусственных и естественных эпидемий (вспышек) инфекционных болезней (табл. 1).
Таблица 1
Сопоставление естественных и искусственно вызванных эпидемий (вспышек) по основным признакам
|
Эпидемиологический аспект |
||
|
Признак |
Естественная |
Искусственная |
|
Масштабность и длительность эпидемии |
Определяют: сложность и эшелонированность природных резервуаров возбудителей инфекционных болезней; многообразие эпидемических цепочек, дублирующих друг друга; продолжительность активности природного очага возбудителя инфекционной болезни; наличие высоко восприимчивой к возбудителю популяции людей; эффективность противоэпидемических мероприятий |
Определяют: общий замысел преступления; кратность применения биологического агента; количество, качество и физико-химические свойства применяемой биологической рецептуры; метеоусловия; биологические свойства самого агента (вирулентность, резистентность к лекарственным препаратам, способность преодолевать специфический иммунитет и др.) |
|
Завершение эпидемии |
Угасание природного очага возбудителя инфекционной болезни. Самоторможение эпидемического процесса из-за формирования иммунной прослойки среди населения. Эффективная работа противоэпидемической службы |
Достижение цели, которую ставили перед собой злоумышленники. Эффективная работа противоэпидемической службы. Пресечение деятельности биотеррористической (диверсионной) организации правоохранительными органами |
|
Информационная составляющая эпидемии |
Формируется стихийно, как отражение представлений об эпидемиях в массовом сознании населения, коррупционных и коммерческих интересов групп, пытающихся «заработать» на эпидемии |
Планируется заранее и осуществляется последовательно, как основная составляющая биологического террористического акта |
|
Этиологический аспект |
||
|
Свойства этиологического агента |
Этиологическим агентом является патогенный микроорганизм с характерными для него биологическими свойствами |
Этиологическим агентом является специальная рецептура, имеющая определенную дисперсность частиц, и содержащая патогенный микроорганизм. Биологические свойства возбудителя инфекционной болезни могут отличаться от встречающихся во время природных вспышек (устойчивость к отдельным лекарственным препаратам, повышенная вирулентность, способность преодолевать иммунитет, вызванный вакцинацией и др.) |
|
Инфицирование человека этиологическим агентом |
Осуществляется способом, характерным для эпидемиологии данной инфекционной болезни |
Осуществляется способом, выбранным злоумышленником (ингаляционно, энтерально или инъекционно) |
|
Поддержание этиологического агента |
Обычно поддерживается природных очагах, на территории которых проживает периодически инфицируемая популяция людей; иногда имеют место «завозные случаи», но для них можно проследить эпидемическую цепочку, начинающуюся с территорий природных очагов этой болезни |
Инфицирование людей осуществляется штаммами, селекционируемыми и поддерживаемыми в лабораторных условиях |
|
Идентификация этиологического агента |
Проводится для установления причины эпидемии, нозологии болезни, выявления эпидемических цепочек и др. подобных целей; выявление тонких генетических отличий между штаммами, вызвавшими вспышку, не обязательно |
Выявление тонких генетических отличий между штаммами, вызвавшими вспышку, обязательно, так как позволяет установить факт искусственного вмешательства в геном микроорганизма, определить масштабы теракта (диверсии) и получить доказательства причастности отдельных лиц к их организации |
|
Клинический аспект |
||
|
Роль возбудителя инфекционной болезни в развитии клиники болезни |
Характерная нозологическая форма. Особенности клинического течения болезни определяет специфичность возбудителя, его вирулентность, доза заражения, и особенности реакции иммунной системы индивидуума на возбудитель болезни |
На клинику болезни также будет влиять способ применения биологического агента; физические и химические свойства биологической рецептуры, в составе которой будет находиться биологический агент |
|
Роль возбудителя болезни в патогенезе болезни |
Возбудитель инфекционной болезни является пусковым механизмом патогенеза болезни, уже известного из наблюдений над прошлыми эпидемиями |
Патогенез болезни будет зависеть от места аппликации возбудителя болезни, от физических и химических свойств биологической рецептуры, в составе которой он будет находиться |
|
Патологоанатомическая и патоморфологическая диагностика |
Посмертная диагностика инфекционной болезни |
Установление механизма и пути инфицирования жертвы биологического нападения, установление технического уровня, достигнутого нападавшей стороной при создании БО и организации биологического нападения |
Эпидемиология искусственных эпидемий (вспышек) и поражений токсинами. Внешнее сходство между естественными и искусственными эпидемическими процессами обнаруживается без особого труда — появление на определенной территории за определенный период времени людей с одним и тем же инфекционным заболеванием, однако единой внутренней логики у них нет. Масштабность и длительность этих процессов зависят от различных факторов. Классическая триада эпидемического процесса предполагает наличие: источника возбудителя инфекции (например, эпизоотии среди диких животных), механизма передачи возбудителя инфекции (наличие инфицированных насекомых, способных паразитировать на людях и животных; например, блохи, как переносчики возбудителя чумы от больных чумой крыс к людям) и восприимчивости населения к данной инфекции. Сложная и эшелонированная организация природных резервуаров возбудителей инфекционных болезней, многообразие эпидемических цепочек, дублирующих друг друга, продолжительная активность природного очага возбудителя инфекционной болезни, могут превратить естественно возникшую эпидемию в катастрофу. Но выключение (искоренение) любого из факторов эпидемического процесса приводит к его остановке [13]. Уже по этим причинам о механизмах развития искусственного эпидемического процесса, о его структуре, движущим силам, проявлениям и типам, нельзя судить на основе представлений о естественном эпидемическом процессе.
Триада при искусственных эпидемических процессах иная. Источником возбудителя инфекционной болезни при применении БО и осуществления биологических убийств или терактов становятся специальные устройства, разработанные для ведения биологической войны, осуществления биологических убийств и терактов (рис. 2).
Рис. 2. Специальные устройства, разработанные для ведения биологической войны, осуществления биологических убийств и терактов. А. Американская кассетная 500 фунтовая биологическая бомба М33. Включала 108 суббоеприпасов М114. По [49]. Б. Пуля, извлеченная британскими врачами в 1978 г. из тела болгарского диссидента Георгия Маркова. Представляла собой покрытый воском пустотелый шарик, состоящий на 9/10 из платины и 1/10 иридия. Воск расплавлялся при температуре тела, высвобождая растительный токсин рицин. Пуля содержала примерно 500 мкг рицина. По [14]. В. Конверт письма с рецептурой спор возбудителя сибирской язвы на имя ведущего телекомпании Эй-Би-Си Тома Брокау (Tom Brokaw). Г. Стреловидные элементы американских спецслужб, предназначенные для индивидуальных убийств с помощью химических или биологических агентов. По [49]
При воздушно-капельном инфицировании возбудителем инфекционной болезни в природном очаге, источником инфекции является больной человека. Дисперсность капелек мокроты (200–50 мкм), образующихся при кашле или чихании, не позволяет им распространяться на значительное расстояние от источника. Капли такого размера движутся через воздух (газовую фазу) и быстро оседают. Как правило, заболевают люди, находящиеся в непосредственной близости от больного. Масштабируют вспышки воздушно-капельных инфекций любые факторы внешней среды и санитарного состояния территорий, которые приводят к скученности людей. При применении биологического агента террористами его источником является техническое устройство. Это устройство формирует механизм передачи возбудителя инфекционной болезни — облако частиц мелкодисперсного биологического аэрозоля. Такие частицы движутся вместе с воздухом (газовой фазой), т. е. ведут себя как газ и могут распространяться на значительно большие расстояния, чем капельки мокроты больного человека. Критическую роль в масштабировании вспышки болезни играют совершенно иные факторы, чем при воздушно-капельной инфекции. Прежде всего, это: 1) физическая и биологическая устойчивость аэрозоля; 2) дисперсность вдыхаемого человеком аэрозоля (см. ниже); 3) масштабность и кратность биологических атак [8] (рис. 3).
 Рис. 3. Поведение аэрозоля, созданного линейным источником. Средство доставки рассеивает аэрозоль по линии, перпендикулярной направлению ветра, цель находится в одном или нескольких километрах с подветренной стороны. По [53]
Рис. 3. Поведение аэрозоля, созданного линейным источником. Средство доставки рассеивает аэрозоль по линии, перпендикулярной направлению ветра, цель находится в одном или нескольких километрах с подветренной стороны. По [53]
При распространении возбудителя инфекционной болезни или токсина с пищей, механизм передачи будет сформирован преступниками в технологической цепочке приготовления продукта. Масштаб и длительность искусственной вспышки инфекционной болезни определяются не только техническими характеристиками источника возбудителя инфекции, но и замыслом самого преступления (рис. 4).
Следовательно, основной особенностью искусственных эпидемических процессов, позволяющей отличать их от природных эпидемических процессов, является их неправильная эпидемиология, т. е. обнаружение случаев инфекционных болезней среди людей при отсутствии в природе условий для их появления [9].
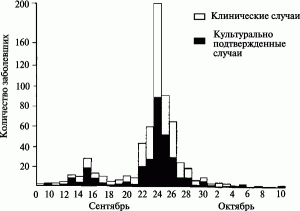 Рис. 4. Развитие искусственной вспышки гастроэнтерита в Далласе в 1984 г. Вспышка имела две волны заболеваемости: с 9 по 18 сентября и с 19 сентября по 10 октября. Разрыва между волнами не было. Первая волна была связана с «испытаниями» агента террористами, вторая предназначалась для срыва выборов в местные органы власти. Как правило, террористы применяли агент в каждом ресторане по нескольку раз. Во время второй волны вспышки S. typhimurium была выделена из сливочной добавки к салату с голубым сыром одного из ресторанов, но ее не обнаружили в сухой смеси, использованной для приготовления приправы к салату. S. typhimurium не была выделена из салата латука, который был получен из той же партии, использованной во время вспышки, но ее обнаружили в салате, изъятом из салат-бара. Эпидемиологам стал понятен и способ, которым террористы инфицировали продукты. Работники обычно выставляли в закусочной полные контейнеры с каким-нибудь свежеприготовленным пищевым продуктом и не контролировали их в дальнейшем. Этим пользовались террористы. По [66]
Рис. 4. Развитие искусственной вспышки гастроэнтерита в Далласе в 1984 г. Вспышка имела две волны заболеваемости: с 9 по 18 сентября и с 19 сентября по 10 октября. Разрыва между волнами не было. Первая волна была связана с «испытаниями» агента террористами, вторая предназначалась для срыва выборов в местные органы власти. Как правило, террористы применяли агент в каждом ресторане по нескольку раз. Во время второй волны вспышки S. typhimurium была выделена из сливочной добавки к салату с голубым сыром одного из ресторанов, но ее не обнаружили в сухой смеси, использованной для приготовления приправы к салату. S. typhimurium не была выделена из салата латука, который был получен из той же партии, использованной во время вспышки, но ее обнаружили в салате, изъятом из салат-бара. Эпидемиологам стал понятен и способ, которым террористы инфицировали продукты. Работники обычно выставляли в закусочной полные контейнеры с каким-нибудь свежеприготовленным пищевым продуктом и не контролировали их в дальнейшем. Этим пользовались террористы. По [66]
Выявление источника возбудителя инфекции, путей и факторов его передачи начинается с эпидемиологического обследования эпидемического очага. Но понятие «эпидемический очаг» как место пребывания источника возбудителя инфекции (больной человек при кори; больной человек и вши — при сыпном тифе; суслики, сурки и мышевидные грызуны, вовлекающиеся в эпизоотии чумы и блохи, передающие чумную палочку от них в популяции людей) и прилегающая территория, в пределах которой возбудитель инфекции предается к людям (подробно см. [3]), не может быть применено при эпидемиологическом обследовании очагов инфекционных болезней, образовавшихся в результате биологического нападения. В этом случае протяженность очага, его границы, будут определяться не особенностями поддержания в природе возбудителя инфекционной болезни и условиями социально-бытовой обстановки в очаге, а техническими возможностями преступников по применению биологических агентов; выбранным ими объектом преступления; моделью территории, на которой совершено биологическое нападение; метеоусловиями в момент применения биологического агента и др. подобными факторами (рис. 5).
Рис. 5. Искусственный очаг сибирской язвы в Центре сортировки почты в Вашингтоне в 2001 г. Серые ромбы с буквами показывают участки, где могло находиться письмо с рецептурой спор возбудителя сибирской язвы. Черные кружки с цифрами — место работы инфицированных людей на 12 октября. Участок, где инфицирование людей было наиболее вероятно, показан ромбом С. Открытыми кольцами показано расположение людей с наибольшим риском инфицирования. Очаг сибирской язвы сформировался благодаря тому, что среди писем, поступивших в здание Центра обычной почтовой доставкой вечером 11 октября или ранним утром 12 октября, был не плотно закрытый конверт с сибиреязвенной рецептурой, и во время тряски на конвейере происходило ее диспергирование. По [25]
Искусственный эпидемический очаг будет локализован с подветренной стороны от возможной точки атаки аэрозолем. Это важная характерная особенность искусственного эпидемического процесса, вызванного однократным ингаляционным применением биологического агента. Полоса поражения[6] будет зависеть от способа рассеивания биологических агентов и высоты источника аэрозоля над местностью. Известны три способа рассеивания биологических агентов (см. [67]).
1. Рассеивание точечным источником — предполагает рассеивание аэрозоля стационарным генератором из одной точки.
2. Рассеивание линейным источником — аэрозоль возбудителя инфекционной болезни рассеивается по одной линии, либо по множеству линий, «прочерченных» поперек направлению ветра. Например, такими линейными источниками будут установленные или сброшенные с одного или нескольких самолетов (других транспортных средств) источники аэрозоля (бомбы малого калибра или другие диспергирующие устройства). В последнем случае формируется линия небольших точечных источников, которые дают широкую полосу аэрозоля по поверхности земли. Распределение людей, получивших ингаляционное поражение, будет зависеть от высоты линейного источника аэрозоля (рис. 6).
 Рис. 6. Полоса поражения и уровни поражения аэрозолем, выпущенного из линейного источника. А. Линия выпуска находится на поверхности земли или на малой высоте. Б. Линия выпуска удалена от поверхности земли. По [67]
Рис. 6. Полоса поражения и уровни поражения аэрозолем, выпущенного из линейного источника. А. Линия выпуска находится на поверхности земли или на малой высоте. Б. Линия выпуска удалена от поверхности земли. По [67]
3. Рассеивание многоточечным источником — источники аэрозоля расположены на местности (или над местностью) в произвольном порядке. Каждый из них представляет собой небольшой точечный источник, зона поражения одного источника перекрывается другим.
Эпидемический очаг в общей эпидемиологии считается ликвидированным тогда, когда обезврежен или блокирован источник возбудителя инфекции (обсервация, изоляция, госпитализация заболевших людей); окружающие проверены на носительство возбудителя болезни и свободны от него; в очаге проведены мероприятия по уничтожению возбудителя болезни или переносчиков инфекции (дезинфекция, дезинсекция, дератизация); когда истекает максимальный срок инкубации при данной болезни и среди лиц, общавшихся с больным, нет больше случаев болезни. Для ликвидации же искусственного эпидемического очага этих мер недостаточно. Искусственный эпидемический очаг может возникнуть вновь без всякой связи с природными очагами возбудителя болезни. Появление таких очагов будет продолжаться либо до ликвидации террористической (диверсионной) организации, либо до достижения террористами поставленной цели (см. рис. 4). Прекращение искусственно вызванной эпидемии (вспышки) или серии убийств с помощью биологического токсина зависит уже не от действий эпидемиологов, а от способности правоохранительных органов обнаружить и ликвидировать террористическую (диверсионную) организацию.
Этиология искусственных эпидемий и поражений токсинами. Даже при одной нозологической форме болезни, ее этиология при искусственных и естественных эпидемиях может различаться. Инфицирование людей возбудителем инфекционной болезни при естественно развившихся эпидемиях происходит либо трансмиссивно — посредством переносчиков (блохи для возбудителя чумы); контактно, через повреждения кожи и слизистых поверхностей — например, при разделке туш животных, погибших от сибирской язвы; алиментарным путем — употребление в пищу продуктов и воды, контаминированных возбудителями кишечных инфекций; воздушно-капельным путем — первичная легочная чума. При любом из перечисленных способов инфицирования человека, способность микроорганизма вызывать инфекционный процесс и его летальная доза зависят от его биологических свойств (вирулентность, токсигенность и др.); биологии переносчика, если он присутствует в эпидемической цепочке; и восприимчивости к возбудителю инфекции человека, замкнувшего эпидемическую цепочку.
При ингаляционном применении того же микроорганизма (токсина), его способность вызывать поражение людей будет зависеть, прежде всего, от физико-химических свойств биологической рецептуры[7] и способа ее применения. Именно эти два фактора определяют «полосу свободы» в действиях террористов. Поражение людей сибирской язвой во время «почтовой эпидемии» 2001 г. в США стало возможным благодаря использованию террористами биологической рецептуры, предназначенной для снаряжения кассетных биологических боеприпасов американской армии. После вскрытия конверта рецептура распространялась воздушными потоками по помещениям. Никаким иным способом в условиях существовавших тогда в Конгрессе США мер безопасности, вызвать вспышку опасной инфекции среди конгрессменов было невозможно.
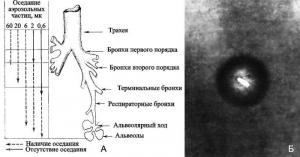
Определяют летальную дозу возбудителя инфекционной болезни или токсина не только их биологические свойства, но глубина проникновения частиц биологического аэрозоля в дыхательные пути человека и их первичное распределение в различных отделах дыхательной системы. Только частицы с размером 1–3 мкм и меньше могут достигнуть альвеол. В альвеолах микроорганизмы фагоцитируются альвеолярными макрофагами и лейкоцитами, и вместе с ними попадают или непосредственно в кровеносные капилляры легкого и по ним разносятся по всему организму; либо поступают в лимфатические сосуды, оттуда в регионарные лимфатические узлы, и далее в грудной проток и венозную кровь (рис. 7).
Рис. 7. Ингаляционное инфицирование мелкодисперсным аэрозолем биологического агента. А. Схематическое строение легочных путей и их отношение к оседанию частиц. Задержка частиц аэрозоля обусловливается силой тяжести, силой инерции и броуновским движением. Эти факторы связаны с массой частиц, т.е. практически с их дисперсностью. В верхних дыхательных путях, где воздух движется с достаточно большой скоростью, основным механизмом осаждения крупных частиц являются инерция и седиментация, влияние которых прямо пропорционально плотности и квадрату диаметра частиц. С уменьшением величины частиц влияние указанных факторов ослабевает и поэтому мелкие частицы в верхних участках задерживаются меньше и проникают в более глубокие отделы легких, где основным механизмом их оседания будет броуновское движение. На степень задержки частиц в дыхательных путях влияет также концентрация вдыхаемого аэрозоля, глубина и частота дыхания, носовой или ротовой тип дыхания, состояние органов дыхания. Б. Смерть в аэрозоле. На фотографии чумная палочка в частичке аэрозоля. По [8]
Экспериментально показано, что если размер частиц аэрозоля увеличивается с 2–3 мкм до 12 мкм, то LD[8]50 для возбудителя чумы повышается в 2,5 раза [27]; для возбудителя сибирской язвы — в 17 раз [26], а для возбудителя бруцеллеза — в 600 раз [28]. Токсичность рицина снижается, если увеличивается средний диаметр аэрозольных частиц. При попадании в трахею рицин высоко токсичен. Но этот же токсин, из-за большого размера диспергированных частиц застрявший в носовых ходах, показывает очень низкую токсичность для экспериментальных животных (цит. по [45]).
Врач может столкнуться с тем, что штамм возбудителя инфекционной болезни, использованный для биологического нападения, прошел селекцию в лабораторных условиях. Благодаря этому он оказался способен преодолевать иммунитет, создаваемый коммерческими вакцинами, либо вызванная им болезнь не поддается лечению по типовым схемам[9]. Ситуация с этиологией болезни еще более запутывается, когда использованный для биологического нападения штамм генетически изменен.
По работе [57] рассмотрим простые эксперименты по получению генетически измененных штаммов возбудителя сибирской язвы и близкородственного ему малопатогенного микроорганизма Bacillus cereus. Ни B. anthracis, ни использованный в работе штамм B. cereus, не имеют конъюгативных плазмид. Авторы использовали обнаруженную ими способность плазмид четырех подвидов непатогенной для человека бациллы Bacillus thuringiensis[10] мобилизовать неконъюгативные плазмиды для переносов в близкородственные микроорганизмы. Крупные плазмиды B. thuringiensis pXO13, pXO14, pXO15 и pXO16 (их молекулярная масса от 50 до 120 мДа), оказались способными не только передаваться конъюгацией в B. anthracis и B. cereus, но и осуществлять мобилизацию плазмид своих новых хозяев. Вирулентные штаммы возбудителя сибирской язвы дополнительно к хромосоме содержат две крупные плазмиды, включающие гены сибиреязвенного токсина и полимерного вещества капсулы, pXO1 и pXO2, соответственно (рис. 8).
Результаты этих экспериментов весьма показательны. Возбудитель сибирской язвы в результате конъюгации получил неконъюгативную плазмиду pBC16 (дорожка 3), придавшую ему устойчивость к антибиотику широкого спектра действия — тетрациклину (Tcr), и приобрел способность передавать эту плазмиду в другие штаммы сибиреязвенного микроба (дорожка 4). Сама же pBC16 представляет собой специальный многокопийный вектор для клонирования генов в бациллах. Поэтому ген Tcr только один из возможных генов, которые можно передать сибиреязвенному микробу с помощью этой плазмиды. Не менее интересны результаты передачи конъюгацией pXO2 от B. anthracis к B. cereus (дорожка 7). Получив эту плазмиду от B. anthracis, B. cereus приобрел способность синтезировать важный фактор вирулентности сибиреязвенного микроба — капсулу.
 Рис. 8. Электрофорез в агарозном геле плазмидной ДНК из штаммов бацилл, использованных для демонстрации мобилизации плазмидой pXOl4 плазмид B. anthracis pXO1, pXO2 и pBC16. Номера напротив полос в геле соответствуют названиям плазмид: 1 — pXO1 и т. д. Широкая диффузная полоса соответствует фрагментам хромосомной ДНК. Дорожки 1–4 показывают плазмиды в штаммах, использованных для демонстрации переноса pXO1; дорожки 5–7 показывают плазмиды в штаммах, демонстрирующих перенос pXO2. Дорожки: 1 — B. thuringiensis subsp. toumanoffi 4059 UM1(pXOl4, pBC16), донор; 2 — B. anthracis Weybridge UM44-1(pXO1), реципиент; 3 — B. anthracis Weybridge UM44-1 trl69A-4(pXO1, pXO14, pBC16), штамм-трансципиент, производный в результате скрещивания между штаммами, электрофорез ДНК которых показан на дорожках 1 и 2; 4 — B. anthracis Weybridge A UM23C1-1 tr357A-16(pXOl, pXO14, pBC16), штамм-трансципиент, производный в результате скрещивания между штаммами, электрофорез ДНК которых показан на дорожке 3 (донор) и излеченного от плазмиды B. anthracis Weybridge A UM23C1-1; 5 — B. anthracis 4229 UM12(pXO2), реципиент; 6 — B. anthracis 4229 UM12 tr4O7A-7(pXO2, pXOl4, pBC16), штамм-трансципиент, производный в результате скрещивания между штаммами, электрофорез ДНК которых показан на дорожках 1 и 5; 7 — B. cereus 569 UM20-1 tr4l2A-1(pXOl4, pXO2, pXO3, pBC16), штамм-трансципиент, производный в результате скрещивания между штаммами, электрофорез ДНК которых показан на дорожке 6 (донор) и B. cereus 569 UM20-1. По [57]
Рис. 8. Электрофорез в агарозном геле плазмидной ДНК из штаммов бацилл, использованных для демонстрации мобилизации плазмидой pXOl4 плазмид B. anthracis pXO1, pXO2 и pBC16. Номера напротив полос в геле соответствуют названиям плазмид: 1 — pXO1 и т. д. Широкая диффузная полоса соответствует фрагментам хромосомной ДНК. Дорожки 1–4 показывают плазмиды в штаммах, использованных для демонстрации переноса pXO1; дорожки 5–7 показывают плазмиды в штаммах, демонстрирующих перенос pXO2. Дорожки: 1 — B. thuringiensis subsp. toumanoffi 4059 UM1(pXOl4, pBC16), донор; 2 — B. anthracis Weybridge UM44-1(pXO1), реципиент; 3 — B. anthracis Weybridge UM44-1 trl69A-4(pXO1, pXO14, pBC16), штамм-трансципиент, производный в результате скрещивания между штаммами, электрофорез ДНК которых показан на дорожках 1 и 2; 4 — B. anthracis Weybridge A UM23C1-1 tr357A-16(pXOl, pXO14, pBC16), штамм-трансципиент, производный в результате скрещивания между штаммами, электрофорез ДНК которых показан на дорожке 3 (донор) и излеченного от плазмиды B. anthracis Weybridge A UM23C1-1; 5 — B. anthracis 4229 UM12(pXO2), реципиент; 6 — B. anthracis 4229 UM12 tr4O7A-7(pXO2, pXOl4, pBC16), штамм-трансципиент, производный в результате скрещивания между штаммами, электрофорез ДНК которых показан на дорожках 1 и 5; 7 — B. cereus 569 UM20-1 tr4l2A-1(pXOl4, pXO2, pXO3, pBC16), штамм-трансципиент, производный в результате скрещивания между штаммами, электрофорез ДНК которых показан на дорожке 6 (донор) и B. cereus 569 UM20-1. По [57]
Эксперименты по конструированию генетически измененных вирусов ведутся уже не менее 50 лет в рамках подходов по созданию новых вакцин и инсектицидов. Сравнительно новым подходом в конструировании опасных вирусов стало повышение их вирулентности на основе нарушения регуляции иммунных ответов макроорганизма. Такие эксперименты проводятся под предлогом изучения тонких механизмов иммунных реакций на вирусы, разработки стратегий для контроля аутоиммунных реакций и др. Они основаны не на формальном понимании вирулентности вирусов как функции так называемых «генов вирулентности», т. е. чем больше таких генов у вируса, тем больше его вирулентность; и не на прямолинейном вмешательстве в геном вируса, когда его «заставляют» секретировать ген какого-то токсина из инфицированной клетки (например, эксперименты по клонированию в вирусах генов нейротоксинов; см. [4, 22]). В основе новых подходов лежит знание тонких механизмов воздействии на систему иммунных ответов организма на вирус во время инфекционного процесса. В качестве примера разберем работу R. J. Jackson с соавт. [40], исследовавших изменение вирулентности вируса мышиной оспы (вирус эктромелии[11]) после клонирования в его геноме гена интерлейкина-4 (IL-4)[12].
В экспериментах авторы использовали линии мышей двух типов: чувствительных к мышиной оспе (например, BALB/c), у которых болезнь развивается как острая системная инфекция с высокими вирусными титрами в печени и селезенке, обусловливающими некроз и высокую смертность (модель натуральной оспы у человека); и резистентных к мышиной оспе (например, C57BL/6). У последних оспа развивается в субклинической форме и характеризуется низкими уровнями вирусной репликации во внутренних органах и появлением не смертельно опасных поражений.
Генетическая устойчивость мышей к вирусу эктромелии характеризуется эффективной реакцией естественных киллеров (NK) и ранним появлением сильной реакции цитолитических Т-лимфоцитов (ЦТЛ) CD8+. R. J. Jackson с соавт. [40] клонировали в геноме вируса эктромелии ген IL-4 и изучили влияние экспрессируемого вирусом мышиного IL-4 на клеточно-опосредованную иммунную реакцию во время инфекции. Ими было отмечено, что у мышей, генетически устойчивых к вирусу эктромелии, экспрессирование IL-4 рекомбинантным вирусом эктромелии подавляло цитолитические реакции NK и ЦТЛ, и синтез последними гамма-интерферона. Инфицирование генетически устойчивых мышей модифицированным вирусом эктромелии приводило к развитию у них симптомов острой оспы, сопровождающейся высокой летальностью, подобно заболеванию, наблюдаемому у мышей, генетически чувствительных к этому вирусу.
Реакции иммунной памяти у мышей, ранее иммунизированных против вируса эктромелии, также ингибировались IL-4, синтезированным вирусом эктромелии. Во внутренних органах иммунных мышей развивалась неконтролируемая репликация модифицированного вируса и, как следствие, у них появлялись классические симптомы острой мышиной оспы. Предыдущие исследования с использованием близкородственного осповируса — вируса осповакцины, показали, что и у него коэкспрессия IL-4 ассоциируется с задержкой выведения вируса из основных органов-мишеней и повышением вирулентности для мышей [15].
При описании экспериментов по созданию гибридных и модифицированных бактериальных токсинов, исследователи единодушно проявляют скромность в отношении публикации данных по их поражающему действию, когда оно оценивается на лабораторных животных. В тоже время этими данными они обстоятельно делятся в тех случаях, когда такие токсины создаются для более эффективного истребления насекомых. Так как инсектицидные токсины отличаются от токсинов, поражающих млекопитающих, только иной специфичностью действия, то будем рассматривать их как модели, на которых отрабатываются технологии модификации токсинов, опасных для млекопитающих.
Наиболее изучены поробразующие токсины семейства Cry (Bt-токсины, δ-эндотоксины). Cry-токсины продуцируются B. thuringiensis (Bt) и представляют собой семейство глобулярных белков, включающее три домена, объединенных через простой линкер. Их организация типична для бинарной А-В-структуры бактериальных токсинов. По механизму действия на клетки они схожи с поробразующими токсинами стафилококков [24].
Первичными рецепторами для Cry1A-токсина являются белки, сходные с кадхеринами (cadherins, CADR) — трансмембранными кальций-зависимыми гликопротеинами, осуществляющими адгезивные межклеточные контакты. Взаимодействие Cry-токсинов с кадхерином осуществляется через комплекс связывающих сайтов: CADR7, CADR11 и CADR12 [52]. Вторичными рецепторами для Cry1A-токсина являются два протеина, «заякоренных» через мостик в мембране клетки-мишени: гликозилфосфатидилинозитол (glycosylphosphatidyl-inositol, GPI) и либо аминопептидаза N (aminopeptidase N, APN), либо щелочная фосфатаза (alkaline phosphatase, FAL) [19].
Отдельные насекомые имеют видовую устойчивость к Cry-токсинам, либо приобретают ее в результате систематического применения таких токсинов для регуляции их численности. В этом случае в популяциях насекомых накапливаются особи с мутировавшими кадхериновыми рецепторами, не взаимодействующими с токсином. Разработчики инсектицидных токсинов вынуждены решать две технические задачи: расширять спектр поражающего действия Cry-токсинов и увеличивать их токсичность в отношении конкретных видов насекомых. Методические подходы, использованные для вмешательства в структуру молекул токсинов семейства Cry, включают сайт-направленный мутагенез отдельных доменов токсина, конструирование гибридных токсинов, внедрение в молекулу токсина сайтов для расщепления протеазами, делеции его отдельных регионов и др. (рис. 9).
Рис. 9. 3D-модели токсинов семейства Cry с модифицируемыми участками. А. Токсин Cry1A. Стрелками показаны точечные мутации в доменах I и II. Делетированный N-терминальный регион обозначен черным цветом (Cry1AMod-токсин). Мутации N372A или N372G локализованные в петле 2 домена II, вызвали восьмикратное увеличение токсичности по отношению к непарному шелкопряду Lymantria dispar. Тройной мутант — N372A, A282G и L283S — показал 36-кратное увеличение токсичности к этим же насекомым. Б. Токсин Cry3A. Стрелками показаны точечные мутации в доме II, улучшающие его инсектицидную активность. Созданный протеолитический сайт, включенный в домен I, показан черным цветом. В. Токсин Cry2A. Черным цветом показан N-терминальный регион токсина, делетированный для улучшения его инсектицидной активности. По [52]
Изменение специфичности Cry-токсинов достигается посредством замены домена III на такой же домен из токсина, обладающего нужной исследователям специфичностью (рис. 9А). Cry1-токсины с низкой специфичностью по отношению к Spodoptera exigu, включая Cry 1 Ab , Cry1Ao, Cry1Ba и Cry1Ea, становятся для них токсичными, если домен III будет заменен аналогичным доменом из Cry1Ca. Например, Cry1Ab-токсин не токсичен для S. exigua, но замена его III-домена на III-домен Cry1C приводит почти к десятикратному росту его токсичности для S. еxigua. Замена участка молекулы Cry1Aa-токсина в пределах аминокислотных остатков 450-612 (домен III) на такие же из Cry1Ac-токсина, ведет к 300-кратному увеличению токсичности Cry1Aa в отношении табачной огневки Heliothis virescens.
Активация токсина в новом для него хозяине может быть достигнута внедрением в его молекулу сайта для расщепления протеазами. Вставка в петлю Cry3A-токсина между спиралью альфа-3 и спиралью альфа-4 сайта для хемотрипсин/катепсина ( chymotrypsin/cathepsin G-сайта), позволило в три раза увеличить его токсичность для личинок D. virgifera (см. рис. 9Б).
Делеция в аминотерминальном регионе, включающая спираль альфа-1 Cry1A-токсинa, делает возможной олигомеризацию токсина в отсутствие кадхеринового рецептора. Такие модифицированные токсины (Cry1AMod) убивают насекомых, у которых развилась резистентность к Cry1A-токсинaм, вызванная мутациями в гене кадхерина. Олигомерные структуры, формируемые Cry1AMod-токсинaми, обладают пороформирующей активностью, сходной с таковой у природного («дикого») токсина (см. рис. 9А).
Токсичность Cry2-токсинa была повышена для египетской хлопковой совки (Spodoptera littoralis) и совки ипсилон (Agrotis ipsilon) не менее чем в четыре раза делецией 42 аминокислот из N-концевого региона молекулы, предшествующих аминокислотным последовательностям, формирующим альфа-1 спираль. Этот участок молекулы прототоксина в кишечнике насекомого отщепляется трипсином, после чего «обнажается» прежде закрытый регион токсина, соответствующий связывающему региону Cry2-токсинa (см. рис. 9В).
Как частный случай гибридного токсина могут рассматриваться иммунотоксины — химерные белки, включающие два домена, один из которых обладает свойствами антитела, а другой свойствами ферментативной субъединицы токсина (как правило, цитотоксина). Первый домен обеспечивает связывание химерного белка со специфической молекулой или клеткой, второй инактивирует молекулу-мишень или убивает клетку.
Конструирование иммунотоксинов, используемых в медицинских целях, предполагает повышение их специфичности к опухолевым клеткам. При более высокой дозе иммунотоксина у пациента может развиться синдром пропускания сосудов (vascular leak syndrome, VLS), вызванный высвобождением цитокинов после гибели в коже периваскулярных Т-клеток. Количества иммунотоксинов, вызывающих VLS, находятся в пределах десятков мкг/кг веса пациента [44].
Для врачей-инфекционистов возможности технологий селекции и генной инженерии микроорганизмов означают, что они могут оказаться в ситуации, когда: 1) будет невозможно установить этиологию инфекционной болезни; 2) типовые схемы профилактики и лечения поражений, вызванных микроорганизмами и токсинами, окажутся не эффективными. И сегодня уже есть печальный опыт лечения пораженных такими агентами. Полученный классической селекцией по признакам антибиотикорезистентности и вирулентности природный штамм возбудителя сибирской язвы Ames, будучи примененным для осуществления теракта в 2001 г. в США, вызвал болезнь, не поддававшуюся лечению антибиотикам бета-лактамного ряда [41, 56].
При расследовании искусственно вызванных эпидемий (вспышек) инфекционных болезней идентификация этиологического агента проводится не только для того, чтобы установить этиологию болезни, но и для определения масштабов теракта (диверсии), и для представления в суде доказательств причастности отдельных лиц к его организации [20]. Отсюда следуют более высокие требования к точности межштаммовой дифференциации возбудителей инфекционных болезней. Для идентификации возбудителя сибирской язвы, выделенного в очагах болезни от заболевших людей и животных, достаточно традиционных биологических и иммунологических методов исследования. Но установить масштабы биотеррористического акта 2001 г. в США и сузить круг подозреваемых в его совершении, стало возможным благодаря субтипированию B. anthracis по его ДНК с помощью MLVA[13] [38].
Клинические проявления искусственных эпидемий (вспышек). Роль возбудителя инфекционной болезни в развитии клиники болезни при естественных и искусственных эпидемиях (вспышках) также различна. Для эпидемий, возникающих естественным путем в природных очагах, механизм инфицирования и доминирующая клиника болезни обычно хорошо известны. Например, инфицирование возбудителем чумы в природных очагах этой болезни происходит через кожу посредством укуса блохи. Возбудитель чумы лимфогенным путем достигает регионарных лимфатических узлов, где задерживается и интенсивно размножается. В лимфатическом узле развивается воспалительный процесс, внешне это проявляется первичным бубоном. Большинство случаев чумы в ее природном очаге регистрируются как бубонные.
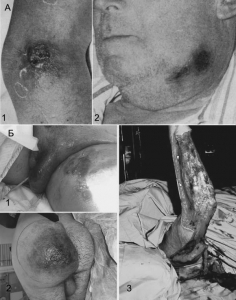
При эпидемиях, вызванных искусственно, клиника болезни будет зависеть от способа введения возбудителя инфекции в организм человека, выбранного террористами. В этом случае врач столкнется с клинической формой болезни, ранее ему неизвестной, т. е. с невозможной клинической формой болезни. «Невозможная» она в том смысле, что никогда не встречается при естественном заражении данным возбудителем. Например, кожная форма сибирской язвы хорошо известна инфекционистам. Она наблюдается среди людей, контактирующих с мясом и шкурами болевших сибирской язвой животных. Ее характерное проявление — сибиреязвенный карбункул, обычно появляющийся на открытых частях тела. Однако при подкожном и внутримышечном введении B. anthracis человеку развивается незнакомая инфекционистам локальная форма сибирской язвы, протекающая без развития карбункула, но с обширными некрозами и отеками в участке инъекции (рис. 10).
Рис. 10. Кожная форма сибирской язвы (А) и внешние проявления инъекционной сибирской язвы (Б). А1. Сибиреязвенный карбункул и отек в латеральной локтевой области пациента. А2. Сибиреязвенный карбункул и отек в левой подчелюстной области пациента. По [43].
Б1. Предоперационная фотография кожного некроза верхней части бедра и большой половой губы. Б2. Отек мошонки и кожный некроз ягодицы. Б3. Хирургическая обработка некротизированной кожи и мышечной фасции правой руки у пациента с инъекционной сибирской язвой. По [37]
При в/в введении B. anthracis смерть человека клинически напоминает «апоплексический удар». При вскрытии — никакой специфики. Выявляются только признаки серозного или серозно-геморрагического полиаденита, полнокровие и дистрофические изменения в паренхиматозных органах, и кровоизлияния в легких. Такие случаи сибирской язвы зарегистрированы в 2009 г. в Шотландии у наркоманов, купивших афганский героин одной партии, к которому были подмешаны споры возбудителя сибирской язвы турецкого происхождения [11, 37, 55].
Частным случаем невозможных клинических форм болезни является «патология мелкодисперсного аэрозоля», т. е. патология, развивающаяся у человека при инфицировании его аэрозолем возбудителя инфекционной болезни с размером дисперсной фазы менее 5 мкм. Например, в природных очагах чумы первичная легочная чума распространяется воздушно-капельным путем (Маньчжурия, 1910 г.). Воротами инфекции являются миндалины и лимфатическая ткань глотки. Поэтому инфекционный процесс клинически проявляет себя нисходящей бронхопневмонией с поражением верхних долей легких. При поражении мелкодисперсным аэрозолем развивается катаральная узелковая пневмония [10].
Поражение человека, вызванное вдыханием аэрозоля спор B. anthracis с размером частиц биологической рецептуры, приближающихся к размеру споры (1,2 мкм), клинически проявляется системной болезнью с вовлечением в инфекционный процесс паренхимы легких и лимфатических узлов средостенья. Вдыхание такого же аэрозоля, но с размером частиц 12 мкм и более, приводит к развитию локализованной инфекции с выраженным отеком лица [41, 46].
При инфицировании обезьян Macacca mulatta аэрозолем с жидкой фазой возбудителя туляремии штамма Shu-S-4 с дисперсностью частиц 1–8 мкм, первичный патологический процесс и размножение агента начинаются в области респираторных бронхиол, где развивается специфический бронхиолит, распространяющийся в прилежащую легочную ткань и захватывающий альвеолярные пространства, вызывая развитие мелкоочаговой пневмонии. Ингаляция животных монодисперсным туляремийным аэрозолем с размером дисперсной фазы 18 мкм ни у одной из обезьян не вызвало поражения со стороны легких. Воротами инфекции служили носоглотка с поражением регионарных лимфоузлов, откуда возбудитель попадал в кровоток, вызывая гематогенную диссеминацию и гибель животного [69]. Ангинозно-бубонная форма туляремии может возникнуть при ингаляционном инфицировании аэрозолем с размером частичек более 5–10 мкм, задерживающихся в носоглотке, и инфицирующих миндалины. Глазо-бубонная форма туляремии развивается при импакции на конъюнктиву относительно крупных частиц аэрозоля (более 25 мкм) [6].
Клиника ингаляционной формы сибирской язвы, вызванной мелкодисперсными аэрозолями разного происхождения, но одинаковой дисперсности, так же может не совпадать. За много лет наблюдений над вспышками ингаляционной сибирской язвы естественного происхождения, ни разу не было обнаружено патологических процессов в паренхиме легких. До биотеррористического акта 2001 г. в США считалось, что первично-легочной сибирской язвы не существует. На рентгенограмме грудной клетки пациента может быть обнаружено только выраженное расширение медиастинальных узлов при отсутствии признаков первичной пневмонии [1, 18]. Но изучение в США в 2001 г. последствий ингаляционного поражения людей сухой рецептурой сибирской язвы показало, что в их легких образуются еще и легочные инфильтраты (отмечены у семи пациентов из 12). При этом клиническое течение болезни было очень тяжелым.
К свойствам биологической рецептуры, определяющим полиморфизм клинической картины в очаге искусственно вызванной болезни, может быть отнесено ее качество в момент применения. Во время искусственной вспышки сибирской язвы в США в 2001 г. все пострадавшие контактировали с одним и тем же «белым порошком». Но случаи сибирской язвы в Нью-Йорке и Нью-Джерси были представлены кожной формой болезни; а случаи, выявленные в Вашингтоне, представлены ее ингаляционной формой. Последнее связано с лучшим качеством рецептуры, помещенной в конверт, предназначавшийся для сенатора Томаса Дашли (Thomas A. Daschle), чем рецептуры, содержавшейся в конвертах, направленных в редакции СМИ Нью-Йорка. В конвертах, полученных редакциями «Эн-Би-Си» и «Нью-Йорк-Пост», следователями ФБР обнаружена увлажненная, образовавшая агломераты, рецептура. Она оказалась неспособной проникать в глубокие отделы легких людей, и вызывала только кожную форму болезни у лиц, имевших небольшие повреждения кожных покровов [59].
Место аппликации возбудителя болезни меняет не только ее патогенез, но, соответственно, патанатомию. Поэтому во время искусственно вызванных эпидемий (вспышек) патологоанатомические и патоморфологические исследования используются не только для посмертной диагностики инфекционной болезни, но и для расследования обстоятельств и масштабов теракта; выявления технического уровня, достигнутого террористами в разработке средств биологического поражения. Также они могут позволить отличить непосредственных жертв биологической атаки от людей, заразившихся от них «по цепочке». Например, при искусственно вызванных вспышках легочной чумы, для первых будут характерны поражения мелкодисперсным аэрозолем (катаральная узелковая пневмония), для вторых — проявления воздушно-капельной инфекции (чумная бронхопневмония).
Искусственные генетические конструкции. Генная терапия наследственных и инфекционных болезней предполагает доставку генов в клетки-мишени. Но ни ДНК, ни РНК не могут быть использованы в «голом виде» для достижения этой цели. Сахарофосфатный остов обоих типов молекул нуклеиновых кислот располагается по их периферии полярными группами наружу и придает им анионные свойства. При физиологическом значении рН нуклеиновая кислота несет отрицательный заряд и не способна непосредственно взаимодействовать с отрицательно заряженными наружными поверхностями клеточных мембран. Из-за высокой гидрофильности нуклеиновой кислоты все гидрофобные основания «повернуты» вовнутрь ее молекулы, поэтому она не может проникнуть через гидрофобный барьер клетки-мишени. В сыворотке крови нуклеиновая кислота быстро деградирует под воздействием нуклеаз. Период полужизни немодифицированной интерферирующей РНК в сыворотке крови укладывается в 5–60 мин, для ДНК — он составляет не более 10 мин. Кроме того, нуклеиновые кислоты не способны специфически узнавать клетки-мишени [62]. Поэтому для доставки генов в эукариотические клетки, с начала 1980-х гг. разрабатываются искусственные генетические конструкции. В настоящее время сформировалось два альтернативных направления их создания — на основе вирусов и на основе искусственных векторных систем (табл. 2).
Таблица 2
Сравнение свойств наиболее распространенных генотерапевтических векторных систем*
|
Характеристика |
Гамма- ретровирусные (MLV, FLV и др.) |
Лентивирусные (ВИЧ-1 и ВИЧ-2, FIV, CAEV, EIAV, JDV, MVV и др.) |
Аденовирусные (Ad) |
Вирус герпеса первого типа (HSV-1) |
Аденоас-социированный вирус (AAV) |
Плазмидная ДНК (в искусственной векторной системе) |
|
Размеры частицы, нм |
80–100 |
80–100 |
70–90 |
120–300 |
20 |
15–5000 |
|
Максимальный размер вставки, т.п.о. |
7–7,5 |
7–7,5 |
До 30 |
До 30 (на основе рекомбинантного вируса), до 150 т.п.о. на основе ампликона |
3,5–4,0 |
Неограничен |
|
Концентрация (количество вирусных частиц в мл) |
>108 |
>108 |
>1011 |
До 108 (на основе ампликона) |
>1012 |
Неограничена |
|
Схема доставки генов |
Ex vivo |
Ex/in vivo |
Ex/in vivo |
In vivo |
Ex/in vivo |
Ex/in vivo |
|
Интеграция с ДНК реципиента |
Возможна |
Возможна |
Невозможна |
Невозможна для ампликонов |
Возможна/ невозможна |
Маловероятна |
|
Продолжительность экспрессии in vivo |
Короткая |
Продолжительная |
Короткая |
Короткая |
Продолжительная |
Короткая |
|
Стабильность |
Хорошая |
Не проверялась |
Хорошая |
Нестабилен |
Хорошая |
Очень хорошая |
|
Легкость приготовления |
Пилотные установки размером 20–50 л |
Неизвестно |
Легко масштабируется |
Неизвестно |
Трудно очищать от клеточных фрагментов и масштабировать производство |
Легко получать в больших количествах |
|
Иммунологические проблемы |
Незначительны |
Незначительны |
Серьезны |
Незначительны для ампликонов |
Неизвестны |
Нет |
|
Наличие иммунитета у реципиента |
Маловероятно |
Маловероятно, за исключением больных СПИДом |
Возможно |
Возможно |
Возможно |
Невозможно |
|
Проблемы безопасности |
Инсерционный мутагенез? |
Инсерционный мутагенез? |
Воспалительный ответ, токсичность |
Незначительны для ампликонов |
Воспалительный ответ, токсичность |
Преодолимы в рамках подбора нетоксичных компонентов системы |
* Таблица составлена по работам [17, 39, 50, 54, 61].
Искусственные генетические конструкции на основе вирусов в организме человека имитируют поведение вирусной частицы, но не вызывают инфекционный процесс. В их состав входят: белки вируса, формирующие оболочку частицы, способную к узнаванию клеток-мишеней и к интернализации в цитоплазму; и трансген-экспрессирующая кассета, осуществляющая после доставки в клетку длительную экспрессию одного или нескольких генов.
Наибольшее распространение в практике генной терапии наследственных и инфекционных болезней приобрели векторные системы на основе лентивирусов, аденовирусов, аденоассоциированных вирусов, ортопоксвирусов, герпесвирусов и отдельных РНК-вирусов, не относящихся к ретровирусам.
Достигнутый сегодня уровень соматической генной инженерии позволяет создавать векторные системы, нацеленные на разные типы клеток и участки генома человека (векторы на основе ВИЧ). Векторные системы, полученные на основе лентивирусов и аденоассоциированных вирусов, способны интегрировать трансген-экспрессирующую кассету с геномом клеток-мишеней.
Ретровирусные (лентивирусные) векторы могут быть перенацелены на разные типы клеток и разные участки генома человека. Первая задача решается благодаря псевдотипированию вируса. Смысл этого методического приема в следующем. Так как из лентивирусной векторной системы удален ген оболочки (env) ВИЧ, то оболочечный вектор может содержать ген, направляющий синтез гетерологичного гликопротеина. Такие вирусы называют псевдотипированными (pseudotyping) или вирусами-обманщиками. В зависимости от используемого в пакующей системе гликопротеина, формируются различные псевдотипы вируса [54].
Например, лентивирусные векторы, псевдотипированные с гликопротеинами оболочки вируса бешенства (PV-штамм), приобретают тропность к нейрональной ткани и способность к ретроградному транспорту в условиях in vivo. Введенный в периферерическом участке нервной системы псевдотипированный лентивирусный вектор по нейрональным аксонам доставил трансгены в ЦНС [29]. Подробно стратегия использования таких векторов для целей генотерапии описана в работах [22, 30, 54, 68].
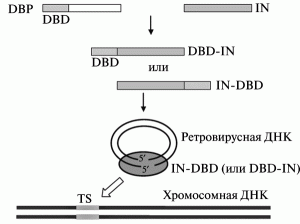
В первом десятилетии текущего века наиболее распространенным подходом к нацеливанию ретровирусного вектора на конкретные участки в геноме человека было использование в составе вирусной частицы слитых белков, образующих вирусный преинтеграционный комплекс, импортирующийся вовнутрь нуклеуса. Такие белки обычно включают IN-белок (вирусная интеграза), полученный из ВИЧ-1 или ASV; и ДНК-связывающие последовательности клеточных и бактериальных белков, слитых с N- или C-концом IN. Что бы вирус не утратил инфекционности, слитые белки вводят в вирион ВИЧ-1 вместе с исходным IN (wild-type IN). Одна из используемых моделей нацеливания ретровирусных векторов на конкретные участки ДНК в геноме человека (таргетинговой интеграции), показана на рис. 11.
Рис. 11. Модель таргетинговой интеграции ретровирусных векторов. Интеграция осуществляется посредством использования модифицированной интегразы, слитой гетерологичными ДНК-связывающими доменами. DBD — ДНК-связывающий домен (DNA-binding domain); IN — интеграза. TS — белок, образовавшийся в результате слияния DBD и IN. Преинтеграционный комплекс интегрируется с участком хромосомной ДНК (target site, TS), узнаваемым DBD. По [58]
О том, какое значение имеет участок интеграции провируса в развитии неинфекционной патологии, говорит накопленный опыт применения ретровирусных векторов для лечения детей с Х-связанным тяжелым комбинированным иммунодефицитом (X-linked severe combined immunodeficiency, SCID-X1). Например, у 4-х детей из 11, которым в терапевтических целях вводили вектор на основе MLV, развилась Т-клеточная лейкемия. В последующем было установлено, что, по крайней мере, у двух детей клональная экспансия Т-клеток была вызвана вставкой вектора в Lin-1-, Isl-1-, Mec-3(LIM)-домены протоонкогена only-2 (LMO2) и его активацией через энхансеры вектора, содержащиеся в LTR [34].
Для изменения тропизма векторных систем исследователями используются также физический таргетинг, заключающийся в покрытии вирусной частицы специальной оболочкой, изменяющей ее природный тропизм и делающей ее неузнаваемой для иммунной системы человека [63]. Повышение эффективности транскрипции трансгена в клетке-мишени достигается путем транскрипционального таргетинга, предполагающего введение в трансген-экспрессирующую кассету специфических для данных тканей промоторных последовательностей [54].
Искусственные векторные системы разрабатываются по трем направлениям: комплексы, образованные нуклеиновыми кислотами и катионными полимерами (полиплексы); комплексы, образованные нуклеиновыми кислотами и липидами (липоплексы), и использование для комплексообразования наночастиц двуокиси кремния. На рис. 12 показаны механизмы формирования первых двух комплексов и их проникновения в клетку.
Рис. 12. Механизмы формирования искусственных векторных систем и их проникновения в клетку. А. Формирование комплекса. Имеющие отрицательный заряд нуклеиновые кислоты взаимодействуют с катионными липидами или поликатионами через электростатические взаимодействия. В результате формируются положительно заряженные липоплексы или полиплексы. Б. Положительно заряженные небольшие частицы связываются со специфическими рецепторами или непосредственно с поверхностью клетки. Комплексы проникают в клетку по механизму эндоцитоза. После высвобождения из эндосомы и разборки комплекса, нуклеиновая кислота проникает через поры в ядро клетки. По [35]
Третьим направлением получения искусственных векторных систем, развитие которого по открытой литературе прослеживается только с 2012 г., стало использование наночастиц двуокиси кремния в качестве носителя терапевтических генов. Их основными преимуществами перед липо- и полиплексами разработчики считают низкую токсичность, контролируемость размеров и простоту приготовления векторной системы [21].
Наиболее распространенным вариантом конструирования искусственных векторных систем является создание комплексов наноразмеров, подвергающихся декомплексации в эндосомах и высвобождающих ДНК трансгена в цитоплазму. Нанополиплексы размером меньше 25 нм эффективно трансфецируют неделящиеся клетки, так как они меньше чем размер пор в мембране ядра. Нанополиплексы стабильны в солевых растворах. Конденсированный пептид, содержащий в своей структуре тридцатимерный полилизин с цистеином на N-конце, к которому «пришит» 10 кДа ПЭГ, при температуре 4°C стабилен в солевом растворе более трех лет; 9 месяцев он сохраняет свои основные свойства при комнатной температуре, и один месяц при температуре 37°C [23].
Перечисленные подходы к конструированию искусственных векторных систем позволяют разрабатывать векторы с тонко управляемой специфичностью для направленной доставки трансгенов в целевые клетки (в печень, надпочечники, глубокие отделы мозга, медуллярные двигательные нейроны, костные ткани, гладкую мускулатуру кровеносных сосудов, легочную ткань, опухоли эндотелия и др.).
Исследователями предпочтение отдается использованию неинвазивных технологий, предполагающих ингаляционное или энтеральное введение в организм человека генотерапевтических векторных систем. Полимерные композиции для ингаляционного введения генов конструируют таким образом, чтобы их размер не превышал 5 мкм и они были устойчивы физическому воздействию, возникающему во время их диспергирования, и стабильными в аэрозолированном состоянии. Стабилизация полиплекса достигается формированием глютаральдегидом или карбодиимидами поперечных сшивок между образовавшими полиплекс катионными макромолекулами (обычно это ветвящиеся производные PEI). Чем больше таких сшивок, тем прочнее носитель, тем менее он подвержен деградации в растворе и тем прочнее в него «упакована» экспрессирующая кассета. Весовое содержание нуклеиновой кислоты в таких носителях достигает 30 % (W/W). Уменьшение агрегации полиплексов в растворе достигают путем увеличения количества поперечных сшивок между катионными макромолекулами, либо их конъюгированием с ПЭГ 5000. Лиофилизованные сшитые полиплексы в водном растворе обычно сами дезагрегирут до исходного размера частиц [60].
По данным F. Thierry [65], субмикронные липосомы выдерживают перевод в аэрозоль. Их устойчивость в таком состоянии достаточна, по крайней мере, для терапевтических целей. Более тонко аэродинамический размер частиц образуемого аэрозоля липо- и полиплексов с жидкой дисперсной фазой регулируется с помощью диспергирующего устройства [47].
Полимерные композиции для энтерального введения в основном предназначаются для введения генов в стволовые клетки кишечного эпителия и предполагают одновременное введение факторов пролиферации стволовых клеток [36, 70].
По мнению J. L. Black [16], возможны два типа нападений с применением таких поражающих агентов, а именно: нападение с кратковременным или продолжительным латентным периодом. В первом случае гены могут доставляться при помощи вектора, который инфицирует хозяина и вызывает быструю экспрессию трансгена, оказывающего вредное для здоровья действие (векторы на основе аденовирусов или AAV, искусственные векторные системы). Этот вид нападения похож на использование традиционных агентов БО. Наиболее вероятно, что он будет осуществлен с помощью аэрозолей. Продолжительность латентного периода может зависеть от того, насколько скоро начнет экспрессироваться ген, вызывающий патологический процесс, а сама экспрессия определяется типом используемого вектора и используемой дозой.
Еще больший интерес представляет сценарий J. L. Black [16], предполагающий длительный латентный период после нападения, поскольку он означает возможность ведения скрытой масштабной биологической войны, осуществляемой диверсионными способами. При реализации такого сценария население подвергается нападению посредством искусственных генетических конструкций через продукты (энтерально), лекарственные и иммунобиологические препараты (парэнтерально, например, под предлогом массовой вакцинации). Наиболее вероятно применение векторов на основе лентивируса. Его осуществление приведет к инкорпорированию трансгена в геном подвергшихся такому нападению людей и, как следствие, к появлению обширных популяций людей с психическими изменениями, онкологическими и неврологическими болезнями, генетическими поражениями и, даже, наследственно передаваемыми дефектами генов.
Наночастицы. К ним относятся объекты с размером от 1 до 100 нм. По характеру поражающего действия они не имеют аналогов ни среди боевых отравляющих веществ (ОВ), ни среди традиционных агентов БО или искусственных генетических конструкций.
К особенностям наночастиц, обуславливающие их поражающее действие, прежде всего, следует отнести химическую и каталитическую активность их поверхности, отсутствующих у этого же вещества при более крупной дисперсности частиц. Второй особенностью наночастиц, проявляющейся их токсичностью, является их высокая концентрация в воздухе при незначительном количестве самого распыленного вещества. Например, 10 мкг/м3 вещества образует более чем 1х106 частиц/см3 при их размере в 20 нм. И третья особенность наночастиц, проявляющаяся их токсическими свойствами, это их способность к ингаляционному, трансдермальному, транснейральному и энтеральному проникновению в любые органы и ткани человека, включая ЦНС. Физические свойства наночастиц, определяющие их распространение в организме человека и поражающее действие, приведены в табл. 3.
Таблица 3
Физические свойства наночастиц, определяющие их распространение в организме человека и поражающее действие
|
Физические свойства |
Распространение наночастиц в организме человека |
Поражающее действие наночастиц |
|
Размер |
Определяет ее биодоступность и продолжительность циркуляции в кровеносном русле. Частицы размером <5–10 нм удаляются из организма путем почечного клиренса; >200 нм депонируются (sequestered) в селезенке. Частицы размером до 70 нм могут пенетрировать капилляры. Нанокомплексы размером в пределах 35–120 нм собираются в лимфатических узлах. Размер частицы определяет механизм ее интернализации в клетку (фагоцитоз, эндоцитоз, пикноцитоз) и внутриклеточную локализацию, а также то, будет ли она опсонизирована белками сыворотки плазмы, фагоцитирована макрофагами или удалена клетками РЭС |
Варьирование размером наночастицы позволяет более точно нацелить на клетки, содержащие специфические сайты для наночастицы, тем самым уменьшить их поражающую дозу |
|
Мультифункциональность |
Размер частицы определяет ее биодоступность и создание более высоких концентраций в органах-мишенях, структура той же частицы (например, нанотрубка) позволяет использовать ее в качестве носителя токсического соединения в клетку-мишень, поверхность частицы определяет ее сродство к определенному рецептору и др. |
Повышение специфичности поражающего действия наночастиц |
|
Большая площадь поверхности |
Плохо растворимые в воде токсические вещества могут быть сорбированы на поверхности частиц |
Расширение круга поражающих агентов |
|
Высокий поверхностный заряд |
Поверхность клетки имеет отрицательный заряд, придание частице положительного заряда повышает ее проникающий потенциал. Позволяет повысить эффективность доставки в клетки химических и биологических соединений, имеющих отрицательный заряд |
Снижение поражающей дозы и расширение круга поражающих агентов |
|
Формирование стабильных структур, способных инкапсулировать химические и биологические соединения (нанокапсулы и нанотрубки) |
Инкапсуляция позволяет защитить биологическое или химическое соединение от действия факторов внешней среды при хранении, переводе в аэрозоль, нахождении в аэрозолированном состоянии и от воздействия факторов организма (кислая среда желудочного сока, иммунные ответы и др.), а также доставлять в клетки плохо растворимые в воде соединения. Но только частицы размером менее 100 нм могут попасть вовнутрь везикулы в ходе эндоцитоза, что определяет наиболее оптимальный размер наночастиц, включающих биологические активные соединения, должен находиться в пределах от 10 до 100 нм |
То же |
|
Возможность биофункционализации |
Достигается путем присоединения наночастиц к биоактивным молекулам. Например, присоединение к ПЭГ (пэгилирование) продляет длительность циркуляции наночастицы в крови, уменьшает их взаимодействие с опсонизирующими белками; конъюгирование с белками-лигандами повышает эффективность проникновения наночастиц в клетки-мишени |
Снижение поражающей дозы |
В патологических эффектах нанообъектов, проявившихся в уcловиях in vivo при одном способе введения, прослеживается определенная специфичность, обусловленная их структурой и химическим строением. Например, агрегированные одностеночные углеродные нанотрубки в легочной ткани мышей индуцируют образование гранулем, главным образом связанных гипертрофией эпителиальных клеток. Эти же трубки, но в диспергированном состоянии, вызывают развитие диффузного интерстициального фиброза с утолщением стенок альвеол [64].
Внутренний объем нанотрубок может быть заполнен токсическими соединениями биологической и химической природы. Стенки нанотрубок исключат взаимодействие биологических компонентов с клетками иммунной системы и последующие иммунные ответы. Благодаря достижениям в конструировании таких структур стала возможной доставка биологически активных веществ и генов в клетки, очень трудные для трансфекции, включая В-клетки и первичные нейроны [31, 41].
Своеобразной «новинкой» для токсикологов, характерной именно для частиц нанодиапазона, является возможность их проникновение в ЦНС по нервным волокнам, идущим от обонятельного эпителия и сетчатки глаза [42, 51].
Нанотехнологии обладают большим потенциалом для создания средств массового поражения, серьезно отличающихся по механизмам поражения, путям проникновения в организм человека, способам применения и целям ведения войны, от тех, что разрабатывались в ХХ в. применительно к микроорганизмам, токсинам и ОВ. Наибольшую опасность в настоящее время представляют нанообъекты, имеющие размер менее 50 нм; формирующие инкапсулирующие структуры; и подвергнутые биофункционализации. Их применение для поражения людей, возможно, будет осуществляться по тем же сценария, что разработал J. L. Black [16] для искусственных генетических конструкций. Уже в настоящее время грань между наночастицами и искусственными генетическими конструкциями становится все более условной. По сути, они позволяют вести новый вид биологической войны, когда невозможно установить не только ее организаторов и но, даже, ответить на вопрос: «Война это или не война?». Игнорировать такую угрозу не создавая долговременной и прочной научно-методической базы для противодействия, означает создание преступникам оптимальных условий для их деятельности — сон разума рождает чудовищ.
Терминологическое определение неправильной эпидемиологии. Приведенные данные показывают, что эпидемиология, этиология и клиника естественных и искусственно вызванных эпидемий (вспышек) и других массовых искусственных поражений населения, имеющих биологическую природу, имеют принципиальные отличия и могут рассматриваться как самостоятельные объекты эпидемиологического исследования. Неправильная эпидемиология — самостоятельный раздел в эпидемиологии инфекционных болезней, представляющий собой систему научных знаний, обосновывающих распознание искусственно вызванных вспышек (эпидемий) инфекционных болезней, поражений биологическими токсинами, искусственными генетическими конструкциями и наночастицам, а также устранение (минимизацию) их последствий; и оказание содействия правоохранительным органам в выявлении организаций и преступников, осуществивших применение биологических агентов для поражения людей.
Общая эпидемиология инфекционных болезней и общая неправильная эпидемиология используют метод эпидемиологического анализа, т. е. специфическую совокупность приемов изучения закономерностей появления множества событий (заболеваний, смертей и др.), позволяющих установить причины возникновения и распространения патологических состояний любой природы в популяции людей. Эпидемиологический анализ в неправильной эпидемиологии основывается на знании характерных особенностей эпидемиологии искусственных эпидемических процессов и других массовых поражений населения, имеющих биологическую природу.
Подобно классической эпидемиологии инфекционных болезней, неправильная эпидемиология может быть разделена на два подраздела, логически следующих из сути рассматриваемого материала — общего и частного. Как и любая другая наука, неправильная эпидемиология должна иметь объект исследования, цель и задачи.
Объектом исследования неправильной эпидемиологии являются искусственно вызванные эпидемии (вспышки) инфекционных болезней и другие массовые поражения населения, имеющие биологическую природу.
Цель неправильной эпидемиологии как самостоятельного раздела в эпидемиологии инфекционных болезней — установление искусственного характера вспышки (эпидемии) инфекционной болезни, поражений биологическими токсинами, искусственными генетическими конструкциями и наночастицам.
Основные задачи неправильной эпидемиологии сводятся к следующим:
выявление новых биологических угроз и биологических агентов, которые могут быть использованы для преднамеренного поражения людей;
изучение общих закономерностей развития искусственных эпидемических процессов, поражений биологическими токсинами, искусственными генетическими конструкциями и наночастицам;
изучение потенциальной опасности и условий, реализующих потенциальную опасность биологических агентов при их преднамеренном применении для поражения людей;
разработка подходов к эпидемиологическому расследованию искусственных эпидемических процессов, поражений биологическими токсинами, искусственными генетическими конструкциями и наночастицам;
выявление эпидемиологических последствий преступления, совершенного с помощью биологических агентов;
разработка критериев для установления деятельности биотеррористических организаций (совместно с правоохранительными органами);
систематизация специальных знаний, необходимых для проведения экспертиз по уголовным делам, возбужденным в связи с расследованием преступлений, совершенных с помощью биологических агентов.
Неправильная эпидемиология, как раздел в эпидемиологии инфекционных болезней, находится в тесной методической связи с клинической медициной (инфекционные и соматические болезни), микробиологией, общей и частной эпидемиологией, токсикологией, молекулярной биологией, аэробиологией, соматической генной терапией, наноматериаловедением, судебной медициной, оперативно-розыскной деятельностью и криминалистикой.
В отличие от общей и частной эпидемиологии, в компетенцию неправильной эпидемиологии не входит предотвращение вспышек (эпидемий) инфекционных болезней и поражений другими биологическими агентами. Их предотвращение является задачей правоохранительных органов.
Список сокращений, нераскрытых в тексте
в/в — внутривенно.
мДа — мегадальтон.
мин — минута
мкм — микрон.
нм — нанометр.
ПЭГ — полиэтиленгликоль.
РЭС — ретикулоэндотелиальная система.
т.п.о. — тысяч пар оснований.
ЦНС — центральная нервная система.
CAEV (caprine arthritis encephalitis virus) — вирус артрита и энцефалита коз.
EIAV (infectious anemia virus) — вирус инфекционной анемии лошадей.
FLV (feline immunodeficiency virus) — вирус иммунодефицита кошачьих.
JDV (Jembrana disease virus) — вирус болезни Джембрана (лентивирус, вызывающий иммунодефицит у крупного рогатого скота).
MLV (Moloney murine leukemia virus) — вирус мышиной лейкемии Молони.
MVV (Maedi-Visna virus) — вирус Висна-Маэди.
PEI (polyethylene imine) — полиэтиленимин.
W/W (weight/weight) — вес на вес.
Список использованных источников
1. Бургасов П.Н., Рожков Г.И. Сибирская язва. — М., 1984.
2. Галактионов В. Г. Эволюционная иммунология. — М., 2005.
3. Зуева Л. П., Яфаев Р. Х. Эпидемиология. — СПб., 2006.
4. Керлей П., Дайт Л., Посси Р. с соавт. Патент 2156300, RU, МПК C12N15/33, C12N15/86, A01N63/00. Дата публикации: 2000-09-20.
5. Кузник Б. И. Физиология и патология системы крови. — М., 2004.
6. Огарков В. И., Гапочко Н. Г. Аэрогенная инфекция. — М., 1975.
7. Онищенко Г. Г., Шапошников А. А., Субботин В. Г. с соавт. Противодействие биологическому терроризму. — М., 2003.
8. Ситников М. Н. Поражающее действие бактериологического оружия и некоторые медицинские вопросы защиты // Журн. Всес. Хим. общ. им. Д. И. Менделеева. — 1968. — Том XIII, № 6. — С. 637–648.
9. Супотницкий М. В. Микроорганизмы, токсины и эпидемии. — М., 2000, 2005 (2-е изд.).
10. Супотницкий М.В., Супотницкая Н.С. Очерки истории чумы. — М., 2006.
11. Cупотницкий М.В. Героиновая сибирская язва в Шотландии и Германии // Биопрепараты. — 2011. — № 1. — С. 40–44.
12. Супотницкий М.В. Генотерапевтические векторные системы на основе вирусов // Биопрепараты. — 2011. — № 3. — С. 15–26.
13. Черкасский Б. Л. Руководство по общей эпидемиологии. — М., 2001.
14. Beckett B. Weapons of Tomorrow. — N.Y., 1982.
15. Bembridge G. P., Lopez J. A., Cook R. et al. Recombinant vaccinia virus coexpressing the F protein of respiratory syncytial virus (RSV) and interleukin-4 (IL-4) does not inhibit the development of RSV-specific memory cytotoxic T lymphocytes, whereas priming Is diminished in the presence of high levels of IL-2 or gamma interferon // J. Virol. — 1998. — Vol. 72, № 5. — Р. 4080–4087.
16. Black J. L. Genome projects and gene therapy: gateways to next generation biological weapons // Milit. Med. — 2003. — Vol. 108, № 11. — Р. 864–871.
17. Boeckle S., Wagner E. Optimizing targeted gene delivery: chemical modification of viral vectors and synthesis of artificial virus vector systems // AAPS J. — 2006. — Vol. 8, № 4. — P. 731–742.
18. Braude A. I., Davis C. E., Fierer J. F. Infectious diseases and medical microbiology. — W. B. Saunders Company, Philadelphia, 1986.
19. Bravo A., Gomez I., Conde J. et al. Oligomerization triggers binding of a Bacillus thuringiensis Cry1Ab pore-forming toxin to aminopeptidase N receptor leading to insertion into membrane microdomains // Biochim. Biophys. Acta. — 2004. — Vol. 1667. — P. 38–46.
20. Budowle B., Schutzer S. E., Burans J. P. et al. Quality sample collection, handling and preservation for an effective microbial forensics program // Appl. Environ. Microbiоl. — 2006. — Vol. 72, № 10. — Р. 6431–6438.
21. Cheang Tuck-yun, Tang Bing, Xu An-wu et al. Promising plasmid DNA vector based on APTESmodified silica nanoparticles // Intern. J. of Nanomed. — 2012. — Vol. 7 — P. 1061–1067.
22. Cronin J., Zhang X. Y., Reiser J. Altering the tropism of lentiviral vectors through pseudotyping // Curr. Gene. Ther. — 2005. — Vol. 5. — P. 387–398.
23. Davis P. B., Cooper M. Vectors for airway gene delivery // AAPS J. — 2007. — Vol. 9, № 1. — E11–E17.
24. De Maagd R. A., Bravo A., Creckmore N. How Bacillus thuringiensis has evolved specific toxins to colonize the insect world // Trends in Genet. — 2001. — Vol. 17. — P. 193–199.
25. Dewan P., Fry A., Laserson K. et al. Inhalational anthrax outbreak among postal workers, Washington, DC, 2001 // Emerg. Infect. Dis. — 2002. — Vol. 8. — P. 1066–1072.
26. Druett H. A., Henderson D. W., Packman L. et al. Studies on respiratory infection: I. The influence of particle size on respiratory infection with anthrax spores // J. Hyg. Camb. — 1953. — Vol. 54. — P. 49–57.
27. Druett H. A., Henderson D. W., Packman L. et al. Studies on respiratory infection: I. The influence of aerosol particle size on infection gunea-pig with Pasturella pestis // J. Hyg. — 1956a. — Vol. 54. — P. 37–48.
28. Druett H. A., Henderson D. W., Peacock S. Studies on respiratory infection: III. Experiments with Brucella suis // J. Hyg. Camb. — 1953b. — Vol. 54. — P. 359–371.
29. Federici T., Kutner R., Zhang X. Y. et al. Comparative analysis of HIV-1-based lentiviral vectors bearing lyssavirus glycoproteins for neuronal gene transfer // Genet. Vaccin. Ther. — 2009. — Vol. 7, № 1 (doi:10.1186/1479-0556-7-1).
30. Frecha C., Szecsi J., Cosset F. L. et al. Strategies for targeting lentiviral vectors // Curr. Gene Ther. — 2008. — Vol. 8. — P. 449–460.
31. Goldberg M., Langer R., Jia X. Nanostructured materials for applications in drug delivery and tissue engineering // J. Biomater. Sci. Polym. — 2007. — Vol. 18, № 3. — P. 241–268.
32. Goncalves D. M., de Liz R., Girard D. Activation of neutrophils by nanoparticles // The Sci. World J. — 2011. — Vol. 11. — P. 1877–1885.
33. Gorman S., Viseshakul N., Cohen B. et al. A recombinant adenovirus that directs secretion of biologically active к-bungarotoxin from mammalian cells // Molecular Brain Research. — 1997. — Vol. 44, № 1. — P. 143–146.
34. Hacein-Bey-Abina S., von Kalle C., Schmidt M. et al. A serious adverse event after successful gene therapy for X-linked severe combined immunodeficiency // N. Engl. J. Med. — 2003 —Vol. 348, № 3. — P. 255-256.
35. Halama A., Kulinski M., Librowski T. et al. Polymer-based non-viral gene delivery as a concept for the treatment of cancer // Pharm. Rep. — 2009. — Vol. 61. — P. 993–999.
36. Henning S. J., Ledley F. D. Патент США 5821235, МПК6 A61K 31/704; A61M 5/14; C12N 15/09. Gene therapy using the intestine / заявитель Baylor College of Medicine, США; заявл. 20.01.1995, 376473; опубл. 13.10.1998.
37. Hicks K. W., Sweeney D. A., Cui X. et al. An overview of anthrax infection including the recently identified form of disease in injection drug users // Intensive Care Med. — 2012. — Vol. 38, № 7. — P. 1092–1104.
38. Hoffmaster A. R., Fitzgerald C. C., Ribot E. et al. Molecular subtyping of Bacillus anthracis and the 2001 bioterrorism-associated anthrax outbreak, United States // Emerg. Infect. Dis. — 2002. — Vol. 8. — № 10. — Р. 1011–1016.
39. Inder M. V., Nikunj S. Gene therapy promises, problems and prospects // Nature. — 1997. — Vol. 389. — P. 239–242.
40. Jackson P. J., Ramsay A. J., Christensen C. D. et al. Expression of mouse interleukin-4 by a recombinant ectromelia virus suppresses cytolytic lymphocyte responses and overcomes genetic resistаnce to mousepox // J. Virol. — 2001. — Vol. 75, № 3. — P. 1205–1210.
41. Jernigan J. A., Stephens D. S., Ashford D. A. et al. Bioterrorism-related inhalational anthrax: the first 10 cases reported in United States // Emerg. Infect. Dis. — 2001. — Vol. 7. — Р. 933–942.
42. Jo D. H., Lee T., Kim J. H. Nanotechnology and nanotoxicology in retinopathy // Int. J. Mol. Sci. — 2011. — Vol. 12. — P. 8288–8301.
43. Knight A. H., Wynne-Williams J. E., Willis A. T. Cutaneous anthrax-the non-industrial hazard // Brit. med. JY. — 1969. — № 1. — P. 416–418.
44. Kreitman R. J. Immunotoxins for targeted cancer therapy // The AAPS J. (http://www.aapsj.org). — 2006. — Vol. 8, № 3. — E532–E551.
45. Lamanna G. Immunological aspects of airborne infection: some general consideration of response to inhalation of toxins // Bact. Reviews. — 1961. — Vol. 25, № 3. — Р. 323–330.
46. Lindler L. E., Lebeda F. J., Korch G. W. Biological weapons defense. — N. J., 2005.
47. Manunta M. D., McAnulty R. J., Tagalakis A. D. et al. Nebulisation of receptor-targeted nanocomplexes for gene delivery to the airway epithelium // PLoS ONE. — 2011. — Vol. 6, № 10 (e26768. doi:10.1371/journal.pone.0026768).
48. Mataraza C., Qin Z. H., Huang Z. et al. Highly efficient molecular delivery into mammalian cells using carbon nanotube spearing // Nature Methods. — 2005. — Vol. 2. — P. 449–454.
49. Medical aspects of chemical and biological warfare / Ed. F. R. Sidell, E. T. Ta-fuqi, D. R. Franz. — Washington, 1997.
50. Nemunaitis J., Edelman J. Selectively replicating viral vectors // Canc. Gen. Ther. — 2002. — Vol. 9. — P. 987–1000.
51. Oberdörster G., Oberdörster E., Oberdörster J. Nanotoxicology: an emerging discipline evolving from studies of ultrafine particles // Environ. Health. Perspect. — 2005. — Vol. 113. — P. 823–839.
52. Pardo-Lopez L., Munoz-Garay C., Porta H. Strategies to improve the insecticidal activity of Cry toxins from Bacillus thuringiensis // Peptides. — 2009. — Vol. 30, № 3. — P. 589–595.
53. Patric W III. Biological warfare scenarios // Firepower in the Lab. Automation in the Fight against Infectious Diseases and Bioterrorism / S. P. Layne, T. J. Beugelsdijk, C. K. N. Patel (Eds.). Washington, D. C.: Joseph Henry Press, 2001. — P. 215–223.
54. Pluta K., Kacprzak M. M. Use of HIV as a gene transfer vector // Act. Biochim. Pol. — 2009 — Vol. 56, № 4. — P. 531–595.
55. Price E. E., Seymour M. L., Sarovich D. S. et al. Molecular epidemiologic investigation of an anthrax outbreak among heroin users, Europe // Emerg. Infect. Dis. — 2012. — Vol. 18, № 8. — P.1307–1313.
56. Ravel J., Jiang L., Stanley S. T. et al. The complete genome sequence of Bacillus anthracis Ames «Ancestor» // J. Bacteriol. — 2009. — Vol. 191, № 1. — P. 445–446.
57. Reddy A., Battisti L., Thorne C. B. Identification of self-transmissible plasmids in four Bacillus thuringiensis subspecies // J. Bacteriol. — 1987. — Vol. 169, № 11. — P. 5263–5270.
58. Rene D., Smith J. A. Integration site selection by retroviral vectors: molecular mechanism and clinical consequences // Hum. Gen. Ther. — 2008. — Vol. 19. — P. 557–568.
59. Roseberg B. H. Analysis of the anthrax attacks // Federation of American Scientists. — 2002, 5 february.
60. Roy K., Mao H., Truong Vu L. et al. Патент США 5972707, МПК6, C12N15/00; Gene delivery system / заявитель The Jons Hopkins University., США; заявл. 09.07.1997, 08/890599; опубл. 26.10.1999.
61. Sena-Esteves M., Saeki Y., Fraefel C. et al. HSV-1 amplicon vectors — simplicity and versatility // Mol. Ther. — 2000. — Vol. 2, № 1. — P. 9–15.
62. Seow Y., Wood M. J. Biological gene delivery vehicles: beyond viral vectors // Molecular. Therapy. — 2009. — Vol. 17, № 5. — P. 767–777.
63. Sharma A., Lia X., Bangari D. S. et al. Adenovirus receptors and their implications in gene delivery // Virus. Res. — 2009. — Vol. 143, № 2. — P. 184–194.
64. Shvedova A., Kisin E., Mercer R. et al. Unusual inflammatory and fibrogenic pulmonary responses to single-walled carbon nanotubes in mice // Am. J. Physiol. Lung. Cell. Mol. Physiol. — 2005. — Vol. 289. — L698–L708.
65. Thierry A. Патент 5908635 (A) США, МПК6 A61K9/127B2; C12N15/88. Method for the liposomal delivery of nucleic acids / заявитель Alan Thierry; патентообладатель The United States of America as represented by the Departament of Health and Human Service; заявл. 05.08.1994, 08/286,730; опубл. 01.06.1999.
66. Torok T. J., Tauxe R. V., Wise R. P. et al. A large community outbreak of salmonellosis caused by intentional contamination of restaurant salad bare // JAMA. — 1997. — Vol. 278, № 5. — P. 389–395.
67. US Departments of the Army, Navy and Air Force. Employment of chemical and biological agents. March, 1966 (FM 3-10; NWIP 36-2; AFM 355-4 FMFM 11-3).
68. Verhoeyen E., Cosset F. L. Surface-engineering of lentiviral vectors // J. Gene Med. — 2004. — Vol. 6 (Suppl 1). — P. 83–94.
69. White J. D., Rooney J. R., Prickett P. A. et al. Paithogenesis of experimental respiratory tularemia in monkeys // J. Inf. Dis. — 1964. — Vol. 47. — P. 277–286.
70. Wirtz S., Neurath M. F. Gene transfer approaches for the treatment of inflammatory bowel disease // Gen. Ther. — 2003. — Vol. 10. — P. 854–860.
Библиографическое описание:
Супотницкий М. В. Эпидемиология искусственных эпидемических процессов как третий раздел эпидемиологии // Новости медицины и фармации. — 2013. — № 5 (449) (http://www.mif-ua.com/archive/article/35221; ).
ССЫЛКИ ПО ТЕМЕ
Супотницкий М. В. Распознание поражений рицином // Прикладная токсикология. —2013. — № 1 (9). — С. 44–49.
Супотницкий М.В. Ещё не получали белый порошок? Тогда мы идём к вам! // Свободная пресса .— 2012 .— Интервью от 9 и 17 июля.
НЕСОСТОЯВШАЯСЯ БИОЛОГИЧЕСКАЯ ВОЙНА
(цикл статей по истории биологического оружия)
I. Боги-«биотеррористы» и древние отравители // Офицеры. — 2011. — № 5. — С. 56-61.
II. Средневековые «сеятели чумы» // Офицеры. — 2011. — № 6. — С. 56-61.
III. Бактериологические диверсии Первой мировой // Офицеры. — 2012 — № 1. — С. 58–63.
V. Крах «отряда 731» // Офицеры. — 2012 — № 3. — С. 62–67.
VI. Повелители эпидемий // Офицеры. — 2012 — № 5. — С. 56–61.
VII. Бактериологическая война в Корее // Офицеры — 2013. — № 1. — С. 58–63.
VIII. От расцвета до запрета // Офицеры — 2013. — № 3. — С. 58–61.
ЗАБЫТАЯ ХИМИЧЕСКАЯ ВОЙНА 1915-1918 гг.
(цикл статей о применении химического оружия в годы Первой мировой войны)
IV. Химическая война в России // Офицеры. — 2010. — № 6 (50). — С. 52–57.
VI. Адское пламя. Огнеметы Первой мировой войны // Офицеры. — 2011. — № 2 (52). — С. 56–61.
[1] Биотеррористический акт, совершенный в 2001 г. в США, не был раскрыт. Как и в случае с убийством президента Джона Кеннеди, ФБР вело следствие «вширь», хотя использованный террористами иммунитет преодолевающий штамм возбудителя сибирской язвы («vaccine-resistant Bacillus anthracis») Ames имелся только в нескольких лабораториях, работавших по программам Министерства обороны США. С 2002 г. в роли подозреваемого проходил микробиолог Стивен Хатфилл (Steven Jay Hatfill), но доказать его причастность к теракту в суде не удалось. В 2003 г. он подал иски против ФБР и Министерства юстиции и отсудил 5,8 млн долларов компенсации («…violating his constitutional rights and for violating the Privacy Act»). В 2008 г. в качестве подозреваемого оказался микробиолог Брюс Айвинс (Bruce Edwards Ivins), но и его вина не была доказана в суде. В июне Брюса нашли в коме в ванной комнате своего дома, отравленного туленолом. Через два дня, не приходя в сознание, он умер от почечной и печеночной недостаточности. После чего федеральный обвинитель, прокурор Джеффри Тэйлор (Geoffrey Taylor) официально сделал утверждение, что Брюс совершил самоубийство, и он был единственным преступником, организовавшим биотеррористический акт в 2001 г. Газета «New York Times» по этому поводу задала вопрос: «А что если бы доктор Хэтфилл совершил самоубийство в 2002 г.? Достаточно ли это было бы для правосудия, чтобы объявить о смерти преступника?».
[2] Термины «эпидемиология искусственных эпидемических процессов и других, умышленно вызванных биологических поражений» и «неправильная эпидемиология» используются как синонимы.
[3] Русский перевод статьи J. L. Black доступен в глобальной сети — http://www.cbio.ru/v5/modules/news/article.php?storyid=1666.
[4] Токсикология — это наука, изучающая действие ядовитых (токсичных) веществ на уровне индивидуального организма, но она не изучает токсические поражения как массовый процесс со своими закономерностями и особенностями развития.
[5] В данном контексте специфическое поражение — поражение, которое вызвано именно этим фактором, имеющее характерный для действия этого фактора механизм развития и клинико-анатомические проявления.
[6] Или, если вернуться к привычной терминологии естественных эпидемических процессов, — площадь эпидемического очага.
[7] Биологическая рецептура — это многокомпонентная система, содержащая патогенные микроорганизмы (токсины), наполнители и стабилизирующие добавки, обеспечивающие повышение их устойчивости при хранении, применении и нахождении в аэрозольном состоянии. В зависимости от агрегатного состояния рецептуры могут быть сухими или жидкими.
[8] LD50 (англ. lethal dose, 50%) — средняя доза вещества, вызывающая гибель половины членов испытуемой группы.
[9] Он просто не может быть иным, так как в лабораторных условиях быстро теряет вирулентность при пересевах на искусственных питательных средах.
[10] B. thuringiensis используется в сельском хозяйстве в качестве биопестицида.
[11] Вирус эктромелии (семейство Pоxviridae, род Orthopoxvirus) является естественным патогеном лабораторных мышей, вызывает у них системную болезнь — мышиную оспу.
[12] IL-4 относится лимфоцитарным цитокинам противоспалительного действия. Ингибирует функции моноцитов, макрофагов и NK-лифоцитов (более подробно о его функциях см. в работах [2, 5].
[13] MLVA (multiple-locus variable-number tandem repeat analysis) — анализ многолокусных вариабельных тандемных повторов.

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2013