Протективные свойства порообразующих белков патогенных бактерий
За последние два десятилетия в зарубежных научных изданиях опубликован обширный экспериментальный материал об иммуномодули-рующей активности порообразующих белков (поринов) бактерий. Анализ отечественных публикаций показывает, что российскими специалистами еще не оценены должным образом возможности использования этих белков для создания новых средств специфической профилактики и лечения инфекционных заболеваний. В настоящем обзоре обобщены результаты исследований протективных свойств порообразующих белков патогенных бактерий.
1.Пориновые белки бактерий
Белки клеточной стенки бактерий, обладающие способностью образовывать заполненные водой поры (каналы) и способствующие неспецифическому прохождению через внешнюю мембрану веществ с относительно невысокой мол. массой, названы поринами [3, 5].
Порины обладают следующими физико-химическими свойствами, отличающими их от других белков клеточной стенки бактерий [3, 5]:
1) нативные белки имеют трехмерную субъединичную структуру. Мол. масса субъединицы,как правило, составляет 36–40 кД;
2) в исследованиях in vitro порины проявляют выраженную способность к самоорганизации волигомеры. Присутствие незначительных количеств липополисахаридов (ЛПС) в очищенных препаратах порообразующих белков является непременным условием для образования ими каналов в бислойных липидных мембранах (БЛМ);
3) порины очень прочно связаны с липополисахаридом наружной поверхности внешней мембраны;
4) денатурированные порины представляют собой гидрофобные кислые пептиды с изоэлектрической точкой от 4,8 до 6,2.
Топологически порины занимают трансмембранное положение. Они пронизывают липидный бислой наружной клеточной стенки и простираются через периплазматическое пространство до пептидогликана, но не взаимодействуют с ним [5].
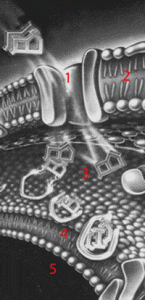
Схематическое изображение инактивации антибиотиков в периплазматическом пространстве клеточной стенки грамотрицательной бактерии. 1. Тример поринового белка. 2. Наружная клеточная оболочка. 3. Периплазматическое пространство. 4. Внутренняя мембрана. 5. Цитоплазма. (по материалам Pfizer , 1987)
2.Протективные свойства поринов отдельных возбудителей инфекционных заболеваний
2.1. Порины Haemophilus influenzae типа В (Hi В )
Неудачи экспериментов по получению эффективных гемофилезных вакцин на основе капсульного полимера и липополисахаридного комплекса стимулировали интерес исследователей к таким компонентам соматического антигена HiB , как поверхностные мембранные белки [18, 19].
Е. Hansen и соавт. [19] впервые показали возможность получения специфических антител к HiB в ответ на введение экспериментальным животным препаратов мембранных поверхностных белков. Один из этих белков с мол. массой 39 кД защищал молодых кроликов от большинства штаммов HiB. В дальнейшем была установлена способность данного белка (обозначен как Р2) образовывать поры в БЛМ [32]. От других иммуногенных белков клеточной стенки HiB его отличают крайне высокая консервативность первичной структуры и сходство с OmpF-порином E . coli и Р1-порином N. gonorrhoae (до 20% гомологии). Кроме того, белок Р2 представлен среди белков наружной мембраны в наибольшем количестве [21].
Мутанты HiB , не содержащие белка Р2, не реагировали с Р2-специфическими моноклональными антителами, имели значительно большее время генерации в полноценном питательном бульоне, чем родительский штамм, не вызывали бактериемию у крысят после внутрибрю-шинного введения. Повторное введение копии родительского гена Р2 в мутантный штамм приводило к сокращению времени генерации in vitro и восстановлению его вирулентности [4].
2.2. Порины Salmonella typhimurium
Основными недостатками убитой брюшнотифозной вакцины являются неполный защитный эффект и большое количество противопоказаний к ее применению. N. Kuunsi и соавт. [23] попытались устранить эти недостатки, используя для иммунизации порин S . typhimurium .
Им удалось повысить титр антипориновых антител в сыворотке крови иммунизированных мышей в 100 раз по сравнению с исходным. При этом индекс защиты в зависимости от штамма возбудителя, использованного для заражения, составлял от 8,2 до 32,0.
Пассивную иммунизацию мышей авторы проводили путем интраперитонеального введения 0,2 мл различных разведений сыворотки от иммунизированных порином кроликов. Индекс защиты в отдельных опытах достигал 47,5, и, как правило, эта величина была в 20–30 раз выше, чем в опытах с использованием сыворотки от интактных кроликов [23]. Защитный эффект сохранялся и после удаления из сыворотки антител к ЛПС. Сыворотка кроликов, иммунизированных порином с полностью удаленным ЛПС, не обладала протективным свойством в аналогичных опытах. На основе этих данных авторы сделали вывод, что следовые количества ЛПС в препаратах поринов, используемых для иммунизации, необходимы для сохранения конформационных эпитопов на поверхности комплексов, образуемых в результате олигомеризации субъединиц порообразующих белков [24].
Другими исследователями отмечено усиление гиперчувствительности замедленного типа и повышение синтеза интерлейкина-2 у иммунизированных порином мышей. Т-клетки, перенесенные от иммунных животных к неиммунным, оказались способными предотвращать развитие сальмонеллезной инфекции [26]. На основании этих данных авторами сделан вывод об индуцировании клеточного звена иммунитета порообразующим белком возбудителя сальмонеллеза [26, 27].
Участие поринов в патогенезе сальмонеллезной инфекции подтверждается в опытах по заражению мышей линии BALB/C вариантами возбудителя брюшного тифа с мутациями в двух генах поринов ОтрС и ОтрВ. Вирулентность таких двойных мутантов снижается в 10–1000 раз в зависимости от способа заражения [12].
2.3. Порины Neisseria meningitidis
Интерес исследователей к белкам наружной мембраны N. meningitidis объясняется неудачными попытками создания вакцины на основе полисахаридов капсул менингококков различных групп [34].
W. Zollinger и соавт. [34] впервые установили способность вакцины, включающей белок наружной мембраны, индуцировать высокий титр бактерицидных и гемагглютинирующих антител у кроликов и защищать мышей от гибели после инфицирования культурой менингококка группы В типа 2.
В последующих экспериментах обнаружено 4 класса поверхностных мембранных белков менингококков — 1,2/3, 4 и 5. Но только к белкам классов 1 и 2/3 удалось получить моноклональные антитела, обладающие выраженной бактерицидной активностью. Белки класса 1 обладали высокой протективной активностью в опытах на животных и формировали в БЛМ катионселективные поры [30]. Белки класса 2/3 образовывали анионселективные поры [29].
У высокоочищенного белка Р2 обнаружена способность к формированию пор в эритроцитах. Считается, что он может образовывать поры в мембранах других клеток эукариот [31].
2.4. Порин Neiseria gonorrhoeae
Порин PI — основной поверхностный мембранный белок N. gonorrhoeae [15]. Благодаря своей способности к транслокации через мембрану эукариотической клетки он играет существенную роль в патогенезе гонококковой инфекции [11]. В отличие от других поверхностных антигенов возбудителя гонореи Р1 не подвержен антигенному дрейфу в ходе инфекционного процесса [33]. По данным J. Heckels и соавт. [22], Р1 способен индуцировать выработку антител, оказывающих бактерицидное действие в отношении различных серотипов N. gonorrhoeae.
2.5. Порин Pseudomonas aeruginosa
К началу исследований протективной способности порообразующего белка P. aeruginosa (белка F) в 1983 г. было установлено следующее [16, 20, 21]: антипсевдомонадные вакцины на основе ЛПС реактогенны и позволяют получать защитный эффект только в отношении штамма того же серотипа, из которого ЛПС был выделен; у больных с псевдомонозным фиброзом легких преобладают антитела к белку F; белок F является основным белком наружной мембраны, он консервативен и антигенно связан со всеми серотипами P . aeruginosa .
Основываясь на этих данных, Н. Gilleland и соавт. [16, 17] провели серию экспериментов по изучению протективного действия белка F. Было показано, что при двукратной иммунизации мышей белком F в дозе 10 мкг на животное с последующим инфицированием 3 LD 50 возбудителя синегнойной инфекции процент выживших животных составлял от 90 до 100 в зависимости от штамма, выбранного для заражения. При той же дозе заражения выживало до 90% мышей, которым вводили иммунную кроличью сыворотку [16].
В другой работе Н. Gilleland и соавт. [17] доказали возможность получения протективного эффекта при хронической легочной инфекции кроликов, моделирующей легочный фиброз у людей. Иммунизация белком F защищала кроликов от 6 (из 6 имеющихся в распоряжении авторов) иммунотипов P . aeruginosa .
F-белок стимулировал образование IgC и IgM, реагирующих с клеточными оболочками всех штаммов P . aeruginosa .
Преимущества белка F как "кандитата" в вакцины для профилактики хронической псевдомонозной легочной инфекции Н. Gilleland и соавт. обосновывают тем, что в результате перехода шероховатой формы P . aeruginosa в гладкую при колонизации легочной ткани возбудитель утрачивает О-антиген, стимулирующий специфический иммунитет, и начинает продуцировать альгинат (главный компонент мукоидного сектора). Вместе с тем антитела к белку F оказывают бактерицидное действие не только на шероховатую форму возбудителя, но и после его перехода в гладкую. Другой "кандидат" для использования в качестве антигена в составе вакцины — альгинат — не обладал достаточной защитной эффективностью в аналогичных экспериментах [17].
2.6. Порин Pseudomonas mallei
У P. mallei описан один порообразующий белок с мол. массой 38 кД, аналогичный по своим свойствам белку F P . aeruginosa [8].
Исследование протективного действия поринового белка возбудителя сапа показало, что он способен индуцировать у золотистых хомячков иммунитет, обеспечивающий их невосприимчивость к последующему заражению различными штаммами P . mallei . В зависимости от схемы иммунизации и дозы вводимого антигена индекс защиты находился в пределах 8,6–14,1 [6, 8].
Кроме иммунопрофилактического эффекта, обнаружено специфическое протективное действие, не связанное с развитием иммунного ответа. Суть его заключается в том, что введение препаратов порина интактным животным через 1 ч после их инфицирования P. mallei приводило к блокированию инфекционного процесса. Процент выживших животных зависел от количества введенного препарата и схемы его применения. Введение порина через сутки после заражения резко снижало этот эффект. В тех же опытах препараты поринов возбудителей мелиоидоза, синегнойной инфекции и сальмонеллеза профилактического действия не оказывали [6, 8].
2.7. Порин Pseudomonas pseudomallei
Доказательства возможности получения протективного эффекта порина P . pseudomallei при экспериментальном мелиоидозе получены в опытах на золотистых хомячках и крысах. Индекс защиты для однократно иммунизированных хомячков колебался в пределах 12,5–28,0 и зависел от дозы использованного для иммунизации антигена [7].
Однако наиболее убедительные данные получены в опытах на белых крысах. Животных иммунизировали следующим образом: однократно по 350 мкг на животное, дву- и троекратно по 150 мкг на животное с интервалами между иммунизациями 14 сут. Инфицирование осуществляли через 10 сут после последней иммунизации дозой 30 LD 50 - Однократно иммунизированные крысы погибли в те же сроки, что и интактные. Среди животных, иммунизированных дважды и трижды, случаев заболевания мелиоидозом и гибели не отмечено [7].
2.8. Порин Vibrio cholerae
Chahjahan Kabir [12] в 1980 г. описал белок с мол. массой 48 кД (оценена приблизительно), который он смог отделить от других компонентов клеточной стенки классического холерного микроба только после продолжительного инкубирования в растворе додецилсульфата натрия при температуре 100°С. Сыворотки, полученные к данному белку, агглютинировали бактерии обоих биотипов. Автор высказал предположение о возможности его использования для создания химической холерной вакцины.
2.9. Порин Legionella pneumophilla
И.С. Тартаковским и соавт. [9] установлено, что аттенуированные вакцинные живые штаммы и препараты на основе ЛПС-антигенов, эффективные при внутрибрюшинном инфицировании морских свинок, не обладали защитным свойством при аэрогенном заражении.
Результаты сравнительного исследования протективной способности различных белковых антигенов и биологически активных молекул легионелл позволили авторам утверждать, что только основной белок внешней мембраны L. pneumophilla (порин с мол. массой 39 кД) способен индуцировать иммунитет, защищающий морских свинок от аэрогенного заражения 5–10 LD 50 возбудителя легионеллеза. Присутствие липополисахаридного компонента, ковалентно связанного с порином, приводило к более выраженным результатам [9].
2.10. Порин вида Shigella
Иммунизация морских свинок и кроликов мембранными белками, изолированными из S. flexneri и S. zonnei, а также введение специфической к этим белкам сыворотки, защищало животных от кератоконъюнктивита, вызванного негомологичными штаммами данных возбудителей [10].
2.11. Порин Yersinia pseudotuberculosis
Порин возбудителя псевдотуберкулеза (иерси-нин) впервые описан О. Д. Новиковой [5]. Автором доказана видоспецифичность данного антигена. Индекс защиты для иммунизированных иерсинином мышей, инфицированных бактериями псевдотуберкулеза первого и третьего серова-ров, составил от 100 до 1000 в зависимости от схемы иммунизации и штамма, выбранного для инфицирования. Одновременно усиливалась активность макрофагов перитонеального экссудата на всех стадиях фагоцитоза [5].
3. Свойства пориновых белков, определяющие возможность создания на их основе новых средств специфической профилактики инфекционных заболеваний
Внимательный анализ ряда свойств пориновых белков показывает, что они не всегда могут быть объяснены на основе традиционных представлений о их роли в регуляции проницаемости клеточной стенки бактерии [3, 5].
Например, основное свойство поринов — способность контролировать прохождение через внешнюю бактериальную мембрану низкомолекулярных веществ — показано на таких экспериментальных моделях, как БЛМ [5]. Однако подобная организация биологической мембраны характерна для эукариотических клеток [4]. У бактерий порины не проникают в пептидогликан [5], а следовательно, через цитоплазматическую мембрану, которую имитируют БЛМ.
Эта особенность поринов свидетельствует о том, что модели типа БЛМ—порин больше отражают характер взаимодействия поринов с эукариотическими клетками, чем проясняют функционирование поринов в прокариотических организмах.
На активное взаимодействие поринов с мембранами эукариотов указывает их способность гемолизировать эритроциты [31] и вызывать отеки [12]. Имеются многочисленные указания и на то, что инвазивные патогены, какими являются грамотрицательные бактерии, определенным образом влияют на проницаемость мембраны клеток-мишеней хозяина именно с помощью поринов [11, 14, 21, 25, 34].
Таким образом, формирование пор в БЛМ (т.е. в мембранах эукариотов) и регулирование проницаемости низкомолекулярных веществ через внешнюю бактериальную мембрану — это две функции, которые выполняет один белок благодаря своим структурным особенностям. Вместе с тем ни та, ни другая функция консервативности от белковой молекулы не требует. Более того, консервативность нехарактерна для поверхностных структур белков [1]. Известны порины-мутанты, способные нормально функционировать во внешней бактериальной мембране [3]. Пориновые тримеры из различных бактерий могут формировать одинаковые поры в БЛМ [3, 5]. В то же время бактерии с мутантными поринами утрачивают патогенность [14, 28, 34]. Следовательно, консервативность первичной структуры порина не связана только с его способностью образовывать поры.
Нам хотелось бы обратить внимание и на то обстоятельство, что у представителей другого живого царства, а именно у оболочечных вирусов, описаны белки, поразительно напоминающие порины бактерий. Это так называемые "белки слияния". Общими для них и поринов являются следующие свойства [2]: консервативность, гидрофобность, способность гемолизировать эритроциты и дестабилизировать липидный бислой в модельных системах, высокая степень гомологии с аналогичными белками близкородственных видов. Отсюда можно сделать предположение об одинаковой роли поринов и белков слияния оболочечных вирусов в инфекционном процессе, заключающейся во взаимодействии с поверхностью эукариотической клетки и обеспечении трансмембранного проникновения возбудителей.
Однако порообразующие белки взаимодействуют не с любым участком поверхности эукариотической клетки. Об этом свидетельствуют данные, показывающие возможность высокоспецифичного дозозависимого и не связанного с иммунным ответом блокирования развития сапа введением порина P . mallei в первые сутки после инфицирования [6].
Данное явление может быть объяснено на основе положений Ю.В. Езепчука [4] о роли феномена биологического узнавания в развитии инфекционного процесса. Возбудитель сапа узнает определенную эукариотическую клетку по комплементарному рецептору, находящемуся на поверхности клетки-мишени. При этом роль лиганда играет поверхностный белок, выполняющий у бактерий функцию порообразования. Высокоочищенный порин, введенный в инфицированный возбудителем макроорганизм, связывается с рецепторными структурами соответствующей ткани. В результате такого связывания происходит экранирование рецепторов и микроорганизм не может вступить во взаимодействие с нужной клеткой, тем самым предотвращаются этапы адгезии и колонизации тканей, специфически поражаемых микробом (т.е. порин в данном случае действует как специфический "антидот"). Сам порин в дальнейшем либо проникает в клетку благодаря инициированному им рецепторному эндоцитозу (функция белка слияния), либо десорбируется. Продолжительность специфического связывания порином P . mallei рецепторов на поверхности клеток-мишеней не превышает 1 сут [6].
В рамках этих представлений могут быть объяснены и основные физико-химические свойства пориновых белков:
консервативность — следствие консервативности рецепторов клеток-мишеней, с которыми взаимодействуют выполняющие роль лигандов порины [2];
гидрофобность — реализует лиганд-рецепторные механизмы узнавания. Функция гидрофобных порообразующих комплексов в данном процессе сводится к преодолению микроорганизмом электростатического барьера и сближению с поверхностью клеток-мишеней эукариотов [4];
высокая степень гомологии с аналогичными белками близкородственных видов, вероятно, связана с сохранением многими генерациями микроорганизмов способности осуществлять лиганд-рецепторное взаимодействие с одними и теми же поверхностными структурами клеток высших организмов.
Таким образом, для рассмотренных порообразующих белков бактерий характерна высокая иммуногенность. Показана возможность их использования в качестве компонентов химических вакцин против возбудителей инфекционных заболеваний, в отношении которых ранее не удавалось создать эффективные средства специфической профилактики [7–9, 16, 17, 19, 22, 23, 26]. В ряде исследований [9, 16, 26] продемонстрировано важное значение примесей следовых количеств ЛПС в препаратах пориновых белков для индуцирования иммунного ответа на них. Установлено выраженное защитное действие антипориновых сывороток в отношении возбудителей брюшного тифа, синегнойной инфекции и дизентерии [10, 16, 24].
Анализ задач, решаемых в данных исследованиях, показывает, что включение поринов в состав химических вакцин осуществляется в случаях, когда требуется: а) создать напряженный видоспецифический иммунитет [10, 11, 16, 17, 22]; б) повысить эффективность защиты от аэрогенного заражения [9, 17].
Исключительно важная роль поринов в патогенезе инфекционных заболеваний и уникальные биологические и физико-химические свойства предполагают (кроме включения в состав химических вакцин) по крайней мере два новых направления их использования для создания средств специфического лечения инфекционных заболеваний:
1) разработка препаратов, блокирующих рецепторы, узнаваемые патогенными бактериями на поверхности клеток-мишеней эукариотов (мономерные формы поринов, их синтетические аналоги и др.);
2) конструирование на основе поринов и их синтетических аналогов конъюгатов, способных адресно доставлять биологически активные вещества (антибиотики, цитостатики, токсины, гормоны и др.) через мембраны клеток эукариот.
Важным является и то, что запатентованные препараты, содержащие порины, могут быть легко идентифицированы по единственному признаку — способности формировать поры и БЛМ. Тем самым значительно облегчается контроль со стороны патентовладельца за соблюдением его исключительного права на использование данного препарата.
ЛИТЕРАТУРА
1. Основы биохимии / Анисимов А.А., Леонтьева А.Н. Александрова И.Ф. и др. — М., 1986.
2. Букринская А.Г., Жданов В.М. Молекулярные основы патогенности вирусов. — М., 1991.
3 . Грязнова Н.С, Субботина Н.А. // Антибиотики и химиотер. 1986. Т. 34. № 12. С. 925–932.
4 . Езепчук Ю. В. Патогенность как функция биомолекул. — М., 1984.
5. Новикова О. Д. Дис. ... канд. биол. наук. — Владивосток,1986.
6. Заявка 5060605, Россия МКИ А61К 35/66, 35/74. Способ специфического лечения сапа / Супотницкий М.В. Кузнецов С.М., Полевщиков С.Н. и др.; НИИМ МОРФ (Россия).
7. Заявка 92-006762, Россия, МКИ А 61К 39/00. Способ специфической профилактики мелиоидоза / Супотницкий М.В., Маслов А.В., Сероглазов В.В. и др.; НИИММО РФ (Россия).
8. Супотницкий М.В., Бакулин М.К., Левчук Б.А. и др. // Иммунология и специфическая профилактика особо-опасных инфекций. — Саратов, 1993. С. 203.
9. Тартаковский И. С., Прозоровский С.В. и др. // Там же. С. 209–210.
10. Adamus С , Mulczyk М ., Witkowska D. et al. // Infect, andImmun. 1980. Vol. 30. № 2. P. 321–324.
11. Blake M.S. // The Pathogenic Neisseria. 1985. P. 251–258.
12. Chahjahan Kabir // J. Bact. 1980. Vol. 144. № 1. P. 382–389.
13. Chatfield S.N., Dorman С .S., Hagward С et al. // Infect,and Immun. 1991. Vol. 59. № 1. P. 449–452.
14. Cope L., Pelzel S.E., Jo L.L. et al. // Ibid. 1990. Vol. 58. № 10. P. 3312–3318.
15. Douglas J. Т ., Lee M.D., Nekaido H. // FEMS Microbiol.Lett. 1981. Vol. 12. № 1. P. 305–309.
16. Gilleland H.E., Parker M.G., Matlens J.M. et al. // Infect, and Immun. 1984. Vol. 44. № 1. P. 49–54.
17. Gilleland H.E, Gilleland L. В ., Matthews-Greer J.M. // Ibid. 1988. Vol. 56. № 5. P. 1017–1022.
18. Granoff D.M., Rockwell R. // Ibid. 1978. Vol. 29. № 1. P. 215–220.
19. Hancock R.E.W., Carey A.M. // J. Bact. 1979. Vol. 140. № 3. P. 902–910.
20. Hancock R.E.W., Dead G.M., Nikaido H. // Biochim, biophys. Acta. 1979. Vol. 136. № 1. P. 381–390.
21. Hansen E.J., Frisch С . К , McDade J.R. et al. // Infect, andImmun. 1981. Vol. 32. № 3. P. 1084–1092.
22. Heckels J E., Fletcher J.N., Virji M. // J. gen. Microbiol. 1989. Vol. 135. Pt. B. P. 2269–2276.
23. Kuunsi N., Nurminen M., Saxen H. et al. // Infect, and Immun. 1979. Vol. 25. № 3. P. 857–862.
24. Kuunsi N., Nurminen M., Saxen H. et al. // Ibid. 1981. Vol. 34. № 2. P. 328–332.
25. Lynch E. C, Blake K. S., Gotschlich E. С et al. // Biophys. J. 1984. Vol. 45. № 1. P. 104–107.
26. Matsui K., Aral T. // Jap. J. Bact. 1989. Vol. 44, № 1. P. 313.
27. Matsui K., Aral T. // Microbiol and Immunol. 1989. Vol. 33. № 9. P. 699–708.
28. Matsui K., Aral T. // Ibid. 1990. Vol. 34. № 11. P. 917–927.
29. Runeberg-Nyman K., Butcher S., Wshlstrom E. et al. // Vac-cines'91. — Cold Spring Harbor, 1991. P. 415–419.
30. Saukkonen K., Leinonen M., Addillahi H. et al. // Vaccine. 989. Vol. 7. № 2. P. 325–328.
31. Ulmer J. В ., Fredman A., Burke С G. et al. // J. Cell Biol. 1991. Vol. 115. № 3. Pt 2. P. 467.
32. Vachon V., Lyen D. S., Coulton J. W. 11 J. Bact. 1985. Vol. 162, № 3. P. 918–924.
33. Zak K., Diaz J.K., Jackson D. et al. // J. infect. Dis., 1989. Vol. 149, № 1. P. 166–173.
34. Zollinger W.D., Mandrel! R.E., Altieri P. // Ibid. 1978. Vol. 137. № 6. P. 728–739.
Супотницкий М. В. Протективные свойства порообразующих белков патогенных бактерий // Вестник Российской академии медицинских наук. – 1996. - № 8. – С. 18 – 22.
Продолжение темы смотрите в статьях "ПОРООБРАЗУЮЩИЕ БЕЛКИ — ИММУНОГЕННЫЕ КОМПОНЕНТЫ ВЕТЕРИНАРНЫХ ВАКЦИН", "ЭФФЕКТИВНОЕ ПАТЕНТОВАНИЕ СРЕДСТВ СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ"; патентах №2052993, № 2059413, № 92006762; и в книге " Микроорганизмы, токсины и эпидемии"

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2005