Эффективное патентование средств специфической профилактики инфекционных заболеваний
В настоящее время ведущие биотехнологические организации ( Genentech Inc ., Inst . Pasteur , Monsanto и др.) имеют патенты практически во всех промышленно развитых странах. Благодаря патентам формируется новый тип колониальной зависимости стран с меньшим технологическим потенциалом от стран, обладающих высокими технологиями [1].Весьма важно и то, что патенты способны поддерживать цены на лекарственные средства на уровне, значительно превышающем их фактическую стоимость [2]. Российские исследователи действуют в условиях патентного законодательства сравнительно недавно, с 1991 года, и не все из них осознали должным образом тот факт, что разработка новой наукоемкой продукции без ее умелой патентной защиты в современных условиях не имеет смысла. В то же время ведущие зарубежные разработчики биотехнологической продукции не стремятся раскрывать секреты своей деятельности на рынке патентов и лицензий. Патентование изобретений «случайным образом» в лучшем случае будет просто малорезультативным, в худшем — приведет к бессмысленному расходованию средств, судебным разбирательствам и т.п.
Данная работа имеет целью оказать помощь отечественным разработчикам в выборе собственной стратегии в патентовании вакцин, а также приходящих им на смену средств специфической профилактики, исключающих иммунный ответ из механизма защиты от возбудителей инфекционных заболеваний.
МЕТОД ИССЛЕДОВАНИЯ
Анализировались практика патентования средств специфической профилактики инфекционных заболеваний, осуществляемая в 80—90-е годы ведущими биотехнологическими организациями, и опубликованные работы отечественных и зарубежных специалистов по правовым и коммерческим аспектам патентования биотехнологических изобретений [1–11]. Исследование проводили по изобретениям, имеющим широкую патентную защиту (вакцина, антиген, адъювант и др.), а также по изобретениям, защищающим ключевые технические решения по средствам специфической профилактики СПИДа, гриппа, гепатита В, гемофилеза, коклюша и некоторых других инфекций, которые рассматривались нами как опережающие объекты [10]. Для изучения пределов развития отдельных технологий использовали методологию логического системного анализа [12]. Технические решения, созданные в процессе конструирования таких средств, рассматривали как совокупность элементов, находящихся между собой в определенной зависимости и составляющих некоторое единство (целостность), т.е. систему. Данную систему расчленяли на отдельные подсистемы, представляющие собой конкурирующие, альтернативные направления (типовые приемы), и оценивали возможности условной биотехнологической фирмы по созданию технических решений. Затем прогнозировали принципы функционирования и структуру эффективных охраноспособных технических решений, а также эффективные подходы к их патентной защите. В тексте при ссылке на патент указано сокращенное наименование патентного ведомства, номер патентного документа. Ссылки на отдельные патенты, знакомство с которыми может быть очень полезным, вынесены в список использованных источников.
ВОЗМОЖНОСТИ УСЛОВНОЙ БИОТЕХНОЛОГИЧЕСКОЙ ОРГАНИЗАЦИИ ПО РАЗРАБОТКЕ ОХРАНОСПОСОБНЫХ ТЕХНИЧЕСКИХ РЕШЕНИЙ
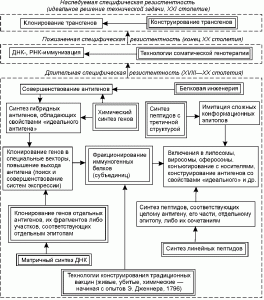
На рис. 1 показаны пределы развития технологий специфической профилактики инфекционных заболеваний. Освоение отдельных ключевых технологий (выделены двойной линией) предоставляет организации определенный диапазон возможностей по патентованию своих изобретений [10].
Рис. 1. Пределы развития технологий специфической профилактики инфекционных болезней.
Технологии конструирования традиционных вакцин предполагают конструирование живых, убитых и химических вакцин [13]. Методический уровень, используемый для конструирования первых двух типов вакцин, более характерен для периода конца XIX века и начала 50-х годов XX века. Объекты защиты — вакцинные штаммы, способы аттенуации вирулентных штаммов возбудителя, для убитых вакцин — их композиции с адъювантами, консервантами и лимфокинами; отдельные технологические процессы, обеспечивающие наработку микробной биомассы; питательные среды и компоненты для них; способы контроля качества вакцин, питательных сред и др. [9]. Используемый для создания химических вакцин методический уровень характерен для периода от начала до середины 70-х годов XX столетия. Получение антигенов, как правило, осуществляется из среды культивирования (токсины, слизь, ферменты), либо из убитых клеток. В последнем случае объектами защиты становятся грубые, неохарактеризованные по химической и физико-химической структуре комплексы липидов, белков и полисахаридов, называемые «протективными антигенами», «О-антигенами», «комплексами мембранных белков» и т.п. [8]. В настоящее время в рамках данных технологий осуществляется патентование вакцин только ветеринарного назначения.
Фракционирование иммуногенных белков (субъединиц) микроорганизмов. Освоение технологии в виде различных приемов хроматографического разделения белков предполагает эмпирический поиск протективных антигенов (их эпитопов) среди белков и гликопротеинов вирусов и бактерий. Как правило, антигены, включенные в вакцины, охарактеризовываются в патентных притязаниях по физико-химическим и иммунологическим свойствам, позволяющим проводить их идентификацию в смесях других биополимеров. Патентуемые изобретения решают задачи снижения токсичности антигенных белков и повышения их иммуногенности. В конце 80-х и в начале 90-х годов основным критерием при выборе антигена для патентования стала возможность получения видоспецифического иммунитета (антигены на основе белков слияния вирусов, модифицированного липида А бактерий и эпитопов порообразующих белков; US 4861707, US 5141867, ЕР 0244748, WO 94/16082), а также создание эффективной защиты от аэрогенного инфицирования (вакцины на основе живых векторов и поринов) [14,15]. Объекты патентования — композиции или соединения, включающие антиген и компоненты, способствующие его эффективной презентации иммунной системе [9].
Клонирование отдельных генов антигенов и их фрагментов. Технология с конца 70-х годов используется для конструирования вакцин против возбудителей инфекционных заболеваний, представляющих собой ДНК-вирусы, бактерии и риккетсии. В рамках технологии осуществляется последовательное переклонирование фрагментов ДНК, имеющее целью получение участков, определяющих синтез консервативных и высокоиммуногенных антигенов (эпитопов), и совершенствование подходов к представлению антигена клеткам иммунной системы ( FR 2587720,2600079,267518, WO 88/ 00311, 92/22641). Для этого гены антигенов клонируются в вирусные и бактериальные векторы, частицы HBsAg [14]. Другим направлением, реализующим заложенный в данной технологии изобретательский потенциал, является повышение уровня экспрессии и секреции генов клонированных антигенов. Оно находит свое выражение в появлении патентов на векторы экспрессии и способы очистки антигенов, основанные на тонких методах фракционирования биополимеров (ЕР 0343132). В рамках этой же технологии осуществляется поиск (а соответственно и патентование) новых продуцентов (культуры тканей эукариот, метилотрофные дрожжи, трансгенные растения и животные и др.; JP 74990, ЕР 255785, ЕР 0340837). Синтезированные в различных системах экспрессии антигены также включаются в состав композиций, усиливающих иммунный ответ [9].
Матричный синтез ДНК. Освоение технологии позволяет организации осуществлять клонирование генов РНК-вирусов [8]. Возможности и ограничения те же, что мы отметили при рассмотрении предыдущей технологии. Обе характеризуют методический уровень 80-х годов.
Химический синтез генов наиболее активно начал использоваться для получения генов антигенов со второй половины 80-х годов. Освоение технологии позволяет осуществлять конструирование генов антигенов, состоящих из нескольких эпитопов [9]. В ее рамках наиболее реально конструирование антигенов, обладающих свойствами «идеального антигена» для данной системы «микроорганизм—хозяин». Но в тоже время выход организации на этот уровень является своеобразным индикатором исчерпания возможностей традиционной технологии рекомбинантной ДНК, и, соответственно, предстоящего снижения патентной активности по объекту.
Белковая инженерия. Технология используется со второй половины 80-х годов для удаления из антигенных пептидов сайтов расщепления протеазами, изменения конформации эпитопов, снижения токсичности антигенов (ЕР 0155146). Объектами патентования являются антигены [9]. Однако, как и при использовании химического синтеза генов, применение разработчиками белковой инженерии для создания новых технических решений свидетельствует о предстоящем снижении патентной активности по объекту.
Синтез линейных пептидов. Вакцины на основе синтетических линейных пептидов патентуются с начала 80-х годов. Освоение технологии пептидного синтеза позволяет организации осуществлять патентование синтетических аналогов протективных эпитопов, в том числе одновременно соответствующих нескольким природным антигенам. Низкая иммуногенность синтетических пептидов подталкивает разработчиков к совершенствованию способов их представления иммунной системе, например, путем включения в липосомы, образования конъюгатов и композиций с иммуномодуляторами, введения в их структуру участков, узнаваемых Т- и (или) В-лимфоцитами и др. [13,14].
Синтез пептидов с третичной структурой. Под данной технологией понимается конструирование пептидов с искусственно приданной конформацией (циклизация пептидов, соединение двух и более пептидов поперечными сшивками, синтез разветвленных пептидов и др.; US 4639371, US 4778784). Технология используется с первой половины 80-х годов для воспроизведения или имитирования сложных эпитопов [16]. Ее возможности исследованы недостаточно полно, однако анализ динамики патентования показывает, что появление патентов, защищающих антигенные полипептиды этого типа, также является сигналом возможного в ближайшем будущем отказа от получения синтетических вакцин против данного возбудителя и перехода к другим технологиям конструирования средств специфической профилактики.
ДНК-иммунизация. Способ основан на введении в макроорганизм плазмидной ДНК, способной экспрессировать гены антигенов. Как одна из технологий соматической генотерапии ДНК-иммунизация активно разрабатывается с начала 90-х годов ( WO 94/2197). Общим с традиционной иммунизацией живыми вакцинами является то, что развитие иммунного ответа происходит в ответ на синтезированные эндогенно антигенные белки, однако их экспрессия осуществляется в тканях (кожа, мышцы, селезенка и др.) иммунизированного объекта без развития инфекционного процесса. Теоретически, в рамках данной технологии, однократным введением плазмидной ДНК можно добиться пожизненной устойчивости к нескольким возбудителям инфекционных заболеваний [17]. Выход на данный уровень закономерен у организаций, использующих технологию рекомбинантной ДНК и работающих с векторами для эукариотических клеток.
Далее рассмотрим технологии, исключающие иммунный ответ из механизма защиты от возбудителя инфекционного заболевания.
Блокирование связывания возбудителя с рецепторами. Специфический защитный эффект достигается за счет экранирования лектиноподобным соединением специфического для возбудителя (токсина) рецептора на поверхности чувствительной клетки [18]. Конструирование препаратов идет по пути эмпирического подбора (синтеза) малотоксичных соединений (растительные гликозиды, В-субъединицы токсинов), обладающих большей, чем у возбудителя (токсина), или равной с ним константой связывания с рецептором [18,19].
Связывание возбудителя во внеклеточных жидкостях организма. Технология предполагает введение соединений, способных блокировать действие агента путем связывания с его консервативными структурами, участвующими в специфическом узнавании [20]. Для противодействия возбудителям, персистирование которых сопровождается феноменом антителозависимого усиления инфекции, специфически блокирующие соединения применяются как аналоги антител. По этой же причине их включают в мембраны липосом, а в сами липосомы — химиопрепарат ( WO 90/04414, ЕР 0385909, WO 91/04050). Другое направление патентования — создание производных таких соединений с увеличенным периодом полувыведения ( WO 90/ 08198, WO 91/00360). Параллельно патентуются нуклеотидные последовательности, кодирующие фрагменты белковых рецепторов, рекомбинантные плазмиды и векторные молекулы ДНК, включающие эти последовательности, штаммы-продуценты, способы получения плазмид и штаммов, способы очистки рецепторных белков и их производных.
Использование феномена интерференции. Феномен эмпирически обнаружен Л. Пастером и им же использован для блокирования инфекционного процесса, вызываемого возбудителем бешенства [21]. Специфическое профилактическое и лечебное действие достигается введением ослабленного вирусного штамма, конкурирующего с вирулентным за рецепторы клеток-мишеней. Блокирование инфекции достигается еще до образования антител. Интерес к патентованию разработок, созданных в рамках данной технологии, начал расти с конца 80-х годов из-за неудач, сопровождавших конструирование вакцин против ряда новых заболеваний.
Олигонуклеотидное и антисмысловое ингибирование генов возбудителя. Оба направления развиваются с конца 80-х годов [22,23]. Первоначально олигонуклеотиды патентовались как химиотерапевтические средства. Предполагалось, что будучи введенными в организм эти соединения проникнут в клетки и свяжутся с определенными структурами белков и нуклеиновых кислот (мРНК для антисмысловых олигонуклеотидов) возбудителей. Развитие технологий применительно к конкретному возбудителю шло по пути повышения устойчивости нуклеотидов к нуклеазам, а также расширения круга блокируемых структур и выбора тех из них, связывание с которыми наиболее эффективно блокирует развитие инфекционного процесса. Антисмысловые олигонуклетиды обнаруживали большую эффективность, чем олигомерные нуклеотиды той же длины [23]. Поэтому более поздние патенты защищают более эффективные олигонуклеотиды с охарактеризованной третичной структурой ( WO 94/08004). Однако с увеличением сложности таких структур их дальнейшее развитие затормозилось. Использование же антисмысловых последовательностей вышло на уровень соматической генотерапии. Этому предшествовали патенты на конъюгаты антисмысловых последовательностей с молекулами-лигандами, распознающими рецепторы на поверхности клеток-мишеней. Эффект рецепторного эндоцитоза активно использовался в патентуемых конструкциях, способных доставлять последовательности ДНК в цитоплазму определенных клеток и транскрибировать антисмысловую РНК уже там ( US 5324643). В настоящее время активно патентуются как конструкции, направленные против отдельных возбудителей (частные технические решения уже известных задач), так и способы внутриклеточной регуляции экспрессии генов антисмысловых нуклеиновых кислот.
Каталитическое расщепление мРНК отдельных белков. В целом патентование рибозимов [24] происходит с соблюдением тех же закономерностей, что отмечены для антисмысловых конструкций.
Специфическая репрессия генов возбудителя достигается внутриклеточной экспрессией генов регуляторных белков ( WO 93/23569, WO 94/01549). Направление развивается с конца 80-х годов в рамках технологии соматической генотерапии. Индукция экзогенных генов регуляторных белков, как правило, достигается продуктами генов, экспрессируемых возбудителем ( WO 93/05147).
Уничтожение инфицированных клеток специфическим цитотоксином. Различные конъюгаты лигандов (антител, белка С Д4, В-субъединиц отдельных токсинов и биологически активных веществ) и цитотоксинов, избирательно разрушающих инфицированные клетки [25], активно патентовались в конце 80-х годов ( WO 90/04414, ЕР 0385909, WO 91/ 04050). Однако позже интерес к правовой защите таких соединений снизился.
Уничтожение инфицированных клеток путем экспрессии экзогенного цитолитического гена. В заявленных технических решениях имеет место совмещение двух вышеописанных подходов. Индукция генов цитолитических белков (рицин А или тимидинкиназа вируса герпеса I типа), введенных в цитоплазму клеток, чувствительных к возбудителю инфекционного заболевания, достигается продуктами генов, экспрессирумых самим возбудителем [26].
Внутриклеточный лизис возбудителя заключается в цитоплазматическом лизисе возбудителя «по частям». В патентуемых в начале 90-х годов технических решениях «сборку» вириона блокируют синтезируемые внутриклеточно структуры, способные к лиганд-рецепторному (специфическому) взаимодействию с белками вируса. Эти же структуры направляют отдельные белки вируса в лизосомы ( WO 94/16672). В последующих технических решениях кроме блокирования сборки вириона решаются задачи разрушения (блокирования) мРНК, синтезированной на ДНК провируса [27].
Конструирование и клонирование трансгенов. В рамках обеих технологий реально достижение «идеального технического результата», т.е. создание индивидуума, обладающего наследуемой устойчивостью к возбудителю инфекционного заболевания (ЕР 0462215). Технологии могут стать единственно эффективными при катастрофическом инфицировании населения возбудителями ретровирусной и прионной природы.
Закономерности в появлении патентов показаны на рис. 2.
 Рис. 2. Закономерности в патентовании вакцинных препаратов.
Рис. 2. Закономерности в патентовании вакцинных препаратов.
Прекращение же патентования по объекту происходит в следующих случаях.
Достижение полной патентной защиты объекта. Применительно к вакцинам данная закономерность является отражением эмпирического подхода к выбору антигенов. Хронологически первыми патентуются целые клетки возбудителя или какого-то его наиболее иммуногенного штамма, затем антигенные белки, гликопротеины и другие полимерные структуры микроорганизма различной локализации, способные вызвать протективный иммунитет у макроорганизма. Например, для ряда вирусов имело место патентование вакцин на основе живых и убитых клеток, затем отдельных поверхностных белков и, наконец, более сложно поддающихся очистке и менее иммуногенных внутренних (матриксных) белков, а также их комбинаций с поверхностными. Патентование прекращалось после того, как были охарактеризованы и заявлены все эффективные антигенные структуры возбудителя и их сочетания.
Достижения максимального методического уровня патентуемых технических решений. Закономерность проявляется в последовательном привлечении к конструированию средств специфической профилактики методически более сложных подходов (химический синтез генов, белковая инженерия, синтез пептидов с третичной структурой, ДНК-иммунизация, олигонуклеотидное и антисмысловое ингибирование генов возбудителя и др.), что является результатом неверно выбранного принципа решения технической задачи. После исчерпания возможностей данных технологий патентование по объекту прекращается. Результатом усилий большого количества разработчиков чаще всего становится «идеальное техническое решение». Для вакцин — это антигенная структура, соответствующая наиболее распространенным на данный период времени представлениям о механизме иммунного ответа на возбудитель, но не обязательно эффективно защищающая от него.
Достижение предельной эффективности. Патентование по объекту прекращается или становится минимальным после создания технического решения, удовлетворяющего общественной потребности на данный момент времени. К таким решениям можно отнести живые чумную, сибиреязвенную, туляремийную, оспенную вакцины и ряд анатоксинов, разработанных в 20—40-х годах этого столетия [13]. Дальнейшее их совершенствование, решая отдельные частные задачи, например, снижение реактогенности, ухудшало другие потребительские свойства, такие как иммуногенность, низкая стоимость, длительный протективный эффект.
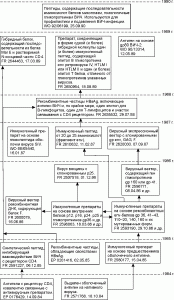
Первые две закономерности можно проследить с помощью эволюционной модели (рис. 3), отражающей деятельность Института Пастера (Франция) по разработке (патентованию) средств специфической профилактики ВИЧ-инфекции. Одновременно она позволяет выяснить причины утраты Институтом Пастера лидерства в разработках вакцин против ВИЧ.
Согласно этой модели, конструирование вакцин началось с выделения оболочечного антигена и получения на его основе химической вакцины ( FR 2571768, FR 2580177). С 1986 г. Институтом Пастера патентуются уже только генно-инженерные вакцины на основе оболочечных и внутренних белков, а также группоспецифического антигена. Большинство из выявленных патентных документов, заявленных в 1986 г. и после, защищали незначительные усовершенствования, имеющие целью уменьшение антигенного дрейфа и снижение побочных эффектов иммунизации. Разработка ВИЧ-вакцин сопровождалась появлением патентов с последовательно уменьшающимся объемом испрашиваемых прав (см., например, пионерские FR 2571768 и FR 2580177, но далее идут мелкие усовершенствования: FR 2610632, FR 2593190, FR 2620030, ЕР 0201416 и т.д.). Сопоставив эволюционную модель со схемой генома ВИЧ, нетрудно убедиться, что технические решения, запатентованные Институтом Пастера за период с 1984 по 1990 г., охватили практически все гены, кодирующие белки (их сочетания, отдельные фрагменты и точечные мутанты), обладающие способностью индуцировать иммунный ответ у макроорганизма. Для клонирования генов использовались практически все известные в первой половине 1980-х годов векторы. Аналогичные исследования параллельно выполнены Институтом Пастера с ВИЧ-2 и SIV . Своеобразным итогом проведенной работы стало создание в 1988 г. вакцинного препарата на основе рекомбинантного белка HBsAg , объединяющего несколько частных технических решений ( FR 2635532). Препарат представлял собой антиген, вызывающий выработку вируснейтрализующих антител, участки для распознавания антигена Т- и В-лимфоцитами и участок связывания с СД4 рецептором, т.е. «идеальный антиген». Предполагалось, что его использование способно блокировать как проникновение вируса через СД4 рецептор (по двум механизмам!), так и нейтрализовать вирус до его взаимодействия с чувствительными клетками. Однако через год конструирование ВИЧ-вакцин на основе заявленных ранее антигенов прекращается ( WO 92/06199).
Таким образом, конструирование вакцин против ВИЧ в Институте Пастера, пройдя через стадии, показанные на рис. 2, завершилось разработкой «идеального антигена». Приведенные данные показывают исчерпание возможностей технологий, используемых в институте для конструирования вакцин на основе структурных антигенов ВИЧ. Одновременно была достигнута полная патентная защита объекта, однако эффективного технического решения так и не было создано.
ПРОГНОЗИРОВАНИЕ ПРИНЦИПА ФУНКЦИОНИРОВАНИЯ И СТРУКТУРЫ ЭФФЕКТИВНЫХ ТЕХНИЧЕСКИХ РЕШЕНИЙ
Выбор принципа функционирования объекта. Выбранный принцип функционирования должен позволить создавать прогрессивные, рентабельные и длительно пользующиеся спросом на рынке средств специфической профилактики технические решения.
В табл.1, построенной по типу матрицы Р. Коллера [28], систематизированы принципы функционирования охраноспособных технических решений, используемые для создания средств специфической профилактики и лечения опасных инфекционных заболеваний. В вертикальных столбцах матрицы указаны виды входных воздействий на макроорганизм — типы персистирования возбудителя, критические для разработки таких средств. В горизонтальных — результирующие действия, обеспечивающие разработчику эффективное функционирование технического решения при данном исходном воздействии.
Таблица 1
Принципы функционирования охраноспособных технических решений, используемых для создания средств специфической профилактики и лечения опасных инфекционных заболеваний
| Исходное воздействие на макроорганизмы | Результирующее действие, которое необходимо обеспечивать для эффективного функционирования технического решения | ||
| Нейтрализация возбудителя во внеклеточных жидкостях организма | Торможение проникновения возбудителя в чувствительные клетки | Ингибирование внутриклеточного размножения возбудителя | |
|
1
|
2
|
3
|
|
| Персистирование в макроорганизме А | Связывание возбудителя с антителами. Связывание возбудителя с водорастворимыми рецепторами. Связывание возбудителя факторами местного иммунитета | Блокирование рецепторов узнавания. Использование феномена интерференции | Уничтожение инфицированных клеток с помощью факторов клеточного иммунитета |
| Персистирование, сопровождающееся феноменом антителозависимого усиления инфекции Б | Связывание возбудителя с водорастворимыми рецепторами | Блокирование рецепторов узнавания. Использование феномена интерференции | Уничтожение инфицированных клеток путем экспрессии экзогенного цитолитического гена. Олигонуклеотидное и ангисмысловое ингибирование генов возбудителя. Специфическая репрессия генов возбудителя. Уничтожение инфицированных клеток специфическим цитотоксином. Каталитическое расщепление мРНК отдельных генов. Внутриклеточный лизис возбудителя |
| Персистирование с сохранением провируса в геноме макроорганизма В | Клонирование линий животных, не содержащих провирус (уменьшение симптомов заболевания, см. Б, столбец 3) | ||
При создании средств специфической профилактики и лечения инфекций, вызываемых микроорганизмом, основными путями распространения которого в макроорганизме являются гематогенный и лимфогенный (а также при поражении биологическими токсинами), эффективным будет использование принципов функционирования технических решений, приведенных в строке А матрицы (см. табл. 1, для биологических токсинов — столбцы 1 и 2). Если разработчики ставят задачу нейтрализации возбудителя (токсина) до его взаимодействия с чувствительной клеткой, то выбор принципа осуществляется на пересечении строки А и столбца 1. Но этот выбор значительно меньше, если персистирование возбудителя сопровождается феноменом антителозависимого усиления инфекции (ВИЧ, возбудители лихорадки Дэнге и др.), — пересечение строки Б и столбца 1. Наличие патентов на так называемые ВИЧ-вакцины не должно вводить в заблуждение исследователя. Анализ описаний изобретений свидетельствует, что оптимизм разработчиков таких вакцин стимулировался получением высоких титров антител к белкам вируса у мышей и кроликов [29]. Однако исследования инфицированных людей во всех случаях позволяли проследить только историю сопротивления иммунной системы, но никогда — ее победу [30].
Для возбудителей, персистирующих при наличии в геноме макроорганизма провируса (ретровирусы), технические решения, способные нейтрализовать возбудитель в крови макроорганизма либо тормозить его проникновение в чувствительные клетки, практического значения не имеют, так как в основном они распространяются в результате межклеточного контакта.
Имеющиеся данные, к сожалению, свидетельствует о невозможности полной элиминации провируса из генома макроорганизма [31]. Поэтому, на пересечении строки В со столбцом 3 мы указываем гипотетическую для людей, но уже реальную для животных технологию — клонирование безвирусных (бесприонных) линий трансгенных животных.
Более подробно остановимся на выборе вариантов технических решений против возбудителей, в отношении которых не созданы эффективные вакцины.
Прогнозирование структуры эффективных технических решений. Представим в виде матрицы варианты технических решений, использованные для конструирования средств специфической профилактики инфекционных заболеваний (табл. 2). Сопоставим известные технические решения (вертикальные столбцы), выявим наиболее часто заполняемые клетки матрицы и те из них, которые остались пустыми (горизонтальные столбцы).
Из морфологической матрицы следует, что разработчики вакцин наибольшие надежды возлагают на функционально охарактеризованные пептиды, их субъединицы (поверхностные белки вирусов и бактерий, токсины), соответствующие иммуногенным эпитопам синтетические и генно-инженерные пептиды, а также на живые атгеннуированные штаммы возбудителей, в том числе полученные в результате генно-инженерных манипуляций. Для повышения иммуногенности включаемых в вакцины антигенов наиболее распространенными (за исключением уже ставшего традиционным сорбирования на минеральном носителе) стали: конъюгирование с носителем, клонирование в бактериальных и вирусных векторах, образование нековалентных комплексов антигена и носителя [9]. В тоже время такие относительно не новые подходы к повышению иммуногенности антигенов, как включение в многофазные системы и образование комплексов «антиген—антитело» ( US 4847080, ЕР 0243913), не нашли широкого применения. Анализ динамики патентования свидетельствует о прекращении в конце 90-х годов разработок новых технических решений в рамках данных технологий. Это является косвенным указанием на их неэффективность. Анализ структуры патентных документов показывает, что такие подходы, как «добавление в композицию лимфокинов» и «включение структур, избирательно взаимодействующих с иммунокомпетентными клетками», в начале 90-х годов утратили свое самостоятельное значение, превратившись в частные приемы конструирования генно-инженерных вакцин, когда гены лимфокинов клонируются либо в ослабленный штамм ( WO 88/00971), используемый для иммунизации, либо вместе с геном антигена в вакцинообразующий вектор (например, в вирус вакцины; WO 92/12240). Сами же антигены конструируются таким образом, чтобы иметь участки узнавания Т- и В-лимфоцитами («идеальный антиген» [32]). То же самое произошло и с полимерными композициями. В конце 80-х годов их уже не рассматривают только как «антигенное депо», но продукты деградации полимеров используют в качестве иммуностимуляторов ( WO 87/06129, WO 88/02262). С этой же целью в их состав включают лимфокины ( WO 88/02262). Но одновременно возрастает сложность композиций, увеличивается число соединений, входящих в состав композиций, возрастает количество классов соединений различной природы, что делает их патентную защиту неустойчивой. Анализ взаимосвязей технических решений, используемых при конструировании вакцинных препаратов (рис. 4), свидетельствует о том, что интерес к различным иммуномодулирующим композициям (как и к другим «неживым» вакцинам) не будет продолжительным. Принципиальным ограничением является неспособность таких вакцин эффективно индуцировать СД 8+ цитотоксические лимфоциты, т.е. клеточное звено иммунитета [13,17].
Теперь сопоставим «горизонтальные столбцы» матрицы (см. табл. 2). Обращает внимание исчерпание альтернатив развития по вакцинам против СПИДа, гепатита В, ящура, коклюша, бешенства, чумы, сибирской язвы, гемофилеза. Одновременно наблюдается переход к отдельным технологиям соматической генотерапии (ДНК-иммунизация в профилактике СПИДа, гепатита В, гриппа, ящура, бешенства, гемофилеза, коклюша). В то же время при конструировании вакцин против некоторых других возбудителей инфекционных заболеваний (сапа, мелиоидоза, геморрагических лихорадок) было использовано относительно мало современных технических решений.
Чтобы исключить многовариантность при создании эффективных технических решений, будем исходить из следующих минимальных требований:
1) антиген должен индуцировать видоспецифический иммунитет — это позволяет функционировать техническому решению в природном очаге инфекционного заболевания при антигенном дрейфе у возбудителя, либо при появлении его редких серотипов [13];
2) в иммунном ответе должно преобладать клеточное звено, так как именно оно наиболее эффективно при профилактике заболеваний, вызываемых грамотрицательными микроорганизмами и вирусами. Кроме того, особенностью клеточного иммунитета является то, что ответ происходит на многие эпитопы одного и того же возбудителя. Это позволяет защищаться от возбудителей, которым свойственна антигенная изменчивость [13,17];
3) иммунизация должна предотвращать аэрогенное инфицирование как наиболее опасное из возможных механизмов распространения возбудителей инфекционных заболеваний среди людей и домашних животных, и при применении их как агентов биологического оружия [13,33].
Таблица 2
Морфологическая матрица вариантов технических решений, использованных в 80–90-е годы при конструировании средств специфической профилактики инфекционных заболеваний
| Возбудитель | Традиционные вакцины | ДНК-вакцины | Технологии соматической генотерапии, исключающие иммунный ответ макроорганизма на введение антигена | ||||||||||||||||||||||||
| Типы антигенов | Повышение иммуногенности антигена путем | ||||||||||||||||||||||||||
| Функционально охарактеризованные пептиды и их субьединицы | Живые штаммы, в том числе рекомбинантные | Убитые штаммы | клонирования в вирусных векторах | коньюгирования с носителем | образования нековалентного комплекса с носителем | включения в поверхностные структуры бактерий | добавления в композицию лимфокинов | имитирования конформации природных антигенов | включения в многофазную систему типа «липосома» | включения в полимерные композиции | включения структур, избирательно взаимодействующих с иммунокометентными клетками | включения в многофазную систему типа «масло—вода», «вода—масло» | |||||||||||||||
| СПИДа* | + | + | + | + | + | + | + | + | + | + | + | + | - | + | + | ||||||||||||
| гриппа | + | + | + | + | + | + | + | + | + | + | + | + | - | + | - | ||||||||||||
| гепатита В | + | - | - | + | + | + | + | + | + | + | + | + | - | + | + | ||||||||||||
| ящура | + | + | + | + | + | + | + | + | + | - | - | - | + | + | - | ||||||||||||
| коклюша | + | + | + | - | + | + | + | - | - | + | - | - | - | + | - | ||||||||||||
| бешенства | + | + | + | + | + | + | - | + | + | - | - | + | - | + | - | ||||||||||||
| чумы | + | + | + | - | + | + | + | + | - | + | - | - | - | - | - | ||||||||||||
| сибирской язвы | + | + | + | + | + | + | + | + | - | + | - | - | - | - | - | ||||||||||||
| гемофилеза | + | + | + | - | + | + | + | - | + | - | - | - | - | + | - | ||||||||||||
| синегнойной инфекции | + | + | + | - | + | - | + | - | - | - | - | - | - | - | - | ||||||||||||
| столбняка | + | - | - | + | + | + | + | - | - | - | + | - | - | - | - | ||||||||||||
| мелиоидоза | + | + | + | - | + | - | - | - | - | - | - | - | - | - | - | ||||||||||||
| сапа | + | + | + | - | - | - | - | + | - | - | - | - | - | - | - | ||||||||||||
| лихорадки Денге* | + | + | + | + | - | - | - | - | - | - | - | - | - | - | - | ||||||||||||
| ВЭЛ | - | + | + | + | - | - | - | - | - | - | - | - | - | - | - | ||||||||||||
| болезни легионеров* | + | + | + | - | - | - | - | - | - | - | - | - | - | - | - | ||||||||||||
| Ку-лихорадки | + | - | - | + | - | - | - | - | - | + | - | - | - | - | - | ||||||||||||
| лихорадки Эбола* | - | - | + | + | - | - | - | - | - | - | + | - | - | - | - | ||||||||||||
| желтой лихорадки | + | + | - | + | - | - | - | - | - | - | - | - | - | - | - | ||||||||||||
| лихорадки Ласса* | + | - | + | + | - | - | - | - | - | - | - | - | - | - | - | ||||||||||||
| лихорадки Хантаан* | + | + | - | - | + | - | - | - | - | - | - | - | - | - | - | ||||||||||||
| туляремии | + | + | - | - | - | - | - | - | - | - | - | - | - | - | - | ||||||||||||
| лихорадки Марбург | - | - | + | + | - | - | - | - | - | - | - | - | - | - | - | ||||||||||||
| лихорадки долины Рифт* | + | + | - | + | - | - | - | - | - | - | - | - | - | - | - | ||||||||||||
Примечание: * — эффективные средства специфической профилактики не созданы.
Рис. 3. Эволюционная модель конструирования вакцин против ВИЧ в институте Пастера.
Анализ научной литературы свидетельствует о том, что видоспецифический иммунитет могут индуцировать порообразующие белки, производные липида А грамотрицательных бактерий, а также белки слияния и внутренние (матриксные) белки вирусов [14,15]. Индуцирование клеточного иммунитета макроорганизма наиболее эффективно происходит в ответ на введение тех же порообразующих белков, белков слияния вирусов, живых вакцин, вакцин на основе вирусных и бактериальных векторов и ДНК-вакцин [14,17]. Защита от аэрогенного инфицирования показана на экспериментальных животных, иммунизированных поринами, живыми вакцинами на основе бактериальных и вирусных векторов, а также ДНК-вакцинами [14,15], т.е., как это ни парадоксально, выбор антигенов для вакцин ограничен отдельными поверхностными белками микроорганизмов и матриксными белками вирусов, сами же вакцины должны представлять собой либо живые организмы, либо их имитаторы (ДНК-вакцины). Внутренние закономерности конструирования вакцин против грамотрицательных микроорганизмов приведены на рис. 5. Банк нежелательных эффектов, возникающих в ходе конструирования вакцинных препаратов приведен в табл. 3.
Таблица 3
Банк нежелательных эффектов, возникающих в ходе конструирования вакцинных препаратов
| Решение | Нежелательный эффект | Устранение нежелательного эффекта* | ||
| 1. «Живые» вакцины | Реверсия к патогенным формам. Ограниченный период жизни живого компонента. Контаминация посторонними патогенами. Возможность развития инфекционного процесса у младенцев и иммунодефицитных больных | Инактивация живого компонента (2). Использование бактериальных экспозиционных векторов (13). ДНК-иммунизация (16) | ||
| 2. Инактивированные вакцины (убитые клетки, отдельные антигены их субъединицы) | Малая эффективность индуцирования клеточного звена иммунитета | Длительная и эффективная презентация антигенов клеткам иммунной системы (3–16) | ||
| 3. Соединение антигена и иммунитетстимулирующего носителя ковалентной связью | Повышение реактогенности ответа на носитель | Уменьшение молекулярной массы антигена. Уменьшение молекулярной массы носителя. Использование носителя, не вызывающего иммунный ответ у макроорганизма. Исключение носителя и увеличение антигенной плотности эпитопов малоиммуногенных пептидов другим способом (14) | ||
| Индуцирование иммунного ответа на носитель | Конъюгирование антигена с небелковыми носителями, способными к гидрофобному взаимодействию с клетками иммунной системы | |||
| Наличие в конъюгатах токсических компонентов | Замена способов, использующих восстановительное аминирование | |||
| 4. Включение антигена в иском | Малая иммуногенность комплекса | Увеличение размера комплекса до 35 нм за счет включения холестерола и фосфолипидов | ||
| Токсичность комплекса | Очистка входящих в состав комплекса тритерпеновых гликозидов. Включение в комплекс липидов (5) | |||
| 5. Включение антигена в липидный комплекс | Низкая иммуногенность | Замена липидов с алифатическими жирными кислотами на липиды, содержащие длинные алкильные цепи | ||
| 6. Включение антигена в состав многофазной системы «вода—масло» или «масло—вода» | Низкая иммуногенность | Создание капель достаточно мелкого размера (менее 1 мкм), позволяющего макрофагам активно усваивать композицию в целом. Включение в качестве ПАВ иммунопотенциаторов. Стабилизация многофазной системы. Включение в композицию лимфокинов (8) | ||
| Токсичность | Замена неметаболизируемого (минерального) масла метаболизируемым (соевым и арахисовым маслами, скваленом и др.). Замена клеток микобактерий сложными соединениями, например, пептидогликаном стафилококков и др. | |||
| 7. Включение антигена в многофазную систему типа «липосома» | Низкая иммуногенность | Представление антигена на наружной поверхности липосомы Включение в липосому компонентов, распознаваемых Т-хэлпер лимфоцитами или цитотоксическими Т-лимфоцитами (9). Активация деления и дифференциации лимфоцитов В- и Т-субпопуляций в месте введения вакцины, включение в состав липосомы лимфокинов (8) | ||
| 8. Включение в состав вакцин лимфокинов | Низкая иммуногенность | Стабилизация лимфокина в вакцинной композиции. Получение слитых генов лимфокинов и иммуногенных белков. Подбор (конструирование) лимфокина с определенными свойствами | ||
| Токсичность | Комбинированное введение лимфокинов с другими иммуностимуляторами в меньших дозах. Адресная доставка лимфокинов, например, в составе липосомы. Медленное высвобождение лимфокина из вакцинной композиции (11) | |||
| 9. Включение в состав вакцинных препаратов структур, избирательно взаимодействующих с иммунокомпетентными клетками | Низкая иммуногенность | Конъюгирование антигена со структурами, способными избирательно связываться с рецепторами на поверхности определенных иммунокомпетентных клеток (тафтсин, LFA -3 и др.) | ||
| 1О. Включение генов иммуногенных детерминант в состав вирусных векторов, способных к персистированию в макроорганизме | Отсутствие инфекционности у очищенной вирусной ДНК | Конструирование рекомбинантных плазмид, обеспечивающих интеграцию чужеродного генетического материала в геном вируса и др. Совершенствование способов получения рекомбинангного потомства. Переход к ДНК-вакцинам (15) | ||
| Развитие инфекционного процесса у ослабленных и иммунодефицитных больных | Конструирование экспрессирующих векторов с низкой способностью к репликации. Переход к бактериальным экспозиционным векторам (13). Переход ff ДНК-вакцинам (16). Переход к вакцинам, представляющим собой полимерные композиции (11) | |||
| Антигенная конкуренция между вектором и антигеном | Усиление экспрессии антигена. Переход к ДНК-вакцинам (16). Переход к вакцинам, представляющим собой полимерные композиции (11) | |||
| Развитие осложнений после иммунизации | Получение вирусов, обладающих повышенной чувствительностью к интерферону. Клонирование в геном вакцинообразующего вектора генов лимфокинов | |||
| Низкая иммуногенность | Использование вакцинообразующих векторов, активно размножающихся в данном организме. Эффективная экспрессия гетерологичных генов без существенной репликации и персистирования вектора в макроорганизме (16) | |||
| 11 .Включение антигенов в состав полимерной композиции | Низкая иммуногенность | Использование полимеров, удлиняющих период высвобождения антигенов из таких композиций. Использование в качестве полимеров соединений, продукты распада которых являются иммуностимуляторами. Включение в полимерные композиции: лимфокинов(8); антигенов, соединенных с иммуностимулирующим носителем ковалентной связью (3); антигенов в составе «искома» или липидного комплекса (4, 5); антигенов, включенных в многофазные системы (17); антигенов, кояъюгированных с антителами (12). Переход к ДНК-вакцинам (16) | ||
| 12. Использование комплексов «антиген—антитело» | Низкая иммуногенность | Повышение избирательности моноАТ, взаимодействующих с иммунокомпетентными клетками. Использование антител для получения иммуносорбента, который затем используется как адъювант, способный формировать антигенное депо | ||
| 13. Включение антигенных белков в поверхностные структуры бактерий | Низкая иммуногенность | Исключение внутриклеточной экспрессии антигена. Включение антигенов в белки, образующие петлеобразные ' структуры на поверхности бактериальной клетки (белок LamB E . coli и др.). Синтез антигенов в составе фимбрий, липопротеинового сигнального полипептида и др. систем, позволяющих извлекать антигенный белок в составе внеклеточных структур, способных к гидрофобному взаимодействию с иммунокомпетентными клетками | ||
| Антигенная конкуренция между вектором и антигеном | Усиление экспрессии гена антигена. Переход к вакцинам, включающим полимерные композиции (11). Переход к ДНК-вакцинам (16) | |||
| 14. Имитация конформации природных антигенов | Низкая иммуногенность | Для пептидов, не содержащих сложных конформационных эпитопов — полимеризация по принципу «голова к хвосту» или путем образования межмолекулярных дисульфидных связей между остатками цистеина. Создание сложных конформационных эпитопов — циклизация белковых субъединиц и использование морфогенетической сборки (структур типа «псевдовирус», «виросома» и др.). Сорбирование (конъюгирование) на (с) микросферических (кими) носителях (ми) | ||
| 15. Включение антигена в гели гидроокиси алюминия | Невозможность индукции клеточного звена иммунитета | Презентация антигена клеткам иммунной системы другими способами (10, 13,16) | ||
| 16. ДНК-иммунизация | Низкая иммуногенность | Усиление и продление экспрессии гена антигена. Введение вместе с плазмидной ДНК лимфокинов. Внутрикожное введение ДНК-вакцины | ||
| Развитие осложнений после иммунизации | Не использовать ДНК-иммунизацию, если человек ранее был иммунизирован данным антигеном любым другим способом | |||
| 17. Вирусные антигены | Низкая иммуногенность | Длительная и эффективная презентация антигена клеткам иммунной системы (3–16) | ||
| 18. Поверхностные (оболочечные) вирусные белки | Токсичность | Клонирование (синтез) отдельных антигенных эпитопов (см. «узкий защитный спектр» и «антигенный дрейф») | ||
| Узкий защитный спектр | Клонирование (синтез) консервативных антигенов (внутренние антигены) и консервативных эпигонов поверхностных антигенов. Получение иммуногенов, включающих комбинации консервативных эпигонов (антигенов). | |||
| Антигенный дрейф | Включение в иммуноген эпитопов внутренних структурных белков вируса, а также пептидов, кодируемых регуляторными генами | |||
| 19. О-антигены бактерий | Низкая иммуногенность | Конъюгирование с носителем (3) | ||
| Токсичность | Удаление примесей липида А | |||
| Штаммоспецифичностъ иммунного ответа |
|
|||
| Слабая защита при аэрогенном инфицировании | Переход к другим антигенам (24) | |||
| 20. Капсульный полисахарид бактерий | Т-независимость иммунного ответа | Использование у детей до 2 лет конъюгатов полисахаридов с носителями (3) | ||
| Штаммоспецифичность иммунного ответа | Создание поливалентных вакцин (21). Переход к другим антигенам (23, 24) | |||
| Слабая защита при аэрогенном инфицировании | Переход к другим антигенам (24) | |||
| 21. Поливалентные конъюгаты полисахаридов капсулы и О-антигена | Высокая реактогенность | Переход к другим антигенам (24) | ||
| 22. Жгутиковые (фимбриальные) антигены бактерий | Штаммоспецифичность иммунного ответа | Переход к другим антигенам (23, 24) | ||
| Слабая защита при аэрогенном инфицировании | Переход к другим антигенам (24). | |||
| Неустойчивость конформационных эпитопов к факторам внешней среды | Переход к другим антигенам (19, 20,23,24) | |||
| 23. Липид А | Токсичность | Получение менее токсичных аналогов. Включение в состав композиций, медленно высвобождающих антигенное вещество | ||
| Низкая иммуногенность | Конъюгирование с носителем (3) | |||
| Слабая защита при аэрогенном инфицировании | Переход к другим антигенам (24) | |||
| 24. Пориновые белки | Образование отека в месте введения порина |
|
||
| 25. Анатоксины | Узкий защитный спектр | Переход к другим антигенам (23, 24). Использование комбинаций анатоксинов | ||
| Токсичность препаратов | Удаление примесей эндотоксина, попадающих в препарат из культуральной жидкости | |||
| Восстановление активности токсина в процессе хранения | Замена токсина, инактивированного формальдегидом, генно-инженерными детоксицированными производными его субъединиц | |||
| Низкая иммуногенность | Длительная и эффективная презентация антигена клеткам иммунной системы (3–16) | |||
| 26. Антигенные комплексы на основе слизи | Токсичность | Переход к другим антигенам (24) | ||
| Штаммоспецифичность иммунного ответа | Переход к другим антигенам (24) |
Здесь и далее в скобках указан порядковый номер решения (см. левые столбцы)
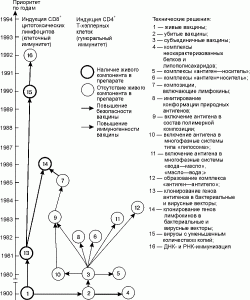 Рис. 4. Взаимосвязь патентуемых технических решений при конструировании вакцинных препаратов.
Рис. 4. Взаимосвязь патентуемых технических решений при конструировании вакцинных препаратов.
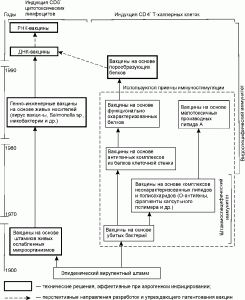 Рис. 5. Внутренние закономерности конструирования вакцин против грамотрицательных микроорганизмов.
Рис. 5. Внутренние закономерности конструирования вакцин против грамотрицательных микроорганизмов.
Если персистирование возбудителя инфекционного заболевания сопровождается антителозависимым усилением инфекции (отдельные возбудители геморрагических лихорадок), то нецелесообразно патентование технических решений, использующих данный принцип функционирования. В этом десятилетии сложились два внешне не связанные между собой направления противодействия таким инфекциям (рис. 6). Одно предполагает создание популяций, устойчивых к возбудителю, например, включающих трансгенные особи, не содержащие в клетках-мишенях рецепторы, узнаваемые микроорганизмом. Другое — исключение возбудителя из популяции путем подавления его репликации, а следовательно, и его передачи. Видимо, в дальнейшем оба направления пересекутся, например, при трансплантациях клеток, тканей и органов от устойчивых к возбудителю трансгенных особей к природным. Рис. 6 также показывает, что в конце 90-х годах произошло уменьшение количества альтернативных направлений, позволяющих добиться блокирования репликации возбудителя в рамках технологии соматической генотерапии.
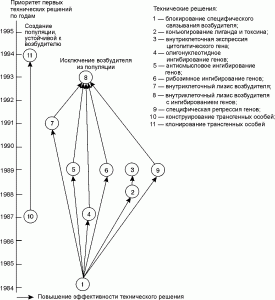 Рис. 6. Взаимосвязь патентуемых технических решений, исключающих иммунный ответ из механизма защиты от возбдителя инфекционной болезни.
Рис. 6. Взаимосвязь патентуемых технических решений, исключающих иммунный ответ из механизма защиты от возбдителя инфекционной болезни.
Следует также отметить, что эффективность большинства технических решений, созданных в её рамках, показана только в системах in vitro . Тем не менее, можно сформулировать несколько требований к структуре конструкций, позволяющих осуществлять внутриклеточное ингибирование репликации возбудителя:
1) для проникновения в соматическую клетку они должны использовать высокоспецифический механизм рецепторного эндоцитоза;
2) блокирование репликации возбудителя должно основываться на высокоспецифическом узнавании его консервативных структур биологическими макромолекулами, синтезированными внутриклеточно (регуляторные пептиды, рибозимы, антисмысловые РНК и др.);
3) индукцию синтеза таких биологических макромолекул целесообразно осуществлять продуктами генов возбудителя.
ПАТЕНТНАЯ ПОЛИТИКА БИОТЕХНОЛОГИЧЕСКОЙ ОРГАНИЗАЦИИ
При патентовании изобретений необходимо учитывать, что получение патентов не является самоцелью. Патенты обладают двойственной природой. Они не только предоставляют патентовладельцу право на исключительное использование своего изобретения, но одновременно позволяют целенаправленно осуществлять патентные санкции в отношении аналогичных разработок других лиц, даже если те были созданы ими совершенно самостоятельно. При умелом составлении формулы изобретения объем патента может оказаться настолько большим, что под санкции попадут даже исследования фундаментального характера, как это и произошло в США с исследованиями по генетике хлопка после выдачи патента калифорнийской фирме Monsanto [7].
Наиболее уязвимой в отношении патентных санкций является продукция на этапе сбыта [1]. Поэтому появление патентов не носит случайный характер. Посредством их патентообладатель преследует определенные цели. В результате — конкурентная борьба приобретает «цивилизованные формы» патентной политики.
Характер патентной политики биотехнологической организации будет определяться двумя основными моментами [11]: во-первых , патентная защита может быть наступательной , предвосхищая возможные изменения на рынке потребителей, обеспечивая наиболее близкую к оптимальной защиту выпускаемой или предполагаемой к выпуску биотехнологической продукции; во-вторых , проводится в предвидении ожидаемых претензий со стороны более сильных конкурентов, т.е. иметь оборонительный характер.
Основные приемы, которые может использовать биотехнологическая организация для осуществления патентной политики, приведены табл. 4
Таблица 4
Основные приемы, используемые при осуществлении патентной политики
| Наступательная патентная защита | Оборонительная патентная защита |
| Получение блоков патентов, препятствующих проникновению конкурентов в соответствующую область биотехнологии | Заявки на несуществующие и только намечаемые в общих чертах решения по направлениям деятельности технологически более сильных конкурентов (заявки-ловушки) |
| Обвальное патентование по всем направлениям деятельности соперничающей фирмы | Расширительное толкование сферы действия охранного документа с помощью теории эквивалентов |
| Затяжные судебные процессы по патентам конкурентов | Селективные патенты на отдельные соединения «рода» |
| Получение патентов на «род» веществ | Новое применение известного вещества |
| Получение патентов на препараты, эффект которых основан на новом, ранее неизученном механизме действия | Патенты на пролонгированные формы известных препаратов |
| Сочетание в одной формуле притязаний на различные объекты | Патентование препаратов, которые могут быть использованы в удобной и безболезненной форме |
| Систематическое патентование каждого последующего усовершенствования охраняемого объекта | Патенты на технические решения, устраняющие побочные эффекты известных препаратов |
| Принудительное лицензирование под предлогом злоупотребления патентной монополией |
Следует также отметить, что патентуемые объекты неравноценны с точки зрения их «хозяйственной независимости», т.е. возможности использования описанного в патенте изобретения без согласия обладателей других патентов. Существует определенная иерархия патентов [2,3]. На первом месте патенты на химические соединения. Применительно к исследуемым объектам это заявленные как вещества с установленной структурой (т.е. с указанной нуклеотидной последовательностью для ДНК и аминокислотной для белков) гены антигенов (либо сами антигены), лектиноподобных соединений, рибозимов, антисмысловых РНК и др. Такие патенты контролируют возможное использование технического решения; производные от защищенного основного изобретения; другие способы изготовления запатентованного соединения и новые области его применения; новые составы, включающие запатентованное соединение в качестве возможного ингредиента. На втором — патенты на известные соединения и известные смеси веществ, впервые предложенные для лечения и профилактики инфекционных заболеваний (например, производные В-субъединицы экзотоксина А для непосредственного лечения синегнойного сепсиса; ЕР 0261671), а также патенты на композиции (например, комбинированная сибиреязвенная вакцина, содержащая споры сибиреязвенного микроба и протективный антиген; российская заявка 5060604). Способы получения профилактических препаратов занимают самое последнее место (третье) в данной «табели о рангах» из-за невозможности контроля их использования.
Тащим образом, характер и стратегия патентной политики биотехнологической организации при разработке средств специфической профилактики инфекционных заболеваний, могут быть определены исходя из освоенных ею и конкурирующими организациями технологий, тех пределов, рамками которых ограничено развитие каждой технологии, закономерностей в патентовании отдельных объектов и особенностей возбудителей.
ЛИТЕРАТУРА
1. Карпова И.М. Экспортный контроль и патентно-лицензионная политика ведущих капиталистических стран. — М.,1991.
2. Фогель А.Л. Патентная охрана фармацевтических изобретений в капиталистических странах. — М., 1988.
3. Мамиофа И.З. Правовая охрана изобретений в капиталистических и развивающихся странах. — М., 1986.
4 . Гурьянов П.П., Сольц Л.О., Фурман Э.И. Теория эквивалентов и ее использование при толковании формулы изобретения. — М, 1971.
5. Свядосц Ю.И. Буржуазное патентное право. — М., 1967.
6. Гришаев С.П. Правовая охрана изобретений, промышленных образцов, полезных моделей в России и за рубежом. — М., 1993.
7 . Ducur, P. //Nature. — 1997 — V. 387. — N 6628. — Р .13–14,
8. Рыбальский Н.Т., Шевелев Н.П. Объекты биологии и биотехнологии. Методические рекомендации по правовой охране. — М., 1990.
9. Рыбальский Н.Г. Идентификационные модели биологических объектов и разработка эффективных подходов к защите биотехнологических изобретений: Дис д-ра биол. наук. — М., 1990.
10. Методические рекомендации по проведению патентных исследований. — М., 1986.
11. Дауранов Р.Б. Патентная служба и формирование патентной политики организации // Вопросы изобретательства.— 1989. — № 11. — С. 52–55.
12. Александров Л.В., Шепелев Н.П. Системный анализ при создании и освоении объектов техники. — М., 1992.
13. Вакцинопрофилактика: Справочник для врачей / Таточенко В.Н., Озерцковский Н.А., Соколова А.Ф. и др. /Под ред. B .К. Таточенко, Н.А. Озерцковского. — М.,1994.
14. Иванов БЛ., Петров А.Б. Повышение иммуногенности пептидных вакцин: Актуальные проблемы создания и применения иммунобиологических препаратов для диагностики и профилактики инфекционных болезней. — Пермь, 1993. — Т.1. — С. 35–53.
15. Супотницкий М.В. // Вестник Российской Академии медицинских наук. — 1996. — № 8. — С. 18–22.
16. Заявка 2178041,18.03.83, GB , МКИ С07К 3/00. Antigenic modifficacion of peptides /Ohio State University ( США ).
17 . Hassett, D.E., Whitton , J.T. DNA immunization / Trends Mikrobiol. — 1996. — V.4 — № 9 P. 307–312.
18. Fu, H., Shen, W., Collier, Я .J. Vaccines 93: Mod. Approaches New Vaccined Includ. Prev. AIDS. — N.Y.,1993. — P.379–383.
19. Singh, Y., Chaudhary. V.K., Leppla, S.H. // J. Biol. Chem. — 1989. — V. 264. — № 32. — P. 19103 – 19107.
20. Angstrom, J., Neneberg, S., Karlsson, K. // Proc. Natl. Acad. Sci. US. — 1994. — V. 91. — № 25. — P. 11859 – 11863.
21. Романова Л.И. Препараты для экстренной вакцинопрофилактики и диагностики бешенства: Актуальные проблемы создания и применения иммунобиологических препаратов для диагностики и профилактики инфекционных болезней. — Пермь, 1993. — Т.2. — С. 90 – 106.
22. Agrawal, I., Sun, D., Sarin, P. et al . // J. Cell. Biochim. — 1990.— Suppl. 14D. — P. 145.
23. Scrakiel, G., Pawitta, M., Kleinheinz, A. et al // BGA — Schriften. — 1990. — № 1. — P. 263 – 264.
24. Заявка 89/05852, 10.11.87, PCT , МКИ C 12 N 9/22. Ribozimes / Commonwealth Sci. and Industrial Res. Organisation (Австралия).
25. Заявка 90/04414, 18.10.88. PCT, A61K 39/395. Conjugatesof soluble T4 proteins and toxins / Biogen Inc. ( США ).
26. Vencates, L.K., Arens, M.Q., Subramanian, T. et al . // Proc. Nafl. Acad Sci. US. — 1990. — V. 87. — № 22. — P. 8746 – 8750.
27. Заявка 93/06216,26.09.91. PCT. МКИ C12N 15/12. Fusionproteins targeted to lisosomes, for treatment of AIDS /Medical Res. Found (США).
28. Половинкин А.И . Основы инженерного творчества. — М., 1988
29. Супотницкий М.В. // Российский химический журнал.— 1996. — Т. XL .— № 2. — С. 141–156.
30. Цыганков А.Ю. // Новости науки и техники, серия Биотехнология. — 1989. — Вып. 9. — С. 31–35.
31. Медников Б.М. Лечение СПИДа: проблемы и перспективы // Природа. — 1990. — № 4. — С. 18–23.
32. Заявка 2635532,29.07.88, FR , МКИ C 12 N 15/51. Particular HBsAg recombinantes hybrides / lost Pasteur ( Франция ).
33. Жданов В.М. Эпидемиология. — M .: Медгиз, 1961.
Супотницкий М.В. Эффективное патентование средств специфической профилактики инфекционных заболеваний // Биотехнология. - 1997. - № 9-10. - С. 56-79.

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 1997, патентная политика