Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. 4.1. Пандемические и эпидемические процессы, вызываемые паразитами, использующими стратегию первого типа
4. ПАНДЕМИЧЕСКИЕ И ЭПИДЕМИЧЕСКИЕ ПРОЦЕССЫ
Микроорганизмы-паразиты, использующие принципиально различные стратегии по отношению к иммунным ответам своих хозяев, должны вызывать у них не только принципиально различные инфекционные процессы (см. гл. 3), но и принципиально различные пандемические и эпидемические (эпизоотические) процессы среди их популяций. Однако если мы попытаемся описать такие процессы в рамках сложившихся в ХХ в. определений, то столкнемся с тем, что имеющиеся определения односторонни. Например, по Б. Л. Черкасскому (2001) «эпидемический процесс — это процесс возникновения и прекращения среди населения специфических инфекционных состояний». Данная формулировка предполагает существование эпидемий одного типа — развивающихся как циклический монопроцесс. К тому же понятия «возникновение», «прекращение» и др. основываются на масштабе времени, воспринимаемом человеком в повседневной жизни.
4.1. Пандемические и эпидемические процессы, вызываемые паразитами, использующими стратегию первого типа
«Цикличность» пандемических (эпидемических) процессов, вызываемых паразитами, использующими стратегию первого типа, предопределяется по меньшей мере цикличностью активизации природных очагов возбудителя инфекционной болезни и цикличностью самого инфекционного процесса.
4.1.1. Терминология
К определению терминов «природный очаг» и «природный резервуар» возбудителей инфекционных болезней. Типы первичных природных резервуаров. Первичный природный очаг возбудителя инфекционной болезни. Вторичный природный очаг возбудителя инфекционной болезни. Общие свойства вторичных природных резервуаров возбудителей опасных инфекционных болезней.
Термины «природный очаг», «природный резервуар», «возбудитель инфекционной болезни» носят искусственный, сугубо антропоцентрический характер, так как рассматривают поддержание в природе тех или иных видов микроорганизмов исключительно с точки зрения причинения ими вреда (т. е. болезни) человеку. Микроорганизмы и экосистемы, в которых они существуют, появились задолго до появления человека, поэтому мы должны понимать естественно-научную ограниченность этих терминов.
К определению терминов «природный очаг» и «природный резервуар» возбудителей инфекционных болезней. Имеются разные определения того, что понимать под природным очагом возбудителя инфекционной болезни. Например, М. Г. Таршис и Б. Л. Черкасский (1997) таким очагом считают наименьшую часть одного или нескольких географических ландшафтов, где циркуляция возбудителя между животными способна осуществляться неопределенно долго без необходимости заноса его извне. Данное определение относится только к зоонозам. Оно не отражает знаний по экологии возбудителей опасных инфекционных болезней людей и животных, накопленных за последние 20 лет (см. разд. 2.1). К тому же оно не подходит для описания механизмов поддержания в человеческом обществе антропонозов и проникновения в него сапронозов. Поэтому в 1998 г. В. Ю. Литвиным с соавт. было предложено другое определение: природный очаг — это естественные экосистемы, включающие популяцию возбудителя инфекционной болезни. На мой взгляд, формулировка неудачна из-за отсутствия в ней привязки экосистемы к какому-то ландшафту или территории, она все-таки ближе к определению природного резервуара.
Термин «природный очаг» отражает частный случай взаимодействия на конкретной территории (ландшафте) определенных животных и их эктопаразитов с природным резервуаром, в результате которого они становятся носителями микроорганизма, поддерживаемого в этом резервуаре. Как же отличить «природный очаг» от «природного резервуара»? Ответ на этот вопрос можно получить, исключая промежуточные резервуары из цепочек распространения возбудителя (трофических, эпидемических, эпизоотических) инфекционной болезни на данной территории, до видов, без которых его существование станет невозможно, т. е. до конкретных видов простейших. Их совокупность, минимально необходимую для поддержания микроорганизма, целесообразно считать «первичным природным резервуаром» (см. разд. 2.1). Для описания эпидемических (эпизоотических) процессов, учитывающих сапронозный механизм поддержания возбудителей опасных инфекционных болезней, необходимо ввести ряд новых взаимосвязанных терминов.
Реликтовый очаг опасной инфекционной болезни — территория, неопределенно долго включающая природный очаг возбудителя опасной инфекционной болезни, о существовании на которой в прошлом вспышек данной болезни среди людей и животных известно из исторических источников. Этот термин — гипотеза. Должен применяться при историческом описании эпидемий и при постановке задачи исследователям на определение методами молекулярной диагностики границ природных очагов возбудителей опасных инфекций, поддерживающихся среди простейших и не проявляющих себя эпизоотиями или вспышками инфекционной болезни среди людей в настоящее время.
Природный резервуар возбудителя опасной инфекционной болезни (первичный) — совокупность одноклеточных организмов — биологических хозяев возбудителя опасной инфекционной болезни человека (животного), без которых его существование в природе как биологического вида невозможно.
Усилители природного резервуара возбудителя опасной инфекционной болезни человека — биотические объекты (растения, животные, их эктопаразиты), не имеющие значения для поддержания в природе возбудителя данной болезни как биологического вида, но способные накапливать, размножать и доставлять его в организм человека.
Природный очаг возбудителя опасной инфекционной болезни (первичный) — географический ландшафт, в почве которого методами молекулярной диагностики доказано присутствие этого возбудителя среди простейших, но не проявляющий себя эпизоотиями или вспышками инфекционной болезни среди людей (животных) в настоящее время (холодный очаг), и/или на его территории фиксируются эпизоотии и эпидемии данной инфекционной болезни (пульсирующий или активизировавшийся очаг).
Активизировавшийся природный очаг возбудителя опасной инфекционной болезни — периодическое появление на территории природного очага возбудителя опасной инфекционной болезни, вызываемых этим возбудителем эпизоотий и эпидемий.
Пульсация природного очага возбудителя опасной инфекционной болезни — процесс кратковременного (до нескольких лет), интенсивного и охватывающего обширные территории разрушения экосистем «простейшие — возбудитель опасной инфекционной болезни», проявившийся проникновением этого микроорганизма в популяции диких и домашних животных и их эктопаразитов.
Типы первичных природных резервуаров. Основываясь на исследованиях О. В. Бухарина и В. Ю. Литвина (1997), в зависимости от комплексных условий среды, в которой будут поддерживаться микроорганизмы, можно выделить четыре типа природных резервуаров возбудителей инфекций.
Почвенный резервуар — возбудитель инфекционной болезни поддерживается в одноклеточных обитателях почв (простейшие), их ассоциациях, а также в свободном состоянии.
Водный резервуар — патогенные микроорганизмы имеют в качестве хозяев различных представителей фито- и зоопланктона (водоросли, простейшие, низшие ракообразные), бентоса (черви, моллюски, членистоногие) и их ассоциации.
Техногенный резервуар — возбудитель существует в простейших организмах, населяющих трансформированные человеком экосистемы.
Наземный резервуар — существование возбудителей инфекций связано с простейшими наземных животных, их макрофагами и эктопаразитами.
Облигатным паразитам простейших, имеющим циркуляцию в наземном резервуаре (как например возбудитель чумы), свойственна передача среди людей и животных посредством переносчиков, т. е. усилителей природного резервуара возбудителя опасной инфекционной болезни. Их распространение среди людей может приобретать эстафетный характер по крайней мере, в двух случаях: 1) если в процесс передачи будут вовлечены эктопаразиты человека; 2) если произойдет «отрыв» возбудителя инфекционной болезни от природного резервуара (см. «Эпидемические монопроцессы циклического типа» в разд. 4.1.2) и они сформируют самостоятельные эпидемические цепочки путем воздушно-капельной передачи (возбудители чумы, натуральной оспы, гриппа, туберкулеза и др.). Многие возбудители инфекционных болезней людей, поддерживающиеся в техногенном, почвенном и водном резервуарах, не имеют возможностей для циркуляции в наземном резервуаре, и они не способны образовывать самостоятельных эпидемических цепочек. Инфицирование людей происходит «веерным путем» из какого-то единого источника (легионеллез — системы кондиционирования воздуха, холера — источники воды, сибирская язва — мясо инфицированных животных и почва; псевдотуберкулез — инфицированные растения и др.).
Первичный природный очаг возбудителя инфекционной болезни. Первичный очаг (пульсирующий или холодный) может изменять свои границы, расширяться или сужаться в результате естественной миграции одноклеточных животных, а также проникая в кишечник позвоночных организмов и распространяясь по территории в составе их фекалий. И. В. Домарадский (1998) считает важным фактором существования сапронозов способность простейших образовывать цисту (капсулу или наружную оболочку которой большинство простейших окружает при временном переходе в особое состояние покоя), устойчивую к высушиванию и температурным колебаниям среды. Цисты переносятся на большие расстояния воздушными и морскими течениями, а также перелетными птицами (посещающими болотные места) и насекомыми. Переселенные таким пассивным путем и попавшие в благоприятные условия существования инцистированные простейшие выходят наружу и быстро начинают размножаться. Вместе с ними новый регион может начать «обживать» и новый сапроноз.
Активизация (пульсация) первичного очага происходит из-за стрессового воздействия на экосистему «простейшие — возбудитель опасной инфекционной болезни», занимающую определенную территорию. Например, в результате длительного изменения микроэлементного, водно-солевого и температурного состава среды, в которой существовала экосистема, она переходит в неустойчивое состояние и периодически разрушается, затем восстанавливается, причем масштабы этих процессов нарастают, так как нарастает и само воздействие. Такое состояние экосистемы проявляется сначала небольшими локальными вспышками инфекционной болезни, но постепенно они становятся все более масштабным.
Пульсацию первичного очага могут вызывать быстро наступающие изменения в экосистеме «простейшие — возбудитель опасной инфекционной болезни», действующие на фоне развивающихся изменений в окружающей среде. Например, увеличение на данной территории численности простейших, в которых микроорганизм будет вести себя как паразит, а не как симбионт. Повышение же вирулентности возбудителя, паразитирующего в фагоцитирующих клетках первичного резервуара аналогично селекции по одному признаку (в данном случае по вирулентности), используемому в животноводстве. Такой прием селекции обычно приводит к утрате многих других свойств, имевшихся у исходной популяции вида. Этот феномен известен генетикам еще с 1930-х гг. и называется «платой за селекцию» (см. у Алтухова Ю. П., 2003). Поскольку «вирулентные» штаммы «отрываются» от первичного резервуара и формируют нестойкий вторичный резервуар, снижение генетического разнообразия «вирулентной» популяции не сказывается на поддержании вида микроорганизма в первичном резервуаре.
Вторичный природный очаг возбудителя инфекционной болезни. Формирование нестойкого вторичного резервуара возбудителя инфекционной болезни среди животных, обитающих на определенной территории, формирует вторичный природный очаг возбудителя инфекционной болезни. Для классификации вторичных природных очагов возбудителей инфекционных болезней можно использовать либо вид животного, наиболее часто вовлекающегося в эпизоотические процессы на исследуемой территории, как это делается в отношении очагов чумы (крысиный, сусликовый, песчаночный и др.; см. в работе Сунцова В. В. и Сунцовой Н. И., 2006), либо классифицировать их по типу географического ландшафта, в пределах которого локализуются основные эпизоотии и эпидемии. Обычно такие ландшафты характеризуются наличием определенных видов животных, вовлекаемых в эпизоотии членистоногими — переносчиками возбудите членистоногих, их суммарной сезонной активностью, а иногда и биологическим подтипом циркулирующего микроорганизма. По этому принципу Б. Л. Черкасский (2001) выделял степные, лесостепные, лугополевые, пойменно-болотные, долин пустынных рек, горно(предгорно)-ручьевые и др. очаги.
Продолжительность существования такого очага может не превышать продолжительности инфекционного процесса у отдельного инфицированного животного. Однако в тех случаях, когда благодаря эктопаразитам позвоночных между ними формируются эпизоотические (эпидемические, когда речь идет о человеке) цепочки, микроорганизм — облигатный паразит простейших получает возможность длительно поддерживаться среди позвоночных, обитающих на данной территории. Основную роль в его поддержании играют макрофаги/моноциты позвоночных организмов, эволюционные потомки простейших. Попав в организм человека или грызуна, микроорганизм использует те же механизмы специализации, которые позволяют ему поддерживаться среди почвенных одноклеточных организмов (см. разд. 2.1 и 2.2). В результате среди животных, обитающих на определенной территории, вспыхивают эпизоотии, сами они и их эктопаразиты становятся источником возбудителя инфекционной болезни для людей, т. е. усилителями первичного природного резервуара возбудителя опасной инфекционной болезни.
Вследствие меньшей устойчивости вторичные природные очаги не могут существовать дольше, чем первичные. После «угасания» таких очагов остается территория — первичный очаг, в котором микроорганизм продолжает поддерживаться среди одноклеточных организмов. Если мы обратимся к примерам из истории эпидемий чумы, то важным для понимания географической локализации таких очагов может быть сопоставление наблюдений авторов, описавших ее первую и вторую пандемии. В описаниях, разделенных почти восьмью веками, встречаются не только одни и те же города и местности, «пораженные» чумой. Совпадают сроки ее максимального территориального распространения по Европе, «направление движения » и еще ряд других, редко встречающихся обстоятельств, как, например, предшествующее появлению чумы распространение проказы, а затем и натуральной оспы (более подробно см. в книге: Супотницкий М. В., Супотницкая Н. С., 2006).
Общие свойства вторичных природных резервуаров возбудителей опасных инфекционных болезней. Рассмотрим некоторые общие свойства этих резервуаров, определяющие их роль в поддержании эпидемически значимых микроорганизмов среди позвоночных на определенных территориях.
Вторичные природные резервуары всегда эшелонированы. Для наземных резервуаров — это множество популяций и видов хозяев возбудителя инфекции, живущих при относительно высокой плотности в различных и неоднородных местах обитания (Gage К., Ostfield В., Olson J., 1995).
Для патогенных бактерий из водных и почвенных резервуаров — это обширные связи с различными обитателями воды, почвы и наземного резервуара. Например, холерные вибрионы обнаруживаются у вислоногих ракообразных, устриц, инфузорий, рыб. Легионеллы — у дождевых червей, личинок насекомых, кузнечиков и др. Возбудитель псевдотуберкулеза у моллюсков, плоских и кольчатых червей, водных растений, а также у более чем 300 видов питающихся ими рыб, млекопитающих, птиц, рептилий (Бухарин О. В., Литвин В. Ю., 1997).
Первичным резервуаром возбудителя туляремии, F. tularensis, скорее всего, являются простейшие A. castellanii (см. разд. 2.1 и рис. 25). Во вторичных резервуарах на территориях природных очагов он может поддерживаться не менее чем 125 видами диких позвоночных животных. Находят инфицированных возбудителем туляремии грызунов, насекомоядных, хищных, птиц, земноводных и даже рыб. В распространении туляремии среди грызунов основная роль принадлежит кровососущим эктопаразитам. Всего на территории бывшего СССР естественная инфицированностьвозбудителем туляремии была обнаружена у 74 видов паразитических клещей и насекомых. Эпизоотии туляремии наблюдаются в год высокой численности грызунов (рис. 61).
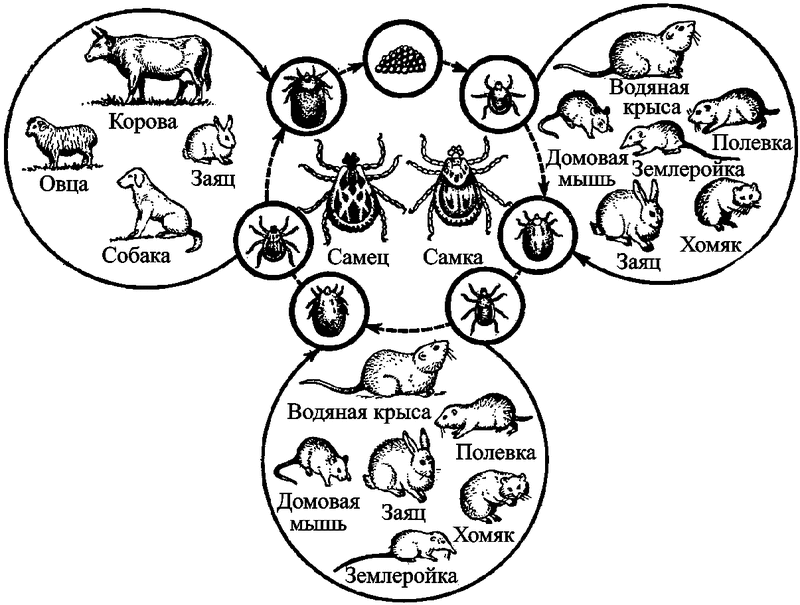
Рис. 61. Упрощенная схема поддержания возбудителя туляремии во вторичном природном резервуаре. Разнообразие животных, формирующих вторичные резервуары F. tularensis, способствует многообразию природных очагов туляремии. Они встречаются во всех равнинных ландшафтных зонах, местами проникают в горы. На территории бывшего СССР выделены следующие типы природных очагов туляремии: поймено-болотный, лугополевой, лесной, степной, предгорно-ручьевой, тугайный, тундровый. Каждый тип очага имеет собственные эпизоотологоэпидемиологические особенности (рисунок из книги Шуваловой Е. П., 1976)
Эшелонированность резервуара может проявляться наличием в нем имеющих сходные экологические потребности близкородственных видов микроорганизов (например, возбудители коклюша и паракоклюша; бешенства и сходных с ним вирусов — Lagosbat, Mokola, Duvenhage, EBLV1 и EBLV2), видов-аналогов эпидемически значимого возбудителя инфекции (малярийные паразиты) или вообще неродственных видов (возбудители гепатитов В и С), использующих одинаковый механизм трансмиссии.
Патогенные для человека виды «второго эшелона» не фиксируются в эпидемических вспышках из-за относительно небольшого количества вызываемых ими случаев инфекции и сходности ее клинических проявлений с вызываемой доминирующим возбудителем. Однако после «победы» над доминирующим возбудителем они постепенно занимают его место в этой же экологической нише.
Кумуляция резервуаров. Происходит тогда, когда небольшие по численности резервуары перекрывают друг друга и в совокупности ими достигается критический для развития эпидемического (эпизоотического) процесса размер популяции хозяев и переносчиков паразитических видов. Напри мер, орангутаны (Pongo pygmaeus), даже когда плотность их популяций составляет две особи на км2, являются хозяевами двух различных видов малярийных плазмодий. Эти же плазмодии находят в небольших популяциях людей, проживающих «по соседству», которых также недостаточно для поддержания существования этих патогенов (Wolfe N. D. et al., 1998).
Наличие хозяев, функционирующих как усилители природного резервуара. Как правило, это промежуточные хозяева, способствующие максимальному распространению возбудителя в среде, в которой возрастает его эпидемическая значимость, или способствующие инфицированию переносчиков. Например, для возбудителя псевдотуберкулеза такими хозяевами будут домашние грызуны, которые вводят его в непосредственное окружение человека, но при этом сами инфицируются, поедая в хранилищах овощи, обсемененные иерсиниями. Другой, более сложный, пример — поддержание эпидемического потенциала R. rickettsii — риккетсии, вызывающей в США пятнистую лихорадку Скалистых гор. По данным K. Gage et al. (1995), для этой риккетсии весьма эффективны трансовариальный и трансстадийный пути передачи между клещами-переносчиками; по-видимому, она не может поддерживаться во вторичном резервуаре без хозяевмлекопитающих. Экспериментальные исследования показали, что инфицирование R. rickettsii самок клещей оказывает вредное воздействие на их жизнеспособность и плодовитость. Существенные потери в инфицированных линиях клещей компенсируются паразитированием самок на риккетсиемичных млекопитающих-хозяевах с передачей вновь приобретенной инфекции своему потомству путем трансовариальной трансмиссии.
Смещение резервуара. Примером такого явления может быть смещение в США природного резервуара вируса бешенства. Если в 1930-х гг. его находили среди домашних собак, то с 1980-х гг. по ряду причин (вакцинация домашних собак, размножение койотов и др.) он переместился в популяции контактировавших с собаками койотов. А затем распространился на популяции скунсов, енотов и летучих мышей (Rupprecht С. et al., 1995).
«Вакуум вирулентности» в резервуаре. Понятие «вакуум вирулентности» предложено В. А. Лашкевичем и соавт. (1996) в отношении ситуации, сложившейся в человеческих популяциях в результате вытеснения из них вирулентного полиовируса невирулентными вакцинными штаммами. По их мнению, изменение существовавшего веками экологического баланса между людьми и вирулентными энтеровирусами породило ситуацию, при которой этот баланс восстанавливается за счет проникновения в чувствительную популяцию другого патогена, способного использовать ее как территорию для своего обитания и размножения. Этими вирусами стали вновь возникшие особо вирулентные варианты вирусов из других неполиомиелитных групп энтеровирусов, в частности ЕСН011 и ЕСН193, ранее считавшихся малозначимыми патогенами, т. е. «вакуум вирулентности» во вторичном природном резервуаре образуется в случае вытеснения из него вирулентного возбудителя. Однако будет неправильным ожидать появления во всех случаях вместо вытесненного возбудителя другого, но использующего ту же стратегию паразитизма. Например, если возбудитель использует первую стратегию (вирус натуральной оспы), то совсем необязательно, что его место займет возбудитель с этой же стратегией паразитизма (вирус оспы обезьян), если продолжают действовать те же факторы, которые привели к элиминации из природного резервуара паразита «первого эшелона».
4.1.2. Циклические пандемические и эпидемические монопроцессы
Пандемии чумы. Пандемии холеры. Пандемии гриппа. Стадии эпидемических монопроцессов циклического типа. Незавершающиеся циклические эпидемические монопроцессы.
Пандемия данного типа — это процесс появления, распространения и прекращения эпидемий (вспышек) одной и той же инфекционной болезни на нескольких континентах одновременно. Раньше им вели счет и каждой присваивали свое название или порядковый номер, в зависимости от сложившейся традиции (первая и вторая пандемии чумы, семь пандемий холеры, пандемия гриппа «испанки» и т. п.). Сегодня, благодаря прекращению масштабных эпидемий данного типа, у нас даже сформировалось представление о собственном могуществе в борьбе с эпидемиями вообще.
Пандемии чумы. Возбудитель чумы, Y. pestis, способен формировать вторичные, хорошо эшелонированные (полигостальные) резервуары среди грызунов. В человеческие популяции он проникает посредством блох, инфицировавшихся от грызунов. При переходе бубонных форм болезни во вторично-легочную Y. pestis может формировать цепочки из случаев первично-легочной чумы и вызывать масштабные вспышки легочной чумы (до 100 тыс. человек, погибших во время легочной чумы в Маньчжурии 1910–1911 гг.), но для ее поддержания в природе жертвы среди вида Homo sapiens не имеют значения.
Пандемии чумы начинаются за несколько десятилетий, а возможно, и веков до своего «официального признания» в качестве эпидемической катастрофы — реликтовые очаги чумы разогреваются десятилетиями. Так, первая исторически зафиксированная пандемия чума (чума Юстиниана, 531–589 гг.) в восприятии современников проявилась разрозненными случаями в Константинополе в 531 г. Однако историк церкви Евсевий Памфил (Eusebius, ок. 260–340) в своем труде «Церковная история» упоминает о чуме, как об известной в Европе (в отличие от оспы) на его время болезни.
Второй пандемии также предшествовали какие-то эпидемии, сопровождавшиеся повальной смертностью и оставившие свидетельства в легендах и летописях именно как «чума» или «мор». Культ Святого Рока как защитника от чумы, появился в Европе перед «черной смертью», сам святой умер в тюрьме в 1327 г. Традиция изображать «Гнев Господень» в виде стрел чумы, ниспосланных сверху, начинается еще раньше, как минимум в XIII в. (Делюмо Ж., 1994). На территории России летописцы в течение двух веков, предшествовавших «черной смерти», фиксировали «бысть мор» в городах, ставших потом ее основной жертвой (Смоленск, Псков, Новгород, Изборск и др.). «Мор» с завидной регулярностью начинался в конце лета (Рихтер В. М., 1815). С XIII в. затлели очаги чумы на Балканах, в Курдистане и Месопотамии. В 1346 г. начался глобальный «пожар» чумы.
Пандемиям чумы предшествуют пандемии проказы и натуральной оспы (более подробно об этом феномене см. в разд. 4.2.3 и в книге Супотницкий М. В., Супотницкая Н. С., 2006).
Первая пандемия чумы (чума Юстиниана, 531–589 гг.). Сведения по ней разрозненные. Началом пандемии принято считать 542 г., когда бубонная чума вспыхнула в Константинополе. Исходным пунктом ее развития византийский историк Прокопий (VI век) считал земли, расположенные в дельте Нила. По его восприятию, чума распространилась в двух направлениях — по африканскому побережью, после чего она вспыхнула на европейском континенте; и к востоку — по Сирии, Персии и Индии. Пандемия развилась за 4–5 лет. В 542 г. чума охватила Грецию, в 543 г. она появилась на Апеннинском полуострове. В 545-м и 546 гг. чума опустошила различные области Галлии, особенно ту ее часть, которая расположена в устье Роны, и Клермонтскую область. В 546 г. она появилась в провинции Germania prima, которая включала в себя земли по левому берегу Рейна, от Бингена до Шлетштадта, с городами Майнц и Реймс. Чума не прекращалась в этих местностях до 556 г. — этот ее период называют первым циклом (Гезер Г., 1866).
Второй цикл чумы в Константинополе начался зимой 558 г. и был более жестоким, чем предыдущий. В Константинополе чума «держалась» полгода. Но дальше ее «ход» повторился. Под 565 г. датируется катастрофическая чума на Апеннинском полуострове, особенно в провинции Лигурия и в Венеции. Опустошения в Западной Римской империи были так велики, что римляне оказались не в состоянии дать отпор подступившим лангобардам. Но с этого года современниками было замечено снижение смертности среди заболевших чумой людей.
Третий цикл чумы в Константинополе начался в 570 г., в 584 г. она поразила отдельные местности Пиренейского полуострова, особенно смертельной чума оказалась в Толедо, в 589 г. ее «завезли кораблем из Испании» в Марсель, т. е. в Испании чума в это время продолжалась. Четыре вспышки чумы зафиксированы в Антиохии (Сирия). Но к концу века чума перестала упоминаться в исторических источниках, видимо, она повсеместно прекратилась. Всего же, по описаниям современников, эпидемии чумы в Европе продолжались не менее 50 лет (Гезер Г., 1866).
Вторая пандемия чумы («черная смерть», 1346–1351 гг.). Также как и во время первой, чума охватила Европу за 5 лет «двигаясь» с юга на северо-запад, но продолжалась значительно дольше, что я поясню ниже.
По собранным нами данным (Супотницкий М. В., Супотницкая Н. С., 2006) 1346–1347 гг. чумой были охвачены территории, включающие низовья Волги, Северный Прикаспий, Северный Кавказ, Закавказье, Крым, Восточные отроги Карпат, Причерноморье, Ближний и Средний Восток, Малую Азию, Балканы, Сицилию, Родос, Кипр, Мальту, Сардинию, Корсику, Северную Африку, юг Пиренейского полуострова, устье Роны. В ноябре 1347 г. «черная смерть» появилась в Марселе, к январю 1348 г. волна эпидемии докатилась до Авиньона. К началу 1348 г. «черная смерть» распространилась по Испании. К концу января чума свирепствовала во всех крупных портах южной Европы, включая Венецию, Геную, Марсель и Барселону. Весной, превратив Венецию и Геную в мертвые города, чума достигла Флоренции. Затем чума «перешагнула» через Альпы, в Баварию. Также весной 1348 г. она объявилась в Гасконии. Вскоре после этого чума вспыхнула в Париже. В июле эпидемия охватила северное побережье Франции. В начале августа «черная смерть» пришла в Англию в «обход портов», разразившись в маленьком прибрежном дорсетширском городке Мельком Регис (Уэймут), «почти полностью лишив его жителей». Только через несколько недель чума появилась в Бристоле. В течение той осени чума поражала одно южное графство за другим. Дорсет и прилегающие графства почти вымерли. В Лондоне эпидемия вспыхнула в ноябре, в Шотландии в конце года. В следующем году наступила очередь Уэльских гор и долин, и «наконец, как будто плывя дальше, чума достигла Ирландии, поразив огромное количество англичан, проживавших там». Она едва затронула самих ирландцев, которые проживали в горах и горных территориях, но и их она безжалостно и неожиданно «уничтожила повсюду самым жестоким образом» в 1357 г. Осенью 1348 г. чума появилась в Норвегии, Шлезвиг-Голштейне, Ютландии и Далмации. В 1349 г. чума захватила Бельгию, Германию, а в следующем году — Польшу (рис. 62).

Рис. 62. «Похороны жертв чумы в Турне» («Burying Plague Victims of Tournai»).
Фрагмент иллюстрации из рукописи, называемой «Хроники Гилля Майзета» («Annals Gilles de Muisit», 1272–1352 гг.), настоятеля монастыря святого праведника Мартина. Рукопись хранится в Библиотеке короля Альберта I, Брюссель. Показанные художником события относятся к чуме «черной смерти» в бельгийском городе Турне в 1349 г. Изображенная на рисунке ситуация отражает типовое восприятие людьми эпидемий циклического типа. Болезнь вспыхивает неожиданно и в течение воспринимаемого в быту периода времени (месяц, сезон и т. п.) заканчивается. Например, в русских летописях можно прочитать следующее: «В то же лето бысть болесть сильна в людех»; или «за пять дней, да после Покрова дней с десять» — т. е. в конце сентября и в начале октября
На территории средневековой Руси чума появилась в 1352 г. на следующий год после того, как ее эпидемии закончились в Германии и Польше. Летом 1352 г. «черная смерть» охватила Псков, затем Новгород. В течение 15 лет чума распространилась на Ладогу, Суздаль, Смоленск, Чернигов, Киев и по всей Центральной Руси (1363–1365 гг.).
Распространение «черной смерти» шло «скачками». Ряд городов Месопотамии был охвачен этой болезнью, дававшей, как правило, до 100 % смертности заболевших. Но на том же пути многие города, находившиеся в сообщении с зачумленными, остались нетронутыми «черной смертью ». Русские летописи оставили нам любопытную подробность «движения » чумы по территории древней Руси. В низовьях Волги она появилась в 1346 г., но, опустошая Орду, чума упорно не «заносилась» на территории русских княжеств еще почти 5 лет, хотя никаких ограничений на сообщения между «субъектами федерации» тогда не было.
Развитие второй пандемии больше напоминает сложнопериодические колебания в еще неизвестных экосистемах, вмещающих чумной микроб, чем передачу возбудителя болезни по цепочке от человека к человеку или из крысиных очагов чумы посредством инфицированных эктопаразитов. На огромных территориях вспыхивают несвязанные друг с другом, но синхронизированные по времени и разные по интенсивности эпидемии чумы. Между ними остаются временные промежутки, которые достаточны для того, чтобы сменилось несколько поколений людей, живших в мире без чумы. Например, относительно благополучными по чуме для Европы были промежутки между 80-ми гг. XIV в. и 40-ми гг. XV в.; между 1527-м и 1545 гг. На территории отдельных реликтовых очагов чумы можно отметить и более продолжительные периоды эпидемического благополучия. До чудовищной чумы 1773 г. в Багдаде и Басре жители Месопотамии не встречались с ней почти 90 лет. Между последними чумными эпидемиями в Москве (1654-й и 1771 гг.) прошло 117 лет, за это время сменилось четыре поколения москвичей, незнавших этой болезни. Пульсация реликтовых очагов чумы возобновляется на огромных территориях. Например, в середине XVII в. процесс осуществился на пространстве от Вятки до Лондона в течение 10 лет, погубив, по приблизительным оценкам, от 0,5 до 1 млн человек. Всего же таких периодов (пиков активности чумы) после окончания «черной смерти» 1346–1351 гг. и последовавших за ней пульсаций очагов чумы в более северных широтах (первый пик — 1346–1382 гг.) мы насчитали еще не менее трех: 1440–1530 гг. (второй); 1545–1683 гг. (третий; по площади охваченных чумой территорий его можно прировнять к «черной смерти»); 1710–1830 гг. (четвертый). Внутрь этих пиков всеевропейских пульсаций вложены пики пульсаций отдельных релитиктовых очагов. Однако с середины XVII в., по мере потепления климата, постепенно происходит отступление чумы в направлении с севера и запада на юго-восток. Все больше западных и северо-западных территорий Европы становятся свободными от чумы, если, конечно, под чумой понимать только ее вспышки среди людей.
В XIX в., угасая на Европейском континенте, очаги чумы разгораются южнее, в глубине территорий, занимаемых сегодня Индией и Китаем. Эти территории были интенсивно поражены чумой во время «черной смерти», но в XVII в. Индостан и Китай оставались относительно благополучными по чуме. В начале XIX в. чума в Индии вновь резко активизировалась. Бубонная и легочная чума появились в 1815 г. в горной провинции Куче и на юго-востоке провинции Гузерат (штат Гуджарат — там же она появилась в 1994 г., и, разумеется, оказалась нераспознанной более месяца, так как о чуме в этих местах уже никто не помнил). В 1819 г. чума в Индии получила еще большее распространение. В 1836 г. она появилась в местности, отстоящей далеко от пораженных прежде, в Пали. В эти же годы началась активизация природных очагов чумы на юге Китая и в Индокитае. К 1834–1835 гг. относятся сведения о появившейся в китайском городе Нинпо (Нинбо — город на берегу Восточно-Китайского моря) эпидемии чумоподобного характера. В 1850 г., когда бубонная чума выпала из поля зрения европейских ученых, и даже считалась ими «вымершей болезнью», легочная чума вновь вспыхнула на южных склонах Гималаев (в Гурвале и Камауне). В этот же год бубонная чума напомнила о себе в Кантоне (Китай). В 1858 г. обнаружилось «движение» чумы на север и запад. Она появилась в бубонной форме среди бедуинов на побережье Средиземного моря в близи Триполи, где чума была известна еще во времена карфагенского владычества. Через 5 лет активизировались очаги Великого Евразийского чумного излома (1863–1879 гг.), с начала 1880-х гг. чума все чаще регистрируется в Северном Прикаспии, Поволжье, Монголии, Северном Китае и Забайкалье. С середины XIX в. чума становится эндемичной на юге Китая. В 1864 г. вновь «чумоподобная эпидемия» в Нинпо. В 1866 г. чума обнаружена в столице китайской провинции Юнъ-нань (граничит с Вьетнамом и Бирмой, от самого южного ее участка до побережья моря не менее 400 км) в городе Юнъ-нань-фу (до побережья не менее 1000 км). Во время гражданских войн в 1860–1870 гг. чума свирепствовала на юге Китая эндемически (!). В 1867 г. чума вспыхивает в Пакхое (город в провинции Гуанъ-дунъ на берегу Тонкинского залива), но никуда не «разносится кораблями и крысами». В 1871 г. чума «возвращается» в провинцию Юнъ-нань, продолжаются значительные вспышки чумы в Пакхое. С конца 70-х гг. XIX в. обнаружилась сезонность в появлении чумы в южном Китае. Она стала появляться в январе каждого года в провинции Квангси (Гуанъ-си) и в округах Лиенчоу и Лейчоу. Болезнь наблюдалась ежегодно с 1881-го по 1884 г. в Пакхое, но кораблями она почему-то не распространяется. В 1889 г. была эпидемия в Люнгчоу (Лунчжоу), а в 1890 г. чума вспыхнула в Ву-чу (Бучу), на берегу между Пакхоем и Кантоном. В 1891 г. появилась чума в Као-чау, области смежной с Лиенчоу, где находится Пакхой. В 1892 г. вспыхнула эпидемия чумы в Ан-пу, городе, находящемся в 180 км к востоку от Пакхоя. В 1893 г. вновь появилась чума в Пакхое. Она также была в Юнъ-нане, преимущественно в городе Мингз (в южной части провинции). Тогда же чума свирепствовала в Люнгчоу и во многих глубинных городах провинции Квангси. В 1894 г. чума устраивает побоище в китайских портовых городах Кантоне, Гонконге и Амое, и только тогда (!) она попадает в поле зрения европейских ученых, и понимается ими как начавшаяся третья пандемия. С этим событием по времени совпало бактериологическое обнаружение Y. pestis у крыс в городах и у их блох. Теперь с эпидемиологией чумы все стало ясно, и даже более чем (рис. 63).
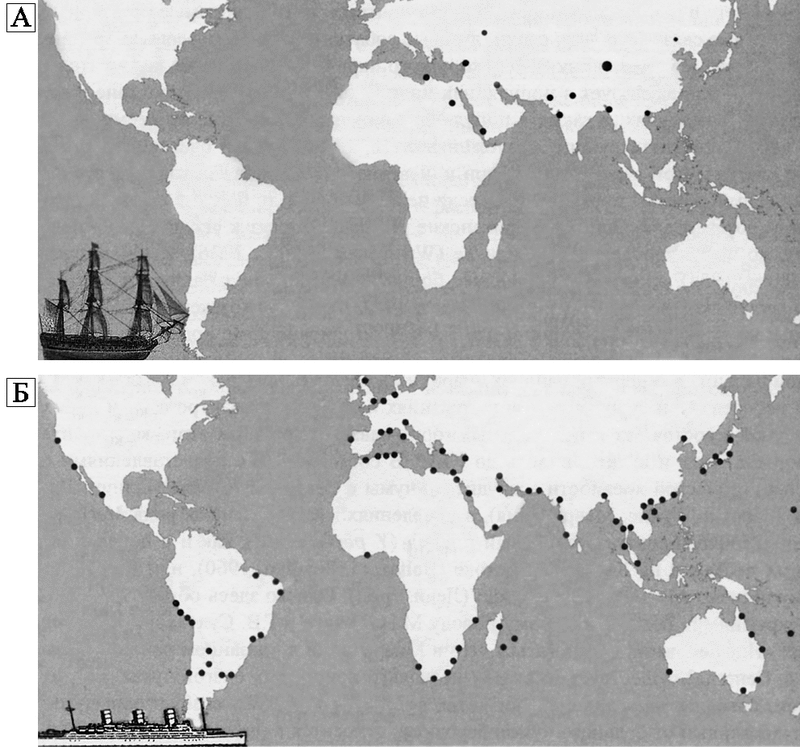
Рис. 63. Схема глобального распространения очагов чумы больными чумой крысами и кораблями. По В. Н. Федорову, В. П. Козакевичу (1959).
А. До начала третьей пандемии чумы с 1846-го по 1894 гг.
Б. В начале третьей пандемии с 1894-го по 1903 гг. Данная иллюстрации — любопытный образчик конъюнктурного искажения научной информации в угоду господствующей в эпидемиологии чумы концепции. Проигнорированы предшествовавшие «третьей пандемии» вспышки чумы в горных долинах китайской провинции Юнънань (о них было известно уже не менее 50 лет!), в Индии, Курдистане, Афганистане, Северной Персии, Астраханском крае, Месопотамии, в центральной Танзании и Уганде, в Маньчжурии, Забайкалье и в других местностях. И куда только они делись с карты с началом «третьей пандемии»? Схема взята из монографии, изданной в 2006 г., где она приводится как «образец научности»
За первые 10 лет пандемии (1894–1903 гг.) чума отметилась в 87 (из нескольких тысяч!) портовых городов. Хотя в те же годы фиксировали эпидемии, которые не были связанны с морскими портами, все равно действовал следующий стереотип мышления: пандемия чумы началась в 1894 г. и была «портовой» (Ахшарумов Д. Д., 1900; Диаптроптов П. И., 1901; Wu Lien-Ten et al., 1936; Николаев Н. И., 1949). Факты, свидетельствовавшие о том, что чума в XIX в. не прекращалась, не принимались во внимание, так как они противоречили ставшей очень прогрессивной теории разноса чумы кораблями, кстати, известной еще со времен чумы в Марселе 589 г. (см. у Гезера Г., 1866). Следовательно, началом так называемой «третьей пандемии чумы» сегодня считается случайно взятая дата одной из эпидемий чумы в Кантоне, периодически вспыхивающих там с 1850-х гг., а схема «грызун — блоха — грызун», ставшая основой для объяснения распространения портовой чумы, существует еще и для того, чтобы бесконечно вылавливать грызунов и вычесывать у них блох.
Сопоставление же территориальных масштабов так называемой «третьей пандемии» с предыдущими пиками активности чумы второй пандемии показывает, что она значительно уступает по этому показателю последнему, четвертому ее пику (1710–1830 гг.). Учитывая также и искусственность даты начала третьей пандемии, правильнее будет считать ее не самостоятельным явлением, а пятым, самым низким пиком второй пандемии чумы.
Реликтовые очаги чумы. Для приблизительного определения их границ мы воспользовались работами В. М. Рихтера (1815), Г. Ф. Архангельского (1879), Г. Гезера (1866), Н. К. Щепотьева (1897), Д. Д. Ахшарумова (1900), Ф. И. Дербека (1905), К. Г. Васильева и А. Е. Сегала (1960), М. П. Козлова и Г. В. Султанова (1993). Для систематизации реликтовых очагов мы использовали синхронистический принцип. Точные же границы таких очагов можно определить с помощью методов молекулярной диагностики (Супотницкий М. В., Супотницкая Н. С., 2006).
Реликтовый Северо-западный природный очаг чумы — представляет собой восточную оконечность цепочки очагов чумы, тянущихся от побережья северной Франции (пролив Ла-Манш) через территории Голландии, Дании, германских государств, балтийское побережье Швеции и Польши, Прибалтику и по Карелии до южного побережья Белого моря. Активизация очага зафиксирована в русских летописях XIII в. и приходится на начало малого ледникового периода. В 1424 г., судя по территории, охваченной чумой, пульсация очага достигла максимума — бубонная и легочная чума в Новгороде, Пскове, Карелии, а также в «Литве и Немцах». Последняя эпидемия чумы в Пскове пришлась на 1711 г., в Новгородской области на 1606 г.
Реликтовый природный очаг чумы Русской равнины. Включает территорию, по форме приближающуюся к четырехугольнику с углами Великие Луки — Вологда — Кострома — Смоленск. Вместе с похолоданием климата разогревался очаг чумы. В 1229–1230 гг. чума дала о себе знать мором в Смоленске, где погибло до 32 тыс. человек. «Черная смерть» 1346–1351 гг. «обошла» Москву. В 1363 г. чума поразила Переславль, Коломну, Владимир, Суздаль, Дмитров, Можайск, Вологду. Только в 1364 г. чума появилась в Москве. В этом же году чума свирепствовала в Переславле, Рязани, Коломне, Суздале, Дмитрове, Можайске, на Волоке. В 1654–1656 гг. пульсация очага возобновилась и достигла максимума. В Москве эпидемия началась в августе 1654 г. и продолжалась до января 1655 г., погубив до 300 тыс. человек. С августа по сентябрь 1654 г. чумой были охвачены Кострома, Тверь, Коломна, Торжок, Звенигород, Кашин, Переславль-Рязанский, Переславль-Залесский, Суздаль, Тула, Калуга, Углич, многие их слободы и уезды. Осенью 1771 г. в Москве и в ближайших к ней городах вновь разгорается эпидемия чумы, сопровождающаяся бунтом населения. Однако по охвату территории ее масштабы были значительно меньшими, чем в 1654 г. В 1773 г. пульсация очага прекратилась.
Реликтовые природные очаги чумы Северного Причерноморья и Малороссии. Это восточная оконечность последовательности реликтовых очагов чумы, тянущихся от Балкан на восток вдоль всего северного побережья Черного и Азовского морей до очагов чумы Великого Евразийского чумного «излома» (см. ниже). На севере границы очага можно расположить на равнинном пространстве между Волыно-Подольской и Среднерусской возвышенностями до границ Курской области. Пульсации очагов происходят в направлении с запада на восток. Начало активизации очагов чумы Северного Причерноморья и Малороссии приходится на период свирепствования «черной смерти». В 1738 г. их активность достигла максимума. Во второй половине XVIII в. чума постепенно отступает в направлении с севера на юг и дробится на мелкие очажки. В первой половине XIX в. активными остаются очаги чумы Северного Причерноморья, расположенные на пространстве между Крымским полуостровом и Тирасполем, причем их границы постепенно сужаются. Небольшую активность эти очаги проявили в начале ХХ в. (чума в Одессе в 1902-м и 1910 гг.)
Великий Евразийский чумной «излом». Под ним мы понимаем гигантскую последовательность как реликтовых, так и пульсирующих сегодня природных очагов чумы, расположенную «изломанной» дугой — от пустынь Йемена до возвышенностей, называемых Северными увалами (север Кировской области, Россия). Эта последовательность включает Саудовско-Йеменский очаг с центром в Эль-Асире и Хавлане, Сирийско-Месопотамский пустынный очаг, Курдо-Иранский природный очаг чумы, очаги чумы Центрально-Иранского плоскогорья, Северо-Иранских краевых гор, а также смежных с ними плоскогорий и впадин Афганистана, Приараксинский участок очаговости чумы, Закавказский равнинно-предгорный очаг чумы, Закавказский высокогорный природный очаг чумы, Центрально-Кавказский природный очаг чумы, Восточно-Кавказский природный очаг чумы, Прикаспийский северо-западный очаг чумы, Зауральский природный очаг чумы, Волго-Уральский природный очаг чумы и реликтовые очаги чумы долин рек Ветлуга, Вятка и Кама до Северных Увалов. Объединение в «излом» не носит произвольный характер. В пульсациях этих очагов в максимумы их активности (XVII–XIX вв.) отчетливо прослеживается пространственная и временная последовательность.
Активизация очагов «излома» начинается с горного Курдистана. Затем, в промежуток времени в 2–4 года, в этот процесс вовлекаются Сирийско-Месопотамские очаги чумы, поэтому в восприятии современников чума «идет» с верховьев Тигра и Евфрата по их долинам и опустошает Месопотамию, юго-западную Персию и Малоазиатскую часть Турции. В промежуток времени 10–15 лет от начала активизации очагов горного Курдистана чума «поднимается» на север, вспыхивая сначала на Карском плато; затем на территориях, которые сегодня называют Приараксинским участком очаговости чумы; затем, в течение еще двух-трех десятилетий, она «скачками» продвигается далее на север; и, описав дугу вокруг Каспия со стороны Кавказского хребта, «ударяет» по Астрахани (1662, 1693, 1727, 1806, 1877 гг.), после чего «поднимается» по Волге, иногда до Саратова (1808 г.), реже, в максимум активности «излома», еще дальше (Нижний Новгород, 1363 г.; Казань, 1665 г.; Вятка, 1667 г.).
Современники «черной смерти» зафиксировали активизацию, по крайней мере, части очагов чумы Великого Евразийского чумного «излома» — от Курдо-Иранского до Прикаспийского Северо-западного. В их восприятии это была «другая волна чумной эпидемии», прокатившаяся через Сирию, Армению, Малую Азию и прикаспийские земли.
На территории России наиболее северным участком «излома», на котором в 1346 г. наблюдалась пульсация реликтовых очагов чумы, была местность в районе Енотаевки (Астраханская область), где, по указанию летописца, произошла «казнь от Бога» на жителей города Бездеж (Воскр. лет.). Самой южной территорией «излома» с пульсирующими очагами времен «черной смерти» можно считать местность между реками Тигр и Евфрат в районе Багдада (1347 г.), охваченную бубонной и бубонно-септической чумой с ужаснувшей современников повальной смертностью населения.
В годы последующих пульсаций «излома» территории пульсирующих очагов расширялись и смещались на север и на юг. В 1363 г. границы таких очагов «поднялись» до Нижнего Новгорода, «…а пришел (мор) от низу, от Бездежа, …и опусте земля вся и порасте лесом, и бысть пустыни всюду непроходимы (Никон. лет.)». До середины XVII в. о чуме на российской территории «излома» в исторических источниках не упоминается, возможно, это не от невнимательности летописцев. Например, Петр Петерей (1620 г.); писал: «Московиты, находящиеся за Рязанью и в Татарии, вовсе не знают моровой язвы, страдают же от нее лишь близкие к западной границе, а именно: Новгород, Псков, Смоленск и др.», т. е. в этот исторический период активными оставались очаги чумы, расположенные в северной части Европейского континента.
Пульсации очагов «излома» возобновились в середине XVI в. Их максимум на территории России совпал с наибольшей активностью реликтового природного очага чумы Русской равнины и большинства других европейских реликтовых очагов. Летом 1655 г. моровое поветрие появилось в низовьях Волги и в Астрахани. Затем эпидемия вспыхнула в Казани, где в тот год от чумы погибло 48 тыс. человек. В 1657 г. чума свирепствовала и в соседней с Казанской — Вятской области (северная граница «излома»), и в самом городе Вятке. Летом 1657 г. чума снова возобновилась в низовьях Волги, в 1692 г. чума повторилась в Астрахани.
Южная граница реликтовых очагов «излома» проходит по побережьям Персидского залива (на восточном побережье, по крайней мере, она достигает Бушира). Максимум в их активности достигнут через век после максимума активности северных очагов «излома». Он проявился чудовищными эпидемиями чумы в Багдаде и Басре в 70-х гг. XVIII в. (до 2 млн погибших). В последующие годы «северные территории» пульсирующих очагов «излома» (Россия) сужались и «смещались» к югу (сегодня это Прикаспийские, Волго-Уральские и Кавказские очаги чумы). «Южные» (Месопотамия), наоборот, «подтягивались» на север (Закавказские и Иранские очаги чумы). Количеств жертв чумы в одних и тех же природных очагах снижалось от вспышки к вспышке, как и их территориальные масштабы.
Балкано-Придунайские реликтовые очаги чумы. Синхронно активизировались как в первую, так и во вторую пандемии чумы, приводя к массовой гибели людей. Среди них можно выделить три группы реликтовых очагов: 1) цепочка очагов на равнинной местности между реками Прутом и Серетом, расположенных от Хотина до Измаила (включая Яссы, Браилов, Галац и др.), своей восточной частью вплотную прилегающих к реликтовым очагам Северного Причерноморья и Малороссии; 2) цепочка очагов на равнинной местности между Дунаем и Черноморским побережьем от Бабадага до Варны (включая Черноводы, Каварну, Кюстенджи); 3) отдельные очаги на равнинной местности между Константинополем, Андрианополем и побережьем Мраморного моря. Максимум активности достигнут в конце XVIII в. Очаги третьей группы проявляли небольшую активность даже в начале ХХ в.
Реликтовые очаги чумы долины реки По. Исторически они наиболее смертоносные в Европе и самые активные на Апеннинском полуострове; многократно разгорались в первую и вторую пандемии. Их пульсациями объясняются масштабные эпидемии Средневековья и эпохи Возрождения в городах Венеция, Милан, Падуя, Болонья, Пьяченца, Палермо, Верона и др., иногда воспринимаемых современниками как «конец света». Максимум активности достигнут в середине XVII в.
Реликтовые очаги чумы долины реки Арио. Катастрофические эпидемии чумы в Пизе и Флоренции во времена первой и второй пандемий. Пик активности приходится на времена «черной смерти» (художественное описание см. у Боккаччо в «Декамероне»).
Реликтовые очаги чумы долины реки Рона. По многочисленным историческим источникам очень активны. Пульсации проявлялись сокрушительными эпидемиями чумы во времена первой и второй пандемий. Границы очагов можно заключить в треугольник «Авиньон (вершина) — Тулон и Монпелье (основание)». Максимум активности пришелся на 1720–1722 гг.
Реликтовые очаги чумы долины реки Вольтурно. Их пульсации проявлялись тяжелыми эпидемиями в Неаполе в период второй пандемии чумы. Самая смертоносная эпидемия чумы вспыхнула в 1656 г. Она унесла жизни 200 тыс. человек из 400 тыс. населения города. Последний раз очаги пульсировали в 1900 г.
Сицилийские реликтовые очаги чумы. Располагаются вдоль северного побережья острова между городами Трапани и Сиракузы. Наиболее активно пульсация очагов происходила в период второй пандемии на местности, прилегающей к городу Мессина.
Реликтовые очаги чумы долины реки Гаронна. Пульсации проявлялись сокрушительными эпидемиями чумы в городах Бордо и Тулуза во времена второй пандемии. Пик активности приходится на конец XVII в.
Реликтовые очаги чумы северо-восточной Франции. Это обширное равнинное пространство между городами Руан, Амьен, Реймс и Париж, включающее долины рек Сена, Марна, Сомма. Мощные пульсации во времена первой и второй пандемий чумы (пик активности приходится на середину XVII в.). В начале 1930-х гг. отдельные случаи бубонной чумы в предместье Парижа Сент Уэн, оставшиеся тогда без объяснения.
Реликтовые очаги чумы Пиринейского полуострова. Долина реки Дуэро (местность в районе города Порто) — в последний раз очаги пульсировали в начале ХХ в.; долина реки Гвадалквивир (Севилья); местность южнее и восточнее Андалузских гор, включающая Гибралтар, Малагу, Альмерию; низовья реки Турия (Валенсия); долина реки Эбро (Сарагоса); местность, прилегающая к Каталонским горам с востока (Барселона) — в последний раз пульсировали в конце августа 1931 г., когда было выявлено не менее пяти случаев бубонной чумы (двое заболевших умерли) среди тряпичников поселка Госпиталет в 4 км на восток от Барселоны. Пик активности реликтовых очагов чумы Пиринейского полуострова приходится на середину XVII в.
Реликтовые очаги чумы полуострова Корнуолс (о. Великобритания). Равнинная местность, по форме напоминающая неправильный параллелограмм, расположенная между Бристолем и Уэтмутом и вдоль юго-восточного склона Корнийских гор, где в августе 1348 г. вымерло почти все население («люди ложились, подобно колосьям под серпом жнеца»).
Реликтовые очаги чумы Юго-Восточной Англии. Расположены на местности, включающей Лондон и его пригороды в радиусе 20 миль от Сити. Пульсации достигли максимума в середине XVII в., что имело своим следствием Великую Лондонскую чуму 1665 г. В 1900 г. отмечены чумные эпизоотии среди лондонских крыс, объясненные в соответствии с представлениями того времени «заносом чумы кораблями» (рис. 64).

Рис. 64. Фрагмент картины «Спасение от чумы, Лондон, 1665 г.» («Rescued from the Plague, London, 1665» Guildhall Art Gallery, Corporation of London).
Картина написана британским художником Francis Tophan (1838–1924) в 1898 г. В контексте данной работы картина иллюстрирует несоответствие реальной эпидемиологии инфекционной болезни принимаемым в отношении нее противоэпидемическим мероприятиям. В XVII в. считалось, что чума передается особым вредоносным химическим веществом — контагием по принципу: «прикоснулся к чумному больному — заболел чумой». Контагий также сохранялся в вещах больного человека. Люди, находившиеся в контакте с больным чумой, считались потенциально «чумными» и их запирали в тех домах, где выявляли заболевших. «Зачумленные» дома в Лондоне местные власти помечали крестом и на двери делали надпись «Да спасет их Господь», что и изображено на картине Francis Tophan. В действительности в домах формировались локальные (домовые) вторичные крысиные очаги чумы, и возбудитель болезни инфицировал людей посредством укуса инфицированных им блох. Следовательно, правильнее было бы людей эвакуировать из их «зачумленных» домов, что и делают жители, основываясь на своем эмпирическом опыте, вопреки «научным представлениям» врачей. Но к этому пониманию эпидемиологии чумы наука придет еще только через три века.
Реликтовые центрально-европейские очаги чумы. Цепочка реликтовых очагов, расположенных вдоль северных отрогов Альп (сокрушительные эпидемии чумы второй пандемии в городах Женева, Базель, Берн, Цюрих, Мюнхен, Линц, Вена, Краков) и соединяющихся с западной оконечностью Балканских реликтовых очагов чумы (пик активности приходится на первую половину XVII в.).
Реликтовые очаги чумы долин рек Рейн, Везер, Эльба. Во время второй пандемии их эпидемическая активность нарастала по мере приближения к побережью Балтийского моря (сокрушительные эпидемии чумы второй пандемии в Страсбурге, Франкфурте, Кельне, Ганновере, Гамбурге, Магдебурге и др.). Видимо «сливаются» с цепочкой реликтовых очагов чумы, расположенных вдоль побережий пролива Ла-Манш, Северного и Балтийского морей. Пик активности приходится на первую половину XVII в. Наиболее упорно в Центральной Европе эпидемии чумы «держались» на местности, включающей в себя города Дрезден (1680 г.), Магдебург (1681 г.), Галле (1682 г.), Гальберштад, Брауншвейг, Эрфрут, Нордгаузен и Мюльгаузен (1682–1683 гг.) — «Германское чумное пятно». На его территории отдельные вспышки и случаи чумы встречались до 1711 г., после чего она «совершенно исчезла» из Германии.
Приведенные по пандемиям чумы исторические материалы свидетельствуют о следующем.
1. Процессы глобальной активизации природных очагов чумы связаны с активизацией природных очагов возбудителей других инфекционных болезней людей. Анализ исторических источников показывает, что пандемиям чумы предшествуют пандемии проказы и натуральной оспы.
2. Существует глобальная многолетняя цикличностьи в развитии пандемий данного типа. Такой цикл хронологически выходит за рамки известных пандемий. Например, отнеся вторую пандемию чумы только на 1346–1351 гг. мы игнорируем то, что после небольших временных перерывов вспышки чумы продолжались до 1382 г., занимая все большие территории и продвигаясь скачками на север, т. е. пандемический процесс продолжался после даты, считающейся его окончанием. Но и после 1382 г. нельзя говорить о ее окончании. Очаги чумы на Европейском континенте еще почти 500 лет то расширялись и разгорались, то угасали на сто и более лет, но потом снова активизировались. Изучение хронологии эпидемий по городам позволило выявить еще несколько пиков активности чумы в Европе: второй (1440–1530 г.), третий (1545–1683 гг.; максимум), четвертый (1710–1830 гг.) и пятый (1899–1931 гг.). Пики неравноценны. Четвертый даже не имел территориальных размахов первого, предпандемического. А пятый (так называемая «третья пандемия чумы») дал всего несколько незначительных по смертности вспышек среди людей (Оппорто, 1899 г.; Глазго, 1900 г.; Неаполь, 1900 г.; Константинополь, 1900-м, 1919–1929 гг.; Одесса, 1902-м, 1910 гг.; Париж, 1930 г.; низовья реки Турия и долина реки Эбро на Пиренейском полуострове, 1931 г.; и др.). Современникам так и не удалось их привести в связь с кораблями и чумными крысами. Вспышки развились на местностях, уже известных как чумные в прошлом. Следовательно, эти пики чумы стали проявлением одного процесса активизации природных очагов чумы в Европе, имевшего свое начало (1346–1382 гг.), максимум (1545–1683 гг.) и угасание (1710–1830 гг.; 1899–1931 гг.).
Пандемии холеры. Возбудитель холеры, V. cholerae, поддерживается в водном резервуаре среди одноклеточных гидробионтов, распространяется среди людей веерно, посредством инфицированной воды. Вызываемые им вспышки «привязаны» к конкретным территориям, и в периоды холерных пандемий, как правило, на этих территориях они повторяются (см. наблюдения Щепотьева Н. К., 1884, 1890). Данные обстоятельства позволяют предположить наличие реликтовых очагов холеры, однако их границы по историческим источникам еще только предстоит установить. В этом аспекте проблемы история холерных пандемий весьма содержательна. По сложившейся в эпидемиологии традиции, начиная с 1817 г. выделяют семь пандемий холеры. Хронологически их появление совпадает с переходом от малого ледникового периода (XII–XVII вв.) к общему постепенному потеплению в северном полушарии. Холера практически везде (за исключением Индостана и прилегающих к нему регионов) врачами рассматривалась как «новая болезнь». Стереотип восприятия холерных пандемий на протяжении почти полутора веков заключался в том, что все холерные пандемии начинаются в Индии, а «затем по путям человеческих сношений холера распространяется по всему миру». Распространение холеры объяснялось экспансией европейских стран на Восток и значительным расширением международных контактов, создавших новые условия для развития эпидемий холеры (Гезер Г., 1866; Гамалея Н. Ф., 1905). Но если смотреть по конкретным территориям, то еще в XIX в. было замечено (Щепотьев Н. К., 1884, 1890), что она появляется там, где раньше свирепствовала чума (Марсель, Барселона, Москва, Лондон). Здесь я прошу читателя обратить внимание на то, что чума до начала XIX в. в течение почти 500 лет занимала совсем иные территории, чем она занимает сегодня (см. «Реликтовые очаги чумы»).
Холера не появилась в Европе внезапно, будучи «занесенной» из Нижней Бенгалии. Так же как и чума, до общеизвестных пандемий она давала о себе знать отдельными вспышками болезни. Поэтому в сочинениях многих врачей средней и северной Европы XVII в. холера упоминалась под названием «белого натужного поноса». К ней относятся вспышки болезни, которые наблюдал Т. Сиденгем с 1669-го по 1672 г. и в 1679 г. в Лондоне. Но с приходом холерных пандемий и появлением их удобного контагионистического объяснения местные вспышки как-то надо было научно объяснять. Тогда холеру разделили на две формы: азиатскую (cholera asiatica), которую считали «приходящей» из нижней Бенгалии; и так называемую cholera nostras, т. е., европейскую холеру или нашу холеру. Болезнь встречалась в виде спорадических случаев среди бедных слоев населения в середине или в конце лета, чаще всего в августе, особенно в жаркие годы. Различия между этими болезнями по клиническим симптомам не проводились, так как их и не возможно было провести из-за полного сходства, но считалось, что это две разные болезни «с этиологической точки зрения » (см. у Гризингера В., 1866).
Патолого-анатомических различий между азиатской и европейской холерой также не удавалось установить. Даже после открытия Р. Кохом холерного вибриона, по сложившемуся стереотипу представлений, обе холеры «этиологически» продолжали разделять, хотя один и тот же вибрион находили в кишечнике и испражнениях больных как европейской, так и азиатской холерой (см., например, работу Раскиной М. А. и Афанасьева М. И., 1892). В начале ХХ в. упоминания о cholera nostras просто исчезли из учебников и монографий, с эпидемиологией холеры (как и чумы!) уже все было ясно. И если она где-то появлялась отдельными вспышками или случаями, это означало только то, что санитарные службы не уследили за перемещением людей, прибывших из эндемичных по холере регионов.
Общая тенденция в появлении вспышек холеры во время ее пандемий в северном полушарии аналогична «поведению» чумы во время ее первой и второй пандемий — с юга на север и с востока на запад. Во время каждой пандемии оставались местности, в которые холера никогда «не заносилась», сами же пандемии «рассыпались» на сотни вспышек, связь между которыми можно было установить, только встав на позиции средневековых контагионистов. Кратко, по работам Г. Гезера (1866); Г. Ф. Архангельского (1871, 1874); Г. Ф. Вогралика (1935); О. В. Барояна (1967, 1971); и Н. Ф. Гамалеи (1905, 1910), рассмотрим эти пандемии.
Первая пандемия холеры (1817–1823 гг.). В эти годы глобальная ситуация по холере только начала «раскачиваться», примерно так, как это было во время первого цикла чумы Юстиниана или периода 1346–1351 гг. времен «черной смерти». Толчком к активизации реликтовых очагов в 1815–1817 гг. послужили климатические изменения, произошедшие за годы, предшествовавшие «выходу» возбудителя холеры за пределы Индостанского полуострова.
По данным Е. П. Борисенкова и В. М. Пасецкого (1988), в первые два десятилетия XIX в. лето в Европе отличалось исключительным обилием влаги. Дожди начинались в мае и шли до конца августа. В ноябре 1819 г. в Западной Европе снова цвели деревья. В России весны стали ранними, но холодными. Лето засушливым. С начала 1820-х гг. в Европе все чаще стали наблюдаться засушливое лето и необычно теплая длительная осень. В России засуха стала губить урожаи даже в Западной Сибири. К середине 1820-х гг. продолжительность холодного времени года резко сократилась, весна стала ранней, и лето повсеместно засушливым. Неурожаи появились не только в России, но и в Европе.
Значительные погодные аномалии дали о себе знать в 1817 г. в Индии. Количество осадков в том году в Бомбее, где оно обычно доходит до 78,54 английских дюймов, достигло 103 дюйма. При этих обстоятельствах и в одно время во многих местностях Индостана начались масштабные вспышки холеры (в Бихаре уже в 1816 г.). В мае 1817 г. впервые она появилась в Поддии, в районе слияния многочисленных рукавов Ганга; в июне холера обнаружилась в Нусерабаде, в июле — в Пaтне и во многих местностях вдоль Ганга (Гезер Г., 1866). Эта эпидемия в Бенгалии еще резко не отличалась от тех, которые имели место в предшествующие годы, но с нее началось «извращение» в распределении холерной смертности в Индии по месяцам года. А именно, в 1815-м и 1816 гг. смертность от холеры имела свой максимум в сентябре и в октябре, тогда как минимум падал на апрель и май. Страшная эпидемия 1817 г. имела также наибольшее напряжение в сентябре. Но на следующий год максимум заболеваемости оказался уже перемещенным на март и апрель. Затем дождливое время (с июня по сентябрь) сопровождалось уменьшением смертности от холеры, которая снова поднялась в ноябре. Таким образом, создалась типичная кривая на начало ХХ в. месячного распределения холерных случаев в Калькутте двумя максимумами в феврале и ноябре и с минимумом, соответствующим периоду дождей (Гамалея Н. Ф., 1905).
Первая пандемия началась в Бихаре (Индия) в 1816 г. Затем холера вспыхнула на юге Индии, на Цейлоне, в Африке, Китае, Аравии, Месопотамии, Сирии, Иране, России (от Баку до Астрахани, где «взяла» 200 жизней), Филиппинах и Японии.
Запущенные глобальными климатическими сдвигами изменения в среде обитания холерного вибриона после 1823 г. (окончание первой пандемии холеры) уже не вернулись к исходному состоянию начала XIX в. — сholera nostras «превратилась» в азиатскую холеру. Колебания системы, образуемой холерными вибрионами и гидробионтами, стали самоподдерживающимися и быстро нарастающими из-за совпадения с колебаниями других сложно опосредованных экологических факторов, вызванных продолжающимся глобальным изменением климата. Каждая последующая пандемия имела свой «ход» (т. е. свою последовательность активизации холерных очагов, на которой не отразились ни прорытие Суэцкого канала, ни развитие транспортных коммуникаций — в этом легко убедиться из работ современников этих пандемий — ученых XIX в.) и распространялась севернее предыдущей, пока они как бы не «оборвались» в 1920-х гг.
Вторая пандемия холеры (1826–1837 гг.) «продвинулась» гораздо дальше на север, чем первая. Началась эпидемией в Бенгалии и затем охватила всю Индию. Вскоре холера дала о себе знать на Ближнем Востоке, в Иране, Закавказье, Китае, Афганистане, Бухаре, оттуда она «прорвалась» до Оренбурга. В России холера распространялась в поволжских регионах (но против течения Волги!), по Черноморскому побережью, затем «рассыпалась» отдельными вспышками в направлении с востока на запад по большинству российских губерний. Холера широко распространилась в Западной Европе, Америке и Австралии. В течение всего 6 лет (1826–1832 гг.) очаги холеры почти синхронно сформировались на огромном пространстве, охватывающем Европу, Азию, северное побережье Австралии и оба Американских континента. Глобальное распространение холеры сопровождалось ее «проникновением» в «холодные районы» планеты (Архангельск в Северном; и Вальпараисо в Южном полушарии).
Интересно отметить, что холера в Германии в разгар эпидемии так и не «проникла» в ряд городов: ее не было в Мекленбурге, Ганновере, в Саксонском государстве, даже в Лейпциге, который не прекращал своих весьма оживленных сообщений с пораженным холерой Галле. Холера не «проникла » в Гессен, Брауншвейг и гористые местности Тюрингена, тогда как в нижележащей Иене было очень много тяжелых случаев заболеваний «спорадической холерой». Такой же «незаразимостью» отличались Ангальт, Гессен, Брауншвейг. В великом герцогстве Веймарском было несколько случаев холеры в деревнях близ Эрфурта, в котором эпидемия привела к гибели многих граждан. Город Веймар, несмотря на постоянную связь с пораженным холерой Эрфуртом, оставался свободным от эпидемии. Отсутствие холеры в ряде указанных городов и местностей пытались объяснить принятыми против нее мерами, хотя в пораженных и не пораженных холерой германских городах меры против нее были приняты те же.
В 1834 г. холера «обосновалась» на юге Европы и достигла широтного максимума на ее севере. Она появилась сначала в южной части Швеции, потом в Гётеборге и далее «проникла» до 60∞ с. ш. Наиболее интенсивные вспышки холеры, как правило, происходили вокруг больших озер. В середине августа она обнаружилась в Стокгольме, где из 7889 больных умерло 3278 (41,5 %). Меньших размеров достигла холера в Норвегии.
Во время третьей пандемии (1844 –1864 гг.) активность реликтовых очагов холеры еще более возросла. Количество заболевших и скорость распространения холерных эпидемий были значительно большими, чем во времена предшествовавших двух пандемий. Одновременно возросла смертность заболевших людей. Холера 1848 г. была самая смертоносная из всех, когда-либо поражавших Россию.
Пандемия началась с активизации холерных очагов к северу и к северо-западу от Индостана. Холера появилась Лагоре, Кашмире и Афганистане. В июне 1844 г. она поразила Кабул, в июле — Герат, в сентябре — Бухару и Самарканд; в конце года — Персию. В сентябре 1847 г. холера вспыхнула на турецком побережье Черного моря, опустошила Трапезунд и многие населенные пункты Малой Азии. Первый случай холеры в Европе имел место в Константинополе в августе. Одновременно с активизацией холерных очагов на берегах Черного и Азовского морей аналогичный процесс осуществлялся в направлении на север, к Азиатской и Европейской России. С апреля 1847 г. эпидемия холеры стала принимать угрожающие размеры на Кавказе, захватив Кубу и Дербент. В мае холера была в Кизляре. В июне холера появилась в Георгиевске, Моздоке, Пятигорске; в июле — в Ставрополе, в Азове, в Ростове-на-Дону, в Астрахани. Затем она последовательно захватила всю Европейскую Россию до Финляндии включительно. В 1849 г. холера вновь «вернулась» в Европу, достигнув Шотландии и Ирландии.
Во время третьей пандемии в России холера так же, как и во вторую пандемию, распространялась против течения рек. Теперь для борьбы с ней не использовались карантины. Но холера не только не стала распространяться быстрее, но и замедлила свой «ход» (табл. 17).
Таблица 17
Сравнение продолжительности «движения» холеры вдоль Волги во вторую и в третью пандемии*
| Холера после ее первого появления в Астрахани обнаружена в городах |
Сутки |
|
| 1830 г. | 1847 г. | |
| Царицын | 12 | 12 |
| Саратов | 18 | 38 |
| Пенза | 28 | 50 |
| Самара | 36 | 66 |
| Симбирск | 43 | 70 |
| Казань | 51 | 63 |
| Нижний Новгород | 38 | 67 |
| Москва | 57 | 76 |
* По К. Г. Васильеву и А. Е. Сегалу (1960).
Как видно из этих данных, холера в 1847 г. распространялась по Волге даже несколько медленнее, чем в 1830 г. В 1850 г. эпидемии холеры повсеместно стали «ослабевать». Зимой 1849–1850 гг. холера давала о себе знать отдельными случаями во многих местах Европы, но общее количество заболевших было невелико. С наступлением теплого времени года обнаружились новые эпидемии, но пандемия уже теряла свою силу. В 1853 г. холерная пандемия начинается как бы заново. По своей сути, это была уже новая пандемия, но так как предыдущая тогда еще не закончилась, то их, после ожесточенных дискуссий, решили объединить в одну. Своей высшей точки эпидемия достигла в августе, когда холера распространилась по всей территории России, «проникнув» далеко в Сибирь, в Тобольскую и Томскую губернии. Чудовищно пострадала от холеры Северная Европа. В Италии в 1854 г. холера достигла невиданных ранее размеров.
В 1856 г. территории, занятые холерой, начинают сокращаться. Эпидемии отличаются гораздо меньшей напряженностью. В 1859 г. произошло резкое усиление холеры в России, в Германии, Бельгии, Испании, Дании и Швеции. Но с 1860-го по 1862 гг. пожар холерной пандемии в Европе, Африке и Америке угасает. В Азии холера в эти годы продолжала свирепствовать в Индии, Китае, Японии, а также в Персии, Афганистане, Хиве, Туркестане, Месопотамии и Аравии. В 1860-м и 1861 гг. в России отмечены лишь единичные заболевания. До 1865 г. случаи холеры на территории России не регистрировались. С 1863 г. Европа и Америка уже не имели у себя холерных вспышек.
Всего за время третьей пандемии в Европе заболело около 6 млн и погибло около 2,5 млн человек. Из них около 1,7 млн заболеваний с 40 % смертности приходится на Россию (Архангельский Г. Ф., 1874).
Четвертая пандемия холеры (1865 –1875 гг.). К 1863 г. по всей территории Индии холера практически прекратилась и обнаруживалась только в Бенгалии и на Гангесской равнине. Но в 1864 г. она снова распространилась по полуострову до западного берега. В следующем, 1865 г., уже в апреле холера появилась в Геджасе (западный берег Аравийского полуострова), к концу апреля холера свирепствовала в Мекке и Медине, в мае она объявилась в Египте. Вместо традиционного «проникновения» из Индии в Европу как бы по территории России (в контагионистическом представлении!) она неожиданно «появилась» во Франции (Марсель), на восточном берегу Италии и в Константинополе.
В России холера объявилась 1 августа 1865 г. в Подольской губернии, Балтском уезде, в селении Боршах. В тот год холера распространялась весьма медленно и имела ограниченные размеры. Она ни в одной из пораженных губерний не достигала такой степени интенсивности, как в 1848-м или 1830 гг. Эта эпидемия в России как бы составляла только окраины района будущей эпидемии, имевшей центральное гнездо в других местностях. Всего в Европейской России в этом году холерой заболело 13 315 человек, из них погибло 4177.
В следующем году очаги холеры начали вспыхивать с запада на восток и с юга на север, «пропуская» огромные территории. В июне в один день (14-го) холера появилась в Херсонской и Петербургской губерниях (в Петербурге и Кронштадте). Затем вспышки холеры начались в Таврической (15-го), Екатеринославской и Полтавской (1-го), Харьковской (23-го), Курской и Орловской (?), Черниговской (25-го), Гродненской (11-го) губерниях и др.
Главным центром эпидемии в Европейской России в тот год была местность, занимаемая Бессарабской областью и Подольской губернией. Интенсивность эпидемии (% умерших на 1000 жителей) в Бессарабской области составила 6,5 %, в Подольской — 5,4 %. В губерниях же, окружающих эту местность, интенсивность эпидемии была еще меньше. Далее интенсивность эпидемии была очень слабо выражена в губерниях, лежащих на юго-востоке от этой местности. Но губернии, расположенные по направлению на восток и на север, были поражены сильнее. Всего в этот год в России зарегистрировано 298 853 холерных больных, из них умерло 72 386.
В Европе холера, видимо, приобрела значительно более тяжелый характер, чем в России. Только в Австрии в 1866 г. умерло от холеры почти столько же людей, сколько и в России — 234 920. В 1867 г. заболеваемость холерой повсеместно снизилась, но в 1871–1872 гг. Россия вновь вступает в полосу холерных катастроф. В 1871 г. наибольшей интенсивности холерная эпидемия достигла в Тамбовской (6,7 %), Воронежской (5,0 %), Ярославской (6,2 %), Московской (5,6 %) и Могилевской (5,0 %) губерниях. Всего в Европейской России холерой тогда заболело 322 711 человек, из них умерли 124 831. В 1872 г. центр эпидемии вновь сместился на местность, занимаемую губерниями: Киевской (интенсивность эпидемии 9,0 %), Подольской (6,6 %), Волынской (6,4 %), Черниговской (6,0 %), Полтавской (5,0 %), Екатеринославской (5,7 %) и Могилевской (5,0 %). Холерой заболело 310 697 человек, из них погибли 113 196.
В 1873–1874 гг. азиатская холера прекращается на всей территории Европы и России. Во всяком случае, так тогда считали. Во время этой пандемии было установлено, что напряженность холерных эпидемий отнюдь не растет пропорционально увеличению и улучшению путей сообщения и перевозочных средств.
Пятая пандемия холеры (1883 –1896). С 1875 г. холера активизировалась в Индии, на юге Китая, в Японии с крайне высокой смертностью среди населения, но в Россию и Европу она «не проникла». К 1883 г. в Индии холера практически угасла. Та же тенденция наблюдалась еще в течение нескольких лет. Поэтому связать вновь вспыхнувшие эпидемии пришлось уже c другим источником «холерного контагия». Теперь холера «началась» из Саудовской Аравии, из Геджаса (Хиджас), где с 1875 г. не прекращались холерные вспышки. В мае 1883 г. число холерных заболеваний в Аравии резко возросло, тяжесть их значительно повысилась. Но в этом же году холера посещает целый ряд китайских договорных портов, Маньчжурию.Европа осталась пощаженной, как тогда считали, благодаря учреждению карантинов в английских портах и на всех пунктах Средиземного моря.
В 1884 г., 26 апреля, когда все прилегающие к Средиземному морю страны, не исключая Египет, не имели ни одного холерного заболевания, холера неожиданно «занеслась» во Францию, в Тулон и в Марсель. Затем она очень быстро распространилась почти на всю южную Францию, где проявила себя в «мягкой форме» (в 280 местах было выявлено около 12 тыс. заболевших и 5 тыс. смертельных исходов, тогда это считалось «мягкой формой эпидемии»). В августе холера проникла в Италию, «прорвавшись сквозь карантины», вернее вообще мимо них. Сначала холера появилась в Северной Италии (Специя), а затем в Неаполе, Женеве, северной Франции, в Париже. Началось очередное холерное побоище. За 1884 г. население Европы потеряло от холеры 21 тыс. человек. Но с этого времени началось неуклонное, хотя и неровное, скачкообразное распространение холеры по странам мира. Волны эпидемий как бы перекатывались с одного континента на другой, нередко возвращаясь и давая новые эпидемические взрывы в странах, где незадолго перед этим, как казалось, болезнь совсем исчезла.
В Российской империи холера началась в мае 1892 г. Первый случай болезни, по данным Д. И. Впрюжского (1895), консультанта Николаевского военного госпиталя, имел место в ауле Кахки, расположенном вблизи станции Закаспийской железной дороги. Так как холерный вибрион уже был открыт Кохом, то объяснение начала эпидемии не вызвало никаких затруднений — холера «занесена», так как началась на станции. Звенья эпидемических цепочек соединили следующим образом.
18 мая, т. е. через 6 дней после начала эпидемии в Мешхеде (Персия), здесь заболел холерой торговавший в селении хивинец и к вечеру 19 мая умер. Последующим дознанием установлено, что сам хивинец до своей болезни не отлучался из аула и не получал товаров из местностей, пораженных холерой. Но впоследствии выяснилось, что за 4 дня до его заболевания в аул прибыл из персидского города Арчиньян перс, который заболел холерой 24 мая (!) и в тот же день умер. В соответствии с контагионистиче скими воззрениями Коха, этого человека, умершего от молниеносной холеры, назначили «переносчиком холерной заразы из Персии в Закаспийскую область».
Вскоре холера появилась в Астрахани и стремительно распространилась вверх (!), против течения Волги. Холерные эпидемии вспыхнули в Ставропольской губернии, в Терской и Кубанской областях до Ростова-на-Дону. Затем она распространилась по всему югу России. К началу июля пожар эпидемии уже охватил все побережье Волги, Камы и Вятки. Холерные эпидемии начались в центральной черноземной области. Они поразили Владимирскую, Московскую губернии. Большое количество заболеваний холерой зарегистрировано в Москве, Петербурге, Орловской, Тамбовской, Тульской, Пензенской и других центральных губерниях. Всего в 1892 г. в России было поражено 77 губерний и областей страны, заболело 604406 и умерло 295744 человека. Кроме Германии в этом же году холера дала небольшое количество заболеваний в Австро-Венгрии, Бельгии, Нидерландах, Франции. В 1894-м и 1895 гг. количество заболеваний холерой в России начало уменьшаться.
В 1895 г. большая эпидемия наблюдалась только в Волынской губернии, где заболело 28 тыс. человек. В том же году холера появилась на Дальнем Востоке, в Приморье, но ограничилась там небольшой эпидемией. Всего она зарегистрирована в 10 губерниях страны. Этот год был последним холерным годом в России в XIX в. В 1897 г. холера почти исчезает с мировой сцены, и только в некоторых азиатских странах тлеют еще искры пожара эпидемии. Пятая пандемия холеры считается закончившейся.
Шестая пандемия холеры (1900 –1926 гг.). Самая необычная пандемия из известных. Холера вспыхнула в тех высоких широтах, где ее ранее не фиксировали. Первая волна охватывала 1902–1911 гг., вторая — 1913–1926 гг. и ее связывали с войнами (балканская, Первая мировая война, гражданская война в нашей стране). Пандемия вновь началась в Индии. В 1901 г. она охватила французскую Индию, Индокитай, Японию, Суматру, в 1902 г. была уже в Китае и Японии, поразила острова: Борнео, Целебес, Яву, а также Филиппины, Персию, Аравию, Египет. Затем распространилась по Месопотамии, охватила всю Малую Азию до Черного моря, среднюю Aзию и Самарканд, в 1904 г. вспыхнула в Баку и в Астрахани. «Поднялась» по Волге до Самары и с наступлением зимы затихла. В 1907 г. холера снова появилась в Поволжских губерниях, а затем и в юго-западном крае (Киев). В 1908 г. холера распространилась еще севернее, в сентябре она была в Петербурге, Кронштадте, Выборге, Нарве, Ревеле, Риге. Из южных городов — в Одессе, Киеве, Херсоне, Феодосии, Таганроге. В 1909 г. вспышки холеры в разных городах России продолжались в Саратове, Самаре, Ростове-на-Дону, Новгороде, Баку. Единичные заболевания наблюдались в различных пунктах западной Европы. В 1910 г. особенно пострадали от холеры Петербург, Киев, Оренбург, Екатеринославская и Подольская губернии. В осенние месяцы холера была сильна в Турции, Болгарии и Румынии и «проникла» в Италию. В этом же году была холерная вспышка на острове Мадейра. В 1911 г. холера усилилась в Италии, дала вспышки в Австрии, Турции, южной Франции, в России же затаилась. Вспышки холеры наблюдались на Балканском полуострове во время первой и второй Балканских войн в 1913 г. В 1914 г. со вспыхнувшей общеевропейской войной создались благоприятные условия для оживления холеры на Балканском полуострове и в Галиции. В 1915 г. холера получила значительное распространение по России, особенно в прифронтовой полосе. К 1917 г. холера в армии прекратилась вовсе, и среди мирного населения было очень мало случаев заболеваний ею. В период гражданской войны в России (1918–1922 гг.) холера вновь широко распространилась по России. Всего 37 губерний европейской части СССР, Кавказа, Сибири и Средней Азии были охвачены вспышками холеры, нередко не прекращавшимися и зимой. Только к 1925 г. эта пандемия прекратилась совершенно.
После 1926 г. холера снова становится болезнью, локализованной в определенных районах Азии. Такое благополучие, длившееся почти 34 года, само по себе загадочно, так как приходится на период Второй мировой войны. Несмотря на колоссальные миграционные потоки людских контингентов, значительную активизацию холерных очагов в Индии, она не получила пандемического распространения.
В послевоенный период «торжество человеческого разума, победившего грозную болезнь», уже стало столь очевидным, что не требовало никаких доказательств. В 1958 г. на Всемирной ассамблее здравоохранения было заявлено, что холера больше не представляет реальной угрозы человечеству и идет на «спонтанное исчезновение». Инфекцию же, вызываемую вибрионом Эль Тор, рекомендовано вообще не считать холерой. Но, видимо, не все решения, которые принимает человек, становятся обязательными для природы. В 1961 г. началась новая (седьмая) пандемия холеры, вызванная вибрионом Эль Тор. Эта пандемия продолжается и в настоящее время, но такого масштаба, как шестая пандемия, она не приняла.
Таким образом, по пандемиям холеры XIX–XX вв. мы наблюдаем ту же закономерность, что и по пандемиям чумы в XIV–XIX вв., только «сжатую» по времени. Первая пандемия (1817–1823 гг.) с предшествующими ей вспышками в разных регионах мира cholera nostras — предпандемия, далее максимум пандемии — то, что мы называем третьей (1844–1864 гг.) и четвертой пандемиями (1865–1875 гг.), и ее угасание в 1920-х гг. Седьмая пандемия уже непроявляет себя традиционной для азиатской холеры смертностью и ареалом, включающим самые северные территории Европы. Следовательно, пандемии холеры с первой по шестую представляли собой единый процесс, который закончился в первой половине ХХ в.
Пандемии гриппа. По мнению отдельных исследователей, вирус, возбудитель гриппа, поддерживается в природе как сапроноз (см. работу Э. И. Коренберга, 2006). Такой же вывод можно сделать, анализируя некоторые особенности гриппозных эпидемий и пандемий (более подробно см. разд. 2.1). Тогда первичный резервуар вируса гриппа относится к водному типу. Основные хозяева вируса — простейшие.
Эпидемиология гриппа при внимательном изучении отдельных эпидемий любой из известных пандемий далеко не так очевидна, как это представляется в отдельных учебниках для медицинских вузов (например, у Шуваловой Е. П. с соавт., 2001).
Наиболее часто историки медицины первую эпидемию гриппа относят на 1173 г., когда была описана серия из следовавших друг за другом эпидемий лихорадочной катаральной болезни в Италии, Германии и Англии. С середины XVI в. грипп не сходит со страниц эпидемиологической хроники, поэтому я не буду описывать его историю до пандемии 1889–1892 гг., предшествовавшей смертоносной «испанке» 1918–1921 гг. Более подробно с историей пандемий гриппа можно знакомиться по работам Г. Гезера (1866), Н. А. Протасова (1891) и Г. Ф. Вогралика (1935). Ниже приведу только отдельные закономерности, прослеживающиеся в описаниях этих пандемий.
1. Большинство зафиксированных пандемий гриппа имели двух- или трехволновый характер и не сопровождались большой смертностью населения. Например, пандемии 1780–1782, 1830–1833 и 1889–1892 гг.
2. Обычно большое число погибших наблюдается во время вспышек гриппа, привязанных к отдельным местностям и/или этническим группам. Например, вспышки гриппа в Сибири в 1843-м и 1858–1859 гг. смертельными были только для некоторых «туземных» народностей; пандемия 1729–1730 гг. наиболее тяжелые осложнения дала в отдельных местностях в Соединенном Королевстве и в Италии.
3. Гибель людей во время пандемий и вспышек гриппа имела место на фоне осложнений со стороны органов дыхания (пневмонии, плевриты, абсцессы), поражения ЦНС (помрачение сознания, энцефалиты, гипертермия и др.), нарушения гемодинамики (обычно описывается врачами как «нарастающая слабость») и системы свертывания крови (петехии, кровотечения и кровоизлияния различной локализации). За время одной пандемии на разных территориях и в разных этнических группах характер таких осложнений был различным (например, у бурят и русских во время вспышек гриппа в Сибири в 1858–1859 гг.).
4. «Скорость» распространения гриппа по планете во время масштабных пандемий прошлого практически не отличалась от той, которую приписывают современным пандемиям, объясняя это явление возросшей способностью человека к перемещениям. Например, пандемия 1580 г., начавшись в июне одновременно в Сицилии и в Нидерландах, «обошла» в течение 6 месяцев всю Европу и распространилась на Североамериканский континент, Африку и на Восток. Пандемии 1780–1782, 1847–1847, 1889–1892 гг. распространялись с той же скоростью, что и пандемии «испанки », Азиатского гриппа или Русского гриппа в ХХ в.
5. Нет территорий, для которых было бы установлено, что именно с них всегда начинаются пандемии гриппа, сама пандемия может «двигаться» в разных направлениях. Например, масштабная эпидемия гриппа 1510 г., охватившая почти всю Европу, началась на Мальте и «двинулась» на север, северо-восток и северо-запад. Пандемии 1557-го и 1580 гг. начинались на Сицилии и распространялись в направлении с запада на восток. Пандемия 1729–1730 гг. «шла» с востока на запад, начавшись в России в апреле 1729 г. С разных направлений могут «двигаться» и волны, составляющие одну пандемию. Грандиозная пандемия 1780–1782 гг. состояла издвух волн: волны 1780 –1781 гг., «шедшей» с северо-запада Европы, когда она обошла Францию, Германию, Россию, Италию и Северную Америку. И волны 1781–1782 гг. На этот раз пандемия началась в Китае или в Индии и «шла» в противоположном направлении. Пандемия гриппа 1830 –1833 гг.
началась в Китае в сентябре. Пандемия гриппа 1836 –1837 гг. началась в Австралии и ограничилась Восточным полушарием.
Кратко по работам А. Перуанского (1919); П. И. Диатроптова с соавт. (1919); Н. А. Старковой (1921); А. А. Садова (1927); Д. М. Российского (1942); К. Г. Васильева, А. Е. Сегала (1960); А. А. Смородинцева, А. А. Коровина (1961); О. В. Барояна (1967); Х. Андревса (1970); Д. М. Злыдникова с соавт. (1971); Г. Л. Ерусалимчика с соавт. (1971); Г. И. Карпухина (1985), рассмотрим пандемии конца XIX и ХХ вв.
Пандемия 1889 –1892 гг. на территории Российской Империи началась в Бухаре, куда, как тогда предполагали, она «проникла» из Китая. В феврале 1889 г. эпидемии гриппа начались в Европейской России. Первые заболевания гриппом в Петербурге начались в октябре, а к середине ноября число заболевших достигло 150 тыс. В Москве эпидемия появилась в начале ноября; в этом же месяце она охватила Польшу, Германию, Австрию, Данию, Бельгию и Францию (в Париже за одни только сутки заболело 50 тыс. человек). В декабре грипп проник в Северную Америку, в январе 1890 г. — в Египет и Алжир. В феврале эпидемия обнаружилась в Индии, в апреле, заканчивая свое кругосветное путешествие, она захватила Австралию. Финалом эпидемии считают вспышку гриппа в Абиссинии осенью 1890 г. По оценкам специалистов того времени, всего в пандемию 1890 г. переболело до 50 % населения земного шара. Новая волна пандемии, поднявшаяся в начале 1891 г., захватила Америку и страны Северной и Западной Европы. С осени 1891 г. до весны 1892 г. через Европу, а затем через другие части света, прошла третья волна этой большой пандемии, «остатки» которой наблюдались в некоторых районах земного шара в 1893-м и 1894 гг. Первая волна характеризовалась большой заболеваемостью и незначительной смертностью. Во время следующих волн заболеваемость была меньшей, но смертность намного большей.
Во время этой пандемии катаральные симптомы отошли на задний план. Резко бросались в глаза крайняя степень прострации, слабость и угнетенность; часто наблюдалась также боль во лбу, в глазных яблоках и в мышцах. Длительность болезни была 3–5 дней; в тяжелых случаях часто развивались бронхиты и пневмонии, особенно в конце эпидемии; но общая смертность, зависевшая в ту пандемию главным образом от легочных осложнений, была незначительна. По данным серологической археологии, пандемия 1889–1892 гг. была вызвана вирусом серотипа Н2N2.
После большой пандемии 1889–1892 гг. в Европе продолжали появляться небольшие эпидемии гриппа. Наиболее тяжелая из них охватила Европу в конце XIX века. Но даже во время Первой мировой войны грипп появлялся сравнительно редко.
Пандемия гриппа 1918–1920 гг. («испанка»). В каком регионе мира начались первые эпидемии «испанки», неизвестно. После войны выдвигались разные гипотезы по этому поводу. Достоверно установлено только то, что она началась весной 1918 г., а катастрофический характер сначала приобрела во Франции. По данным серологической археологии, пандемия 1918–1920 гг. была вызвана вирусом серотипа Н1N1.
По своей клинической картине болезнь в некоторых группах населения напоминала легочную чуму. Последнее обстоятельство в связи с массовостью заражения людей и быстрым распространением гриппа по Западной Европе, с одной стороны, внезапным началом и бурным течением болезни с частыми летальными исходами — с другой, обратило на себя общее внимание и создало у современников, знакомых с гриппом только по пандемии 1889–1892 гг., взгляд на эту болезнь, как на новое эпидемическое явление. Но это не так. Исторические источники свидетельствуют, что пандемия «испанки» была не первой из пандемий гриппа, сопровождавшейся большой смертностью населения (табл. 18).
Таблица 18
Гриппозные пандемии и эпидемии XVI–XIX вв., которые, по восприятию современников, сопровождались большой смертностью населения*
| Годы | Масштабы | Клинические особенности |
| 1580 | Европа, Североамериканский континент, Африка, Восточные страны | Подробностей нет, но отдельные вспышки по смертности сравнивали с чумой |
| 1626 | Италия, южная часть Франции | То же |
| 1729–1730 | Европа, Россия | По смертности сравнивали с чумой. Наиболее тяжело болезнь протекала в Италии, Соединенном Королевстве (Лондон), Испании и Франции (Париж). Респираторные и геморрагические явления, нарушения гемодинамики, симптомы поражения ЦНС. В Англии наблюдали петехиальные сыпи |
| 1836—1837 | Австралия, остров Ява, Индия, Южная Африка, Европа, Россия | По смертности сравнивали c холерой (эпидемии чумы в Европе уже прекратились и были забыты). Тяжелое течение болезни отмечалось в Западной Европе. Пневмонии, поражения ЦНС, выраженные геморрагические явления, воспаления глаз, какие-то сыпи |
| 1843 | Север Сибири (район не указан) | Очень тяжелое течение болезни среди «туземцев». Основные поражения со стороны легких и ЦНС |
| 1858–1859 | Сибирь (район Иркутска) | Тяжелое течение болезни у бурят. Поражения со стороны легких и ЦНС, геморрагические явления, нарушения гемодинамики, отеки, поражения печени, органов слуха |
* Обобщено по данным Г. Гезера (1866), Н. А. Протасова (1891) и Г. Ф. Вогралика (1935).
В конце апреля 1918 г. эпидемия гриппа охватила Париж. Одновременно она вспыхнула в Италии. В мае грипп распространился по Испании, Швейцарии, Португалии, Италии, Сербии, Греции. В июне — по Англии, Румынии, Швеции, Германии. В июле — по Дании, Голландии, Бельгии, Скандинавским странам и Польше.
Еще в мае «испанка» объявилась в Северной Африке, а в июне дала первые очаги в Индии (Бомбей, Калькутта, Мадрас). Затем число случаев болезни, достигавшее довольно крупных цифр при очень малой смертности, стало убывать. В августе количество заболевших резко снизилось, что было принято за конец пандемии, но эти эпидемические события оказались только ее первой волной.
После нескольких месяцев «затишья» накатилась вторая волна пандемии, во время которой заболеваемость была ниже, но смертность выше предыдущей. Сначала она появилась на западном побережье Африки в Сьерра-Леоне в конце августа 1918 г., потом болезнь охватила все западное побережье Африки. В Северной Америке эпидемия этого типа возникла в октябре 1918 г. в Бостоне, куда, как тогда считали, ее занесли возвратившиеся из Европы солдаты. Первые случаи гриппа второй волны в Польше появились в середине сентября в Кракове. В течение короткого времени эпидемия заняла всю Польшу. Катастрофические размеры вторая волна пандемии «испанки» приняла в Индии, где число смертей ориентировочно оценивали в 5 млн случаев. Наблюдались случаи поголовного вымирания ряда деревень; мертвых не было возможности хоронить, поля оставались неубранными.
К концу второй волны из населенных мест остались пощаженными лишь Мадагаскар, Австралия и Новая Каледония, как тогда считали, благодаря рациональным и строго проводимым мерам профилактики. Окончание второй волны относят на конец декабря 1918 г.
Третья волна пандемии началась в феврале — марте 1919 г. и вновь поразила обширные территории, захватив на этот раз и уцелевшие до сих пор островные колонии. Эта вспышка также отличалась высокой смертностью. Окончилась она в разных местностях не одновременно, растянувшись кое-где до июня и даже августа. Пандемия полностью прекратилась только в 1920 г. Невозможно было определить точное количество переболевших людей. По-видимому, болело не меньше 550 млн человек, а погибло 20–25 млн — более 1 % всей численности населения планеты того времени, составлявшей 1850 млн. Подлинный масштаб трагедии стал ясен только после завершения пандемии (рис. 65).
Рис. 65. Число смертельных случаев от гриппа в крупнейших городах мира на 1000 человек населения во время трех волн пандемии гриппа в 1918–1920 гг. По Д. М. Российскому (1942)
Странно только то, что эти пики совпадают во времени (например, Нью-Йорк, Лондон, Париж). Если пандемия распространяется путем перемещения людей, то и максимумы заболеваемости должны бы отражать их перемещения, сначала грипп начался в одном населенном пункте, потом инфицированные вирусом гриппа люди занесли его в другой, пусть даже через Атлантический океан.
В России первая волна гриппа не была масштабной и осталась незамеченной. Но потом в Россию пришла вторая волна эпидемии. В августе — сентябре 1918 г. Сначала эпидемия разразилась на Украине, дав в Киеве до 700 тыс. заболеваний, т. е. почти поголовно поразив все население; смертность составила 1,5 %. В русских губерниях «испанская» болезнь впервые появилась в Мстиславле (Могилевская губерния) 13 августа 1918 г. и сразу вылилась в эпидемию большого масштаба. Но грипп «не спешил» в густонаселенные города. В конце августа грипп вспыхнул в Бирючах (Воронежская губерния), в самом же Воронеже и его уезде грипп зафиксирован только 15 октября. Тогда же болезнь появилась в Рязанской,Курской, Смоленской, Петроградской и Орловской губерниях. Несколько позже, 28 августа, заболевания гриппом зарегистрированы в Перми и Пермской губернии, в некоторых уездах Вятской губернии. Отчетливо прослеживался «ход» эпидемии с юго-запада на сeверо-восток, в «обход» Москвы. В Московской губернии массовый характер заболевания «испанкой » приняли в первой половине октября.
Возраст людей, умерших от «испанки», был необычен для гриппозных эпидемий и пандемий прошлого (рис. 66).
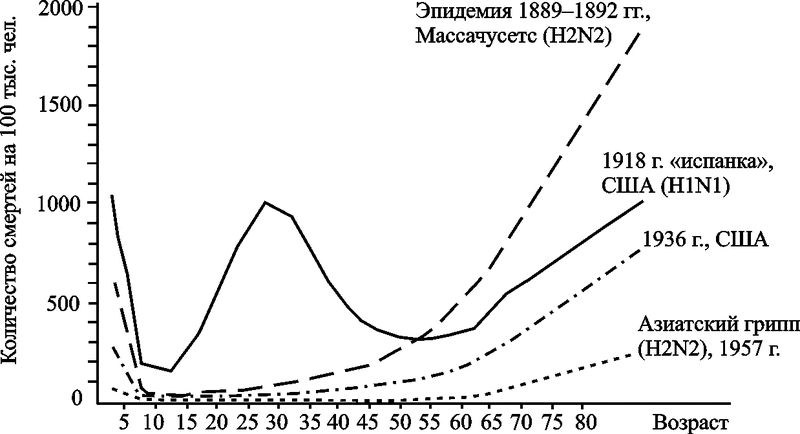
Рис. 66. Гибель людей по возрастам во время гриппозных эпидемий и пандемий на территории США По J. Lederberg (1997)
В Голландии максимум смертности пал на возраст 14–29 лет, в Египте — 10–20 лет, в Англии — 15–35 лет, в Швейцарии — 20–30 лет; в Южной Африке максимальные потери понесли люди 30–50 лет. Во французской армии в 1918 г. из 408 180 заболевших гриппом военнослужащих умерло 30382 человека (смертность 7,44 %). В Японии в январе 1919 г. насчитали 20 млн больных гриппом и 250 тыс. смертельных случаев (смертность 1,25 %).
Алиментарный (водный) путь инфицирования. Воздушно-капельный путь инфицирования вирусом гриппа был не единственным в ту пандемию. В 1919 г. С. Lynch и J. Gumming сообщили об интересных для эпидемиологов фактах, полученных ими при изучении быта 66 тыс. американских солдат в 11 лагерях на территории США. Ими обнаружена огромная разница в заболеваемости гриппом в тех лагерях, где столовая и кухонная посуда мылась, как это делается обычно, в теплой воде (при температуре не выше 40–50°С), и в тех, где пользовались кипящей водой. В первой группе заболеваемость равнялась 252 на 1000, во второй — 51,1; т. е. она была в 5 раз меньше. Наблюдения этих авторов, сделанные на основе такой большой выборки, нельзя игнорировать и они нуждаются в объяснении.
Территории. В отдельные пандемии гриппа всегда находятся строго локализованные местности, на которых развиваются вспышки гриппа, сопровождающиеся массовым заболеванием живущих на них жителей и, соответственно, массовой смертностью заболевших. Рассмотрим этот феномен на примере Исландии.
«Испанкой» на острове было поражено в основном население Рейкьявика, составлявшее тогда 15176 человек (население острова не превышало 80 тыс. человек). Всего в городе заболело 9016 человек, из них погибло 258, т. е. 2,8 % от числа заболевших. Эпидемия длилась с 26 октября по 6 декабря, умирали пациенты преимущественно в возрасте от 16 до 35 лет. Всего на острове от «испанки погибло 484 человека. Фатальные исходы «испанки» были локализованы в основном в церковных приходах южной и восточной частей острова (рис. 67).
Рис. 67. Распределение по церковным приходам смертельных исходов от гриппа «испанки» в Исландии в 1918 г.
Плотность серого цвета отражает количество заболевших гриппом в данном церковном приходе в абсолютных цифрах. Высота черных столбиков показывает пропорцию фатальных исходов в процентах ко всему количеству населения (прихожан) данного прихода. Рисунок свидетельствует о том, что на разных территориях в эпидемический процесс вовлекались штаммы вируса гриппа с разной вирулентностью для людей. По М. Gottfredsson et al. (2008)
M. Gottfredsson et al. (2008) не получили доказательств того, что погибшие были между собой в родственных отношениях, тем самым они исключили возможность элиминации вирусом гриппа людей близких генотипов.
Клиника болезни. В пандемию гриппа 1918–1920 гг. врачам часто приходилось наблюдать чрезвычайно быстро наступающее развитие пневмоний, сопровождающихся обширным поражением легких с большим количеством крови в мокроте, протекавших бурно, с явлениями тяжелой общей интоксикации, с быстро нарастающим поражением сердечно-сосудистой системы, резким падением кровяного давления, помрачением сознания и быстро наступающим смертельным исходом.
Если гибель больного не происходила в первые трое суток, то высокая с самого начала болезни температурная кривая в большинстве случаев за этот период времени снижалась, чтобы снова подняться на более или менее продолжительное время, что было связано с развившимися осложнениями или обострением легочного заболевания.
Степень пораженности дыхательного аппарата воспалительными процессами и геморрагическими фокусами в большинстве случаев настолько очевидно не соответствовала степени ослабления сердечной деятельности, что одним ограничением дыхательной территории легких и, следовательно, затруднением доступа кислорода и накоплением СО2 в крови нельзя объяснить такое тяжелое поражение сердечно-сосудистой системы. Раннее развитие цианоза, иногда только при очень незначительных изменениях в легких, явно противоречило бы такому объяснению. Сопоставляя факты раннего расстройства сердечной деятельности с многочисленными кровоизлияниями и кровотечениями из различных слизистых оболочек, гиперемией мозговых оболочек, кровоизлияниями в мозговую ткань, с изменениями лимфатического аппарата, врачи, наблюдавшие пандемию «испанки», считали, что ее возбудитель (тогда за него принимали бактерию Haemophilus influenzae) обладает сильнодействующими токсинами, которые избирательно поражают систему кровообращения человеческого организма.
Вирус, вызвавший грипп «испанку». J. K. Taubenberger et al. (1997, 2000, 2005) и A. H. Reid et al. (1999, 2000, 2002) установили, что вирус, вызвавший пандемию «испанки», не был «эпидемической новинкой» 1918 г. — его «предковый» вариант «проник» в отдельные человеческие популяции приблизительно в 1900 г. и циркулировал в там почти 18 лет, не вызывая пандемии. Не показано связи этого вируса с вирусами — возбудителями «птичьего гриппа». Например, последовательность НА1-вируса «испанки» отличалась от ближайшего предкового птичьего вируса на 26 аминокислот, в то время как Н2-пандемии 1957 г. и Н3-пандемии 1968 г. различались на 16 и 10 замен, соответственно. Анализ же нуклеотидных последовательностей генов НА показал, что вирус «испанки» проник в популяцию свиней в 1918 г. и циркулировал там не изменяясь, еще не менее 12 лет, не приводя к пандемическим вспышкам гриппа. Этими данными также опровергается теория существования независимых друг от друга свиных и человеческих вирусов гриппа Н1 в период с 1905-го по 1918 г. Вирусы «испанки», циркулировавшие в пандемию 1918–1920 гг. среди людей в разных районах США, практически не отличались друг от друга по структуре генов НА и NA. У вируса, вызвавшего «испанку», не обнаружено никаких мутаций, которые бы объяснили его смертоносность в 1918–1920 гг.
Пандемия Азиатского гриппа. Пандемия гриппа имела две волны (1957 г. и 1959 г.), в некоторых странах, в том числе и в СССР, эти волны делились еще на две. Пандемия началась весной 1957 г., когда в некоторых районах Азии почти одновременно было зарегистрировано резкое увеличение гриппоподобных болезней. Эта эпидемическая волна гриппа в сравнительно короткий период (1–2 месяца) охватила почти все страны Азии. В мае эпидемия проникла в Африку, вызвав здесь сравнительно крупные вспышки в ряде стран. Позднее (июнь — июль) было зафиксировано резкое увеличение гриппоподобных заболеваний в отдельных районах других континентов, в частности в Америке и Австралии. В сентябре и октябре пандемия гриппа широко распространилась в странах Европы и в США. В СССР в марте и апреле 1957 г. регистрировались ограниченные вспышки гриппозных заболеваний в различных географических зонах. Основной подъем заболеваемости гриппом H2N2 (тогда его называли А2) начался в Советском Союзе с первой декады мая. В 1958 г. в странах мира хотя и отмечалась повышенная заболеваемость гриппоподобными инфекциями, однако количество заболеваний было значительно ниже, чем в 1957 г.
Иное развитие получает пандемическая волна 1959 г. В отличие от 1957 г. резкое увеличение заболеваемости гриппом начинается в странах Среднего и Ближнего Востока в конце декабря 1958 г. и в начале января 1959 г. В феврале — марте 1959 г. отмечается заметный подъем заболеваемости гриппом в странах Юго-Восточной Азии. В этот период локальные, но крупные вспышки гриппа были зарегистрированы в Индии, Индонезии и Японии. В мае и июне отмечена высокая заболеваемость гриппом в Австралии, особенно на ее северной территории. В мае эпидемической волной гриппа были охвачены страны Африканского континента. В СССР эпидемия 1959 г. распространилась с юго-востока и к середине января охватила весь Советский Союз и ряд ближайших стран.
При серологическом и вирусологическом обследовании больных было установлено, что эпидемическая волна 1957 г. имела строго моноэтиологический характер, и более 90 % заболеваний было связано с вирусом гриппа H2N2. Во время пандемической волны 1959 г. в значительном проценте (до 30) наряду с вирусом H2N2 был выделен вирус типа В.
Случаи гриппа, клинически и патоморфологически сходного с «испанкой» 1918–1920 гг., были единичными, но тем не менее их наблюдали практически в каждом крупном городе как в 1957-м, так и в 1959 г.
Характерной особенностью таких случаев стало быстрое развитие клиники болезни, приводившее к летальному исходу в течение короткого времени, иногда 1–2 дней, а изредка и нескольких часов от начала заболевания. Как правило, симптомы болезни стремительно нарастали, лечение же оказывалось неэффективным даже при использовании антибиотиков. По обнаруженным морфологическим признакам их делили на две группы. Первая — с преобладанием общих токсических явлений, вызвавших множественные кровоизлияния, дистрофические поражения внутренних органов, отек и полнокровие головного мозга и его оболочек с острыми деструктивными изменениями ганглиозных клеток коры и ствола мозга, при сравнительно слабовыраженном местном легочном процессе. Вторая — с преобладанием местных легочных изменений и в половине случаев имевших характер распространенной геморрагической пневмонии.
Характерной особенностью гриппозного поражения, особенно во время второй волны эпидемии 1959 г., стало быстрое развитие болезни, зачастую приводившее к летальному исходу в течение одного-двух дней, а изредка и нескольких часов от ее начала, что напоминало «токсические случаи» пандемии гриппа 1918–1920 гг.
Также как и при «испанке», во время пандемии Азиатского гриппа далеко не всегда клинические данные о скоропостижной смерти совпадали с патоморфологическими изменениями, обнаруживаемыми на секции. В большинстве случаев патологоанатомы не имели морфологических доказательств «острого, токсического течения гриппа». На вскрытии в легких во многих случаях не удавалось обнаружить пневмонические очаги, а в остальных была картина мелкоочаговой пневмонии с геморрагиями на фоне отека и полнокровия легочной ткани. В мозгу и внутренних органах отмечались сходные изменения (отек, полнокровие, периваскулярные геморрагии), а в клинике наблюдалась картина резкой «интоксикации» с энцефалитическими симптомами. Большая часть таких случаев относилась к детям раннего возраста.
Общие человеческие потери в пандемию Азиатского гриппа достигли одного миллиона человек (Смородинцев А. А., 1971).
Пандемия Гонконгского гриппа (1968–1970 гг.). Пандемия развивалась тремя волнами (1968-й, 1969-й и 1970 гг.) и была вызвана вирусом нового серотипа H3N2. После первых сообщений о новом вирусе эпидемиологи ожидали быстрого распространения серьезной эпидемии глобального масштаба, такой, как эпидемия, вызванная в 1957 г. вирусом гриппа H2N2. Сначала это казалось весьма вероятным. Болезнь появилась в Сингапуре в начале августа и к сентябрю она уже распространилась на другие сопредельные страны, в частности на Индию и северные территории Австралии, но в большинстве районов грипп носил клинически легкую форму, хотя распространился довольно широко. Осенью 1968 г. новый вирус появился в Европе, но и там до начала зимы не было зарегистрировано ни одной большой вспышки. Наиболее опасной была вторая волна пандемии, во время других обычно не отмечали сколько-нибудь значительного повышения смертности.
Сообщения о высокой смертности заболевших гриппом людей во время первой волны пандемии поступали в основном из горных районов Папуа и Новой Гвинеи.
Третья волна пандемии дала о себе знать в конце 1970 г. Затем эпидемические волны резко пошли на убыль. Отмечалась тенденция к увеличению легких форм гриппа и снижению тяжелых форм в последние вспышки 1970–1971 гг.
Феномен «испанки», как и в предыдущую пандемию, встречался отдельными «гнездами». В России он обратил на себя внимание врачей в Куйбышевской области. В отличие от других регионов России пандемия гриппа там не воспринималась как «легкая». По данным Л. В. Захаровой (1970), смертность от гриппа в области в эпидемию 1969 г. была в 33 раза выше, чем в эпидемию 1967 г. Особенно высокой смертность была в разгар эпидемии среди детей первых лет жизни.
Пандемия Русского гриппа (1977–1978 гг.). К концу 1970-х гг. ученым казалось, что о вирусе гриппа и об эпидемиях, им вызываемых, они знают все, или почти все. Новые пандемические вирусы никого не удивляли, их появление пытались даже моделировать с помощью компьютера. Но возвращение в ноябре 1977 г. вируса гриппа H1N1, сходного по антигенной структуре с вирусом, уже циркулировавшим в мире в 1918–1956 гг., стало для современников неожиданным явлением.
С самого начала этой пандемии в «гонке по континентам» не оказалось лидера среди серотипов вируса. В начале 1978 г. вирусы серотипа H3N2 (А/Техас/1/77 и А/Виктория/З/75) вызвали эпидемии в Европе, Африке и Азии, а на американском континенте (США, Канада) обосновался вирус гриппа серотипа H1N1. В марте во всех странах Европы и Северной Америки наступило снижение заболеваемости. Причем в это время во многих странах изолировали одновременно штаммы вирусов гриппа A (H1N1), A/Texac/l/77(H3N2) и реже штаммы А/Виктория/З/75 (H3N2). В СССР в осенне-зимний период 1977–1978 гг. этиологическая структура гриппа была смешанной. Если в сентябре 1976-го — апреле 1977 гг. грипп был вызван двумя типами вируса (H3N2 и В), то в те же месяцы 1977–1978 гг. грипп был обусловлен его тремя серотипами (H1N1, H3N2, В).
По поражаемому контингенту и серотипу вируса, вовлеченного в пандемическое распространение, пандемия Русского гриппа напоминал пандемию «испанки» 1918–1920 гг., однако ее последствия были уже иными.
Первая особенность этой пандемии выявлена при анализе заболевшего гриппом контингента. При распределении больных в нарастающем итоге по всем возрастным группам было установлено, что дети до 2 лет составили 10 % больных, до 6 и 14 лет — 22 и 43 %, соответственно, а лица до 25 лет — 73 %. Эти данные указывают на то, что подавляющее число заболевших в эпидемию 1977–1978 гг. приходилось на людей в возрасте до 20 лет, т. е. на ту часть населения, которая не имела контакта с вирусами гриппа серотипа H1N1, исчезнувшими из циркуляции более 20 лет тому назад. Напротив, лица старше 30 лет составили только 20 % больных, хотя их доля в общей численности населения превышает 50 %, т. е., учитывая низкую заболеваемость в эту эпидемию вообще, люди зрелого и пожилого возраста, имевшие в прошлом контакт с вирусами гриппа H1N1, практически не болели.
Второй особенностью пандемии было сравнительно легкое течение болезни. Так, в 57,8 % случаев оно было легким и в 42,2 % — средней тяжести. Тяжелых форм с выраженной «интоксикацией» не наблюдали. В первую волну эпидемии гриппа, вызванную вирусом H3N2, в 1969 г. на тех же контингентах больных эти же исследователи наблюдали: 24 % легкой и 55 % среднетяжелой и 21 % тяжелой степени заболевания гриппом.
Третьей особенностью пандемии было небольшое количество свойственных гриппу осложнений. Даже геморрагические осложнения в пандемию 1977–1978 гг. были редкостью — не более чем у 3 % стационарных больных.
Подводя итоги эпидемии гриппа H1N1 1977–1978 гг. в СССР, Г. И. Карпухин с соавт. (1979) пришли к парадоксальному заключению, что, несмотря на резкую смену антигенной природы эпидемически актуальных возбудителей, рассматриваемая эпидемия оказалась вполне заурядной и даже наименее интенсивной среди всех прошедших в последние 20 лет эпидемий гриппа. Ее наиболее важной особенностью явился сдвиг возрастного распределения больных в сторону преобладания молодых людей, что объясняется только влиянием иммунологических факторов.
Грипп между пандемиями. Этиология гриппа после пандемии Русского гриппа продолжает характеризоваться выраженной гетерогенностью циркулирующих в популяциях людей штаммов вируса (два подтипа вируса А — H1N1 и H3N2 с несколькими антигенными разновидностями, два варианта вируса типа В и вирус типа С). По данным В. Т. Ивановой с соавт. (2006), вирусологические и серологические исследования материалов от больных и доноров показали, что в России, как и во всем мире, в эпидемическом сезоне 2003–2004 гг. циркулировал вирус гриппа А (H3N2), подобный эталонному штамму А/Фуцзянь/411/02. Значительно реже встречались вирусы серотипа А (H1N1) и В.
В силу массовости охвата населения пандемиями гриппа, воздействие вируса гриппа на генотипическое разнообразие популяций людей должно быть более выражено, чем при пандемиях чумы и холеры. К тому же люди, переболевшие гриппом, в течение почти двух десятилетий сохраняют иммунитет к штамму, вызвавшему пандемию. Поэтому механизмы ограничения пандемий гриппа могут включать не только прекращение активности его природных очагов, но и формирование глобальных иммунных и генетически-резистентных популяций людей. Какой из двух последних факторов является доминирующим в прекращении пандемий гриппа, еще предстоит выяснить. Наблюдения над пандемиями гриппа в ХХ в. дают основания говорить о возможности глобальной многолетней цикличности пандемий гриппа. После пандемии 1918–1920 гг. каждая последующая пандемия гриппа, вне зависимости от типа или серотипа вызвавшего ее вируса (или вирусов), сопровождалась меньшим количеством осложнений, характерных для «испанки», и меньшей смертностью населения, чем предыдущая, что подтверждает выдвинутое нами ранее положение о связи появления осложнений гриппа типа «испанки» с накоплением генотипов людей, высокочувствительных к вирусу гриппа (Супотницкий М. В., 2005). Глобальное снижение восприимчивости населения к вирусу гриппа проявило себя ростом количества циркулирующих на отдельных территориях типов и подтипов вируса, неспособных к «вытеснению» друг друга. Следовательно, в настоящее время мы имеем дело с «хвостом» цикла активизации пандемий гриппа, начало которого уходит в XIX в.
Стадии эпидемических монопроцессов циклического типа. Эпидемии такого типа обычно ассоциируются у людей с морами или поветриями, т. е. с появлениями на отдельных территориях различных инфекционных болезней, уносящих в относительно короткие сроки сотни и тысячи жизней (чума, холера, натуральная оспа и др.). К ним же относятся эпидемии (вспышки) менее смертельных болезней самой различной этиологии, такие как грипп, корь, краснуха, малярия, гепатит А, туляремия, бруцеллез и др., но в массовом сознании фиксируются как начало такой эпидемии (вспышки), так и ее прекращение. Принципы типизации таких эпидемических процессов изложены Б. Л. Черкасским (2001). Он делит их группы на основе следующих частных критериев: характера заболеваемости во времени; ведущего пути передачи возбудителя; условий инфицирования людей; экологической специфики животных — основных хозяев и переносчиков возбудителя инфекционной болезни. В данной работе эти процессы не разделяются на группы на основе частных критериев, а, наоборот, объединяются в пределах одного процесса, имеющего общие для частных эпидемических процессов типовые периоды (рис. 68).
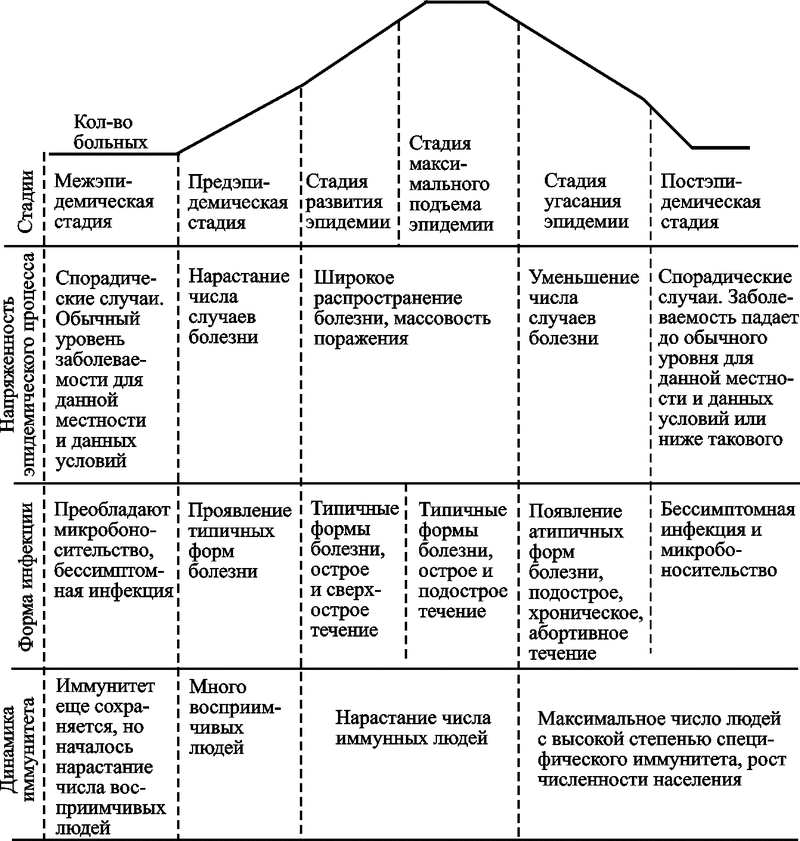
Рис. 68. Схематическое изображение типовых периодов эпидемического процесса, вызванного микроорганизмом, использующим первую стратегию паразитизма (за основу взята схема Бакулова И. А. с соавт., 1997)
Межэпидемическая стадия. Это период видимого эпидемического благополучия. Болезнь, как правило, уже имеет описание в руководствах по эпидемиологии, противоэпидемические мероприятия разработаны при ее предыдущих появлениях. Ее отсутствие в эпидемических сводках рассматривается как «победа человеческого разума». Среди «ликвидированных» болезней сегодня числятся чума, холера, проказа, натуральная оспа. Единственное, на что обращают внимание врачи в этом периоде эпидемического процесса, — на постепенно увеличивающиеся случаи осложнений от вакцинаций, выполненных хорошо зарекомендовавшими в эпидемические годы вакцинами. Обычно такие события вызывают общественный резонанс и требования различных неправительственных организаций «отменить прививки вообще».
Предэпидемическая стадия. При эпидемической настороженности (например, в природном очаге возбудителя болезни) ее первые типичные случаи служат сигналом для проведения профилактических мероприятий, направленных на разрыв эпидемической цепочки (выявление источника возбудителя инфекции, механизма его передачи и специфическое повышение устойчивости организма реципиента путем вакцинации). Единичные случаи болезни привлекают большое внимание со стороны противоэпидемических служб, СМИ. На их ликвидацию бросаются огромные силы и средства, и обычно подавляют «героическими усилиями врачей». Эпидемия вызывается одним микроорганизмом и протекает как монопроцесс, поэтому все усилия эпидемиологов и врачей-инфекционистов сосредоточиваются на противодействии одному возбудителю инфекционной болезни.
Стадия развития («разгара») эпидемии. Население и власти осознают опасность эпидемической ситуации и активно противодействуют эпидемии. На этой же стадии эпидемического процесса начинается элиминация носителей отдельных вариаций генов среди людей, которые вне эпидемического процесса могли бы рассматриваться как носители нейтральных мутаций. При контакте с возбудителем инфекционной болезни такие мутации становятся селективными, и их носители подпадают под действие естественного отбора (рис. 69).
Рис. 69. Схематическое изображение соответствия локализации хромосомных локусов чувствительности к возбудителям инфекционных болезней у людей.
Цифрами обозначен порядковый номер хромосомной пары; Х — Х-хромосома; Y — Y-хромосома. Буквенным обозначением показаны локусы, соответствующие повышенной восприимчивости человека к возбудителям: А — шистозомиаза; В — малярии; H, D, C — лепры; F, E и J — туберкулеза; G — туберкулеза и лепры; I — кала-азара. Объяснение в тексте. По А. Frodshan, А. Hill (2004)
Подробно о механизмах генетической устойчивости (восприимчивости) к возбудителям инфекционных болезней см. в работах J. McNicholl (1997); А. Hill (1999); S. Marquet, E. Schurr (2001); A. Frodshan, A. Hill (2004). В табл. 19 охарактеризованы основные гены человека, прямо или косвенно способствующие повышению его восприимчивости или, наоборот, резистентности к возбудителям инфекционных болезней, использующим разные стратегии паразитизма. Так как восприимчивость (резистентность) к возбудителю инфекционной болезни человеческой популяции или этнической группы всегда носит полигенный характер и определяется частотами встречаемости генов, то на стадии «разгара» эпидемии наблюдается множество переходных вариантов одной патологии между типичными формами проявления инфекционной болезни (рис. 70).
Таблица 19
Вариации генов человека, способствующие повышении его восприимчивости или, наоборот, резистентности к возбудителям инфекционных болезней*
| Ген(ы) | Вариант(ы) | Болезнь | Что повышается |
| AB0 | Кровь группы 0 | Холера | Восприимчивость |
| Альфа-глобин | Талассемиаз | Малярия (Pf) | Резистентность |
| Бета-глобин | Серповидный, талассемиаз | Малярия (Pf) | Резистентность |
| G6PD | Дефицитные варианты | Малярия (Pf) | Резистентность |
| HLA-B | HLA-B53 | Малярия (Pf) | Резистентность |
| HLA-DR | HLA-DRB1*1302 | Малярия (Pf) | Резистентность |
| HLA-DR | HLA-DRB2 | Туберкулез | Восприимчивость |
| HLA-DR | HLA-DR2 | Лепра | Восприимчивость |
| HLA-DR | HLA-DRB1*1302 | Персистенция HBV | Резистентность |
| HLA-DR | HLA-DR1*11 | Персистенция HСV | Резистентность |
| TNF | Промотор 308 | Малярия (Pf) | Восприимчивость |
| NRAMP1 | 5’ и 3’ варианты | Туберкулез, другие внутриклеточные бактерии | Восприимчивость |
| Рецептор гамма-интерферона | Различные мутации | Диссеминация вакцины BCG | Восприимчивость |
| Рецептор интерлейкина 12 | Различные мутации | Внутриклеточные бактерии | Восприимчивость |
| ССR5** | Делеция 32 п. о. | ВИЧ, прогрессирование/инфицирование | Резистентность |
* По А. Hill (1999).
** Для ВИЧ более подробно аналогичная информация приведена в разд. 4.2.3.
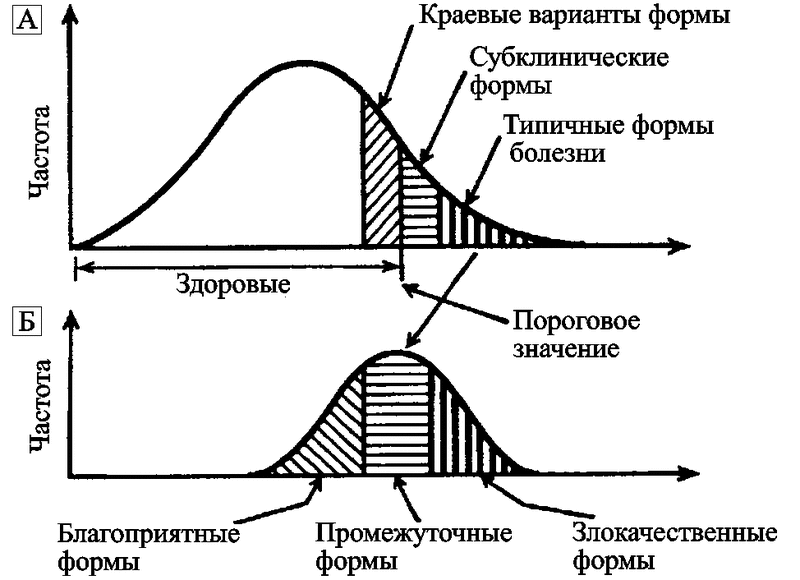
Рис. 70. Клинические признаки инфекционной болезни на стадии «разгара» эпидемии при полигенной устойчивости (восприимчивости) заболевшего человека к возбудителю инфекции
А. Разнообразие стертых и субклинических вариантов, образующих непрерывный переход от нормы до выраженных форм типичного проявления болезни. Б. Множество переходных вариантов патологии между типичными формами проявления болезни. По В. Л. Петухову с соавт. (1996).
Ку-лихорадка. Клиническая картина при Ку-лихорадке отличается разнообразием. У пациентов, носителей аллели HLA DRB1*11, перенесших Ку-лихорадку (Q-fever), наблюдается осложнение, названное «слабостью после Ку-лихорадки» (post-Q-fever fatigue patients, QFS). У макрофагов людей, носителей данной аллели, обнаружена пониженная секреция интерферона-гама и IL-2 в ответ на стимуляцию лигандами в короткоживущих культурах. Эндокардит (Q fever endocarditis, QFE) обычно наблюдается у лиц с высоким полиморфизмом TNFальфа-рецептора II 196R (Helbig K. et al., 2005).
Малярия. Установлена связь между HLA-антигеном класса I, HLA-B53 и защитой от тяжелых форм малярии — церебральной и сопровождающейся развитием выраженной анемии (Hill A. et al., 1992). Аллель HLA-антигена класса II HLA-DRB1 ассоциирована с резистентностью только к анемии (Hill A., 1999). Независимо от HLA-аллелей, аллель TNF2 гена фактора некроза опухолей альфа, показана как фактор, способствующий развитию церебральных форм малярии (McGuire W. et al., 1994). TNF2 отличается от распространенной аллели TNF1 более сильным транскрипционным активатором, способствующим увеличению экспрессии TNFальфа. По этой причине у больных с церебральными формами малярии обычно находят повышенное содержание в крови TNFальфа (Miller L., 1996). Эта же аллель способствует более тяжелому течению инфекции, вызываемой хантавирусом Puumala (см. ниже). Отдельные аллели гена ISAM-1 (ген внутриклеточного фактора адгезии 1) способствуют повышенной адгезии паразита к клеткам красной крови в эндотелии небольших сосудов, что также проявляется церебральными формами малярии (Fernandez-Reyes D. et al., 1997).
Хантавирус Puumala. Лица, которые экспрессируют гены HLA-B8, переносят болезнь более тяжело. У них она проявляется пониженным кровяным давлением, повышенным содержанием креатинина в крови. Одновременно наблюдается большее количество вируса в моче и крови. У лиц с HLA-B27 болезнь протекает в мягкой форме. Почти все больные с гаплотипом HLA-A1-B8-DR3, у которых прогрессивно развивался шок, экспрессировали аллель TNF2. Аллель была связана с повышенной продукцией фактора некроза опухолей макрофагами в ответ на инфекцию (Wilson A. et al., 1997).
Болезнь Лайма. Исследование аллелей HLA класса II показало связь аллели HLA-DRB1*0401 с хроническими артритами и отсутствием у организма реакции на антибиотикотерапию. Эта аллель связана также с повышенным риском развития тяжелых ревматоидных артритов. При исследовании антительных ответов у пациентов, перенесших болезнь Лайма, реакции иммуноглобулина G (IgG) на поверхностный наружный белок A (OspA) и OspB спирохеты часто обнаруживались в самом начале длительно текущих артритов. После проведения курса лечения антибиотиками у пациентов с HLA-DR4 и антительными ответами на OspA и OspB артриты продолжались значительно дольше, чем в тех случаях, когда ответы на данные белки отсутствовали (Kalish R. et al., 1993). Лица, переболевшие болезнью Лайма и страдающие устойчивыми к лечению артритами, обычно имеют Т-клетки, которые взаимодействуют со многими эпитопами OspA, в то время как у лиц, хорошо отвечающих на лечение, они обычно отсутствуют. Т-клеточный ответ на OspA у больных с артритами, устойчивыми к лечению, может перекрестно распространяться и на собственный антиген в суставной сумке. И тогда ответ на этот собственный антиген может продолжать вызывать воспаление сустава в течение месяцев или даже лет после удаления из него спирохет (McNicholl J., 1998).
Вакцинация. В этом периоде эпидемического процесса ее результативность обычно вызывает споры среди врачей даже при применении тех вакцин, для которых эффективность доказана в эксперименте, либо при подавлении вакцинацией эпидемий, начатой на других стадиях эпидемического процесса. Например, во время жестокой пандемии натуральной оспы 1870–1874 гг. двукратная противооспенная вакцинация не сыграла роли в противоэпидемических мероприятиях. Так во время Франко-прусской войны лучше всех французских соединений была вакцинирована и ревакцинирована собственно армия во Франции. Но она же имела относительно наибольшую заболеваемость и смертность от оспы. Хуже всех был вакцинирован Алжирский корпус: он же имел и наименьшую заболеваемость и смертность от оспы. Вторая французская армия, наскоро организованная и, за недостатком времени, неревакцинованная и вообще плохо вакцинированная, вовсе не пострадала от оспы (Бразоль Л. Е., 1875).
В разгар эпидемии легочной чумы в Маньчжурии в 1910–1911 гг. двукратная вакцинация убитыми чумными вакцинами не предотвращала заражение людей, поэтому она вызвала такое недоверие у врачей и населения, что русским властям пришлось закрыть специально созданные медицинские пункты, где вакцинация населения осуществлялась бесплатно (Богуцкий В. М., 1911). Но в Индии в конце 1890-х гг. в очагах вяло развивающейся бубонной чумы вакцинация такой же вакциной оказалась весьма успешной (Хавкин В. М., 1899). В 1930-х и в начале 1940-х гг. японцы безуспешно пытались предотвратить сезонные эпидемии бубонной чумы массовыми вакцинациями китайского населения убитыми вакцинами (Николаев Н. И., 1949).
Возможно, что снижение эффективности вакцинации в этом периоде эпидемического процесса вызвано повышенной вирулентностью возбудителя, массированностью инфицирования людей и наличием среди них индивидуумов, высоковосприимчивых к возбудителю болезни.
«Отрыв» возбудителя инфекционной болезни от природного резервуара. Многообразие результатов, получающихся на стадии разгара эпидемии от взаимодействия возбудителя инфекционной болезни с людьми разных генотипов, может проявиться изменением не только клиники инфекционной болезни (см. рис. 70), но и ее эпидемиологии. Например, тогда когда возбудитель инфекционной болезни утрачивает связь со своим природным резервуаром и начинает передаваться «по цепочке» среди людей. В тех случаях, когда природный резервуар такого микроорганизма неизвестен, его относят к антропонозам. Ниже, на примере легочной чумы, будет показан механизм формирования эпидемических цепочек среди людей для ситуации, когда возбудитель инфекционной болезни не поддерживается за пределами своего природного резервуара. Возможный механизм полного «отрыва» возбудителя инфекционной болезни от своего природного резервуара обсуждается в разд. 4.2. Обратимся к исследованию Г. Н. Минха (1898) динамики развития чумы в станице Ветлянская (Астраханская область), вспыхнувшей осенью 1878 г. (рис. 71).
Рис. 71. Распространение чумы в станице Ветлянская
1 — динамика заболеваний чумой в станице; 2 — движение чумы в домах Беловых; 3 — движение заносов (первичных) из домов Беловых; 4 — движение заносов чумы из ст. Ветлянской в другие селения. Схема составлена Г. Н. Минхом (1898)
По сути, на схеме показаны три разные эпидемии, протекающие одновременно, но вызванные одним возбудителем. Первая — бубонная чума, развивавшаяся среди жителей станицы единичными случаями с конца сентября в результате их укусов инфицированными Y. pestis блохами, паразитировавшими на больных чумой грызунах. Вторая — «переход » бубонной чумы во вторично-легочную в семье Беловых и образование эпидемических цепочек между членами этой семьи и другими жителями станицы. Третья — формирование самостоятельных эпидемических цепочек первично-легочной чумы среди жителей станицы и других селений, начавшихся от вторично-легочных случаев в семье Беловых.
По клиническим проявлениям болезни эпидемия делится Минхом на два периода: 1) с преобладанием бубонных форм (с 28 сентября); 2) с преобладанием безбубонных и в основном ее легочных форм (с 27 ноября).
Первый период эпидемии (предэпидемическая стадия) начался с заболевания 65-летнего казака Агапа Хритонова. Он жаловался на головную боль, слабость, общее недомогание и боль в боку (без кашля и кровохарканья) и, кроме того, у него был бубон под мышкой. Казак умер 2 октября. Далее эпидемия продолжилась единичными случаями бубонной чумы среди жителей станицы со смертностью около 50 % от числа заболевших. Со второй половины ноября злокачественность болезни возросла, в это же время стали появляться случаи заболеваний, не осложненные поражением лимфатических узлов (повышение вирулентности Y. pestis по мере развития эпидемического процесса, является характерной особенностью эпидемий чумы; см. в разд. 2.2). В последней декаде ноября были два случая затянувшейся бубонной чумы с кровохарканьем, закончившихся смертью заболевших. Однако они не привели к распространению легочной чумы по станице, возможно, ее вообще бы там не возникло, если бы возбудитель болезни не попал в семейство Беловых.
Второй период Ветлянской чумы (стадия «разгара» эпидемии) начался в семье богатого казака Осипа Белова. Его сын Федор был женат на Марье Хритоновой. Минх не знал о существовании вторичных крысиных очагов чумы и о возможности развития домовых эпидемий чумы посредством блох, инфицированных Y. pestis. Он считал, что именно от семейства Хритоновых произошел занос «контагия» чумы в семейство Беловых. Однако к моменту заболевания первых Беловых легочной чумой их свояки уже были «выбиты» бубонной чумой, сам Агап умер почти два месяца назад. Всего у Хритоно ых в первом периоде эпидемии было поражено бубонной чумой 9 человек, из которых четверо умерли, но ни один из них не страдал легочной формой болезни. В домах Беловых эпидемия проявляет себя сразу массой почти внезапных смертельных заболеваний (первыми погибли Федор и Марья) с почти полным отсутствием бубонов. Минх подчеркивал, что это обстоятельство могло бы «навести лиц, мало или совсем незнакомых с первым периодом Ветлянской чумы, на мысль о какой-то другой, начавшейся только с Беловых, болезни».
Минх, писавший свой труд в добактериологический период изучения эпидемиологии чумы, легко допускал перенос между семействами абстрактного «контагия». Но он обратил внимание на то, что чума хотя и держалась в первом периоде эпидемии в северо-западном, Царицынском, конце станицы, но во втором периоде она равномерно была рассеяна всюду. Если исходить из существующих сегодня представлений о контагиозности легочной чумы, то каждое пораженное эпидемией семейство должно было вовлекать в нее всех тех, кто находился с ними в контакте. Минх же констатировал тот факт, что близкое соседство даже с наиболее пострадавшими от чумы семействами не имело никакого влияния на распространение болезни по станице. Он отметил отсутствие заболевших во многих домах, расположенных вблизи тех, семейства которых поголовно вымерли. Просматривая метрические записи, Минх увидел в списке умерших все одни и те же фамилии: целые десятки Беловых (табл. 20), много Лобановых, Астаховых, Писаревых, Назаровых и т. д.
Таблица 20
Смертность от легочной чумы в семействе Беловых (по отдельным родам)*
| Рода семейства Беловы | Число домов вообще | Число пострадавших домов | Число вымерших домов | Число членов семейства |
Число умерших (%) |
Число оставшихся в живых |
| Род Белова Ивана | 8 | 8 | 6 | 41 | 36(88) | 5 |
| Род Белова Якова | 4 | 3 | 1 | 24 | 15(62) | 9 |
| Род Белова Игнатия | 3 | 3 | — | 19 | 8 (42) | 11 |
| Итого | 15 | 14 | 7 | 84 | 59 (70) | 25 |
| %-ное отношение к общему числу домов и жителей | 4,7 | — | — | 4,8 | 16% всех умерших | — |
* По Минху Г. Н., 1898.
Вывод, сделанный Минхом из этих наблюдений, состоял в том, что «только эти родословные могут досказать нам то, чего не могли открыть свидетели, что только они могли дать нам ясное представление о списке умерших, представляющемся нам, как мы сказали, без знания родословных, простым перечнем имен и фамилий». Следовательно, можно предположить, что второй период Ветлянской чумы — легочный — начался со случайного вовлечения в эпидемический процесс «критической массы» особых человеческих генотипов, у которых инфекционный процесс проявился вторично-легочной формой болезни. Относительная генетическая однородность многочисленных родов Беловых, и особенно членов семейства Белова Ивана, способствовала крайне упорному распространению вторично-легочной чумы по станице и отбору высоковирулентных штаммов ее возбудителя. После достижения «критической массы» из вторично-легочных случаев болезни чума сформировала самостоятельные эпидемические цепочки (без участия эктопаразитов), состоящие уже из первично-легочных случаев («первичные заносы», по определению Минха), это и привело к эпидемической катастрофе, названной впоследствии «Ветлянской чумой».
Стадия угасания эпидемии. Характеризуется: а) упрощением генотипического разнообразия популяции людей за счет элиминации лиц, особовосприимчивых к возбудителю болезни; б) снижением вирулентности вызвавших эпидемию штаммов возбудителя инфекционной болезни; в) ростом иммунной прослойки среди населения.
Снижение вирулентности возбудителей, оторвавшихся от своего природного резервуара и сформировавших самостоятельные эпидемические цепочки, происходит по следующим причинам. Фагоцитирующие клетки позвоночных организмов (т. е. реликтовая система иммунитета), в отличие от своих эволюционных предшественников, не являются свободноживущими организмами, а представляют собой часть иммунной системы более сложного организма и функционируют под ее управлением. Иммунная система распознает макрофаги/моноциты, используемые возбудителем для своего паразитирования и уничтожает их через систему Т-клеточных ответов (см. ниже), тем самым оказывая сильное отрицательное давление на наиболее патогенные микроорганизмы в популяции возбудителя, вызвавшей эпидемию болезни. По этой причине в конце каждой крупной эпидемии от заболевших, но выживших людей, как правило, высеваются маловирулентные штаммы возбудителя инфекционной болезни. Сама же болезнь протекает легко и поддается лечению средствами, оказывающимися бесполезными на пике эпидемии. Лечебные и профилактические мероприятия (включающие серотерапию и вакцинацию), имевшие сомнительный эффект на стадии развития эпидемии, теперь становятся эффективными и попадают в учебники, по которым учатся следующие поколения врачей. Эту стадию эпидемического процесса циклического типа хорошо характеризует образное описание Альбера Камю (Чума, 1947): «Откровенно говоря, трудно было утверждать, действительно ли это победа или нет. Приходилось лишь констатировать, что эпидемия уходит так же неожиданно, как и пришла. Применявшаяся в борьбе с ней стратегия не изменилась, вчера еще бесплодная, сегодня она явно приносила успех. Так или иначе, создавалось впечатление, будто болезнь сама себя исчерпала или, возможно, отступила, поразив все намеченные объекты. В каком-то смысле ее роль была сыграна».
Такие эпидемии прекращаются с затуханием природных очагов и под давлением противоэпидемических мероприятий. Благодаря формированию иммунной прослойки среди населения циклические эпидемии способны самоограничиваться даже без проведения противоэпидемических мероприятий. Как правило, после крупных эпидемий данного типа численность населения восстанавливается в течение жизни одного-двух поколений.
Незавершающиеся циклические эпидемические монопроцессы. Не все микроорганизмы взаимодействуют с клетками реликтовой иммунной системы многоклеточных организмов исключительно как паразиты и завершают свой цикл размножения в течение нескольких часов (возбудители чумы, оспы, легионеллеза) или суток (возбудители бруцеллеза). В самом феномене паразитизма много различных оттенков и проявлений. Совместное эволюционное прошлое предполагает возможность развития и более длительных отношений микроорганизмов с макрофагами/моноцитами (см. разд. 2.2, «Микобактерии»). Они могут рассматриваться как симбиотические до тех пор, пока потребление ресурсов клетки медленно размножающимися микроорганизмами не достигнет того уровня, когда существование самой клетки станет невозможным. В позвоночных организмах такие «эндосимбионты» обнаруживаются иммунной системой по общему механизму
узнавания инфицированных фагоцитирующих клеток — по комплексам их антигенов, образованных с молекулами главного комплекса гистосовместимости. Комплекс был открыт в связи с разработкой вопросов внутривидовой пересадки тканей — отсюда и такое название. У человека гены МНС расположены на 6-й хромосоме, в диске р21.3. Их около 50, присутствуют многие аллельные формы одного гена. Все гены комплекса делятся на три группы, каждая группа контролирует синтез полипептидов одного из классов (Галактионов В. Г., 2005). Молекулы МНС расположены на поверхности фагоцитирующих клеток. Комплекс МНС участвует в удалении фрагментов погибших и не метаболизированных в пределах фагоцитирующих клеток микроорганизмов (в основном, фрагментов их оболочки). Если бы такой процесс осуществлялся среди свободноживущих простейших, то никаких бы последствий ни для самих простейших, ни для их «эндосимбионтов» не наступало бы. Но в позвоночном организме комплексы антигенов с молекулами гистосовместимости I типа распознаются цитотоксическими Т-лимфоцитами (Т-киллеры, CD8 Т-клетки); комплексы антигенов с молекулами гистосовместимости II типа распознаются либо СD4 Т-клетками воспаления (Th1), либо хелперными CD4 Т-клетками (Th2) и инфицированные фагоцитирующие клетки уничтожаются по различным механизмам. Подробно о механизмах их взаимодействия можно прочитать в монографии В. Г. Галактионова (2005).
Для того чтобы «удостоиться чести» быть представленным Т-клеткам на поверхности белков МНС макрофагов, микроорганизм должен активно размножаться и тем самым создавать достаточное для «презентации» количество антигенного материала. У медленно реплицирующихся в макрофагах бактерий этот процесс идет медленно, что приводит к длительному персистированию микроорганизма среди клеток реликтовой иммунной системы без эффективного ответа на них со стороны Т-клеток. Когда все же происходит накопление антигенного материала на поверхности белков МНС, то запускаются Т-клеточные механизмы элиминации инфицированных макрофагов/моноцитов. Эффективная работа таких механизмов зависит уже от «исправности» их самих. У части же людей, вследствие накопления во время длительных межэпидемических периодов мутаций в генах белков, участвующих в презентации и узнавании чужеродных антигенов и др. реакциях, имеющих отношение к комплексным иммунным ответам на чужеродные антигены, снижается эффективность элиминации возбудителя инфекционной болезни. Например, в тех случаях, когда мутировавшие аминокислотные цепи, образующие щель у антигенов II класса, не в состоянии связать пептидный фрагмент чужого антигена, Т-хелперы остаются ареактивными и их помощь В-клеткам не реализуется. Так как люди с таким генетическим дефектом не реагируют на некоторые критические эпитопы патогенов, то инфекционная болезнь у них развивается значительно легче, чем у тех лиц, у которых Т-хелперы активируются. По сходному механизму развивается инфекционная болезнь у людей с неадекватной аллелью антигена I типа. Поэтому при анализе распределения аллелей МНС люди с аллелью, неспособной к связыванию данного антигена, обнаруживаются среди больных в статистически значимых ассоциациях.
Из-за того что микроорганизмы-эндосимбионты простейших широко представлены в окружающих человека экосистемах, их проникновение в популяции людей имеет массовый характер. Но лишь у незначительной части инфицированных людей, у тех, у которых иммунная система имеет врожденные дефекты, инфекция не обрывается, а проявляется болезнью. Поэтому, для того чтобы началась эпидемия, помимо активизации природного очага возбудителя данной болезни, в проживающей на территории этого очага человеческой популяции еще в межэпидемический период должно накопиться какое-то пороговое количество людей с мутациями генов, участвующих в иммунных ответах. А поскольку вызвавшие эпидемию микроорганизмы-эндосимбионты простейших не обладают вирулентностью, способной привести к быстрой гибели своего случайного хозяина, как это происходит в результате инфицирования возбудителями чумы или сибирской язвы, то популяция людей, проживающая на территории активизировавшегося природного очага, постоянно пополняется новыми больными из числа лиц с дефектами иммунной системы. Эти люди не выздоравливают
и в течение нескольких лет не погибают, поэтому эпидемия приобретает масштабный характер. Динамика эпидемического процесса и наиболее характерная для него клиническая картина болезни будут зависеть от относительного количества таких лиц в популяции и характера генетических дефектов их иммунной системы (табл. 21).
Таблица 21
Примеры ассоциации или связи между отдельными генами людей и риском развития микобактериальных инфекций*
|
Инфекционная болезнь |
Ассоциации клинических форм болезни с отдельными аллелями генов людей |
Популяции |
|
Лепра |
MHC класса II HLA-DR (лепроматозная и туберкулоидная) |
Индийцы, бразильцы |
| TNFальфа (лепроматозная) |
Индийцы |
|
|
NRAMP1 (лепра per se) (ответы на лепромин в условиях invivo) |
Вьетнамцы |
|
|
VDR (лепроматозная и туберкулоидная) |
Индийцы |
|
|
Туберкулез |
MHC класс II HLA-DR2 (легочный туберкулез) HLA-DRB1 (легочный туберкулез) HLA-DQB1 (прогрессирование туберкулеза) HLA-DQB1 (легочный туберкулез) |
Индийцы Индийцы Камбоджийцы Индийцы |
| NRAMP1 (легочный туберкулез) |
Гамбийцы, канадские индейцы |
|
| VDR (легочный туберкулез) |
Гамбийцы |
|
|
MBL (легочный туберкулез) (туберкулезный менингит)
|
Индийцы Цветные |
|
| IL-1Rа/IL-1b (tuberculosis form) |
Гуджаратцы |
|
|
Атипичные микобактериальные инфекции |
IFNгаммаR1
|
Мальтийцы, тунисцы, итальянцы, германцы, португальцы |
|
IFNгаммаR2
|
Англичане |
|
| IL-12Rb1 |
Марокканцы |
|
| IL-12p40 |
Пакистанцы |
* По S. Marquet, E. Schurr (2001).
Сокращения: MHC — главный комплекс гистосовместимости; MBL (mannose binding lectin) — лектин, связывающий маннозу; MBP (mannose binding protein) — протеин, связывающий маннозу; IL (interleukin) — интерлейкин; BCG (Bacillus Calmette-Guerin) — бациллы Кальметта-Гирена; IFNгамма — интерферон гамма; IL-1Ra (interleukin-1 receptor antagonist) — антагонист рецептора интерлейкина-1. IFNгаммаR1 (interferon gamma receptor 1) — рецептор гамма-интерферона 1; VDR (vitamin D receptor) — врожденная низкая усвояемость витамина D. Per se — сам(а) (само, сами) по себе, в чистом виде.
Лепра. Клиника эпидемического процесса при лепре определяется наличием в популяции людей мутаций в генах, перечисленных ниже. В разных этнических группах предрасположенность к лепре и клиническое течение болезни, проявляются по-разному.
МНС. Для MHC класса II наличие аллели HLA-DR2 определяет предрасположенность к обеим формам проказы. Среди некоторых народов Индии и Бразилии аллель ассоциирована с лепроматозной формой проказы. Среди египтян — с туберкулоидной формой. DQ-аллели, особенно DQw1, ассоциированы с туберкулоидной лепрой среди населения Индии, Кореи, Таиланда и Японии и с лепроматозной формой болезни среди отдельных групп населения Индии и Японии. DQ-аллели встречаются вместе с аллелью HLA-DR2. Аллель HLA-DR3 ассоциирована с туберкулоидной формой проказы среди населения Мехико, Суринама и Венесуэлы. Для отдельных аллелей MHC класса I также установлена связь с развитием разных клинических форм лепры, но пока наблюдения одних исследователей не находят подтверждения в работах других (Fitness J. et al., 2002).
TAP (transporter associated with antigen processing) — это гетеродимерный трансмебранный протеин, состоящий из двух гомологичных субъединиц: TAP1 и TAP2. Он играет основную роль в транспортировке антигенного пептида из цитозоля в эндоплазматический ретикулум (endoplasmic reticulum), где пептид «загружается» в молекулы MHC класса I. Различные комбинации полиморфизма в кодонах 379, 565 и 665 дают восемь TAP2 аллелей (A–H) (Joly A. L. et al., 1998). Из них TAP2-B описана как аллель, ассоциированная с туберкулоидной проказой; TAP2-A/F ассоциирована с тяжелым течением легочного туберкулеза во время вспышек этой болезни среди населения на севере Индии (Rajalingam R. et al., 1997).
TNFальфа (tumor necrosis factor, фактор некроза опухолей) — цитокин, активирующий макрофаги и способствующий презентации антигенов посредством MHC класса II. Является важным модулятором продукции хемокинов, необходимых для эффективной локализации лейкоцитов в очаге воспаления и формирования лепрозной и туберкулезной гранулемы. По данным M. Engele et al. (2002), низкая продукция TNFальфа недостаточна для активизации макрофагов до того уровня, когда они способны убивать микобактерии и/или формировать гранулемы, отграничивающие инфекционные локусы. Повышенная продукция TNFальфа усиливает прогрессирование болезни через локальные повреждения тканей и повышает вирулентность самих микобактерий. Установлено, что повышенное в сравнении с нормой количество TNFальфа усиливает рост M. tuberculosis в альвеолярных макрофагах людей. По мнению тех же авторов, микобактерии «преднамеренно» усиливают продукцию TNFальфа инфицированными макрофагами для «привлечения» к очагу инфекции неинфицированных макрофагов, затеминдуцируют апоптоз инфицированных макрофагов и распространяются по неинфицированным макрофагам.
Наибольшее значение в эпидемиологии проказы имеет аллель TNF*2, ассоциированная с повышенным синтезом фактора некроза опухолей макрофагами. В Бенгальской Индии носительство такой аллели проявляется распространением среди населения лепроматозной формы болезни. В южной Бразилии эта аллель, наоборот, ассоциирована с повышенной устойчивостью к проказе. У бразильцев, больных лепрой, носительство этой аллели проявляется сильными кожными воспалительными реакциями на лепромин (суспензия убитых автоклавированием M. leprae). Чрезмерная продукция TNFальфа ассоциируется также со слизисто-кожным лейшманиазом (Cabrera M. et al., 1995), рубцовой трахомой (Conway D. J. et al., 1997), церебральной малярией (McGuire W. et al., 1994) и фатальными исходами при менингококковых заболеваниях (Nadal D. et al., 1989).
Лимфотоксин альфа (lymphotoxin альфа, LTA; ранее назывался TNFбета). Ген LTA локализован близко к гену TNFальфа и кодирует лимфотоксин — хемокин, секретируемый лимфоцитами и натуральными киллерными клетками. Растворимый альфа-лимфотоксин представляет собой гомотримеры (homotrimers), способные связываться теми же рецепторами, что и TNFальфа. В тоже время гетеродимеры (heterotrimers) формируют связанный с мембраной бета-лимфотоксин, взаимодействующий с рецепторами бета-лимфотоксина. Через эти рецепторы лимфотоксины вызывают плейотропные (pleiotropic) иммуномодуляторные эффекты. Локус HLA класса II, включающий LTA, был связан с чувствительностью бразильцев к лепре. Также с повышенной восприимчивостью к лепре у бразильцев ассоциирован гаплотип TNF*1/LTA*2, но не TNF*1/LTA*1. Эти данные предполагают причастность варианта гена лимфотоксина альфа — LTA*2 в развитии эпидемий проказы в отдельных популяциях населения Бразилии (Shaw M. A. et al., 2001).
Компонент комплемента 4В (сomplement component 4B, C4B). Отсутствие у отдельных лиц экспрессии гена белка C4B (аллель C4B*Q0) ассоциируется в Бразилии с лепроматозной формой болезни и таким ее клиническим проявлением, как узловатая лепрозная эритема (еrythema nodosum leprosum, ENL) (Messias I. J. de et al., 1993).
Белок теплового шока 1А массой 70 кДа макрофагов (heat shock 70 kD protein 1A, HSPA1A). Установлена ассоциация аллели HSPA1A-A с туберкулоидной формой болезни в популяциях населения на севере Индии (Rajalingam R. et al., 2000).
Белок SLC11A1 (solute carrier family 11 member 1, другое название белка NRAMP1). Биохимическая функция белка полностью не ясна, но есть основания считать, что он причастен к функции фагоцитоза у макрофагов и к «представлению» ими антигенов Т-хелперам. Первые прямые доказательства причастности мутантных аллелей этого гена к развитию проказы получены при изучении эпидемиологии болезни среди населения Южного Вьетнама (Abel L. et al., 1995). Подробнее см. ниже «Врожденная недостаточность функции фагоцитоза».
Тулл-подобный рецептор 2 (TLR2). Рецепторы данного типа (TLRs) способны активировать транскрипцию генов, регулирующих иммунные ответы. TLR2 отвечает на многие микробные компоненты, включая липопротеины и липоарабиноманнан (lipoarabinomannan). Мутации гена TLR2 обычно связаны с развитием лепроматозной формы болезни у жителей Южной Кореи (Kang T. J., Chae G. T., 2001).
Туберкулез. Доминирующие клинические проявления болезни во время эпидемии туберкулеза зависят от наличия в популяциях людей носителей мутаций в определенных генах иммунной системы.
МНС. Играет ключевую роль в контроле над чувствительностью к инфицированию M. tuberculosis. Выявлена связь между легочной формой туберкулеза и специфичностью HLA. HLA-DR2 и -DR3 ассоциируются с легочным туберкулезом и туберкулоидной проказой. HLA-DR2 определяет восприимчивость больного к легочному туберкулезу, резистентному к лекарственным препаратам (Singh N. et al., 1997; Fitness J. et al., 2002).
Врожденная недостаточность функции фагоцитоза. На хромосоме 2q35 человека был идентифицирован ген NRAMP1 (natural resistance-associated macrophage protein gene 1, другое название SLC11A1), гомологичный мышиному Bcg-гену, который придает мышам резистентность к бациллам Кальмета и Герена и к возбудителю лепры. Все четыре мутантных типа (аллели) этого гена связаны с туберкулезом. Отдельные аллели гена с необыкновенно высокой частотой преобладают в восточно-африканской популяции, но редко встречаются в европейских. Это наблюдение может частично объяснить более высокую, в сравнении с другими этническими группами, чувствительность африканцев к туберкулезу. (McNicholl J. 1998). Нетранслируемый ген NRAMP1 у жителей Гамбии ассоциируется с открытыми формами легочного туберкулеза и, следовательно, с передачей M. tuberculosis по эпидемической цепочке — от одного заболевшего к другому (Hill A., 1999). Установлена ассоциация N02C-аллели NRAMP1 у детей различных этнических групп, живущих в Большом Хьюстоне (США), со злокачественным течением туберкулеза (Malik S. et al., 2005) (рис. 72).
Рис. 72. Схематическое изображение гена NRAMP1 и его аллелей
Указаны номера экзонов, участок инициации трансляции (translational initiation, ATG), терминирующая последовательность (Stop) и расположения различных генных полиморфизмов в отношении интрон-экзонной организации гена (приведены на левой стороне схемы). Используются принятые обозначения генного полиморфизма: микросателлитный повтор (microsatellite repeat), снипс (single nucleotide polymorphism, SNP), вставочно/делеционный полиморфизм (insertion/deletion polymorphism, INS/DEL). Указано количество семейств жителей Большого Хьюстона, включающих по крайней мере одного гетерозиготного носителя полиморфного гена NRAMP1. По S. Malik et al. (2005)
Врожденная недостаточность системы интерферона. Мутация в гамма-интерфероновом рецепторе 1 (IFNгамма Rl) приводит к диссеминации малопатогенных микобактерий. Ген IFNгамма Rl расположен в регионе хромосомы 6q22q23. Мутация в гене приводит к отсутствию экспрессии рецептора на поверхности клеток. Мутация часто обнаруживается в семьях больных туберкулезом (Newport M. et al., 1996).
Врожденная низкая усвояемость витамина D. Рецептор витамина D (vitamin D receptor, VDR) является неядерным рецептором, его ген находится на 12q12–q14. Посредством этого рецептора модулируются цитокино вые ответы Т-клеток. Одновременно этот генотип ассоциируется с повышенным риском развития остеопорозов (McNicholl J., 1998).
Маннозасвязывающий лектин (mannose-binding lectin 2, MBL2). Ген расположен на 10q11.2–q21, кодирует кальцийзависимый маннозасвязывающий лектин, найденный в сыворотке. MBL связывается с терминальными маннозными группами на поверхности различных бактерий. Тем самым он инициирует активацию комплемента (классический путь) и механизм опосонофагоцитоза (opsonophagocytosis), независящего от антител и Clq (одна из трех субъединиц белка Cl комплемента, в ее составе имеется рецептор для связывания с Fc-фрагментом антитела). Мутация в экзоне 1 MBL2 снижает концентрацию MBL в сыворотке, вероятно вследствие интерференции с олигомеризованным белком. Низкие уровни MBL могут быть связаны с рекуррентными инфекциями у маленьких детей. Мутация в экзоне 1 у отдельных этнических групп ассоциируется с менингеальным туберкулезом (Hoal-Van H. et al., 1999).
Малопатогенные микобактериальные инфекции. Вспышки болезней, вызванные такими микроорганизмами (M. fortuitum, M. chelonei, M. avium, M. smegmatis, BCG и др.) являются следствием присутствия в инфицированных человеческих популяциях какого-то порогового количества людей с мутациями в следующих четырех генах: IFNгамма RI (рецептор гамма-интерферона 1), IFNгамма R2 (рецептор гамма-интерферона 2), IL-12Rбета1 (рецептор бета1 интерлейкина-12) и IL-12p40 (Marquet S., Schurr E., 2001; Hill A., 1999).
Стадия «разгара» незавершающейся циклической эпидемии предполагает максимально возможное инфицирование лиц с вышеперечисленными дефектами иммунной системы. Самостоятельное угасание эпидемии данного типа возможно. Оно происходит по тем же причинам, которые указаны выше для циклических монопроцессов. Но продолжительность такой эпидемии может превышать продолжительность жизни нескольких поколений людей.
***
Древность взаимоотношений микроорганизмов и простейших, сложность и разнообразие формируемых ими экосистем, их подверженность внешним воздействиям находят свое отражение в грандиозных природных явлениях, воспринимаемых нами как пандемические процессы.
1. Пандемия представляет собой качественно иное явление, чем отдельная эпидемия. Пандемия циклического типа распадается на десятки и сотни эпидемий (вспышек), развивающихся и прекращающихся на разных континентах. Если воспроизводить такую пандемию путем сложения составляющих их эпидемий, то они не будут складываться, как керамическая плитка, когда каждая сторона прилегает одна к другой. Во временном интервале, в который мы помещаем данную пандемию, эпидемии могут не совпадать ни во времени, ни граничить в пространстве. У каждой эпидемии, составляющей пандемию, свой природный очаг, свои усилители природного резервуара возбудителя опасной инфекционной болезни. С ними соприкасаются популяции людей определенных генотипов и типов поведения. Отсюда огромное разнообразие проявлений эпидемических процессов.
2. Существует глобальная многолетняя цикличность в проявлении пандемических процессов, вызванных микроорганизмами, использующими стратегию паразитизма первого типа. Она обусловленна активизацией, а затем и угасанием их природных очагов. Синхронизация активности природных очагов возбудителей опасных инфекционных болезней на разных континентах достигается благодаря глобально действующим факторам (деятельность человека по «преобразованию природы», изменение климата, тектоническая активность и др.). Для пандемических процессов данного типа характерны четыре периода: предпандемический, собственно пандемия, угасание пандемии и постпандемический период. Периодически повторяющиеся пандемии образуют цикл активизации пандемий, включающий несколько пандемий сначала с нарастающей интенсивностью и территориальным охватом, затем от пандемии к пандемии количество вовлеченных в нее людей и площади, охваченных эпидемиями территорий сокращаются. Так развивались пандемии чумы от начала XIV в. по первую половину ХХ в., пандемии холеры от начала XIX в. по 1920-е гг., гриппа (начало последнего пандемического цикла не установлено) и натуральной оспы (см. разд. 4.2). Предпандемический или период раскачивания пандемии является следствием начавшихся процессов разрушения экосистем, вмещающих возбудитель опасной инфекционной болезни, — он проявляется синхронными вспышками инфекционной болезни на огромных территориях, однако не достигающих возможного для данной пандемии максимума. Собственно пандемия — это достижение максимума пульсаций природных очагов возбудителя инфекционной болезни на нескольких континентах. Угасание пандемии — природные экосистемы, вмещающие возбудитель инфекционной болезни, восстанавливаются, вспышки болезни становятся реже, сужаются размеры охваченных ими территорий. Постпандемический (межпандемический) период — эпидемии опасных инфекционных болезней, сопровождающихся по восприятию людей быстрым течением болезни и высокой смертностью (чума, холера, натуральная оспа) отходят в область преданий, мир кажется безопасным и свободным от опасных инфекционных болезней. В этот период накапливаются нейтральные мутации в генах людей, отвечающих за эффективные иммунные ответы, что проявляется ростом числа осложнений в ответ на массовые вакцинации препаратами, еще недавно казавшимися безопасными, и появлением «социально значимых болезней» (туберкулез, проказа и др.). Высвободившуюся нишу во вторичном резервуаре занимают возбудители инфекционных болезней с другой стратегией паразитизма (ретровирусы, онковирусы, возбудители сывороточных гепатитов и др.), не вызывающих в масштабе времени, воспринимаемого человеком, быстрой и повальной гибели инфицированных людей и животных.
3. Наши успехи в борьбе с основными циклически развивающимися пандемиями (чума, натуральная оспа, грипп, холера), достигнутые во второй половине ХХ в., пришлись на стадии угасания их циклов активизации. Например, цикл активизации холерных пандемий закончился еще в 1920-х гг., вспышки чумы второй пандемии прекратились на два десятилетия позже. В настоящее время мы имеем дело с «хвостом» цикла активизации пандемий гриппа, начало которого уходит в XIX в. На этот же период приходится «успешное» применение основных противоэпидемических мероприятий, разработаных после открытия в конце XIX и в начале ХХ вв. вирусов и бактерий, возбудителей этих болезней.
4. Для всех исторически зафиксированных пандемий источники отмечают наличие местностей, где вспышки болезни сопровождаются более высокой смертностью среди заболевших. Например, Месопотамия и п-ов Корнуолс (о. Великобритания) во времена чумы «черной смерти» (1346–1351 гг.). Бессарабская и Тамбовская губернии в 1865-м и 1871 гг. (соответственно), в период четвертой пандемии холеры. Отдельные местности Исландии (смертность до 2,8 % заболевших; см. рис. 67) во время пандемии гриппа «испанки» 1918–1920 гг. Гипотетический механизм такого явления заключается в том, что возбудители
этих болезней на данных территориях получили возможность для активного размножения и селекции вирулентных штаммов среди многочисленных видов простейших, с которыми они взаимодействуют как паразиты (см. в разд. 2.1, «Границы феномена сапронозного существования патогенных для людей микроорганизмов»). Вирулентные штаммы возбудителя инфекционной болезни в больших количествах попадали в среду, окружающую человека, и инфицировали многочисленные группы населения по одному из механизмов передачи, не считающегося сегодня основным (например, алиментарным путем во время пандемии гриппа 1918–1920 гг.; см. работу Lynch С. и Gumming J., 1919). Но после инфицирования какой-то критической массы населения возбудитель инфекции формировал самостоятельные эпидемические цепочки, т. е. он «отрывался » от первичного резервуара. С этой точки зрения понятно почему вирус гриппа, получивший эпидемическое распространение в пандемию 1918–1920 гг. не был «эпидемической новинкой» 1918 г. Его «предковый» вариант «проник» в отдельные человеческие популяции приблизительно в 1900 г. и циркулировал там почти 18 лет, не вызывая пандемии. Да и после пандемии до 1930-х гг. он поддерживался среди свиней, не вызывая серьезных эпидемических проблем. Пандемия «испанки» началась не благодаря тому, что новый вирус начал свою циркуляцию в популяциях людей, а вследствие активизации в 1918 г. его первичных природных резервуаров среди гидробионтов и массивного вброса с водой этого вируса в популяции людей и позвоночных животных, находящихся в окружении человека.
5. Пандемии циклического типа могут «наслаиваться» друг на друга, не представляя единого процесса. Находящиеся в сходных природных резервуарах возбудители разных инфекционных болезней могут вызывать синхронно развивающиеся пандемии при воздействии на эти резервуары сходных факторов.
6. Длительное отсутствие селективного давления возбудителей опасных инфекционных болезней циклического типа на популяции людей приводит к накоплению среди них лиц с дефектами иммунной системы. Тем самым создаются благоприятные условия для возвращения в человеческие популяции возбудителей инфекционных болезней, обычно не развивающихся у людей с эффективно функционирующей иммунной системой (туберкулез, проказа и др.).
Метки: чума