Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. 4.2. Пандемические и эпидемические процессы, вызываемые паразитами, использующими стратегию второго типа
4.2. Пандемические и эпидемические процессы, вызываемые паразитами, использующими стратегию второго типа
Такие пандемические и эпидемические процессы могут рассматриваться как нециклические только в масштабах времени, воспринимаемых человеком. Именно в таком понимании я использую данный термин в этой работе. Варианты «завершения» нециклических эпидемических и пандемических процессов рассматриваются ниже.
4.2.1. Терминология
Трудности терминологии для пандемических и эпидемических процессов нециклического типа. Терминология привычного для человека масштаба времени.
Трудности терминологии для пандемических и эпидемических процессов нециклического типа. Термины, применяемые для описания природной очаговости возбудителей циклических инфекций (см. разд. 4.1.1), могут быть использованы для описания механизмов поддержания и вовлечения в эпидемические процессы возбудителей нециклических инфекций, если удастся получить прямые доказательства их существования среди простейших обитателей почв или гидробионтов. О том, что такие открытия не столь уж отдаленная перспектива эпидемиологии, говорит эндемичность отдельных ретровирусных инфекций. Например, возбудитель Т-клеточного лейкоза, ретровирус HTLV-1 (по ряду свойств он мало отличается от ВИЧ), эндемичен для юго-западных районов Японии, особенно префектур Кюсю и Сикоку; а также для стран Карибского бассейна. Замечено, что для людей, родившихся в эндемичных по HTLV-1 областях и переехавших в раннем возрасте в неэндемичные районы, сохраняется высокий риск развития Т-клеточного лейкоза (Сарнгадхаран М. Г. с соавт., 1989). Ретровирусы могут распространяться жалящими насекомыми (слепни, комары, мухижигалки и др.), как, например, ретровирус — возбудитель инфекционной анемии лошадей (Бакулов И. А. с соавт., 1997). Данное обстоятельство показывает возможность поддержания паразитических микроорганизмов, вызывающих нециклические инфекции у людей, в сложных экосистемах, включающих как их первичные, так и вторичные природные очаги. Они, как и возбудители циклических инфекций, должны иметь свои усилители природных резервуаров и активизироваться (угасать) в результате изменений в окружающей среде (см. разд. 4.1.1). Выявление экосистем, включающих ретровирусы, — дело недалекого будущего.
Распространение среди людей микроорганизмов, использующих вторую стратегию паразитизма, происходит в иных временных масштабах, чем мы привыкли придерживаться при описании циклических эпидемических процессов. На примере ретровирусов мы видим возможность существования одних и тех же паразитических микроорганизмов миллионы лет то в эндогенной, то в экзогенной фазах у видов, сменяющих друг друга в процессе эволюции (см. разд. 1.2 и 1.3 и рис. 4). Поэтому для описания эпидемических процессов, вызываемых паразитическими микроорганизмами второго типа, необходима дополнительная терминология. Она должна соответствовать реалиям пандемии в привычном для человека масштабе времени, соответствовать его восприятию пространства и иметь прикладной характер в аспекте разработки противоэпидемических мероприятий.
Терминология привычного для человека масштаба времени. Здесь я обращаюсь к исследованиям доктора географических наук Д. В. Николаенко (2005, 2006, 2007), самостоятельно разработавшего терминологическую базу описания таких эпидемий и пандемий на примере ВИЧ/СПИД-эпидемии, наблюдаемой им в ЮАР.
Подходы к исследованию ВИЧ/СПИД-пандемии у нас с Д. В. Николаенко схожи в том, что мы рассматриваем ее как нециклический природный процесс. Но Д. В. Николаенко называет такие эпидемические процессы диффузией (диффузия — распространение тел друг в друга, результатом чего является полная однородность системы, вначале разнородной). В дополнение к временной составляющей в их описании он вводит пространственную. На мой взгляд, заимствованный из техники термин «диффузия» удачен, так как наиболее верно отражает суть происходящих процессов при ВИЧ/СПИД-пандемии, хотя и непривычен «для слуха» эпидемиолога. В свете последних данных по возможности эндогенизации экзогенных ретровирусов и последующего изменения ими эволюционной траектории вида (см. разд. 1.2 и 1.3), он имеет даже более широкий смысл, чем первоначально вкладывал в него Д. В. Николаенко.
Благодаря наличию обеих составляющих — временной и пространственной — в описаниях нециклических эпидемических (пандемических) процессов, у исследователей появляется возможность выделять различные блоки. Среди них: морфологический блок — анализ общих закономерностей развития (диффузии) эпидемии (пандемии) данного типа; кластерный блок — рассмотрение различных групп (кластеров, когорт) общества с точки зрения их большей или меньшей уязвимости для данной эпидемии; и пространственный блок — конкретные особенности пространственного проявления диффузии возбудителя нециклической инфекционной болезни. Ниже приведена терминология, предложенная Д. В. Николаенко для описания ВИЧ/СПИД-пандемии (подробнее см. Николаенко Д. В., 2007).
Эпидемический центр (очаг) — населенный пункт или функциональный центр, который имеет критическую массу людей, инфицированных ВИЧ, достаточную для поддержания эпидемических показателей на характерном для него уровне. Наиболее важное отличие именно эпидемического центра от сопредельной освоенной территории в том, что имеет место его активное влияние на диффузию ВИЧ/СПИД в рамках своего стандарта (определение ниже). Д. В. Николаенко выделяет три принципиальных типа эпидемических центров (очагов):
1) эпидемические очаги как населенные пункты;
2) эпидемические очаги как функциональные центры;
3) эпидемические очаги как инвестиционные проекты в районах пионерного освоения территорий.
Все они формируют специфические пространственные сети (см. ниже), определяющие районы вторичного распространения ВИЧ-инфекции.
Эпидемический микроочаг — район крупного города или микрорайон с различными типами стабильных поселений, в котором есть критическая масса людей, инфицированных ВИЧ/СПИД, достаточная для поддержания эпидемических показателей на стабильном и аномально (относительно) высоком уровне. Количественные показатели могут быть различными. Наиболее важно наличие эпидемического градиента (см. ниже) с остальной территорией и активное влияние данного микрорайона на диффузию ВИЧ/СПИД в другие районы. Эпидемические микроочаги могут быть различными. Они могут быть связаны как с общинами-анклавами, воспроизводящими эпидемические константы своего социокультурного образования, так и с различными группами риска, имеющими территориальное компактное проживание.
Первичное распространение ВИЧ/СПИД — вариант распространения ВИЧ/СПИД, при котором инфицирование людей происходит на территориях риска.
Вторичное распространение ВИЧ/СПИД — вариант распространения ВИЧ/СПИД, при котором инфицированность приобретается за пределами территорий риска и постоянного проживания. В районах площадного распространения ВИЧ-инфекции с очень высокими показателями инфицированности населения разделение понятий первичного и вторичного распространения частично может утрачивать смысл. Например, такое положение имеет место на юге Африки. Сама территория постоянного проживания характеризуется (подразумевается) относительно благополучной с эпидемической точки зрения. Естественно, эта «благополучность» в высшей степени относительна. Для тауншипа в ЮАР можно считать благополучными и показатели ВИЧ-инфицированности в 30 %.
В силу развития стандарта диффузии ВИЧ-инфекции (см. ниже) изменение эпидемической ситуации может сделать территорию вторичного распространения эпидемическим очагом и, соответственно, изменить ее статус. Происходит морфологическое изменение локальной эпидемической ситуации. Например, таковы сельские районы в провинции Квазулу-Наталь (ЮАР), связанные с исконными местами проживания народа зулу. В начале развития эпидемии они были районами вторичного распространения ВИЧ-инфекции. После 15–20 лет развития данной эпидемии они стали районами первичного распространения ВИЧ-инфекции. Это связано с особенностями сексуальной культуры зулу. Наиболее существенно то, что причины такой трансформации носят внутренний характер. Количественные показатели по ВИЧ/СПИД имеют основания в особенностях организации человеческой среды обитания.
Социокультурная система (СКС) — тип организации человеческой жизнедеятельности, для которого характерны устойчивые и закономерно воспроизводящиеся признаки. Они имеют гуманитарное и биологическое выражение. Гуманитарное выражение связано с особенностями языка, религии, восприятия пространства и времени, доминирующими стандартами сексуального поведения и др. Биологическое выражение связано с генотипическими, фенотипическими и развивающимися после рождения и в условиях проживания в строго определенной географической среде адаптационными особенностями людей. Все СКС связаны с доминирующими для них типами природных сред, в которых они сформировались.
При выходе ее представителей за пределы исконной территории обитания сформированные ранее доминирующие биологические характеристики сохраняются. В том числе сохраняются и некоторые признаки адаптационного характера. Это может делать людей более или менее уязвимыми к возбудителям определенных инфекционных болезней за пределами их традиционных территорий проживания. Частным выражением эволюции СКС является различный характер эпидемических процессов, которые происходят с их участием. Наиболее полное выражение это имеет в естественной структуре заболеваемости населения, характерной для определенного района СКС.
Стандарт диффузии ВИЧ/СПИД — целостная система распространения ВИЧ/СПИД в конкретной СКС. Для них характерны закономерные и специфические пространственные, временные, структурные, количественные эпидемические показатели, доминирующие факторные наборы, определяющие особенности распространения ВИЧ/СПИД.
Эпидемический градиент — различие эпидемических характеристик определенных территорий. В рамках однотипной СКС определение градиентов важно для исследования и прогнозирования диффузии ВИЧ-инфекции.
Эпидемический «каскад» — разновидность эпидемического градиента, связанная с драматическим различием показателей заболеваемости. Ключевое понятие здесь — «драматическое различие». Обычно «каскад» проявляется в условиях связи диффузии ВИЧ/СПИД в естественных условиях и эпидемических функциональных центрах (см. ниже). Их эпидемические характеристики могут катастрофически различаться даже для одной СКС. Например, таково различие эпидемических показателей в местах заключения и «на воле». В зависимости от стандарта диффузии ВИЧ/СПИД такой вариант может быть более или менее значимым фактором, влияющим на темп и характер диффузии ВИЧ-инфекции в СКС. В некоторых районах мира имеет место «каскад» по причине сосуществования различных стандартов диффузии ВИЧ-инфекции. Например, такое положение в ЮАР. Показатели ВИЧ-инфицированности европейского и африканского населения различаются драматически.
Эпидемическое давление — совокупность прямых и опосредованных воздействий, которые оказывает эпидемический очаг или район площадного распространения инфекции на другую освоенную территорию. Это понятие пространственное, а не территориальное. В данном случае непосредственное соседство территорий т. е. обязательная характеристика эпидемического очага. Примером могут быть связи районов постоянного проживания людей и районов, в которые совершаются трудовые миграции. Между ними может быть «пустое место», определяемое временем переезда. Например, таково положение в связи Дурбана (провинция Квазулу-Наталь, ЮАР) и Йоханнесбурга (провинция Гаутенг в ЮАР). Примерно аналогичная ситуация с трудовыми поездками в постсоветских государствах.
При исследовании достаточно большого массива информации по эпидемии ВИЧ/СПИД можно определить связь, характеризующую эпидемическое давление одной территории на другую. Эпидемическое давление меняется по мере формирования пространственно-временной структуры эпидемии ВИЧ/СПИД. Изменение достаточно медленное (с точки зрения человека), сроки изменений в пять-десять лет.
Несколько лет эпидемические показатели территорий могут быть однопорядковые. Затем они могут меняться в сторону увеличения или снижения. Это связано с эволюцией морфологической структуры эпидемических очагов, составляющих данную эпидемию ВИЧ/СПИД (пример такой структуризации см. в разд. 4.2.3, «Морфологическая структура эпидемических очагов нециклического типа»). Например, совокупность неких эпидемических точек (см. ниже) перерастает в эпидемический центр (см. выше «Эпидемический центр»). В таком случае начинает сказываться давление нового центра на самое себя. Эпидемическое давление старых центров на него может резко снижаться, но эпидемическая ситуация в таком районе не улучшается. Происходит трансформация морфологических единиц эпидемии ВИЧ/СПИД. Локальные эпидемические показатели изменяются согласно логике эволюции морфологической структуры эпидемического очага. Абсолютные показатели количества ВИЧ-инфицированных людей в районе резко возрастают.
Эпидемические константы — относительно стабильные эпидемические показатели распространения ВИЧ/СПИД, характерные для определенной обитаемой территории. Такими территориями могут быть социокультурные образования в целом, характерные для них социокультурные районы и более мелкие таксономические пространственно-временные единицы. Важно, что ими могут быть и общины-анклавы. Например, таковы общины выходцев из черной Африки, проживающих в Западной Европе. В них есть критическая масса людей, и они практически всегда воспроизводят эпидемические константы своей СКС, независимо от периода проживания в Западной Европе. Формируется некий порядок показателей распространения ВИЧ/СПИД, который характерен для строго определенного типа социокультурной среды.
Эпидемическая точка — населенный пункт, в котором проживает некоторое количество людей, инфицированных ВИЧ. Количественные показатели могут быть различными. Наиболее важный признак эпидемической точки в том, что она не оказывает активного эпидемического влияния на сопредельный или удаленные районы. Разумеется, дальнейшее распространение ВИЧ/СПИД в ее пределах может иметь место, но оно не носит существенного характера. Это единичные случаи.
Эпидемическая цепь (трасса) — совокупность эпидемических точек. Как правило, они связаны с одним из эпидемических очагов. Наиболее важно именно пространственно-временное соотношение источников передачи ВИЧ/СПИД. Есть некая территория, которая наиболее активна и определяет диффузию эпидемических показателей за ее пределами. Именно она формирует совокупность эпидемических точек (трассу). Примером эпидемической цепи может быть государство Гаити и влияние его эмигрантов, нелегально направляющихся в США, на эпидемическую ситуацию в Карибском регионе. Траектории перемещения гаитянских эмигрантов достаточно стабильны. Они и ведут к формированию эпидемической трассы, для которой характерны более высокие эпидемические показатели, чем на сопредельных территориях.
Эпидемический функциональный центр — (достаточно) закрытая организация, в которой есть некоторое количество инфицированных ВИЧ/СПИД людей, имеющая специфические эпидемические показатели, отличные от характерных для данного района и/или социокультурной среды. Это может быть место заключения, закрытая школа, монастырь и многие другие заведения, в которых могут генерироваться специфические и более высокие эпидемические показатели.
Эпидемическая сеть — устойчивая совокупность пространственно-временных связей между эпидемическим очагом и точками вторичного распространения эпидемии ВИЧ/СПИД, которая формируется на некой территории. Для формирования эпидемической сети весьма важны границы социокультурных образований. Они являются ее важным ограничением, поскольку именно они отражают наиболее устойчивые и важные связи, сформировавшиеся в процессе исторически длительного освоения территорий.
Площадное распространение — тип распространения, при котором показатель позитивности взрослого населения на ВИЧ/СПИД достигает 4 % и выше. Показатель определен на основании статистического анализа диффузионных процессов в странах юга Африки. Характерен для районов с доминирующим гетеросексуальным путем распространения ВИЧ-инфекции. Также должен проявляться в средах с первоначальным доминированием диффузии ВИЧ-инфекции как спутника употребления инъекционных наркотиков. Это территория риска. Вероятность заражения во время пребывания на ней резко возрастает. Меняется характер эпидемической диффузии.
Региональное площадное распространение — вариант распространения ВИЧ/СПИД, при котором площадной стандарт с показателями 4 % и выше имеет место не в рамках государства в целом, а в его отдельном макрорайоне. Такой вариант встречается в условиях поляризованного освоения территорий, для которого характерна высокая степень неравномерности расселения и разнообразие типов освоения территорий.
Микроплощадное распространение — вариант распространения ВИЧ/СПИД, при котором площадной стандарт с показателями 4 % и выше имеет место не в рамках государства, макрорайона или в пределах крупного города, а лишь в четко локализованном микрорайоне крупного города. Несмотря на незначительные количественные характеристики среды своего распространения, например, относительно небольшую численность населения, микроплощадное распространение отличается высокой степенью устойчивости. Оно связано с общинами-анклавами. Примером может быть Гарлем (район Нью-Йорка), заселенный афроамериканцами.
4.2.2. Нециклические пандемические и эпидемические процессы
Типовые периоды нециклического эпидемического (пандемического) процесса. Почему невозможно использовать вакцинацию в борьбе с ВИЧ/СПИД-пандемией.
К настоящему времени у нас нет других свидетельств завершения хотя бы одного эпидемического (эпизоотического) процесса, вызванного паразитом, использующим вторую стратегию, кроме эндогенных ретровирусов в геноме человека. Поэтому у меня нет возможности показать стадии развития нециклического эпидемического процесса на разных конкретных примерах, как это сделано в разд. 4.1.2. Ниже мы их рассмотрим в пределах условного процесса, межэпидемический и предэпидемический период которого «списаны» с ВИЧ/СПИД-пандемии (рис. 73).
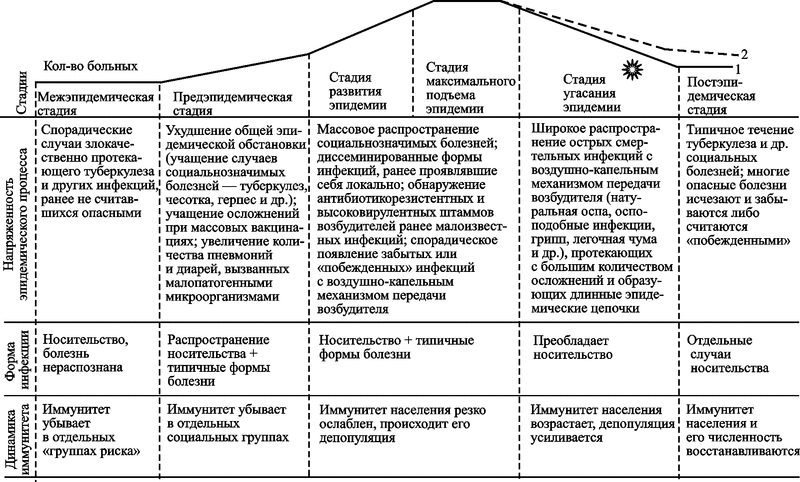
Рис. 73. Схематическое изображение стадий эпидемического процесса, вызванного микроорганизмом, использующим вторую стратегию паразитизма: 1 — кривая торможения пандемии; 2 — кривая вымирания H. sapiens; — изменение эволюционной траектории
Типовые периоды нециклического эпидемического (пандемического) процесса. В глобальном масштабе этот процесс не может осуществляться равномерно и с одинаковой скоростью, так как на пути распространения возбудителя нециклической инфекции стоят территориальные и политические границы, скорость его распространения различна в разных СКС, различается также и восприимчивость к нему различных этносов и групп населения. Существуют и другие факторы, тормозящие или ускоряющие ход пандемии, их мы рассмотрим ниже, однако все они имеют значение только на отрезках времени, сопоставимых по продолжительности с различными социальными, политическими и иными событиями в жизни людей.
Отсутствие иммунной прослойки среди населения и передача между хозяевами возбудителя инфекции половым путем являются причиной того, что в бесконечно больших панмиксных популяциях хозяина продолжительность эпидемического (пандемического) процесса может соответствовать продолжительности его существования как биологического вида.
В межэпидемический период возбудитель, использующий стратегию паразитизма второго типа, поддерживается в микроочагах (здесь и далее используются определения, предложенные Д. В. Николаенко) и, как правило, неизвестен ни эпидемиологам, ни ученым. Микроочаги могут поддерживаться далеко за пределами эндемичных территорий, оставаясь еще со времен предыдущей активизации пандемии (см. разд. 4.2.3), либо поддерживаясь в общинах-анклавах мигрантов, воспроизводящих эпидемические константы своей СКС, так и с различными группами риска, имеющими территориальное компактное проживание (см. у Николаенко Д. В., 2007).
В научных журналах публикуются описания казуистических случаев тяжелых форм туберкулеза, отмечается рост внелегочных форм этой болезни, врачи общих стационаров иногда сталкиваются с пневмониями, неподдающимися лечению антибиотиками и вызванными какими-то редкими, малопатогенными возбудителями, по большей части остающимися неидентифицированными. Сведения о них иногда попадают в учебники по внутренним болезням в виде коротких справок, набранных мелким шрифтом (например, о цитомегаловирусной пневмонии).
К концу этого периода на отдельных эндемических территориях формируются эпидемические центры (очаги) инфекции. Эпидемические центры начинают оказывать эпидемическое давление на невовлеченные в эпидемию территории, между ними образуются эпидемические градиенты. Начинается диффузия возбудителя инфекции за пределы эндемичных территорий (и территорий риска). Формируются глобальные эпидемические цепи (трассы) распространения возбудителя инфекции, связанные с конкретными очагами (рис. 74).
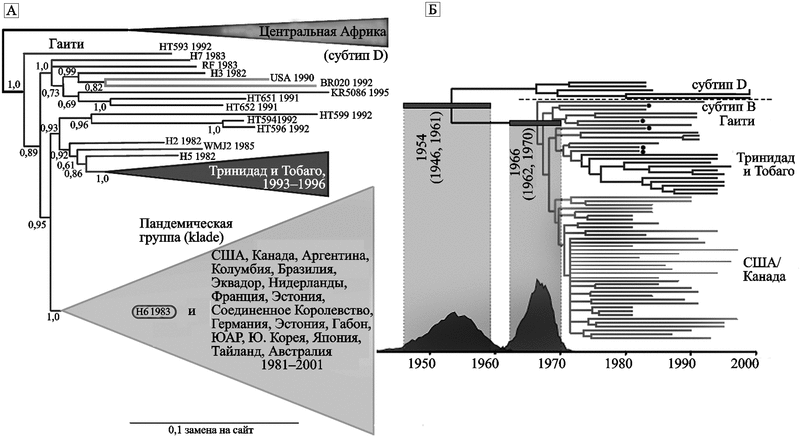
Рис. 74. Эволюция и глобальное распространение ВИЧ группы М субтипа В.
А. Эволюционное древо ВИЧ, построенное с помощью MrBayes-анализа полных генов env. Свидетельствует о появлении у людей данного типа вируса в Центральной Африке южнее Сахары (sub-Saharan Africa) в 1950-х гг., заносе его сначала на Гаити около 1966 г. (1962–1970 гг.), затем в США (1966–1972 гг.) и в другие страны.
Б. Консенсусное древо (consensus tree) по типу молекулярных часов. Для его построения использовались образцы тканей людей, умерших от СПИДа, сохранившиеся на Гаити. Верхушка древа соответствует году отбора первой пробы
ВИЧ группы М субтипа В сегодня наиболее широко представлен среди других вариантов ВИЧ. Большинство распространяющихся вирусов данного подтипа появились на Гаити в 1960-х гг. В США ВИЧ субтипа В циркулировал, по крайней мере, за 12 лет перед тем как была распознана пандемия ВИЧ/СПИДа (Gilbert M. et al., 2007). Рис. 74 также свидетельствует о том, что пандемия ВИЧ/СПИДа началась не менее 50-ти лет назад. Любопытно и то, что в 1950-е гг. она не только не получила широкого распространения, но и оборвалась. О возможных причинах этого явления см. в разд. 4.2.3.
Уже в этот период эпидемического процесса упускаются имеющиеся возможности по разрыву эпидемических цепей. Инфицирование населения и формирование микроочагов ускоряются медицинскими манипуляциями. Когда инфицирование населения достигает некой критической массы, лицам, занимающимся исследованием статистики инфекционной заболеваемости, становится очевидным ухудшение эпидемической обстановки. Обращают на себя внимание необычные инфекции в отдельных СКС. Причины же ухудшения эпидемической ситуации остаются неясными. Эпидемический процесс входит в предэпидемическую стадию, его напряженность нарастает. Начинается вторичное распространение возбудителя нециклической инфекции с территорий очагов, сформировавшихся за пределами его эндемичного распространения. Формируются устойчивые локальные эпидемические сети, но пока в пределах отдельных СКС.
Эпидемии по-прежнему проявляют себя тяжелыми инфекционными осложнениями, вызванными таксономически мало связанными между собой патогенами, ранее редко встречавшихся врачам. На фоне экономического благополучия регистрируется рост социальных болезней (туберкулез, особенно его внелегочные формы; чесотка; проказа и др.). Большое количество жертв при массовых вакцинациях, уже превышающее количество жертв той болезни, от которой такая вакцинация проводится, заставляет органы здравоохранения отказаться от ряда прививок. Например, с 1920-х гг. противооспенная вакцинация становилась все более обременительной для здравоохранения, так как она сопровождалась нарастающим количеством случаев поствакцинальных энцефалитов, вакцинальной экземы и прогрессирующей вакцины («progressive vaccinia») (рис. 75).
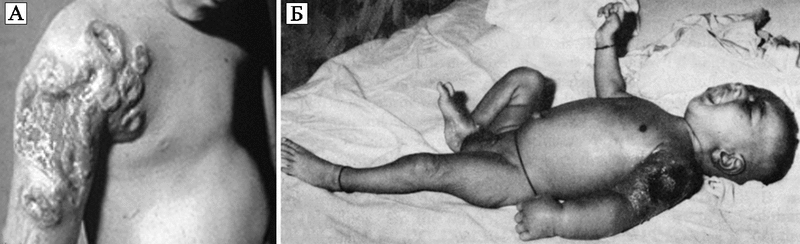
Рис. 75. Прогрессирующая вакцина после вакцинации против натуральной оспы внешне здоровых детей.
А. Прогрессирующая вакцина у вакцинированного ребенка с нераспознанным лейкозом. По D. Maurer et al. (2003).
Б. Ребенок, умерший от прогрессирующей вакцины, причины которой так не были установлены. По А. Braude et al. (1986)
В стационарах растет количество больных с диареями и пневмониями, вызванными малозначимыми ранее возбудителями. Появляются первые научные работы, описывающие типичные формы новой инфекционной болезни и вызывающих их микроорганизмов. Постепенно становится ясной ее этиология. Требуется осмысление новой эпидемической реальности, однако этого не происходит. На основе ложных представлений об эпидемическом процессе принимаются неверные управленческие решения. Борьба с новой инфекцией строится на основе опыта борьбы с инфекциями, вызываемыми паразитами, использующими стратегию первого типа, и поэтому изначально она обречена на неудачу. Активно «создаются» вакцины, подбираются химиопрепараты, разрабатываются методы химиотерапии.
Так как клетки-хелперы (CD4+-клетки) избирательно элиминируются ВИЧ, то не происходит индукции адаптивных CD8+-клеток и эффективных В-клеточных ответов на использованный для вакцинации вирус вакцины (Vaccinia virus, VACV). Соответственно не вырабатывается вирусспецифический иммуноглобулин, играющий основную роль в блокировании ортопоксвирусных инфекций (см. разд. 3.1). До обнаружения пандемий ВИЧ/СПИДа и Т-клеточного лейкоза многие случаи осложнений, показанные на рисунках, были связаны с инфицированием людей этими ретровирусам. Но только в 1980-х гг., уже после глобальной ликвидации ВНО и прекращения массовых вакцинаций, стала ясна причина прогрессирующей вакцины. D. Zagury (1991) описал осложнения противооспенной вакцинации у рекрутов в виде широкого некроза в участке подкожного введения вакцины, приведшего к гибели 3 человек из 8, у которых ретроспективно был установлен СПИД. У лиц, погибших после вакцинации, количество CD4-клеток было менее 50 в мм3.
Возбудитель болезни распространяется на отдельные социальные группы населения, проникает в отдельные СКС в результате ошибок и несчастных случаев, например, переливания инфицированной крови или каких-то хирургических манипуляций. Иммунитет населения ослабевает, отмечается рост онкологической заболеваемости. В эпидемических центрах (очагах) снижается средняя продолжительность жизни за счет смертности среди лиц, недостигших 30-летнего возраста. Но новая пандемия не кажется еще опасной и даже сулит новые перспективы ученым в виде грантов, ассигнований, новых должностей и наград. Начинают стихийно формироваться весьма разнообразные силы, заинтересованные в отсутствии вообще каких-либо противоэпидемических мероприятий. Теперь и их деятельность становится проявлением нового пандемического процесса.
1. Поскольку возбудитель болезни передается половым путем и в первую очередь поражает людей с рискованным сексуальным поведением и гомосексуалистов, то любые противоэпидемические мероприятия должны сказаться на «интересах» прежде всего этих, весьма широких и элитарных групп населения. Поэтому через СМИ у населения формируется определенный стандарт восприятия пандемии, как распространения неопасной болезни, при которой важно не предотвращение инфицирования его, населения, а соблюдение прав «инфицированных». Фальсифицируются биографии знаменитых людей, в соответствии с которыми они были инфицированы возбудителем этой болезни (как, например, биография певца Фредди Меркьюри, о котором говорили, что он умер от СПИДа; более подробно о причинах его смерти см. в книге Ахундовой М., 2005) Такой подход к освещению пандемии в СМИ агрессивно поддерживают личности, страдающие комплексом самоуничтожения и всякого рода вырожденцы. Среди отдельных групп людей, нежелающих изменять своим привычкам, формируется убеждение в том, что пандемии нет, ее придумали врачи. Практика «соблюдения прав» доводится до абсурда — становится невозможным даже обсуждать постоянно ухудшающуюся эпидемическую ситуацию вне каких-то политически выверенных установок. Реальная эпидемическая ситуация искажается, общественное внимание переводится на ложные фетиши, вроде единичных случаев атипичной пневмонии или птичьего гриппа среди людей. Все ждут какую-то другую эпидемическую катастрофу.
2. Другой заинтересованной силой становятся фармацевтические компании, организации медицинского сервиса и отдельные «деятели науки». Пандемия рассматривается ими просто как источник наживы. Связь «деятелей науки» и чиновников в борьбе с новым пандемическим вызовом порождает пандемию коррупции. Бесконечно создаются какие-то вакцины. Когда испытания одних вакцин заходят в тупик, начинают испытывать новые «вакцины» и т. д. и т. п. Власти обещают начать борьбу с пандемией, как только создадут вакцину. Вакцина объявляется единственным средством, способным остановить пандемию. Формируются устойчивые группы ученых, предпринимателей, чиновников, политиков и «правозащитников », материально заинтересованных в развитии пандемии.
3. Пандемия рассматривается определенными политическими силами как инструмент разрушения неугодных государств и истребления «неполноценных народов» (например с черным или желтым цветом кожи; с «тоталитарными режимами власти», неспособных к восприятию идей демократии и т. п.), но по какому-то историческому недоразумению несправедливо занимающих территории, богатые газом, нефтью, полезными ископаемыми и чистой водой. Этим странам последовательно навязываются противоэпидемические мероприятия, ухудшающие эпидемические показатели, но соответствующие придуманным «демократическим стандартам».
Пока какая-то часть вида Homo sapiens ожидает для себя «новых возможностей », а другая — новых вакцин и спасительных таблеток, локальные эпидемические сети становятся глобальными. Эпидемическое давление на невовлеченные в эпидемические процессы территории достигает максимума. Отдельные эпидемии «сливаются» в пандемию.
В стадии развития пандемии возбудитель болезни выходит за пределы групп риска, СКС и других социальных образований. Инфицированность населения на разных территориях становится все более однородной, не остается территорий с неинфицированным населением. Теперь основной путь передачи возбудителя болезни — половой, основной контингент инфицированных — семейные гетеросексуальные пары и их дети. Лечение ассоциированных инфекций все более затрудняется появлением резистентных к химиопрепаратам штаммов малопатогенных организмов, этиологическое лечение оказывается неэффективным и только приводит к появлению все более опасных штаммов возбудителя болезни. Возможности по получению новых препаратов исчерпываются. Крупные частные компании прекращают финансирование проектов по разработке вакцин, финансирование таких исследований ведется из государственного бюджета в рамках многочисленных коррупционных схем. Масштабы и опасность эпидемии от населения по-прежнему скрываются властями и СМИ. На этом фоне, как проявление отчаяния людей, подозревающих, что они стали жертвой какого-то обмана, появляются «демоны эпидемий» — так в Средние века называли заболевших чумой людей, заражающих других в отместку за свое несчастье. Власти крупных городов сталкиваются с проблемой выделения территорий под новые кладбища.
В стадии своего максимального развития эпидемия распадается на несколько десятков масштабных эпидемий, вызываемых возбудителями «ассоциированных инфекций». Повсеместно фиксируется распространение социально-значимых болезней (туберкулез, чесотка, герпес 1-го и 2-го типов, в отдельных странах — проказа и др.). Болезни, ранее проявлявшие себя локально (чесотка, герпес) либо носительством (криптоспоридоз, сальмонеллез и др.), протекают как диссеминированные формы инфекций, переходящие в сепсис. Обнаруживаются антибиотико-резистентные и высоковирулентные штаммы возбудителей ранее малоизвестных инфекционных болезней. Регистрируются упорные вспышки контагиозных инфекций, считавшихся контролируемыми. Периодически фиксируются вспышки среди людей оспы обезьян и оспы коров, формирующие длинные не кажется еще опасной и даже сулит новые перспективы ученым в виде грантов, ассигнований, новых должностей и наград. Начинают стихийно формироваться весьма разнообразные силы, заинтересованные в отсутствии вообще каких-либо противоэпидемических мероприятий. Теперь и их деятельность становится проявлением нового пандемического процесса. эпидемические цепочки, причем в большинстве случаев не удается проследить источник заражения, и его фальсифицируют. Иммунитет населения резко ослаблен, происходит его депопуляция.
Далее (стадия угасания пандемии) события могут развиваться по всем трем направлениям, показанным на рис. 73. Первое предполагает задействование имеющихся в природе механизмов прекращения эпидемий данного типа (кривая торможения пандемии); второе направление реализуется при их отсутствии (кривая вымирания вида Homo sapiens). Третье — изменение эволюционной траектории вида; может иметь место на фоне второго варианта развития событий, как его продолжение.
Сначала рассмотрим развитие событий по первому направлению. Болезнь охватывает все слои общества, включая элитарные. Крупные состояния оказываются без наследников, исчезают отдельные слои населения и этносы, которые в силу своих традиций и генетических особенностей особенно подвержены инфицированию. В отдельных эпидемических центрах происходит «этническая подмена». Ее суть в том, что ранее жившие на этих территориях этнические группы под давлением пандемии погибают полностью, а на их место мигрируют другие и присваивают себе название прежнего этноса (наблюдение Д. В. Николаенко, сделанное им в ЮАР).
Широкое распространение получают острые смертельные инфекции с воздушно-капельным механизмом передачи (оспоподобные инфекции, грипп, легочная чума и др.). Их активизация зависит от региона; эпидемические цепочки, как правило, необычно длинные. Особое удивление у ученых вызовет появление болезней, считавшихся уничтоженными. Среди них оспоподобная инфекция, по контагиозности и смертельным исходам сопоставимая с большой оспой (variola major) (см. разд. 4.2.3). Ее распространение приобретет тяжелый характер с преобладанием смертельных форм болезни, меры вакцинации окажутся столь же неэффективными как во время пандемии натуральной оспы 1871–1874 гг. (Бразоль Л. Е., 1875). Из-за распространения таких инфекций депопуляция населения значительно усилится, однако его иммунитет начнет постепенно подниматься из-за гибели иммунодефицитных лиц. В постэпидемической стадии типичное течение туберкулеза и других социальных болезней восстановится; многие опасные инфекционные болезни будут считаться «побежденными ». Но численность населения будет восстанавливаться несколько поколений из-за повторяющихся вспышек опасных циклических инфекций, вызванных пульсациями угасающих природных очагов.
При развитии событий по второму направлению основная борьба среди участников этого пандемического процесса будет разворачиваться на уровне генома человека, как проявление соперничества ретровирусов между собой и с теми мобильными элементами хромосом, которые играют роль «защитных экранов» генома от таких паразитов. Как вариант возможных событий, преимущество получит паразит, способный к более эффективной интеграции и противодействию репарационным системам хозяина. Увеличение же числа сайтов интеграции генетического паразита, блокирование им репарационных систем клетки, конкуренция с генами-трансактиваторами (трансрегуляторами) ВИЧ, перемещение по геному с захватом участков ДНК, интеграция в гомеозисные гены приведут к возникновению патологии, которая далеко не сразу будет воспринята клиницистами как инфекционная.
Возможные клинические проявления таких болезней представлены ранее (Супотницкий М. В., 2000; Супотницкий М. В. 1996). Ими могут быть прогрессирующие неоплазии, иммунодефициты (без выявления ВИЧ), мышечная дистрофия, демиелинизация, отложения бета-амилоидных белков, атеросклероз, психические нарушения. Если исходить из того, что паразит будет способен осваивать экологические ниши вытесняемого им ВИЧ, то более вероятна патология, связанная с дефектами ДНК Т-лимфоцитов и макрофагов, эндотелиоцитов кровеносных и лимфатических сосудов, эпителиальных клеток кожи, астроцитов и нейронов мозга.
Пандемия, развивающаяся по второму направлению, прекратится значительно позже, чем по первому, не раньше чем будет достигнуто 100 % инфицирование населения. Постэпидемической стадии не будет.
Развитие событий по третьему направлению уже неоднократно имело место в эволюционной истории приматов вообще, и гоминоидов в частности (см. разд. 1.2), детали этого процесса неизвестны. Да и саму эволюцию гоминоидов нельзя представить в виде эволюционного древа, у которого отдельные ветви «развиваются» в прочные стволы, наоборот, они почти все уже «обломаны» естественным отбором (рис. 76).
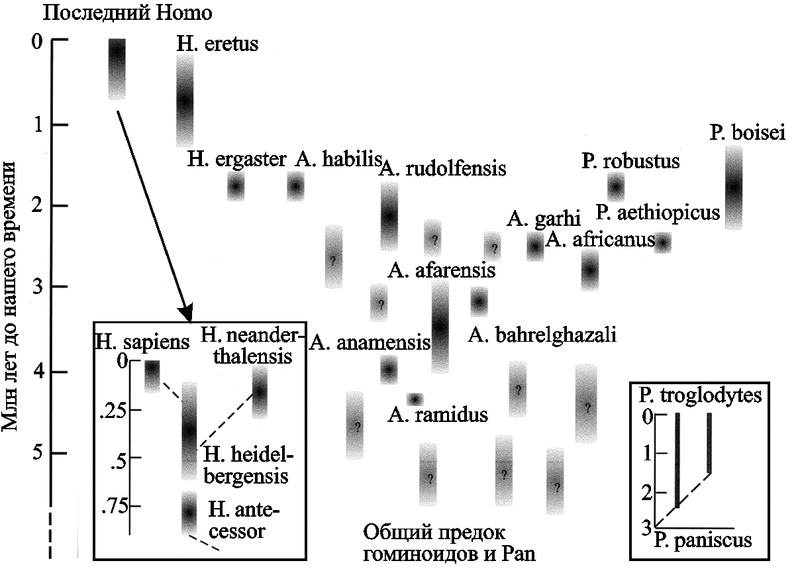
Рис. 76. Эволюция гоминоидов по D. Wood и B. Richmond (2000).
Гоминоиды представлены короткоживущими (в геологических масштабах времени, разумеется) видами. По сути, это диссипативные виды (см. разд. 2.3), «взрывное» образование которых имело место в период 5–1,5 млн лет назад, после дивергенции гоминоидов и предков современных обезьян. Однако эволюция гоминоидов не дала ни одной прочной ветви на эволюционном древе приматов. Сегодня из всего многообразия «мыслящей жизни» периода «взрывного» появления гоминоидов остался только один вид — наш
Начало изменению эволюционной траектории вида Homo sapiens положит эндогенизация ВИЧ у какой-то части инфицированного и географически изолированного населения. В условиях географической изоляции станет невозможным панмиксическое «перемешивание» генофонда лиц с эндогенизировавшимся ВИЧ, с генофондом населения, у которого эндогенизация ВИЧ невозможна. Близкородственное скрещивание (инбридинг) увеличит количество новых эндогенных ретровирусов в геноме человека (см., например, работу Mang R. et al., 2001) до какой-то критической массы, когда генетическая дивергенция вида станет необратимой. Видообразование в результате географической изоляции эволюционисты называют аллопатрическим. Более подробно о механизмах видообразования можно прочитать в работе А. В. Яблокова, А. Г. Юсуфова (1998). Сам же ВИЧ возможно еще десятки поколений «новых людей» будет играть роль фактора стабилизирующего отбора, «закрепляющего» новые генотипы путем негативной селекции особей современного вида Homo sapiens. Что будет представлять собой «новый вид», предполагать трудно. Совсем не обязательно, что эволюция Homo sapiens пойдет по пути его улучшения в нашем понимании «хорошего». В разд. 1.2 приведены примеры из палеонтологии гоминоидов, свидетельствующие о том, что последние 150 тыс. лет у человека современного типа имело место снижение объема мозга. К тому же интеграционные акты, в которых участвуют ретроэлементы, могут приводить не только к созданию новых экзонов, но и к их аннулированию (см. рис. 14).
Произойдет эндогенизация ВИЧ или нет, сейчас трудно предугадать. Возможно, что этот процесс идет, но мы пока не знаем критериев, по которым его можно зафиксировать (см. разд. 4.2.3, «Молчащие педиатрические инфекции»). Распространение ВИЧ среди популяций людей продолжается. Благодаря деятельности их иммунной системы, ВИЧ становится все более многообразным (см. рис. 47 и 74). Многообразие (полиморфизация) вируса складывается с многообразием вовлекающихся в пандемию генотипов людей. Возможно, что механизм эндогенизации экзогенных ретровирусов запускается каким-то иным, неизвестным нам сегодня способом, но нет сомнения в том, что он существует в объективной реальности как часть целого — эволюции.
Почему невозможно использовать вакцинацию в борьбе с ВИЧ/СПИДпандемией. В разд. 4.1.2 не приведены описания пандемий натуральной оспы, хотя они развиваются циклически. Причина следующая. Победа над оспой стала главным итогом противоэпидемической борьбы ХХ в. Сегодня опыт борьбы с ВНО рассматривается как приемлемый для борьбы с ВИЧ/СПИД-пандемией, но только в аспекте массовых вакцинаций (см., например, удручающий труд академика РАМН Воробьева А. А., 2003). Эта точка зрения в России является массовой и как бы свидетельствует о прогрессивности ученого. Обращение же к научной литературе XIX и ХХ вв. показывает, что борьба с натуральной оспой посредством вакцинации шла с переменным успехом и вакцинация не сыграла той решающей роли в глобальной ликвидации натуральной оспы, которую ей приписывают сегодня. Поэтому история эпидемий натуральной оспы и мероприятий борьбы с ней приводится ниже в контексте возможности перенесения накопленного тогда опыта на борьбу с ВИЧ/СПИД-пандемией.
В табл. 22 приведен краткий сравнительный анализ биологических свойств ВНО и ВИЧ (обоснование приведенных данных см. в гл. 3).
Таблица 22
Краткий сравнительный анализ биологических свойств ВНО и ВИЧ*
|
Свойства |
ВНО |
ВИЧ |
|
Таксономия |
Семейство Poxviridae |
Семейство Retroviridae |
|
Механизм проникновение в организм человека |
Воздушно-капельным путем |
Половым, от матери к плоду и через инфицированную кровь |
|
Репликация на начальном этапе инфекционного процесса (первичная виремия) |
Преимущественно в моноцитах/макрофагах |
Преимущественно в фагоцитирующих клетках (макрофаги, моноциты, дендритные клети) и Т-хелперах |
|
Течение инфекционного процесса |
Циклический монопроцесс |
Многокомпонентный нециклический процесс |
|
Развитие стерильного иммунитета |
Возможно |
Невозможно |
|
Т- и В-клеточные ответы |
Сохранены |
Нарушены |
|
Взаимоотношения с фагоцитирующими клетками |
Паразитические |
Преимущественно симбиотические |
|
Основная антигеная детерминанта |
Консервативный белок L1. Необходим для сборки вириона, поэтому не подвергается конформационным изменениям |
Консервативный домен V3 гликопротеина gp120. Относится к структурам, связывающимся с рецепторами на поверхности макрофагов и Т-хелперов, подвержен конформационным изменениям |
|
Роль в инфекционном процессе антител к основным антигенным детерминантам |
Блокируют инфекционный процесс |
Усиливают инфекционный процесс |
|
Феномен антитело-зависимого усиления инфекции |
Не наблюдается |
Наблюдается |
|
Феномен первичного антигенного греха |
Не наблюдается |
Наблюдается |
|
Феномен инфекционно-эволюционных качелей |
Не наблюдается |
Наблюдается |
|
Роль комплемента в инфекционном процессе |
Блокирует инфекционный процесс |
Усиливает инфекционный процесс |
|
Наличие в геноме человека подобных структур |
Нет |
До 45 % генома составляют эндогенные ретроэлементы |
|
Взаимодействие с системой APOBEC макрофагов и Т-хелперов |
Нет |
Система поддерживает варианты вируса с интактным геном vif (вирулентности) |
* По М. В. Супотницкому (2008).
Сравнение инфекционных процессов и иммунных ответов на ВНО и ВИЧ (см. в гл. 3), показало следующее.
1. ВНО вызывает инфекционный монопроцесс, имеющий циклическое течение. На начальном этапе инфекции он ведет себя как облигатный паразит фагоцитирующих клеток, имеет короткий цикл размножения, разрушает клетку и в течение первых двух суток с момента проникновения в организм человека становится доступным как для антител, так и клонов лимфоцитов, несущих иммунологическую память об антигене, использованном для вакцинации. Сохранение Т- и В-клеточных звеньев иммунитета формирует полноценные гуморальные и клеточные ответы на вирус, способствующие его полной элиминации из организма, инфекционный процесс прекращается. Поэтому ВНО меняет хозяина на 8–10-е сутки от начала болезни, но так как люди, перенесшие натуральную оспу, формируют иммунную прослойку, препятствующую дальнейшему распространению вируса, вызываемый им эпидемический процесс ограничивается, т. е. носит циклический характер.
2. На начальном этапе инфекции ВИЧ взаимодействует с клетками иммунной системы более сложно, чем ВНО. Он колонизирует как макрофаги, так и Т-клетки-хелперы и устанавливает контроль над их генетическим аппаратом. Вирус блокирует апоптоз макрофага и интегрируется с геномом Т-хелпера, поэтому его персистирование по макроорганизму не может контролироваться специфическими антителами, как это происходит в отношении ВНО. В зависимости от рецепторов, посредством которых ВИЧ взаимодействует с макрофагом, он вступает с ним либо в симбиотические отношения, либо начинает размножаться. Оба этих процесса идут одновременно и усиливают диссеминацию ВИЧ. Инфекционный процесс постоянно усложняется, к моменту смерти больного он представляет уже комплекс нециклических инфекционных процессов, в которых участвуют не только ВИЧ и возбудители СПИД-ассоциируемых инфекций, но и эндогенные ретровирусы человека. Так как ВИЧ передается в основном половым путем, а иммунная система человека неспособна ограничить размножение вируса и сформировать иммунную прослойку среди населения, как это имеет место в отношении ВНО, то вызванный им эпидемический процесс носит необратимый нециклический характер.
3. Иммунная система человека воспринимает ВНО и другие ортопоксвирусы как антигенно-чужеродные объекты и элиминирует их из организма. Роль основной антигенной детерминанты у вирусов данного семейства играет консервативный белок L1, участвующий в морфогенезе вирусной частицы. Это крупный миристиолированный оболочечный белок, экспрессирующийся на поверхности внутриклеточных созревающих вирионов возбудителя натуральной оспы (IMV-форма вируса). Его консервативная часть формирует гидрофобную «каверну», необходимую для сборки вириона, поэтому он не может подвергаться конформационным изменениям и маскироваться полисахаридными «экранами». После лизиса клетки, L1 экспонируется функционально неповрежденным Т- и В-клеткам иммунной системы и вызывает полноценные гуморальные и клеточные ответы на ВНО.
4. Иммунная система человека не только не воспринимает ВИЧ как антигенно-чужеродный объект, но и способствует его размножению, эволюции и распространению по человеческим популяциям. Причины данного явления кроются в совместной эволюционной истории ретровирусов и многоклеточных организмов и нуждаются в исследовании (см. разд. 2.3). Основные консервативные домены оболочечных белков интактных частиц ВИЧ относятся к структурам, связывающимся с рецепторами и корецепторами на поверхности макрофагов и Т-хелперов. Они либо экранированы карбонгидратными группами, либо «заглублены» и малодоступны для антител. Роль основной антигенной детерминанты у ВИЧ играет консервативный домен V3 гликопротеина gp120, однако антитела к нему усиливают проникновение вируса в фагоцитирующие клетки посредством взаимодействия с рецептором Fc. Благодаря феномену антителозависимого усиления инфекции, антитела к V3 и к некоторым другим «антигенам» способствуют прогрессированию ВИЧ-инфекции и переносу вируса от матери к плоду. Иммунизация приматов оболочечными белками ВИЧ сопровождается феноменом «первичного антигенного греха» и не предотвращает развитие ВИЧ-инфекции.
Таким образом, сравнение биологических свойств ВНО и ВИЧ свидетельствует о профанации проблемы борьбы с пандемией ВИЧ/СПИДа путем ее отождествления с натуральной оспой. Теперь попробуем разобраться, как и почему мы «победили» натуральную оспу.
Глобальная цикличность в появлении эпидемий натуральной оспы. При перенесении опыта борьбы с натуральной оспой на пандемию ВИЧ/СПИДа необходимо учитывать глобальную многовековую цикличность в появлении оспенных пандемий, т. е. они могут исчезать «сами по себе», а потом «возвращаться».
Анализ исторических источников, проведенный историком эпидемий В. Губертом (1896), свидетельствует, по крайней мере, о трех «пришествиях» натуральной оспы на Европейский континент. Первое упоминание об оспе в исторических источниках приходится на IV в. Историк церкви Евсевий Памфил (Eusebius, ок. 260–340) дает следующее описание повальных болезней и народных бедствий, пришедшихся на 313 г. (год смерти римского императора Максимина, произвол которого против христиан прервала эта эпидемическая катастрофа, что особенно подчеркивает Евсевий): «Обычные во время зимы ливни и дожди не орошали землю в прежнем количестве; неожиданно обрушились голод, чума, к тому же появилась новая болезнь — язва, сопровождавшаяся огненным жаром и за эту особенность названная «антракс». Распространяясь по всему телу, она грозила великой опасностью. Появлялась она преимущественно на глазах и сделала слепыми бесчисленное множество мужчин, и женщин, и детей» (цит. по русскому изданию «Церковной истории», 2001). Интересно, что Евсевий считал «чуму» общеизвестной болезнью, а вот такой «антракс» он видел впервые («антраксом» также называют сибирскую язву, но в цитированном тексте речь идет о натуральной оспе, так как Евсевий пишет о слепоте — осложнении, характерном для этой болезни).
Первое достоверное указание на масштабные оспенные эпидемии в Европе В. Губерт относил к 541 г. К этому времени, по свидетельству С. Гемблоурского (Sigbert Gemblours), в Галлии свирепствовала эпидемия, описание которой в соответствует натуральной оспе. В VI–VII вв. об оспе упоминают многие как европейские, так и арабские источники и даже Коран (105 сура). Но в VIII–Х вв. сообщения об оспенных эпидемиях в Европе исключительно редки и касаются только тех случаев, когда ее жертвами становились влиятельные люди или в связи с какими-то другими значительными для современников событиями. А арабский писатель и врач Рази (Razi, Rhases, 850–923) рассматривал оспу как новую болезнь, неизвестную древним греческим врачам и пытался найти ответ на вопрос — знал ли Гален об оспе? И, видимо, ни он, ни его современники не находили на него однозначного ответа.
Летописные источники первых веков второго тысячелетия содержат очень мало упоминаний об оспенных эпидемиях. Особенно странно это выглядит на фоне начавшихся крестовых походов (с 1096 г.), которые, казалось бы, должны способствовать их распространению. Но в конце XII в. оспа в Европе как бы «очнулась». По неизвестным причинам после почти двухсотлетней «спячки» контагиозность и вирулентность возбудителя оспы начали расти, что вновь нашло свое отражение в летописях. Одно из первых упоминаний о крупной оспенной эпидемии в Европе приходится на 1174 г., когда болезнь вновь появилась в Лондоне и произвела там страшные опустошения. Хроники XIII–XIV вв. уже изобилуют указаниями на оспенные эпидемии. В середине XV в. оспенные эпидемии в Европе достигли особенного размаха в Ломбардии, Голландии, Франции, Германии. Но к концу XV в. оспа снова перестала интересовать летописцев, и количество летописных записей об оспенных эпидемиях значительно снизилось.
Сообщения о масштабных оспенных эпидемиях в начале XVI в. приходят не из Европы, а из «Новых земель», открытых как в «Новом Свете», так и в Сибири. В Европе в начале XVI в. о крупных эпидемиях оспы, сопровождающихся высокой смертностью заболевших людей, неизвестно. Но в 1527 г. роли «туземцев» и «европейцев» меняются. Оспа, по восприятию современников, впервые (!) появилась в Дании, затем в 1536 г. в Париже, и вскоре она распространилась по всей Европе. Со второй половины XVIII в. смертность от оспы начала снижаться, что более детально мы разберем, когда будем рассматривать натуральную оспу накануне введения массовых вакцинаций. Сейчас обратим внимание еще на другую закономерность — оспа не приходит одна, она возвращается как пандемия на фоне появления других опасных пандемий.
Появлению оспы в VI в. предшествовало распространение проказы или болезни, которую тогда считали «проказой». На фоне «свирепствования» этих двух болезней распространилась чума («Чума Юстиниана»).
Второй пандемии чумы, названной «черной смертью» (1346–1351 гг.), предшествовали те же пандемические события, что и «Юстиниановой чуме». С XI в. в Европе вновь активизируется «проказа». Чума «черная смерть» за 5 лет охватила Европу опять же на фоне масштабных оспенных эпидемий. Исчезновение «проказы» началось в конце XV в. вместе с исчезновением натуральной оспы, прежде всего в Италии, несколько позже во Франции, потом в Голландии и Северной Германии (Гезер Г., 1866).
В середине XIX в. оспа, чума и проказа считались побежденными болезнями (см. работу Веревкина И., 1867), но уже с 1870-х гг. они начали повсеместно возвращаться, что должно иметь какие-то серьезные основания, кроющиеся в экологии возбудителей этих болезней (см. разд. 2.2).
Натуральная оспа перед началом массовых вакцинаций. Чтобы составить себе представление о том, что же представляла натуральная оспа до Дженнера, обратимся к отчетам об оспенных эпидемиях XVII–XVIII вв., приведенных как сторонниками, так и противниками вакцинации.
1. Болели и умирали от оспы только дети. Взрослые, если заболевали оспой, то не умирали от нее; или если умирали, то чрезвычайно редко. По утверждению детально исследовавшего этот вопрос противника вакцинации Л. Е. Бразоля (1875), в доступной ему богатейшей медицинской литературе везде, где говорится об оспенных эпидемиях XVIII в., упоминается лишь о гибели детей; и сама оспа называлась детской болезнью (kinderblattern). Так, в Берлине в 1721 г. умерло от оспы 224 ребенка; в 1722 г. — 231; в 1724 г. — 179 детей; из взрослых же никого.
В Женеве за период 1680–1760 гг. наблюдалось на 1000 умерших от оспы около 13 человек в возрасте свыше 20 лет. В Стокгольме за периоды 1774–1787 гг. и 1788–1800 гг. в данной возрастной группе 4–8 погибших. По данным Л. Бразоля (1875), такое соотношение заболевших и умерших оставалось в отдельных группах никогда невакцинованного населения даже во второй половине XIX в. Он приводит данные по смертности от оспы в секте липован (в Буковине), у которых вакцинация всегда была запрещена. На 1000 смертельных случаев от оспы 932 приходились на возраст 0–5 лет и 68 на возраст 6–10 лет; взрослые редко заболевали и не умирали от оспы. По его же данным, в медицинских сочинениях и отчетах XVIII в. нет указаний на смертельные случаи от оспы в армии.
2. Там, где оспа была эндемичной болезнью, она собирала относительно постоянное количество жертв среди населения. Из данных, приведенных в табл. 23 по десятилетним периодам, сглаживающим 5–6-летние пики заболеваемости оспой, следует, что в Лондоне ежегодное число погибших от оспы стабильно находилось в пределах шестидесяти человек на тысячу умерших в течение почти полутора веков.
Таблица 23
Распределение числа умерших от оспы в Лондоне за период с 1700-го до 1800 года (по десятилетиям)*
|
Периоды времени |
Число умерших от оспы на 1000 умерших от всех причин |
|
1650-1660 |
48 |
|
1660-1670 |
36 |
|
1670-1680 |
71 |
|
1680-1690 |
74 |
|
1690-1700 |
71 |
|
1700-1710 |
53 |
|
1710-1720 |
81 |
|
1720-1730 |
82 |
|
1730-1740 |
76 |
|
1740-1750 |
77 |
|
1750-1760 |
100 |
|
1760-1770 |
108 |
|
1770-1780 |
98 |
|
1780-1790 |
87 |
|
1790-1800 |
88 |
* По Л. Бразолю (1875) и В. Губерту (1896).
3. Смертность не превышала 12 –14 % всех заболевших оспой в различных возрастах. Умирали преимущественно дети младших возрастов.
4. Оспенные эпидемии конца XVIII в. не приводили к депопуляции населения.
5. В конце XVIII в. в Европе происходило снижение заболеваемости натуральной оспой. Ниже приводится знаменитая таблица Саймона, составленная им в середине XIX в. (табл. 24). Ее использовали сторонники вакцинации для обоснования целесообразности обязательной вакцинации населения.
Таблица 24
Смертность от оспы в Швеции с 1776-го по 1825 г. (на 100 тыс. человек)*
|
Возраст, группы |
1776-80 гг. |
1781-85 гг. |
1786-90 гг. |
1791-95 гг. |
1796-00 гг. |
1801-05 гг. |
1806-10 гг. |
1811-15 гг. |
1816-15 гг. |
1816-25 гг. |
|
0-5 |
1692,2 |
1440,7 |
1227,2 |
1001,9 |
1257,3 |
635,9 |
460,7 |
123,5 |
63,2 |
65,7 |
|
6-10 |
426,7 |
371,0 |
266,2 |
245,8 |
282,9 |
129,7 |
112,3 |
31,7 |
19,4 |
10,2 |
|
11-15 |
93,6 |
113,2 |
64,4 |
50,6 |
65,9 |
14,2 |
13,9 |
6,4 |
7,2 |
11,5 |
|
16-20 |
37,3 |
44,8 |
31,0 |
18,4 |
23,9 |
|||||
|
21-25 |
14,8 |
18,4 |
13,0 |
6,0 |
9,9 |
* Большая медицинская энциклопедия, 1932, т. 23.
Однако, анализируя распределение заболеваемости по годам, нетрудно убедиться в том, что такое влияние вакцинации на заболеваемость натуральной оспой невозможно. Падение заболеваемости в Швеции началось еще в начале 80-х гг. XVIII в. К 1800 г. заболеваемость оспой снизилась почти в 2,5 раза, но тогда в Швеции не было еще ни одного вакцинированного ребенка. В 1801 г., по данным самого же Саймона, во всей Швеции было только два вакцинированных ребенка, один в Мольмо (Molmo), вакцинированный 23 ноября, и один в Стокгольме, вакцинированный 17 декабря. На основании официальных цифр, заимствованных из сводки Королевского статистического бюро, общее число вакцинированных во всей Швеции в 1804 г. равнялось 28 418, что составляло тогда едва только 1 % всего населения. Количество же умерших от оспы было почти в 4 раза меньшим, чем в 1776 г. Падение заболеваемости натуральной оспой наблюдалось и в других странах. Например, в Лондоне на 1000 смертей вообще смертность от оспы стала уменьшаться еще с 70-х гг. XVIII в. Сходная ситуация наблюдалась в конце XVIII в. и в Берлине, и в Петербурге (Губерт В., 1896). Таким образом, накануне введения массовой вакцинации натуральная оспа была в основном детской болезнью и она сама «уходила» с Европейского континента.
Введение практики вакцинации как средства борьбы с натуральной оспой. Вакцинация «выросла» из оспопрививания (вариоляции) — очень древнего способа привития натуральной оспы от больного с легким течением болезни здоровому человеку с целью его защиты от этой болезни. Подробно об истории оспопрививания можно прочитать в работах А. Никитина (1885) и В. Губерта (1896). На момент разработки Дженнером (Eduard Jenner, 1749–1823) своего метода, оспопрививание в Европе зашло в тупик из-за большого количества осложнения и даже смертей привитых людей (погибал каждый 50–100 привитый человек). Повышение смертности в середине XVIII в. от натуральной оспы, отраженное в табл. 23, — это результат бесконтрольного массового использования оспопрививания.
Дженнер, сельский хирург, также как и остальные его коллеги, занимался оспопрививанием. Дженнер обнаружил, что всякий раз, когда он делал вариоляцию лицам, которые ранее переболевали коровьей оспой, человеческая (натуральная) оспа у них не приживалась. С этим феноменом сталкивались и другие хирурги, но они не были любопытны. Дженнером было выяснено, что все эти пациенты в прошлом заражались коровьей оспой при доении коров на ферме, пораженных особой сыпью на вымени. Далее он установил, что эта болезнь с незапамятных времен известна на скотных дворах, и что между всеми скотниками и скотницами распространено представление о том, что она предохраняет от настоящей оспы. Лубочная часть его жизни излагается следующим образом. Утром 2/14 мая 1796 г. Дженнер в присутствии врачей и посторонних лиц, произвел два поверхностных надреза на руке здорового, восьмилетнего мальчика и привил «вакцинный яд», т. е. содержимое пустулы с правой кисти женщины, случайно заразившейся оспой от коров при дойке (рис. 77).
Рис. 77. Привитие Дженнером коровьей оспы (вакцины, cow-pox) Джеймсу Фипсу с руки молочницы Saran Nelmess. (Saran стоит справа, заматывая кисть руки бинтом) 2/14 мая 1796 г. Картина G. Vtlingue, 1879 г. (из книги Губерта В., 1896).
Пустулы, воспроизведенные таким образом на руке ребенка, имели большое сходство с пустулами, происходящими от прививания натуральной оспы, но болезненное состояние, обычно сопровождавшее вариоляцию, здесь не было так выражено. Через полтора месяца Дженнер взял содержимое пустулы человека, заболевшего натуральной оспой, и привил ее Джеймсу, оспа не привилась. Далее он провел много добросовестных экспериментов и доказал эффективность и безопасность своего способа защиты от натуральной оспы, и, разумеется, нажил врагов и завистников, а не денег и славы. Плохо вскрытый панариций у сельского кузнеца ему бы, конечно, простили, но вот средство, способное оградить мир от оспы, — это «шапка не по Сеньке». За свое открытие ему пришлось перетерпеть много неприятностей, но та часть жизни Дженнера не является предметом нашего анализа. В 1799–1801 гг. хирург В. Вудвилл (W. Woodvill) вакцинировал в лондонском Оспенном госпитале 7500 человек, подвергнув большую их половину контрольной прививке натуральной оспы; результаты получились самые блестящие. Племянник Эдварда Дженнера, Джеймс (G. C. Jenner), привил 30 тыс. человек без малейших осложнений. Почти 200 из них произведено контрольное прививание натуральной оспы, обнаружившее полный иммунитет вакцинированных лиц. С 1800 г. вакцинация стала признанной и распространенной медицинской процедурой, и мы можем проанализировать некоторые ее отдаленные последствия.
Отдаленные последствия вакцинации. Вместе с оживленной деятельностью начала XIX в. по распространению вакцинации, оспенные заболевания стали уменьшаться в своей частоте. Продолжалась и тенденция к их снижению, обозначившаяся еще в прошлом веке (см. табл. 24). По данным, собранным Н. Ф. Гамалеей (1913, 1934), в Лондоне за десятилетие 1791–1800 гг. было 18 477 смертей от оспы; за 1801–1810 гг. — 12534; а за 1811–1820 гг. — 7858. Впечатляющие результаты были получены в Швеции, Дании и Германии. Статистическая отчетность свидетельствовала о том, что население от оспы защищено и оспа вскоре будет побеждена. Но вскоре выяснилось, что эти ожидания оказались преждевременными.
Тревожные симптомы «возвращения» оспы стали появляться довольно рано и, как это ни парадоксально, на родине Дженнера в Англии и еще во время его жизни. В 1808 г. в Рингвуде, в 1813 г. в Ферфаксе, в 1812-м и 1816 гг. в Норвиче вспыхнули эпидемии оспы. Их с трудом удалось «потушить», как тогда считали, посредством широкой вакцинации населения.
К концу второго десятилетия XIX в. наступил кризис. Оспенные эпидемии стали развиваться повсюду. Они снова охватили Европу и Америку. В Монпелье в 1816 г., в Эдинбурге в 1817–1818 гг., в Марселе, Бордо и других французских городах в 1818 г. и в последующие годы, в Норвиче в 1819 г., в Нью-Йopке, Филадельфии и других американских городах в 1820 г. Затем в Женеве в 1822–1823 гг., в Дублине в 1823–1824 гг., в Швеции в 1823 г., в Берлине в 1823–1824 гг., в Милане в 1823–1824 гг., в Дании в 1824–1827 гг., в Лозанне в 1827 г., снова в Марселе в 1827–1828 гг.
Любопытны данные Dezeimeris (1839), описавшего «возвращение» оспы в Данию. С 1800-го по 1804 г. в стране не было замечено ни одного случая оспы у вакцинированных людей. В 1804 г. обнаружены два случая, но они представляли собой вариолоиды (легкая форма оспы). В 1805 г. в Копенгагене умерло от такого вариолоида 5 человек, а в 1806 г. еще трое. В 1808 г. умерло 46 человек от натуральной оспы, из которых у 13 болезнь протекала в форме вариолоида. В 1819 г. случаи вариолоидов и даже натуральной оспы стали обнаруживаться среди вакцинированных людей. В 1823 г. среди вакцинированных людей оспа приобрела повальный характер. Власти вынуждены были открыть оспенный госпиталь в Копенгагене. С 1824-го по 1827 г. последовало три повальных эпидемии оспы. Из 412 больных натуральной оспой, принятых в оспенный госпиталь, 257 были в детстве привиты вакциной.
Первая оспенная пандемия «времен вакцинации» затихла «сама собой» уже к середине 1830-х гг, однако она заставила переосмыслить причины ее возникновения. Особенно странным при этих эпидемиях был факт, не замедливший обратить на себя внимание исследователей, — заболевания оспой вакцинированных прежде людей. В Эдинбурге на 626 заболевших оспой было 344 привитых; в Дублине на 584 больных — 94 привитых; в Копенгагене на 988 оспенных больных — 659 привитых; в Марселе на 6000 больных — 2000 привитых. В Лондоне среди заболевших оспой людей было отмечено непрерывное нарастание количества случаев оспы среди вакцинированных. В 1809 г. их было 4 на 146 больных, т. е. 1 на 36,5; в 1819 г. — 17 на 47, т. е. 1 на 5; в 1822 г. — 57 на 194, т. е. 1 на 4; в 1825 г. — 147 на 305, т. е. почти 1 на 2.
Ввиду таких фактов, естественно, появились сомнения в защитном значении вакцинации. Снова начались дискуссии между ее противниками и ее сторонниками. Однако накапливались новые доказательства предохранительного действия вакцинации. Тогда возникла мысль о неправильности вакцинации у заболевших людей. Анализ существовавшей практики приготовления прививочного материала и техники вакцинации показал, что нередко прививки осуществлялись испорченным прививным материалом. Кроме того, дело прививок скоро перешло в руки невежественных людей и коммерсантов от медицины. Началась борьба эмпирически выстроенных учений.
Наиболее обоснованным было учение о «вырождении вакцины». Вакцина со времени Дженнера в течение четырех десятков лет прошла через бесчисленные поколения прививаемых пациентов.
Однозначных доказательств причастности «вырождения» гуманизированной вакцины к возобновлению оспенных эпидемий получено не было. Тогда стала все более укрепляться мысль, высказанная еще в 1818 г. профессором Годенпилем из Роттердама, о возможности исчезновения с годами защиты вакцинированных людей от заболевания натуральной оспой. Эта возможность сначала упорно отрицалась всеми, ввиду того что Дженнером как раз были собраны факты, доказывающие, что коровья оспа, перенесенная десятки лет назад, предохраняет от последствий заражения или инокуляции. Доказательства правильности мнения Годенпиля были получены в результате изучения возраста людей, заболевающих оспой. Но это исследование показало, что оспа, которая в прежние времена была чисто детской болезнью, стала, после введения вакцинации, поражать преимущественно взрослых. Например, в Пруссии, до введения вакцинации, из 1252 заболевших оспой 44,5 % были возрасте до 10 лет, старше 20 лет не было ни одного больного. После введения вакцинации ситуация поменялась — в Вюртемберге из 667 больных только 18,4 % были моложе 10 лет; 42 % было старше 20 лет.
Прямым последствием убеждения в ослаблении иммунитета с возрастом стало требование вторичной вакцинации — ревакцинации. Для того чтобы ревакцинация получила повсеместное практическое использование, потребовалась новая эпидемическая трагедия. В 1840–1850-е гг. натуральная оспа вновь стала редкостью в Европе. Но «затишье» было обманчивым. Оспа «тихой сапой» возвращалась в Европу как пандемическая болезнь, правда почти десятилетие обнаружить ее возвращение можно было только методами медицинской статистики. Статистик Э. Энгель (Engel; 1821–1896) вычислил, что смерть от оспы в 1860 г. встречается чаще, чем за 40 лет до того — во времена первой пандемии «после Дженнера»: в 1820 г. регистрировалось 10,56 смертей от оспы на 1000 умерших жителей, а в 1860 г. — 18,95 на 1000.
Катастрофа разразилась в 1870–1874-х гг. — натуральная оспа вернулась как пандемическая болезнь сразу на Североамериканском континенте, в Европе и России. Вакцинация не сдержала эту пандемию. Да и само появление натуральной оспы сразу на нескольких континентах больше говорит о глобальной активизции каких-то пока неизвестных природных очагов ВНО. Но большинство ученых связало ее появление с непоследовательным проведением ревакцинации населения. Во многих странах были приняты соответствующие законы, были значительно усовершенствованы технологии получения дермальной осповакцины. Даже во время Первой мировой войны 1914–1918 гг. пандемия натуральной оспы типа случившейся в 1870–1874 гг. не повторилась. К 1928 г. натуральную оспу на Европейском континенте и в СССР удалось полностью взять под контроль. До 1980-х гг. ВНО даже не рассматривали в качестве потенциального агента биологического оружия.
Глобальная ликвидация натуральной оспы. Вторая мировая война привела к ухудшению эпидемической ситуации по оспе. По сравнению с довоенным 1939 г., в конце войны количество зарегистрированных случаев оспы увеличилось более чем вдвое, возросло и число стран, где она наблюдалась. В целом ареал оспы охватывал обширные территории Африки, Азии и Америки, где проживало не менее 2/3 всего человечества.
Но в послевоенной Европе оспенные вспышки носили завозной характер. Несмотря на то что общее число заболевших во время таких вспышек, как правило, не было большим, появление оспы заметно осложняло нормальную жизнь страны и требовало значительных, а порой и огромных усилий и затрат для ограничения распространения инфекции и ликвидации ее очагов (см. ниже). Помимо этого, европейские страны, а также
другие свободные от оспы государства, вынуждены были затрачивать огромные средства на проведение мероприятий, направленных на предупреждение завоза оспы. В число этих мер входили: производство и контроль оспенной вакцины, организация и проведение профилактических прививок населению, санитарно-карантинные мероприятия и т. д. Первичная вакцинация против оспы, при всем ее положительном значении для охраны здоровья общества, в целом ряде случаев приводила к развитию тяжелых, а иногда и смертельных поствакцинальных осложнений. Их статистика во многих странах производила удручающее впечатление — от поствакцинальных осложнений ежегодно погибало больше людей, чем за 10 лет от завозов оспы. Причины развития таких осложнений не были тогда ясны, но вновь, как и в начале XIX в., возникли сомнения в целесообразности первичной вакцинации населения (см. рис. 75).
Становилась все более очевидной необходимость борьбы с оспой на новой основе — ее полного искоренения совместными согласованными действиями всех стран мира. И тогда многие ученые снова вернулись к идее Э. Дженнера о возможности ликвидации натуральной оспы путем всеобщей вакцинации. Теперь они располагали уже реальными техническими возможностями для осуществления этих планов. Рассмотрим ход дальнейших событий по работам И. Д. Ладного (1985) и С. С. Маренниковой, С. Н. Щелкунова (1999).
Теоретические обоснования возможности нового глобального проекта были следующими.
1. Эпидемиология натуральной оспы была всесторонне изучена. Многолетние наблюдения свидетельствовали о том, что заразное начало при оспе передается от человека к человеку без участия каких-либо представителей позвоночных или насекомых. Следовательно, основной особенностью натуральной оспы является ее классический антропонозный характер, поскольку многочисленными наблюдениями в эпидемических очагах установлено, что источником инфекции при натуральной оспе является только больной человек.
2. Имевшаяся противоэпидемическая практика свидетельствовала, что главным механизмом распространения инфекции при оспе является воздушно-капельный, при котором заразное начало выделяется с капельками слюны и слизи через рот и нос. Однако, несмотря на высокую заразительность больного натуральной оспой, разнообразие механизмов передачи инфекции и исключительную восприимчивость человека к ней, замкнутая цепь эпидемического процесса поддавалась разрыву во всех ее звеньях, а прекращение заболеваемости среди людей приводило к исчезновению на данной территории источников инфекции.
3. В распоряжении правительств многих стран имелась высокоэффективная живая вакцина, однократная прививка которой создает полноценную невосприимчивость на 3–5 лет, причем этот иммунитет может быть продлен путем ревакцинации. К моменту принятия программы ликвидации оспы в 1958 г. в СССР и других странах уже производилась лиофильно-высушенная вакцина. Такая вакцина обладала устойчивостью к температурному фактору, что было чрезвычайно важно для стран тропической Африки, Азии, Южной Америки, где жидкий препарат быстро инактивировался.
4. Имелась возможность распознавания оспы на ранней стадии болезни по характерным клиническим признакам без лабораторных методов диагностики, что позволяло заподозрить данное заболевание и своевременно провести комплекс противоэпидемических мероприятий. При натуральной оспе таким характерным признаком являлась сыпь. По виду сыпи и особенностям ее развития оспа резко отличается от других экзантемных инфекций.
5. К 50–60-м гг. ХХ в. были разработаны новые методы лабораторной диагностики, отличающиеся высокой чувствительностью, значительно расширившие возможности распознавания оспы практически на всех стадиях болезни. Их принципиальное отличие от ранее использовавшихся методов лабораторного диагноза заключалось в быстроте ответа и в возможности провести дифференциацию ВНО от других близкородственных поксвирусов;
6. Имелся положительный опыт организационных и практических мероприятий, приведших к полной ликвидации натуральной оспы на территории СССР и ряда других стран.
Сразу замечу, что ситуация с ВИЧ сегодня противоположна той, что была накануне принятия этой программы. Болезнь хоть и носит антропонозный характер, но механизм передачи ее возбудителя исключает возможность любого контроля над ним и разрыва эпидемической цепи, так как человечество, как биологический вид, в таком случае не смогло бы существовать. Вакцина создана не будет по выше приведенным причинам, а возможность контроля над болезнью по характерным клиническим признакам отсутствует. Существующие методы лабораторной диагностики ВИЧ-инфекции не могут быть использованы в таких масштабах, какие применялись при ликвидации натуральной оспы; нет опыта ликвидации ВИЧ-инфекции даже в масштабах хотя бы небольшого острова.
После провозглашения в 1959 г. Программы ликвидации натуральной оспы в глобальном масштабе во многих странах мира начались массовые кампании вакцинации против оспы, которые в течение всего первого этапа программы рассматривались ВОЗ в качестве важнейшей и наиболее действенной ее составляющей. Ожидания были самыми оптимистичными. Ликвидировать оспу надеялись в течение четырех или пяти лет. Однако цель программы оказалась недостигнутой, несмотря на то что было потрачено вдвое больше времени, чем это первоначально планировалось. Оспа по-прежнему сохранялась в ее основных эндемических очагах (в Азии, Африке и Южной Америке).
Как показали в дальнейшем специальные исследования, из всей используемой в эндемических странах сухой оспенной вакцины лишь 10–15 % соответствовали по качеству международным требованиям. Однако не только низкое качество вакцины и неполнота охвата населения вакцинацией были причинами малой эффективности Программы на первом этапе. Среди основных факторов, которые повлияли на исход первого этапа Программы, была недооценка ВОЗ роли эпидемического надзора как важного инструмента для борьбы с оспой.
Эпидемический надзор. На заседании научной группы по ликвидации оспы (октябрь, 1967 г.) эксперты рассмотрели ход выполнения как отдельных национальных программ, так и Программы в целом с обращением особого внимания на факторы, оказывающие отрицательное влияние на ее развитие. Наиболее существенным было то, что эта научная группа впервые подчеркнула важное значение эпидемического надзора. Проведение систематической вакцинации населения стало рассматриваться как поддерживающая мера. Это изменение стратегии основывалось на результатах анализа практической деятельности при проведении кампании в различных странах. Например, начиная с 1962 г. кампания массовой вакцинации в Индии не привела к сколько-нибудь заметному снижению заболеваемости оспой к 1967 г. В Индонезии на острове Ява, где охват вакцинацией населения превышал 90 %, продолжалась трансмиссия оспы. В то же время опыт ряда стран Западной Африки показал, что введение системы активного эпиднадзора позволяет быстро выявлять вспышки оспы и проводить эффективные меры по их ограничению и подавлению с помощью экстренной вакцинации населения этих районов.
На опыте противоэпидемических мероприятий, проводившихся в Индии, целесообразно остановиться подробнее, так как именно здесь стратегия эпидемического надзора была применена в период чрезвычайно высокого уровня заболеваемости. Метод активного выявления больных оспой состоял в этой стране в следующем: один раз в месяц силами вспомогательного персонала медицинских учреждений районов в течение недели проводился обход всех деревень штата с целью выявления больных оспой. Поскольку обходы проводились не медицинским персоналом, то сведения о случаях натуральной оспы после этого подтверждались врачом или санитарным инспектором (средний медицинский работник). В конце недели сведения представлялись врачу района (или санитарному инспектору), который организовывал бригады вакцинаторов из своего персонала и направлял их для проведения вакцинации всем членам семьи больного и жителям ближайших домов.
По мере того как число вспышек уменьшалось, количество домов, жители которых подлежали вакцинации, увеличивалось. С октября 1974 г. прививались жители ближайших 50 домов или вся деревня. В специальной книге регистрировались все жители и отмечались сведения о прививках против оспы в прошлом, а также в данный момент. Если кто-либо из людей, проживающих в деревне, отсутствовал, вакцинатор должен был посетить его второй раз и в случае отказа от прививки сделать соответствующую отметку в книге. После окончания прививок деревня находилась под наблюдением в течение 6 недель. Визит вакцинатора повторялся один раз в неделю. В двух наиболее пораженных районах штата Бихар обходы проводились с интервалом в неделю вместо 4–6 недель. За неделей обходов следовала неделя вакцинации. Сокращение интервалов между обходами деревень увеличивало не только полноту выявления больных, но и обеспечивало обнаружение больных на более ранней стадии болезни.
Новая для программы система оказалась более эффективной для прерывания трансмиссии оспы, чем «поголовная» вакцинация даже в тех случаях, когда было вакцинировано менее половины населения на данной территории. С учетом этих данных Комитет экспертов определил эпиднадзор как краеугольный камень стратегии ликвидации оспы (WHO Expert Committee on Smallpox Eradication, 1972).
Помимо переоценки роли эпиднадзора, сделанной научной группой в 1967 г. и Комитетом экспертов по ликвидации оспы в 1972 г., чрезвычайно значение имела рекомендация о необходимости введения оценки и контроля каждого компонента Программы и развитие службы регистрации и оповещения о случаях заболевания. Именно контроль за результатами проведенной работы обеспечил реальную базу для принятия правильных решений. Через год, в декабре 1979 г., комиссия пришла к выводу об успешном завершении Программы в глобальном масштабе.
Перенесение опыта ликвидации натуральной оспы на борьбу с ВИЧ/СПИДпандемией. Теперь поясню, что на практике означает перенос этого опыта на борьбу с ВИЧ-пандемией. Придется сначала многократно исследовать сложными иммунологическими и молекулярно-биологическими методами (а не только путем осмотра санитаром кожных покровов) население каждого города или деревни на носительство ВИЧ. Затем выявленных ВИЧ-инфицированных жителей изолировать до конца их жизни (а не на 5–10 дней, как это делали в очагах натуральной оспы в Индии), и только потом оставшееся население многократно вакцинировать ВИЧ-вакциной, если такая вдруг будет создана. Возможно ли почти 50 млн ВИЧ-инфицированных человек таким образом «изъять» из эпидемических цепочек? Нет. Тогда зачем «пускать пыль в глаза» бесконечными разговорами типа: «Вот создадим ВИЧ-вакцину и тогда покончим с ВИЧ, как с натуральной оспой»?
Теперь посмотрим, какими усилиями ликвидировались даже небольшие вспышки натуральной оспы (сводка сделана по работам Серенко А. Ф., 1962; Еремяна А. В., 1962; Дубровинского С. Б., I964; Duncan S. R., Scott S., 1996).
Вспышка в Нью-Йорке в 1947 г. Всего 12 заболевших, двое из них умерли. Диагноз натуральной оспы сначала был отвергнут врачами, так как в анамнезе первого заболевшего не установлено контакта с больным натуральной оспой, не отмечалось характерных для оспы высыпаний. К тому же у больного были ясно видны знаки от противооспенных прививок в детстве. Год назад в Мехико его вакцинировали, но реакция на прививку оказалась отрицательной. В течение месяца в Нью-Йорке было привито 6350 тыс. жителей города, вспышка была локализована. Сейчас в научной литературе обсуждается возможность смертельных исходов от поражений сердца, вызванных вакцинацией.
Во время вспышки оспы в Хидальго в 1949 г. (США, штат Техас) зарегистрировано 8 случаев заболевания, двое заболевших погибли. Для ликвидации вспышки было привито 239 тыс. человек.
Завозная оспа в Москве в 1959 г. Первый заболевший за 2 недели до выезда в Дели «был вакцинирован против оспы, но вакцинальной реакции у него не было отмечено, ранее прививался против оспы только в детстве». Всего заболело 46 человек, умерло трое. В Московской городской санитарно-эпидемиологической станции имелось в наличии 3 млн доз вакцины, в Институте им. Н. Ф. Гамалеи — 5 млн доз. Недостающее количество вакцины — 6 млн доз горздравотдел просил Министерство здравоохранения РСФСР выделить из научно-исследовательских институтов и санитарноэпидемиологических станций других городов и областей страны. В течение 3 дней в Московскую городскую санитарно-эпидемиологическую станцию было доставлено самолетами 10 млн доз противооспенной вакцины Краснодарской краевой санитарно-эпидемиологической станции. По указанию Министерства здравоохранения СССР Институт им. И. И. Мечникова изготовил дополнительно 6 млн доз противооспенной вакцины. Для проведения прививок в Москве был организован 3391 прививочный пункт и работало 8522 прививочные бригады. Всего в проведении прививок участвовало 26 963 медицинских работника (врачей и сестер). Для проведения вакцинации были привлечены врачи научно-исследовательских институтов. Созданы специальные бригады квалифицированных врачей для визуальной проверки результатов вакцинации. Под медицинским наблюдением на дому и в учреждениях по месту работы по Москве и Московской области находилось 5074 человека. Кроме того, в инфекционной больнице им. С. П. Боткина находилось под медицинским наблюдением 966 человек медицинского и обслуживающего персонала и 2092 больных.
Завозная оспа в Германии в 1970 г. Отели и гостиницы были блокированы военными, и туда направлялись в сопровождении последних все, о ком было известно, что они контактировали с заболевшими. В карантине в условиях изоляции в течение двух недель и более побывало почти 10 тыс. человек. Закрыли свои границы соседние страны. Во время вспышки оспой переболело 175 человек, 35 из которых умерли. Всего в Германии было вакцинировано 20 млн человек!
Вот так «гасили» вакцинацией единичные завозные случаи натуральной оспы, которые нередко начинались с людей, вакцинированных по оспе. Ясно, что количество ВИЧ-инфицированных людей несопоставимо с масштабами этих «побед».
4.2.3. Глобальные пандемические циклы
Морфологическая структура эпидемических очагов нециклического типа. «Молчащие педиатрические инфекции». CCR5-рецептор. «Змеиный клубок ». Эволюционные процессы в ВИЧ-инфицированных популяциях людей. Возвращение оспы. Глобальный многовековой цикл циклических и нециклических инфекций (пандемический цикл).
Результаты популяционных исследований тонкой структуры генома человека показывают наличие большого количества лиц, имеющих мутации гена рецептора лимфокинов CCR5, обычно используемого ВИЧ для проникновения в макрофаги и Т-лимфоциты. Данный феномен свидетельствует о том, что наши предки (а возможно и эволюционно предшествующие виды) уже сталкивались с ВИЧ. Однако каков мог быть механизм, «обрывавший » такие пандемии в прошлом, если сегодня мы их не контролируем?
Морфологическая структура эпидемических очагов нециклического типа. Структуризацию очага предопределяет гетерогенность популяции людей, проживающих на вовлеченной в эпидемический процесс территории. Мутационные процессы у индивидуумов, благодаря которым отдельные гены иммунной системы в течение многих поколений людей накапливают точечные мутации, вне инфекционного процесса не проявляют себя фенотипически, т. е. такие мутации являются нейтральными. Но у инфицированных индивидуумов они определяют клинику болезни, а на популяционном уровне — динамику и основные клинические особенности эпидемического процесса (табл. 25).
Таблица 25
Варианты генов человека, изменяющие динамику и клинические проявления ВИЧ/СПИД-пандемии*
|
Продукт гена |
Вариант гена |
Хромосома |
Эффект |
|
Проникновение ВИЧ в клетку, корецепторы |
|||
|
CCR5 |
▲32 |
3p21 |
Резистентность к ВИЧ-инфекции, замедление развития СПИДа |
|
CCR5 |
C20S |
3p21 |
Предотвращает развитие ВИЧ-инфекции в присутствии D32 |
|
CCR5 |
А295 |
3p21 |
Спорное |
|
CCR5 |
R60S |
3p21 |
Спорное |
|
CCR5 |
C101X |
3p21 |
Предотвращает развитие ВИЧ-инфекции в присутствии ▲32 |
|
CCR5 |
G106R, C178R, C269F |
3p21 |
Резистентность к ВИЧ, торможение развития СПИДа |
|
CCR5 |
P1 (promoter haplotypes) |
3p21 |
Ускорение развития СПИДа |
|
CCR5 |
59029AA |
3p21 |
То же |
|
CCR5 |
HHC (promoter haplogroup) |
3p21 |
Ускорение развития СПИДа у японцев |
|
CCR5 |
HHЕ (promoter haplogroup) |
3p21 |
Ускорение развития СПИДа у людей белой расы (сaucasians) |
|
CCR2 |
64I |
3p21 |
Замедление развития СПИДа у отдельных лиц |
|
DC-SIGN |
Вариант промотора |
19p13 |
Парэнтеральная инфекция |
|
CX3CR1 |
I249/M280 |
3p21 |
Ускорение развития СПИДа |
|
Лиганды корецепторов |
|||
|
MIP-1альфаP (CCL3L1) |
Количество копий гена |
17q12 |
Увеличение восприимчивости к инфицированию |
|
MIP-1бета (CCL4L1) |
L2 |
17q12 |
То же |
|
RANTES (CCL5) |
−403A, −28G (промотор) |
17q12 |
Торможение развития СПИДа |
|
RANTES (CCL5) |
В 1.1C (intronic) |
17q12 |
Ускорение развития СПИДа |
|
SDF-1 (CXCL12) |
3'A |
10q11 |
Торможение развития СПИДа? |
|
MCP1/MCP3/Eotaxin |
Н7 (гаплотип) |
17q11 |
Снижение чувствительности к инфицированию |
|
После проникновения ВИЧ в клетку |
|||
|
TRIM 5альфа |
Гаплотип 9 |
11p15 |
Увеличение трансмиссии ВИЧ |
|
TRIM 5альфа |
136Q, 43Y |
11p15 |
Защита от ВИЧ-инфекции |
|
APOBEC3G |
186R, C40693T |
22q13 |
Ускорение развития СПИДа, увеличение трансмиссии ВИЧ |
|
TSG101 |
−183C |
11p15 |
Ускорение элиминации CD4 T-клеток |
|
Приобретенный/врожденный иммунитет |
|||
|
HLA |
B*27 |
6p21 |
Торможение развития СПИДа |
|
|
B*18 |
6p21 |
Быстрое развитие болезни |
|
|
B*57 |
6p21 |
Торможение развития СПИДа |
|
|
B*35Px |
6p21 |
Ускорение развития СПИДа |
|
|
E*0103 |
6p21 |
Резистентность к ВИЧ-инфекции |
|
|
G*0105N |
6p21 |
То же |
|
|
G*010108 |
6p21 |
Увеличение восприимчивости к ВИЧ |
|
KIR3DS1 |
3DS1 + HLA-Bw4-80Ile |
19q13; 6p21 |
Торможение развития СПИДа |
|
|
3DL1 + HLA-B*57s |
19q13; 6p21 |
То же |
|
Гены цитокинов |
|||
|
Th1 (гамма-IFN) |
+874T аллель |
12q14 |
Замедление начала развития болезни |
|
Th2 (IL10) |
IL10-5'-592A |
1q31 |
Ускорение прогрессирования болезни |
|
Th2 (IL4) |
−590T |
5q31 |
То же |
* По P. Singh et al. (2008); HHC, HHЕ — эволюционно различающиеся гаплотипы CCR5 (более подробно о гаплотипах CCR5 см. в работе Gonzalez E. et al., 1999).
Морфологическая структура такого очага следующая:
быстрые прогрессоры («fast progressors») — лица, у которых СПИД развивается в течение 1–3 лет;
умеренные прогрессоры («moderate progressors») — лица, у которых течение ВИЧ-инфекции приводит к СПИДу в промежуток времени 3–10 лет;
длительные непрогрессоры («long-term non-progressors», LTNPs) — лица, не имеющие симптомов болезни, у которых поддерживается нормальное количество Т-хелперов и отсутствуют другие признаки иммунной дисфункции более 10 лет (примерно 5 % всего количества ВИЧ-серопозитивных пациентов);
индивидуумы с высоким риском инфицирования, но остающиеся серонегативными (individuals that are highly exposed persistently seronegative, HEPS) или незащищенные неинфицированные (exposed uninfected, EUs) — лица, которые не инфицируются даже после многократной экспозиции к ВИЧ. Их периодически обнаруживают среди пациентов, страдающих гемофилией и которым неоднократно переливали инфицированные ВИЧ-продукты крови, проституток, наркоманов и детей, родившихся от ВИЧ-инфицированных матерей.
По мере формирования очага усложняется его морфология, очаг становится более резистентным к внешним воздействиям. Существование LTNP- и HEPS-индивидуумов обусловлено наличием в их геноме мутаций, препятствующих проникновению ВИЧ в клетки иммунной системы и его последующему жизненному циклу (см. табл. 25). Как правило, LTNPи HEPS-индивидуумы гомозиготны по мутациям данного типа. Например, гомозиготы по CCR5-D32 (см. ниже) в европейских популяциях составляют не более 1 %, в африканских их вообще нет (Gonzalez E. et al., 2001). Более подробно о вариантах таких генов и их роли в инфекционном и эпидемических процессах можно прочитать в обзоре P. Singh et al. (2008). Но вернемся к морфологии очага нециклической инфекции. Если смотреть на его структуру с точки зрения поддержания эпидемического процесса, то нельзя не отметить иерархичность в построении тех его элементов, которые поддерживают постоянную инфицированность популяции:
быстрые прогрессоры поддерживают инфицированность популяции на начальном этапе эпидемического процесса (предэпидемическая стадия), когда паразит (например, ВИЧ) размножается только за счет ресурсов реликтовой иммунной системы человека и вне контроля со стороны Т- и В-клеток (см. разд. 3.2). Благодаря вовлечению в эпидемический процесс быстрых прогрессоров, у паразита появляется возможность за несколько лет «укорениться» среди людей, живущих на данной территории или в определенной СКС;
умеренные прогрессоры обладают наибольшим трансмиссионным потенциалом, так как имеют длительный период асимптоматического течения инфекции (см. работу Fraser C. et al., 2007). Они формируют основное разнообразие штаммов ВИЧ, вовлекающихся в эпидемический процесс (см. рис. 47). Умеренные прогрессоры образуют устойчивые совокупности пространственно-временных связей между эпидемическим очагом и точками вторичного распространения эпидемии ВИЧ/СПИД (эпидемические сети по определению Д. В. Николаенко; см. разд. 4.2.1).
Само наличие в популяциях людей LTNP- и HEPS-индивидуумов создает иллюзию возможности прекращения пандемии ВИЧ/СПИДа. Индивидуумы, имеющие повышенную резистентность к возбудителю циклической инфекции, действительно могут тормозить эпидемический процесс, так как такие процессы редко длятся более года. Однако продолжительность нециклических эпидемий (пандемий) значительно превосходит временные рамки циклических. Например, пандемия ВИЧ/СПИДа, по самым приблизительным оценкам, длится уже более 50 лет (см. рис. 74). За это время сменилось два поколения людей. И пока нет никаких признаков завершения пандемии. Носители гомозиготных мутаций среди весьма редко встречающихся LTNP- и HEPS-индивидуумов в следующих поколениях будут представлены уже гетерозиготными носителями и перейдут в категорию умеренных прогрессоров. Следовательно, наличие LTNP- и HEPSиндивидуумов в очаге усложняет его морфологическую структуру и увеличивает градиент иммунодефицитности в эпидемических цепочках (см. ниже «Эволюционные процессы в ВИЧ-инфицированных популяциях людей») — очаг становится еще более устойчивым к внешним воздействиям.
«Молчащие педиатрические инфекции» («silent pediatric infections»). Суть феномена заключается в обнаружении провирусной ДНК ВИЧ в мононуклеарных клетках крови серонегативных детей, родившихся от ВИЧинфицированных родителей несколько лет назад (рис. 78).
Рис. 78. Интеграция провирусной ДНК ВИЧ в ДНК мононуклеарных клеток серонегативных детей, родившихся от серопозитивных матерей два года назад
A. Схема соответствия ПЦР-амплификации провирусному геному ВИЧ.
Праймеры, использованные для детекции LTR (1A–4A) и GAG (1B–4B) участков ДНК, показаны небольшими тонкими стрелками. PCR-амплификаты (Alu/LTR-4) участка ДНК Alu-HIV LTR были подвергнуты второму циклу ПЦР с помощью специфического праймера LTR-1-UIRH-4 (большие стрелки).
Б. ПЦР-амплификаты ДНК мононуклеарных клеток серопозитивных детей: пациент 1 (P1) (a–c), P2 (a–d), P3 (a–c), P4 (a), P5 (a–b), P6 (a–b), P7 (a–c) и P8 (a, b). Дорожка, обозначенная как IIIB — результат исследования ДНК мононуклеарных клеток детей с серологически подтвержденной ВИЧ-инфекцией (серопозитивных). NI — результат исследования ДНК мононуклеарных клеток заведомо неинфицированных ВИЧ детей. По Р. Vаґzquez et al. (2006)
Эпидемическая опасность и масштабы такого феномена неясны. Его нельзя отождествлять с торможением ВИЧ-инфекции у LTNP- и HEPSиндивидуумов (см. выше). У последних репликация вируса все же происходит, о чем свидетельствует сероконверсия и обнаружение вирусной РНК в сыворотке пациентов. Является ли такой тип течения ВИЧ-инфекции абортивным, или это проявление эндогенизации вируса, станет окончательно ясно только через несколько десятилетий.
CCR5-рецептор. Это древний хемокиновый рецептор, сформировавшийся еще до появления позвоночных животных. Экспрессируется на поверхности моноцитов/макрофагов, дендритных и микроглиальных клеток и активированных Т-клеток. Одновременно он является основным корецептором, посредством которого ВИЧ проникает в клетку. Физиологическое предназначение CCR5-рецептора еще только устанавливается. Видимо, у многоклеточных организмов оно зависит от иерархического уровня иммунной реакции, в которой участвуют клетки — носители данного рецептора. На самом нижнем уровне, моделируемом только в условиях эксперимента (in vitro), клетки, экспрессирующие CCR5-рецептор, после взаимодействия с лигандом мигрируют в направлении его большей концентрации. Утратив данный рецептор, клетка утрачивает способность к миграции (см. Yurchenko E. et al., 2006).
Ген рецептора расположен на хромосоме 3p21.3. Сам рецептор представляет собой белковую молекулу, формирующую семь трансмембранных доменов, образующих три петли на поверхности клетки (см. разд. 2.3, «Реликтовая иммунная система человека»). Полиморфизм гена CCR5 может проявляться как замедлением ВИЧ-инфекции, так и, наоборот, ускорением ее течения (см. табл. 25). Ниже речь идет только о наиболее распространенной и изученной мутации гена — делеции CCR5-▲32.
Обычно такая мутация проявляется преждевременным стоп-кодоном (stop codon). Ген рецептора полностью инактивируется (knockout deletion variant), CCR5-корецептор не экспрессируется на поверхности клетки, что ведет к эффективной рестрикции проникновения макрофаготропных ВИЧ в макрофаги людей (Liu R. et al., 1996) и к торможению перехода болезни на стадию СПИДа (Buseyne F. et al., 1998). Лица, гомозиготные по аллели CCR5-▲32, не имеют рецепторсвязывающих сайтов для макрофаготропных ВИЧ. У гетерозигот этот рецептор составляет менее половины от уровня зрелого CCR5, находящегося на поверхности фагоцитирующих клеток гомозигот с неизмененным рецептором (рис. 79).
Рис. 79. CCR5-рецептор.
А. Локализация генов CCR2, CCR5 и других хемокиновых рецепторов на хромосоме 3p21.3. По Р. Singh et al. (2008).
Б. Роль рецептора CCR5 в развитии ВИЧ-инфекции: (1) оболочечный гликопротеин gp120 на поверхности ВИЧ связывается с CD4 и корецептором CCR5 на поверхности макрофага; (2) гомозиготы по CCR5-▲32-делеции не имеют корецептора CCR5 на поверхности макрофагов. Поэтому они устойчивы к инфицированию макрофаготропными вариантами ВИЧ. По P. W. Hedrick, B. C. Verrelli (2006)
Макрофаги и циркулирующие в периферической крови Т-клетки экспрессируют оба рецептора, хотя количество CXCR4 (см. разд. 3.2, «Генерализация ВИЧ») у Т-клеток меньше, чем на макрофагах. М-тропность у ВИЧ вызвана способностью белковых структур его оболочки связываться с CCR5 и проникать в оба типа макрофагов, а также в циркулирующие в крови Т-клетки. Т-тропный ВИЧ преимущественно связывается с CXCR4 и проникает в Т-клетки или Т-клеточные линии макрофагов. Поэтому устойчивость к ВИЧ относительна даже у гомозигот по делеции CCR5-▲32. Из генов других хемокиновых рецепторов, мутации в которых снижают восприимчивость человека к ВИЧ, исследователи отмечают производные CCR2. Замена в 64-й позиции гена хемокинового рецептора CCR2 валина изолейцином приводит к тому же эффекту, что и делеция 32 п. о. в гене рецептора CCR5. Эффект обеих мутаций на прогрессирование ВИЧ-инфекции является аддитивным (McNicholl J. еt al., 1997).
Распределение аллели ▲32 ограничено Европой, где у гетерозигот ее можно выявить с частотой 4–16 %. Частота встречаемости аллели снижается в направлении с севера на юго-восток — с 16 % в Северной Европе до 6 % в Италии, и 4 % в Греции (рис. 80).
Рис. 80. Контурная карта частоты встречаемости аллели CCR5-D32.
Черными точками отмечены географические координаты забора проб.По J. Novembre et al. (2005).
Наиболее распространены носители аллели ▲32 в Балтийском регионе (Швеция, Финляндия, Эстония и Латвия), Беларуси. Их количество увеличивается в отдельных местностях Франции, в таких российских городах как Москва и Рязань, Волго-Уральском регионе России, у евреев-ашкенази (Ashkenazi Jews). Носители аллели ▲32 практически не встречаются среди африканских и азиатских народов (Novembre J. et al., 2005). Р. Singh et al. (2008) обнаружили только одного гомозиготного носителя CCR5-▲32 среди 460 здоровых людей на севере Индии. Среди ВИЧ-инфицированных индийцев носителей таких мутаций им обнаружить не удалось.
Предложены разные объяснения неравномерного распределения мутаций CCR5-▲32 в популяциях людей. Наиболее популярными среди ученых в начале текущего десятилетия оказались две гипотезы: 1) связывающая распространение аллели ▲32 с расселением викингов; 2) предполагающая селекцию людей с данной мутацией во время пандемии чумы «черной смерти» (1346–1351 гг.). Причем для обоснования последней теории сделано предположение о значительно большей устойчивости к возбудителю чумы людей, носителей мутации CCR5-▲32 (Galvani A., Slatkin M., 2003).
Эти гипотезы встретили трудности из-за противоречащих им фактов. Обобщенные в работе S. Hummel et al. (2005) результаты исследования образцов ДНК из скелетов людей, умерших более чем 2900 лет назад, свидетельствуют о сходстве частот встречаемости CCR5-▲32 мутаций среди людей Бронзового века и современных (рис. 81).

Рис. 81. Частоты встречаемости носителей CCR5-▲32 в ДНК образцов, отобранных из скелетов людей, живших в Бронзовом веке и в Средние века Цифрами указано количество исследованных образцов ДНК. Чума — люди, умершие от чумы. Голод — люди умершие от голода. По S. Hummel et al. (2005)
Среди людей Бронзового века, живших на территории современной Германии, мутация встречалась у 11,8 %, но и 9,2 % современных немцев гетерозиготны по CCR5-▲32. S. Hummel et al. (2005) не нашли значительных различий в частотах встречаемости таких мутаций среди людей, погибших от чумы в XIV в., и современных европейцев (см. рис. 81). Сохранились даже различия в частоте встречаемости CCR5-▲32 на севере и юге Европы, по крайней мере, они не менялись за 200-летний промежуток времени. Sabeti P. C. et al. (2005), используя новые генетические карты, «отодвинули » появление CCR5-▲32 на 5 тыс. и более лет. Эти данные «перечеркивают » первую гипотезу, но не в пользу второй.
J. Mecsas et al. (2004) сравнили в экспериментах и по литературным данным восприимчивость мышей к Yersinia (Y. pestis и Y. pseudotuberculosis), Listeria, Cryptococci и Leishmania, гомозиготных по CCR5-▲32. Макрофаги таких мышей утрачивают способность к ответу на воспалительный белок 1b (inflammatory protein-1b). У людей мутация CCR5-▲32 является нейтральной. У мышей, гомозиготных по CCR5-▲32, иммунологические нарушения проявляются только тогда, когда иммунная система испытывает нагрузку. Мыши, гомозиготные по CCR5-▲32, отличаются от контрольных повышенной восприимчивостью к инфицированию Listeria, Cryptococci, Leishmania и Yersinia. Данные J. Mecsas et al. (2004) противоречат гипотезе о положительной селекции людей с CCR5-▲32 мутациями во время масштабных вспышек чумы. Скорее всего, имела место элиминация носителей такой аллели (т. е. отрицательная селекция).
«Змеиный клубок». ВИЧ/СПИД-пандемия — это многокомпонентный и постоянно усложняющийся процесс. Помимо двух десятков СПИД-ассоциируемых инфекций, находящихся в причинно-следственной связи с распространяющимся ВИЧ (см. разд. 3.2), ВИЧ/СПИД-пандемия дала следующие эпидемические «новинки».
1. Антибиотикоустойчивые штаммы возбудителей инфекций, распространяющиеся среди иммунокомпетентных людей — сальмонеллеза, туберкулеза, кандидоза и др. (Morris J. G., Morris P., 1997). Резистентность к химиопрепаратам и антибиотикам у микроорганизмов формируется в иммунодефицитных популяциях значительно быстрее, чем в иммунокомпетентных популяциях (Бердсли Т., 1993). Чем выраженнее иммунодефицитное состояние, тем более резистентные штаммы выделяют от больных (Ampel N., 1996). Это связано с большими возможностями по отбору вариантов и отсутствием давления на них со стороны иммунной системы (см. ниже «Эволюционные процессы в ВИЧ-инфицированных популяциях людей»). D. Palmero et al. (2003) описали вспышку лекарственно резистентного туберкулеза среди иммунокомпетентных людей, развившуюся в стационаре, где одновременно с ними проходили лечение ВИЧ-инфицированные пациенты. Вспышка началась среди ВИЧ-инфицированных, затем она перекинулась на иммунокомпетентных больных. Идентичность штаммов возбудителя туберкулеза, выделенных от тех и других, была подтверждена молекулярно-генетическими методами.
2. Вирулентные штаммы возбудителей малоизвестных инфекций, не считавшихся ранее серьезной проблемой для иммунокомпетентных лиц. Например, в экспериментах на животных было показано, что штаммы грамположительной коккобациллы Rhodococcus eque, выделенные от больных СПИДом, почти в сто раз более вирулентны, чем штаммы этого же микроорганизма, полученные от иммунокомпетентных людей (Pakai S. et al., 1995). Эпидемиологам данное явление известно давно — в более чувствительных популяциях отбираются более вирулентные штаммы, в иммунных (резистентных) популяциях — маловирулентные (Беляков В. Д. и др., 1987). Только теперь оно приобретает все более глобальный характер.
3. Возбудители инфекций, ранее не встречавшихся клиницистам. Например, широкое применение у ВИЧ-инфицированных с целью подавления инфекций, вызываемых грибковыми микроорганизмами, нового препарата триазола флюконазола, привело к заметному увеличению количества больных, инфицированных устойчивой к этому препарату Candida krusei. Раньше она считалась микроорганизмом, имеющим второстепенную клиническую значимость (Samaranayake Y., Samaranayake L., 1994)
4. Распространение малопатогенных возбудителей инфекционных болезней. Эпидемиологами Лос-Анджелеса обнаружен почти 35-кратный рост среди больных СПИДом числа лиц, инфицированных Campylobacter jejuni (Sorvillo F. et al., 1991). В Сан-Франциско количество лиц, инфицированных Listeria среди ВИЧ-инфицированных, превышало этот показатель для иммунокомпетентных людей в 280 раз (Schuchat A., 1992).
5. Штаммы ВИЧ, устойчивые к широко используемым в клинической практике антиретровирусным препаратам. К настоящему времени уже исчерпаны возможности разработки эффективных препаратов так называемых «старых классов» — нуклеозидных ингибиторов обратной транскриптазы и ингибиторов протеазы. Сегодня основные надежды ученые возлагают на ингибиторы слияния и созревания ВИЧ, да на еще не сделанные научные открытия (Dunne M., 2008).
6. Возвращение проказы. По мере вовлечения в ВИЧ/СПИД-пандемию все большего количества людей и территорий, становится очевидным возвращение проказы. Еще в 1991 г. R. A. Miller в опытах на обезьянах показал, что инфекция SIV увеличивает восприимчивость экспериментальных животных к M. leprae (Miller R. A., 1991). Эпидемиологические исследования, проведенные в Танзании в конце 1990-х гг., позволили установить возрастание риска инфицирования M. leprae для ВИЧ-инфицированных жителей страны и поставили под сомнение эффективность вакцины BCG, как средства специфической профилактики лепры в ее природных очагах (van den Broek J. et аl., 1997). ВИЧ-инфекция у больных проказой гораздо быстрее приобретает манифестное течение и переходит в СПИД, чем у людей, не страдающих проказой (Moses A. E. et al., 2001; Kalu W., 2006). В целом же причины проявления проказы среди ВИЧ-инфицированных пациентов весьма разнообразны и еще плохо изучены. На рис. 82 показаны проявления проказы у ВИЧ-инфицированных пациентов в Бразилии.
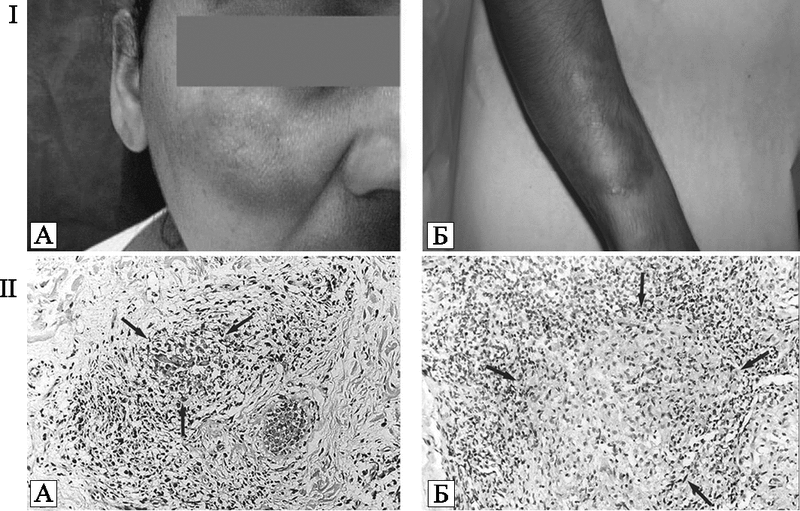
Рис. 82. Проявления проказы у ВИЧ-инфицированных пациентов в Бразилии По М. А. Trindade (2006)
I. A. Эритроматозное (еrythematous) и отечное (edematous) пятно на правой щеке первого пациента.
Б. Эритроматозное, хорошо отграниченное пятно на правом предплечье второго пациента.
II. A. Гистопатология биопсии поврежденных проказой тканей первого пациента соответствует небольшой туберкулоидной гранулеме в дермисе, разъединенной через отек около волосяного фолликула. Стрелки определяют границы зоны с небольшим скоплением эпителиоидных гистиоцитов (epithelioid histiocytes), которые окружены «мантией» из лимфоцитов. Участок повреждения окрашен гемотоксилинэозином. Первоначальное увеличение — 200 раз.
Б. Гистопатология биопсии повреждений ткани второго пациента показывает хорошо организованные туберкулоидные гранулемы (tuberculoid granulomas) в дермисе. Стрелки определяют границы области, богатой эпителоидными гистиоцитами, с многочисленными лимфоцитами, инфильтрировавшими на периферию. Повреждение окрашено гемотоксилинэозином. Первоначальное увеличение — 100 раз. Оба ВИЧ-инфицированные пациента обнаружили первый тип лепрозной реакции в отсутствие антиретровирусной терапии. У первого пациента, 36-летней женщины, кожные поражения появились за год-полтора до проведения HAART. На момент данного наблюдения вирусная нагрузка не определялась, CD4+ T-клетки — 120/мм3. Второй пациент, мужчина, 32 года. ВИЧ-инфекция уже 8 лет, кожные поражения не менее двух лет, никакого лечения не получал. Вирусная нагрузка — 85 400 копий/мл; CD4+ T-клетки — 353/мм3
7. Синдром восстановления иммунитета (СВИ) — развитие у ВИЧ-инфицированного пациента туберкулеза или проказы либо впервые, либо в новой локализации на фоне увеличенного числа лимфоцитов CD4 и снижения вирусной нагрузки, достигнутых благодаря HAART (Pereira G. A. et al., 2004).
Синдром отмечен у 20–30 % пациентов, совмещающих антиретровирусную терапию с противотуберкулезной. Развитие СВИ у больных туберкулезом объясняют тем, что обусловленное HAART резкое повышение числа специфических Т-лимфоцитов приводит к взрывному усилению иммунного ответа на антигены микобактерий. Обычно СВИ развивается тогда, когда от начала противотуберкулезной терапии до начала HAART проходит около 2 месяцев (Breen R. A. et al., 2005). Самый большой срок для туберкулезной инфекции, описанный в литературе, составил полтора года (Cailhol J. et al., 2008). Синдром описан у пациентов, коинфицированных нетуберкулезными микобактериями, вирусами гепатита В и С, цитомегаловирусами (Pereira G. A. et al., 2004).
Эволюционные процессы в ВИЧ-инфицированных популяциях людей. «Откат» иммунной системы человека почти на 600 млн лет назад к иммунной системе первых многоклеточных организмов предоставляет новые эволюционные возможности микроорганизмам-оппортунистам (см. разд. 3.2, «Эволюционный смысл ВИЧ-инфекции»).
Популяционные волны. Высокий темп размножения и высокая плотность их популяций в иммунодефицитном хозяине способствуют накоплению мутаций в их популяциях, колонизировавших эктопические органы и ткани. Проникновение паразита в новую для него экологическую нишу сопровождается явлением, известным эволюционистам как популяционная волна или «волна жизни». Такие волны являются самостоятельными факторами эволюции микроорганизмов в иммунодефицитных хозяевах и касаются колебаний численности сразу многих их мутантных производных. Поэтому действие любых факторов, снижающих численность паразитов (лекарственных препаратов или сохранившихся звеньев иммунной системы, вытеснение другим паразитическим видом и др.), приводит к тому, что от многочисленной популяции остаются отдельные особи, имеющие уже измененный набор генов. Снятие такого давления, например, из-за прекращения введения лекарственного препарата после исчезновения клинических признаков болезни, дальнейшего нарастания иммунодефицита, либо прекращения колонизации органа (ткани) другим паразитом, приводит росту численности уже измененного возбудителя. У микроорганизмов, использующих стратегию паразитизма первого типа, вызывающих инфекционный процесс у иммунокомпетентного хозяина, обычно имеется возможность только для одной эволюционной волны, в результате которой должна произойти его передача новому хозяину, а затем либо наступит смерть хозяина, либо иммунная система очистит организм от возбудителя инфекции. Но поскольку иммунодефицитность — это не состояние, а процесс, то в иммунодефитных хозяевах такие волны будут повторяться многократно, каждый раз в различных условиях, периодически меняя генотипический состав одних и тех же возбудителей.
Градиент иммунодефицитности. Важным элементом среды обитания паразитов, формирующихся в иммунодефицитных популяция, является градиент иммунодефицитности в эпидемических цепочках. Практически нельзя найти двух ВИЧ-инфицированных людей с одинаковой вирусной нагрузкой; вариантами генов, изменяющих динамику и клинические проявления ВИЧ/СПИД-пандемии (см. табл. 25); количеством CD4+ T-клеток. При достижении «критической массы» иммунодефицитных людей формируются условия для последовательного пассирования вирулентных микроорганизмов через особи с большим иммунодефицитом, к особям с меньшим иммунодефицитом а потом и через иммунокомпетентных хозяев. Остановимся на механизмах такой эволюции.
Дегенеративная эволюция. Как оказалось, нельзя ожидать того, что мутации у микроорганизмов в иммунодефицитных хозяевах происходят так, как об этом пишут в книгах по эволюции жизни для студентов — мутируют гены одних белков, затем других, а потом естественный отбор миллионы лет «отбрасывает» миллиарды нежизнеспособных вариантов генов, закрепляя новые. Паразиту, когда его эволюция направляется естественным отбором по пути специализации, новые гены не нужны; не нужны ему и многие уже имеющиеся. Рассмотрим это явление на примере распространения среди больных СПИДом полирезистентных штаммов возбудителя туберкулеза (multidrug-resistant tuberculosis, MDR-TB), фактически единственного фактора, сдерживающего сегодня эту пандемию.
Резистентность М. tuberculosis к изониазиду у иммунодефицитных людей развивается не путем приобретения новых генов, а утратой имеющихся. Ген, кодирующий чувствительность туберкулезной палочки к изониазиду, локализуется на плазмиде или хромосоме возбудителя туберкулеза и определяет синтез фермента, активизирующего изониазид, который и убивает М. tuberculosis. В иммунодефицитных популяциях М. tuberculosis утрачивает этот ген, и антибиотик остается неактивным, ВИЧ-инфицированные люди, одновременно инфицированные резистентными к лекарственным препаратам штаммами М. tuberculosis, погибают всего за несколько недель. Такие штаммы с начала 1990-х гг. распространяются и среди иммунокомпетентных людей (Бердсли Т., 1993).
Следовательно, в организме больных СПИДом и с иммунодефицитами другой этиологии создаются условия для дегенеративной эволюции возбудителей инфекционных болезней. Отбор более специализированных дегенеративных вариантов осуществляется в организме больных СПИДом из большого количества мутантов неспециализированных микроорганизмов-оппортунистов, активно размножающихся в отсутствии селективного давления иммунной системы. Видимо, это распространенный механизм эволюции паразитов в иммунодефицитных организмах. Согласно правилу «прогрессирующей специализации» Ш. Депре (1876), «группа, вступившая на путь специализации, в дальнейшем развитии будет идти по пути все более глубокой специализации».
Возвращение оспы. Натуральная оспа «угасала» со середины XVIII в. В ее «ликвидации» основную роль сыграли: 1) цикличность оспенных пандемий; и 2) эпидназдзор в сочетании с вакцинацией населения, примененные в глобальных масштабах в период угасания последнего цикла оспенных пандемий (см. разд. 4.2.2, «Почему невозможно использовать вакцинацию в борьбе с ВИЧ/СПИД-пандемией»). Ликвидация эндемичной натуральной оспы в 1960–1970-х гг. в странах, находящихся к югу и юго-востоку от Сахары, происходила на фоне широко распространившихся менее опасных штаммов вируса (типа minor, см. разд. 3.1). Вызываемые такими штаммами оспоподобные болезни под разными названиями (аластрим, санага, самоа и др.) были известны ранее, однако длительное время они не были преобладающими. Любопытен механизм снижения вирулентности ВНО. Выполненные несколько лет назад молекулярно-генетические исследования вирусов, выделенных в последних очагах натуральной оспы, показали, что геномы менее вирулентных для людей штаммов отличаются от геномов высоковирулентных возбудителей натуральной оспы увеличением своих размеров за счет увеличения количества ITR. В то же время основная часть генома вируса остается неизмененной (табл. 26).
Таблица 26
Характеристика вирусов, выделенных в последних очагах натуральной оспы*
|
Изолят (страна), год выделения |
Тип |
Смертельные исходы, % |
Размер ITR, пары оснований |
|
Harvey (Англия), 1944 |
major |
27,3 |
518 |
|
Bangladesh (Бангладеш), 1975 |
major |
18,5 |
725 |
|
Congo (Конго), 1970 |
major |
9,6 |
793 |
|
Somalia (Сомали), 1977 |
minor |
0,4 |
1051 |
* По R. Massung et al. (1995).
Считающийся последним очаг оспы, ликвидированный в 1977 г. в Сомали, был вызван штаммом ВНО типа minor. Смертность в очаге не превышала 0,4 %. И если быть строгим в терминах, то эта болезнь по клинике уже не была натуральной оспой, а представляла собой оспоподобную болезнь — аластрим. Приведенные данные свидетельствуют о возможности двух самостоятельных процессов: 1) приспособительном мутировании в ходе эпидемий самого вируса в направлении образования маловирулентных штаммов. Такие штаммы накапливаются в популяции ВНО за счет увеличения количества инвертированных терминальных повторов; 2) повсеместном исчерпании в первичных природных резервуарах высоковирулентных для людей вариантов вируса (например, из-за исчезновения простейших, в которых ВНО ведет себя как облигатный паразит). Первая гипотеза может помочь в объяснении причин исчезновения ВНО во второй половине ХХ в. Вторая — в объяснении механизмов возвращения высоконтагиозных для людей ортопоксвирусов. Теперь присмотримся к геному ВНО, воспользовавшись данными, приведенными в работе С. С. Маренниковой и С. Н. Щелкунова (1998).
Если следовать формальной логике публикаций, объясняющих патогенность микроорганизмов приобретением ими «генов патогенности» (например, учебники Борисова Л. Б., 2001; Воробьева А. А. с соавт., 1994), то ВНО должен быть безобидным. У него разрушена ОРТ гена белка, обладающего IL-1бета-связывающей активностью, считающегося фактором патогенности. Однако вирус вакцины (ортопоксвирус, используемый для иммунизации против вируса натуральной оспы) синтезирует этот белок. У ВНО утратил свое значение ген 3бета-гидроксистероиддегидрогеназы (3бета-HSD), играющий важную роль в биосинтезе стероидных гормонов. Стероидные гормоны также обуславливают столь необходимые ВНО иммуносупрессию и противовоспалительное действие. Тем не менее вирус их утрачивает. В отличие от вируса вакцины и вируса оспы коров, у ВНО разрушены ОРТ всех белков межклеточных каналов (всего семейства!). С. С. Маренникова и С. Н. Щелкунов (1998) обратили внимание и на то, что по сравнению с маловируленым для человека вирусом вакцины, у ВНО за счет мутационных изменений разрушено значительное число других ОРТ.
У ВНО существует механизм, ограничивающий возможность его генетической рекомбинационной изменчивости по сравнению с другими видами ортопоксвирусов, характеризующимися относительно высоким уровнем перестроек геномов. У него необычайно маленького размера ITR — от 518 до 1051 п. о. С их увеличением вирус теряет вирулентность для человека (см. табл. 26). У вируса вакцины, имеющего более широкий круг хозяев, ITR на порядок больше: 10–12 т. п. о. Кроме того, разные штаммы вируса вакцины содержат различающиеся наборы генов. У ВНО ITR — это минимальный теломерный элемент, необходимый для репликации поксвирусной ДНК в клетке, и не более. С. С. Маренникова и С. Н. Щелкунов (1998) считают, что столь малый размер ITR существенно ограничивает возможность генетической рекомбинации ВНО.
Такая консервативность генома свидетельствует либо о приобретении необычайно глубокой адаптации ВНО к макрофагам человека уже после того как он сформировался как вид, либо ВНО адаптировался еще к эволюционным предкам человеческих макрофагов среди простейших. Разрушение рамок считывания генов ВНО — это такой же процесс дегенеративной эволюции, как утрата возбудителем чумы генов «вирулентности» или внутренними паразитами органов чувств, упрощение до предела нервной системы и исчезновение пищеварительной у ленточных червей — они им больше не нужны. Отбор перестал следить за формированием структуры, и этого оказалось достаточно, чтобы она исчезла (о феномене паразитизма см. у Медникова Б. М., 1982). Рассмотрим при каких обстоятельствах может произойти адаптация к макрофагам человека вируса — эволюционного предшественника ВНО, т. е. становление его как ВНО.
Ортопоксвирусу, циркулирующему в различных природных резервуарах, например среди простейших (первичный резервуар) или грызунов (вторичный резервуар), нет необходимости проходить сложный путь эволюции, сопровождающийся приобретением новых генов. Чтобы стать высокоспециализированным паразитом, достаточно попасть в такие условия, когда многие собственные гены перестанут поддерживаться естественным отбором. Эти условия создаются в иммунодефицитных организмах. Причем, чем шире иммуннодефицитная прослойка среди населения, тем больше возможностей для специализации и отрыва от исходного природного резервуара имеется у паразита, использующего первую стратегию (рис. 83).
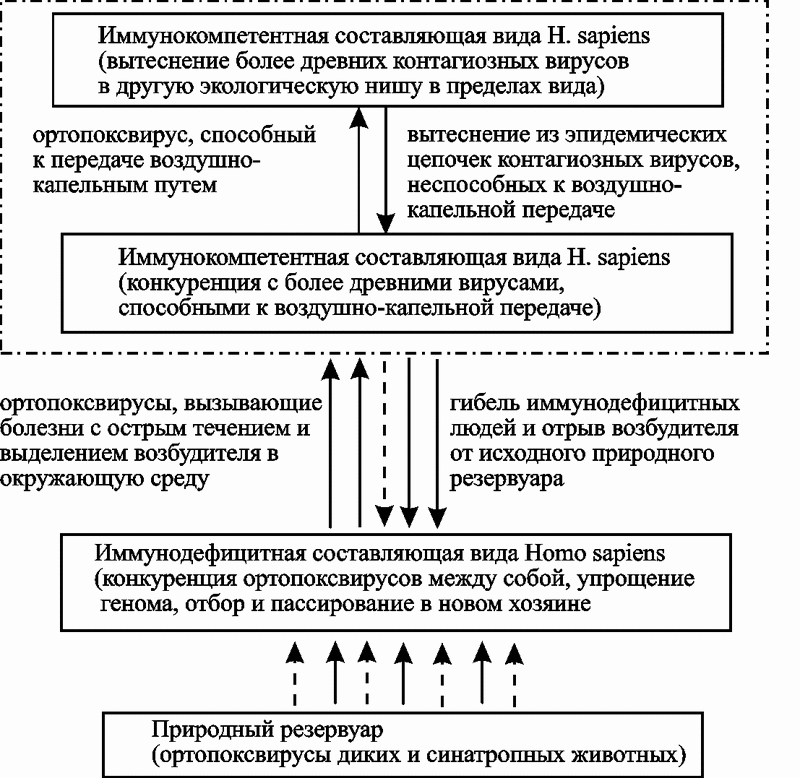
Рис. 83. Схематическое изображение возможного механизма формирования узкой специализации у ортопоксвируса в отношении вида Homo sapiens и его отрыва от исходного природного резервуара
G. Werner и соавт. (1968), еще до обнаружения ВИЧ, провели ряд интересных экспериментов, показавших, что у иммунодефицитных особей возможно значительное снижение специфичности заражения поксвирусами. По их данным, у облученных кроликов вирус вакцины вызывал острую болезнь. У облученных крыс, обычно абсолютно невосприимчивых к вирусу этромелии (вирус оспы мышей), инфицирование этим вирусом вызывало острую инфекцию с 30 % смертностью. Аналогичное явление могло наблюдаться и среди иммунодефицитных людей в прошлом, только с той поправкой, что инфекционные процессы происходили при жесткой конкуренции между несколькими видами ортопоксвирусов, чьи экологические потребности оказались сходными. Полиморфизации вирусов, накоплению их специализированных дегенеративных форм способствовало отсутствие селективного давления со стороны иммунной системы. В эпидемических цепочках, образовавшихся в социально организованных и плотных «популяциях» людей, большую возможность сохраниться имели подтипы возбудителей, вызывающих болезнь с острым течением и массивным выделением вируса в окружающую среду. Одновременно пассированием через особи с различной степенью иммунодефицитности происходил отбор более вирулентных производных.
Глобальный многовековой цикл циклических и нециклических инфекций (глобальный пандемический цикл). Образование в процессе эволюции ВНО из менее специализированных осповирусов, циркулирующих в популяциях простейших организмов и/или в популяциях контактирующих с людьми млекопитающих, было случайным событием. Разумеется, как случайность, может рассматриваться сохранение вируса в простейших — эволюционных предках макрофагов человека. Однако ВНО оказался идеальным антагонистом возбудителей нециклических инфекций, вызывающих развитие иммунодефицитных состояний у «мыслящих» приматов, склонных не только к размышлениям о своем доминировании в природе, но и к созданию крупных, социально организованных общин.
При достижении определенного уровня плотности иммунодефицитной составляющей среди населения, ее опутывает «змеиный клубок» возбудителей опасных инфекционных болезней циклического типа. Отдельные иммунодефицитные лица становятся звеньями эпидемических цепочек, по которым распространяются возбудители контагиозных инфекций с длительным инкубационным периодом и течением, «оторвавшиеся» от своих природных резервуаров (возбудители туберкулеза; возможно, проказы и др.; см. разд. 2.2, «Микобактерии») (рис. 84).
Рис. 84. Проказа и кожные поражения, принимаемые в Средние века за проказу
В появлении «проказы», натуральной оспы и чумы с глубокой древности наблюдается определенная цикличность. Сначала исторические источники фиксируют появление «проказы», т. е. какого-то массового заболевания у людей, сопровождающегося обширными поражениями кожи (обычно этот период тянется 2–3 века). Затем в исторических источниках появляются упоминания о злокачественной оспе, распространяющейся одновременно в нескольких странах. На этом фоне вскоре вспыхивают масштабные эпидемии чумы. На рисунке (справа) приведен фрагмент картины Конрада Витца «Прокаженный» (1450). Слева фотографии кожных поражений у больных СПИДом, взятые из монографии А. Я. Лысенко с соавт. (1996). Вверху — первичная лимфома; внизу — саркома Капоши туловища и верхних конечностей. Сходные поражения присутствуют на коже человека, изображенного К. Витцом. Разумеется, сопоставление этих изображений ничего не доказывает, но… все же интересно
Постепенно количество высоковосприимчивых звеньев в цепочках увеличивается. Эпидемии приобретают упорное течение. С ростом ВИЧинфицированности населения на отдельных территориях или в СКС количество высоковосприимчивых звеньев в эпидемических цепочках возрастает настолько, что позволяет вовлекаться в эпидемические процессы возбудителям контагиозных инфекций с непродолжительным инкубационным периодом и быстрым течением болезни. Среди них тысячелетиями «лидировала» натуральная оспа, как единственная контагиозная инфекция, передающаяся воздушно-капельным путем и имеющая относительно других антропонозов продолжительный инкубационный период (до 14 суток) и высокую вирулентность для людей. Эта совокупность свойств ВНО позволяла натуральной оспе в прошлом охватывать население города (страны), распространяясь по принципу «из дома в дом», приводя к гибели людей с иммунодефицитами различной этиологии.
ВНО упрощает морфологическую структуру эпидемического очага, сформированного ВИЧ или возбудителем другой нециклической инфекции. Наиболее легко в оспенные эпидемические процессы вовлекаются люди с выраженной неспособностью к Т- и В-клеточным ответам — быстрые прогрессоры и умеренные прогрессоры, инфицированные ВИЧ уже длительное время. У них инфекционный процесс заканчивается смертью от тяжелых форм болезни (purpura variolosa fulminans и variola confluens malignus, смертность до 100 %) (рис. 85).
Рис. 85. Сливная оспа (variola confluens malignus).
А. Фотография больного со сливной формой натуральной оспы. По П. Н. Бургасову, Г. П. Николаевскому (1972).
Б. Сливная оспа, старинный рисунок. По В. Губерту (1896).
Обычно тяжелые формы натуральной оспы развиваются у лиц с нарушенными Т- и В-клеточным ответами на ВНО
У людей с нарушенными Т- и В-клеточными ответами болезнь сопровождается обильным выделением вируса из носоглотки. В условиях социально организованного общества, предполагающего высокую плотность совместно проживающих людей, формируются эпидемические цепочки от людей с нарушенными Т- и В-клеточным ответам к иммунокомпетентным.
Среди иммунокомпетентных людей оспа развивается в легких и среднетяжелых формах. У переболевших людей формируется иммунитет к ВНО. Но у ВИЧ-инфицированных лиц возможны два варианта течения оспенного процесса даже после вакцинации ослабленными штаммами вируса. Быстрая гибель непосредственно от оспенного процесса — как это показано на примере вакцинации ВИЧ-инфицированных рекрутов. Для того чтобы умереть от вируса вакцины, количество CD4-клеток должно быть у человека менее 50 в мм3 (Zagury D., 1991). И «отложенная смерть» от обострения течения ВИЧ-инфекции, спровоцированного живой вакциной. Например, у 20-летнего пациента, вакцинированного живой противокоревой вакциной, через 10 месяцев развились легочные инфильтраты, в которых был обнаружен вакцинный штамм вируса кори (Moratan strain). Несмотря на лечение специфическим иммуноглобулином и рибаверином, болезнь прогрессировала и больной погиб (Angel J. B. et al., 1998). Описаны и другие случаи гибели людей, вакцинированных живыми вакцинами на поздней стадии ВИЧ-инфекции (Talbot E. A. et al., 1997).
В результате элиминации из эпидемического центра (очага) возбудителями циклических монопандемий носителей ВИЧ-инфекции, эпидемические цепочки, по которым распространяется ВИЧ, «обрываются». ВИЧ перестает самоподдерживаться на данной территории или в данной СКС. Однако он еще может туда «заноситься» благодаря эпидемическому градиенту с другими территориями. Но теперь быстрые прогрессоры уже не в состоянии инициировать масштабное распространение ВИЧ-инфекции и сформировать новый эпидемический центр, так как на них постоянно оказывается селективное давление со стороны ВНО. Одновременно ВНО элиминирует людей с генетическими дефектами иммунной системы, тем самым сужая ареалы возбудителей туберкулеза, проказы и других микроорганизмов, возбудителей незавершающихся циклических эпидемических монопроцессов (см. табл. 21).
По мере распространения ВНО на смежные с очагом ВИЧ/СПИДа территории, эпидемическое давление очага на них снижается, эпидемические сети рвутся, эпидемия ВИЧ/СПИДа вступает в стадию угасания. Формирование иммунной к ВНО прослойки среди населения и элиминация из популяций людей носителей мутаций, определяющих генетические дефекты иммунной системы, приводит к вытеснению ВНО в детские возраста, и его поддержанию среди людей как возбудителя детской болезни с незначительной смертностью. На рис. 86 представлена модель глобального многовекового цикла циклических и нециклических инфекций.
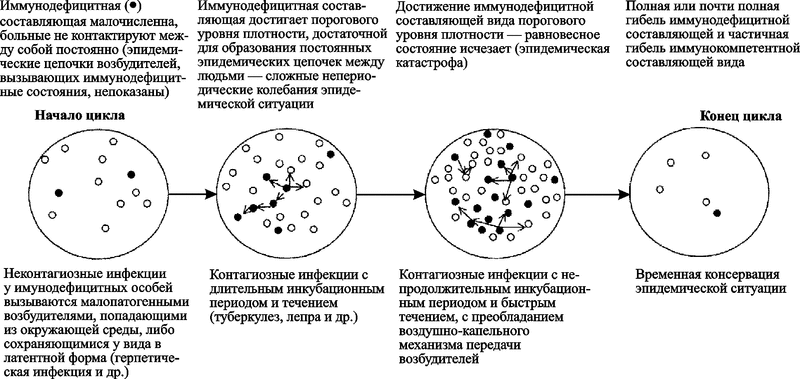
Рис. 86. Схема глобального многовекового цикла циклических и нециклических инфекций. По мере совершенствования средств борьбы с возбудителями инфекционных болезней, такой цикл становится все более растянутым, но последствия пандемий все более губительными. Видимо, этот механизм с глубокой древности являлся естественным регулятором пандемий, вызываемых ВИЧ и другими микроорганизмами, вызывающими пандемии нециклического типа
Судя по последним датировкам времени появления аллели ▲32 (см. выше «CCR5-рецептор»), в европейских популяциях людей ВИЧ присутствовал еще с тех времен, когда разрозненные и малочисленные праевропейские племена шли за отступающими ледниками на север Европы. Из-за небольшой численности и рассеянности они были менее уязвимы для возбудителей острых контагиозных инфекций (т. е. инфекций циклического типа), в том числе и ВНО. Эпидемические цепочки ВИЧ и подобных вирусов среди европейцев поддерживались сравнительно долго, возможно до античных и даже до сокрушительных раннесредневековых эпидемий контагиозных болезней, собирательно называемых тогда «чумой». Постепенное и повсеместное истребление носителей экзогенных ретровирусов среди людей ВНО способствовало увеличению продолжительности жизни и репродуктивного периода человека.
Формирование первых государств в истории человеческой цивилизации (V–IV тысячелетие до н. э.) происходило именно вдоль путей естественного распространения ВНО из регионов Центральной Африки (долина Нила, Ближний Восток, Месопотамия). Возбудитель натуральной оспы и ВИЧ неоднократно проникали в Древний Египет из своих природных резервуаров в Центральной Африке (первичных — в простейших, вторичных — среди позвоночных организмов) вместе с людьми, двигавшимися вниз по Нилу. ВНО выступал в качестве антагониста ВИЧ, обрывая его распространение масштабными оспенными эпидемиями. Последнее нашло отражение в соответствующей мифологии. Еще А. П. Лопухин (1867) заметил, что в Древнем Египте предание о потопе изменено было в том смысле, что «нечестивый род человеческий наказан был язвой, истребившей его весь, за исключением немногих лиц, ставших родоначальниками человечества».
Люди негроидной расы, пришедшие в Центральную Африку с севера уже после образования там ВНО, подвергались его селективному давлению на протяжении нескольких тысяч лет. И это давление продолжалось до проведения полной противооспенной иммунизации населения региона в 1950–1970-х гг. Эпидемические цепочки, тянущиеся к людям от спорадических возникающих резервуаров ВИЧ в популяциях приматов, весь этот период были блокированы ВНО. Поэтому африканцы не имеют мутантных аллелей гена CCR5 и более чувствительны к ВИЧ, чем европейцы.
Среди европейцев территориальное распределение аллели ▲32 соответствует активности реликтовых очагов чумы. Наибольшее количество таких очагов расположено на юге Европы. Эти же очаги были наиболее активны в период последних полутора тысяч лет (см. разд. 4.1.2, «Пандемии чумы»). Так как люди с мутантной аллелью гена рецептора CCR5 имели всегда меньше шансов выжить во время чумы, то их количество на территориях, наиболее часто «посещаемых» чумой, минимально.
Теперь вернемся в Центральную Африку и посмотрим, каков конечный результат нашей «победы» над натуральной оспой, естественного ограничителя распространения ВИЧ-инфекции? Для многих африканских племен оспа была связана с какими-то преданиями, ей поклонялись как наиболее почитаемому божеству. Один из наиболее почитаемых богов у нигерийского племени йоруба — бог оспы Сапоне (рис. 87).

Рис. 87. Бог оспы Сапоне
Но не только африканцы видели в эпидемиях оспы мистический смысл. В Китае и Европе с глубокой древности натуральную оспу почему-то считали «очистительной болезнью». Ни одно другое эпидемически распространяющееся заболевание не удостоилось такой чести (подробнее о мифах, связанных с натуральной оспой, см. у Губерта В., 1896).
В 1990-х гг. эпидемическая ситуация «южнее Сахары» стала хуже, чем она была в 1960-х гг. Теперь там доминирует ВИЧ, и, видимо, неслучайно. Если наложить друг на друга карту заболеваемости натуральной оспой в Африке в начале 1960-х гг. и карту инфицирования африканцев ВИЧ в 1990-х гг., то нетрудно заметить, что их границы совпадают (см. Eradication de la variole..., 1968; и Андерсон Р., Мей. Р., 1992, соответственно). Этот факт означает то, что население именно тех стран, где сейчас повсеместно распространен ВИЧ, к началу 1960-х гг. было поражено ВНО в значительно большей степени, чем в других регионах Африки. В условиях повсеместного распространения ВНО, люди, больные СПИДом, и носители ВИЧ-инфекции не могли долго существовать (см. 1950-е гг. на рис. 74). Эндемический ВНО обрывал цепочки, по которым распространялся эндемический для данного региона ВИЧ. В результате ВИЧ не имел возможности эволюционировать, его законсервированные в более древних гоминидах варианты ничем не успевали проявляться у людей на фоне других массовых инфекций. Снятие этого селективного давления спровоцировало глобальное распространение ВИЧ и гибель миллионов людей.
***
Нециклические пандемические процессы представляют собой иное природное явление, чем пандемии циклического типа.
1. Пандемия нециклического типа — это единый процесс, начало которого и, соответственно, окончание, в рамках доступного нам восприятия времени, неизвестны. Эпидемии нециклического типа не заканчиваются после угасания природных очагов, «вбросивших» в популяции людей возбудителей нециклических инфекций. Благодаря половому механизму передачи возбудителя инфекционной болезни между людьми и нецикличности инфекционного процесса, они переходят в пандемии.
2. Пандемии нециклического типа в отличие от пандемий, вызываемых возбудителями циклически протекающих инфекций (натуральная оспа, грипп, корь и др.), обладают следующими особенностями: а) начинаются с носительства, а не заканчиваются им; б) протекают как многокомпонентные, т. е. одновременно как десятки взаимозависимых эпидемий, вызванных возбудителями инфекций, таксономически и экологически несвязанных между собой; в) постоянно самоорганизуются и усложняются; г) способствуют формированию узкой специализации отдельных микроорганизмов и их «отрыву» от природного резервуара.
3. Прекращение нециклического эпидемического (пандемического) процесса, вызванного ретровирусами, может произойти в следующих случаях: а) когда будут инфицированы все особи вида-хозяина; б) когда инфицированные ретровирусами особи будут элиминированы из популяций вида-хозяина паразитами, являющимися естественными ограничителями нециклических пандемических процессов (возбудителями циклических монопандемий); в) когда вид-хозяин перестанет давать потомство, способное к размножению (см. разд. 4.3).
4. Как вариант исхода ретровирусной пандемии может иметь место эндогенизация вируса и изменение эволюционной траектории вида H. sapiens.
Метки: чума
