Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. 3.3. Многокомпонентные нециклические инфекционные процессы
3.3. Многокомпонентные нециклические инфекционные процессы
Одной из самых ранних находок у ВИЧ-иммунокомпромисных людей стала их поразительная чувствительность к оппортунистическим инфекциям. По мере прогрессирования болезни у ВИЧ-инфицированных пациентов развиваются инфекционные процессы, называемые СПИД-ассоциируемыми. Они и становятся основной причиной смерти больного СПИДом. Прослеживаются как минимум три уровня взаимодействия возбудителей оппортунистических инфекций, ВИЧ и клеток иммунной системы.
Надклеточный уровень. Изучен наиболее детально. Развитие оппортунистических инфекций при ВИЧ-инфекции формально «привязано» к количеству в крови Т-хелперов. У здоровых людей в 1 мм3 содержится около 1000 таких клеток. У ВИЧ-инфицированных их число постепенно падает (см. рис. 47). Когда хелперных Т-лимфоцитов становится меньше 400 — 200 на мм3, появляются первые инфекционные болезни — обычно неопасные, но беспокоящие больных инфекции кожных покровов и слизистых оболочек.
Наиболее чувствительными к ослаблению иммунной защиты организма являются вирус герпеса зостер (опоясывающий лишай), грибок кандида (молочница), вирус Эпштейна-Барра (волосатая лейкоплакия полости рта), туберкулезная палочка (стадия пре-СПИДа). На фоне прогрессирующего паралича иммунной системы (ранняя стадия СПИДа) активируются пневмоцисты, гистоплазмы, кокцидии, криптококки, токсоплазмы, вирус простого герпеса, криптоспоры. Поздняя стадия СПИДа (число Т-хелперов падает до минимума) сопровождается активацией цитомегаловируса и атипичных микобактерий — предвестников фатального исхода болезни (Милз Д., Мазур Г., 1990).
А. Я. Лысенко с соавт (1996) выделяют следующие особенности течения инфекций у лиц с приобретенным иммунодефицитом (табл. 15):
1) инфекции имеют тенденцию протекать с опасной для жизни пациента остротой;
2) имеют тенденцию к диссеминации возбудителя с обнаружением его в эктопических органах и тканях;
3) слабую податливость специфической терапии с тенденцией к множественным рецедивам, что особенно характерно для пневмоцистоза, токсоплазмоза, криптоспоридоза, атипичных микобактериозов и др;
4) слабый иммунный ответ на оппортунистического возбудителя.
Но у многих исследователей ВИЧ/СПИД-пандемии вызывает недоумение то обстоятельство, что нет логики в «подборе» перечня СПИД-ассоциируемых инфекций. Их возбудители таксономически крайне неоднородны, отсутствуют видимые признаки сходства в жизненных циклах и экологии. Иными словами, между условно-патогенными паразитами и СПИД-ассоциируемыми инфекциями нет обязательной обусловленности (см. работу Лысенко А. Я. с соавт., 1996). Отсутствие ожидаемой «логики» или «обусловленности» СПИД-ассоциируемых инфекций все же указывает на возможность определенной специфичности в подборе их возбудителей. Вот несколько примеров.
Сурфактантный белок A (SP-A), присутствующий в бронхоальвеолярной жидкости ВИЧ-инфицированных людей, усиливает прикрепление M. tuberculosis к альвеолярным макрофагам, провоцируя туберкулезную инфекцию. Этот процесс на стадии «преСПИДа» не связан с ослаблением иммунной системы, так как инфицирование человека туберкулезной палочкой обычно происходит еще до истощения Т-хелперов (Downing J. P. et al., 1995). M. tuberculosis и их белки, в свою очередь, способны активировать репликацию ВИЧ в макрофагах (Toossi Z. et al., 1997). Развитие туберкулезной инфекции усиливает репликацию ВИЧ и, соответственно, увеличивает вирусную нагрузку в крови ВИЧ-инфицированных пациентов. По данным Goletti D. еt al. (1996), она возрастает от 5 до 160 раз в период острой фазы туберкулеза.
Для возбудителя другой СПИД-индикаторной инфекции — M. avium — известны, по крайней мере, три таких фактора. Первый, это интерлейкин 6 (IL-6). Его повышенный синтез у ВИЧ-инфицированных людей резко увеличивает чувствительность макрофагов к M. avium. Второй — гликопротеин gp120 самого ВИЧ. Он усиливает размножение M. avium в альвеолярных макрофагах, — заражение человека этой микобактерией становится специфическим и неизбежным (Denis M., 1994а). Третий — это Tat-белок ВИЧ, трансактиватор транскрипции вируса (transactivator of transcription), обеспечивающий усиление репликации вируса и регулирующий экспрессию клеточных генов. Он с высокой аффинностью присоединяется к M. avium посредством интегрина (integrin alpha 5 beta 1), присутствующего на поверхности микобактериальной клетки. В результате у M. аvium значительно возрастает инфективность в отношении альвеолярных макрофагов человека (Denis M., 1994b).
Таблица 15
Характерные симптомы и признаки СПИД-ассоциируемых инфекций у людей различным иммунным статусом*
|
Вид возбуди-теля |
Здоровые |
С иммунологической дисфункцией |
С приобретенным иммунодефицитом, в том числе вызванным ВИЧ |
|
Cryptospori-dium spp, |
В подавляющем большинстве случаев — бессимптомное носительство |
Преходящая самокупирующая диарея |
Персистирующая водянистая диарея, диссеминация (холангит: холецистит, реактивный панкреатит, пневмония) |
|
Toxoplasma gondii |
У 99 % — бессимптомное носительство, около 1 % лимфоаденопатия |
Лимфаденопатия, хроническая инфекция с органными поражениями, в том числе ЦНС |
Менингеальные знаки, двигательные расстройства (очаговая дистония, гемибаллизм), пневмония, хориоретинит |
|
Pneumocystis carinii |
В подавляющем большинстве случаев — бессимптомное носительство |
Интерстициальная пневмония |
Рецидивирующая интерстициальная пневмония, кавернизация легких, диссеминация с эктопическими поражениями (кожи, костей, сетчатки, щитовидной железы, кишечника, гепатобилиарной сисемы, КМ) |
|
Isospora belli |
Носительство или кратковременная самокупирующаяся диарея |
Хроническая диарея с признаками мальабсорбации |
Хроническая рецидивирующая диарея с диссеминацией возбудителя в лимфатические узлы |
|
Leishmania infantum |
У взрослых — латентная инфекция |
Лихорадка, гепато- и спленомегалия, панцитопения, иммуносупрессия |
Диссеминация с эктопическими поражениями (легочные инфильтраты, плевральные выпоты, эзофагогастродуоденит, поражение гепатобилиарной системы, кожные поражения). Характерно: часто нет спленомегалии, отсутствуют специфические антитела в сыворотке |
|
Acanthamoeba spp |
Носительство |
Изъязвление роговицы, гранулематозный энцефалит |
Энцефалит, некротическая пневмония, панникулиты |
|
Blastocystis nominis
|
Носительство |
Легкая самокупирующаяся диарея |
Хроническая рецидивирующая диарея |
|
Strongyloides stercoralis |
В 50 % случаев бессимптомно, линейная крапивница, бронхообструктивный синдром, легкая диарея, эозинофилия |
Гиперинвазивный и диссеминированный с присоединением бактериальной инфекции с септицемией, эозинофилия, парез кишечника |
Чаще всего диссеминированный стронгулоидоз: истощение, хроническая диарея: асцит, пневмония, нефрит, менингит, хроническая линейная крапивница |
|
Sarcoptes scabiei |
Чесоточные ходы, зуд |
Диссеминированная инвазия с тяжелыми кожными поражениями |
Диссеминированная инвазия, может служить ко-фактором сепсиса с летальным исходом |
|
Candida albicans |
В подавляющем большинстве случаев носительство |
Стоматит, эзофагит, хронический гранулематозный кандидоз кожи, диссеминированный (кандидемия, кандидоз ЦНС, гломерулонефрит, эндофтальмит, эндокардит, холецистит, гепатит) |
Стоматит, эзофагит, вагинит, кандидоз кожи, пневмония, очень редко кандидоз ЦНС |
|
Cryptococcus neoformans |
Чаще всего — бессимптомно, реже — менингит, острый бронхит |
Острый менингоэнцефалит, лихорадка, фунгемия, криптококкома кожи, остеомиелит, целлюлит, спондилит |
Подострый менингоэнцефалит, диссеминированная инфекция (миокардит, медиастенит, плеврит, интерстициальная пневмония, тиреоидит, панкреатит, нефрит, эндофтальмит) |
|
Histoplasma capsulatum |
В большинстве случаев — бессимптомно, 1% — острый диссеминированный |
Хронический легочный или хронический прогрессирующий диссеминированный гистоплазмоз |
Диссеминированный гистоплазмоз (истощение, лихорадка, гепатоспленомегалия, панцитопения, ДВС синдром, поражение кожи, менингит, хориоретинит) |
|
Coccidioides immitis |
В 50 % случаев — бессимптомно, в 0.2-10 % — абсцессы кожи, мягких тканей, л/узлов, костей, бронхопневмония |
Пневмония, лихорадка, лимфаденопатия, менингит, кардиомиопатия, спондилит |
Чаще всего кокцидиоидный “сепсис” — пневмония, абсцессы мозга, мягких тканей, кожи, почек, гепатит, панкреатит, поражение КМ, селезенки |
|
Cytomega-lovirus hominis |
В подавляющем большинстве случаев — носительство |
Пневмония, гепатит, стоматит, эзофагит: “мононуклеозоподобный” синдром, виремия, анемия, тромбоцитопения |
Интерстициальная пневмония, стоматит, эзофагит, колит, проктит, менингоээнцефалит, полирадикуломиелит, адреналит хориоретинит, нефрит |
|
Herpes simplex |
Практически всегда – носительство, редко – гингивостоматит, локальные везикулярные высыпания на коже |
Стоматит, эзофагит, гепатит, пневмония, распространенные везикулярные высыпания на коже, часто рецидивирующего характера |
Стоматит, эзофагит, ретинит, менингоэнцефалит, пневмания, проктосигмоидит, перианатальный герпес, диссеминированное поражение кожи, гепатит, нечасто — генерализованная герпетическая инфекция |
|
Myco-bacterium avium complex |
Носительство |
Хронический легочный, вялотекущий процесс |
Хроническая диарея, гепатоспленомегалия, лимфаденопатия, бактериемия, колит, поражение лимфоузлов (часто мезентериальных), редко — поражение легких |
|
Myco-bacterium tuberculosis |
Чаще всего — носительство, реже — туберкулез бронхов, очаговый, инфильтративный процесс в легких, разрешающийся полностью после адекватной терапии |
Очаговый, инфильтративный, склонность к развитию каверн, миллиарный туберкулез, довольно часто внелегочные формы (кости, ЦНС) |
Неблагоприятно протекающий, ранее приобретенный туберкулез, торпидность к общепринятой терапии, отрицательная кожная проба с туберкулином, часто туберкулез легких протекает по типу диффузной интерстициальной пневмонии, нередко внелегочные формы (поражение селезенки, лимфоузлов, почек, костей, кишечника, менингоэнцефалит) |
|
Salmonella s pp. |
Очень часто носительство, редко — диарея, рвота, лихорадка, обезвоживание |
Пневмония, нефрит, гастроэнтероколит, септицемия, септикопиемия |
Практически всегда генерализованная форма, редко - гастроэнтероколит |
* По А. Я. Лысенко с соавт (1996).
Клеточный уровень. ВИЧ поражает различные клетки человека, но два типа являются критическими для развития ВИЧ-инфекции — это T-лимфоциты-хелперы и макрофаги. Если первые постепенно устраняются из крови самим вирусом, то вторые, наоборот, приобретают устойчивость к апоптозу и используются им до самой гибели больного СПИДом. Еще в 1994 г. Stevenson M. и Gendelman H. E. на основе собственных наблюдений пришли к выводу, что макрофаги играют центральную роль в прогрессировании ВИЧ-инфекции и ее клинических проявлений (рис. 56).
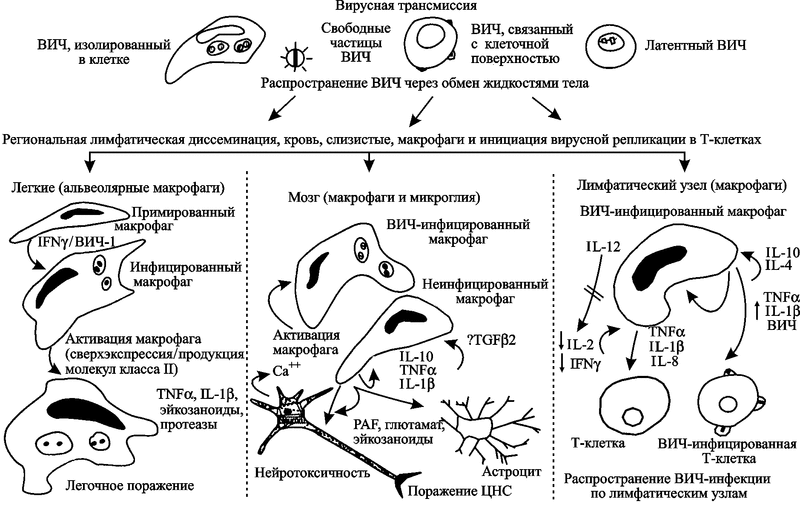
Рис. 56. Роль макрофагов в прогрессировании ВИЧ-инфекции
Вирус приникает в организм человека как в составе макрофагов, так и с тканевыми жидкостями в виде свободных частиц. Макрофаги распространяют ВИЧ по тканям и органам (современную модель повреждения и смерти нейронов под воздействием ВИЧ-инфекции см. на рис. 34) и непосредственно передают его Т-клеткам-хелперам. В этом процессе Т-хелперы активируются через представление антигена главным комплексом гистосовместимости макрофагов. Вирус от моноцитов передается к взаимодействующим с ними Т-хелперами. Активация макрофагов происходит через опортунистическую инфекцию и стимуляцию иммунной системы (Stevenson M., Gendelman H.E., 1994).
Поведение макрофагов, вышедших из под контроля Т- и В-клеточной системы, мало похоже на то, что приписывается им учебниками по иммунологии. По «законченным» представлениям их авторов о роли иммунной системы в инфекционном процессе, макрофаги относятся к врожденной системе иммунитета человека. Основное предназначение макрофага — удаление из крови микроорганизмов, опухолевых клеток, иммунных комплексов, презентация антигенов лимфоцитам и т.п. (см., например, работы Б. И. Кузника, 2004; А. С. Ройта с соавт., 2000; В. Г. Галактионова, 1998). В подглаве 2.2 я уже обращал внимание исследователей на то, что ВИЧ взаимодействует с макрофагами не только посредством хемокиновых рецепторов, но и маннозных, что более характерно для взаимоотношений паразитов почвенных и водных простейших. Причем в последнем случае он ведет себя как эндосимбионт, т. е. не интегрируется с геномом макрофага и не реплицируется. Но и те хемокиновые рецепторы на поверхности макрофагов, с которыми взаимодействует ВИЧ, очень древние, из времен одноклеточной жизни, так как принадлежат хемокинам C-X-C и C-C подклассов.
По данным S. Wahl et al. (2006), клеточная поверхность и внутриклеточные протеины макрофагов оказались весьма эффективными на различных этапах жизненного цикла лентивирусов. И хотя многие из них «подражают» таковым у CD4+ T-клеток, этими авторами получены доказательства существования у макрофагов хорошо отлаженных индивидуальных механизмов, позволяющих ВИЧ более эффективно колонизировать макрофаги, чем Т-клетки-хелперы. Например, в дополнение к хемокиновому рецептору CD4 и корецептору CCR5 Т-клеток-хэлперов, наружная мембрана макрофагов содержит белок аннексин II (annexin II), облегчающий ранние этапы проникновения ВИЧ в клетку. Связывание ВИЧ с макрофагами осуществляется более просто, чем с Т-клетками-хэлперами, так как для этого он может использовать значительно большее количество поверхностных молекул клетки, а не только рецептор CD4 (рис. 57).
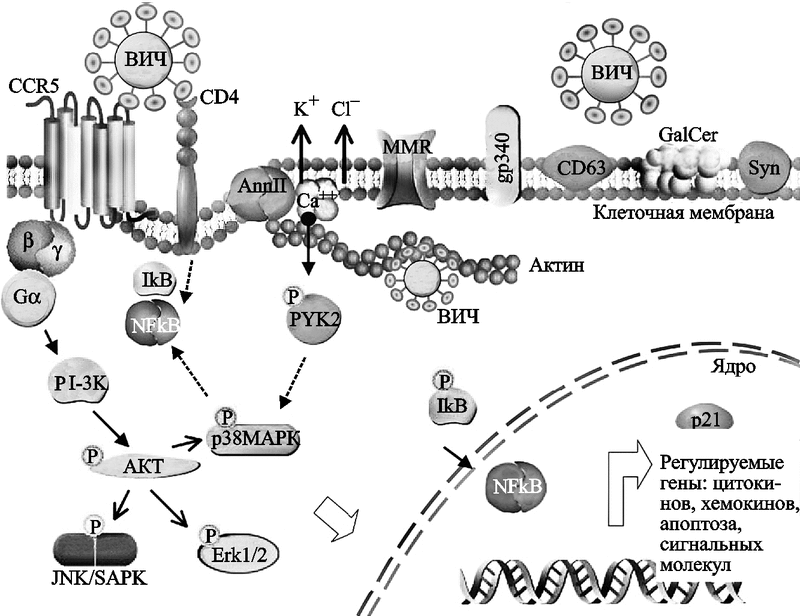
Рис. 57. Схематическое изображение участка мембраны макрофага, способного к взаимодействию с ВИЧ
В дополнение к каноническим рецепторным структурам типа CD4 и CCR5/CXCR4, мембрана макрофага имеет дополнительные молекулярные структуры, позволяющие вирусу эффективно узнавать макрофаг, присоединяться к его наружной поверхности и проникать вовнутрь клетки. Они могут также играть важную роль в сигнальных клеточных актах, лежащих в основе жизненного цикла вируса. Взаимодействие гликопротеина gp120 ВИЧ с CCR5 приводит к сигнальной трансдукции, активирующей PI-3K (PI — ингибитор протеазы). PI-3K, в свою очередь, активирует серин/треонин протеинкиназу (serine/threonine protein kinase, AKT). Далее запускается каскад реакций фосфорилирования, формирующих связи между транскрипционными актами. Аннексин (annexin II, Ann II) — это кальцийсвязывающий белок [calcium (Ca++)-binding protein], он взаимодействует с фосфатидилсерином (phosphatidylserine) Env ВИЧ и участвует в актин-цитоскелетных перестановках (actin cytoskeletal rearrangement) и в транспорте вируса вовнутрь макрофага. Актин и аннексин II «вовлекают» вирус в эндосомальный компартамен, где он чувствует себя «как дома». В «узнавании» ВИЧ также участвуют маннозный рецептор макрофага (macrophage mannose receptors, MMR), gp340, CD63, галактозилцереброзид (galactosylcerebroside, GalCer) и синдекан (syndecan, Syn). Точечные линии относятся к путям, предполагаемым для Т-клеток. Pyk2 (proline-rich tyrosine kinase-2) — пролин-обогащенная тирозинкиназа-2; SAPK (stress-activated protein kinase) — стресс-активированная протеинкиназа (Wahl S. et al., 2006).
Среди компонентов мембраны макрофагов в качестве кандидатов в кофакторы, позволяющих gp120 или gp41 ВИЧ взаимодействовать с этими клетками, уже описаны протеогликаны гепарин-сульфата (heparan sulfate proteoglycans), такие как синдекан (syndecan); цистеин-богатый рецептор-мусорщик (cysteine-rich scavenger receptor), gp340; маннозный рецептор, эластаза лейкоцитов человека (human leukocyte elastase), локализованная в клеточной поверхности и др. (табл. 16).
Таблица 16
Кофакторы мембраны макрофага, взаимодействующие с ВИЧ в дополнение к CD4 и CCR5
|
Лиганды оболочки ВИЧ |
Кофакторы мембраны макрофага |
|
gp 120 |
Синдекан, GalCer , MMR ( CD 206), Gp -340, сульфат гепарина, DC - SIGN ( CD 209), PDI |
|
gp41 |
Эластаза |
|
PS |
Аннексин II |
|
ICAM-3 |
DC-SIGN (CD209) |
|
ICAM-1 (CD54) |
LFA-1 |
|
MHC-I/MHC-II |
CD4 |
|
CD28 |
CD80* |
|
CD44 |
HA* |
|
CD62L |
Карбонгидраты : sLE X , GlyCAM1 |
|
? |
CD63 |
|
CD63 ( tetraspan transmembrane glycoprotein ) |
? |
|
CD36 |
? |
|
CD86 |
CD28* |
|
CD40 |
CD40* |
|
CD55 |
? |
|
CD 81 |
? |
* Предсказано на основе аналогии с Т-клетками. Сокращения: DC-SIGN (dendritic cell-specific intracellular adhesion molecule 3-grabbing nonintegrin) — внутриклеточная адгезионная молекула 3-захватывающего неинтегрина, специфического к дендрическим клеткам; PDI (protein disulfide isomerase) — протеин дисульфид изомераза; PS (phosphatidylserine) — фосфатидилсерин; HA (hyaluronic acid) — гиалуроновая кислота; CD62L, CD62-лиганд; sLEX — sialyl Lewis X; GlyCAMI (glycosylation-dependent cell adhesion molecule I) — молекула клеточной адгезии, зависящая от гликозилирования I; PSGLI (P-selectin glycoprotein ligand-1) — Р-селектин гликопротеин лиганд-1. В оболочку ВИЧ входят отдельные белки клеток человека (Wahl S. et al., 2006).
В зависимости от обстоятельств каждая из этих молекул (вместе или по отдельности с другими) может присоединять и концентрировать ВИЧ на поверхности макрофага, обеспечивать ему слияние с клеточной мембраной и/или влиять на его «благополучие» посредством сигнальной трансдукции. ВИЧ — облигатный паразит, имеющий ограниченный репертуар генов и генных продуктов, весьма эффективно использует ресурсы макрофага для своего существования и размножения. S. Wahl et al. (2006), исследовавшие возможные клеточные механизмы торможения репликации ВИЧ, которые могли бы рассматриваться как «защищающие клетку от вируса», не нашли убедительных доказательств их наличия.
Выделенные из крови моноциты конститутивно экспрессируют CD4 и CCR5 с вариабельным уровнем CXCR4 (Wahl S. M. et al., 1999). После дифференциации в макрофаги количество корецепторов на их поверхности увеличивается — их чувствительность к ВИЧ возрастает. Еще на поверхности слизистых инфицированный макрофаг может «случайно столкнуться» с миелоидными производными дендритных клеток (myeloid-derived dendritic cells, DC), которые, благодаря экспрессии DC-специфических межклеточных адгезионных молекул SIGN, могут «запустить» репликацию ВИЧ еще до проникновения макрофага в лимфоидную ткань (Geijtenbeek T. B. et al., 2000; Baribaud F. et al., 2001).
После взаимодействия ВИЧ с макрофагом он индуцирует сигнально-трандукционные акты, приводящие к транскрипции генов. Эти ответы, как правило, скоротечные и клетка возвращается к покоящемуся фенотипу («resting» phenotype) в течение 24–48 ч. В этих пределах времени вирус начинает свой жизненный цикл. Между 5 и 10 сутками после инфицирования макрофага, начинается активная продукция ВИЧ. Ее максимум достигается на 14 сутки. В макрофаге у ВИЧ экспрессируются гены, важные не только для его собственной репликации, но и способны эффективно оказывать влияние на функцию клетки-хозяина (рис. 58).
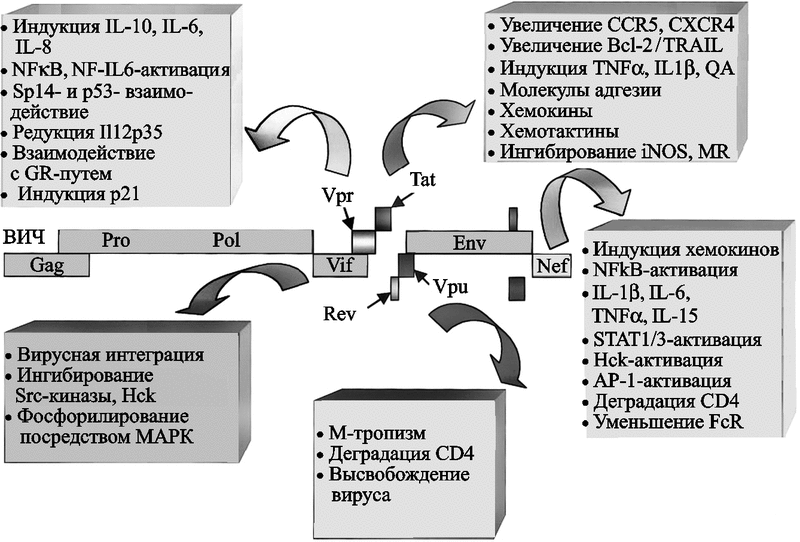
Рис. 58. Механизмы контроля со стороны ВИЧ над внутриклеточными процессами макрофагов
Белки ВИЧ Vpr, Vpu, Vif и Nef, в дополнение к Tat-регуляторному белку, влияют на сигнальную трансдукцию, генную экспрессию и белковый синтез. Сокращения: Sp1 (specificity protein-1) — специфичный белок-1; GR (glucocorticoid receptor) — глюкокортикоидный рецептор; QA (quinolinic acid) — квинолиновая кислота; TRAIL (TNF-related apoptosis-inducing ligand) — TNF-связанный апоптоз-индуцирующий лиганд; iNOS (inducible nitric oxide synthase) — индуцибельная окись-азота синтетаза; MR (mannose receptor) — маннозный рецептор; STAT (signal transducer and activator of transcription) — сигнальный преобразователь и активатор транскрипции; AP-1 (activated protein-1) — активированный белок-1; HCK (hematopoietic cell kinase) — гематопоэтическая клеточная киназа; FcR (Fc receptor) — Fc-рецептор; p21 (cyclin-dependent kinase inhibitor 1A; CDKN1A — циклин-зависимый ингибитор киназы 1А) (Wahl S. et al., 2003).
Гены сигнальной трансдукции наиболее активно экспрессируются ВИЧ-инфицированным макрофагом в 1-е и 14-е сутки; пики экспрессии генов транскрипции, клеточного цикла и апоптоза приходятся на 1-е сутки и на 7–14; гены метаболических процессов, цитокинов и хемокинов наиболее активны в 1-е сутки после инфицирования (Vazquez N. et al., 2005). Среди генов клеточного цикла N. Vazquez et al. (2005) выделяют ген p21 (cyclin-dependent kinase inhibitor 1A; CDKN1A/p21) — классический ингибитор G1-фазы клеточного цикла. Он наиболее активно экспрессируется ВИЧ-инфицированным макрофагом. Вирусный белок R (Vpr) независимо регулирует экспрессию p21. «Лечение» макрофагов p21-антисмысловыми олигонуклеотидами или малыми интерферирующими РНК (small interfering RNAs) тормозит репликацию ВИЧ. Эти данные показывают, что p21 является основным стимулятором жизненного цикла ВИЧ в макрофагальной клетке.
Одной из самых ранних находок у ВИЧ-иммунокомпромисных людей стала их поразительная чувствительность к оппортунистическим инфекциям. Макрофаги, полученные от ВИЧ-инфицированных пациентов с такими инфекциями, содержат значительное количество вирусных частиц. Этот феномен сказывается на эффективности активной ретровирусной терапии и является основной причиной смерти больных СПИДом.
S. Wahl et al. (2003) исследовали причины повышения такой восприимчивости на примере Mycobacterium avium — бактерии, неспособной вызывать инфекционный процесс у иммунокомпетентного человека. В организм иммунокомпромиссного пациента M. avium проникает через слизистую поверхность, активно размножается в макрофагах и ими же диссеминируется.
S. Wahl et al. (2003) наблюдали воздействие бактерий на макрофаги в условиях in vitro, когда на них не действуют цитокины Т-клеток. M. avium активирует основной транскрипционный активатор воспалительных цитокинов, NF-кB (nuclear factor кB ), и увеличение экспрессии CCR5 и цитокинов. Оба фактора стимулируют репликацию ВИЧ у инфицированного макрофага, и восприимчивость неинфицированного макрофага к этому вирусу (рис. 59).
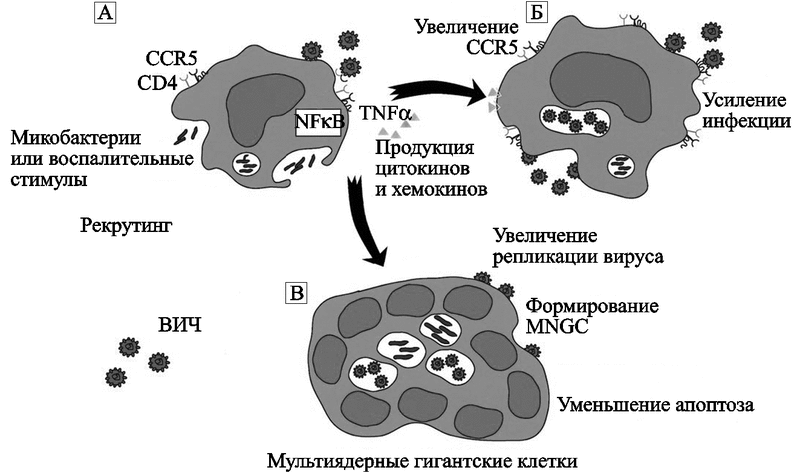
Рис. 59. Один из механизмов индукции благоприятных для ВИЧ факторов в макрофагах, инфицированных M. avium
Микобактерия активирует NF-kB, экспрессию CCR5, синтез хемокинов и цитокинов и подавляет апоптоз. В результате у макрофага повышается восприимчивость к ВИЧ, а в ВИЧ-инфицированных макрофагах вирус активно размножается. Образование бактериальных скоплений в макрофаге вызывает у людей гранулематозоподобные поражения, наполненные мультиядерными гигантскими клетками (multinucleated giant cells; MNGC), активированными макрофагами и заново рекрутированными мононуклеарными клетками (Wahl S. M. et al., 2000).
Макрофаги, инфицированные M. avium, интенсивно секретируют хемокины MCP-1 и MIP-1. По данным H. Hale-Donze et al. (2002), с этими хемокинами связана способность макрофагов к диссеминации микобактериальной инфекции в новом хозяине. Также MCP-1 и MIP-1 повышают их восприимчивость к ВИЧ. Особо хочу здесь отметить то, что на этом примере мы вновь видим участие в диссеминации микроорганизмов фагоцитирующими клетками человека, прежде всего хемокинов группы СС, сформировавшейся до появления позвоночных организмов (см. работу Najakshin A. M. et al., 1999; и рис. 38). Индукция цитокинов, специализирующихся в многоклеточных организмах на воспалительных реакциях, поддерживает ВИЧ в состоянии активной репликации и обеспечивает работу механизма, посредством которого оппортунистическая инфекция функционирует как кофактор, повышающий экспрессию генов ВИЧ и утяжеляющий течение ВИЧ-инфекции.
На раннем этапе взаимодействия M. avium с макрофагом активируется Toll-подобный рецептор-2 (Toll-like receptor 2), что проявляется фосфорилированием p38 MAPK (mitogen-activated protein kinase — митоген-активированная протеин киназа) и активацией серии транскрипционных факторов, ведущих к изменению экспрессии генов макрофага. Посредством транскриптомного анализа было показано, что M. avium, также как и ВИЧ (см. Vazquez N. et al., 2005), увеличивает количество p21, ингибитора G1-фазы клеточного цикла в клетке, который облегчает ее инфицирование ВИЧ. В дальнейшем происходит быстрое и масштабное нарастание экспрессии генов цитокинов TNF-альфа и IL-lбета.
M. avium может не только облегчить свое проникновение и выживание в макрофагальных внутриклеточных вакуолях, но и обрывать любое возможное противодействие ВИЧ со стороны клетки. В дальнейшем экспрессии подвергаются гены IL-10 и других иммуносупрессивных молекул, которые подавляют антибактериальные и противовирусные ответы хозяина (Greenwell-Wild T. et al., 2002).
Обнаружены и более сложные механизмы активации экзогенных ретровирусов возбудителями оппортунистических инфекций. Например, экспрессия генов ВИЧ, регулируемая посредством LTR, может быть трансактивирована регуляторными генами многих ДНК-вирусов, обычно инфицирующих людей. Среди них вирус простого герперса первого и второго типа, цитомегаловирусы, герпес-вирус 6, вирус гепатита В (Urnovitz H. B., Murphy W. H., 1996).
Клинические и экспериментальные данные показывают, что человеческий герпес-вирус 6А (human herpesvirus 6A; HHV-6A) — цитопатический Т-лимфотропный ДНК-вирус и этиологический агент roseola infantum способствует прогрессированию СПИДа совместно с ВИЧ. Этот вирус повышает патогенность ВИЧ по нескольким механизмам: активизацией LTR ВИЧ; индукцией CD4-экспрессии; повышением чувствительности к ВИЧ обычно мало восприимчивых к нему клеток, таких как CD8+ T-клетки и NK-клетки; переключением тропности ВИЧ с рецептора CCR5 на рецептор CXCR4 (см. рис. 47); и др. В опытах по совместному инфицированию обезьян (Macaca nemestrina) вирусом иммунодефицита обезьян (simian immunodeficiency virus, SIV) и HHV-6A было обнаружено быстрое нарастание количества частиц SIV в плазме крови, ассоциированное со скоротечным проявлением клиники болезни и последующей сероконверсией. В то же время животные, инфицированные только HHV-6A, не имели длительных патологических последствий (рис. 60).
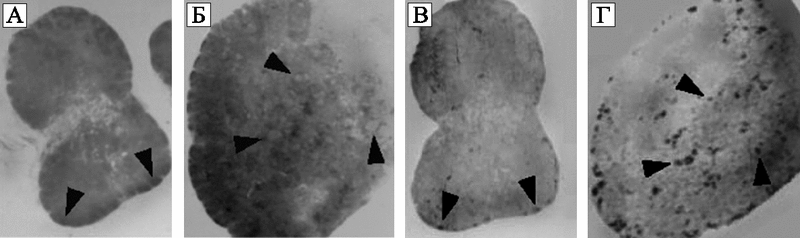
Рис. 60. Результаты гистопатологического исследования и гибридизации in situ ткани лимфатических узлов, полученных от макак, инфицированных SIVsmE660 (А и С) и SIVsmE660+HHV-6AGS (B и D)
На фотографиях A и B показаны результаты окрашивания гистологических препаратов гематоксилинэозином (hematoxylineosin).
На фотографиях C и D показаны результаты гибридизации in situ SIV РНК тех же разрезов лимфатических узлов.
Стрелки показывают увеличенные лимфоидные фолликулы с реагирующими (reactive) герминальными центрами (A и B), и специфический SIV РНК-гибридизационный сигнал соответствующих герминальных центров (C и D). В ткани животного, инфицированного только SIV (А и С), общая архитектура лимфатического узла сохранена, лимфоидные фолликулы едва видны в субкапсулярной области. Низкий уровень SIV РНК. В ткани животного, инфицированного SIVsmE660 и HHV-6AGS (B и D), гистологическая архитектура лимфатического узла значительно «сглажена» за счет выраженной фолликулярной гиперплазии и сливающихся между собой герминальных центров. Интенсивный сигнал SIV РНК в субкапсулярной области и глубоко расположенных фолликулах (Lusso P. et al., 2007).
Следовательно, хотя ВИЧ-инфекция и лежит в основе повышения чувствительности макрофагов к оппортунистическим патогенам, их действие друг на друга взаимное и специфическое, оппотунистические патогены промотируют ВИЧ по механизму обратной связи.
Уровень генома. Предположения о связи между собой процессов, в которых участвуют экзогенные ретровирусы и эндогенные ретроэлементы, появились в начале 1990-х гг. Однако трудности их изучения обусловлены не только недостаточным развитием соответствующей методологии. В привычном для человека масштабе времени не всегда возможно определение пределов таких процессов в эволюционной истории его как вида Homo sapiens . Пока «максимальным разрешением» таких исследований является жизнь конкретного человека. В этом масштабе времени нециклические процессы, в основе которых лежит взаимодействие эндогенных ретровирусов и ретроэлементов с экзогенными ретровирусами , могут, как минимум, протекать в следующих четырех вариантах.
1. Эндогенные ретровирусы и ретроэлементы усиливают инфекционный процесс, вызванный экзогенным ретровирусом. H. B. Urnovitz и W. H. Murphy (1996) описали ВИЧ-инфицированного пациента, чья иммунная система, благодаря активности эндогенного ретровируса млекопитающих типа С, находилась в хронически активированном состоянии. В результате прогрессирование ВИЧ-инфекции шло очень стремительно.
2. Эндогенные ретровирусы и ретроэлементы участвуют в комплементации нарушенных функций экзогенных ретровирусов. Отдельные HERV-K имеют транскрипционно активные открытые рамки считывания и кодируют собственную протеазу, идентичную протеазе ВИЧ. Протеаза HERV-K может комплементировать функцию протеазы ВИЧ у ВИЧ-инфицированных пациентов, подвергнутых лечению ингибиторами протеаз, и тем самым значительно снизить эффективность таких препаратов (Padow M. еt al., 2000).
3. Экзогенные ретровирусы активизируют эндогенные ретровирусы и ретроэлементы. J. J. Goedert et al. (1999) показали усиление экспрессии генов эндогеного ретровируса K10 (HERV-K10) у ВИЧ-инфицированных людей и больных СПИДом, и, соответственно, повышение риска развития у них тестикулярного рака (testicular cancer). ВИЧ индуцирует появление вирусных частиц HERV-K(HML-2) в сыворотке человека (Contreras-Galindo R. et al., 2006; 2007).
По данным Contreras-Galindo R. et al. (2007) РНК HERV-K(HML-2) встречается в крови ВИЧ-инфицированных пациентов почти всегда, в 95,33 % исследуемых образов, но отсутствует в крови неинфицированных ВИЧ людей. Ранее Contreras-Galindo R. et al. (2006), исследовав на нагрузку по РНК HERV-K кровь 20 ВИЧ-инфицированных пациентов, принимавших высокоактивную ретровирусную терапию (HAART), обнаружили, что титры такой РНК всегда значительно повышены у пациентов с несупрессированной HAART (non-suppressive HAART), т. е. у тех из них, у которых такая терапия не дает эффекта в субоптимальных дозах. У пациентов, у которых HAART давала положительный эффект, повышения титров РНК HERV-K, не обнаруживалось. В описанных случаях имеет место активизация ВИЧ HERV-K, те, в свою очередь, снижают эффективность HAART.
В качестве активаторов HERV могут выступить не только экзогенные ретровирусы, например, ВИЧ. По крайней мере, в клеточных линиях, инфицированных вирусом гриппа A/WSN/33 или вирусом герпеса первого типа, удавалось достичь аберрантной экспрессии HERV семейства W (Nellaker С. et al., 2006).
Пока неизвестно, способны ли передаваться горизонтально между людьми HERV, активизировавшиеся благодаря ВИЧ или другой инфекции, Но такую возможность нельзя исключать, и, несомненно, это очень интересная тема будущих исследований взаимоотношений экзогенных и эндогенных ретровирусов человека.
4. Эндогенные ретровирусы и ретроэлементы тормозят инфекционный процесс, вызванный экзогенным ретровирусом. Экспрессия Fv1, gag-последовательности эндогенных ретровирусов мышей, гомологичных семейству HERV-L, блокирует отдельные штаммы вируса лейкемии мышей. Каким образом это происходит, неясно (Bannert N., Kurth R., 2004). Патологические состояния, в основе которых лежит автономная деятельность эндогенных ретровирусов и ретроэлементов, описаны в подглаве 4.4.
***
При ВИЧ-инфекции клеточная и гуморальная составляющие иммунной системы постепенно перестают контролировать реликтовую иммунную систему, и фагоцитирующие клетки начинают играть в инфекционном процессе ту же роль «мусорщиков», которую они играли у первых многоклеточных животных. Между такими клетками и их паразитами восстанавливаются связи, отношения и даже иерархия, существовавшие у них в архее. На уровне макроорганизма они проявляются десятками нециклических инфекционных процессов, называемых СПИД-ассоциируемыми, и активизацией эндогенных ретроэлементов.
Так как взаимодействие возбудителей СПИД-ассоциируемыми инфекций, ВИЧ и клеток иммунной системы носит специфический характер на надклеточном, клеточном и генетическом уровнях, я предлагаю выделить такие процессы в отдельную группу — многокомпонентные нециклические инфекционные процессы. Их сложность, по мере ослабления контроля клеточной и гуморальной иммунной системы над реликтовой иммунной системой, нарастает; и они начинают поддерживать себя сами по различным дублирующим специфическим механизмам. Например, белок SP-A, присутствующий в бронхоальвеолярной жидкости ВИЧ-инфицированных людей, усиливает прикрепление M. tuberculosis к альвеолярным макрофагам; CDKN1A/p21 — классический ингибитор G1-фазы клеточного цикла индуцируется как ВИЧ, так микобактериями, но одновременно он является стимулятором жизненного цикла и ВИЧ, и микобактерий в макрофагальной клетке; индукция M. avium основного транскрипционного активатора воспалительных цитокинов, NF-кB, ведет к увеличению экспрессии CCR5 и цитокинов, стимулирующих репликацию ВИЧ; экспрессия генов ВИЧ, регулируемая посредством LTR, может быть трансактивирована регуляторными генами многих ДНК-вирусов; они же способны повысить чувствительность к ВИЧ у CD8+ T-клеток и NK-клеток; «переключить» тропность ВИЧ с корецептора CCR5 на корецептор CXCR4. ВИЧ после утраты иммунной системой человека Т- и В-клеточной функции переходит в разряд «равного среди равных» формирующегося паразитоценоза первых многоклеточных организмов. Отдельные нециклические инфекции могут развиваться как комплекс инфекционных болезней и болезней, традиционно не относимых к инфекционным (онкологические, аутоиммунные и др.).
Метки: чума
