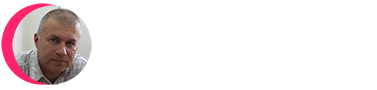Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. 1.3. Ретровирусное окружение вида Homo sapiens
1.3. Ретровирусное окружение вида Homo sapiens
Когда знакомишься с вирусологической литературой, изданной «накануне» обнаружения ВИЧ, то складывается впечатление, что ретровирусы на тот момент были изучены не хуже, чем кишечная палочка (см., например, работы Альштейна А. Д., 1982; Тимакова В. Д. и Зуева В. А., 1977).
Первые ретровирусы открыты еще в начале ХХ столетия, когда была установлена вирусная природа эритробластоза и саркомы кур. Вскоре были обнаружены вирус рака молочных желез мышей и вирус лейкоза мышей. Название семейству дано в 1973 г. W. Parks — оно происходит от англ. «reverse transcriptase» (обратная транскриптаза). В латинском варианте «retro» означает обратный поток информации — не от ДНК к РНК, а, наоборот, от РНК к ДНК. В 1970-х гг. семейство было тщательно классифицировано и изучено. Установлена морфология, химический состав, жизненный цикл и патогенные свойства многих его представителей. Ретровирусы были обнаружены как у животных, составляющих ближайшее окружение человека, так и у его эволюционных предков. Их выявили у норок (эндогенный вирус типа С), мышей (экзогенные и эндогенные вирусы лейкоза, вирус саркомы, вирусы рака молочных желез), крыс (эндогенный вирус типа С), хомяков (эндогенный вирус типа С), кошек (эндогенный вирус типа С, экзогенные вирусы лейкоза и саркомы), крупнорогатого скота (вирус лейкоза), обезьян (эндогенные и экзогенные вирусы типа С, эндогенный вирус типа В, вирус лимфомы гиббонов и др.), свиней (вирус типа С), у пресмыкающихся (вирусы типа С), овец (вирусы висны) и др. «Рука ученого» дотянулась даже до ретровирусов гадюк. Тем более удивительным нам представляется существовавший на тот момент пробел в знаниях по ретровирусам у людей. На этом фоне и так запоздалое обнаружение ВИЧ выглядит до сих пор чуть ли не «как гром с ясного неба», даже роль этого вируса в развитии пандемии СПИДа подвергается сомнению.
Структура и цикл жизни ретровирусов. Ретровирусы — семейство сложных РНК-геномных вирусов, образующих с помощью обратной транскриптазы ДНК-копию генома, которая, интегрируя с геномом хозяина, вызывает интегральную инфекцию. Для включения вируса в семейство Retroviridae обязательны следующие признаки:
1) наличие липидной оболочки и сердцевины (core) и характерная морфология, на основании которой их делят на типы В, С и D;
2) наличие обратной транскриптазы внутри вириона;
3) геном в виде однонитевой линейной РНК, которая образует комплекс, состоящий из двух идентичных субъединиц (т.е. они представляют собой диплоидные организмы, каждый их вирион содержит две идентичные цепи РНК размером от 8 тыс. до 10 тыс. нуклеотидов, соединенных вблизи своих 5’-концов);
4) репликация через стадию образования двунитевого ДНК-провируса, соответствующего по длине одной из субъединиц геномной РНК;
5) интеграция ДНК-провируса с клеточным геномом и осуществление транскрипции клеточной РНК-полимеразой (после интеграции ретровирусная ДНК реплицируется как часть клеточной ДНК), созревание вириона путем почкования на клеточных мембранах (Альштейн А. Д., 1982).
Вирион сферический (диаметр 80-100 нм) оболочечный, с гликопротеиновыми поверхностными выступами (8 нм в длину). Внутреннее ядро включает сферический нуклеокапсид (нуклеоид), расположенный эксцентрично у представителей рода Betaretrovirus, по центру – у Alpharetrovirus, Gammaretrovirus, Deltaretrovirus и Spumavirus, и в виде стержня или усеченного конуса у представителей рода Lentivirus. Традиционно семейство разделяют на подсемейства ленти-, онкорна- и спумавирусов (Dalton F. et. al., 1974; Matthews R., 1979). Ретровирусное филогенетическое древо показано на рис. 17.
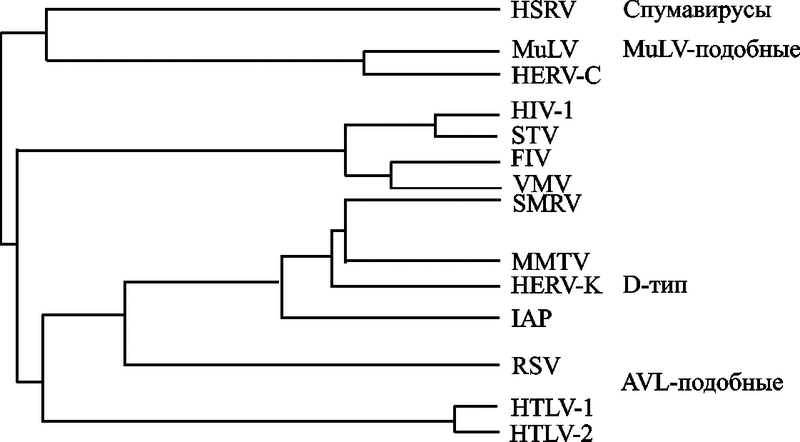
Рис. 17. Ретровирусное филогенетическое древо
На филогенетическом дереве показаны ретровирусы типа С [вирусы лейкозов грызунов (MuLV) и птиц (АLV), а также вирус, тропный к Т-лимфоцитам человека (НТLV)], лентивирусы [вирусы иммунодефицита человека (ВИЧ-1 и 2), обезьян (SIV), кошек (FIV) и вирус visna-maedi (VMV)], спумавирусы и эндогенные ретровирусы человека (HERV-K и HERV-C) (Пауэр К., 2001).
Схематическое изображение РНК-генома ретровирусов приведено на рис. 18.
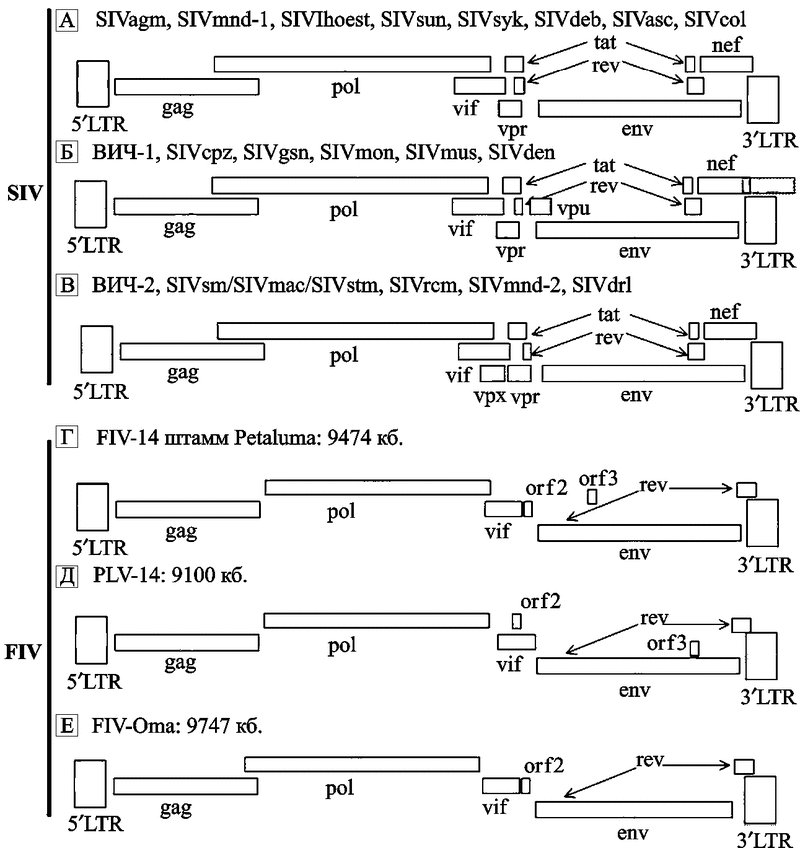
Рис. 18. Схематическое изображение РНК-генома ретровируса на примере сравнения геномов лентивирусов кошачьих и приматов (по Woude S.V., Apetrei C., 2006)
Лентивирусы приматов обладают пятью регуляторными генами (vif, rev, tat, vpr и nef), которые обычно «выстроены в шеренгу» в одних и тех же регионах SIV/ВИЧ генома. Гены tat и rev содержат по два экзона. Присутствие в геноме лентивируса двух других регуляторных генов (vpx и vpu) варьирует в зависимости от происхождения вируса. Их сочетания обычно делят на три геномные групы:
а) SIVsyk, SIVasc, SIVdeb, SIVblu, SIVtal, SIVagm, SIVmnd-1, SIVlhoest, SIVsun и SIVcol содержат пять добавочных генов (tat, rev, nef, vif и vpr);
b) геномы ВИЧ-1, SIVcpz, SIVgsn, SIVmus, SIVmon и SIVden включают дополнительный ген vpu;
c) ВИЧ-2, SIVsmm, SIVmac, SIVrcm, SIVmnd-2 и SIVdrl формируют третью геномную группу, характеризующуюся присутствием гена vpx.
Гены far, vpx специфичны для SIV, инфицирующих обезьян Papionini (триба павиановые, включают следующие рода: павианы, макаки, мангобеи, мандрилы, джелады) и были приобретены в результате негомологичной рекомбинации (nonhomologous recombination), которая привела к дупликации гена vpr. SIVblu, SIVolc, SIVwrc, SIVasc, SIVbkm, SIVery и SIVagi не были полностью секвенированы, и поэтому пока нет возможности охарактеризовать организацию их генов.
Структура геномов трех видов FIV сходна и не обнаруживает явных геномных групп, связанных с патогенностью для кошачьих. FIV несут два других добавочных гена: ген dUTPазы (dUTPase gene; на схеме не показан), расположенный в рамке в пределах гена pol. Он ответственен за предотвращение ошибочного включения урацила (uracil misincorporations) в молекулу РНК вируса во время его репликации и, соответственно, его аттенуации. Вторая открытая рамка считывания, обозначенная как orf-A (также ее называют orf-2), кодирует протеин, состоящий из 77 аминокислот, сходный с Tat ВИЧ. У этого протеина не обнаружена способность к трансактивации (transactivating properties), однако он является критическим на ранней стадии инфицирования клетки и при формировании вирусной частицы, локализован в ядре, что делает его более сходным по свойствам с Vpr. Нарушение функции белка Orf-A ведет к снижению способности вируса к репликации и уменьшению его патогенности. Оrf-3 содержит ATG-кодон в направлении «вниз» (downstream) от потенциального сплайсингакцепторного сайта. кб – килобазы.
Инфекционный ретровирус имеет три основных структурных гена, кодирующих вирусные протеины в следующем порядке: 5’-gag-pol-env-3’. Для ВИЧ их описание следующее:
ген gag — кодирует белки, формирующие «сердцевину» вируса (необходимы для внутриклеточной сборки вируса и его высвобождения из клетки);
ген pol — кодирует ферментную систему вируса (обратную транскриптазу — p66/51; интегразу — p31/33; рибонуклеазу — p31/33);
ген env — определяет способность вируса выходить за пределы клетки и инфицировать другие. Кодирует белки предшественника оболочки вируса — gp160, расщепляющиеся на gp120 и gp41.
Области 5’- и 3’-концов обеих цепей модифицированы, как и у всех эукариотических мРНК (5’-кэпы и 3’-полиадениловые хвосты). Имеются последовательности, необходимые для реализации механизма обратной транскрипции:
1) прямые повторы на 5’- и 3’-концах РНК (LTR — он действует как единица промоции, необходим для транскрипции всего вирусного генома и начала транскрипции отдельных вирусных генов);
2) последовательность из 80–120 нуклеотидов, соседствующая с 5'-концевым прямым повтором (U5);
3) последовательность из 170–1200 нуклеотидов, соседствующая с 3’-концевым прямым повтором (U3);
4) последовательность из 15–20 нуклеотидов (Р), в пределах которой клеточная тРНК спаривается с ретровирусной РНК, что создает праймер для синтеза первой цепи ДНК;
5) сегмент Рu, находящийся непосредственно перед повтором U3 и являющийся сайтом для праймирования второй цепи ДНК.
У ретровирусов кроме структурных есть еще регуляторные гены. У ВИЧ их шесть:
tat (transactivator of transcription) — кодируемый им белок является наиболее активным регулятором, обеспечивающим усиление в 1000 раз репликации вируса и регулирующий экспрессию клеточных генов;
rev (regulator of expression of virus proteins) — кодируемый им белок избирательно активирует синтез структурных белков вируса, обеспечивает экспорт из ядра длинных молекул вирусной РНК. На поздних стадиях ВИЧ-инфекции он замедляет синтез регуляторных белков (см. «Реинфекция»);
nef (negative regulatory factor) — при взаимодействии с LTR кодируемый им белок замедляет транскрипцию вирусных генов. Синхронная функция nef и tat регулируют репликацию вируса таким образом, чтобы она не приводила к гибели клетки-хозяина. Экстрацеллюлярный белок nef увеличивает миграцию моноцитов, тем самым, способствуя распространению по организму ВИЧ и прогрессированию болезни;
vif (virion infectivity factor) — кодируемый им белок необходим для образования функционально полноценных вирусов в определенных типах клеток на поздней стадии инфекции. Белок Vif включается в состав новых вирусов;
vpr — кодируемый им белок вызывает остановку клеточного цикла, способствует входу в ядро прединтеграционного комплекса. Vpr включается в новые вирусы в большом количестве, способен в некоторой степени усиливать экспрессию генов ВИЧ и нарушать экспрессию отдельных клеточных генов;
vpu для ВИЧ-1 (vpx для ВИЧ-2) — кодируемый им белок разрушает комплекс gp120/CD4; снижает экспрессию CD4; способствует высвобождению вируса; усиливает продукцию вируса, связывая цитоплазматический хвост молекулы CD4, пока она находится в эндоплазматическом ретикулуме, и тем самым посттрансляционно сокращает число рецепторов CD4 на поверхности клетки. В результате предотвращается захват Env в эндоплазматическом ретикулуме в комплексе с CD4. В природе не существует других диплоидных семейств ДНК или РНК-вирусов.
Схематично жизненный цикл ретровирусов включает связывание вириона с рецептором клетки хозяина, вход в клетку, затем следует обратное транскрибирование с последующей интеграцией с геномом хозяина. Проникновение в клетку определяется взаимодействием гликопротеина вириона и специфических рецепторов на клеточной поверхности, следствием чего является слияние вирусной оболочки и клеточной мембраны и эндоцитоз. Некоторые из клеточных рецепторов были идентифицированы (более подробно см. в подглаве 3.3). В проникновении ВИЧ в клетку принимают участие как минимум два рецептора: иммуноглобулин-подобный протеин с одним трансмембранным участком CD4 и хемокиновый рецептор, пронизывающий мембрану семь раз (CCR5 или CXCR4). Рецепторы для экотропных (Murine leukemia virus, MLV), амфотропных MLV и Gibbon are leukemia virus (GALV) связаны с участием в транспортировке небольших молекул и имеют сложную структуру с множественными трансмембранными доменами. Для вирусов лейкоза птиц (ALVs) идентифицировано два рецептора: для вирусов подгруппы А — небольшая молекула с одним трансмембранным доменом, отдаленно напоминающая клеточный рецептор для низкоплотностных липопротеинов, тогда как для вирусов подгруппы В — рецепторы семейства протеинов фактора некроза опухоли.
Репликация начинается с обратной транскрипции вирионной РНК в кДНК, с использованием 3’-конца тРНК в качестве праймера. Синтез кДНК сопровождается разрезанием вирусной РНК (за счет РНКазной активности обратной транскриптазы). Продукты гидролиза служат для первичного синтеза кДНК с негативной полярностью. Конечная форма двуспирального ДНК-транскрипта, образуемого из вирусного генома, содержит LTR, состоящие из последовательностей с 3’- и 5’-концов вирусной РНК, фланкирующих сиквенс (R), обнаруженный по обоим концам РНК. Процесс обратной транскрипции характеризуется высокой частотой рекомбинации.
Ретровирусная ДНК интегрируется в хромосомную ДНК клетки, образуя провирус, при участии вирусного протеина интегразы (IN). Ретровирусы имеют собственные «предпочтения» при интеграции в геном "своих" хозяев. Интеграционные сайты для ВИЧ обнаружены в основном в активных транскрипционных участках. Для MLV приблизительно 25 % интеграционных актов происходят вблизи сайтов старта транскрипции и ассоциируются с CpG-островками, тогда как интеграция в пределах транскрипционных участков происходит редко. Этот же вирус удачно интегрируется с хромосомной ДНК у гиперчувствительных к ДНКазе I сайтов (DNase I–hypersensitive sites). Для ASLV характерна «беспорядочность» в выборе сайтов интеграции. Основная роль в выборе сайта интеграции для ретровируса закреплена естественным отбором за интегразой. Этот белок связывается со специфическим белком в близи сайта интеграции, инициируя интеграцию провируса в определенный участок хромосомной ДНК (Lewinski M. K et al., 2006).
Карта интегрированного провируса колинеарна неинтегрированной вирусной ДНК. Интеграция предшествует вирусной репликации. Интегрированный провирус транскрибируется клеточной РНК полимеразой II в вирионную РНК и мРНК в ответ на транскрипционный сигнал в вирусных LTR. У вирусов некоторых родов транскрипция также регулируется вирусными трансактиваторами.
В зависимости от вируса и генетической карты различают несколько классов мРНК. мРНК, включающая весь геном, служит для трансляции генов gag, pro, pol (расположенных в 5’-половине РНК), продуктом которых является полипротеин-предшественник, разрезаемый до структурных протеинов, полимеразы, обратной транскриптазы и интегразы, соответственно. Меньшие РНК, включающие 5’-конец генома, после сплайсинга с сиквенсом 3’-конца генома, и включающие ген env, участки U3 и R, транслируются в предшественники оболочечных протеинов. У вирусов, содержащих дополнительные гены, может происходить другой сплайсинг, но все такие РНК будут иметь общий 5’-концевой сиквенс. Спумавирусы уникальны в том, что могут использовать внутренний промотор, расположенный в гене env выше доступа к рамке считывания. Большинство первично транслированных продуктов представляют собой полипротеины, подвергающиеся протеолитическому разрезанию для приобретения функциональной активности. Продукты генов gag, pro и pol обычно являются вторичными после первичной трансляции продуктов. Для трансляции pro и pol используются обходные трансляционные терминирующие сигналы.
Сборка капсида происходит либо на плазматической мембране (вирусы большинства родов), либо вирусные частицы собираются в цитоплазме (Betaretrovirus и Spumavirus), и высвобождаются из клетки почкованием. Полипротеиновый процессинг внутренних протеинов происходит попутно или последовательно с созреванием вириона.
Онкогенные ретровирусы (Oncovirinae) — для онковирусов в отличие от ретровирусов других подсемейств, характерна способность размножаться в клетке, не повреждая ее жизнеспособности. Они легко становятся эндогенными и передаются вертикально, подобно обычным клеточным генам. К ним относятся вирусы лейкоза грызунов (MuLV); кошек (FeLV) и птиц (ALV); вирусы, тропные к лимфоцитам Т у человека (HTVL-1 и HTVL-2); вирус саркомы шерстистых обезьян (SSV-1) и ряд других. Большинство из них обладают выраженным онкогенным и нейротропным действием. Детально вирусы подсемейства Oncovirinae исследованы еще в 1960-1970-х гг. (см. работу Альштейна А. Д., 1982).
Лентивирусы (Lentivirinae, «медленные вирусы») — в состав подсемейства входят экзогенные вирусы (с горизонтальной и вертикальной передачей) человека и многих других млекопитающих. О существовании родственных эндогенных вирусов сведений нет. Лентивирусы приматов отличаются по использованию хемокинового рецептора и протеина CD4. Некоторые группы проявляют перекрестную активность по антигенам Gag (лентивирусы овец, коз и кошек). Вирусы, родственные Feline immunodificiency virus (FIV), были выделены от других крупных кошачьих (например, Puma lentivirus), а наличие антител к антигену Gag у львов и других крупных кошачьих свидетельствует о существовании других вирусов, близких FIV и лентивирусам овец и коз. На основе различий по спектру восприимчивых хозяев лентивирусы были подразделены на 5 групп (лентивирусы приматов, овец и коз, лошадей, кошек и КРС). Внутри группы лентивирусов приматов HIV-1 отличается от HIV-2, прежде всего по дивергенции нуклеотидных сиквенсов, которая превышает 50 %, и по наличию у HIV-2 гена vpx (табл. 6).
Таблица 6 Семейство ретровирусов
|
|
Название вида вируса |
Название на русском языке |
№ генома в |
Аббревиатура |
|
|
|
Группа лентивирусов КРС |
||||
|
|
Bovine immunodeficiency virus |
Вирус иммунодефицита КРС |
M32609 |
BIV |
|
|
|
Группа лентивирусов лошадей |
|
|||
|
|
Equine infectious anemia virus |
Вирус инфекционной анемии лошадей |
M16575 |
EIAV |
|
|
|
Группа лентивирусов кошек |
|
|||
|
|
Feline immunodeficiency virus (Petu) |
Вирус иммунодефицита кошек (Петулума) |
M25381 |
FIV-P |
|
|
|
Feline immunodeficiency virus(Oma) |
Вирус иммунодефицита кошек (Ома) |
FIU56928 |
FIVO |
|
|
|
Puma lentivirus (PLV-14) |
Лентивирус пум (PLV-14) |
PLU03982 |
PLV |
|
|
|
Группа лентивирусов овец и коз |
||||
|
|
Caprine arthritis encephalitis virus |
Вирус артрита-энцефалита коз |
M33677 |
CAEV |
|
|
|
Visna/Maedi virus (strain 1514) |
Вирус Висна-Мэди (штамм 1514) |
M60609 |
VISNA |
|
|
|
Группа лентивирусов приматов |
||||
|
|
Human immunodeficiency virus 1 Геномные клады HIV-1 примеры: Clade A:U455 |
ВИЧ 1 (генетические группы или клады HIV-1, примеры вирусов каждой группы) |
|
HIV-1
|
|
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
M62320 |
HIV-1.U455 |
|
||
|
|
Clade B: ARV-2/SF-2 |
K02007 |
HIV-1.ARV-2/SF-2 |
|
|
|
|
BRU (LAI) |
K02013 |
HIV-1.BRU (LAI) |
|
|
|
|
HXB2 |
K03455 |
HIV-1.HXB2 |
|
|
|
|
RF |
M17451 |
HIV-1.RF |
|
|
|
|
MN |
M17449 |
HIV-1.MN |
|
|
|
|
Clade C: ETH2220 |
U46016 |
HIV-1.ETH2220 |
|
|
|
|
Clade D: NDK |
M27323 |
HIV-1.NDK |
|
|
|
|
ELI |
X04414 |
HIV-1.ELI |
|
|
|
|
Clade F: 93BR020 |
AF005494 |
HIV-1.93BR020 |
|
|
|
|
Clade H: 90CR056 |
AF005496 |
HIV-1.90CR056 |
|
|
|
|
Clade O: ANT70 |
L20587 |
HIV-1.ANT70 |
|
|
|
|
Human immunodeficiency virus 2 |
ВИЧ 2 (генетические группы или клады) HIV-1, примеры вирусов каждой группы) |
|
HIV-2
|
|
|
|
|
||||
|
|
Геномные клады HIV-2 |
|
|||
|
|
примеры: |
|
|||
|
|
Clade A: BEN |
M30502 |
HIV-2.BEN |
|
|
|
|
ISY |
J04498 |
HIV-2.ISY |
|
|
|
|
ROD |
M15390 |
HIV-2.ROD |
|
|
|
|
ST |
M31113 |
HIV-2.ST |
|
|
|
|
Clade B: D205 |
X61240 |
HIV-2.D205 |
|
|
|
|
EHOA |
U27200 |
HIV-2.EHOA |
|
|
|
|
UC1 |
L07625 |
HIV-2.UCI |
|
|
|
|
Simian immunodeficiency virus |
Вирус иммунодефицита обезьян (ВИО) |
|
HIV-2 |
|
|
|
African green monkey (agm) SIVs |
ВИО африканской зеленой мартышки |
|
|
|
|
|
African green monkey TYO |
ВИО африканской зеленой мартышки TYO |
X07805 |
SIV-agm.TYO |
|
|
|
African green monkey 155 |
ВИО африканской зеленой мартышки 155 |
M29975 |
SIV-agm.155 |
|
|
|
African green monkey 3 |
ВИО африканской зеленой мартышки 3 |
M30931 |
SIV-agm.3 |
|
|
|
African green monkey gr-1 |
ВИО африканской зеленой мартышки gr-1 |
M58410 |
SIV-agm.gr |
|
|
|
African green monkey Sab-1 |
ВИО африканской зеленой мартышки Sab-1 |
U04005 |
SIV-agm.sab |
|
|
|
African green monkey Tan-1 |
ВИО африканской зеленой мартышки Tan-1 |
U58991 |
SIV-agm.tan |
|
|
|
chimpanzee SIV |
ВИО шимпанзе |
X52154 |
SIV-cpz |
|
|
|
mandrill SIV |
ВИО мандрилл |
M27470 |
SIV-mnd |
|
|
|
red-capped mangabey SIV |
ВИО красношапочного мангабея |
AF028607 |
SIV-rcm |
|
|
|
sooty mangabey SIV-H4 |
ВИО-Н4 темно-коричневого мангабея |
X14307 |
SIV-sm |
|
|
|
*Rhesus (Maccaca mulatta) |
ВИО макак резус (Maccaca mulatta) |
M195499 |
SIV-mac |
|
|
|
*pig-tailed macaque |
ВИО свинохвостых макак |
M32741 |
SIV-mne |
|
|
|
*stamp-tailed macaque (stm) |
ВИО медвежьих макак |
M83293 |
SIV-stm |
|
|
|
sykes monkey SIV |
ВИО белогорлых обезьян |
L06042 |
SIV-syk |
|
* - описана межвидовая передача SIV-sm (у приматов, содержащихся в неволе).
Геномы лентивирусов содержат множество дополнительных генов, необходимых для способности к инфицированию и репликации. Лентивирусы отличает их способность реплицироваться в неделящихся клетках, например в покоящихся CD+4 T-клетках и макрофагах (см. подглаву 3.3). Большинство лентивирусов ассоциируются с различными болезнями, включая иммунодефициты, нейрологические нарушения, артриты и др. Патология пока не описана у крупнорогатого скота, инфицированного BIV . Онкоген-вирусов среди представителей подсемейства нет. Нейротропность лентивирусов касается в основном клеток, происходящих из костного мозга, таких, как микроглия и макрофаги, в то время как астроциты и эндотелиальные клетки, очевидно, инфицируются в гораздо меньшей степени. Эволюционная взаимосвязь лентивирусов приматов показана на рис. 19 .
Рис.19. Эволюционная взаимосвязь между лентивирусами приматов, основанная на филогенетическом анализе полной последовательности белка Pol
Последовательности этих белков лентивирусов, инфицирующих африканских приматов, показаны черным цветом. Недавняя перекрестно-специфическая множественная передача в оригинальном тексте выделена красным цветом; в данной книге — это ветви, идущие по направлениям к ВИЧ-2 от темно-коричневого мангобея (sooty mangabeys); и к ВИЧ-1 (O, N и М групп) от шимпанзе. AGM — африканские зеленые обезьяны; RCM — красношапочные мангобеи (по Muller V. и De Boer R. J., 2006).
С помощью филогенетического анализа нуклеотидных последовательностей генома ВИЧ-1 были выделены несколько подтипов вируса — A, B, C, D, E, F, G, H, J и K, и три группы — M (main — главная), которая включает большинство подтипов, O (outlier — обособленная) и N (ни M, ни O). Разные подтипы преобладают в определенных географических районах. Например, подтип B составляет подавляющее большинство штаммов вируса в Северной Америке и преобладает в Европе и Австралии. Подтип A, наиболее гетерогенный, преобладает в Западной Африке, подтип D — в Центральной Африке, подтип С обнаруживается в основном в Южной Африке и полуострове Индостан, подтип E преобладает в Таиланде и соседних с ним странах. Существуют рекомбинантные вирусы, примером которых служит подтип E. Из вирусов, циркулирующих у животных, к ВИЧ-1 ближе всего вирус иммунодефицита обезьян, обнаруженный у шимпанзе (SIVcpz) (Захнер С., 2004).
«Пенящиеся вирусы» (Spumavirinae) — особенностью вирусов этого подсемейства является их способность вызывать своеобразный цитопатический эффект, проявляющийся слиянием клеток. Культура клеток выглядит как бы вспененной, отсюда их название — «пенящиеся». Вирусы распространены повсеместно, экзогенные, найдены у многих млекопитающих. В 1960-1970-х гг. вирусы этого подсемейства выделены от обезьян, человека, кошки, хомяка, быка и др. Есть данные о существовании родственных (но не близких) эндогенных вирусов. Хотя в природных условиях вирус spuma редко вызывает болезнь у своих хозяев, но он способен вызывать нейродегенерацию, будучи экспрессированным как трансген у мышей, и может инфицировать разные виды млекопитающих, в том числе людей. Естественного инфицирования людей не зарегистрировано, отмечались редкие случаи заражения людей от нечеловекообразных обезьян. Замечена их способность контаминировать вакцины, изготовляемые на основе культур клеток почки обезьяны и других видов животных. Отношения спумавирусов к какой-то известной патологии пока не установлено, в тоже время надо понимать и то, что они существуют благодаря ресурсам клетки.
Инфицированность лентивирусами диких животных. В рамках медицинской науки мы воспринимаем пандемию ВИЧ/СПИДа антропоцентрически, вне контекста распространения лентивирусов среди животных, обитающих в естественных условиях. Вроде как это должно интересовать только ветеринарных специалистов и то в аспекте заноса возбудителей лентивирусных инфекций из их резервуаров среди диких животных в популяции домашних. Однако если мы посмотрим на оба процесса с точки зрения времени и места их возникновения, то обнаружим любопытные совпадения, свидетельствующие в пользу существования еще неоткрытых и непростых природных явлений.
Во-первых, азиатские виды диких приматов Старого Света (Colobines и макаки), так же как и отдельные африканские виды (бабуины), не являются носителями специфических SIV. Это позволило Sharp P. M. et al. (2000) утверждать, что появление данного лентивируса среди приматов произошло из источника, не имеющего отношения к приматам и уже после их дивергенции на современные виды. Хотя шимпанзе и была показана как резервуар SIV, нет данных, демонстрирующих то, что SIVcpz коэволюционировал с этим хозяином (Prince A. M. et al., 2002; Santiago M. L. et al., 2002). Шимпанзе инфицированы SIVcpz уже после его дивергенции в самостоятельный вид (Sharp P. M. et al., 2005).
Во-вторых, лентивирусные инфекции среди животных (кошачьи, приматы) в Центральной Африке распространились в те же сроки, что и ВИЧ среди людей. Исследования сывороток сотен африканских зеленых обезьян (african green monkeys, AGMs), выполненные в 1990-х гг. показали, что от 40 до 50 % их популяций, обитающих в различных регионах Центральной Африки, инфицировано SIVagm. Интересно, что сероэпидемические исследования африканских зеленых обезьян, завезенных на Карибские острова в XVII и XVIII столетиях, не выявили ни одного случая их инфицированости SIV, т. е. этот лентивирус не циркулировал среди приматов Центральной Африки, по крайней мере, еще два столетия назад (Woude S. V., Apetrei C., 2006).
В третьих, лентивирусные инфекции могут быть эндемичны для отдельных территорий и проживающих на них видов млекопитающих. Например, львы, обитающие в национальном парке Серенгети (Serengeti, Танзания), почти на 100% FIV-серопозитивны, и среди них уже выявляются особи с иммунодефицитом и энцефалопатиями. Но львы в котловине Этош (Etosha Pan, Намибия) почти все серонегативны (Spencer J. A. et al., 1992; Brown E. W. et al., 1994). Исследование инфицированности SIV антроморфных приматов (anthromorhic primate или great apes) показало носительство SIVcpz только у двух видов шимпанзе (Pan troglodytes troglodytes и P. t. schweinfurthic), обитающих в Восточной Центральной Африке. Не завершились успехом интенсивные поиски серопозитивных особей среди шимпанзе Восточной Африки (P. t. verus или P. t. vellorosus) (Switzer W. M. et al., 2005).
В четвертых, лентивирусная инфекция у живущих в природных условиях приматов и львов потенциально способна перейти в стадию СПИДа, но клинические проявления болезни встречаются редко и только тогда, когда животное инфицировано период времени, превышающий среднюю продолжительность его жизни в естественных условиях. У приматов развитие СПИДа обычно стимулируется возбудителем другой инфекционной болезни, например проказы или Т-клеточного лейкоза (Woude S.V., Apetrei C., 2006).
Таким образом, лентивирусные инфекции являются сравнительно новым явлением не только для человека, но и для приматов и кошачьих. Первоначально они были локализованы в строго определенных географических регионах. И, видимо, существуют какие-то природные факторы, воздействие которых на еще неизвестные первичные природные очаги этих вирусов приводит к их одновременной активизации (см. ниже «Реинтеграция и реинфекция ретровирусов»).
Непатогенная инфекция у темно-коричневых мангобеев. Термин (nonpathogenic infection) предложен V. Muller, R. De Boer (2006) для описания необычного инфекционного процесса, вызываемого SIV у темно-коричневых мангобеев (sooty mangabeys). Развитие SIV-инфекции у этих приматов не приводит к поражению клеток иммунной системы, хотя сопровождается почти такой же вирусной нагрузкой, что и ВИЧ-инфекция у людей. Отсюда можно сделать два важных вывода.
Первый — вирулентность ВИЧ не является результатом его массивной репликации в инфицированном хозяине, а прямые метаболические затраты хозяина на репликацию ВИЧ не достаточны для провоцирования болезни.
Второй — темно-коричневые мангобеи избегают развития болезни не путем контроля над репликацией ретровируса, а отсутствием выраженной реакции на вирус со стороны их иммунной системы (Silvestri G. et al., 2003).
Однако феномен взаимодействия SIV и темно-коричневых мангобеев не является закономерностью в коэволюции ретровирусов и приматов, скорее всего описанное явление — «исключение из правил», за которое было заплачено неизвестным нам количеством вымерших «по правилам» видов приматов. SIV вызывает инфекцию у шимпанзе, очень схожую с ВИЧ-инфекцией у людей, и приводит их к гибели. Поэтому попытки объяснить этот феномен применительно к темно-коричневым мангобеям предпринимались неоднократно.
Несколько лет тому назад S. Norley et al. (1999) предположили, что относительная иммунологическая толерантность к SIV у темно-коричневых мангобеев вызвана экспрессией гена гликопротеина Gag эндогенного ретровирусного элемента.
V. Muller и R. De Boer (2006) не нашли в геноме темно-коричневых мангобеев «следов» лентивирусного происхождения, которые бы ясно свидетельствовали об их происхождении из SIV. Такой результат был ими ожидаем, так как геном этого вида приматов изучен значительно хуже, чем геном человека или шимпанзе. Но ни человек, ни шимпанзе не являются природными хозяевами SIV, поэтому сведения об их нуклеотидных последовательностях мало применимы для интерпретации результатов полученных у темно-коричневых мангобеев.
V. Muller и De Boer (2006) считают, что SIV в виде провируса интегрирует в зародышевую линию темно-коричневых мангобеев, которая способна к экспрессии во время негативной селекции Т-клеток в тимусе и В-клеток в костном мозге. Оба процесса приводят к элиминации клеток, способных узнавать собственные антигены (более подробно о механизмах «созревания» Т- и В-клеток см. в монографии Галактионова В. Г., 2005), в результате иммунная система перестает реагировать на репликацию SIV. В качестве подтверждения своей гипотезы они ссылаются на работу I. Ferrero et al. (1997), показавших развитие Т-толерантности иммунной системы к эндогенному вирусу рака молочных желез мышей (endogenous mouse mammary tumour virus) из-за его экспрессии в тимусе; и работу J. L. Bracy и J. Iacomini (2000), продемонстрировавших возможность индукции В-клеточной толерантности у мышей посредством экспрессии в клетках их костного мозга трансдуцированных ретровирусных генов. Феномена «непатогенной инфекции», подобного наблюдаемому у темно-коричневых мангобеев, у людей пока не установлено.
Реинтеграция и реинфекция ретровирусов. Эти взаимодополняющие друг друга процессы лежат в основе распространения экзогенных и эндогенных ретровирусов по геному любого эукариотического вида. Высокая скорость эволюции экзогенных ретровирусов и относительно медленная скорость эволюции геномной провирусной ДНК (примерно в 104 раз медленнее; Shih A., et al., 1991), должны проявляться серьезными различиями в нуклеотидном составе экзогенных и эндогенных ретровирусов. Однако для некоторых их семейств такие различия показать не удалось, что свидетельствует в пользу двух гипотез:
1) относительно «недавнего» появления инфекционных (экзогенных) ретровирусов из их эндогенных двойников и о существовании определенной цикличности в поддержании отдельных ретровирусных семейств;
2) возможности многократного проникновения экзогенных ретровирусов в популяции приматов (и, разумеется, других позвоночных) из каких-то неизвестных природных резервуаров, способных поддерживать экзогенные ретровирусы миллионы лет.
Первая гипотеза имеет много сторонников, опирающихся на сравнительные данные по возрастным отличиям отдельных белков экзогенных и эндогенных ретровирусов, она приводится ниже. Вторая выдвинута мной из-за того, что не все данные по эволюционной истории ретровирусов можно объяснить в рамках первой гипотезы. Более подробно она приведена в подглаве 2.2 «Ретровирусы».
Существует высокая вероятность того, что ретротранспозоны периодически формируют инфекционные ретровирусы. Для этого у них имеются две возможности:
1) приобретение посредством неправильной рекомбинации (illegitimate recombination) генов, кодирующих вирусную оболочку;
2) рекомбинация с другими эндогенными вирусами. В истории основных линий эндогенных ретровирусов обычно удается проследить внешнюю, «транзиторную фазу» (transitory external phase). Данная гипотеза основана на анализе филогенетических деревьев оболочечных белков различных эндогенных и экзогенных ретровирусов (Doolittle R. F. et al., 1989).
Наличие «внешней фазы» у жизненного цикла эндогенных ретровирусов приматов подтверждено наблюдением над эволюцией многих семейств ERV. Недавно описано семейство ERV-F(c), представляющее собой «расширение» семейства ERV-F/H. Геном человека включает только 6 вставок HERV-Fc, среди которых две имеют полноразмерные гены вирусной оболочки. Дальнейшее сравнение выявленного эндогенного вируса с аналогичными вирусами у других приматов показало, что провирус ERV-F(с) является эндогенным «следом» ретровирусных элементов, активных как экзогенные ретровирусы с низкой способностью к эндогенизации (endogeneization potency). Были получены доказательства его реинтеграции с геномом приматов в два различных периода их эволюции (Benit L. et al., 2003).
Эндогенный ретровирус семейства ERV9 также неоднократно вовлекался в процесс эволюции приматов, затем его транспозиционная активность обрывалась. Первые представители семейства ERV9 (линия А) «проникли» в геном предков нынешних приматов Старого Света уже после разделения континента Гондваны (Gondwanaland), т. е. около 38 млн лет назад. Наиболее активно экспансия ERV9 по геному приматов осуществлялась в период их дивергенции от гиббонов на высшие виды обезьян (16—6 млн лет назад). В период 8—6 млн млн лет назад семейство ERV9 наиболее интенсивно пролиферировало по геному вида, предкового для человека и шимпанзе (см. рис. 4 Б). Затем пролиферация ERV9 остановилась. Как фактор эволюции генома приматов это семейство транспозируемых элементов перестало существовать. В геноме человека сохранились более сотни дефектных ERV9 и, по крайней мере, 4 тыс. одиночных длинных терминальных повтора (solitary LTRs), возникших благодаря гомологичной рекомбинации между 5’- и 3’-LTR полноразмерных ERV9, рассеянных по геному приматов в эволюционном прошлом (Lopez-Sanchez P. et al., 2005).
Как противоположность ретровирусам, имеющим экзогенные и эндогенные аналоги, было описано семейство без гена env — ERV-L (Benit et al., 1999), а следовательно, и без экзогенный фазы в своей эволюционной истории. По примеру других ретроэлементов семейство можно реклассифицировать в группу ретротранспозонов, если бы не следующее обстоятельство. Семейство имеет до 200 копий в геноме человека и мышей. Анализ его филогенетического древа, основанного на гене RT (reverse transcriptase, обратная транскриптаза), показал возможность утраты гена env в прошлом, и реинфекцию и вторичную интеграцию ERV-L в геном млекопитающих в виде полноценного провирусного элемента (Lopez-Sanchez P. et al., 2005).
Эндогенные ретровирусы обнаружены почти у каждого позвоночного вида. Но что касается HERV, то только два их семейства были выявлены в геноме других позвоночных, помимо приматов. Это семейства HERV-L у мышей, кроликов, собак, кошек (общий предок около 100 млн лет); и HERV-I у птиц, рептилий и рыб (общий предок около 400 млн лет) (Martin et al., 1997; Benit et al., 1999). Большинство же из инфицированных HERV зародышевых линий приматов появились в период от 20 до 40 млн лет назад (после разделения приматов Нового и Старого Света). Последующие взрывы реинтеграции/амплификации HERV в эволюции приматов были менее протяженными. Следовательно, участие HERV в эволюции приматов более ограничено по времени, чем его занимали других ретроэлементы, представленные в геноме человека. Например, LINE и SINE обнаружены почти во всех эукариотических линиях и до сих пор показывают признаки активности (см. подглаву 1.2).
Эндогенные ретровирусы имеют не только внешнюю, «транзиторную фазу», но и способны пролиферировать среди клеток зародышевой линии. Скорость такого процесса по восприятию времени человеком настолько мала, что сам факт пролиферирующей активности эндогенных ретровирусов можно установить по соотношению несинонимичных и синонимичных замен нуклеотидов отдельных генов (dN/dS). Дело тут в следующем. Количество копий эндогенных ретровирусов в пределах зародышевой линии может увеличиваться и без их репликации. Для этого существуют два альтернативных механизма: 1) ретротранспозицией в cis — когда вирусы используют собственные гены белков для мобилизации; они копируют сами себя и вставляются в новые участки хромосомы в пределах той же клетки, без обычной для ретровирусов экстрацеллюлярной фазы жизненного цикла (см. «Структура и цикл жизни ретровирусов»); 2) через комплементацию в trans, когда белки, необходимые для пролиферации вирусов, добавляются другими эндогенными и экзогенными вирусами. Ретротранспозиция в cis не требует интактного гена env (он необходим вирусу для перемещения за пределы клетки); комплементация в trans не нуждается в наличии у эндогенного ретровируса функционирующих генов. Достаточно чтобы он имел промотор и другие «мотивы» для экспрессии и упаковки РНК. Пролиферация эндогенных ретровирусов посредством таких механизмов приводит к накоплению в их геноме большого количества мутаций и стоп-кодонов (Belshaw R. et al., 2004).
Эти изменения почти не затронули «вернувшийся» в геном приматов Старого Света 6 млн лет назад эндогенный ретровирус HERV-K(HML-2). Семейство HERV-K(HML-2) впервые интегрировалось с геномом приматов около 30 млн лет назад. Отдельные провирусы, сохранившиеся с первого «пришествия» семейства в геном приматов, у человека сегодня напоминают о себе вирусоподобными частицами, продуцируемыми клетками злокачественной опухоли — тератокарциномы (human teratocarcinoma cells). Семейство вновь инфицировало зародышевую линию человека 100 тыс. лет назад (HERV-K113) уже в качестве экзогенных ретровирусов (Turner et al., 2001). Однако оно еще не «охватило» весь вид Homo sapiens. В геноме многих людей находят пустые сайты интеграции этого ретровируса (Belshaw R. et al., 2005) (см. подглаву 1.2 «Эволюционная роль HERV-K»).
HERV-K(HML-2) содержат неповрежденные открытые рамки считывания почти во всех генах, включая env. У них низкое соотношение несинонимичных и синонимичных замен (dN/dS). Эти находки указывают на постоянную селекцию интактных генов белков HERV-K(HML-2) и на то, что HERV-K(HML-2) увеличивали количество своих копий преимущественно через реинфекцию, а не через ретротранспозицию в cis или комплементацию в trans.
Y. N. Lee et al. (2007) попытались воспроизвести инфекционный провирус HERV-K(HML-2). Для определения способности структурных белков и ферментов, закодированных в геноме HERV-K, «собирать» ретровирусоподобные частицы, ими были сконструированы плазмиды, экспрессирующие Gag, Gag-PR и Gag-PR-Pol. Геном HERV-K имеет необычный нуклеотидный состав, в котором много кодонов, кодирующих аденин (A-rich). Такая особенность генома лентивирусов характерна для ВИЧ-1 и приводит к тому, что не полностью спласингсированные транскрипты мРНК ВИЧ-1 удерживаются в ядре клетке. Их экспорт в цитоплазму достигается благодаря экспрессии гена Rev. HERV-K кодирует функционально ортологичный Rev-протеин, названный Krev (или Rec), медиирующий экспорт РНК HERV-K из ядра в цитоплазму клетки (Magin C. et al., 2000). Поэтому клонирование и экспрессия генов HERV-K в культуре клеток 293Т были осуществлены с помощью ранее разработанного V. Zennou et al. (2004) вектора pCRV1.
Первоначально Y. N. Lee et al. (2007) для получения инфекционного ретровируса был использован HERV-K-К113, имеющий интактные открытые рамки считывания для вирусных белков (за исключением одного гена) и считающийся сегодня самым «молодым» среди эндогенных ретровирусов HML-2 ( см. подглаву 1.2 «Эволюционная роль HERV-K»). Однако плазмиды, сконструированные на основе генов этого провируса, плохо их экспрессировали в культурах клеток и вирусные частицы не образовывались. Тогда исследователи пришли к выводу, что относительная «молодость» эндогенного ретровируса еще не гарантирует экспрессии всех его генов. Они отобрали группу из 10 вирусов, имевших дефекты, по крайней мере, в одном структурном гене, и установили консенсусные последовательности каждого гена. Синтезированный вирус с такой последовательностью нуклеотидов они назвали HERV-KCON. На построенном филогенетическом древе HERV-KCON занимает место, соответствующее предковой последовательности HERV-K, интегрировавшегося с геномом гоминид 6 млн лет назад (рис. 20).
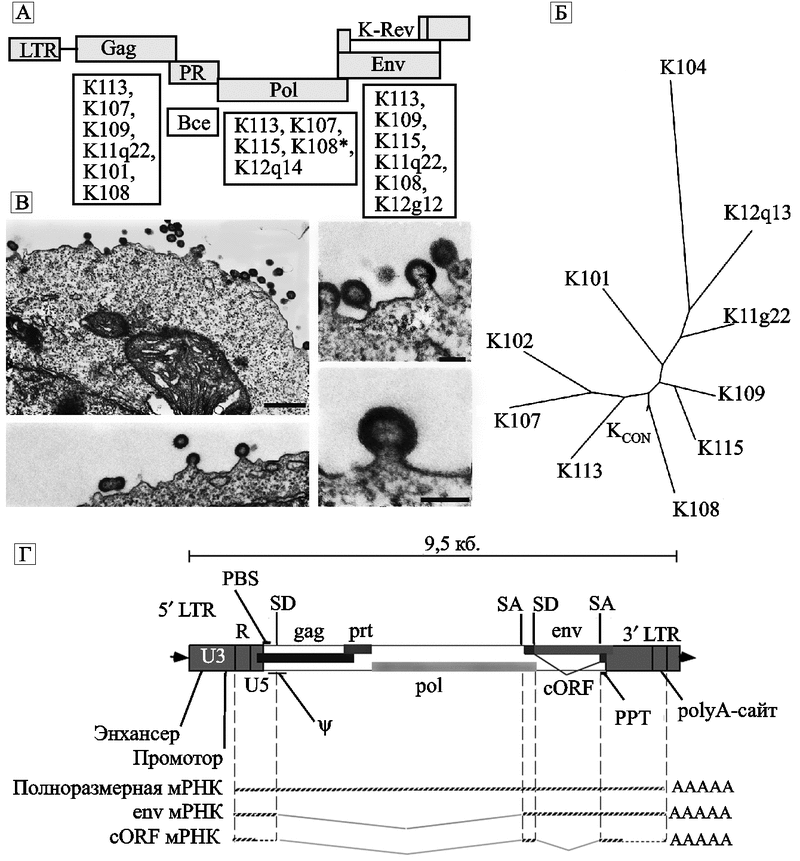
Рис. 20. Синтезированный вирус HERV-KCON
А — схематическое изображение провируса HERV-K. Открытые рамки считывания изображены прямоугольниками. Под ними приведен список ретровирусов, чьи нуклеотидные последовательности были использованы для установления консенсусных последовательностей структурных генов HERV-KCON;
Б — филогенетическое древо этого семейства;
В — электронные микрофотографии ретровирусных частиц HERV-KCON, образовавшихся в культуре клеток 293Т. Сборка вирусных частиц происходит на плазматической мембране клетки (Lee Y. N. et al., 2007);
Г — более детальное схематическое изображение структуры генома интегрировавшегося с ДНК хромосомы человека эндогенного ретровируса K108, принадлежащего к семейству HERV-K(HML-2). LTR включает три домена: U3, R и U5. Провирус содержит 5 генов: классический gag (кодирующий протеина кора вируса), prt (кодирует протеазу), pol (кодирует обратную транскриптазу, RNAseH, интеграза), env (кодирует белок оболочки вируса) и вспомогательный ген cORF/Rec, функционально эквивалентный адаптерным белкам ядерного экспорта — Rev у ВИЧ и Rex у вируса Т-клеточной лейкемии, но отличающийся от них сайтом связывания. Гены env и cORF белков транслируются со сплайсированных транскриптов, которые соответствуют участку: сайт донора сплайсинга (splice donor, SD) — сайт акцептора сплайсинга (splice acceptor, SA); PBS (primer binding site) — праймерсвязывающий сайт; ? — пакующий сигнал; PPT (polypurine tract) — полипуриновый тракт РНК (используется обратной транскриптазой для инициации плюс-цепи ДНК). По N. de Parseval и T. Heidmann (2005).
Попарное сравнение нуклеотидных последовательностей десяти провирусов позволило установить основные различия по нуклеотидам между каждым из провирусов и HERV-KCON. Они заключались либо в замене G-на-A, либо C-на-T, или vice versa. Эта находка указывает на возможную роль цитидиндеаминазы (cytidine deaminases) в эволюции HERV-K у людей и на ее возможное участие в инактивации провирусов. Эксперименты Y. N. Lee et al. (2007) показали, что геном HERV-KCON содержит все функциональные компоненты, необходимые для осуществления им полного цикла ретровирусной репликации.
В дальнейших экспериментах ими установлено, что HERV-KCON оказался способен образовать псевдотипные частицы с ВИЧ-1 и вызывать их проникновение в линии клеток человека. На основе анализа генома эндогенных ретровирусов HERV-K (HML-2) и собственных экспериментальных данных, Y. N. Lee et al. (2007) сделали вывод о существовании пока неизвестных механизмов активации эндогенных ретровирусов, позволяющих им реинфицировать людей и сегодня. Они предположили возможность существования штаммов HERV-K в еще не идентифицированных репликационно-активных формах у отдельных людей и/или в их изолированных популяциях.
Независимо от Y. N. Lee et al. (2007), Contreras-Galindo R. et al. (2006) обнаружили, что dN/dS гена белка env HERV-K(HML-2) меньше единицы, что предполагает распространение этого эндогенного ретровируса через реинфицирование и способность этого семейства кодировать инфекционные вирусные частицы. Они также пришли к выводу о том, что РНК-рекомбинация эффективно удаляет мутировавшие аллели HERV-K через рекомбинацию с интактными участками различных геномов.
Коинфекция. Экзогенные и эндогенные ретровирусы взаимодействуют между собой в инфицированных клетках, но этот процесс еще плохо изучен. Например, по данным Contreras-Galindo R. et al. (2007), у ВИЧ-инфицированных больных раком появляются антитела к антигенам HERV-K, а экспрессия белков HERV-K приводит к цитотоксическим ответам Т-клеток. Эти же авторы в экспериментах в условиях in vitro показали, что ВИЧ-1 увеличивает экспрессию РНК HERV-K дозозависимым образом, и что экспрессия HERV-K в CD4(+) в Т-клетках ВИЧ-инфицированных пациентов выше, чем в контроле (см. также подглаву 3.3).
***
Эукариотические виды существуют, эволюционируют и исчезают в тесном ретровирусном «объятии». Для Природы является нормой постоянная или периодически возникающая инфицированность какой-то части любого многоклеточного вида репликационно-активными ретровирусами. Границы между эндогенными и экзогенными ретровирусами (например, HERV-K-К113 и ВИЧ) можно провести только на момент времени, воспринимаемый человеком. По мере масштабирования времени в пределы, вмещающие геологические эпохи, границы между эдогенными и экзогенными ретровирусами становятся менее ясными. Пандемии ретровирусных инфекций представляют собой «слоеный пирог». Его самый «верхний слой» составляют ретровирусы, активно размножающиеся в цитоплазме клеток хозяина (например, ВИЧ). Самый «нижний» представлен репликационно-активными формами эндогенных ретровирусов (семейство HERV-K-К113). «Слои» «переложены» экзонами и интронами генов, ретротранспозируемыми и регуляторными элементами, псевдогенами и другими последовательностями генома хозяина. Раскрытие взаимоотношений между ними составит основное содержание генетики на ближайшие десятилетия. Наше собственное место в Природе, особенно в сравнении с тем, которое занимают там ретровирусы, невелико. Пока мы не знаем с какой частотой происходила эндогенизация ретровирусов HERV-K (HML-2) в геноме древних гоминоидов и человека, и не можем предполагать такую возможность для ВИЧ. Но уже очевидно то, что ВИЧ/СПИД-пандемия не является обычной пандемией, вызванной проникновением в человеческие популяции нового вируса. Она «верхушка» более сложного природного явления — эволюционного процесса, который из-за нашего ощущения времени представляется нам в маске инфекционного. В эволюции гоминоидов неспособные к эндогенизаци экзогенные ретровирусы играют роль фактора терминации исходных и промежуточных видов. Тем самым они снижают заполнение экологических ниш для новых доминирующих видов, появившихся в результате активности HERV-K (HML-2) и других транспозируемых элементов генома (см. подглаву 1.2), например, по механизму симпатрического видообразования.
Метки: чума