Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. 2.1. Первичный резервуар патогенных для человека микроорганизмов
2. Внутриклеточные паразиты и симбионты многоклеточных организмов
Недооценка эпидемиологами сложности мира микроорганизмов распространяется ими и на мир одноклеточных животных (Protozoa). Естественный отбор действует на основе «принципа экономии генов». Поэтому «пропущенные» и «оптимизированные» им «простые структуры» входят в состав «более сложных» на последующих этапах эволюции. Они как кирпичи, сооружения из которых можно разбирать и строить уже по другому замыслу. Для нас, как биологического вида, пытающегося приспособить окружающую среду «под себя», должно быть весьма интересным то обстоятельство, что появившиеся 500-600 млн лет назад многоклеточные формы жизни имели за собой не менее 3,9 млрд лет эволюции одноклеточных организмов и уже сложившиеся взаимоотношения между существовавшими в этом мире хозяевами и паразитами.
2.1. Первичный резервуар патогенных для человека микроорганизмов
Для прорывов в науке важно уметь выявлять артефакты, т. е. отдельные природные явления, не укладывающиеся в общепринятые научные представления. Собственно задачей ученого и является выявление таких артефактов и затем их объяснение. Но по сложившейся в науке практике в этом случае он рискует нажить себе много неприятностей, и, прежде всего, обвинений в «ненаучности». Чем банальней «научность», тем меньше, к сожалению, она вызывает к себе критическое отношение ученых. Однако если артефакт существует в объективной реальности, он неизбежно обвалит господствующую концепцию при дальнейшем совершенствовании методологии исследований. Ниже мы очень кратко рассмотрим ряд таких артефактов, меняющих наши представления о первичных резервуарах возбудителей опасных болезней человека, важных уже с точки зрения планирования противоэпидемических мероприятий, но одновременно необходимых и для понимания роли иммунной системы позвоночных в распространении ретровирусов.
Предыстория проблемы. Выдающийся немецкий гигиенист Макс Петтенкофер (Pettenkofer Max, 1818—1901) известен еще и тем, что решительно возражал против ведущей роли «заноса» микробного фактора в этиологии холеры как пандемической болезни. По Петтенкоферу, если холерный зародыш обозначить буквой X, а благоприятную для его развития почву буквой Y, а происходящий от их взаимодействия яд буквой Z, то ни X, ни Y не могут сами по себе вызывать холеру, а только один Z, т. е. яд. При этом специфическая природа яда определяется специфическим зародышем, а количество яда свойствами почвы. Благоприятной для развития яда, по мнению Петтенкофера, была почва, в верхних своих слоях пористая и проницаемая для воздуха и воды, и загрязненная в то же время отбросами органических веществ. Если холерный зародыш заносится в такую местность, где почва обладает данными свойствами, то он начинает созревать, обусловливая эпидемическое развитие болезни. Напротив, в тех местностях, где почва не обладает упомянутыми свойствами, занесение холерного зародыша не ведет к дальнейшему распространению болезни (Петтенкофер М., 1885).
Направление в эпидемиологии, связывающее развитие эпидемических болезней со свойствами почвы, называлось тогда локализмом. Петтенкофер не был ни голословен, ни одинок в своих взглядах.
Один из последователей Петтенкофера в России, профессор Казанского университета Н. К. Щепотьев (1884), исследуя географию появления вспышек чумы в Астраханской области, пришел к выводу, что для объяснения эпидемического распространения чумы «еще недостаточно одной переносчивости ее». По его наблюдениям, существуют местности, в которые чума не заносится никогда и ни при каких обстоятельствах. Для развития же эпидемии необходимо временное и местное появление еще особого фактора, независимого от чумного агента. Только с появлением этого фактора открывается возможность чумному агенту фиксироваться, развиваться и существовать в данной местности. С исчезновением этого фактора исчезает и чума; а чумный агент, выделенный больными организмами, быстро разрушается. Фактор должен иметь в различное время различную степень интенсивности и экстенсивности. Разность поражения чумой одной и той же местности в различные годы и в различные месяцы одного и того же года обусловливается именно различной степенью напряженности действия этого неизвестного фактора. Его природа определяется «совокупностью наблюдения над движением и развитием эпидемий». Щепотьев считал, что развитие чумного агента зависит от теплоты и влажности почвы. Какой-то еще не распознанный продукт разложения органических веществ почвы, образовавшийся под влиянием определенных физико-химических процессов, и составляет фактор X, столь необходимый для эпидемического развития чумы (Супотницкий М. В., Супотницкая Н. С., 2006).
К числу сторонников Петтенкофера относился знаменитый патолог того времени Р. Вирхов (Virchow; 1821—1902). Но в конечном итоге его взгляды на доминирующую роль неизвестных науке факторов почвы (Y) в развитии эпидемий большая часть ученых проигнорировала. После открытия микроорганизмов — возбудителей инфекционных болезней — «вес» набирало другое направление, контагионистическое (Р. Кох, Г. Гафки и др.), видевшее только в контактной передаче микроорганизмов причину возникновения инфекционных болезней у людей. Бактерии прекрасно «состыковывались» со средневековым учением о контагии. Но теперь стало ясно, что это живой организм (contagium vivum), а не «яд», и что его можно получать в большом количестве и изучать в лабораторных условиях. У ученых появилась новая положительная мотивация — возможность разрабатывать вакцины, сыворотки, диагностические препараты и пр., и никто не обязан был верить теоретическим выкладкам ученого — реликта добактериологической эпохи. Сам Петтенкофер окончил жизнь самоубийством, а его фамилия в бактериологии стала нарицательной и упоминалась в ХХ столетии лишь в связи со случаем, когда он, чтобы доказать непричастность холерных вибрионов к холерным эпидемиям, выпил холерную культуру. В общем, был такой ретроград — Макс Петтенкофер, не верил в очевидное, в то, что холерные пандемии вызываются холерным вибрионом, тем и запомнился.
Причина научного поражения Петтенкофера и других локалистов заключалась не в отсутствии у них аргументов своей правоты, с этим все обстояло скорее наоборот (см. «Исторические свидетельства»). Как правило, локалисты представляли своим оппонентам обширные и убедительные описания эпидемических процессов и примеры медицинской статистики. Читатель может найти некоторые из них в книге Ф. Ф. Эрисмана (1893) и убедиться в том, что сегодня на таком уровне эпидемиологический анализ уже не проводят. Дело тут было в используемой локалистами методологии — они не могли инструментально продемонстрировать факторы Х, Y и Z. Их взгляды на эпидемический процесс на фоне достижений бурно развивающейся тогда медицинской бактериологии стали выглядеть умозрительными, а обнаруженные особенности таких процессов, необъяснимые как передача «контагия», считаться артефактами. И вообще в эпидемиологии с открытием микроорганизмов — возбудителей инфекционных болезней — все стало как бы понятно и ясно. Поэтому локалистические представления подверглись не опровержению, а забвению, как уже ненужные. А микроорганизмы, возбудители инфекционных болезней людей и животных, отдельные авторы до конца 1930-х гг. продолжали называть контагиями.
Для контагионистов различия в условиях существования микроорганизмов в естественных условиях и в питательном бульоне в лаборатории, носили лишь количественный характер (концентрация и соотношение питательных веществ, температура среды, содержание кислорода и т. п.). В рамках этого подхода для них не существовало методических ограничений еще почти 100 лет. Методический уровень бактериологии, необходимый для экспериментального обоснования экологических позиций локалистов и позволяющий изучать патогенные для людей микроорганизмы в водных и почвенных экосистемах, не был достигнут не только в конце ХIХ столетия, но и почти на всем протяжении двадцатого.
Оставшись без оппонентов, ученые-контагионисты уже не стремились искать иные причины появления эпидемий и пандемий инфекционных болезней вне общих рассуждений о возможности «заноса» их возбудителей-контагиев. Эпидемиологи, сами того не подозревая, вернулись к взглядам средневековых врачей где-то времен после «черной смерти» (1346—1351). С конца XIX столетия в эпидемиологии и микробиологии господствуют антропоцентристские представления о причинах существования в природе патогенных микроорганизмов. Они очень просты и хорошо запоминаются студентами — все патогенные микроорганизмы поддерживаются в природе дикими животными и от них передаются людям, а затем распространяются между людьми. Когда реальная эпидемиология инфекционной болезни не вписывалась в эту схему, ее просто придумывали.
«Выдающимися» примерами такого подхода стали объяснения холерных пандемий заносом больными холерного вибриона из холерных местностей и возрождение раннесредневековых взглядов на эпидемиологию чумы, как на болезнь, распространяемую кораблями. Правда, теперь роль переносчика «чумного контагия» играли не вещи больных чумой, а инфицированные крысы.
Нельзя утверждать, что противоречий и «пробелов» в этих представлениях никто не замечал. Артефакты накапливались и требовали объяснения. Еще в 1956 г. W. Drozanski описал облигатные внутриклеточные паразиты свободно живущих амеб. Тогда эти микроорганизмы назвали Sarcobium lyticum, но в последствии было установлено, что они относятся к опасному для людей семейству бактерий Legionella и их реклассифицитовали. Сегодня они известны как Legionella lytica. В 1958 г. В. И. Терских на основе своих наблюдений заново обосновал положение о том, что внешняя среда может служить средой обитания патогенных микроорганизмов.
Под давлением эпидемиологических наблюдений Mollaret H. (1963), первым среди чумологов, был вынужден вернуться к забытому в начале XX столетия учению Макса Петтенкофера (правда, не упоминая его имени), предполагающему участие почвы в поддержании в природе возбудителей опасных инфекционных болезней. Смысл его гипотезы сводится к тому, что чумной микроб при наличии соответствующих условий может длительно персистировать в почве нор грызунов (теллурическая чума). Развивая гипотезу Mollaret, М. Балтазар (1964) пришел к заключению, что цикл чумы в природных очагах состоит из двух фаз: паразитической (на грызунах и их блохах — кратковременной и неустойчивой); и непаразитической (существование в почве нор — устойчивой). Однако где находится первичный резервуар возбудителя, эти исследования не прояснили. Чумологи по-прежнему рассуждали о заносе чумы кораблями и о тому подобных «научно обоснованных» фактах.
Прошла незамеченной работа С. В Никульшина с соавт. (1993), показавших способность ряда амеб фагоцитировать Y.pestis и сохранять ее в предцистах. Механизм и эпидемическая значимость этого явления оставались непонятным до открытия явления «некультивируемости бактерий» и разработки методов молекулярной диагностики.
Суть феномена «некультивируемости» заключается в следующем. Исследователи обнаруживают микроорганизмы в одноклеточных животных (простейших) методами молекулярной диагностики, но не могут подтвердить их наличие культивированием на искусственной питательной среде. С антропоцентристской точки зрения феномен объяснялся просто — случайностью; микроорганизм случайно попал в неблагоприятную для него среду (благоприятная среда, разумеется, питательный бульон, приготовленный в лаборатории этих исследователей) и находится в состоянии стресса. Однако границы феномена оказались значительно более широкими, чем это можно ожидать от «случайности».
Простейшие и их паразиты. Свободноживущие амебы имеют, по крайней мере, две стадии развития: трофозоиты (trophozoite) — вегетативные метаболически активные формы; и цисты (cyst) — «спящие формы», позволяющие им выжить в неблагоприятных условиях среды. Отдельные амебы, такие как Naegleria spp., имеют дополнительную стадию флагеллят (flagellate stage), другие, такие как Mayorella и Amoeba, включают виды, не формирующие цисты (рис. 21).
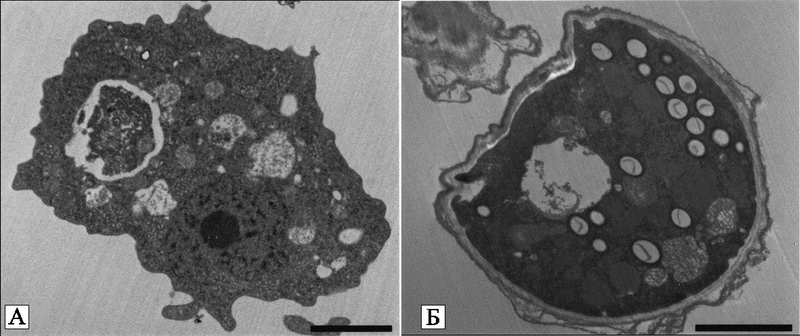
Рис. 21. Стадии развития Hartmanella vermiformis
(A) вегетативная форма;
(B) циста.
Черная полоса внизу фотографии соответствует 2 микронам (Greub G., Didier R., 2004).
Свободноживущие амебы представлены повсеместно и могут быть изолированы из воздуха, почвы, воды, назального секрета позвоночных. В почве они наиболее распространены в тех ее участках, которые покрыты растениями. На растениях обильно паразитируют грибы и бактерии, являющиеся пищей для свободноживущих амеб (Rodriguez-Zaragoza S., 1994). Более подробно о таксономии, анатомии и экологии простейших можно прочитать в работах Г. Н. Калкинса (1912), Л. Н. Серавина (1984), К. Хаусмана (1988) и А. П. Пехова (1994). Нас же простейшие интересуют как эволюционные предки макрофагов и как первичный резервуар возбудителей опасных инфекций для человека.
Амебы живут в широком интервале условий окружающей среды. Адаптация бактерий к протозойным хищникам происходит уже миллиарды лет, и в настоящее время ученые насчитывают не менее четырех форм их взаимодействия, хотя, естественно, эти знания являются только предварительными.
Во-первых, отдельные бактерии могут использовать их для увеличения своей численности в окружающей среде, как это показано для Klebsiella aerogenes, размножающихся «за счет» Acanthamoeba castellanii.
Во-вторых, некоторые бактерии продуцируют литические компоненты, разрушающие простейших, и тем самым предотвращающие фагоцитоз, например Bacillus liqueniformis синтезирует литический компонент, направленный против Nagleria fowleri.
В-третьих, между бактериями и простейшими могут устанавливаться эндосимбиотические отношения. Известно, что бактерии могут оставаться в простейших длительное время в некультивируемом состоянии. Было установлено экспериментально, что паразитические бактерии могут существовать в простейших в таком состоянии не менее шести лет.
В-четвертых, в процессе эволюции и коэволюции бактерии могут совершенствовать механизм внутриклеточного существования в амебах и затем, после проникновения в организм позвоночных, пользоваться этим механизмом для выживания в макрофагах (например, Legionella pneumophila; см. ниже) (Harb O. et al., 2000).
В основе взаимодействия простейших с микроорганизмами (бактерии, дрожжи, вирусы и др.) лежит способность группы их поверхностных рецепторов взаимодействовать со структурами, богатыми углеводом маннозой. Они получили общее название — маннозные рецепторы. Их присутствие на поверхности амебы необходимо для связывания микроорганизмов, инициирования их поглощения клеткой и доставки в лизосомы для переваривания (Allen P. G., Dawidowicz E. A., 1990). Позже было показано, что и сами одноклеточные паразиты проникают в эпителиальные клетки высших животных посредством взаимодействия с маннозными рецепторами этих клеток. Например, посредством такого механизма Acanthamoeba проникает в роговицу глаза человека и вызывает кератит (Zhantao Yang et al., 1997).
Механизмы проникновения свободноживущих почвенных амеб в организм позвоночных также сложно опосредованы с рецепторными структурами внеклеточного матрикса. Например, почвенная амеба Balamuthia mandrillaris, возбудитель смертельного для человека гранулематозного амебного энцефалита (granulomatous amoebic еncephalitis), использует для проникновения в мозг три типа компонентов внеклеточного матрикса: коллаген I, главный компонент соединительной ткани; молекулы фибронектина, имеющие критическое значение для адгезионных процессов; и ламинин-1 (laminin-1), ключевая молекула для формирования базального слоя. Распознание ламинина зависит от галактозо-связывающего белка (Rocha-Azevedo B. et al., 2007). Типичные молекулы данного типа в эукариотических клетках — галектины (galectins) относятся к семейству галактозных лектинов и широко распространены среди различных клеток животных (более подробно о галектинах см. в работе Leffler H. et al., 2004).
Весьма любопытно в аспекте понимания эволюции иммунной системы то обстоятельство, что амебы в условиях in vitro реагируют на фактор некроза опухолей (TNF), интерлейкин-1бета (IL-1бета), интерлейкин-8 (IL-8) и циклооксигеназу-2 точно также, как нейтрофилы и макрофаги — т. е. как на хемоаттрактанты (Blazquez S. et al., 2006). С филогенетической точки зрения, направленное движение клеток в ответ на внешние раздражители, является давно известной биологической реакцией (New D. C., Wong J. T., 1999). Следовательно, сигнальные молекулы, которые мы сегодня, путаясь в определениях, называем хемокинами и цитокинами, а также их рецепторы стали «средством общения» между простейшими задолго до появления нейтрофилов и макрофагов как клеток иммунной системы позвоночных организмов.
Уже в этом десятилетии обнаружены микроорганизмы — внутриклеточные паразиты простейших, не растущие на искусственных питательных средах, но являющиеся патогенными для человека. Например, T. J. Marrie et al. (2001) установили, что такие микроорганизмы, как LLAPs (Legionella-like amoebal pathogens — возбудители пневмоний), Parachlamydia acanthamoeba BN9 (болезнь Кавасаки) и Afipia felis (болезнь кошачьей царапины), паразитирующие в свободноживущих почвенных амебах, очень хорошо размножаются в человеческих моноцитах, но не растут на искусственных питательных средах.
Если "пойти в обратную сторону", т. е. проверить способность уже охарактеризованных на искусственных питательных средах патогенных для человека микроорганизмов паразитировать внутри макрофагов, непрофессиональных фагоцитов и даже в нефагоцитирующих клетках (фибробластах, эпителиоцитах), то можно обнаружить, что все они способны к такому паразитизму. Подготовленный О. В. Бухариным (1999) ретроспективный обзор таких экспериментов включает не менее 20 патогенных для человека видов бактерий. Более поздний обзор G. Greub, D. Raoult (2004) включает уже около 50 видов бактерий и отдельные виды риккетсий и вирусов.
Экспериментальные данные также свидетельствуют о другом феномене паразитизма патогенных для человека микроорганизмов у простейших — упрощении генома паразита при специализации его к своему одноклеточному хозяину. Например, сравнение геномов Yersinia pseudotuberculosis и Y. pestis для ученого, привыкшего считать, что патогенность микроорганизмов обусловлена приобретением генов факторов патогенности (т. е. усложнением генома), требует преодоления некоторого психологического барьера. Возбудитель чумы, более патогенный для человека и большинства модельных животных, чем возбудитель псевдотуберкулеза, утрачивает значительную часть генов, которые традиционно относят к генам вирулентности и патогенности. По данным, обобщенным А. П. Анисимовым (2002), по сравнению с псевдотуберкулезным микробом, Y. pestis утрачивает гены адгезинов, уреазы (сдвиг рамки считывания), инвазинов Inv и Ail (вставка IS-элементов), подвижности, способности к синтезу О-боковых цепей ЛПС (не установленные механизмы образования мутаций) и ряд других. Из 17 «биосинтетических» генов, выявленных у псевдотуберкулезного микроба, 5 в геноме Y. pestis инактивированы за счет вставок и делеций. Компьютерный анализ полного генома чумного микроба (штамм CO92, биовар Orientalis; выделен от человека, погибшего от легочной чумы) показал наличие 149 псевдогенов.
Объяснение этому феномену я вижу в сравнении экологии обоих микробов. У псевдотуберкулезного микроба очень широкий круг хозяев, в основном среди гидробионтов. Он является комменсалом для зоопланктона (дафнии, циклопы), бентосных животных (кольчатые черви, моллюски, личинки насекомых и др.) и высших растений. Возбудитель же чумы специализирован на узком круге почвенных простейших. Следовательно, упрощение его генома является следствием дегенеративной эволюции, характерной для видовой специализации любого паразита. Но специализации не к отдельным видам позвоночных животных (включая человека), а к простейшим.
Границы феномена сапронозного существования патогенных для людей микроорганизмов. О том, что границы этого феномена очень широки, свидетельствует много косвенных факторов. Например, все так называемые возбудители опасных и особоопасных инфекционных болезней (чумы, мелиоидоза, сапа, туляремии, сибирской язвы, бруцеллеза, лихорадки Ку и др.), одновременно являющиеся и потенциальными агентами биологического оружия, имеют много сходства в эпидемиологии, биологических свойствах и в клинике вызываемых ими поражений людей, объяснить которое возможно только в том случае, если предположить, что они являются истинными паразитами (или эндосимбионтами) почвенных простейших. В пользу такого предположения говорит «привязанность» вызываемых ими вспышек болезней к конкретным местностям; отсутствие у них резистентности детоксикационного типа к антибиотикам (ненужной для внутриклеточного паразитизма); вовлечение в инфекционный процесс лимфатических узлов и фагоцитирующих клеток крови; а также «запутанность» вопроса о факторах их патогенности и токсинах. Ни один из обнаруженных у них таких «факторов» не может однозначно в эксперименте прояснить клинику вызываемой микроорганизмом у людей болезни, больше похожую на реакцию организма на суперантигенный раздражитель. Не обладают они и контагиозностью, т. е. способностью передаваться от одного теплокровного организма к другому при контакте, что обычно предполагает воздушно-капельный механизм передачи возбудителя болезни непосредственно от одного заболевшего к другому. Редкие случаи «перехода» неконтагиозной бубонной чумы в контагиозную вторично-легочную лишь исключения, подтверждающие вышеприведенные наблюдения. Ни больные с такой формой чумы, ни появившиеся через инфицирование от них больные с первично-легочной чумой, не способны поддерживать возбудитель чумы в природе, так как в 100 % известных случаев (без лечения антибиотиками) они погибают. И если этим возбудителям инфекционных болезней не придумывать эпидемиологию (см. «Исторические свидетельства»), то понять, как они существуют в природе без резервуара среди простейших, практически невозможно.
Vibrio cholerae. Возбудитель холеры является членом семейства Vibrionaceae, о котором известно, что оно прекрасно размножается в простейших A. polyphaga и N. gruberi. Их выживание в пределах цист N. gruberi предполагает то, что свободноживущие амебы могут длительно сохранять холерный вибрион при неблагоприятных условиях среды (Thom S. et al.,1992). Достоверно установлены биоценотические связи холерного вибриона, обитающего в воде, с водными организмами, в том числе и с растениями. Например, была показана способность ряски, зоопланктона (Islam M. et al., 1990) и низших ракообразных (Голубев Б. П.,1993) поддерживать высокую концентрацию холерного вибриона. Islam et al. (1990) также выявили активное размножение и длительную (до 15 месяцев!) персистенцию некультивируемых вибрионов Эль Тор в культуре сине-зеленых водорослей, которые признаются ими возможным резервуаром холеры в межэпидемические периоды. Марамович А. С. и Наркевич М. И. (1993) пришли к выводу о том, что водный гиацинт является природным резервуаром холеры Эль Тор. Он обеспечивает существование вибрионов в межэпидемические периоды и способствует реализации водного пути передачи возбудителя. Бухарин О. В., Литвин В. Ю. (1997) экспериментально показали, что водный гиацинт способствует размножению холерных вибрионов. Их концентрация в его стеблях и листьях была в 300 раз выше, чем в воде.
Эти и другие данные позволили Пушкаревой В. И. и Литвину В. Ю. (Пушкарева В. И., Литвин В. Ю.,1994; Пушкарева В. И.,1994), выдвинуть гипотезу о клонально-селекционном механизме изменения бактерий в почвенных и водных сообществах, способном обеспечивать формирование эпидемически значимых вариантов возбудителей сапронозов в их природных резервуарах. Гипотеза весьма интересная, поэтому ее стоит привести подробно.
В процессе естественной циркуляции холерных вибрионов среди гидробионтов — хозяев возбудителя в водоемах, имеет место селекция токсигенных клонов и их накопление в бактериальной популяции при благоприятных условиях (активном пассировании через хозяев). Всего же у холерных вибрионов в водной экосистеме формируется, как минимум, две экологические ниши. Одна из них (непосредственно водная среда) наиболее характерна для авирулентных штаммов. Вторую нишу (сообщество водных организмов) населяет преимущественно вирулентная часть микробной популяции, устойчивая к перевариванию в организме гидробионтов — первичная функция токсигенности холерных вибрионов, возможно, как раз и состоит в защите бактериальной популяции, обитающей в водоемах, от хищничества простейших и других гидробионтов. Их объем относительно друг друга меняется. Например, при изменении численности хозяев или сдвигах в структуре водного сообщества. В разных условиях и в разные сезоны в водной популяции вибрионов могут доминировать то токсигенные, то атоксигенные клоны холерных вибрионов. Изменение уровня токсигенности всей популяции вибрионов во времени происходит за счет выхода в водную среду нарастающего числа токсигенных вибрионов из организма погибших инфузорий, где они накапливаются благодаря селективному преимуществу перед атоксигенными и слаботоксигенными вибрионами. Прогревание воды до температуры 20 0С и резкое увеличение трофности водоемов в июле—августе определяют пик численности холерных вибрионов, тесно сцепленный с пиком численности планктона. Интенсивно пассируясь среди гидробионтов, вибрионы окончательно выходят из покоящегося состояния (число бактериологически высеваемых культур максимально); численность и вирулентность водной популяции вибрионов резко возрастает, достигая эпидемически значимых показателей. Именно к этому периоду неизменно приурочен пик заболеваемости людей в очагах умеренных широт. Первичные и независимые случаи инфицирования холерой людей, связаны с водоемами, после чего распространение холеры может принять и вторичный (эстафетный) характер, в виде классической вспышки (по работе Бухарина О. В. и Литвина В. Ю., 1997).
Приведенная выше клонально-селекционная теория состыковывается с гениальными прозрениями Макса Петтенкофера (1885) следующим образом. Если принять нетоксигенные клоны холеного вибриона за фактор Х, то гидробионты, через которые пассируются токсигенные клоны возбудителя холеры, можно считать тем фактором Y, существование которого Петтенкофер так настойчиво отстаивал, а сами токсигенные клоны представляют собой фактор Z. Однако только ли для холерного вибриона верна эта теория?
Легионеллы. Для легионелл возможность сапронозного существования установлена бактериологическими методами еще в 1950-х гг. Вспышки легионеллезов обычно сопровождаются высокой смертностью среди заболевших людей. Поэтому экология легионелл и механизмы их проникновения в человеческие популяции находятся в поле зрения ученых уже не менее 30 лет, с момента печально известной вспышки болезни в Филадельфии в 1976 г. В данной работе легионеллы рассматриваются как «опережающий объект» в исследованиях сапронозов, что предполагает перенесение выявленных при их изучении закономерностей на менее исследованные микроорганизмы, обитающие в почвенных и водных экосистемах.
В пределах водных сообществ легионеллы существуют в ассоциации с планктоном или как составная часть биопленок (Rogers J. et al., 1994). Разные легионеллы инфицируют своих протозойных хозяев по разным механизмам, что говорит за многообразие экологических отношений в мире микроорганизмов и простейших. Амебы имеют критическое значение для существования легионелл в окружающей среде и для их способности вызывать инфекционную болезнь у людей (Harb O. et al., 2000). Схематическое изображение взаимодействия L. pneumophila и одноклеточных животных в окружающей среде и механизма ее трансмиссии к человеку приведено на рис. 22.
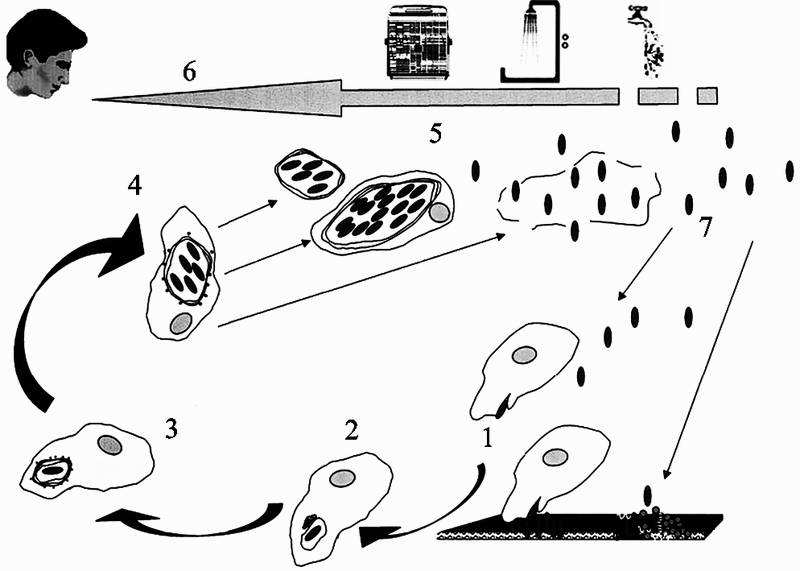
Рис. 22. Механизм взаимодействия L. pneumophila и одноклеточных животных в окружающей среде и их трансмиссии к человеку
1. L. pneumophila из биопленок, формируемых совместно с другими бактериями или из их суспензий, инфицирует Рrotozoa. Проникновение в простейшие осуществляется по механизму фагоцитоза.
2. После проникновения в амебу L. pneumophila остается в мембранно-связанной вакуоле, которая рекрутируется органеллами, такими как митохондрии, и не сливается с лизосомами.
3. В пределах 4 ч после проникновения, вакуоль с L. pneumophila окружается эндоплазматическим ретикулумом.
4. L. pneumophila реплицируется в пределах специализированной вакуоли.
5. Точный механизм «выхода» бактерий из простейших неизвестен, но считается, что возможна их экскреция в составе везикул. Могут лизироваться и сами амебы.
6. Передача L. рneumophila к людям осуществляется механически, через воздух, выбрасываемый кондиционерами, с каплями воды в душевых и т. п. способами.
7. Legionellae могут длительное время выживать в окружающей среде. Они повторно инфицируют Protozoa или реколонизируют биопленки (Harb O. et al., 2000).
Взаимоотношения легионелл и Protozoa, нашедшие свое отражение в патогенности этих бактерий для людей, могут быть следующими. Амебы после превращения в цисты, создают бактериям надежное убежище от враждебных условий внешней среды (температура, влажность, дезинфектанты и т. п.). Этим можно объяснить способность легионелл распространяться и населять инженерные системы зданий, прошедшие специальную обработку. К тому же, реплицирующаяся в амебах L. рneumophila становится почти в 1000 раз более резистентной к антимикробным соединениям, чем при культивировании на искусственных питательных средах (Barker J., Brown M. R., 1995). Жизненный цикл L. pneumophila в амебах сходен с таковым в макрофагах (см. «Предадаптация к макрофагам») (рис. 23).
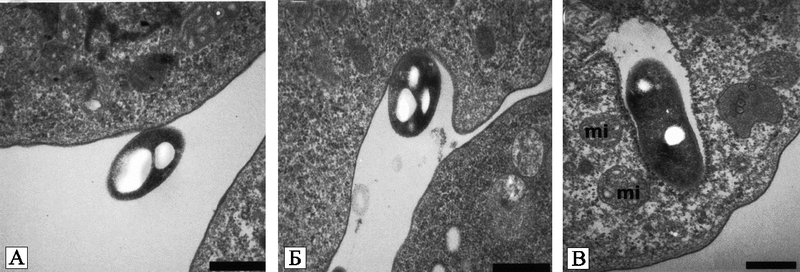
Рис. 23. Фагоцитоз L. pneumophila амебой H. vermiformis в условиях in vitro
(A) адгезия;
(B) поглощение;
(C) интернализированные бактерии.
mi — митохондрия. Черная маркерная полоса соответствует 0,5 мк (Greub G., Didier R., 2004).
Пассирование легионелл в амебах повышает их инвазивность и вирулентность для человека. В пользу последнего предположения говорят экспериментальные данные, показавшие многократно возросшую способность L. рneumophila, выращенных в простейших, внедряться в макрофаги мышей и реплицироваться в легких по сравнению с теми же легионеллами, выращенными на искусственной питательной среде (Cirillo J. D. et al., 1994). Отдельные гены, необходимые для выживания L. рneumophila в макрофагах, такие как dot/icm, pmi и mip, также нужны им для выживания в амебах (табл. 7).
Таблица 7
Гены L. pneumophila, необходимые для инфицирования и внутриклеточного существования в Protozoa и макрофагах
|
Гены |
Функция |
Роль в инфекции |
Примечания |
|
dot/icm (defect in organelle trafficking и intracellular
multiplication ) |
Аппарат секреции IV типа
Конъюгационный перенос ДНК |
Правильное созревание фагосомы.
Репликация в Protozoa.
Цитотоксичность, вызванная формированием пор |
Agrobacterium tumefaciens и Bordetella pertussis, используют подобную систему секреции для переноса ДНК (virB) и секреции коклюшного токсина (ptl), соответственно
|
|
pmi (protozoan and
macrophage infectivity) |
Неизвестная функция |
Внутриклеточное выживание.
Правильное созревание фагосомы.
Присоединение к клетке-хозяину |
Вместе с dot/icm обеспечивают L. рneumophila возможность выживать и реплицироваться в эволюционно значительно отстоящих клетках |
|
pilBCD (encodes a prepillin peptidase)
|
Биогенез пилей IV типа
Секреция II типа |
Секреция бактериальных белков, необходимых для внутриклеточного выживания |
Аппарат секреции II типа позволяет L. рneumophila выживать в Protozoa и в клетках млекопитающих |
|
rpos |
Стационарная фаза ответа на стресс |
Регуляция генов, необходимых для внутриклеточного выживания |
- |
|
prp |
Гомологичен prpD-гену S. typhimurium |
Внутриклеточное выживание |
- |
|
mip (macrophage infectivity potentiator)
|
Относится к семейству белков пептидил-пролил изомераз (peptidyl-prolyl cis/trans isomerases, - PPIase) |
Внутриклеточное выживание в течение ранних стадий инфекции |
Необходим для инфицирования макрофагов, эпителиальных клеток и простейших |
|
emi (early macrophage-induced locus)
|
Неизвестная функция |
То же |
- |
|
asd (aspartate-b-semialdehyde dehydrogenase)
|
Биосинтез диаминопимелата |
Внутриклеточная репликация |
- |
|
Гены усвоения железа |
Захват и ассимиляция внутриклеточного железа |
То же |
- |
* по Harb O. et al., 2000.
Способность легионелл реплицироваться в амебах показывает то, что амебы являются для этих бактерий самой адекватной питательной средой.
Chlamydophila pneumoniae. Бактерия хорошо известна как причина различных респираторных болезней и атеросклероза. Сероэпидемиологические исследования обнаружили ассоциацию антител к С. pneumoniae с атеросклерозом коронарных, сонных и церебральных артерий, а также инфарктом миокарда (Lee Ann Campbell et al., 1998). В природе бактерия поддерживается в Acanthamoeba castelanii, но не в Parachlamydiaceae или Simkaniaceae (Essig A. et al., 1997).
Микобактерии. Для Mycobacterium leprae — микобактерии, вызывающей болезнь, уже тысячи лет известную под названием проказа, было показано, что она может поддерживаться в свободноживущих почвенных амебах. Однако бактериальной репликации или микробного лизиса амеб, вызванного этими микобактериями, описано не было, что свидетельствует в пользу их симбиотических отношений и частично объясняет клинику болезни. Развитие проказы у людей происходит в течение десятков лет, при этом инкубационный период болезни может длиться до пяти лет.
У микобактерий, вызывающих туберкулез, отношения с простейшими могут складываться как по типу эндосимбиоза, так и как паразитические. В экспериментах, выполненных в условиях in vitro, установлена способность M. avium, M. marinum, M. ulcerans, M. simiae и M. habane проникать в свободно живущие почвенные простейшие. M. smegmatis, M. fortuitum и M. рhlei размножаются в самых различных амебах и вызывают их лизис.
Хорошо изучены взаимодействия между M. avium и Acanthamoeba. Было установлено, что M. аvium, выращенная в амебах, более вирулентна чем такая же микобактерия, выращенная на искусственной питательной среде. Причины этого явления следующие. Во-первых, M. аvium, выращенная в амебах, более активно инфицирует как сами амебы, так и клеточные линии интерстинального эпителия (HT-29) и макрофаги. Во-вторых, такие M. аvium обладают расширенными возможностями по колонизации кишечника мышей, в минимальных дозах вызывают у них микобактериальную инфекцию, и быстро проникают в печень и селезенку. M. avium при неблагоприятных условиях среды хорошо выживает в цистах Acanthamoeba. В то же время M. avium, живущая в амебах, более резистентна, чем M. avium, находящаяся в макрофагах, к антимикробным препаратам, используемым для профилактики микобактериоза у больных СПИДом (рифабутин, кларитромицин и азитромицин) (Greub G., Didier R., 2004).
Микобактерии, вызывающие у людей туберкулез, могут существовать длительное время как эндосимбионты простейших. Например, Zhatao Yang et al. (2007) обнаружили в контактных линзах амебы вида Acanthamoeba lugdunensis. Ими было установлено, что эти амебы уже не менее 6 лет поддерживают существование микобактерий (предположительно, M. avium или M. Intracellulare). Причем сами микобактерии не оказывали на Acanthamoeba никакого цитопатического эффекта (рис. 24).
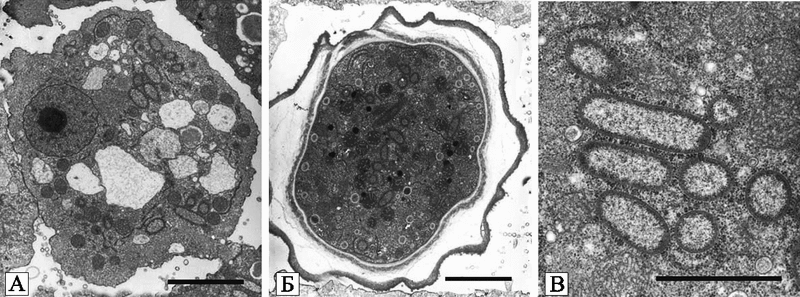
Рис. 24. Электронная микрофотография Acanthamoeba KA/LC6 с бактериями-эндосимбионтами
A. Бактерии-эндосимбионты палочкообразной формы, случайным образом распределенные в цитоплазме трофозоита;
B. Цисты с эндосимбионтами.
C. Увеличенные бактерии-эндосимбионты в цитоплазме трофозоитов.
По поверхности бактерий-эндосимбионтов «рассыпаны» рибосомы. Черная маркерная полоса соответствует 2 мк.
По Zhatao Yang et al. (2007).
Механизм проникновения патогенных микобактерий в популяции людей значительно более сложен, чем у легионелл. В цепочке передачи возбудителя болезни появляется новый промежуточный хозяин — личинки кровососущих комаров. Инфицированные личинки через воду попадают в организм животных и птиц, а от них к человеку. Полученные данные согласуются с сообщениями о выделении патогенных и атипичных микобактерий из проб воды, взятых из прудов, канав и луж, и используемой для поения крупно рогатого скота, а также из опилок, соломы и сена (Ермакова М. с соавт.,1995).
Burkholderiaceae. Бактерия B. cepacia ассоциирована у людей с несколькими легочными инфекциями, особенно с цистическим фиброзом. Роль свободноживущих почвенных амеб как резервуара B. сepacia пока не доказана, однако их участие в трансмисси возбудителя возможно, так как они способны выбрасывать в окружающую среду везикулы, заполненные B. cepacia (Marolda C. L. et al., 1999).
B. pseudomallei — возбудитель опасной болезни, мелиоидоза, и потенциальный агент биологического оружия. Показано, что этот микроорганизм в условиях in vitro в амебах резистентен к антибактериальным препаратам Он также способен выживать в макрофагах после длительного лечения человека антибактериальными препаратами, вызывая у него хроническую инфекцию (Jones A. L. et al., 1999).
Francisella tularensis. Вызывает у животных и человека опасную болезнь — туляремию. Выделяют три подвида этого микроорганизма, различающихся по географическому распространению и вирулентности для людей — tularensis (наиболее вирулентен для людей), holarctica и mediasiatica. F. tularensis tularensis считается своего рода рекордсменом по пороговой инфекционной дозе, способной вызывать болезнь у человека. Обычно она колеблется в пределах 10-100 клеток, поэтому его относят к потенциальным агентам биологического оружия. В естественных условиях болезнь обнаруживается в основном среди грызунов. Микроб хорошо сохраняется в почве, зерне, фураже, но малоустойчив к высушиванию, ультрафиолету, дезинфицирующим средствам. Известные природные очаги болезни характеризуются исключительной стойкостью. Человеку F. tularensis передается трансмиссивным, контактным, оральным и аспирационным путями. Трансмиссивный механизм передачи осуществляется через клещей, преимущественно иксодовых; и летающих кровососущих двукрылых, в частности комаров и слепней (Шувалова Е. П. с соавт., 2001). Тот факт, что свободноживущие амебы могут быть буквально заполненны F. tularensis, причем в неблагоприятных условиях среды возбудитель туляремии может сохраняться в цистах A. castellanii (Abd H. et al., 2003), свидетельствует в пользу того, что простейшие являются первичным природным резервуаром этого микроорганизма (рис. 25).

Рис. 25. Результаты электронно-микроскопического анализа A. castellanii, инфицированных F. tularensis
(A) Трофозоит A. castellanii без внутриклеточных включений F. tularensis (день 0).
(B) Трофозоит A. castellanii с вакуолями, заполненными F. tularensis (день 9).
(C и D) Рекрутирование митохондрий (короткие стрелки) и грубого эндоплазматического ретикулума (длинные стрелки) к вакуолям (см. также рис. 24), содержащим бактерии.
(E) Трофозоит A. castellanii, подвергнутый энцистации (encystations) с клетками F. tularensis, включенными между двумя слоями образовавшейся двойной стенки (день 16).
(F) Циста A. castellanii, содержащая F. tularensis на внутренней стороне двойной стенки (день 16) (Abd H. et al., 2003).
Helicobacter pylori. Вызывает развитие у людей язвы желудка и язвенной В-клеточной лимфомы, ассоциированной с лимфоидной тканью слизистой желудка. То, что H. pylori может распространяться через воду, предполагает определенную роль амеб в поддержании его существования в природе. Эта гипотеза подтверждается демонстрацией способности H. pylori к размножению в A. castellanii (Winiecka-Krusnell J. et al., 2002).
Cryptococcus neoformans. Относится к грибам, обитающим в почве. Возбудитель СПИД-индикаторной инфекции, криптококкоза. Один из лучших примеров адаптации сразу к обоим хозяевам — почвенным амебам и макрофагам людей (Greub G., Didier R., 2004).
Coxiella burnetii. Риккетсия, возбудитель лихорадки Q, потенциальный агент биологического оружия. Филогенетически родственна легионеллам (Weisburg, W. G. et al., 1985). При поглощении почвенными амебами легко в них выживает и размножается. Инфицирование людей обычно происходит посредством вдыхания аэрозоля в зонах интенсивного разведения животных (La Scola B., Raoult D., 2001). Описаны также риккетсиоподбные организмы, являющиеся эндосимбионтами Acanthamoeba spp. (Greub G., Didier R., 2004).
Мимивирусы. В амебах Acanthamoeba polyphaga обнаружен крупный ДНК-вирус (диаметр зрелых частиц достигает 400 нм), названный мимивирусом, т. е. «имитирующий бактерию» ( mimivirus — «microbe - mimicking virus » ), так как его сначала приняли за бактерию ( La Scola B. et al., 2003 ). Его другое название — мимивирус Acanthamoeba polyphaga ( Acanthamoeba polyphaga mimivirus; APMV). Размер вириона мимивируса сравним с размером микобактерии. Геном APMV вмещает 1,2 млн нуклеотидов и кодирует не менее 911 предсказанных белков ( Benarroch D . et al ., 2006 ). Фагоциты мышей «встречают» APMV как «старого знакомого». E. Ghigo et al. (2008) впервые продемонстрировали, что мимивирус в условиях in vitro инфицирует макрофаги мышей путем классического фагоцитоза, выживает в них и успешно размножается (рис. 26).
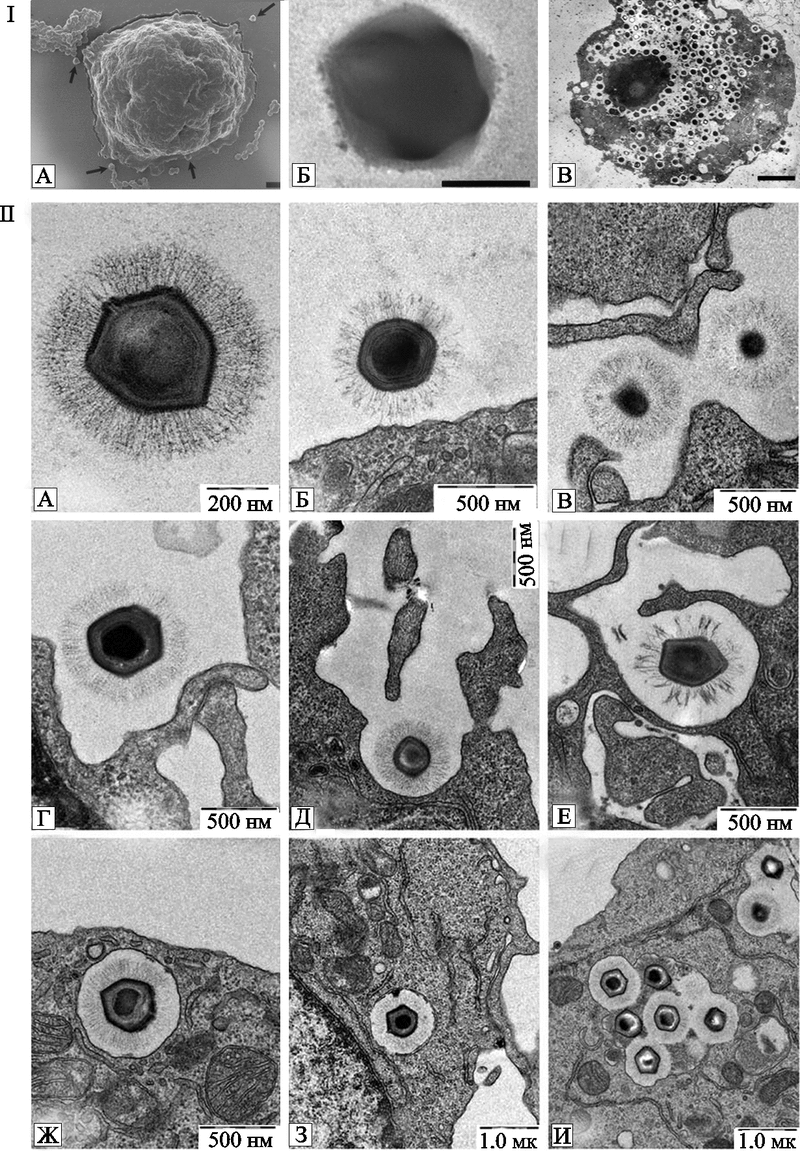
Рис. 26. Мимивирус в амебах и фагоцитах.
I. Мимивирус в клетках свободно живущих амеб. ( A ) Мимивирус и A . polyphaga , снятые с помощью сканирующего микроскопа. Черная маркерная полоса соответствует 1 мк.
( B ) Мимивирус. Негативное окрашивание. Снято с помощью трансмиссионного электронного микроскопа. Черная маркерная полоса соответствует 200 нм.
( C ) Мимивирус в пределах A . polyphaga при лабораторном инфицировании. Снято с помощью трансмиссионного электронного микроскопа. Черная маркерная полоса соответствует 2 мк ( Greub G., Didier R ., 2004) .
II . Мимивирус проникает в макрофаги мышей (электронномикроскопический анализ).
( A ) изолированный мимивирус.
( B ) мимивирус связывается с поверхностью макрофага.
( C ) мимивирус проникает в клеточное выпячивание.
( D и E ) на клеточной поверхности макрофага формируется чашеподобное образование, захватывающее мимивирус, начинается его проникновение в клетку.
( F ) поглощение макрофагом мимивируса.
( G ) большая гладкая поверхность эндоцитической визикулы макрофага, содержащей мимивирус.
( H ) везикула, содержащая мимивирус, глубоко уходит в цитоплазму.
( I ) везикулы, содержащие мимивирусы, случайно сливаются друг с другом.
Черные маркерные полосы соответствуют указанным размерам (Ghigo E . et al ., 2008 ).
Таксономически мимивирус занимает положение между Poxviridae (к этому таксону относится возбудитель натуральной оспы), Iridoviridae (к ним относятся вирус африканской лихорадки свиней — African swine fever; и многие вирусы земноводных, рыб и насекомых) и Phycodnaviridae. Участие мимивируса в патологии человека пока не установлено (La Scola B . et al ., 2003 ). E. Ghigo et al. (2008) выдвинули гипотезу, что APMV способен реплицироваться в альвеолярных макрофагах млекопитающих и вызывать у них пневмонии. Судя по обстоятельности их работы, они скоро ее проверят.
Энтеровирусы. Обычно это возбудители кишечных инфекций у детей, но у некоторых людей они могут вызывать менингоэнцефалиты и асептические менингиты. Передаются между людьми фекально-оральным путем. Широко распространены в морской воде и часто контаминируют моллюсков. Их появление в воде носит спорадический характер, но иногда они месяцами могут заражать морскую воду и воду в дельтах рек (Lo S. et al., 1976). Поэтому была высказана гипотеза, что их природным резервуаром являются простейшие, живущие в морской воде. Однако такая роль простейших в поддержании энтеровирусов не была доказана в эксперименте. Вирусы сорбировались на поверхности амебы и не проникали внутрь клетки и не размножались в ней. Исследования продолжаются и окончательных выводов пока не сделано (Greub G., Didier R., 2004).
Грипп. В истории и эпидемиологии гриппа многое говорит за его сапронозное происхождение. Поиск среди простейших животных вирусов гриппа не проводился из-за отсутствия такой постановки задачи (выгоднее бесконечно создавать «вакцину от птичьего гриппа»). Однако если предположить наличие у этих вирусов природного резервуара среди простейших почвы и гидробионтов, то проще объяснить следующие особенности гриппозных эпидемий и пандемий:
ограниченное число подтипов вирусов гриппа А, В и С человека, вызывающих гриппозные эпидемии и пандемии; и как следствие этого феномена — «возвращение» в человеческие популяции практически одних и тех же вирусов [например, вирус, циркулировавший в 1890—1900 гг., соответствует эталонному штамму А/Сингапур/1/57/ (H2N2); а вирус, циркулировавший в период с 1900 г. по 1917 г. сходен с вирусом А/Гонконг/1/57/ (H3N2); есть и другие весьма показательные примеры такого сходства];
отсутствие среди реассортантов вирусов гриппа, циркулировавших среди людей в разных регионах мира, эпидемически значимых вариантов, или вариантов, имеющих селективные преимущества перед вируcами нерекомбинантной природы;
доминирование водного механизма передачи возбудителя инфекции в природе, проявляющегося одновременными вспышками гриппозной инфекции у разных таксонов животных, вызванных одним штаммом вируса;
появление локальных вспышек гриппозной инфекции у млекопитающих и птиц при отсутствии очевидной связи с «заносом» из других регионов;
возможность развития тяжелых форм гриппа при отсутствии пандемии и выделение вирусов гриппа у заболевших людей, не соответствующих по антигенной структуре подтипу вируса, доминирующему в данный период (так называемые «асинхронизмы»);
отсутствие надежных вирусологических доказательств «положения о непрерывности эпидемического процесса при гриппе» (обычно их подменяют результатами серологических обследований, либо ссылками на «невозможность выделения вируса в межэпидемический период», «снижением вирулентности вируса», наличием «каких-то дефектов вируса, не позволяющих их выделение в обычных лабораторных моделях» и т. п.);
консервативность вируса гриппа, выделяемого от дикой водоплавающей птицы;
то обстоятельство, что все известные подтипы вируса гриппа А выделены от птиц, причем от одной особи может выделяться несколько серовариантов одновременно;
способность вируса размножаться во всех тканях, где есть эпителиальная ткань и в фагоцитирующих клетках макроорганизма;
«поразительная скорость распространения эпидемий гриппа» — если допустить то, что инфицирование водных источников вирусом гриппа происходит одновременно на обширных территориях, например, в результате изменения экологического равновесия гидробионтов;
появление новых серотипов вируса у млекопитающих и домашних птиц как результат «отрыва» вируса от своего природного резервуара и, соответственно, снятия с него селективного давления, существовавшего в природном резервуаре (подробнее см. Супотницкий М. В., 2006).
Э. И. Коренберг (2006) в пользу своей гипотезы сапронозного существования в природе вируса гриппа приводит следующие факты:
вирусы гриппа А способны длительно сохраняться во внешней среде (в воде месяц при температуре 22°С и до 6-8 месяцев при температуре 4°С);
все известные подтипы вируса гриппа А обнаружены у диких птиц (в основном у водоплавающих и околоводных);
у водоплавающих птиц грипп протекает бессимптомно и как кишечная инфекция, следовательно, у них нет непосредственной передачи вируса от особи к особи, что могло бы обеспечить его поддержание в природе;
пандемии гриппа обычно начинаются в теплых регионах Юго-Восточной Азии.
ВИЧ. Попытки установить роль Protozoa (Entamoeba histolytica и Giardia lamblia), патогенных обитателей кишечника человека, в распространении ВИЧ, предпринимались еще в начале 1990-х гг., правда, на низком методическом уровне. Иммунологическими методами установлено присутствие ВИЧ в E. histolytica в течение 48 ч после экспозиции к инфицированным ВИЧ культурам клеток людей (G. lamblia не взаимодействовали с ВИЧ). Но вирус не передавался посредством амеб в неинфицированные клетки. От двух ВИЧ-инфицированных пациентов были выделены ВИЧ-положительные амебы. Их лизировали и полученный лизат добавляли к неинфицированным мононуклеарным клеткам крови человека, однако клеток, инфицированных ВИЧ, обнаружено не было (Brown M. et al., 1991). Эти эксперименты свидетельствуют о том, что ВИЧ способен инфицировать, по крайней мере, отдельные виды простейших. Целесообразно поиски инфицированных ВИЧ простейших продолжить с помощью методов молекулярной диагностики в районах Африки, где население наиболее инфицировано этим вирусом.
Теперь мы можем очертить границы феномена микроорганизмов, способных к сапронозному существованию в природе и одновременно являющихся патогенными для людей. К таким микроорганизмам относятся те из них, которые начинают свое размножение в организме позвоночных в фагоцитирующих клетках. То, что феномен сапронозного существования установлен лишь для отдельных микроорганизмов, опасных для человека и позвоночных животных, во многом связано с тем, что перед учеными такая задача не ставилась.
Признание сапронозного характера существования в природе возбудителей опасных для человека инфекций требует от ученых, с одной стороны, осознания того, что существуют природные очаги инфекционных болезней иные, чем изучаемые сегодня в рамках представлений о природно-очаговых болезнях, когда первичный резервуар возбудителя инфекционной болезни ищут среди позвоночных животных; с другой - необходимость применения новых определений для описания таких очагов и эпидемиологии поддерживающихся в них патогенных микроорганизмов. Подробное обоснование того, что такое «природный резервуар», «природный очаг», «реликтовый очаг», «усилители природного резервуара» возбудителя инфекционной болезни и других определений, выходящих за рамки учения о природной очаговости инфекционных болезней человека Д.К. Заболотного, Е.Н. Павловского и др., мы сделали ранее на примере возбудителя чумы (Супотницкий М.В., 2003; Супотницкий М.В., Супотницкая Н.С., 2006). Их определения включены в словарь терминов, приложенный к этой книге.
Предадаптация к макрофагам. По мнению J. Barker и M. R. W. Brown (1994), свободноживущие амебы в эпидемических процессах среди людей играют роль «Троянского коня», позволяющего микроорганизмам преодолеть «первую линию обороны нового хозяина». Они доставляют их в пределы «Трои», т.е. к слизистым оболочкам человека и в органы дыхания, и обеспечивают микроорганизмам надежную защиту от местных факторов иммунной системы. J. D. Cirillo et al. (1997) нашли подтверждение этой гипотезе. Они продемонстрировали увеличение способности к колонизации кишечника мышей у M. avium, когда эта бактерия была инокулирована в кишечник в составе жизнеспособной амебы. Роль свободноживущих амеб в эпидемических процессах показана на рис. 27.
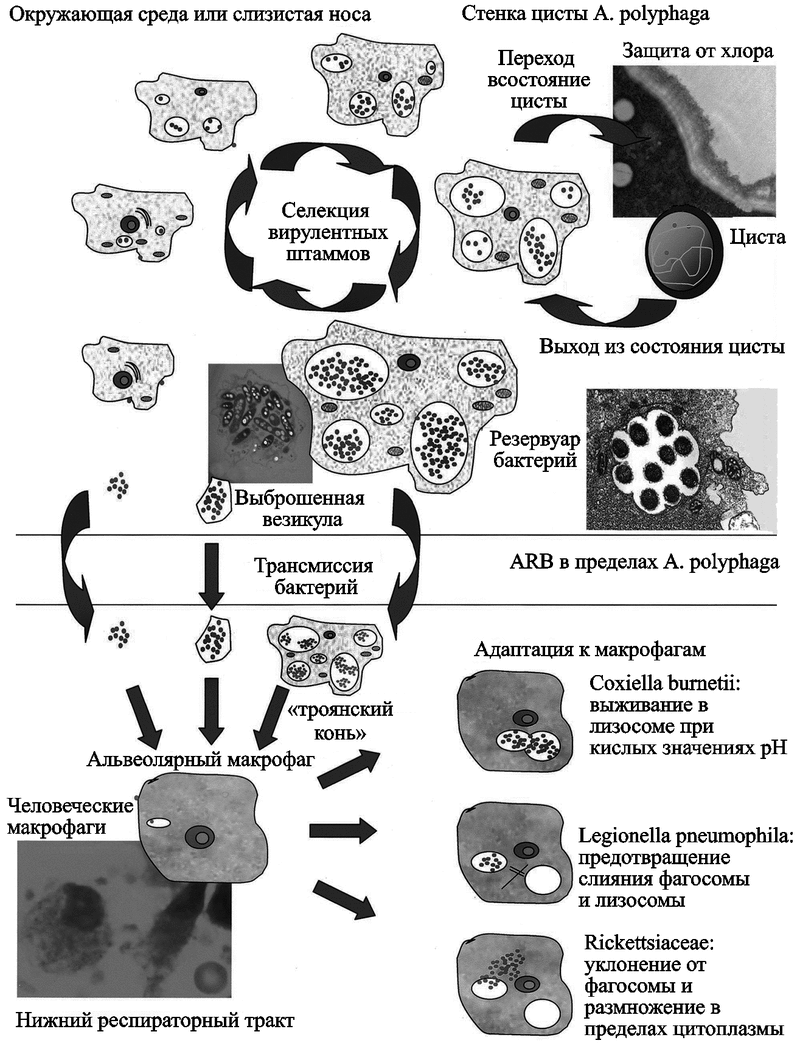
Рис. 27. Роль свободно живущих амеб в эпидемических процессах
Верхняя схема показывает роль свободноживущих амеб как резервуара внутриклеточных бактерий и как "троянского коня" в передаче бактерий позвоночным.
Нижняя — их судьбу в респираторном тракте.
В цитоплазме амебы размножаются более вирулентные бактерии. Вакуоли амеб являются их «убежищем». В составе амеб бактерии достигают нижних дыхательных путей, высвобождаются и поглощаются альвеолярными макрофагами, где цикл их размножения повторяется. Овалами в цитоплазме амеб и фагоцитов показаны митохондрии.
По G. Greub и R. Didier (2004).
Наиболее изучена адаптация к одноклеточным организмам легионелл. На клеточном уровне обнаружено удивительное сходство между путями, по которым Legionella spp. адаптируются к макрофагам и амебам. Совпадает даже тип фагоцитоза, посредством которого легионелла проникает в макрофаг и амебу. Подобное сходство наблюдается на всех последующих этапах жизненного цикла легионелл в фагоцитирующих клетках (табл. 8).
Таблица 8
Сходство механизмов, задействованных для проникновения L. pneumophila в простейшие и макрофаги, их продвижения, репликации и дальнейшего существования*
|
Стадия жизненного цикла |
Свободноживущие амебы |
Макрофаги |
|
Проникновение |
Обвивающий(сoiling)-фагоцитоз |
Обвивающий(сoiling)-фагоцитоз |
|
Продвижение внути клетки
|
Отсутствие фагосомно-лизосомного слияния |
Отсутствие фагосомно-лизосомного слияния |
|
Фагосома
|
Ассоциация с грубым эндоплазматическим ретикулумом |
Ассоциация с грубым эндоплазматическим ретикулумом |
|
Репликация |
Интрафагосомальная |
Интрафагосомальная |
|
Выход |
Лизис клетки-хозяина |
Лизис клетки-хозяина |
* По G. Greub и R. Didier (2004).
В макрофагах и амебах не происходит фагосомно-лизосомного слияния, что позволяет Legionella выживать в этих клетках. Как в тех, так и в других клетках фагосомы окружаются грубым эндоплазматическим ретикулумом, и находящиеся в них бактерии размножаются. Затем Legionella индуцирует лизис макрофага (амебы) и выходит во внешнюю среду, где захватывается другими макрофагами (амебами). На молекулярном уровне основным доказательством сходства процессов фагоцитоза стало сходство генов, необходимых для осуществления фагоцитоза у простейших и макрофагов (см. работу Greub G. и Didier R., 2004; и подглаву 2.2 «Простейшие — симбионты многоклеточных»).
Основываясь на филогенетическом анализе ADP/ATP-транслоказа-кодирующего гена хламидий, G Greub и D. Raoult (2003) показали, что процессы взаимной адаптации амеб, фагоцитирующих клеток многоклеточных организмов и микроорганизмов, начались более миллиарда лет назад, т. е. до появления многоклеточных форм жизни (см. подглаву 2.3). Естественный отбор «подгонял» их друг к другу, отбирал разные формы взаимоприспособления и отбраковывал не приспособившиеся к такому сосуществованию виды.
Исторические свидетельства. Признав за простейшими роль первичного резервуара микроорганизмов, патогенных для человека и животных, нам необходимо признать и то, что должны быть местности, где таких простейших много, и что существуют условия, при которых равновесие между простейшими и их паразитами или эндосимбионтами из числа микроорганизмов, нарушаются. Этот феномен сегодня мы фиксируем по микробиологически подтвержденным эпизоотиям среди животных, по обнаружению инфицированных эктопаразитов и вспышкам инфекционных болезней среди людей. Но если такие очаги существуют постоянно, то сведения об их активизации, т. е. об эпидемических катастрофах, должны периодически фиксироваться в исторических источниках. Ниже, применительно к контексту данной книги, мы приведем только отдельные из них.
Начнем с масштабных эпидемических катастроф. Удивительным образом совпадают местности, охваченные чумой в период ее первой пандемии (VI столетие, «чума Юстиниана») и второй (1346-1351 гг., «черная смерть»). Совпадают даже сроки распространения пандемий — каждая приблизительно «укладывается» в 5 лет. Обе пандемии развились как бубонные (во время второй пандемии у многих больных бубонной чумой развивалась вторично-легочная чума; этот феномен более подробно изложен в нашей книге; Супотницкий М. В., Супотницкая Н. С., 2006). Но известно, что, во-первых, бубоная чума не выходит из своих природных очагов и не заносится ни больными людьми, ни больными грызунами, ни их эктопаразитами; во-вторых, классических очагов чумы, например, в понимании Д. К. Заболотного (1926) или таких, которые описаны в современном учебнике Е. П. Шуваловой (2001), в Европе сегодня нет. Тем не менее существуют исторические свидетельства о чудовищных вспышках чумы в Европе, когда людям казалось, что «наступил конец света».
Сузим горизонт нашего видения до эпидемий чумы средины XVII столетия. Со времен «черной смерти» прошло три столетия. Неконтагиозная болезнь, бубонная чума, вновь «расползается» по Европе в направлении с юга и востока на запад и север и поражает те же города, что и во времена «черной смерти» (Генуя, 1647; Барселона, 1653; Копенгаген и Москва, 1654; Неаполь и Силезия, 1656; Амстердам, 1658; Лондон, 1665). В этих эпидемиях гибнет не менее миллиона человек, но ни в одном из перечисленных городов сегодня нет даже «следов» природных очагов чумы в понимании авторов двух вышеприведенных источников.
Теперь посмотрим на «частный случай» — на отдельные обстоятельства бубонной чумы, вспыхнувшей в Одессе 1812 г. В исторических источниках она проходит как «портовая», т. е. занесенная кораблями. Но материалы комиссии статского советники Н. Трегубова, расследовавшей причины чумы в городе, свидетельствуют об отсутствии заболеваний чумой в Одесском портовом карантине, хотя через него «прошло» за весь 1812 г. 8,5 тыс. человек. Чума началась не в порту, а среди актеров одесского театра (Белиловский В. А. с соавт., 1904). В нашей книге приведена карта того времени, показывающая распространение чумы по Малороссии в 1812 г. Ее зафиксировали среди людей в десятках населенных пунктах, разбросанных по всему краю, не имеющему сегодня природных очагов чумы в традиционном, бактериологическом их подтверждении (Супотницкий М. В., Супотницкая Н. С., 2006). Мы еще многого не знаем о природной очаговости чумы!
Любопытны наблюдения холеры, сделанные локалистами того времени. Исследуя динамику появления холерных вспышек в населенных пунктах Казанской губернии, Н. К. Щепотьев (1890) заметил, что холера распространялась «против течения рек», поэтому он считал, что «извержения холерных больных» не могли служить источником заражения населенных пунктов ниже по течению рек. Он также заметил, что в 1853 г. эпидемии в Демьянском, Ядринском и Чебоксарском уездах начались и прекратились одновременно. Анализ территориального распределения холерных случаев за 30 лет позволил ему установить, что в течение четырех крупных холерных эпидемий (1847, 1848, 1853 и 1871 гг.), как правило, болезнь поражала людей в одних и тех же местностях Казанской губернии. Это означает, что холерный вибрион не завозился и не заносился, а существовал в этих местностях, как и полагал Щепотьев, аутохонно.
Теперь обратимся к знаменитому спору Макса Петтенкофера с Робертом Кохом о роли воды в распространении холеры. Не будем сразу считать Петтенкофера ретроградом, а вникнем в его аргументацию. Контагионисты во главе с Кохом и Гафки (1887), в подтверждение роли воды в переносе возбудителя холеры, утверждали, что строительство водопровода в Калькутте в 1867 г. привело к резкому снижению заболеваемости населения города холерой. Петтенкофер (локалисты), проанализировав статистические данные по заболеваемости холерой в Калькутте, пришел к выводу, что она имеет пульсирующий характер. Поэтому в течение последних 25 лет холера в Калькутте была значительно слабее, чем в предшествовавшее 25-летие. И как раз слабое проявление болезни совпадает с введением в эксплуатацию водопровода. Поэтому Петтенкофер согласился с тем, что Кох, на первый взгляд, имел некоторое основание приписать именно водопроводу преобладающее значение в ослаблении холеры. Но не более того. Оказалось, что эти скачки холерной смертности — то вверх, то вниз — встречаются как в период времени до 1869 г., так и после него.
Петтенкофер указал на продолжительное снижение заболеваемости холерой в Калькутте в 1847—1850 гг. Холера «держалась» на сравнительно низких цифрах в 1854, 1855 и 1857 гг. Но самое заметное падение холерной кривой начинается с 1864 г., т.е. за 3 года до открытия нового водопровода. В этот год без всякого водопровода холерная смертность была в три раза меньшей, чем в предшествовавшем 1866 г. Минимум холерной смертности в течение этой волны падает на 1871 г., когда водопроводом было снабжено еще сравнительно небольшое количество домов. Затем, с 1872 г., когда число домов, присоединяющихся к водопроводу, быстро увеличивается, холера снова усиливается и достигает своего максимума в 1876 г., правда, значительно уступающего максимумам прежних периодов. После этого — новое понижение холерной смертности, с минимумом в 1880 г., за которым опять следует подъем кривой, максимум которой падает на 1884 г. Холерная волна, начавшаяся с 1880 г., оказалась выше ее предшественницы, занявшей десятилетие с 1871 по 1881 г. Петтенкофер указал на следующее обстоятельство: «В Калькутте Коху рассказали не всю правду. Верно то, что городской водопровод, разносящий хорошо фильтруемую воду из Ганга, впервые стал снабжать форт Вильяма 25 марта 1873 г.; но заметное ослабление холеры в крепости началось уже с 1863 г., когда водоснабжение производилось еще из прудов, находящихся на лугах вокруг крепости. Единственная защита этих прудов от загрязнения состояла из низких деревянных заборов, да, пожалуй, еще из стоявших вблизи часовых». Обобщив эти наблюдения, Петтенкофер сделал шуточное заключение, что «параллельно распространению водопровода увеличивается и холера».
Ну а если серьезно, то локалисты пришли к выводу, что «в Калькутте совпадения между водоснабжением и развитием холеры, в котором можно было бы усматривать причинную связь, не существует». Кох был вынужден отвечать оппонентам, так как, с точки зрения его теории о распространении холеры питьевой водой, было непонятно, как это в 1871 г., когда в Калькутте пользовалось новым водоснабжением не более 2000 домов (притом, разумеется, по преимуществу домов в хороших частях города, которые вообще сравнительно свободны от холеры), холера похитила жизни всего 796 человек, тогда как в 1876 г., когда число домов, снабженных водопроводной водой, доходило уже до 10 тыс., от холеры умерло 2272 человека. Явление это объяснялось Кохом указанием на недостаток водопроводной воды, ощущаемый преимущественно бедной частью населения, вынужденной пользоваться водой из реки и из прудов. Петтенкофер и другие локалисты не приняли объяснение Коха и указали ему на то, что, во-первых, недостаток воды был констатирован официально еще в 1872 г., т.е. как раз в то время, когда кривая холерной заболеваемости стояла очень низко; во-вторых, они привели ему статистику, показывающую, что холерная смертность в предместьях города, вовсе не снабженных водой из водопровода, обнаруживает колебания по времени, соответствующие тем, которые происходят в центре города. И окончательно они «добили» аргументы, приведенные Кохом, используя статистику холерной заболеваемости по всей Бенгальской провинции Индии, в которой тогда жило около 30 млн. человек. Оказывается, в 1871—1874 гг. эпидемия холеры была сравнительно слаба, но она снова усилилась в 1876—1877 гг. точно так же, как и в самом городе. Такое же явление повторилось и в 1880 г., когда холерный минимум в Калькутте совпал с таким же минимумом во всей провинции. Если не придумывать эпидемиологию холеры, то ее очень трудно объяснять, разве что только для учебников (более подробно описание пандемий холеры приведено в подглаве 4.1.2).
В исторических источниках приводятся описания и трудно объяснимых с точки зрения контагионистических представлений, совпадений эпидемических катастроф. В период с 1918 г. по 1922 г. по Поволжью, Прикаспию, Закавказью, Забайкалью и по разным местностям, прилегающим к границам России, прокатились вспышки чумы. В 1918 г. радикально изменилась ситуация по холере. Вспышки болезни зафиксированы в 40 российских губерниях, в Средней Азии, на Кавказе и в Сибири (до Якутска). Холера не прекращалась и в 1919 г. и в 1920 г. даже зимой. Но размах холерной эпидемии 1921 г. был настолько большим, что ее выделили в отдельную эпидемию, сопоставимую по потерям среди населения с наиболее крупными холерными эпидемиями прошлого. Смертность от холеры среди населения составила 55 % от количества заболевших. В некоторых населенных пунктах она достигала 80 и даже 100 %. Летом (!) 1918 г. в Росси вспыхнула пандемия гриппа, названная тогда «испанкой». В период 1918—1922 гг. Россия пережила невиданную в мировой истории эпидемию сыпного и возвратного тифов. Большие и узловые станции железных дорог были забиты трупами людей, умерших от тифа. На некоторых станциях залежи трупов достигли огромных размеров, города не успевали открывать тифозные больницы. От «сыпняка» погибла армия адмирала А. В. Колчака. Обычно за сыпным тифом (смертность от 8 до 80%, что зависело от условий жизни заболевшего) следовал возвратный тиф (смертность до 3%); тех, кто переживал паразитарные тифы, «прореживали» холера и голод. В 1921 г. внезапно малярия «вышла» далеко за пределы своего обычного распространения, она охватила всю страну и продвинулась даже в ее северные районы. Тяжелые формы тропической малярии, наблюдавшиеся до войны только в предгорьях Кавказа, в Поволжье и в Средней Азии, распространились по всей республике — малярия приняла характер жесточайшего народного бедствия. Ее отличала необычайная смертность — за 1921 г. 11,3 % от числа заболевших первично, но в некоторых группах населения смертность доходила до 80 %.
Не всегда эти эпидемические события поддаются объяснению трудностями гражданской войны и разрухой того времени. Так чума может проникнуть в населенные пункты только после активизации ее природных очагов, на что человек влиять не может. Но активизация таких очагов почему-то происходила в те годы на огромных территориях России и прилегающих к ней стран. Распространение паразитарных тифов в эти годы было отмечено не только в России и в перенесших войну Европейских странах, но и в Латинской Америке. Для холеры того времени отмечали отсутствие связи ее появления с движениями людских потоков. Например, холеры не было в Красноярске, расположенном на перегруженной холерными больными Транссибирской магистрали, а в Средней Азии ею, как правило, болели только местные жители. Необъясненным осталось повсеместное присутствие в те годы холерного вибриона в источниках питьевой воды даже в северных безлюдных районах Сибири. Например, в реке Иртыш в пределах Тобольска, в реке Туре в пределах Тюмени, в реках Ишиме, Карасуни и Мергени в пределах города Ишима Тюменской области (и выше и ниже по реке), и в воде рек и колодцев более умеренных широт.
Напоминание этих фактов должно предостеречь читателя от упрощенного отношения к экологии возбудителей опасных инфекций. Возможно, что при столь значительных различиях между собой по биологическим свойствам (возбудители чумы и холеры — это бактерии; возбудители паразитарных тифов — риккетсии; возбудитель гриппа — РНК-вирус; возбудители малярии — одноклеточные паразиты крови), их экологические ниши на отдельных территориях находятся в зависимости от одних и тех же природных факторов, что и вылилось в чудовищную эпидемическую катастрофу 1918—1922 гг.
***
Простейшие, обитатели водных и почвенных экосистем, являются как эволюционными предками макрофагов, так и резервуаром возбудителей инфекционных болезней для многоклеточных организмов, и эти два феномена находятся в причинно-следственной связи друг с другом. Роль простейших в поддержании в природе возбудителей опасных инфекционных болезней людей эмпирически зафиксировал Макс Петтенкофер в виде фактора, названного им «фактором Y». К микроорганизмам, способным к сапронозному существованию и одновременно являющимся патогенными для людей, относятся те из них, которые начинают свое размножение в организме в фагоцитирующих клетках, т. е. почти все из известных на сегодняшний день. То, что феномен сапронозного существования пока установлен лишь для отдельных микроорганизмов, опасных для человека, означает новизну данного направления исследований и дает шансы исследователям на обнаружение новых природных закономерностей и явлений. Способность многих недавно выявленных микроорганизмов размножаться только в фагоцитирующих клетках, свидетельствует в пользу того, что именно они, а не искусственные питательные среды современных лабораторий, являются питательной средой, наиболее адекватной их физиологическим потребностям. Нам придется внести очень серьезные изменения в свои представления о физиологии и биохимии микроорганизмов, когда мы начнем их изучать в естественных экосистемах.
Имеющиеся экспериментальные данные по экологии микроорганизмов, эпидемиологические наблюдения и исторические свидетельства, позволяют предположить наличие в природе стойких природных очагов возбудителей опасных для людей инфекционных болезней (в том числе и ВИЧ), не подпадающих под рассмотрение современных теорий природно-очаговых болезней и существующих как «подводная часть айсберга» очагов, обнаруживаемых бактериологическими или вирусологическими способами. Границы и организация таких очагов могут быть установлены с помощью методов молекулярной диагностики, но такую задачу ученые еще должны перед собой поставить. Для понятийной дифференциации таких очагов от тех, территориальные границы которых очерчены по эпизоотиям среди диких животных, мы предложили их называть реликтовыми очагами (Супотницкий М. В., 2003, 2004, 2005: Супотницкий М. В., Супотницкая Н. С., 2006).
Метки: чума
