Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. 1.2. Ретроэлементы генома современного вида Homo sapiens
Супотницкий М.В. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. 2. Внутриклеточные паразиты и симбионты многоклеточных организмов. // Энвайронментальная эпидемиология. — 2007. — Т. 1, № 2. — С. 183—258.;
1.2. Ретроэлементы генома современного вида Homo sapiens
Геном — полная генетическая система клетки, определяющая характер онтогенетического развития организма и наследственную передачу в ряду поколений всех его структурных и функциональных признаков. Суммарные данные о содержании разных видов последовательностей в геноме человека приведены в табл. 1.
Таблица 1
Нуклеотидные последовательности, входящие в состав генома человека*
|
Тип последовательности |
Содержание, % |
|
Экзоны генов |
1 |
|
Интроны генов |
25 |
|
Транспозируемые элементы |
45 |
|
Большие дупликации |
5 |
|
Простые повторы (микросателлиты)** |
3 |
|
Другие межгенные последовательности |
20 |
* Из книги Тарантул В.З., 2003.
** Повторяющаяся ДНК ( r epetitive DNA) в геноме человека включает гены, которые кодируют компоненты рибосом, организованные как тандемные повторы, повторяющиеся по 150—200 раз. Подобным же образом организована высокоповторяющаяся ДНК ( highly repetitive DNA ), включающая очень короткие последовательности, которые могут повторяться миллионы раз, — это так называемая минисателлитная ДНК ( minisatellite DNA ). Она включает блоки длиной по 10—100 пар оснований ( bp ), характерные для каждого индивидуума (в данной работе не рассматриваются).
Классификация транспозируемых элементов. Почти половину генома человека составляют различные транспозируемые элементы (transposable elements, TEs). Они делятся на два основных класса: ДНК транспозоны (DNA transposones) и ретроэлементы (retroelements). Классификация транспозируемых элементов, их процентное содержание и приблизительное количество показаны на рис. 1.
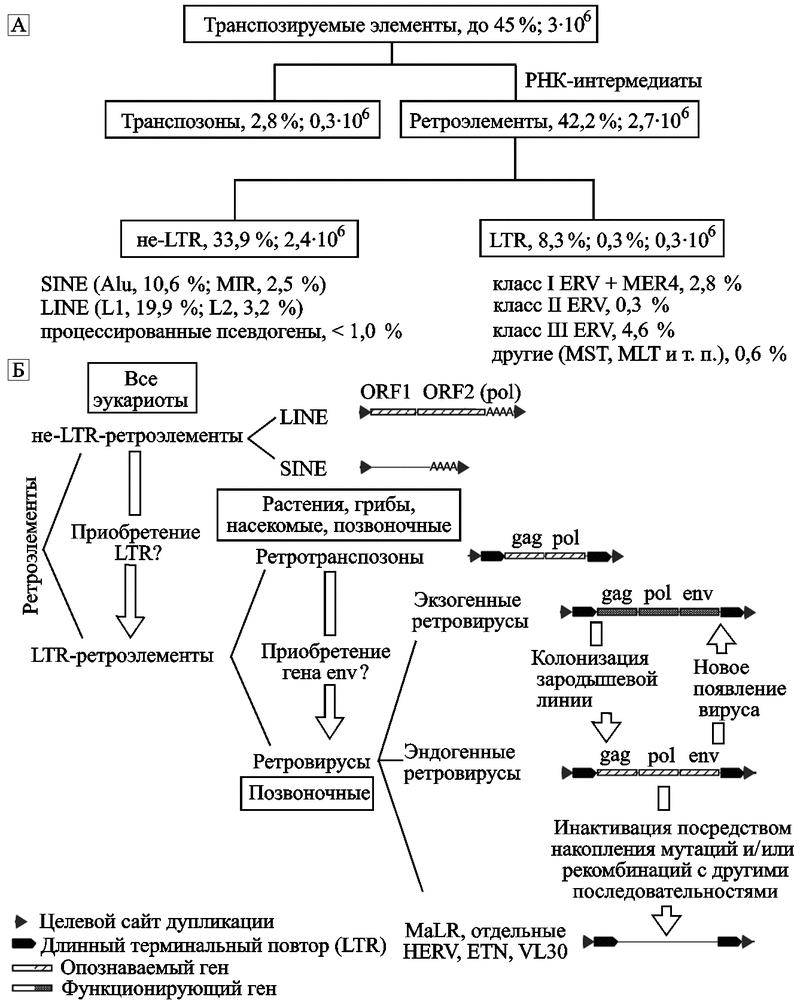
Рис. 1. Классификация транспозируемых элементов генома человека
А. Общая классификация транспозируемых элементов человека по N. Bannert и R. Kurth (2004).
Б. Классификация ретроэлементов по N. de Parseval и T. Heidmann (2005). Короткие прямые повторы фланкируют все ретроэлементы, интегрировавшиеся с геномом хозяина через транспозицию. ORF — открытая рамка считывания. VL30, ETN — повторяющиеся LTR-элементы, найденные у мышей. MaLR — LTR-ретротранспозон, обнаруженный у млекопитающих.
ДНК-транспозоны млекопитающих структурно сходны с бактериальными транспозонами. Подобно другим транспозируемым элементам (см. ниже), ДНК-транспозоны изменяют эволюционную траекторию своего хозяина благодаря следующим механизмам: 1) через изменение функции генов путем вставок генов, регуляторных элементов, «перетасовок» экзонов и интронов; 2) через индукцию хромосомных перестановок; 3) как источники кодирующей и не кодирующей ДНК, которая позволяет появляться различным генетическим новинкам, таким как новые гены и регуляторные последовательности (Feschotte C., Pritham E., 2007).
ДНК-транспозоны реплицируются без РНК-производного и теоретически способны перемещаться по геному по типу «разрезал и встроился» («cut and paste») через использование фермента транспозазы (transposase). Они фланкированы посредством инвертированных терминальных повторов (inverted terminal repeats, ITRs) и имеют одну открытую рамку считывания (open reading frame, ORF), которая кодирует фермент транспозазу. ДНК-транспозоны фланкированы через короткие прямые повторы (short direct repeats, DRs), «приобретенные» в ходе интеграционных процессов; не образуют вирусных частиц и не могут покинуть клетку.
Эволюционная история ДНК-транспозонов приматов закончилась еще до «расщепления» приматов на виды Старого и Нового Света. J. K. Pace II. и С. Feschotte (2007) исследовали не менее 40 семейств ДНК-транспозонов человека, включающих до 98 тыс. таких элементов, и установили высокую активность ДНК-транспозонов в эволюции млекопитающих и, в частности ранних приматов. Но перед радиацией приматов на предков видов-антропоидов (anthropoid primate ancestor), их транспозиционная активность прекратилась. Исследователи не обнаружили ДНК-транспозоны «моложе» 37 млн лет. Поэтому такие транспозируемые элементы считаются ими своего рода «окаменелостями» генома приматов (рис. 2).
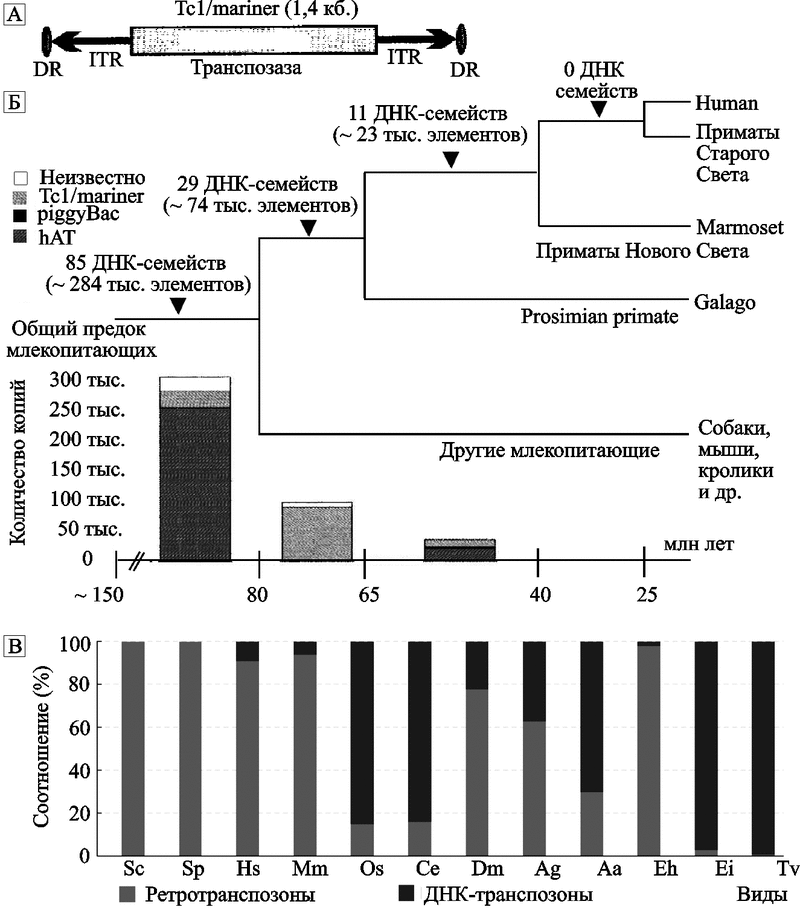
Рис. 2. ДНК-транспозоны в эволюции эукариотов
А. Структура наиболее распространенного среди млекопитающих ДНК-транспозона (по Ostertag E. M., Kazazian H., 2001).
Б. Суммарная активность ДНК-транспозонов в эволюции приматов. Столбики внизу рисунка соответствуют количеству ДНК-элементов, активных на отдельных этапах эволюции приматов (разбиты на суперсемейства). ДНК-транспозонов, активных после появления обезьян Нового Света, в геноме человека не обнаружено. HAT, piggyBac и Ес1/mariner — семейства ДНК-транспозонов, обнаруженные в геноме человека (по Pace II J. K., Feschotte C., 2007).
В. Процентное соотношение ДНК-транспозонов и ретротранспозонов относительно общего количества транспозируемых элементов у эукариотических видов. Сокращения: Sc (Saccharomyces cerevisiae); Sp (Schizosaccharomyces pombe); Hs (Homo sapiens); Mm (Mus musculus); Os (Oryza sativa); Ce (Caenorhabditis elegans); Dm (Drosophila melanogaster); Ag (Anopheles gambiae, малярийный комар); Aa Aedes aegypti, комар, разносчик возбудителя желтой лихорадки); Eh (Entamoeba histolytica); Ei (Entamoeba invadens); Tv (Trichomonas vaginalis). (Feschotte C., Pritham E., 2007).
Млекопитающие сосуществовали с рептилиями еще в Триасе (230-190 млн лет назад), но лишь как дополнение к многообразию последних на планете. Основная масса ДНК-транспозонов (85 %; примерно 291 тыс. элементов) распространились среди млекопитающих в Меловом периоде (135-66 млн лет назад), когда происходило вымирание рептилий. «Расцвет» млекопитающих пришелся на Палеоген (66-25 млн лет назад). До 29 семейств (74 тыс. элементов) были активны у приматов перед их «расщеплением» на антропоидов, и 11 семейств (23 тыс. элементов) интегрировались с геномом антропоидов. Следовательно, в ходе эволюции приматов наблюдалось устойчивое снижение активности ДНК-транспозонов, но почему это произошло, еще предстоит установить. Более подробно о роли ДНК-транспозонов в эволюции эукариотов можно прочитать в работе C. Feschotte, E. Pritham (2007).
Ретротранспозоны. В противоположность ДНК транспозонам, они кодируют обратную транскриптазу (reverse transcriptase, RT) и перемещаются по геному через образование РНК-транскрипта. Образовавшийся транскрипт транскрибируется «обратно» в ДНК-транскрипт и встраивается в хромосому клетки. При перемещении ретротранспозонов соблюдается принцип — «копировался и вставился» («copy and paste»), как в «доброе старое время» протоклеточных образований. Ретроэлементы составляют 90 % всех транспозируемых элементов генома человека, большинство из них не активны, однако некоторые из них остались способными к ретротранспозиции.
По этим данным получается, что структуры, подобные ВИЧ, обобщенно называемые ретроэлементами, и есть геном человека. Ретротранспозируемые элементы (ретроэлементы) делят на две большие группы: способные к автономному существованию (эту их «автономность» нельзя понимать буквально, так как они зависят от ферментов репарации ДНК хозяина, необходимых для их транспозиции) и неавтономные.
Выделены два класса автономных ретроэлементов: не-LTR (non-LTR) и LTR-элементы (LTR-elements), структурно сходные с ретровирусами, но утратившие функционирующий env ген.
Длинные концевые повторы или LTR (long terminal repeats) — это прямые повторяющиеся последовательности на концах ДНК-копии генома ретровирусов, образовавшейся в результате обратной транскрипции. Каждый такой повтор состоит из трех элементов: U3-R-U5, длина которых составляет соответственно 170–1250, 10–80 и 80–100 т. п. н.; 3’-конец U5 сам содержит короткий инвертированный повтор, гомологичный последовательности на 5'-конце элемента U3, т. е. сама последовательность LTR фланкирована короткими инвертированными повторами; LTR участвуют в интеграции ДНК-копии генома ретровируса в геном клетки-хозяина, кроме того, область U3 каждого LTR несет промотор, причем промотор левого LTR участвует в транскрипции ДНК провируса, а промотор правого — последовательности ДНК клетки-хозяина вблизи сайта интеграции ретровируса. LTR фланкируют сложные элементы генома и участвуют в процессе их транспозиции (Khodosevich K. et al., 2002).
Неавтономные ретротранспозоны не кодируют белков. К ним относятся Alu -повторы (в геноме человека их более миллиона; см. «Эволюционная роль Alu-элементов»); псевдогены, образовавшиеся в результате обратной транскрипции (см. «Эволюционная роль псевдогенов»); и SVA -элементы (аббревиатура от заглавных букв SINE - R , VNTR и Alu , описаны как «композитные ретропозоны; более подробно о SVA -элементах см. в подглаве 4.3) . Для своей транспозиции они нуждаются в активности автономных ретроэлементов. Например, SVA-элементы ретротранспозируются с помощью L1-транспозонов (более подробно о транспозиции неавтономных ретротранспозонов см. в работе Ostertag E . M ., Kazazian H ., 2001).
Не-LTR-ретроэлементы. Очень древние ретроэлементы. Широко представлены среди простейших организмов. Два представителя этого семейства ретроэлементов встречаются в геноме человека в очень больших количествах. Это короткие вставочные элементы (short interspersed elements, SINE) с преобладанием Alu- и MIR-повторов; и длинные терминальные вставочные повторы (long-terminal interspersed elements, LINE), представленные автономными L1 и L2 последовательностями (см. «Эволюционная роль L1 ретроэлементов»). SINE обычно имеют длину 100–400 п. о. и по большей части происходят от транскриптов генов тРНК, синтезированных посредством РНК-полимеразы III (pol III). SINE имеют внутренний промотор, который позволяет их транскрипцию РНК-полимеразой III. Они не имеют емкости, достаточной для поддержания генов амплификации, и их размножение в геноме человека зависит от LINE.
LTR-ретроэлементы. Составляют до 8 % генома человека. К ним относятся ретротранспозоны (retrotransposons), эндогенные ретровирусы (endogenous retroviruses, ERVs), человеческие эндогенные ретровирусы (human endogenous retroviruses, HERVs) и повторяющиеся элементы эндогенных ретровирусов человека (repeat elements with HERV origin), такие как SINE-R ретропозоны (SINE-R retroposons). Последние содержат участки последовательностей LTR HERV-K (рис. 3).
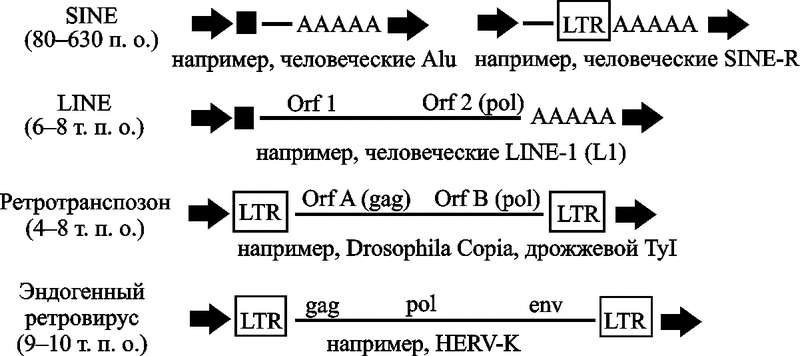
Рис. 3. Структурные особенности наиболее часто встречающихся ретроэлементов
Стрелками показаны повторяющиеся последовательности, образованные во время интеграционных процессов. Заполненные квадраты соответствуют промоторным регионам. А-последовательности показывают первоначальное полиаденилирование (original polyadenylation). Сокращения: bp — пары оснований; Orf — открытая рамка считывания; LTR — длинные концевые повторы (по Bannert N., Kurth R., 2004).
В геноме человека содержится не менее 98 тыс. ERV (Paces J. et al., 2002). Ген env ERV придает способность ретровирусу распространяться между клетками и индивидуумами. Отдельные LTR эндогенных ретровирусов и ретротранспозоны, образовавшиеся благодаря рекомбинационным процессам, в которых участвуют сами LTR-ретроэлементы, встречаются в геноме человека на один-два порядка чаще, чем эндогенные ретровирусы. Всего выделяется 6 суперсемейств LTR-ретроэлементов (табл. 2).
Таблица 2
Суперсемейства LTR-содержащих ретроэлементов*
|
Элемент |
Характеристика |
|
Класс I ERV |
Сходен с типом С или гамма-ретровирусами |
|
Класс II ERV |
Сходен с типом B или бета-ретровирусами |
|
Класс III ERV |
Отдаленно связан со спума-ретровирусами |
|
MER4 |
Неавтономный, связанный с ERV |
|
MST |
Названы по общему MstII рестрикционному сайту |
|
MLT |
LTR транспозоны млекопитающих |
*По P. Medstrand, L. N. van de Lagemaat, D. L. Mager (2002).
Принимая во внимание то, что эндогенные ретровирусы классов I и II проникли в зародышевую линию примитивных приматов как инфекционные ретровирусы и в последующем подвергались взрывной амплификации и транспозиции в периоды активной эволюции приматов, другие суперсемейства, вероятно, соответствуют древним ретротранспозонам, которые амплифицировались на ранних этапах эволюции млекопитающих. Только небольшая часть «молодых» субтипов Alu и L1 non-LTR-элементов остаются активными в геноме человека (Medstrand P. et al., 2002).
В механизме «перехода» экзогенного ретровируса в эндогенный много неясного. Эндогенизации у людей известных экзогенных ретровирусов пока не зафиксировано. Вероятность таких событий для генома нашего вида нельзя исключать, так как сходные процессы обнаружены у других млекопитающих. Например, вирус рака молочной железы мышей (mouse mammary tumor virus, MMTV), вирус мышиной лейкемии (murine leukemia viruses), вирус птичьей лейкемии (avian leukemia viruses, ALV) и вирус кошачьей лейкемии (feline leukemia virus, FeLV) встречаются у своих хозяев как в эндо-, так и в экзовариантах (Medstrand P., Mager D. L.,1998). Как будет показано ниже (см. «Эволюционная роль HERV-K»), эндогенизация ретровирусов у гоминид происходит не только очень редко (в масштабах времени скорее геологических, чем отражающих продолжительность существования вида), но и в периоды каких-то важных эволюционных событий для этого семейства в целом.
Попытки таксономии эндогенных ретровирусов человека приводят ученых к замешательству. Предпочтительным приемом таких исследований является использование аминокислотной специфичности тРНК, которая гибридизуется с праймер-связывающим сайтом (primer-binding site). Например, HERV-K использует лизинспецифическую тРНК как праймер для инициации реакции обратной транскрипции. Но сегодня известно, что весьма различные ретровирусы используют этот же праймер. Кроме того, неполная информация по коротким участкам вирусов, содержащим мутации и делеции, делает их классификацию почти невозможной. К этому надо добавить лабораторные ошибки, когда отдельные ретровирусы выделяются и именуются произвольно в разных лабораториях (Bannert N., Kurth R., 2004).
Эволюционная роль HERV-K. Наиболее вероятной схемой появления в геноме человека мультикопийных семейств HERV, N. de Parseval и T. Heidmann (2005) считают следующую: экзогенные ретровирусы случайно инфицируют клетки зародышевой линии (germline cells) во время развития плода. После первичной «колонизации» генома ставшие эндогенными ретровирусы передаются вертикально. Амплификация копий «предкового» провируса осуществляется путем внутриклеточной ретротранспозиции и повторной интеграции в клетки зародышевой линии. Каждая новая колонизация таких клеток дает новое семейство или линию ERV.
Очень немногие из 30–50 идентифицированных групп эндогенных ретровирусов человека содержат открытые рамки считывания для генов трех основных структурных белков Gag, Pol и Env (см. подглаву 1.3). Все они принадлежат к молодому семейству HERV-K, которое поддерживается в геноме приматов Старого Света (Old World monkeys, OWMs), включая человекообразных обезьян и людей. Всего же, по данным pol-специфического микроанализа, среди OWM выявлено не менее 8 семейств гаммаретровирусов, 9 семейств бетаретровирусов и 5 субгрупп HERV-L элементов (Greenwood A. D. et al., 2005). Происхождение многих эндогенных ретровирусов человека уходит в глубину эволюционной истории только приматов примерно на 30-45 млн лет (см. работы Sverdlov E. D., 2000; и Hughes J. F., Coffin J. M., 2005). В действительности они должы быть намного древнее. По крайней мере, 31 семейство HERV являются потомками независимых актов инфекции экзогенными ретровирусами (Belshaw R. et al., 2005).
На рис. 4. показаны гипотетические модели дивергенции видов приматов, произошедшей в периоды «после» эпизоотий ретровирусных инфекций, имевших место 38-5 млн лет назад.
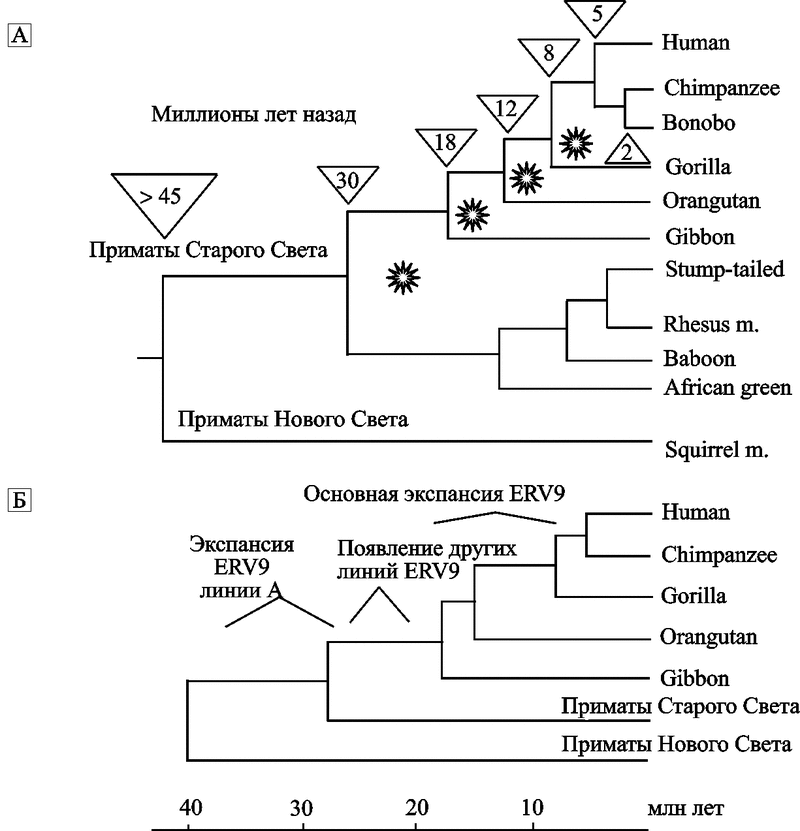
Рис. 4. Эндогенные ретровирусы в дивергенции видов приматов
А. Показано распределение эндогенных ретровирусов, интегрировавшихся с геномом передкового вида современных приматов в период от 30 до 5 млн лет назад. «Звездочками» указаны периоды ретровирусных эпизоотий, следы которых обнаруживаются в геноме современных приматов (см. табл. 3). Числа в перевернутых треугольниках показывает ориентировочное время (в млн. лет) расхождения отдельных эволюционных ветвей приматов (за основу мною взята схема Coffin J. M., 2004).
Б. Эволюционная история эндогенного ретровируса семейства ERV9 на фоне эволюционного древа приматов — частный случай участия ретровирусов в дивергенции видов приматов. Экспансия ERV9 (линия А ретровируса) в геноме предковых видов современных приматов Старого Света началась 38-30 млн. лет назад. Но наиболее активно экспансия ERV9 по геному приматов осуществлялась в период их дивергенции от гиббонов на высшие виды обезьян (16 — 6 млн лет назад). Максимум транспозиционной активности семейством ERV9 достигнут 8—6 млн лет назад, затем это ретровирусное семейство «угасло» (Costas J., Naverira H., 2000).
Правда J. M. Coffin (2004), нарисовавший большую часть схемы А данного рисунка, представляет дивергенцию приматов бесхитростно, как некое прогрессивное явление, имеющее своей целью создание именно тех их видов, во главе которых сегодня как венец творения Природы стоит человек, на чем этот процесс, разумеется, заканчивается. Но так не бывает. У природы нет вечных любимчиков, маховик эволюции может ускоряться и замедляться, но вращаться он будет постоянно, пока существует жизнь.
. Если придерживаться распространенной точки зрения на эндогенизацию ретровирусов как на процесс «перехода» экзогенного ретровируса, вызывающего эпидемии среди своих новых хозяев (а для наших отдаленных предков правильнее использовать термин «эпизоотии»), в эндогенный вирус-мутант, неспособный образовывать вирусные частицы и передаваться горизонтально, то надо предполагать еще и ту цену, которую заплатил отряд приматов за эту «интеграцию». Такая «эндогенизация ретровируса» неизбежно должна сопровождаться массовым вымиранием отдельных видов и даже семейств приматов. Учитывая особенности этих инфекционных процессов, «эндогенизация» в нашем восприятии времени длилась бы десятки тысяч лет (см. Супотницкий М.В., 2000; 2006). Обычно палеоантропологи теряются в догадках о причинах вымирания видов без вроде бы должных на то оснований (изменение климата, тектонические и космические катастрофы и т.п.; иных обычно они себе не представляют (см. работу Оппенгеймера С., 2004).
Оценки возраста ретровирусов делаются на основе сравнения последовательностей двух LTR и знания того, что HERV накапливают мутации со скоростью от 2.3х10 -9 до 5х10 -9 замен нуклеотидов в год, т. е. одно изменение в нуклеотидной последовательности LTR каждые 200 тыс. — 450 тыс. лет. Некоторые ретроэлементы геномов приматов Старого Света имеют возраст не менее 55 млн лет (Bannert N., Kurth R. 2004).
Интересно отметить то, что обезьяны Нового Света (New World monkeys, NWMs) обычно либо вообще не имеют, либо имеют только сильно редуцированные копии ERV большинства классов (Greenwood A. D. et al., 2005). Следовательно, ретровирусное инфицирование вида возможно не при всех сценариях его существования. Однако если оно произошло и привело к эндогенизации ретровируса, то влечет за собой труднопрогнозируемые эволюционные последствия на протяжении нескольких миллионов лет. Объяснение причин отсутствия следов «ретровирусных атак» в геноме обезьян Нового Света представляет собой не менее интересную задачу, чем объяснение их наличия для обезьян Старого Света. Получается, что существуют либо неизвестные источники ретровирусов для приматов (и с ними не соприкасались приматы Американского континента), либо в природе имеются какие-то терминаторы ретровирусных эпизоотий, которые не представлены в Старом Свете. А вот результат эволюции без «эндогенизации» ретровирусов, как говорится, «на лицо». Обычно обезьян Нового Света относят к надсемейству примитивных широконосых обезьян. Это мелкие обезьяны с широкой хрящевой носовой перегородкой, с направленными вперед ноздрями и с когтеобразными ногтями. Большой палец не противопоставляется другим, полушария мозга гладкие. Свою цену за эволюцию они явно не заплатили. Но теперь вернемся к тем, кто «платил за все».
Ретровирусы семейства HERV-K у приматов Старого Света были активны перед и после эволюционного разделения человека и шимпанзе 5—6 млн лет назад. Некоторые из них встречаются исключительно только у людей, тем самым показывая, что они интегрировались с его геномом уже после разделения этих линий (табл. 3).
Видовое распределение и время интеграции HERV-K элементов в геном человека*
|
HERV-K |
Положение в хромосоме человека |
Наибольшая дистанция до вида, в котором провирус был обнаружен |
Оценка времени интеграции (млн лет) |
|
4<>q32 |
166274445- 166281673 |
шимпанзе |
7.2-10.5
|
|
HERVK(<>II) (<>Chr. 3) |
102893427- 102902549 |
горилла |
4.9-5.9
|
|
12<>q24
|
132277472- 132283414 |
горилла |
6.6-9.8
|
|
10p14
|
6906147 6915609 |
горилла |
9.0-12.6
|
|
19p13.11A
|
22549664- 22556401
|
горилла |
10.3-15.4
|
|
22q11
|
22204481- 22215171 |
горилла |
28.6-38.9
|
|
9q34.3
|
136950603- 136960065 |
орангутан |
11.1-12.7
|
|
3p25
|
9864346- 9871236 |
орангутан |
13.4-19.8
|
|
1q23
|
163306258- 163311916 |
орангутан |
15.9-17.3
|
|
19p13.11B
|
20248400- 20258515 |
орангутан |
26.4-28.1
|
|
11q12 |
61892539- 61907139 |
гиббон |
17.5-21.0
|
|
19q13.1
|
42289389- 42298906 |
гиббон |
21.0-36.3
|
|
6p22
|
28758347- 28768714 |
гиббон |
25.0-32.4
|
|
20q11
|
32179289- 32188037 |
OWM**
|
12.8-18.3
|
|
6< >p21
|
42969390- 42979344 |
OWM |
7.4-13.1 |
* По J. F. Hughes и J. M. Coffin (2005); недавно в геноме человека было идентифицировано новое семейство эндогенных ретровирусов — см. работу N. Polavarapu et al. (2006).
** OWM – обезьяны Старого Света (Old World monkeys).
Процесс интеграции ретровирусов с геномом приматов не носил линейный характер. Эволюция приматов сопровождалась взрывной амплификацией ретроэлементов в их геноме. «Новые» HERV-K неоднократно занимали участки генома, принадлежащие «старым» HERV-K по механизму гомологичной рекомбинации. По крайней мере, 1/3 из исследованных провирусов подверглась эктопической рекомбинации (ectopic recombination) (Hughes J. F., Coffin J. M., 2005). J. M. Coffin (2004) указывал на периоды в эволюции приматов «без активности ретровирусов». R. Belshaw et al. (2004), исследовавшие env ген HERV восьми семейств, считают, что реинфекция является наиболее общим механизмом поддержания и пролиферации эндогенных ретровирусов в их хозяевах (см. подглаву 1.3 «Реинфекция»). Однако высокая частота этих событий затрудняет точную оценку времени эндогенизации ретровирусов на основе оценок дивергенции между LTR (рис. 5).
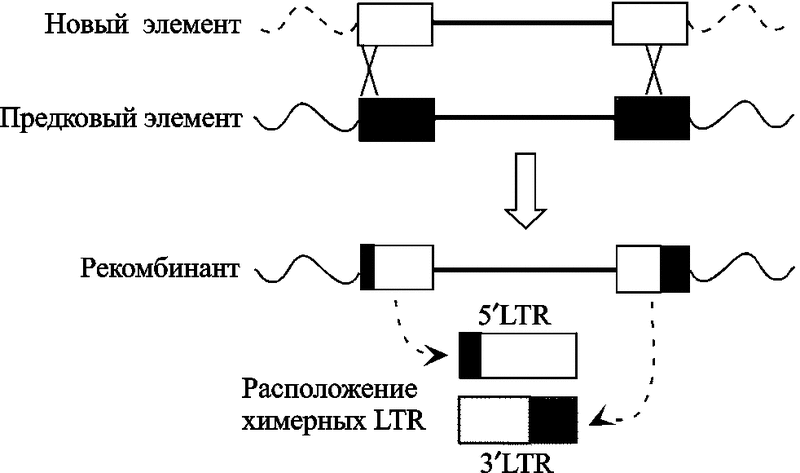
Рис. 5. Образование через гомологичную рекомбинацию химерных LTR в HERV-K6p21
LTR заново интегрировавшихся HERV-K элементов показаны серым цветом (по Hughes J. F. и Coffin J. M., 2005).
В эволюции шимпанзе и людей участвовали разные эндогенные вирусы и с разными сценариями активности. P. Jern et al. (2006) нашли различия в недавней (т. е. имевшей место в ближайшие 5 млн лет) активности бета-подобных и гамма-подобных эндогенных ретровирусов в геномах этих видов приматов. Две большие группы гамма-подобных эндогенных ретровирусов (PtG1 и PtG2) поддерживались в геноме шимпанзе и отсутствовали у людей; PtG последовательности были наиболее сходны с двумя ERV бабуинов, но не с ретровирусами данного типа других шимпанзе или людей. Сама же гамма-ретровирусная интеграционная активность была разделена во времени от бета-ретровирусной (табл. 4).
Таблица 4
Свойства эндогенных ретровирусов, недавно интегрировавшихся с геномом людей и шимпанзе*
|
Выявленный элемент
|
Человек |
Шимпанзе |
||||
|
бета |
гамма |
бета |
гамма |
|||
|
ERV |
12 |
12 |
1 |
35 |
||
|
gag |
12 |
10 |
1 |
18 |
||
|
pro |
12 |
4 |
1 |
27 |
||
|
pol |
12 |
11 |
1 |
27 |
||
|
env |
12 | 2 |
1 |
22 |
||
|
“LTR-gagpro-pol-env-LTR” |
12 |
1 |
1 |
1 |
||
*По P. Jern et al. (2006).
Для исследователей роли ретроэлементов в эволюции человека должно представлять интерес и обнаружение D. J. Hedges et al. (2004) разных сценариев эволюционной активности Alu-элементов, также начавших свой отсчет после дивергенции видов H. sapiens и P. troglodytes (см. «Эволюционная роль Alu-элементов»). Еще более любопытные результаты дает сравнительный анализ экспрессии эндогенных ретровирусов в различных тканях разных видов приматов. Например, анализ 215 образцов РНК, полученных из мозга людей, показал явную специфичность экспрессионного профиля HERV разных семейств и классов (Frank O. et al., 2005).
Недавние эксперименты позволили установить, что фундаментальные биологические различия между видами приматов являются следствием не столько вариаций в их генах, сколько результатом различий в экспрессии и регуляции одних и тех же генов (эволюция по типу анагенеза). Например, исследования, основанные на микроанализе ДНК, показывают, что экспрессия сложных генов человеческого мозга значительно превышает их же экспрессию у нечеловекообразных приматов.
Но ткани, иные чем мозг, у этих же приматов не показывают значительных различий в экспрессии генов (Stengel A. et al., 2006). А. Stengel et al. (2006) сообщили о собственных экспериментах по оценке экспрессии генов HERV в различных тканях приматов разных видов. Ими установлено, что большинство анализируемых HERV активно экспрессировались в тканях мозга человека, но оказывались либо полностью неактивными в аналогичных тканях обезьян Старого Света, либо их экспрессия была незначительной. Данные, полученные O. Frank et al. (2005) и А. Stengel et al. (2006), интересно сопоставить с более ранними наблюдениями палеоантропологов по эволюции мозга человекообразных приматов, обобщенных в работе С. Оппенгеймера (2004). Его собственные объяснения эволюции человека сводятся к необходимости приспособления приматов к внешним факторам, среди которых он на первое место ставит похолодание климата Земли, начавшееся 7-8 млн лет назад. И в качестве адаптивного признака к холоду антрополог Оппенгеймер почему-то видит увеличение объема мозга человекообразных приматов, а не увеличение длины их шерсти или толщины костей черепа. Проанализируем собранные им данные применительно к вышеуказанным работам и к результатам исследования дивергенции видов приматов, полученных другими авторами (см. рис. 4).
По данным антропологических исследований, примерно 7-8 млн лет назад произошло резкое сокращение числа видов человекообразных приматов, совпавшее по времени с расширением площади безлесых травяных степей и глобальным похолоданием, продолжавшимся несколько миллионов лет. Но именно в этот период произошла дивергенция какого-то неизвестного вида приматов на виды, в последующем дивергировавшие на гоминоидов (наших ближайших предков), горилл, орангутанов, бабуинов и шимпанзе. «Списать» оба эти процесса только на «похолодание» не удается, так как тогда же вспыхнули массовые эпизоотии ретровирусных инфекций, оставивших в качестве «отпечатков» в геноме этих видов не менее семи типов эндогенных ретровирусов. Эпизоотии были настолько масштабными, что почти не сохранили в геноме выживших видов приматов «следов» других подобных эпизоотий за предшествующие несколько миллионов лет (см. табл. 3). Массовая гибель приматов снизила заполненность занимаемых ими экологических ниш и способствовала увеличению темпов видообразования у тех представителей их отряда, которые «прошли» через процесс эндогенизации новых ретровирусов. Тогда же стали появляться виды приматов (гоминоиды), которых сегодня палеоантропологи считают нашими предшественниками, т.е. с увеличенным объемом мозга. Следовательно, ретровирусная эндогенизация при условии освобождения экологических ниш, создала условия для эволюции отряда приматов по типу кладогенеза (рис. 6).
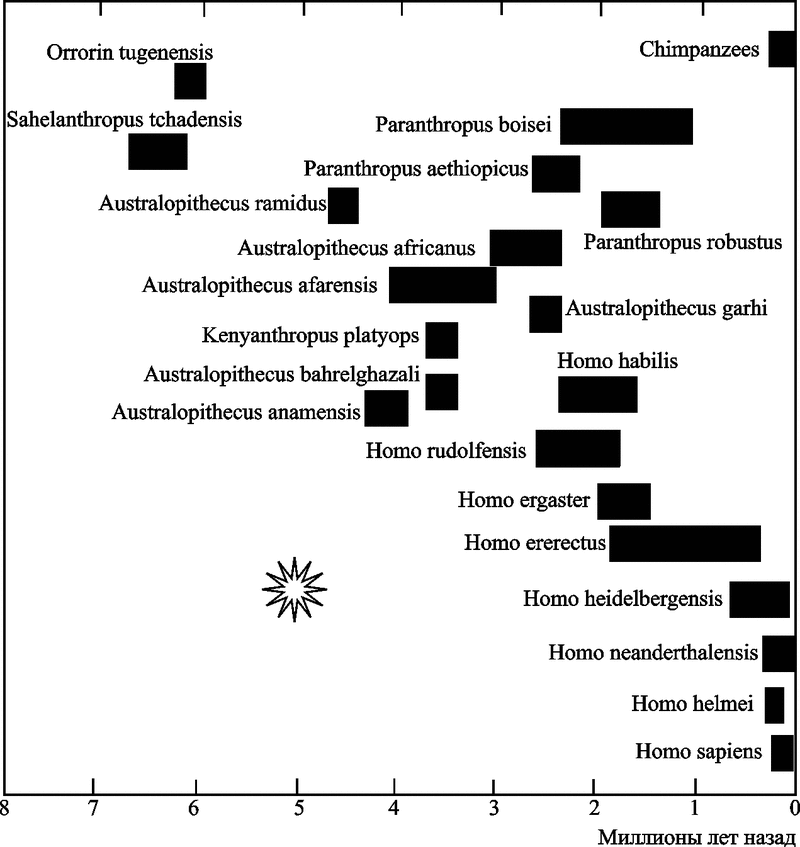
Рис. 6. «Взрывная» дивергенция видов гоминоидов (эволюция по типу кладогенеза)
Произошла 5-2 млн лет назад после процессов эндогенизации ретровирусов, наиболее представленных в нашем геноме в настоящее время. «Звездочкой» обозначена массовая ретровирусная эпизоотия, ее «следы» сегодня обнаруживаются в геноме приматов в качестве эндогенных ретровирусов (за основу взята схема Оппенгеймера С., 2004).
Любопытно и то, что с этого периода времени у предков шимпанзе и предков человека функционируют разные эндогенные вирусы и с разными сценариями активности (см. выше данные Jern P. et al., 2006).С этого же времени у крупных травоядных обезьян за весь период сравнения (5 млн лет) не было выявлено никаких признаков увеличения объема мозга, тогда как у гоминоидов обеих ветвей Homo (ergaster и babilis) и Parantbropus (boisei) такие изменения произошли.
В этот период появилось не только несколько новых видов Homo и Parantbropus со значительно большим объемом мозга, но и, что весьма показательно, объем мозга увеличился у всех гоминоидов в пределах каждого вида с 400 до 900 см3 (Elton S. et al., 2001).
С. Оппенгеймер (2004) отмечает прерывистость увеличения объема мозга при переходе от древних гоминоидов к современному человеку. Он приводит следующий пример. Увеличение объема мозга между древнейшим Homo babilis, жившим примерно 2 млн лет назад, и Homo rbodesiense, жившим 1,07-1,3 млн лет назад, т. е. в период 700 тыс. лет, составило более чем в 2,5 раза. В последующие же 1,2 млн лет, несмотря на тот факт, что гоминоидам было присуще некоторое увеличение объема мозга, от достижения объема мозга современного человека их отделяло всего 6%. Фактически же за последние 150 тыс. лет у человека современного типа имело место снижение объема мозга.
Оппенгеймер, привязавший свою теорию эволюции гомининоидов к похолоданиям климата, не смог скрыть своего удивления, когда не нашел очередных скачков роста объема их мозга в ледниковые периоды последнего миллиона лет и, в частности, ледникового периода, закончившегося 30 тыс. лет назад. Эндогенные ретровирусы участвуют в эволюции приматов не только через увеличение активности и объема их мозга, но и посредством «частных улучшений», когда они берут «на себя» новую функцию для генома (рис. 7).
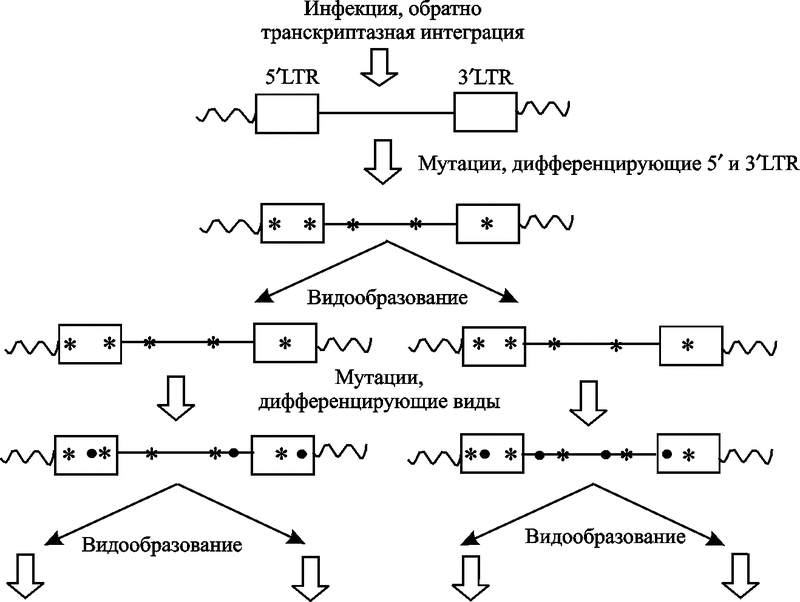
Рис. 7. Эндогенная ретровирусная эволюция
LTR-последовательностям интегрированного провируса соответствуют прямоугольники, между ними последовательность ДНК вируса (прямая линия). Клеточная ДНК показана волнистой линией. Мутации изображены как звездочки или точки. Их обнаруживают двух типов: те, которые видоизменяют у потомков 5’ и 3’LTR (звездочки), и которые после интеграции только предшествуют видообразованию; и те, которые непосредственно способствуют дифференциации видов, т.е. видообразованию (точки) (по Hughes J. F. и Coffin J. M., 2005).
Количество задокументированных случаев, в которых эндогенные ретровирусы человека функционировали миллионы лет как промоторы или энхансеры (эволюция по типу анагенеза), в последние годы становится все большим (табл. 5).
Таблица 5
Примеры вовлечения ретровирусных последовательностей в регуляцию генов клеточных белков*
|
Элемент |
Ген (промотор) |
Функциональная роль |
|
HERV-E |
Mid1 |
Opitz-syndrome |
|
HERV-E |
Аполипротеин С1 |
Печень и другие ткани |
|
HERV-E |
Эндотелин-В рецептор |
Плацента |
|
HERV-E |
Плелотрофин |
Трофобласты |
|
HERV-L |
бета1,3-галактозилтрансфераза |
Толстая кишка, молочная железа |
|
ERV II |
BAAT (трансфераза) |
Метаболизм |
|
ERV I |
Ароматаза |
Плацентарный эстрогенный синтез |
|
ERV III |
Карбоновая ангидраза 1 |
Эритроид-карбон метаболизм |
|
LTR + LINE-2 |
Шаперонин (сhaperonin) |
McKausick-Kaufman синдром |
|
HERV |
INSL4 (семейство инсулинов) |
Плацента |
* По Bannert N., Kurth R., 2004.
Сопоставление палеонтологических доказательств S. Elton et al. (2001) и С. Оппенгеймера (2004) прерывистости в увеличении мозга гоминид с результатами исследований P. Jern et al. (2006) и J. M. Coffin (2004) по эндогенизации ретровирусов в геноме приматов, позволяет нам сделать предположение, что оба этих явления находятся в причинно-следственной связи и «укладываются» в теорию прерывистого равновесия эволюции видов (пунктуализм), сформулированную в 1972 г. С. Гоулдом (Stephen Jay Gould, 1941-2002) и Н. Элдриджем (Niles Eldredge, р. 1943). Их теория дополняет дарвиновскую теорию постепенной эволюции (градуализм). В ее основе лежит антиэнтропийный эволюционный механизм, названный мною «ретровирусной эволюцией» (см. подглаву 1.1).
Теория прерывистого равновесия эволюции видов предполагает, что в эволюции видов чередуются длительные периоды стабильности, когда основные черты вида сохраняются неизменными, и короткие периоды быстрых изменений, в ходе которых вид преобразуется — либо целиком превращается в другой вид, либо делится на два или более новых вида, либо «отпочковывает» их от себя (Pagel M. et al., 2006). Судя по приведенным выше данным, реализуется этот эволюционный механизм после массовых ретровирусных эпизоотий, заканчивающихся эндогенизацией ретровирусов в геноме выживших видов и наращиванием генома вида-хозяина путем образования новых собственных копий ретроэлементов; его усложнения путем образования новых экзонов из интронов и/или увеличения количества генов, подвергающихся альтернативному сплайсингу.
Заканчивая рассмотрение роли эндогенных ретровирусов в эволюции человека, важно отметить тот факт, что процесс эндогенизации отдельных ретровирусов имел место и после сформирования вида Homo sapiens (т. е. приблизительно 170 тыс. лет назад — оценка Оппенгеймера С., 2004). Например, возраст обнаруженного G. Turner et al. (2001) провируса HERV-K113 не превышает 100 тыс. лет. Он локализован в хромосоме 19 (19p13.11) и не полностью зафиксирован в человеческих популяциях. Генотипирование генетически различных популяций показало зависимость его аллельной частоты от исследуемой этнической группы. Провирус весьма распространен среди людей, живущих в Африке, Азии и Полинезии.
Основываясь на данных G. Turner et al. (2001), N. Bannert и R. Kurth (2004) предположили, что полностью интактные и активные аллели HERV все же либо представлены в популяциях людей с очень низкой частотой, либо встречаются с высокой частотой, но в генетически разделенных этнических группах. G. Turner et al. (2001) полагают, что их находка показывает способность HERV-K реинфицировать популяции людей в недавнем эволюционном прошлом, и что HERV-K113 реинфицирует людей даже сегодня (см. подглаву 1.3 «Реинфекция»; и подглаву 4.3« Эпидемиология LTR-ретроэлементов »).
Эволюционная роль L1 ретроэлементов. Обнаруженные в геноме современного человека L1 ретротранспозоны имеют свою собственную эволюционную историю, насчитывающую не менее 100—150 млн лет (Furano A.V., 2000; Han K. et al., 2005); т. е. в известном нам виде они существовали у класса млекопитающих еще во времена господства рептилий. Сегодня они образуют 16 различных семейств (L1PA16–L1PA1). Их активность в геноме человека значительно большая, чем HERV. Эффективно дуплицируя сам себя, L1, вероятно, играют ключевую роль в увеличении генома вида посредством размножения нетранспозируемых Alu- и SVA-элементов и образования ретропсевдогенов (см. «Эволюционная роль ретропсевдогенов»).
Структура типичного полноразмерного L1-элемента показана на рис. 8.
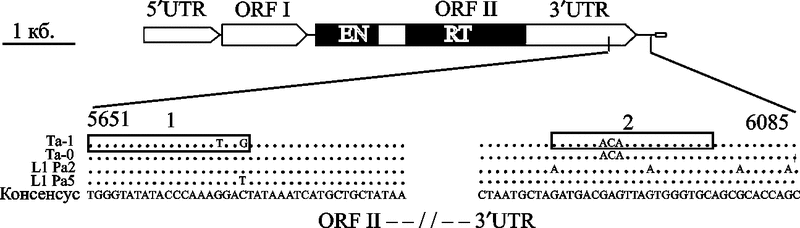
Рис. 8. Структура типичного полноразмерного L1-элемента
5’-нетранслируемый регион (5’-UTR) — является внутренним промотором транспозона, не зависящим от окружающих его нуклеотидных последовательностей. Далее идут открытая рамка считывания I (ORF I), кодирующая 40 кд (р40) РНК-связывающий белок (RNA-binding protein); короткий межгенный регион (intergenic region) протяженностью 63 п.о., содержащий стоп-кодон для всех рамок считывания (мРНК L1 атипична для мРНК млекопитающих, так как она бицистронна); и малоэффективная открытая рамка считывания II (ORF II), кодирующая L1-репликазу (L1 replicase). Она содержит три консервативных домена: NH2-терминальный домен эндонуклеазы (endonuclease, EN), центральный домен обратной транскриптазы (reverse transcriptase, RT) и COOH-терминальный цинк-шарнирный домен (COOH-terminal zinc knuckle-like domain — на схеме не показан). Далее идет 3’-нетранслируемый регион (3’-UTR), содержащий консервативный G-обогащенный полипуриновый мотив (G-rich polypurine motif). AATAAA поли А-сигнал (AATAAA poliA signal) требуется для терминации РНК полимеразы II типа (RNA polymerase II, Pol II). Геномные копии L1 обычно заканчиваются А-обогащенным участком (poliA tail, показан прямоугольником). На рисунке также показаны нуклеотидные вариации разных семейств L1-элементов (Ta-1, Ta-0, L1PA2 и L1PA5) (Ostertag E. M., Kazazian H., 2001; Boissinot S. et al., 2004).
Механизм репликации L1 аналогичен другим РНК, он включает образование транскриптов других ретроэлементов, например, Alu. У млекопитающих большинство L1 неактивны из-за вставок и точечных мутаций. Из 520 тыс. L1-ретротранспозонов генома человека только около 5 тыс. имеют полноразмерный геном. Вставочная история L1-элементов генома человека в основном написана семейством Ta-1, составляющим до 90 % их популяции. Это семейство содержит значительно большее количество полноразмерных транспозонов (full-length, FL), чем L1PA2 и L1PA5 семейства, которые считают более древними. Для интеграции Ta-1 предпочитают области с низким содержанием GC. S. Boissinot et al. (2004) нашли, что Ta-1 элементы вставлены в интроны 46 известных генов и они в два раза чаще ориентированы в антисмысловом направлении в отношении этого гена (67 %), чем в смысловом (33 %). Воздействие L1-ретротранспозонов на геном человека происходит по следующим механизмам (рис. 9):
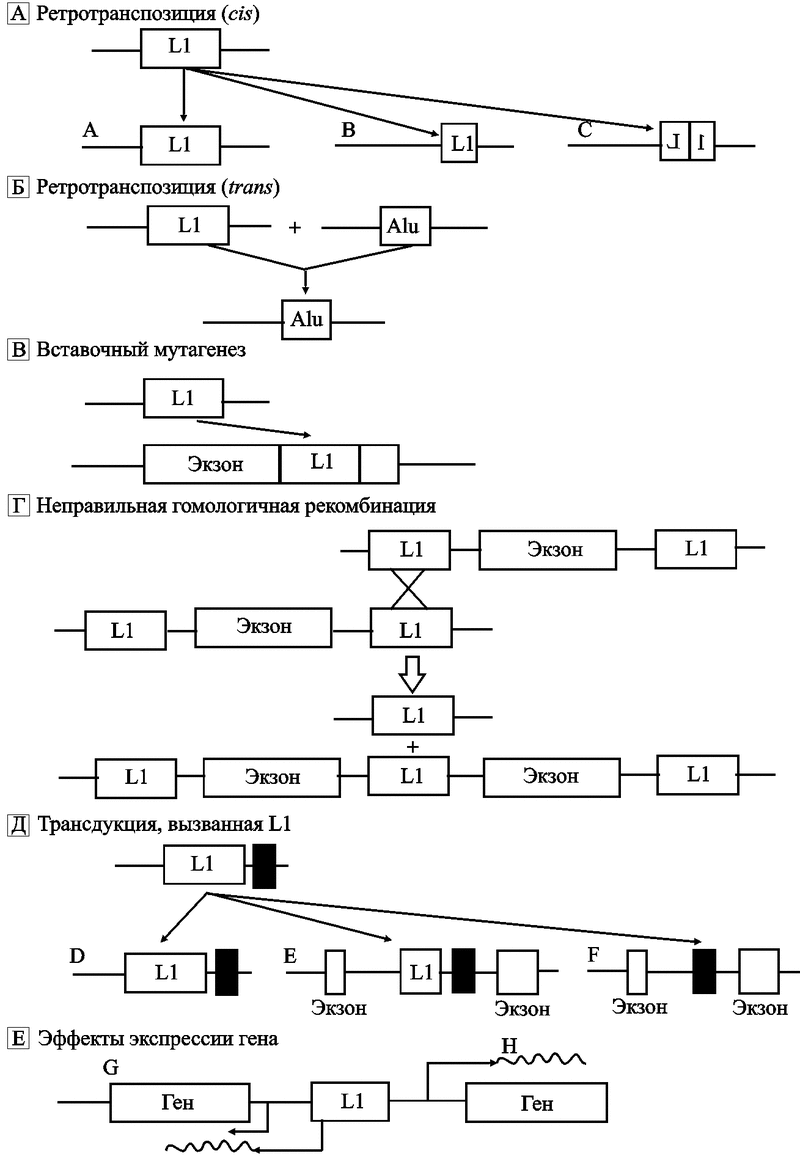
Рис. 9. Механизмы воздействия L1-ретротранспозонов на геном человека (по Ostertag E. M., Kazazian H., 2001)
(а) L-элемент распространяется по геному через транспозицию. Он копируется по принципу «copy and pasty». L-белки синтезируются с их мРНК (cis-предпочтение). Следовательно, активны только полноразмерные элементы с двумя открытыми рамками считывания. Активный L сначала транскрибируется in siti, затем его РНК обратно транскрибируется и интегрируется с геномом в новом участке. L-ретротранспозон может интегрироваться с хромосомой в виде полноразмерной копии (А). Однако часто он оказывается 5’-усеченным (В) или 5’-инвертированным и усеченным (С), образуя неактивные копии исходного ретротранспозона.
(b) отдельные неавтономные ретротранспозоны, такие как Alu, могут быть транспозированны in trans, механизмом, используемым L1, в дальнейшем способствуя увеличению размера генома.
(с) L1 случайно вставляется в последовательность гена, вызывая генетическую болезнь.
(d) L1 может вызывать генетическое поражение через дупликацию или делецию гена после неправильной гомологичной рекомбинации.
(е) РНК-полимераза L1 часто обходит принадлежащий ретроэлементу поли А-сигнал, использует такой же, лежащий по направлению транскрипции, поэтому последовательность ДНК хромосомы, фланирующая L1 3'-сайт (заштрихованный прямоугольник), может быть перенесена в другой участок генома (D). Ретропозиция 3'-экзона в другой ген, может привести к «перетасовке» экзонов (E, F). По данным J. L. Gooldier et al. (2000), приблизительно 20 % L1-вставок содержат 3'-трансдуцируемые последовательности. Обычно размер таких вставок находится в пределах 500 – 3 килобаз.
(f) Экспрессия гена может быть усилена через присутствие L1. Отдельные L1 имеют антисмысловые Pol II промоторы, которые влияют на экспрессию находящихся в непосредственной близости генов (G). Другие L1 могут выполнять функции энхансеров и регулировать гены, находящиеся на некотором расстоянии от них.
Примером участия L1-ретротранспозонов в эволюции человека по типу анагенеза является образование секретируемых форм человеческого трансмембранного белка аттрактина (attractin). L1-ретротранспозируемый элемент обеспечил преждевременный стоп-кодон и полиаденилационный сайт, ответственные за синтез усеченного растворимого аттрактина. Обе формы, трансмембранный и растворимый белки, вовлекаются в клеточные взаимодействия в течение воспалительного процесса. Таким образом, вставки L1-ретроэлементов в данном конкретном случае создали для вида Homo sapiens более тонкие механизмы регуляции воспалительных ответов (Tang W. et al., 2000).
Эволюционная роль Alu-элементов. Среди других семейств ретроэлементов, Alu наиболее многочисленны в геноме человека. Они представлены более чем 1,4 млн копий, которые соответствуют 10 % всей массы генома. Их число продолжает расти, и они встраиваются во все новые сайты с частотой примерно одно новое встраивание на 100–200 новорожденных (Аст Г., 2005).
Происхождение первых Alu-мономеров, называемых также «окаменелыми» Alu-мономерами (fossil Alu monomers, FAMs), неизвестно; и их история уходит в глубину геологического времени. Они имели размер примерно в 160 кб и в геноме человека представлены незначительно. «Современные» Alu–элементы появились не ранее чем 55 млн лет назад, фактически в эпоху «до приматов-антропоидов». Эти ретроэлементы представляют собой продукт слияния «голова к хвосту» двух различных FAM, которые дали начало димерной структуре, состоящей из двух сходных, но не идентичных мономеров (левое и правое плечо Alu), соединенных через A(аденин)-обогащенный линкер. Транскрибированная с Alu-элементов Alu-РНК является высоко структурированной, и поддерживает строгое структурное сходство со своей предковой РНК (Hasler J. и Strub K., 2006).
«Современные» Alu-повторы классифицируют в соответствии с их возрастом. Субсемейство Alu J было активно в период дивергенции приматов на его основные классы. Субсемейство Alu S наиболее активно амплифицировалось в геноме приматов в период появления первых антропоидов, т. е. приблизительно 40 млн. лет назад. Alu Y — самые «молодые» из них. Они по-прежнему активны в отдельных семействах человекообразных приматов (Quentin Y., 1988). В геноме человека все Alu-вставки приходятся на AluY субсемейство или его производные. Из них наиболее представлены AluYa5 и AluYb8 субсемейства, 25 % и 38 % локусов, соответственно (Hedges D. J. et al., 2004).
D. J. Hedges et al. (2004) нашли двукратное увеличение вставок Alu у людей, по сравнению с их количеством у шимпанзе (Pan. troglodytes). Но уровень различий Alu, интегрировавшихся с геномом шимпанзе, в 1,7 раз выше, чем у людей (рис. 10).
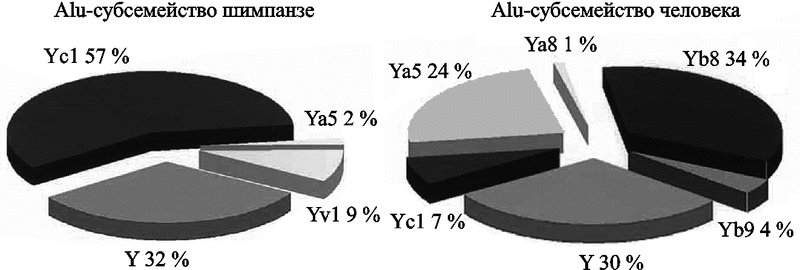
Рис. 10. Субсемейства Alu, представленные в геноме человека (справа) и шимпанзе (слева). По работе D. J. Hedges et al. (2004)
D. J. Hedges et al. (2004), также как и P. Jern et al. (2006), обнаруживших разные сценарии активности эндогенных ретровирусов у людей и шимпанзе, пришли к выводу, что Alu-элементы у людей уже несколько миллионов лет проявляют значительно большую эволюционную активность, чем у шимпанзе (см. «Эволюционная роль HERV-K»). Распределение Alu-повторов по геному человека весьма неравномерно как между хромосомами, так и по их длине. В хромосомах 14, 16, 21 Alu-последовательности концентрируются в области центромеры, а в хромосомах 4, 19, 20, Х и Y человека выраженные кластеры Alu-повторов не найдены (рис. 11 и 12).
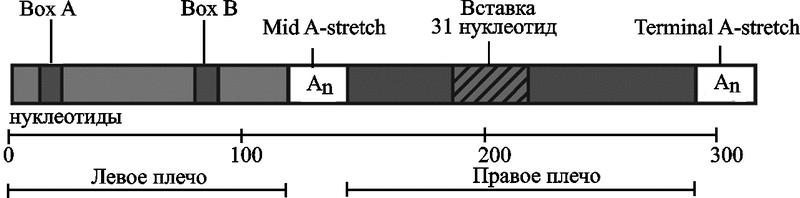
Рис. 11. Архитектура Alu-элемента
Размер Alu-повтора около 300 п.о. В 170 п.о. от начала элемента расположен сайт узнавания рестриктазой AluI (отсюда и его название). Повтор имеет характерную димерную структуру. Состоит из двух похожих, но не эквивалентных прямых повторов длиной около 130 п. о. – левое и правое плечи (left and right arms). Правое плечо содержит вставку из 31 нуклеотида, богатую аденином. Плечи разделены A-богатым регионом (Mid A-stretch), правое плечо закачивается коротким poly(A)-хвостом (terminal A-stretch). Левое плечо содержит функционирующие, но слабые A и B боксы (boxes) внутреннего промотора РНК-полимеразы III (по Hasler J. и Strub K., 2006).
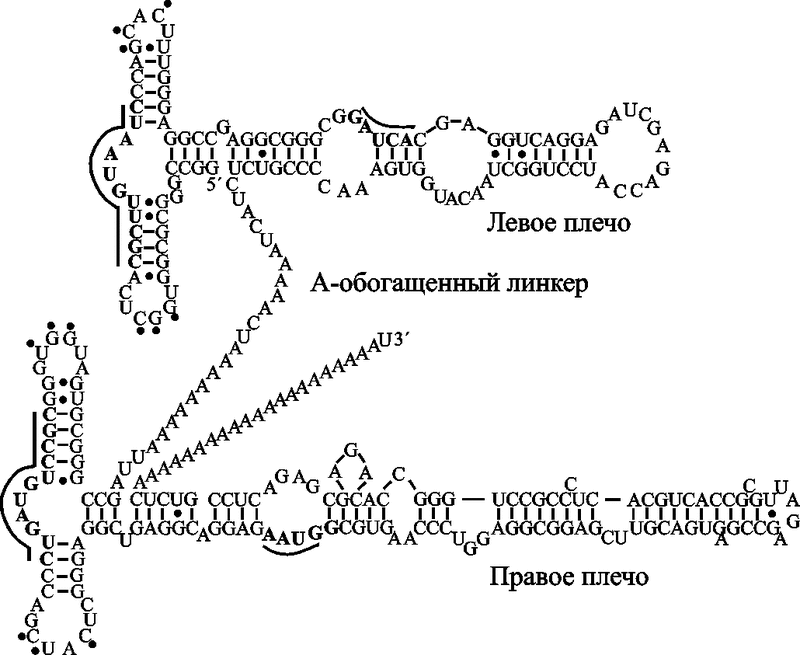
Рис. 12. Вторичная структура Alu-РНК
Подчеркнутые буквы и точки показывают связывающие сайты SRP9/14 и спаривание оснований третичной структуры между двумя петлями, соответственно. Типичная Alu-РНК представляет собой димер сходных, но не эквивалентных плеч, которые соединены через А-обогащенный линкер (Weichenrieder O. et al., 2000).
Alu-элементы амплифицируются через РНК-производное посредством механизма ретротранспозиции, зависящего от других транспозонов (например, LINE-1). Сами они не кодируют генов белков.
К настоящему времени установлено их участие в следующих процессах, способствующих эволюции приматов по типу анагенеза.
Экзонизация. Из тысяч Alu-ретроэлементов, найденных в интронах генов человека, значительная часть их последовательностей полностью или частично представлены в кодирующих регионах мРНК. Некодирующие участки мРНК тоже не остаются без внимания ретроэлементов – см. «A–I редактирование».
Присутствие отдельных потенциально подверженных сплайсингу сайтов в Alu-консенснусных последовательностях дает основание предположить, что они были вовлечены в кодирующий регион через экзонизацию — процесс образования экзонов в интронных областях. Он стал возможен благодаря существованию у Alu-последовательностей участков (motifs), имеющих сходство с сайтами сплайсинга, или они образуют такой сайт посредством вариаций отдельных нуклеотидов интегрировавшимся Alu-элементом (рис. 13).
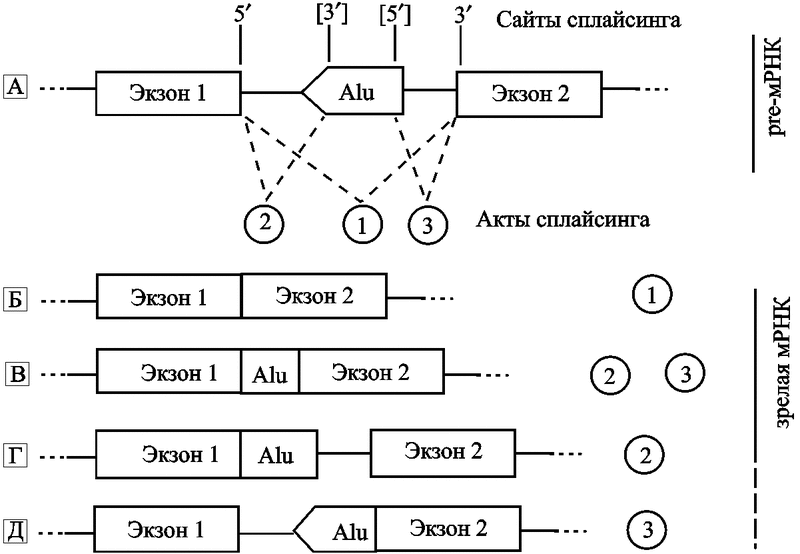
Рис. 13. Экзонизация интронов Alu-элементами
Гипотетически Alu-элементы вставляются в ориентации, которая противоположна смысловой транскрипции интронного региона гена. Этот элемент имеет мажорный 3’-сайт сплайсинга вблизи позиции 275 и мажорный 5’-сайт сплайсинга вблизи позиции 158. Использование альтернативного сайта сплайсинга Alu-элементом ведет к вариациям зрелой (матричной) РНК.
A. Pre-мРНК подвергается актам сплайсинга (1; 2; 3). 3’- and 5’-сплайсинг сайты показаны без скобок. Альтернативные сплайсинг-сайты включены в квадратные скобки.
B. Под актом 1 показан правильный сплайсинг без Alu-экзонизации.
C. Экзонизация интронного Alu-элемента через использование его 5’- и 3’-сплайсинг сайтов вместе с 5'–сплайсинг сайтом экзона 1 и 3’ сплайсинг сайтом экзона 2; результат актов сплайсинга 2 и 3. Экзонизирован только Alu-элемент.
D. Экзонизация интронного Alu-элемента посредством его 3’-сплайсинг сайта вместе с 5’-сплайсинг сайтом экзона 1; результат акта сплайсинга 2. Alu-элемент и 3’-конец интрона 2 были экзонизированы.
E. Экзонизация интронного Alu-элемента посредством использования 5’-сплайсинг сайта вместе с 3’-сплайсинг сайтом экзона 2; результат акта сплайсинга 3. Alu-элемент и 5’-конец интрона 1 экзонизированы (по Hasler J. и Strub K., 2006).
R. Sorek et al. (2002) идентифицировали подмножество альтернативных сплайсингированных внутренних экзонов, из которых до 5 % были производными от Alu-элементов, и установили, что все экзоны, содержащие Alu, образовались в результате альтернативного сплайсинга. Эти же авторы показали, что до 85 % экзонов, содержащих Alu, являются производными от антисмысловых Alu-элементов и что благодаря существующим тонким взаимодействиям между сайтами сплайсинга, некоторые мутации способны привести к повороту сплайсинга от альтернативного к конститутивному. Эволюционный процесс, приводящий к экзонизации частичные и полные Alu-элементы, представляет собой случайное совпадение мутаций.
Например, S. Singer et al. (2004) реконструировали последовательность событий, приведших к образованию альтернативного 5’-экзона гена рецептора фактора некроза человека (p75TNFR). По крайней мере, пять мутационных событий, произошедших в течение 63 млн лет эволюции приматов, оказались необходимыми для случайной экзонизации и фиксации гена p75TNFR:
1) интеграция с геном примата Alu-элемента;
2) приобретение альтернативного сайта начала транскрипции;
3) образование альтернативного стартового кодона;
4) формирование сайта сплайсинга; и только после этого;
5) случайная, в 7 нуклеотидов, делеция привела к образованию открытой рамки считывания.
На рис. 14 суммированы результаты M. Krull et al. (2005), полученные ими при оценке возраста четырех генов и ранее описанного Singer et al. (2004) гена p75TNFR.
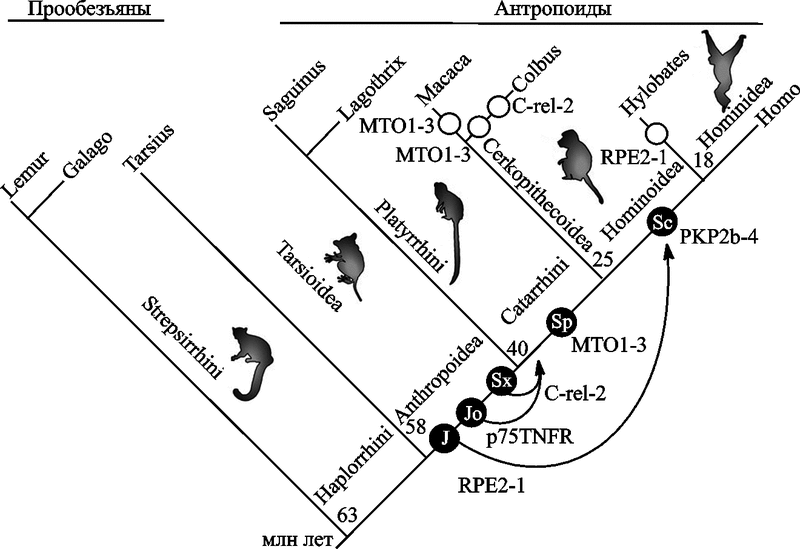
Рис. 14. Оценка возраста интеграционных актов пяти исследованных Alu-элементов и их аффинации в субклассы
Интеграционные акты показаны в виде черных кружков с белыми надписями, указывающими субсемейства Alu. Стрелками показано спроецированное время экзонизации в миллионах лет после интеграции Alu. Вероятное полное аннулирование экзонизации этих же генов для Cercopithecoidea и Hylobates показано открытыми кольцами. Феномен аннулирования экзонизации уже сам по себе свидетельствует не только о возможности «прогрессивной эволюции» под воздействием процессов, в которых участвуют ретроэлементы, но и, наоборот, о возможности регресса вида и его замещения более примитивными эволюционными ветвями.
Ген RPE2-1 (ribulose-5-phosphate-3-epimerase transcript variant 2) у людей найден в пределах хромосомы 2q32-q33.3.
Ген C-rel-2 (изоформа C-rel прото-онкогенного протеина) у людей расположен в хромосоме 2p13-p12.
Ген MTO1 (mitochondrial translation optimization gene homolog) у людей расположен в хромосоме 6q13.
Ген PKP2 (plakophilin) у людей расположен в хромосоме 12p11.
Судя по этим данным, большинство из экзонизированных элементов интегрировались с геномом приматов перед их дивергенцией на антропоидов. В локусе p75TNFR отдельные изменения последовали за интеграцией через период в несколько миллионов лет, рекрутировавшие эти последовательности как экзоны и зафиксировавшие их в линии, ведущей к Сatarrhines. Теоретически Alu-элементы, ретропозировав в MTO1-3 и в PKP2-4, могли проявить активность немедленно после интеграции. Ретропозированный в MTO1-3 Alu-элемент изначально обладал необходимой последовательностью для альтернативного сплайсинга. В случаях RPE2-1 и PKP2b-4, вставки Alu-элементов были активированы криптическими (cryptic — загадочный) 5’- или 3’-сплайсинг-сайтами в интронных последовательностях, которые в случае с PKP2b-4 привели к дополнительной экзонизации рандоминизированной (randomized) интронной последовательности. Более подробно эти наблюдения описаны в работе M. Krull et al. (2005).
Вставки Alu-экзонов вводят преждевременные терминальные кодоны или рамки считывания, а сами Alu-элементы генома человека действуют как очень большой резервуар альтернативных экзонов. В большинстве случаев экзонизированные последовательности являются либо нейтральными мутациями, либо проявляются вредным действием для отдельной особи, но это их влияние на особь незначительно, так как новый альтернативный продукт сплайсинга составляет только небольшую часть продукта обычного сплайсинга зрелой мРНК.
A–I редактирование. Редактирование РНК — процесс, посредством которого нуклеотидные последовательности молекул РНК изменяются во время транскрипции и после нее. Модификация РНК включает нуклеотидные вставки и делеции, и модификации оснований. Наиболее эффективным приемом модификации оснований является реакция гидролитического деаминирования, посредством которой цитозин конвертируется в урацил; а аденозин (А) в инозин (I), другое название процесса — A–I редактирование. Эта реакция в условиях in vivo катализируется ферментами семейства аденозиндезаминаз (adenosine deaminase, ADAR), предпочтительно редактирующих аденозин, расположенный в двуцепочечном регионе молекулы РНК (Valente L., Nishikura K., 2005) (рис. 15).
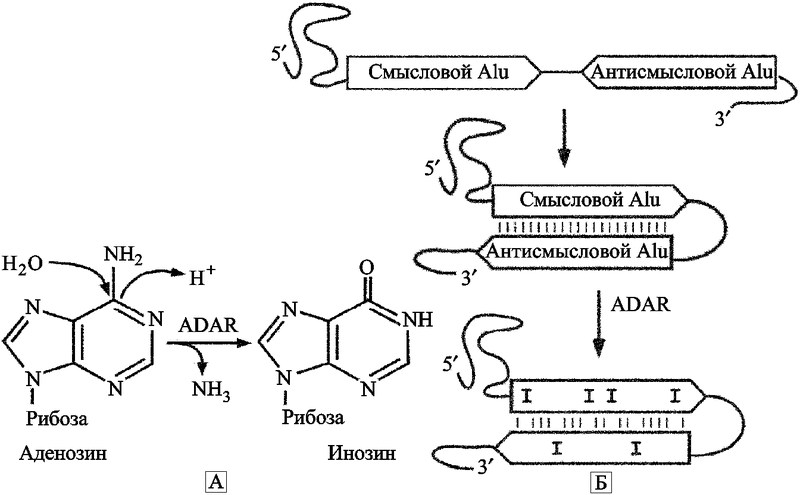
Рис. 15. A–I редактирование в Alu-элементах
(A) Реакция деаминирование аденозина через ADAR, ведущая к образованию инозина.
(B) Внутримолекулярное спаривание оснований двух мРНК, содержащих Alu-элементы в противоположной ориентации. Спаривание оснований двух Alu-элементов приводит к формированию длинного стабильного двунитевого РНК-региона, в котором ADAR выполняет замену A на I. Редактирование является удачным, когда дистанция составляет <2 кб разделенными двумя Alu-элементами в противоположной ориентации. Два близко вставившихся Alu-элемента становятся идеальным субстратом для ADAR (по Hasler J. и Strub K., 2006).
Точная роль A–I редактирования в метаболизме клеток неизвестна, но она жизненно необходима для реализации клеточного цикла. Было показано, что нокаут (knockout – выбивать, испортить) гена ADAR1 эмбрионов мышей приводит к летальному эффекту через разрушение печени (Hartner J. C. et al., 2004). Замена A на I является широко распространенным механизмом редактирования РНК. Более 90 % всех A–I замен происходят в пределах Alu-элементов, содержащихся в мРНК. Установлено что A–I редактирование предпочтительно встречается в некодирующих регионах мРНК. А так как ADAR-ферменты не являются специфичными для двунитевой РНК определенных сайтов, то граничащие с Alu основания также часто подвергаются редактированию.
РНК-редактирование может серьезно воздействовать на экспрессию генов на отдельных этапах жизненного цикла клетки. Так как инозин не может спариваться с урацилом, а только с цитозином, то редактирование может воздействовать на стабильность молекулы РНК посредством создания и разрушения вторичных структур. Когда инозин будет распознан как гуанозин, то посредством аппарата трансляции и сплайсинга A–I редактирование способно привести к аминокислотным заменам в кодирующей последовательности, или к модификации сайта сплайсинга в интроне, приводя к преждевременной терминации транскрипции или к искажению рамки считывания гена белка.
Участие в трансляции белков. С начала 1990-х гг. известно, что Alu РНК, транскрибированная с ДНК Alu-элементов, постоянно представлена в цитозоле клеток приматов. Хотя Alu-элементы и содержат внутренние A и B боксы промотора РНК полимеразы III, но этот внутренний промоторный элемент слишком слаб для осуществления эффективной транскрипции Alu-элементов. В обычных условиях Alu РНК представлена в очень низком количестве копий в цитозоле (103–104 молекулы на клетку). В стрессовых же условиях, таких как вирусная инфекция, экспозиция циклогексемидом или тепловой шок, уровень их экспрессии значительно увеличивается. Alu-элементы имеют высокий потенциал модуляции генной транскрипции посредством связывания отдельных транскрипционных факторов. Alu РНК выполняет какую-то специфическую функцию в клеточном метаболизме, и необходима для выживания клетки в условиях стресса, а транскрибируемая с ДНК Alu-элементов «утиль РНК» («junk RNA») участвует в процессах клеточного метаболизма. Первичные Alu-элементы были не более чем «эгоистичной ДНК» (см. «Проретроэлементы и проретровирусы»), но давление естественного отбора адаптировало их в геноме через закрепление за ними важных функций в регуляции генной экспрессии. Этот выигрыш регуляционной функции, известный как экзаптация (exaptation), участвовал в эволюции приматов по типу кладогенеза и помог их дивергенции среди других млекопитающих (Brosius J., Gould S. J., 1992).
ARE. Значительная часть мРНК млекопитающих в 3'-нетранслируемых регионах (untranslated regions, UTR) представлена последовательностями, содержащими аденин-урацил-обогащенные элементы (adenine and uracil rich elements, AREs). Такие мРНК-последовательности обычно стабильны. Однако в последние годы обнаружены их разновидности, производные от Alu, уменьшающие стабильность мРНК и приводящие ее к распаду. Alu-повторы составляют до 5 % 3' UTR последовательностей мРНК. На рис. 16 показан возможный механизм образования ARE.
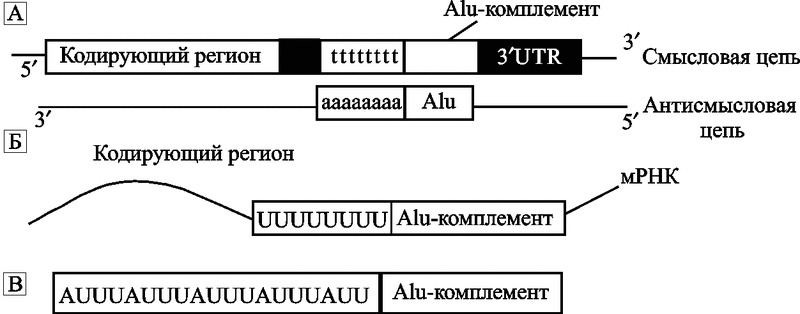
Рис. 16. Схематическое изображение образования ARE
(A) Alu содержат poly-adenine (poly-A)-регион в концевой части. На схеме он показан как «aaaaaaaa» (также см. рис. 10). Poly-A Alu в антисмысловой ориентации становится poly-T (комплементарной poly-A) в смысловой цепи ДНК. Эта последовательность показана как «tttttttt».
(B) Теперь, после транскрипции poly-T-региона, мРНК содержит poly-uracile (poly-U)-регион.
(C) AU-обогащенные элементы находят именно в этих poly-U-регионах (B) (по Hyeong Jun An et al., 2004).
Hyeong Jun An et al. (2004) обнаружили, что не менее половины наиболее протяженных ARE являются производными от (poly-T)-регионов, комплементарных (poly-A)-регионам Alu. Они предположили, что Alu не только участвуют в экспрессии 5'-генов и, в альтернативном сплайсинге интронных регионов генома, но и перемещаясь по геному через ретропозицию (см. «Эволюционная роль L1 ретроэлементов»), они способны увеличивать или сокращать период полураспада мРНК (особенно в области 3' UTR) через образование ARE. Это еще один и, видимо, далеко не последний, из механизмов воздействия на экспрессию отдельных генов, обусловленный активностью ретроэлементов.
Эволюционная роль ретропсевдогенов. В геноме человека имеется более 20 тыс. псевдогенов — «молчащих» копий известных генов. «Ретропсевдогенез» — это процесс образования псевдогенов через обратную транскрипцию с мРНК. Вследствие утраты регуляторных элементов ретропсевдогены почти всегда функционально неактивны, начиная с того самого времени, когда они впервые внедрились в хромосомную ДНК. По этой причине они обычно не подвергаются природной селекции и, следовательно, являются идеальным объектом для изучения нейтральной эволюции (Csuros M., Miklos I., 2005). Например, по нуклеотидным различиям в псевдогенах цитохрома С. Grossman et al. (2001) показали ускоренную эволюцию этого белка в период формирования предка человекоподобных приматов 40 млн лет назад.
Ретропсевдогены могут участвовать в образовании ретроэлементов, что продемонстрировали K. Szafranski et al. (2004), использовавшие в качестве экспериментальной модели одноклеточный эукариотический организм — Dictyostelium discoideum. Эта саркодовая амеба содержит семейство LINE-подобных ретротранспозонов, специфически интегрирующихся с генами тРНК (TRE-элементы). Исследователями было установлено, что ретротранспозированный рибосомальный 5S(r5S)-РНК-псевдоген в геноме D. discoideum содержит в своем 3’-концевом участке 8-bp последовательность, производную от 3’-конца TRE и полиаденилового хвоста. Ретропсевдоген фланкирован через дупликации, имеющие сайт узнавания (target-site duplications), которые характерны для TRE, и вставляются «выше» гена тРНК, точно также, как типичный TRE. r5S-ретропсевдоген имеет структурные особенности SINE, но он не может быть амплифицирован, вероятно, вследствие 5’-усечения, которое происходит во время инициации транспозиции. Обнаружение такого ретропсевдогена означает то, что SINE могут создаваться de novo путем обратной транскрипции LINE-транскриптов, если кодируемая LINE обратная транскриптаза диссоциирует от LINE РНК и «перескакивает» к другим клеточным РНК, транскрибируемым РНК-полимеразой III (см. «Классификация транспозируемых ретроэлементов»). K. Szafranski et al. (2004) предположили, что высокая концентрация транскриптов генов полимеразы III в ядре клетки может способствовать переключению обратной транскриптазы на создание новых SINE. Эти короткие вставочные элементы и другие копии фрагментов геномной ДНК будут занимать новые участки в хромосоме, приводя к модификации уже существующие гены.
Однако роль самих псевдогенов в эволюции еще только выясняется. Обращает на себя внимание и то обстоятельство, что их количество в геноме многих современных позвоночных на порядки превышает количество активных генов-предшественников. Например, число псевдогенов В-тубулина человека превышает количество функционирующих генов этого белка в 10 раз; а число псевдогенов глицеральдегид-3-фосфатдегидрогеназы мышей превышает количество активных генов этого фермента в 200 раз. К тому же дальнейшая судьба гена после его псевдогенизации не предполагает его участия в эволюции таксона. По данным D. Graur D. et al. (1989), после того как ген теряет свою функцию (т.е. становится псевдогеном), он подвергается воздействию двух процессов, обычно относимых учеными к проявлениям нейтральной эволюции.
Первый включает в себя быстрое накопление точечных мутаций и неизбежно стирает сходство последовательностей псевдогена и его функционального гомолога, который эволюционирует гораздо медленнее. Нуклеотидный состав псевдогена будет становиться все более и более похожим на состав его нефункционального окружения, он будет «смешиваться» с этим окружением. Этот процесс получил название композиционной ассимиляции. Второй процесс характеризуется тем, что псевдоген становится все короче по сравнению с функциональным геном. Сокращение его длины вызывается преобладанием делеций над инсерциями.
Оценки показывают, что процессированные псевдогены млекопитающих теряют около половины своей ДНК примерно за 400 млн лет. Но первые млекопитающие появились значительно позже, т.е. этот процесс начался еще при появлении первых позвоночных. Геном человека, например, все еще содержит основные участки ДНК псевдогенов, найденные у самых отдаленных предков. Следовательно, процесс образования псевдогенов — это торможение эволюции таксона. По своему биологическому значению он противоположен ретровирусной эволюции и уравновешивает ее (более подробно см. в подглаве 2.3).
Прекращение инвазии транспозируемых элементов. Геном человека содержит следы многих «угасших» семейств транспозируемых элементов. Каким образом происходит такое «угасание», изучено плохо, но сам феномен зафиксирован.
Основной причиной «угасания» любого семейства транспозируемых элементов может стать уменьшение скорости его пролиферации ниже порогового уровня, зависящего от темпа мутационных замен нуклеотидов (per-nucleotide mutation rate) в геноме хозяина (Nuzhdin S. V., 1999). Высокий темп мутаций генома хозяина может не рассматриваться слишком серьезно в качестве фактора риска для утраты копиями ретровирусов свой функциональности при высокой скорости их транспозиции. Но если в дальнейшем скорость транспозиции ретроэлементов под воздействием каких-либо клеточных механизмов снизится или возрастет скорость появления мутаций в геноме хозяина, то пороговый уровень накопления мутаций для транспозируемых элементов, за которым они уже не смогут существовать, будет пройден (Lopez-Sanchez P. et al., 2005).
Другой механизм «угасания» семейства транспозируемых элементов заключается в фиксации рестриктирующих их факторов у вида-хозяина. Геном хозяина имеет приобретенные за более чем миллиард лет совместной эволюции стратегии противодействия транспозируемым элементам и вирусам. Одна из наиболее использованных и простых моделей для анализа таких взаимоотношений между транспозируемыми элементами и геномом хозяина разработана на модели Drosophila. В лабораторных линиях D. melanogaster активны различные семейства транспозируемых элементов дрозофил. Были показаны как линии Drosophila, несущие пермиссивные аллели, специфически ослабляющие контроль со стороны хозяина над количеством копий соответствующего семейства транспозируемых элементов, так и стабильные линии, несущие аллели, ограничивающие транспозицию транспозируемых элементов. Репрессивное состояние, специфичное для данного семейства, может быть установлено посредством гомологично-зависимых trans-молчащих механизмов (homology-dependent trans-silencing mechanisms), запущенных либо посредством транскрипционального (инактивация промотора), либо посттранскрипционального (деградация специфических последовательностей РНК, sequence-specific RNA degradation) блокирования генов. Наиболее хорошо охарактеризованными механизмами, ограничивающими амплификацию экзогенных и эндогенных вирусов, являются те, которые нарушают их связывание с рецепторами на поверхности чувствительных клеток; и цитоплазматические ферментативные системы, редактирующие РНК/ДНК (cytoplasmic RNA/DNA editing enzymes).
Как только частота рестрицирующих аллелей у вида возрастает до определенного порогового уровня, соответствующее семейство транспозируемых элементов подавляется за относительно небольшое количество генераций. Поэтому возможно его «внезапное» «угасание», разумеется, в масштабах «геологического времени». Такое событие случилось с семейством ERV9, «пресекшимся» в геноме наших эволюционных предков перед самым их разделением на линии шимпанзе и человека. После активного транспозирования в геноме приматов в течение почти 32 млн лет процесс терминации семейства уложился приблизительно в 100 тыс. лет (5000 генераций) (Costas J., Naveira H., 2005).
***
В настоящее время накоплено уже достаточно данных, позволяющих утверждать, что ретротранспозируемые элементы и ретровирусы активно проявили себя в эволюции приматов-гоминоидов. Эволюционные процессы с их участием не только начались задолго до образования современных видов гоминоидов, но они создали определенный генетический «задел на будущее», предопределяя альтернативы дальнейшей эволюции человека в рамках своего систематического класса и вне зависимости от его собственных намерений. Эндогенизация ретровирусов происходила на фоне массовых эпизоотий, сопровождавшихся вымиранием отдельных видов приматов, в том числе и гоминоидов. У предков шимпанзе и предков человека уже не менее 5 млн лет функционируют разные эндогенные ретроэлементы с разными сценариями активности. Одному из таких «сценариев» вид Homo sapiens обязан своим происхождением в качестве «мыслящего». Процессы образования псевдогенов и прекращения инвазии транспозируемых элементов представляют собой некую «систему сдержек и противовесов» ретровирусной эволюции.
Метки: чума
