Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений: монография. 3.8. Натуральная оспа, оспа обезьян
Микробиология возбудителя натуральной оспы. Таксономия и происхождение возбудителя натуральной оспы. Экология и естественная эпидемиология возбудителя натуральной оспы. Экология и естественная эпидемиология возбудителя оспы обезьян. Оспа коров. Восприимчивость к возбудителю натуральной оспы людей и животных. Восприимчивость к возбудителю оспы обезьян у животных. Иммунитет к поксвирусам. Устойчивость возбудителя натуральной оспы во внешней среде. Антивирусные препараты. Обнаружение генетически измененных штаммов ортопоксвирусов. Патогенез ортопоксвирусных инфекций. Клиническая и патологоанатомическая картина натуральной оспы у человека при естественном инфицировании. Клиническая и патологоанатомическая картина оспы обезьян у человека при естественном инфицировании. Клиническая картина и патоморфология натуральной оспы и оспы обезьян у животных при искусственном инфицировании. Клиническая картина натуральной оспы у людей при искусственном инфицировании. Диагностика искусственного поражения возбудителем натуральной оспы. Иммунопрофилактика натуральной оспы. Профилактика после экспонирования к ВНО и ВОО и лечение развившейся болезни.
Библиографическое описание. Супотницкий МВ. Натуральная оспа, оспа обезьян. В кн.: Супотницкий МВ. Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений. М.: "Кафедра", "Русская панорама"; 2013. С. 834–886.
Натуральная оспа (Variola major, Variola vera, Smallpox, Die Pocken, Blattern) — острая высококонтагиозная вирусная болезнь. В типичных случаях характеризуется общей интоксикацией, лихорадкой, высыпаниями на коже и слизистых оболочках, последовательно проходящими стадии пятна, пузырька, пустулы, корочки и рубца. Вызывается вирусом натуральной оспы (ВНО; Variola virus, VAR, VARV). По вирулентности для людей ВНО делится на два подвида: Variola major (летальность среди заболевших людей колеблется в пределах от 5 до 40 %); и Variola minor или алястрим (летальность 0,1-2 %) х . Вспышки малой оспы отмечались параллельно и независимо от таковых большой оспы. Люди, выживающие после натуральной оспы, могут частично или полностью терять зрение, и у них на коже остаются рубцы в местах бывших язв. ВНО относится к семейству Poxviridae, подсемейства Chordopoxviridae, рода Orthopoxvirus. Других природных хозяев, кроме человека, для ВНО не установлено. Поэтому при естественном заражении наиболее вероятным источником вируса для человека является другой человек, больной натуральной оспой. До конца 1950-х гг. военными специалистами ВНО не рассматривался в качестве агента БО. Т. Розбери, Э. Кабат (1955) в своем докладе, представленном Национальному исследовательскому совету США в 1942 г., писали, что ВНО непригоден для ведения войны из-за всеобщей и регулярно проводимой вакцинации войск и населения. Кроме того, в эти годы не существовало технологий получения ВНО в количествах, достаточных для боевого применения. Основным способом получения ВНО было выращивание на хорионаллантоисной оболочке (КАО) развивающихся куриных эмбрионов. Способ позволял получать чистую культуру вируса и поддерживать его в лабораторных условиях, но не более. Только после появления в 1956 г. технологий культивирования ВНО в культурах клеток, его стали упоминать в специальной литературе в качестве агента БО, способного «пробить» высокой дозой иммунитет у человека, созданный вакцинацией (Ротшильд А., 1966). С 1980 г. массовая вакцинация против натуральной оспы отменена и в настоящее время восприимчивость населения к ВНО повсеместная.
Российские санитарно-эпидемиологические правила СП 1.3.2322-08 относят ВНО к I группе патогенности. По степени важности для национальной безопасности США возбудитель натуральной оспы относится к биологическим поражающим агентам категории А (см. табл. 2.2). Военными специалистами он рассматривается в качестве потенциального поражающего агента БО из-за низкой инфицирующей дозы для людей; устойчивости к высушиванию и длительному хранению, и при переводе в аэрозоль. Уже само слово «оспа» обладает большим психологическим эффектом. Упоминание в СМИ о появлении натуральной оспы в каком-то населенном пункте способно вызвать панику среди его населения и социальные эксцессы.
В настоящее время натуральная оспа считается ликвидированной болезнью, официальные коллекции ВНО находятся только в двух лабораториях: Centers for Disease Control and Prevention (CDC; Атланта, США) и в Федеральном бюджетном учреждении науки «Государственный научный центр вирусологии и биотехнологии «Вектор»» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Новосибирск, Россия) 1 .
Оспа обезьян — зооноз, природно-очагововая вирусная болезнь, клинически почти не отличается от натуральной оспы. Характеризуется лихорадкой, общей интоксикацией и появлением экзантемы, сходной с высыпаниями при натуральной оспе. Вызывается вирусом оспы обезьян (BOO; Monkeypox virus, MPVMPXV). Известны два геномных варианта этого вируса. ВОО является близкородственным ВНО и вирусу осповакцины (BOB; Vaccinia virus, W, VACV), но его эволюционная история не связана ни с ВНО, ни с BOB (Douglass N., Dumbell К., 1992). Первичный резервуар ВОО не установлен (Hughes A. L. et al., 2010).
Впервые ВОО выделен в 1958 г. в Копенгагене от азиатских обезьян, содержащихся в зоопарке, и поначалу считался лабораторной редкостью. В 1970 г. было установлено, что ВОО вызывает в тропической Африке у людей болезнь, похожую на натуральную оспу. На фоне побед над ВНО, эти случаи казались досадным недоразумением. Считалось, что оспа обезьян малоконтагиозна и большой опасности не представляет. Однако позднее, вопреки всем своим прежним заявлениям о прекращении глобальной иммунизации против оспы, ВОЗ возобновила иммунизацию населения тропических регионов Африки и продолжала ее до середины 1990-х гг., когда из-за резко возросшего числа ВИЧ-инфицированных иммунизация населения живыми вакцинами стала невозможна в принципе (Cohen J., 1997). В 1990-х гг. в регионе активизировалась оспа обезьян. В небольшой заирской деревушке в районе Котако-Комба оспой обезьян заболели 42 жителя из 346, трое из них погибли. Установлен больной, ставший источником каскада передач вируса 8 жителям, что уже сопоставимо с контаги-озностью натуральной оспы. Все заболевшие ранее не были иммунизированы оспенной вакциной (Mukinda V. et al., 1997). Но и после этого случая оспа обезьян не рассматривалась как потенциальная угроза за пределами Африки. Это мнение изменилось в 2003 г., когда ВОО был завезен в США вместе с дикими африканскими грызунами и распространился среди людей в 11 штатах, вызвав 82 случая болезни (Chastel С., 2009). Естественное инфицирование ВОО в России возможно в результате контакта с контрабанды) завезенными из тропических лесов Центральной и Западной Африки ди-коживущими белками и обезьянами.
С целью поражения людей наиболее вероятно применение ВНО и ВОО посредством использования линейных и многоточечных источников аэрозоля, и диверсионными (террористическими) методами. Террористами ВОО может использоваться для имитации вспышек натуральной оспы. Клинику, напоминающую натуральную оспу, у иммунодефицитных людей может вызвать вирус оспы коров.
Микробиология возбудителя натуральной оспы. ВНО размножается в развивающихся куриных эмбрионах при различных путях введения: на ХАО, в амнион, желточный мешок и аллантоисную полость. Использование куриных эмбрионов позволило впервые выделить вирус оспы в чистой культуре и поддерживать его в лабораторных условиях. В результате заражения ВНО на ХАО образуются характерные белые точечные, куполообразные, резко отграниченные поражения (рис. 3.87).
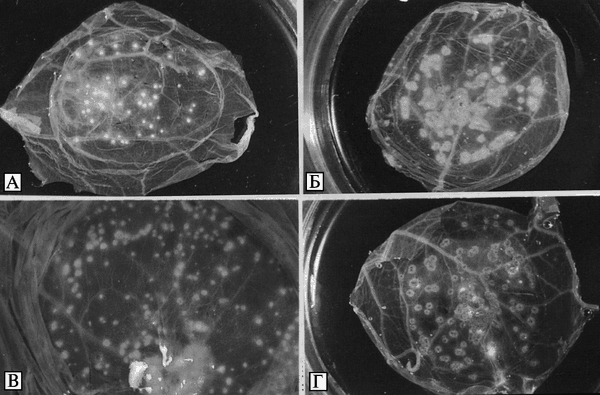
Рис. 3.87. Внешний вид оспенных пустул (pocks) на поверхности хорионаллантоисной оболочки, образованных различными видами Orthopoxvirus. Пустулы ВОО фотографировали после инкубирования в течение трех сут при температуре 35 °С; остальные — после инкубирования в течение трех сут при 36 °С. A. Variola major virus. Б. Vaccinia virus (штамм Листера). В. Monkeypox virus (штамм Копенгаген). Г. Cowpox virus (штамм Brighton). Размер пустул, образованных ВНО на ХАО, находится в пределах 0,3-06 мм. По F. Fenner et al. (1988)
Оптимальная температура для размножения ВНО в куриных зародышах 35 °С. При температуре 37 °С размножение вируса замедляется. Предельная температура развития на ХАО для Variola major — 38,5 °С; для Variola minor — 37,5 °С. При этом уменьшается размер и плотность оспин. Большинство штаммов ВНО не вызывает гибели куриных зародышей при первичном заражении, однако при последовательных пассажах происходит адаптация вируса, проявляющаяся в приобретении им патогенности для зародыша и изменении характера поражений.
ВНО размножается в тканевых культурах, вызывая развитие цитопатического эффекта. Характер цитопатического действия вируса алястрима не отличается от такового у Variola major , однако его накопление в культуре происходит медленнее. К действию вируса чувствительны культуры различных тканей человека и животных. При этом существенного значения не имеют возраст и восприимчивость к действию вируса вида животного, от которого получена ткань, характер культуры (первичная или перевиваемая), особенности ткани (нормальная или злокачественная) и способ ее приготовления (эксплантат, однослойная или взвешенная культура). Отличается лишь характер цитопатического действия: в первичных культурах вирус вызывает с самого начала деструктивные изменения, а в перевиваемых — поражения начинаются пролиферацией ткани, и только в последующем отмечается деструкция клеток.
Для большинства однослойных культур развитие цитопатического действия характеризуется появлением в неизмененном монослое очагов, в которых клетки разобщены, округлены и сильно преломляют свет. Границы клеток четко очерчены, часть клеток сильно увеличена в размере. С течением времени размер и количество таких очагов увеличиваются и в дегенеративный процесс вовлекается весь монослой. Процесс заканчивается полной деструкцией клеточного пласта и отпадением клеток от стенок пробирки. В зараженных клетках образуются цитоплазматические включения — тельца Гварниери. Тельца Гварниери формируются уже через несколько часов после заражения. В дальнейшем их количество увеличивается (как по числу включений в одной клетке, так и по количеству клеток, содержащих включения). Скорость появления включений в различных культурах клеток варьирует. Максимальное накопление вируса отмечается обычно к 72-96 ч. ВНО способен образовывать бляшки (негативные колонии) в культуре ткани с применением техники агарового покрытия и без него. Бляшки вируса в культуре клеток без агарового покрытия образуются через 72-96 ч после заражения и имеют значительно меньшие, чем у вируса вакцины, размеры (до 1 мм). В культуре клеток под агаровым покрытием бляшки вируса оспы выявляются не ранее 5-х сут с момента инфицирования культуры. Размер их не превышает 2 мм.
В культурах клеток, зараженных Variola major и Variola minor , наблюдается феномен гемадсорбции — агглютинация эритроцитов отдельных видов животных суспензиями ВНО. Наиболее вирулентные для людей штаммы ВНО (летальность заболевших 14-44 %) циркулировали в Азии. Летальность среди людей, заразившихся африканскими штаммами ВНО, составляла 5-15 %. Для штаммов ВНО, выделенных от людей из Ближневосточного региона, характерна низкая патогенность для куриных эмбрионов при термоустойчивости, практически равной таковой референс-штамму Harvey. По способности накапливаться в печени куриных эмбрионов они занимают промежуточное положение между азиатскими и африканскими штаммами. Штаммы ВНО, циркулировавшие в Бразилии, представляли собой типичные штаммы аляст-рима. Объяснения этим феноменам найдено не было (Маренникова С.С., Щелкунов С. Н., 1998).
В отличие от большинства ДНК-содержащих вирусов животных, жизненный цикл поксвирусов проходит в цитоплазме клетки в значительной степени автономно от ее ядра. Для этого они, как и бактерии (!), располагают своими ферментативными системами синтеза РНК и ДНК (рис. 3.88 и 3.89).
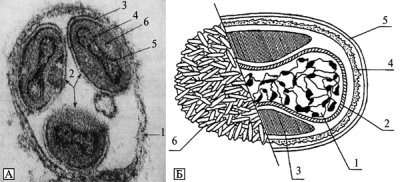
Рис. 3.88. Вирион ортопоксвируса. А. Вирион в фагосоме. 1 — мембрана фагосомы; 2 — вирионы; 3 — оболочка вириона; 4 — оболочка нуклеотида; 5 — нуклеотид; 6 — боковое тело. По П. Н. Бургасову, Г. П. Николаевскому (1972). Б. Структура внеклеточного вириона ортопоксвирусов (на примере вируса вакцины). 1 — сердцевина; 2 — мембрана сердцевины; 3 — боковые тела; 4 — поверхностная мембрана; 5 — липопротеидная оболочка; 6 — трубчатые структуры поверхностной мембраны. По С. С. Маренниковой и С.Н. Щелкунову (1998)
Вирионы ортопоксвирусов (см. рис. 3.89) адсорбируются на клетке (1) и сливаются с плазматической мембраной клетки, высвобождая сердцевины в цитоплазму (2). Сердцевины синтезируют ранние мРНК, с которых транслируются различные белки, включая факторы роста, молекулы защиты от иммунной системы, ферменты и факторы для репликации ДНК и транскрипции промежуточных генов (3). Происходит «раздевание» сердцевины (4), и вирусная ДНК реплицируется, формируя конкатемер-ные молекулы (5). Промежуточные гены транскрибируются на дочерних молекулах ДНК и с этих мРНК транслируются факторы поздней транскрипции (6). Затем транскрибируются поздние гены. С их мРНК транслируются вирионные структурные белки, ферменты и факторы ранней транскрипции (7). Сборка вирионов начинается с образования дискретных мембранных структур (8). Конкатемерные промежуточные формы вирусной ДНК разделяются на единичные геномы и упаковываются в незрелые вирионы (9).
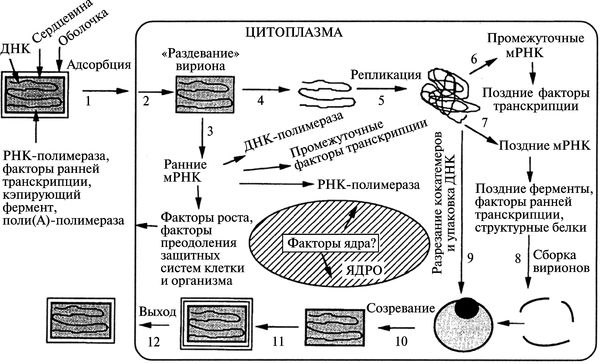
Рис. 3.89. Жизненный цикл осповирусов (на примере вируса вакцины). Вирионы содержат двуцепочечную геномную ДНК, ферменты, факторы транскрипции. По С. С. Маренниковой и С. Н. Щелкунову (1998)
Созревание приводит к образованию внутриклеточных зрелых вирионов (10). Эти вирионы покрываются модифицированными мембранами аппарата Еольд-жи и перемещаются к периферии клетки (11). Слияние таких вирионов с плазматической мембраной завершается высвобождением внеклеточного оболочечного вируса (12). Хотя размножение вируса происходит полностью в цитоплазме, факторы ядра могут быть вовлечены в процессы транскрипции генов и сборки вирионов (Марен-никова С. С., Щелкунов С. Н., 1998).
Инфекционные частицы поксвирусов содержат в своем составе полную ферментативную систему транскрипции, способную синтезировать функциональную мРНК в полиаденилированной, кэпированной и метилированной форме. Это позволяет ВНО:
1) самостоятельно осуществлять эффективную защиту от ранних специфических реакций на инфекцию и противодействовать развивающимся позже специфическим реакциям;
2) размножаться до высокого уровня, обеспечивающего быструю передачу другому хозяину.
Таксономия и происхождение возбудителя натуральной оспы. Семейство поксвирусов относится к монофилетической группе крупных ДНК-вирусов, размножающихся в цитоплазме клетки (NCLDVs — nucleocytoplasmic large DNA viruses). В эту же группу входят семейства Ascoviridae, Asfarviridae, Iridoviridae, Mimiviridae, Phycodnaviridae и Marseillevirus (рис. 3.90).
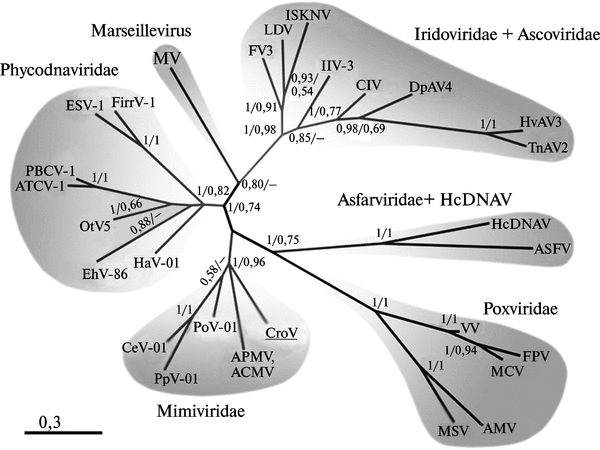
Рис. 3.90. Филогения крупных ДНК-вирусов, размножающихся в цитоплазме клетки. W — Vaccinia virus ; FPV — Fowlpox vius; MCV — Molluscum contagiosum vims; MSV— Melanoplus sanguinipes entomopoxvirus; AM Y — Amsacta moorei entomopoxvirus; HcDNAV— Heterocapsa circularisquama DNA virus. По M. G. Fischera et al. (2010)
Семейство поксвирусов подразделяется на подсемейства энтомопоксвирусов (EnPV) и хордопоксвирусов (ChPV) (Entomopoxvirinae и Chordopoxvirinae), инфицирующих насекомых и хордовых животных соответственно. ChPV дополнительно подразделяются на 8 родов (Avipoxvirus, Molluscipoxvirus, Orthopoxvirus, Capripoxvirus, Suipoxvirus, Leporipoxvirus, Yatapoxvirus и Parapoxvirus), тогда как EnPV подразделяются на 3 рода (А, В и С). Организация генома поксвирусов, их репликация, круг хозяев и патогенез хорошо изучены. Краткая характеристика геномных последовательностей отдельных штаммов ортопоксвирусов приведена в табл. 3.25.
Таблица 3.25. Краткая характеристика геномных последовательностей поксвирусов*
|
Вид |
Штамм |
Геном (п. о.) |
А + Т (%) |
ITR, Т. П. О. |
№ доступа в GenBank |
|
Хордопоксвирусы, род Orthopoxvirus (ОРУ) |
|||||
|
Вирус вакцины, Vaccinia virus (BOB, W) |
Копенгаген |
191636 |
12,0 |
М35027 |
|
|
MVA |
177 923 |
66,6 |
9,8 |
U94848 |
|
|
Тиан Тан |
189274 |
66,8 |
7,5 |
AF095689 |
|
|
Вирус натуральной оспы, Variola virus (ВНО, VAR) |
Бангладеш-1975 |
186 102 |
66,3 |
0,7 |
L22579 |
|
Индия-1967 |
185 578 |
67,3 |
Х69198 |
||
|
Гарсия-1966 |
186986 |
67,3 |
0,6 |
Y16780 |
|
|
Вирус оспы обезьян, Monkeypox vius (BOO, MPV) |
Заир-96-1-16 |
196 858 |
68,9 |
6,4 |
AF380138 |
|
Вирус эктромелии, Ectromelia virus (ЕСТ) |
Москва |
209771 |
66,8 |
AF012825 |
|
|
Нейвл (Naval) |
207 620 |
66,9 |
7,4 |
||
|
Вирус оспы верблюдов, Camelpox virus (CMPV) |
CM-S |
202185 |
66,9 |
6 |
AY009089 |
|
М-96 |
205 719 |
66,8 |
7,7 |
AF438165 |
|
|
Вирус коровьей оспы, Cowpox virus (CPV) reporipoxvirus |
Брайтон Рид |
224501 |
66,6 |
AF482758 |
|
|
Вирус миксомы, Myxoma virus (MYX) |
Лозанна |
161774 |
56,4 |
11,5 |
AF170726 |
|
Вирус фибромы Шоупа, Shope fibroma virus (SFV) |
Каза (Kaza) |
159 857 |
60,5 |
12,4 |
AF170722 |
|
Avipoxvirus |
|||||
|
Вирус оспы птиц, Fowlpox virus (FPV) |
288 539 |
69,0 |
9,5 |
AF198100 |
|
|
Capripoxvirus |
|||||
|
Вирус узелковой сыпи, Lumpy skin disease virus (FSDV) |
Нитлинг 2490 (Neethling) |
150733 |
73,0 |
2,4 |
AF325528 |
|
Вирус оспы коз, Goat pox virus (GTPV) |
Пеллор (Pellor) |
149935 |
75,0 |
2,3 |
AY077835 |
|
G20-LKV |
149695 |
75,0 |
2,2 |
AY077836 |
|
|
Вирус овечьей оспы, Sheeppox virus (SPPV) |
TU-V02127 |
149995 |
75,0 |
2,2 |
AY077832 |
|
Штамм A |
150057 |
75,0 |
2,3 |
AY077833 |
|
|
NISKHI |
149662 |
75,0 |
2,1 |
AY077834 |
|
|
Suipoxvirus |
|||||
|
Вирус оспы свиней, Swinepox virus (SWPV) |
17077-99 |
146454 |
72,0 |
3,7 |
AF410153 |
|
Molluscipoxvirus |
|||||
|
Вирус контагиозного моллюска, Molluscum contagiosum virus (MCV) |
Подтип 1 |
190289 |
36,0 |
4,7 |
U60315 |
|
Yatapoxvirus |
|||||
|
Вирус Яба-подобного заболевания, Yaba-like disease virus (YLDV) |
144575 |
73,0 |
1,9 |
AJ293568 |
|
|
Энтомопоксвирусы, Entomopoxvirus В |
|||||
|
Melanoplus sanguinipes (EnPVm) |
236 120 |
81,7 |
7 |
AF063866 |
|
|
Amsacta moorei (EnPVa) |
232392 |
81,5 |
9,4 |
AF250284 |
|
* По G. Gubser et al. (2004).
Выполненное G. Gubser et al. (2004) сравнение геномов 26 поксвирусов показало, что организация генома вирусов, входящих в подсемейство хордопоксвирусов, консервативна. Их центральная область кодирует почти идентичные белки для синтеза РНК и ДНК, белкового процессинга, сборки вирионов и структурных белков. Гены, кодируемые терминальными участками генома вирусов этого же подсемейства, более дивергентны у различных родов, у видов внутри рода и даже у штаммов одного и того же вида. Многие из этих генов кодируют белки, определяющие круг хозяев вируса, его вирулентность или взаимодействие с иммунной системой хозяина. Несмотря на выявленное сходство геномов ChPV, их длина варьирует от примерно 144 т. п. о. у вируса YLDV до 289 т. п. о. у вируса оспы птиц (FPV), а содержание А + Т варьирует от 75 % у рода Capripoxvirus до 36 % у рода Parapoxvirus (см. табл. 3.25). Геномы энто-мопоксвирусов, наоборот, более дивергентны и по расположению генов отличаются не только от CRPV, но и между различными родами EnPV.
Сравнение секвенированных поксвирусов позволило идентифицировать 90 генов, которые консервативны у всех ChPV; при включении двух EnPV это число сокращено до 49. У ChPV все 90 консервативных генов расположены в центральной области генома, содержащей 100 т. п. о.
Построенное G. Gubser etal. (2004) филогенетическое древо показывает, что ChPV составляют четыре группы вирусов. Первые две группы относятся к Molluscipox и Avipox соответственно. FPV (род Avipoxvirus) является наиболее дивергентным вирусом среди ChPV. За ним следует MCV (род Molluscipoxvirus). Авипоксвирусы являются единственными ChPV, которые инфицируют птиц, a MCV считается патогеном человека; в результате эволюции оба вируса приобрели уникальные иммуномодуляторные белки, позволяющие им противодействовать иммунной системе их хозяев.
Третья , самая большая, группа ChPV, включает роды Yatapoxvirus (YLDV), Capripoxvirus (LSDV), Suipoxvirus (SWPV) и Leporipoxvirus (SFVи MYX). Внутри этой группы SFV и MYX, которые тесно связаны друг с другом, расположены рядом с SWPV и LSDV, в то время как YLDV является более дивергентным. Геномы всех этих вирусов относительно высококонсервативны по составу генов, расположению генов и идентичности аминокислот. SWPV и LSDV произошли от общего предка.
Четвертая группа ChPV— это род ортопоксвирусов (OPV). У них более крупный геном, чем у вирусов других групп ChPV. Наиболее изученными считаются вирус вакцины (W-СОР) и вирус натуральной оспы (VAR-BSH).
G. Gubser et al. (2004) установили близкое родство CMPVи ВНО. Три штамма ВНО составляют одну группу, также как и два штамма CMPV. Группы ВНО и CMPV более тесно связаны друг с другом, чем с любым другим видом OPV. OPV отделились от общего предка позже, чем лепорипоксвирусы. При сравнении различных видов OPV установлено, что наименьшее генетическое различие существует между штаммами CMPV и ВНО, а наибольшее — между ГСТ и ВНО. Интересной особенностью геномов OPV является наличие большого количества генов, интактных у одного вируса, но фрагментированных у другого. Объяснением может служить тот факт, что некоторые OPV являются относительно новыми патогенами для их хозяев и в эволюционном масштабе времени произошли от предкового вируса сравнительно недавно, при этом их дивергенция сопровождалась специализацией паразитизма и, как следствие, «выключением» генов, не нужных в новом хозяине. На рис. 3.91 показано филогенетическое древо семейства поксвирусов, основанное на анализе сцепленных (concatenated) аминокислотных последовательностей 29 консервативных ортологичных белков.
Рис. 3.91. Филогенетическое древо поксвирусов. Таксономически наиболее близкими к ВНО являются не представляющие опасности для людей ортопоксвирусы, вызывающие оспенные заболевания у змей и верблюдов. Эволюционная история патогенного для людей ВОО не связана ни с ВНО, ни с ВОВ. По A. L. Hughes et al. (2010)
Объяснению происхождения ВНО мешает представление о натуральной оспе как о строгом антропонозе. Поэтому данные, полученные путем молекулярно-биологических исследований генома вируса, обычно исследователи пытаются увязать с археологическими данными или упоминаниями в письменных источниках о болезнях, которые они считают натуральной оспой (рис. 3.92).

Рис. 3.92. Мумия фараона Рамзеса V, умершего в 1157 г. до н. э. На коже видны следы оспенных пустул. Мумия считается достоверным археологическим подтверждением существования натуральной оспы в Древнем Египте, однако далее в глубь времени фантазия сторонников антропонозного происхождения ВНО не идет. Рисунок из книги F. Fenner et al. (1988)
В результате сопоставления столь разнородных фактов возникло противоречие в оценке частоты мутации на пару оснований/цикл репликации (mutations per base pairs per replication). Гели в первом случае (частота мутации для ДНК-вирусов оценивается в пределах от 2х10 -8 до 7х10 -7 ) исследователи предполагают, что дивергенция ВНО и Taterapox virus (инфицирует змей и грызунов в Западной Африке) от неустановленного предка произошла не ранее чем 50 тыс. лет назад; то во втором случае (предполагается частота мутации 4х 10 _6 , т. е. почти как у ВИЧ) — их эволюционная история значительно короче — 3-4 тыс. лет (Hughes A. L. et al., 2010) 2 . Но такая частота мутаций в жизненном цикле ДНК-вирусов невозможна, так как репликация их ДНК сопровождается проверочным считыванием и пострепликационной репарацией. При репликации РНК-вирусов, корректировок в синтезе РНК не происходит. Молекулы вирусной РНК реплицируются через ассиметричную транскрипцию от одной цепи, исключающую большинство корректирующих механизмов, характерных для репликации молекул ДНК ( по репликации РНК-вирусов см. работу Holland S. et al., 1982).
Разрешение данного противоречия целесообразно искать в эволюционной истории всей монофилетической группы крупных ДНК-вирусов, рассматривая историю поксвирусов только как ее частный случай и используя аналогии с семействами, чьи первичные хозяева установлены.
Семейство Mimiviridae и семейство Poxviridae — дивергирующие ветви общего для них неизвестного предка (см. рис. 3.90). Мимивирус впервые обнаружен в амебах Асапthamoebapolyphaga. Диаметр зрелых частиц достигает 400 нм (La Scola В. et al., 2003).
Его другое название — мимивирус Acanthamoeba polyphaga (Acanthamoeba polyphaga mimivirus; АРМУ). Размер вириона мимивируса сравним с размером микобактерии. Геном АРМУ вмещает 1,2 млн нуклеотидов (т. е. почти в 6 раз больше генома самого крупного хордопоксви-руса — FPV) и кодирует не менее 911 белков (Benarroch D. et al., 2006). Е. Ghigo et al. (2008) впервые продемонстрировали, что мимивирус в условиях in vitro путем классического фагоцитоза (т. е. так же как и ортопоксвирусы) инфицирует макрофаги мышей, выживает в них и успешно размножается. ДНК-топоизомеразы мимивирусов (IA, IB и IIA) сходны с аналогичными ферментами ортопоксвирусов (Benarroch D. et al., 2006). Репликация ортопоксвирусов и мимивирусов происходит аналогичным образом. Вирусы обоих семейств используют убиквитин-протеосомную систему (Teale A. et al., 2009). Другие примеры сходства мимивирусов и ортопоксвирусов можно найти в работе М. G. Fischera et al. (2010). Поэтому поиски первичных резервуаров поксвирусов целесообразно проводить там же, где их нашли для мимивирусов, т. е. среди простейших, а эволюцию поксвирусов рассматривать как дегенеративную, т. е. сопровождающуюся утратой генов вследствие их большей специализации к новым хозяевам. Более подробно о роли утраты генов в эволюции ортопоксвирусов, см. в работе R. С. Hendrickson et al. (2010). Поиск первичного резервуара вируса, предкового для ВНО и Taterapox virus и, возможно, самого ВНО, целесообразно осуществить в регионах, где произошла их дивергенция (рис. 3.93).
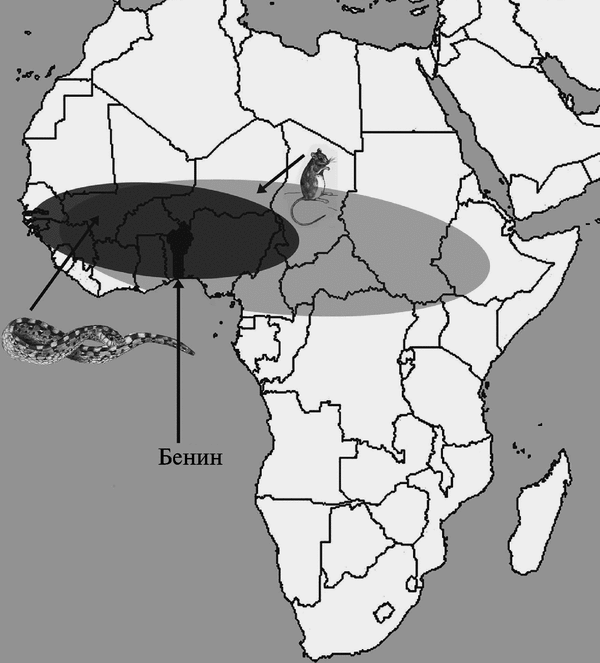
Рис. 3.93. География ареалов Т. kempi и Е. ocellatus в Африке. По О. Piskurek, N. Okada (2007)
Молекулярная эпидемиология ВНО хорошо изучена. С помощью метода изучения RFLP могут дифференцироваться ВНО, ВОВ, ВОС, CMPV, CPV Taterapox virus и другие ортопоксвирусы и устанавливаться их географическое происхождение (Loparev V. et al., 2001). Определены полные геномные последовательности большинства географических изолятов ВНО. Они объединены в базу данных для поксвирусов с открытым доступом: www.poxvirus.org (LeDuc J. М. et al., 2002).
Экология и естественная эпидемиология возбудителя натуральной оспы. Экология ВНО объявлена хорошо изученной. Сегодня принято считать, что ВНО может поддерживаться только среди людей, используя механизм воздушно-капельной передачи (см. Fenner F. et al., 1988). В качестве примера высокой контагиозности ВНО в научной литературе приводятся отдельные вспышки, которые охватывают десятки человек (см., например, работы Бургасова П. Н., Николаевского Г. П., 1972; Серенко А. Ф., 1962). Однако когда анализируются вспышки в целом и за длительный период времени, то выясняется, что способность ВНО передаваться от человека к человеку в имму-нокомпетентных популяциях ограничена. По данным V. Bhatnagar et al. (2006), обобщивших статистическую информацию по 51 вспышке «завозной» натуральной оспы, зарегистрированной в Европе и Северной Америке в период после 1945 г., в среднем каждая такая вспышка ограничивалась четырьмя случаями болезни с одним летальным исходом. Количество передач (генераций) ВНО от заболевшего человека к здоровому, редко превышало 3; а 30 % заносных вспышек вообще не сопровождалось передачами ВНО от человека к человеку. Такую незначительную способность ВНО к быстрому распространению в популяциях людей нельзя объяснить только предварительными массовыми вакцинациями, тем более что достаточно примеров массовых вспышек в вакцинированных популяциях людей (например, московская вспышка натуральной оспы 1959-1960 гг.). Вспышка натуральной оспы среди невакцинирован-ного населения Abakaliki (Нигерия) в 1967 г. ограничилась всего 31 случаем болезни (Eichner М., Dietz К., 2003). В свете этих данных невозможно понять, каким образом жестокая пандемия натуральной оспы 1870-1874 гг. вспыхнула практически одновременно на нескольких континентах (Бразоль JL Е., 1875), если не предполагать наличия первичного природного резервуара для ВНО, способного синхронно активизироваться под воздействием каких-то еще неизвестных факторов. В противоречие с распространенной точкой зрения на природный резервуар ВНО входят и данные, полученные при молекулярно-биологических исследовании генома ВНО (см. выше), свидетельствующие о циркуляции этого вируса еще «на заре» истории человечества; а также странные «родственные связи» самого ВНО. К его «ближайшим родственникам» относятся вирусы, вызывающие болезнь у змей и верблюдов, и при этом не опасные для людей (см. рис. 3.90), что говорит о случайном характере дивергенции предкового вируса и патогенности ВНО для людей. Поэтому в представлениях об экологии ВНО последнее слова еще не сказано.
Естественная эпидемиология натуральной оспы предполагает, что наиболее вероятным источником возбудителя инфекции для человека является человек. Инкубационный период болезни — 7-17 сут. Больной натуральной оспой заразен в течение всего периода заболевания, начиная с момента возникновения лихорадки, а иногда с последнего дня инкубационного периода. Наибольшая заразительность больных приходится на период вскрытия оспенных элементов на слизистой оболочке рта и зева, соответствующий 6-9 сут болезни. Вместе с тем, по данным Комитета экспертов ВОЗ по оспе, многие больные наиболее заразны на 3-4 сут болезни, т. е. к моменту появления высыпаний. Заражение может произойти от больного любой формой оспы, в том числе и оспы без сыпи. Наибольшее эпидемиологическое значение имеют тяжелые формы болезни с обильными высыпаниями. Но самыми опасными в эпидемиологическом отношении являются именно нетипичные, вариолоидные формы заболеваний оспой у привитых. Больные, заболевание у которых не диагностируется, остаются неизолированными и могут служить источником инфекции для окружающих. Они представляют особенную опасность, если среди контактирующих с этими больными оказываются не иммунные лица. В подобных случаях эпидемический процесс может затянуться на продолжительное время.
При абортивных формах болезни (вариолоид, оспа без сыпи и др.) продолжительность инфекционного периода невелика и может измеряться несколькими часами. Несмотря на то что в корках больных оспой содержатся большие количества возбудителя, наибольшее значение в распространении инфекции имеет вирус из дыхательного тракта. Основной путь передачи ВНО — воздушно-капельный: рассеивание вируса с капельками слизи и слюны при разговоре, кашле и чиханье. Меньшее значение имеет воздушно-пылевой путь: рассеивание вируса с частицами пыли, встряхивание инфицированного белья, одежды и т. д. Сохранению вируса в пылевых частицах способствует его высокая устойчивость во внешней среде. Вследствие этой особенности возбудителя, зараженные вирусом оспы вещи и предметы, могут служить источником заражения даже при их пересылке на далекие расстояния. Примером подобного рода является несколько вспышек оспы в Англии, возникших в результате заражения через инфицированный хлопок, полученный из ОАР и Индии.
Контактный путь передачи ВНО, хотя иногда и встречается, большого практического значения не имеет. Трупы погибших от оспы людей могут служить источником заражения. Описаны случаи возникновения как генерализованной оспы, так и оспы, протекающей по типу variola inoculata, у лиц, принимавших участие в аутопсии и обработке материалов, взятых от трупа. Распространение натуральной оспы может осуществляться насекомыми, которые выполняют роль механического переносчика ВНО.
Крупные вспышки завозной натуральной оспы происходят при следующих обстоятельствах: во-первых, формируется массивный первичный очаг, длительное время остающийся нераспознанным; во-вторых, последовательно формируются несколько вторичных эпидемических очагов, в том числе в крупных медицинских учреждениях, куда больные натуральной оспой поступают под ошибочными диагнозами. ВНО начинает распространяться как внутрибольничная инфекция, среди компактно размещенных по палатам больных людей, и от них переходить на посещающих их родственников и врачей. Например, во время московской вспышки 1959-1960 гг. сначала сформировался семейный очаг в семье художника К., вернувшегося из Индии, затем очаг в Московской клинической больнице им. С. П. Боткина среди больных, медицинского и обслуживающего персонала, контактировавших с больным художником. Эти очаги способствовали формированию третьего, городского, очага оспы в Москве. Около 1600 сотрудников больницы в течение 3 нед контактировали с населением города; в-третьих, очаги формируются среди населения, неиммунного в отношении ВНО. Как правило, крупные вспышки возможны в городах, где вакцинация и ревакцинация против натуральной оспы либо вообще не проводилась, либо проводилась небрежно и непоследовательно.
Самая крупная вспышка завозной натуральной оспы (99 заболевших) в послевоенное время имела место в 1963 г. на территории Польской Народной Республики (ПНР). Первым заболевшим оспой в конце мая 1963 г. был гражданин, прибывший из Индии во Вроцлав. Местные врачи поставили ему диагноз малярии. Этот диагноз позднее был изменен на необычно протекающую ветряную оспу, поскольку как у приехавшего, так и у контактировавших с ним лиц появились характерные высыпания, сопровождавшиеся тяжелым клиническим течением, закончившимся в двух случаях смертью больных. Только через 48 сут после появления первого больного, лабораторными исследованиями был установлен диагноз натуральной оспы, а 3 сут спустя начали проводиться необходимые противоэпидемические мероприятия. За время этой эпидемической вспышки натуральной оспы во Вроцлаве заболело 79 человек, из них 6 человек умерли. Инфекция была завезена также в провинцию Вроцлав, где заболели 11 человек, в провинцию Ополе (заболели 4 человека), в провинцию Лодзь (заболели 4 человека, один из них умер), и один больной был зарегистрирован в Гданьске. Более четверти заболевших в описываемую вспышку натуральной оспы составили медицинские работники и лица из обслуживающего персонала больниц. Среди заболевших было 5 врачей, 8 медицинских сестер, 5 палатных нянь, студентка-медик и 7 служащих больницы. Из 7 умерших от оспы, 5 человек также были медицинскими работниками (один врач, 2 медицинские сестры и 2 няни). За несколько недель в районах распространения натуральной оспы было привито более 8 млн человек. Выборочной проверкой было установлено, что 81 % привитых положительно реагировали на введение вакцины. Это свидетельствовало об отсутствии у основной массы населения специфического иммунитета, который был утрачен, по-видимому, со временем в силу нарушения системы ревакцинации против натуральной оспы.
Ниже, по работам А. Ф. Серенко (1962) и С. Б. Дубровинского (1964), как пример естественного течения вспышки натуральной оспы в большом городе, привожу краткое описание московской вспышки 1959-1960 гг.
22/XII. 1959 г. из Дели в Москву на самолете вылетел художник К 3 . По прибытии в Москву 23/XII он почувствовал недомогание и вызвал врача. 24/XII больной К. высказал врачу жалобы на слабость, боли в животе, головную боль, отсутствие аппетита. Объективно у больного температура 38-39 °С, язык обложен, в зеве и легких чисто, тоны сердца глухие, пульс 106/мин, болевые точки в области желчного пузыря.
Был установлен предположительный диагноз гриппа, назначен постельный режим. 25/XII при повторном осмотре температура 39,1 °С, язык обложен, живот не напряжен, в зеве чисто, пальпируется печень и селезенка, пульс 96/мин. Предположительный диагноз: риккетсиоз? аппендицит?
26/XII приглашен хирург, который отверг диагноз аппендицита. У больного на животе и груди крупнопапулезная сыпь, положительный симптом Кончаловского. Высказано подозрение на сыпной тиф, но больной не госпитализирован, так как квартирные условия были вполне удовлетворительными.
27/XII у больного температура 37,8 °С, лицо красное, отечное, кровоизлияние в склере, отхаркивает кровь, АД 100/80 мм рт. ст., тоны сердца глухие, пульс 92/мин. Больного осмотрел врач-инфекционист, который остановился на диагнозе токсического гриппа с медикаментозной сыпью. Больной госпитализирован в 13-е (инфекционное) отделение Московской городской больницы им. С. П. Боткина. В дальнейшем клиническая картина заболевания приводится согласно записям в истории болезни.
Лицо одутловатое, гиперемировано, часть спины синюшняя. На верхних конечностях, груди и животе обильные пятнисто-папулезные полиморфные высыпания, в правой и левой подмышечных впадинах имеются элементы пузырькового характера с гнойным содержимым. Такие же высыпания и на внутренних поверхностях верхних конечностей; на бедрах мелкие пятнисто-папулезные высыпания. Слизистая оболочка зева гиперемирована, сочная. Язык сухой, обложен. На высоте вдоха пальпируется край печени. Сплошное кровоизлияние в склере, конъюнктивит. Предположительный диагноз: лекарственная сыпь.
В ночь на 28/XII больной отхаркивал слизистую мокроту с примесью алой крови, после приема преднизолона была рвота. 28/XII общее состояние больного тяжелое. Яркая, разлитая, интенсивная гиперемия кожи. Кожа лица и верхней половины туловища одутловатая, при пальпации как бы отечна. В паховых областях отдельные геморрагии, в нижней трети правого бедра с наружной стороны имеется кровоподтек величиной с детскую ладонь. Живот мягкий, безболезненный при исследовании. Держится резкий отек и набухание век, из-за резкого отека конъюнктиву не видно.
Клинически впечатление острого аллергического дерматита с выраженными явлениями капилляротоксикоза. На основании анамнеза (больной 22,23,24/XII принимал л евомицетин, стрептомицин, биомицин, синтомицин) консультантом также подтверждается этот диагноз.
28/XII присоединились явления геморрагического нефрита. Поражен весь кожный покров, слизистая оболочка рта и конъюнктива глаз: на общем эритематозном фоне характера эритродермии множественные геморрагические экстравазаты различной величины и оттенков до синего цвета. На слизистой оболочке языка, щек и неба точечные белые налеты — «молочница», местами сливающаяся и образующая на небе пленку. Ощущение жжения в глазах и кожных покровах. Консультация профессора. Диагноз: тяжелая токсико-аллергическая реакция на антибиотики, прогноз сомнителен.
29/XII в 12 ч консультация отоларинголога, стоматолога, терапевта, гематолога, окулиста, в 18 ч 30 мин состояние больного крайне тяжелое: выраженная гипоксия, повышенная кровоточивость, пульс едва прощупывается, кожные покровы синюшно-серые. В 23 ч 29/XII больной К. умер. 30/XII было произведено патологоанатомическое вскрытие. По заключению патологоанатома основным заболеванием у больного К. являлась геморрагическая алейкия, на фоне которой развился некротический ларингит, фарингит, эзофагит и колибациллярный сепсис.
Смерть больного наступила от резкой общей интоксикации, обусловленной сепсисом и чрезвычайно обширными множественными кровоизлияниями.
31/XII труп К. был кремирован, проведена дезинфекция помещений, в которых находился больной К., личные вещи были сожжены.
На вскрытии патологоанатомы, не отрицая диагноза токсического капилляротоксикоза, заподозрили на основании обнаружения биополярных палочек токсическую чуму. 31 /XII на основании дополнительных лабораторных исследований диагноз токсической чумы был отменен.
Позднее было установлено, что больной К. за 2 недели до выезда в Дели «был вакцинирован против оспы, но вакцинальной реакции у него не было отмечено, ранее прививался против оспы только в детстве».
Во время нахождения больного К. дома в Москве с 23 по 27/XII и позднее в больнице с 27 по 29/XII с ним контактировали члены семьи, друзья и медицинский персонал больницы им. С. П. Боткина.
Первые случаи заболеваний натуральной оспой в Москве зарегистрированы с 11 по 14/11960 г. Таким образом, к 14/1, т. е. через 16 сут после смерти К., было установлено, что первый случай натуральной оспы был пропущен. Ретроспективно у больного К. был установлен дигноз purpura variolosa. Пути распространения и формирования очагов натуральной оспы в Москве в 1959—1960 гг. показаны на рис. 3.94.
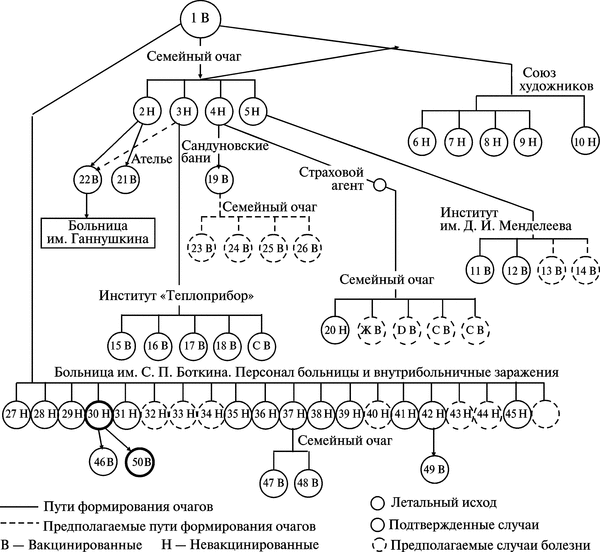
Рис. 3.94. Пути распространения и формирования очагов натуральной оспы в Москве в 1959—1960 гг. В результате формирования крупного очага натуральной оспы в семье художника К. (5 человек) сформировался очаг в московском отделении Союза художников — от сотрудника Союза художников, в Химико-технологическом институте им. Д. И. Менделеева — от дочери художника, в Проектном институте «Теплоприбор» — от родственника художника, в пошивочном ателье — от близких родственников художника. Кроме того, в семье страхового агента сформировался самостоятельный очаг натуральной оспы, а позднее 24/1 был обнаружен очаг в Сандуновских банях. Оба очага сформировались в результате контакта с членами семьи художника. Наряду с этими очагами самостоятельно развивался мощный очаг в Московской клинической больнице им. С. П. Боткина. Около 1600 сотрудников больницы в течение 3-х недель контактировали с населением города. По А. Ф. Серенко (1962)
Первыми выявленными заболевшими натуральной оспой в результате контакта с больным К. были: его знакомая Н., посещавшая К. после возвращения из Дели, и врач-отоларинголог Т., посещавший больного К. 27 и 29/XII 1959 г. Больная Н., 39 лет, проживает в Москве, находилась в контакте с больным К. и его семьей с момента его приезда в Москву. Оспенные знаки от прививок, произведенных в детстве, отчетливы, позднее прививкам против оспы не подвергалась. Заболела 8/1 1960 г., когда почувствовала головную боль, сильную слабость, боли в суставах; температура 38,6°С. На 4 сут болезни при снижении температуры появилась мелкоточечная сыпь на коже в области локтевых и коленных суставов, кистях рук с зудом и болевыми ощущениями. На голове, лице и груди пятнистая сыпь. На 5—6-й день пятна как будто приподнялись, образовались везикулы, наполненные желтоватой жидкостью, на ладонях и подошвах зуд, сыпи не отмечалось. На 4-й день наблюдалась припухлость локтевых суставов.
Лабораторно из содержимого пустул и везикул выделен на куриных эмбрионах оспенный вирус.
Диагноз: вариолоид с множественными высыпаниями.
К 26/1 на коже сохранились пигментированные пятна на месте бывших папул. Больная лечилась в инфекционном отделении больницы им. С. П. Боткина, выздоровела, выписана 16/11 1960 г.
Больной Т., 61 года, работает врачом-отоларингологом. В больнице им. С. П. Боткина посещал больного К. 27 и 29/XII 1959 г. Последний раз прививался против оспы в 1914 г. 7/1 1960 г. почувствовал недомогание, головную боль, повышение температуры. 8/1 работал, но чувствовал усталость и головную боль, ушел с работы раньше времени, к вечеру температура поднялась до 38 °С. 9/1 утром принял 1 таблетку сульфазола, затем еще 2 таблетки. К середине дня на коже лица и туловища появилась мелкоточечная узелковая сыпь. Температура 8 и 9/1 держалась в пределах 38,5—39°С. 10/1 сыпь появилась на голове и конечностях. Температура 39 °С.
11/1 поступил в инфекционное отделение больницы им. С. П. Боткина. При поступлении в больницу состояние больного тяжелое, температура 39,3 °С. На лице, волосистой части головы, туловище и конечностях обильная пятнисто-папулезная сыпь, выраженная также на разгибательных поверхностях конечностей. В зеве легкая гиперемия. 12/1 температура высокая, обильная папулезная полиморфная ярко-красная сыпь.
13/1 зарегистрировано падение температуры до 37,6°С, сыпь значительно увеличилась по всей поверхности тела, приняла геморрагический характер, появились отдельные везикулы. Врачи заподозрили ветряную оспу.
14/1 лицо пациента стало пастозным, сыпь на лице и волосистой части головы сделалась сливной, более полиморфной. Появилась сыпь на ладонях и подошвах. Наряду со свежими пузырьками, наполненными мутной жидкостью и окаймленными красным ободком, имеются пузырьки, появившиеся ранее, на некоторых из них черные корочки. Возникло подозрение на variola vera.
15/1 температура у больного Т. снизилась до нормальной, состояние улучшилось, локализация сыпи осталась прежней, но на верхушках высыпаний появилось много вдавлений в виде пупочков, количество корочек увеличилось.
Материал из пустул взят на исследование и направлен в лабораторию Московской городской санитарно-эпидемиологической станции и в Институт им. И. И. Мечникова. Приглашенный к больному Т. консультант диагностировал variola vera discreta.
Диагноз оспы 15/1 подтвержден вирусоскопически: обнаружены элементарные тельца Пашена серебрением по Морозову, в последующем через 3 дня методом Пауля и через 6 дней путем реакции задержки гемагглютинации.
В последующие дни при лечении состояние больного заметно улучшилось, отмечалось нагноение везикул и образование корочек. С 21/1 началось обильное образование корочек и шелушение, корочки д лительно задерживались на ладонях и подошвах.
К 14/II очищение от корочек закончилось, оставались пигментированные рубцы в большом количестве на туловище и конечностях, в меньшем количестве на лице.
Лечение проводилось пенициллином и стрептомицином, а также симптоматическое по 21/1. Выписан из больницы 16/11 на 40-й день болезни.
За период с 22/XII 1959 г., т. е. с момента прибытия больного К. из Индии в Москву, и по 16/11 1960 г. различными клиническими формами оспы заболело 46 человек.
При изучении клинических проявлений натуральной оспы во время вспышки выявлен ряд особенностей, представляющих интерес для клиницистов и эпидемиологов даже сегодня. Анергическая форма была у одного больного, сливная — у 2, рассеянная — у 3, вариолоид со множественными высыпаниями — у 8, вариолоид с единичными высыпаниями — у 29 и заболевание без сыпи — у 3 больных (табл. 3.26, 3.27).
Таблица 3.26. Клинические формы болезни и течение натуральной оспы во время вспышки в Москве в 1959-1960 гг.*
|
Клиническая форма болезни |
Количество случаев болезни |
Клиническое течение |
Число случаев с летальным исходом |
||||
|
все |
подтвержденные клинически |
подтвержденные лабораторно |
тяжелое |
среднее |
легкое |
||
|
Анергическая |
1 |
1 |
- |
1 |
- |
- |
1 |
|
Сливная |
2 |
2 |
2 |
2 |
- |
- |
1 |
|
Рассеянная |
3 |
3 |
3 |
3 |
- |
- |
1 |
|
Вариолоидная с множественными высыпаниями |
8 |
8 |
7 |
- |
3 |
5 |
- |
|
Вариолоидная с единичными высыпаниями |
29 |
29 |
6 |
- |
3 |
26 |
- |
|
Оспа без сыпи |
3 |
3 |
- |
- |
1 |
2 |
- |
|
Итого |
46 |
46 |
18 |
6 |
7 |
33 |
3 |
* По А. Ф. Серенко (1962).
Таблица 3.27. Течение натуральной оспы во время вспышки в Москве в 1959-1960 гг.*
|
День госпитализации с момента заболевания |
Количество больных, поступивших из города |
Количество больных, выявленных из контактов |
Явления продрома |
Количество больных с |
|
|
температурной реакцией |
высыпанием |
||||
|
1-й |
- |
13 |
- |
- |
- |
|
2-й |
1 |
5 |
- |
- |
- |
|
3-й |
3 |
1 |
- |
- |
- |
|
4-й |
- |
2 |
- |
- |
- |
|
5-й |
1 |
- |
12 |
- |
|
|
6-й |
3 |
2 |
18 |
- |
- |
|
7-й |
2 |
1 |
10 |
- |
- |
|
8-й |
1 |
4 |
15 |
- |
|
|
9-й |
2 |
- |
2 |
23 |
6 |
|
10-й |
2 |
- |
- |
2 |
25 |
|
11-й |
1 |
- |
- |
- |
9 |
|
12-й |
2 |
- |
- |
- |
1 |
|
13-й |
4 |
- |
- |
- |
2 |
|
Итого |
22 |
24 |
46 |
40 |
43 |
* По А. Ф. Серенко (1962).
Тяжелая форма отмечалась у 6 человек, средней тяжести — у 7 и легкие формы — у 33 больных. Из общего количества (46) больных у 43 заболевание закончилось полным выздоровлением, у 3 — летальным исходом. При изучении клинического течения болезни выявлено, что у абсолютного большинства пациентов продромальные явления отмечались в пределах от 5 до 8 сут от заражения, температурная реакция появлялась в период от 8 до 10 сут, высыпания — от 9 до 11 сут. По возрасту всех 44 больных можно разделить на следующие группы: детей до 13 лет — 3 человека, в возрасте от 20 до 50 лет — 37 человек. Среди больных 21 женщина.
У подавляющего большинства больных течение заболевания было легким, только у двух больных натуральной оспой наблюдалось тяжелое течение болезни. Инкубационный период у подавляющего большинства больных (у 31 из 44 наблюдавшихся) колебался в пределах от 7 до 9 сут.
В группе больных вариолоидом с единичными высыпаниями температура быстро повышалась и держалась на высоких значениях 2-3 сут. В день появления папул температура снижалась до нормы; второй лихорадочной волны, связанной с появлением папул, ни в одном случае вариолоида не отмечалось. Продромальная сыпь ранее была зарегистрирована у 2/3 больных на высоте температуры перед появлением характерных для оспы высыпаний.
После отторжения корок у больных вариолоидом рубцовых изменений не оставалось, длительно, до 10-15 сут, держалась пигментация. Кроме общетоксических явлений (головная боль, адинамия, боль в суставах, тошнота, рвота и др.), были отмечены изменения со стороны слизистой оболочки мягкого неба и глотки в виде пузырьковых элементов разной величины на фоне разлитой гиперемии.
До 10-го дня болезни патологических изменений со стороны крови не выявлялось. После 20-30 сут болезни в картине крови отмечалась тенденция к лейкоцитозу и абсолютному нарастанию количества лимфоцитов. Только у одной больной в моче в период лихорадки наблюдалась альбуминурия, у остальных больных патологических отклонений в моче не отмечено.
Один случай заболевания, закончившийся летально, вызвал серьезные разногласия между клиницистами и патологоанатомами.
Больной А. во время вспышки оспы в Москве находился на лечении в Московской городской клинической больнице им. С. П. Боткина с диагнозом лимфогранулематоза, впоследствии присоединилась оспа. Больной погиб на 3-й день после появления высыпаний. Клиницисты утверждали, что больной А. погиб от основного заболевания, патологоанатомы — от оспы, протекавшей по типу вариолоида. Спор этот был решен в пользу натуральной оспы в результате вирусологических исследований и выделения вируса оспы из материала от больного А.
Несмотря на дискуссионный характер диагноза у больного А., учитывая тесный контакт больного А. с больным Б., с эпидемиологической точки зрения этот случай заболевания рассматривался как случай натуральной оспы с последующим осуществлением всех противоэпидемических мероприятий, направленных на локализацию очага. Лабораторная диагностика во время вспышки натуральной оспы в Москве явилась одним из обязательных методов. Большинство (36 случаев) заболеваний протекало по типу вариолоида, т. е. с атипичной клинической картиной, что следует объяснить строгим проведением в нашей стране оспопрививания. Это вызвало серьезные затруднения при клинической диагностике оспы и требовало исключения ветряной оспы почти в каждом случае. Кроме того, лабораторная диагностика была крайне необходима еще и потому, что вспышка протекала в условиях массовой вакцинации, что, естественно, затрудняло дифференциальную диагностику в случаях с различными поствакци-нальными осложнениями.
Вирус удавалось выделять из содержимого кожных элементов до 17 сут болезни, а из носоглоточных смывов — на 3—9 сут болезни.
Определение антигемагглютининов в сыворотках заболевших натуральной оспой показало, что более 60 % заболевших имели титр антигемагглютининов 1:160 и выше, в то время какпочтиу 90 % здоровых, недавно вакцинированных лиц, титр антигемагглютининов не превышал 1:80.
В 36 случаях диагноз натуральной оспы был подтвержден вирусоскопически путем обнаружения телец Гварниери и Пашена в материале из носоглоточных смывов и кожных элементов.
Двое больных, у которых вирус был выделен из крови, погибли. Три случая болезни без кожных высыпаний были подтверждены выделением вируса натуральной оспы из носоглоточных смывов.
Экология и естественная эпидемиология возбудителя оспы обезьян. Инкубационный период болезни у людей — 7-19 сут. Динамика вспышек плохо изучена. Встречается среди людей, живущих в тропических лесах Центральной и Западной Африки. Люди заражаются ВОО при прямом контакте с инфицированными животными (преимущественно обезьяны и белки рода Funisciurus) или больными людьми, а также при употреблении в пищу термически необработанных органов больных животных. Среди животных ВОО очень эффективно передается через воздух, экскременты (рвотные массы и испражнения) и порезы на коже. Первичный природный резервуар ВОО неизвестен. На рис. 3.95. показаны географические районы естественной встречаемости оспы обезьян на африканском континенте и регионы, где она может быть обнаружена из-за сходства экологических условий.
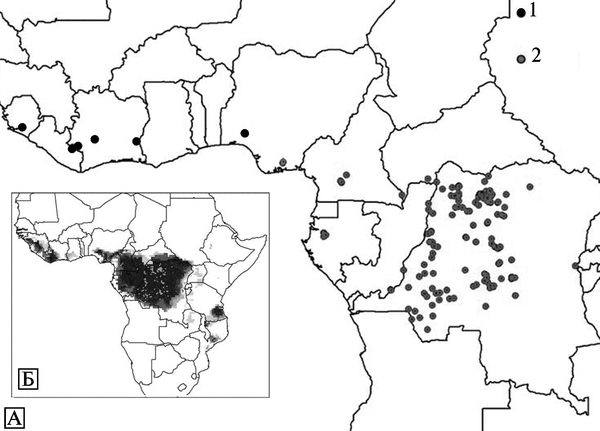
Рис. 3.95. Известные и возможные ареалы оспы обезьян на африканском континенте. А. Территории, где выявлены случаи оспы обезьян среди людей. ВОО, встречающиеся в Центральной Африке, более вирулентные для людей и обезьян, чем вирусы, циркулирующие в Западной Африке. Б. Территории, где экологические условия сходны с теми, на которых поддерживается ВОО. Более плотная штриховка показывает большую вероятность заражения человека ВОО на этой территории. 1 — западноафриканские штаммы; 2 — центральноафриканские штаммы. По R. S. Levine et al. (2007)
Изоляты ВОО, полученные от больных оспой обезьян, обитающих в Западной Африке, менее вирулентны для обезьян и людей, чем изоляты этого же вируса, выделенные от заболевших людей в бассейне реки Конго. Генетически эти изоляты представляют собой разные клады ВОО (см. рис. 3.91). Смертельные исходы оспы обезьян среди людей отмечены только в бассейне реки Конго (Chen N. et al., 2005).
В основном инфицированные ВОО животные встречаются рядом с водоемами в зонах вторичных влажных тропических лесов, густо населенных полосатыми и солнечными белками. Деревья масличной ореховой пальмы (Elaeis guineensis) обеспечивают белок обильной пищей и одновременно привлекают к себе население этих регионов, занимающееся сбором орехов. Такие деревья растут в широких вторичных лесах и на плантациях по всему западу Африки, располагаясь почти непрерывной полосой 50—250 км вдоль побережья Сьерра-Леоне на западе до Южного Камеруна. Этот пояс расширяется в Габоне и Конго, а также занимает почти весь бассейн реки Заир. На рис. 3.96 показана схема передачи ВОО из вторичного природного резервуара в человеческие популяции.
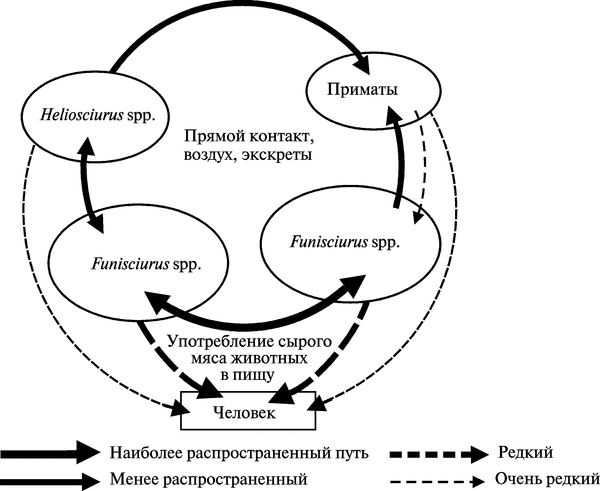
Рис. 3.96. Схема передачи ВОО из вторичного природного резервуара в человеческие популяции. Heliosciurus — род «солнечные белки». Funisciurus — род «полосатые белки». Первичный природный резервуар ВОО не известен. По L. Khodakevich et al. (1988)
Эпизоотическая цепочка, по которой распространяется оспа обезьян, может быть длинной и тянуться с африканского континента в любую точку мира. Например, причиной вспышки оспы обезьян среди населения штата Висконсин (США) был завоз BOO из Ганы с гамбийскими хомяковыми крысами (Cricetomysgambianus). Крысы заразили оспой обезьян луговых собачек (луговые собачки Cynomys — грызуны из семейства беличьих. Внешне напоминают сурков. Живут в прерии Северной Америки ) в одном из магазинов в штате Висконсин, не контактируя с ними непосредственно. Луговые собачки были помещены в клетки, в которых ранее содержались больные крысы. Затем их в инкубационном периоде болезни развезли по другим магазинам и продали населению. Всего оспой обезьян заболело 11 человек (5 мужчин и 6 женщин) в возрасте от 3 до 45 лет. В 10 случаях заболевание возникло в результате контакта с больным животным (укусы, попадание вируса в ранки на коже). В одном случае эпидемиологи предполагают передачу ВОО от человека к человеку. Инкубационный период болезни занимал от 4 до 24 сут, в среднем 15 сут. Так как ВОО относился к вирусам, циркулирующим в Западной Африке, тяжелых случаев болезни не было (Reed К. D. et al., 2004).
В 1982-1984 гг. в Заире случаи заболевания оспой обезьян, вызванные передачей ВОО от человека к человеку, составляли до трети всех случаев (66 из 210). Временные периоды между контактом и появлением сыпи составляли от 7 до 23 сут. Летальность среди детей в возрасте от 7 мес. до 7 лет достигала 11 %, в возрастной группе от 5 до 14 лет — 7,7 %. Примеры передачи ВОО между людьми приведены на рис. 3.97.
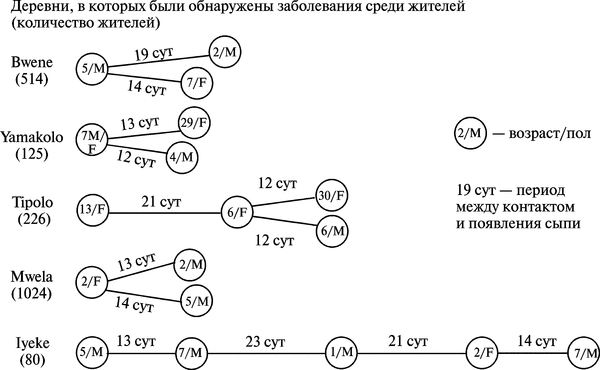
Рис. 3.97. Примеры цепочек передачи ВОО между людьми в Заире. Все заболевшие оспой обезьян проживали в небольших деревнях, распложенных в зоне влажных джунглей, и находились в тесном контакте друг с другом. Предполагается, что заболевший оспой обезьян человек мог быть источником ВОО для другого человека в течение одной недели. М — мужчина, F — женщина. По F. Fenner et al. (1988)
Естественное инфицирование человека ВОО в России возможно в результате контакта с контрабандно завезенными из тропических лесов Центральной и Западной Африки дикоживущих грызунов, белок и обезьян. Другая возможность естественного инфицирования — это пребывание в эндемических по вирусу оспы регионах тропической Африки.
Оспа коров. Это название болезни условно, спектр патогенности вируса оспы коров (CPV) оказался шире, чем считалось тогда, когда болезнь получила это название. Перечень восприимчивых к CPV животных продолжает увеличиваться. У большинства из них болезнь протекает тяжело и сопровождается высокой летальностью. В значительном проценте случаев оспа коров у животных протекает в типичной для поксвирусов форме с развитием характерных поражений (высыпаний) на коже и слизистых. У слонов отмечался, кроме того, отек головы, задних конечностей. У отдельных животных происходила генерализация процесса, сыпь приобретала сливной характер с последующим некрозом кожи и слизистых. Кожная форма инфекции у хищных семейства кошачьих как и у слонов, окапи (крупное парнокопытное млекопитающее из семейства жираф) и носорогов иногда заканчивалась летальным исходом. Оба случая заболевания гигантских муравьедов в Московском зоопарке завершились смертью. У кошачьих (львы, гепарды, черная пантера) болезнь может протекать в легочной форме со 100 % летальностью не позже 8 сут от появления первых симптомов. Клиника легочной формы коровьей оспы характеризуется адинамией, отказом от пищи, затрудненным дыханием, одышкой, приступообразным кашлем и цианозом слизистых. На аутопсии обнаруживают серозно-фибринозную пневмонию с массивным выпотом (до 3 л) в плевральную полость. При легочной форме у животных, как правило, не наблюдалось оспенной сыпи (Маренникова С. С., Щелкунов С. Н., 1998).
Для людей источником CPV могут быть домашние кошки, ламы, рыжие полевки, белые крысы, собаки и кроты (Маренникова С. С. с соавт., 1996; Pahlitzsch R. et al., 2006; Campe H. et al., 2009; Vogel S. et al., 2011). Природные резервуары CPV имеются в Московской области. Ниже по работе С. С. Маренникова с соавт. (1996) привожу краткую историю случая болезни, имевшего место в Московской области.
Девочка Л. Г., 4 лет, не вакцинированная против оспы, заболела в августе 1990 г. во время пребывания на даче под Москвой. До заболевания в течение 2 дней она играла с найденным на участке кротом, беря его в руки и прижимая к себе. Крот был необычно спокойным и малоподвижным. Контакта с другими животными или больными людьми не было. Через 2-3 сут девочка стала вялой, капризной, чувствовала жар. Были очевидными ее недомогание и слабость. На 5 сут после контакта с кротом у нее появились жалобы на боль в правой подмышечной области, где при осмотре оказалось покраснение с узелком в центре, который через сутки превратился в пузырек с пупкообразным вдавлением.
Состояние девочки ухудшалось, и родители увезли ее в Москву, где она была госпитализирована на 9 сут болезни с температурой 39,4°С. При осмотре в правой подмышечной области была обнаружена окруженная зоной гиперемии и инфильтрации крупная (диаметром 20х18 мм), покрытая плотной коркой подсохшая пустула; значительно увеличенные и болезненные лимфатические узлы справа и слегка увеличенные (до размера горошины) слева. На 10 сут рядом с первичным элементом появились четыре «дочерних» везикулы, три из которых затем с ним слились. Увеличение и болезненность региональных лимфатических узлов, субфебрильная температура и болезненное состояние сохранялись в течение 2 нед. После отпадения корок на месте поражения остался отчетливый большой рубец.
При электронной микроскопии в материале из кожного поражения, взятого на 12 сут болезни, были выявлены вирионы, имевшие кирпичеобразную форму и размеры. Инокуляция этого же материала на ХАО куриных эмбрионов сопровождалась формированием нежных поверхностных оспин среднего размера с яркими геморрагиями. На некоторых оболочках можно было также заметить единичные белые оспины, выступающие над поверхностью ХАО. В целом характер поражений был сходен с таковым, вызываемым референс-штаммом CPV, однако в отличие от последнего, при 72-часовой инкубации вторичные оспины не появились, а сами оспины были мельче. Исследование сыворотки крови девочки иммунологическими способами также свидетельствовало об инфицировании ребенка CPV.
Когда CPV инфицируются люди с иммунодефицитами различного происхождения, оспа коров может по клинике напоминать натуральную оспу. Такой случай описан в Германии С. P. Czerny et al. (1991) у 18-летнего пациента. Он не был вакцинирован против натуральной оспы, страдал экземой и аллергическим астматическим бронхитом, принимал иммуносупрессивные препараты. Оспа коров у пациента развилась сразу как генерализованная инфекция с поражением легких и частично сливными экзантемами, распространившимися по всему телу. Клинические симптомы болезни были сходны с «variola pustulosa haemorrhagica». Больной погиб от легочной эмболии в палате интенсивной терапии. Сводные данные по клинической манифестации оспы коров у людей, географии и источникам их заражения в России, приведены в табл. 3.28.
Передача CPVот человека к человеку наблюдается очень редко и происходит только при тесном контакте с больным. Внешние признаки болезни у животных и внешние признаки болезни у людей приведены на рис. 3.98 и рис. 3.99.
Таблица 3.27. Случаи оспы коров у людей в России*
|
Пациент |
Пол |
Возраст в годах |
Вакцинация против оспы в прошлом |
Профессия |
Источник заражения |
Место и время заражения |
Клинические симптомы |
Наличие вируса в содержимом кожных поражений |
Наличие антител к CPV (EIA-A) в сыворотке крови |
|
Е. Н. |
ж |
34 |
+ |
Сотрудница вивария |
Укус больной белой крысы |
Москва, январь, 1987 |
На 3 сут — недомогание, головная боль, слабость, температура до 38 °С, поражение на месте укуса |
Выделен CPV (изолят Ель-87) |
Обнаружены видо-специфические антитела к CPV |
|
С. О. |
ж |
31 |
+ |
Ветеринарный врач вивария |
Укус больной белой крысы (через резиновую перчатку) |
Москва, апрель, 1987 |
На 3 сут — слабость, недомогание, субфебрильная температура; небольшое поражение на месте укуса; увеличение регионарного лимфоузла |
Обнаружены вирионы поксвируса |
То же |
|
Г. А. |
м |
10 |
+ |
Учащийся |
Точно не установлен (предположительно мелкие полевые грызуны) |
Смоленская обл., август, 1988 |
На 3-4 сут — слабость, недомогание, температура до 39 °С; подчелюстной лимфаденит; боль и поражения в области правого уха; на 12-13 сут высыпания на нижних конечностях |
Выделен CPV (изолят Арго-8 8) |
То же |
|
Г. Е. |
ж |
4,5 |
- |
Точно неизвестно (тесный контакт с кротом) |
Московская обл., август, 1990 |
На 3 сут — вялость, недомогание, температура до 40 °С; на 5 сут — боль и местные поражения в правой подмышечной области; подмышеный лимфаденит. На 10 сут вторичные высыпания вокруг первичного очага |
То же (изолят GRI-90) |
То же |
|
|
Р. Е. |
м |
12 |
- |
Учащийся |
Тесный контакт с белой крысой-вирусоносителем ** |
Москва, апрель, 1991 |
На 2-3 сут — слабость, недомогание, температура до 38 °С; местные поражения на плече и шее справа, подмышечный лимфаденит справа |
То же (изолят Rev-91) |
То же |
|
Д. К. |
м |
10 |
- |
Учащийся |
Тесный контакт с белой крысой-вирусоносителем ** |
Москва, май, 1991 |
На 3 сут — слабость, недомогание, температура до 38-40 °С; поражения на туловище, на 6-8 сут — на лице и руке; двусторонний лимфаденит |
То же (изолят DK-91) |
То же |
* По С. С. Маренниковой и С. Н. Щелкунову (1998).
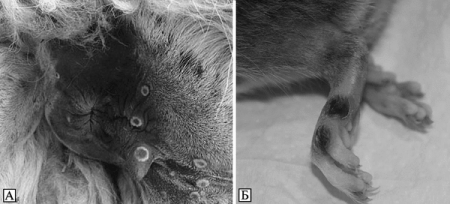
Рис. 3.98. Кожные поражения при оспе коров у животных. А. Кожные поражения в виде кратера вокруг ануса ламы. По С. Cardeti et al. (2011). Б. Кожные поражения на лапках крыс. По S. Vogel et al. (2011)
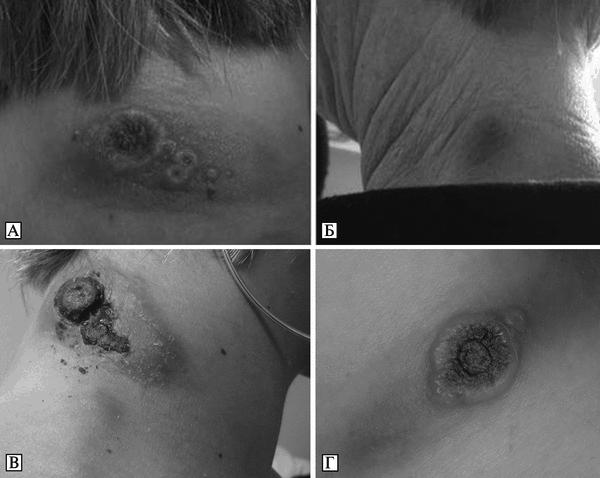
Рис. 3.99. Кожные поражения при оспе коров у людей. А. Некротические поражения и лимфаденит у 16-летней пациентки, ранее не вакцинированной против натуральной оспы. Б. Кожные поражения у ее матери (40 лет). Ранее была вакцинирована против натуральной оспы. Оба снимка сделаны через 15 сут после приобретения в зоомагазине белой крысы, инфицированной CPV. По Н. Сатре et al. (2009). В. Некротические поражения и лимфаденит у 16-летней пациентки. Г. Раннее проявление кожного поражения у 42-летнего мужчины — язва диаметром 35 мм с некротическим дном и лимфаденит. По S. Vogel et al. (2011)
Восприимчивость к возбудителю натуральной оспы людей и животных. Среди невакцинированных людей есть как невосприимчивые к ВНО лица, так и обладающие повышенной восприимчивостью. Во времена крупных эпидемий второй половины XIX в. наблюдали, что на 100 взрослых 5-6 человек не заболевают, несмотря на «пребывание в заразной обстановке». Обширные наблюдения врожденной невосприимчивости к ВНО стали накапливаться с началом кампаний массовой вакцинации. При систематической вакцинации в Германии некоторая часть детей обнаруживала иммунитет. Так, по наблюдениям Р. Коха (1880), на 58913 привитых детей 780 дали отрицательный результат при однократной и повторной прививке и 48 — при троекратной. Описаны случаи 5-, 6- и 8-кратной безуспешной прививки. Процент невосприимчивых к вакцине детей, у различных авторов сильно колеблется: от 0,08 до 2,44 %, что, по мнению Н. Ф. Гамалеи (1913), отражает частоту оспенных эпидемий в данной группе населения в прошлом. Он объяснял это явление тем, что при долгом существовании среди населения какой-либо опасной инфекции, наиболее поражаются и вымирают самые восприимчивые к ней индивидуумы, остаются же и оставляют потомство те, которые обладают сравнительно прочной иммунной системой.
Сверхвосприимчивость у людей к ВНО проявлялась во время оспенных эпидемий, по крайней мере, шестью группами событий:
1) повторными (многократными) заболеваниями у отдельных лиц и семей;
2) высокой смертностью в отдельных возрастных группах населения;
3) крайне тяжелым типичным течением болезни у отдельных лиц, при относительно легком ее развитии у большинства остальных заболевших;
4) крайне тяжелым нетипичным течением оспы или вакцинного процесса у отдельных лиц при типичном их развитии у остальных заболевших;
5) высокой смертностью в отдельных человеческих популяциях (этнических группах);
6) микст-эпидемиями — в этом случае натуральная оспа либо завершает эпидемическую катастрофу, вызванную другими опасными инфекциями, либо встраивается в последовательно развивающуюся цепочку эпидемических катастроф, где они вместе или, следуя «друг за другом», в каком-то смысле, уподобляются «бичу Божьему».
Крайне тяжелое нетипичное течение вакцинального процесса у отдельных лиц, при типичном их развитии у остальных вакцинированных, наблюдали в конце XIX в. в регионах Африки, население которых сегодня поражено СПИДом. Так, из 1156 детей, привитых британскими врачами в Стране зулусов (Зулуленд), у 240 из них вакцинация осложнилась генерализацией процесса. Для 16 детей она окончились смертью при явлениях бронхопневмонии. У 20 % вакцинированных детей общее высыпание наступило через 28-44 сут после прививки, а у 75 % на 8 сут наблюдалось появление вторичных пузырьков вокруг первичной оспины (master-pox), а затем развивалось общее высыпание в течение 2—3 мес. Высыпания имели все характерные признаки оспы: сначала пятна, затем папулы и везикулы с пупком (Гамалея Н. Ф., 1913).
Инфицирующая доза ВНО для человека составляет несколько вирусных частиц, более точные данных в открытых источниках я не нашел. Инфицирующие дозы ВНО для приматов на несколько порядков превышают инфицирующие дозы для человека. К экспериментальному заражению большими дозами ВНО восприимчивы как человекообразные обезьяны (орангутаны), так и ряд низкоорганизованных видов этих животных: макака-резус, яванские обезьяны и др. Вирус патогенен для обезьян при различных путях введения. Описаны результаты успешного заражения нанесением ВНО на скарифицированную кожу, введением внутривенно, с использованием аэрозоля, в тестикулы, бронхи, трахею. При интрацеребральном заражении вирус не вызывает болезни. Инокуляция вируса ВНО обезьянам может вызывать у них в зависимости от дозы и способа заражения либо местный процесс, либо генерализованную инфекцию различной тяжести, напоминающую отдельные клинические формы оспы у человека (от дискретной до геморрагической). Обычно генерализованная инфекция протекает в относительно легкой форме и заканчивается выздоровлением. Инфицирующие дозы для приматов в зависимости от пути введения вируса приведены в разд. «Клиническая картина натуральной оспы у животных при искусственном инфицировании».
По данным большинства исследователей, ВНО не патогенен для взрослых белых мышей при различных путях введения. Выявлена восприимчивость к ВНО белых мышей-сосунков. Вирус размножается и может поддерживаться в пассажах при внут-рибрюшинном введении. При введении ВНО в мозг новорожденным мышам у них наблюдается генерализованная инфекция с размножением вируса в мозгу, во внутренних органах и с двумя волнами виремии. Повышение восприимчивости к ВНО взрослых белых мышей может быть достигнуто с помощью облучения ( 60 Со). В этих условиях как клиническое течение болезни, так и вирусологические показатели становятся такими же, как у 10-12-суточных, естественно восприимчивых к вирусу мышей.
Данные о восприимчивости к ВНО белых крыс противоречивы. Наряду с указаниями на отсутствие патогенности ВНО для этих животных имеются сообщения о способности некоторых штаммов образовывать папулы при нанесении вируса на скарифицированную кожу, специфического кератита при введении вируса на роговую оболочку и интерстициальной пневмонии с цитоплазматическими включениями в пораженных клетках при интраназальном заражении.
К ВНО невосприимчивы морские свинки, кролики, золотистые хомячки, хлопковые крысы, свиньи, козы, бараны и телята. Помимо дозы, на тяжесть и исход болезни влияет возраст животного: молодые животные более чувствительны к ВНО.
Восприимчивость к возбудителю оспы обезьян у животных. ВОО весьма патогенен для белок, кроликов, белых мышей, хлопковых крыс, многососковых крыс, обезьян, и, возможно, антилоп. Из обезьян наиболее чувствительны к ВОО орангутаны. Обезьяны могут быть бессимптомными носителями ВОО. К вирусу невосприимчивы золотистые хомячки, белые крысы и морские свинки (Маренникова С. С., Щелкунов С. Н., 1998). Инфицирующие дозы для отдельных видов животных, в зависимости от пути введения вируса, приведены в разделе «Клиническая картина натуральной оспы у животных при искусственном инфицировании».
Иммунитет к поксвирусам. Основной антигенной детерминантой поксвирусов и мишенью для протективных антител является консервативный белок L1 (другое название L1R). У вируса вакцины, вируса оспы обезьян и ВНО этот белок различается отдельными аминокислотами. Антитела к L1 способны блокировать инвазию орто-поквирусов в клетки. Поэтому он рассматривается учеными в качестве кандидата на включение в перспективные противооспенные вакцины (рис. 3.100).
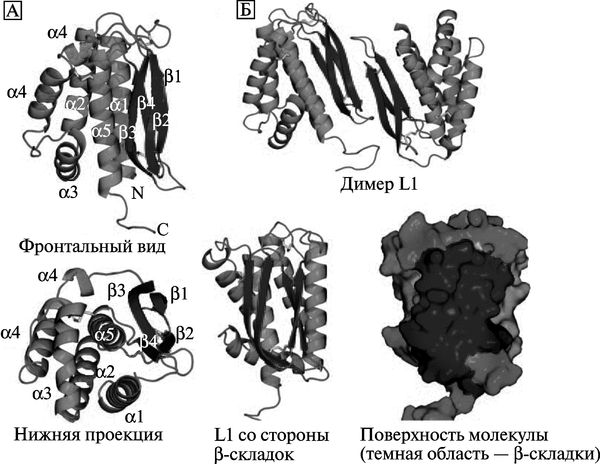
Рис. 3.100. Структура белка L1. А. Две проекции белка на ленточной диаграмме. Фронтальный вид (верхнее изображение) показывает расположение спиралей на одной стороне молекулы, на другой стороне изображены параллельные (3-складки, сформированные непараллельными p-цепями, соединенными через петлю и тремя дисульфидными связями. Нижняя проекция показывает рЗ, р4 и а5, упакованные вблизи центра молекулы. Обозначены спирали (al—a5), N-конец (N), и С-конец (С). Б. Вверху показан димер L1. Взаимодействие двух L1 молекул происходит через края р-складок. Нижнее изображение показывает L1 со стороны р-складок (темная область). L1 — крупная консервативная белковая молекула-мономер с несколькими конформационными эпитопами презентируется иммунным клеткам в виде димера. По Su Ниа-Роо (2005)
На заключительной стадии морфогенеза вируса образуются так называемые внутриклеточные зрелые вирионы (intracellular mature virions, IMVs; см. рис. 3.89), которые имеют липидные мембраны и представляют собой уже способные к инфекции частицы вируса. Большинство IMVвысвобождаются из фагоцитирующей клетки после ее лизиса. Некоторые из них могут транспортироваться через клеточную мембрану хозяина до лизиса клетки. После чего они остаются присоединенными к ее наружной поверхности или отделяются от нее уже как внеклеточный оболочечный вирус (extracellular enveloped virus, EEV). Елавную роль в передаче вируса от одного хозяина к другому играет его IMV-форма (Su Н. et al., 2005).
L1 играет основную роль в «созревании» вирионов ортопоксвирусов. Он представляет собой миристиолированный оболочечный белок (myristoylated envelope protein), состоящий из 250 аминокислотных остатков, экспрессирующийся на поверхности IMV-формы вируса. Его С-гидрофобный сегмент погружен в вирусную мембрану, но консервативная часть L1, включающая 185 аминокислотных остатков, локализуется в цитоплазме клетки-хозяина. Консервативность L1 как антигена предопределяет его ключевая роль в морфогенезе вируса. В области N-конца белка L1 формируется гидрофобная «каверна», необходимая для сборки вириона. После лизиса клетки этот эктодомен экспонируется Т- и В-клеткам иммунной системы и вызывает сильный ответ с их стороны (Su Н. et al., 2005).
Мыши, дефектные по В-клеткам (В-клетки синтезируют и секретируют специфические антитела), так же как и мыши, истощенные по CD4 (помогают в активации и трансформации В-лимфоцитов и в синтезе иммуноглобулинов), неспособны освободиться от вируса и погибают. Так же они оказались неспособны переключаться на IgG (высокоаффинный и количественно доминирующий иммуноглобулин) или на IgM-ответы (IgM низкоаффинный иммуноглобулин, преобладающий во внутрисосу-дистом пуле иммуноглобулинов в начале инфекционного процесса). В ответах на острую инфекцию вирусоспецифические антитела наиболее эффективно освобождают организм от вируса. Вирус разрушается по различным механизмам, предполагающим участие специфических антител. Во-первых, антитела могут непосредственно связывать вирус, вызывая его агрегацию и препятствуя адсорбции и интернализации в клетках. Во-вторых, они могут связывать вирус, вызывая его разрушение с помощью комплемента или опсонизации, а затем посредством фагоцитоза. Антитела к L1 могут связывать инфицированные клетки хозяина, вызывая цитотоксические реакции со стороны клеток-киллеров и др. (Xu R. et al., 2004).
Кроме белка L1, в иммунном ответе на ортопоксвирусы участвуют еще два антигена. Один из них, так называемый ранний антиген (ES), формируется на мембранах инфицированных клеток до начала синтеза ДНК. Антитела, вырабатывающиеся в ответ на введение этого антигена, реагируют с ним в РСК, но не нейтрализуют вирус. Такой же антиген выявлен у большинства штаммов вируса вакцины, а также вирусов оспы обезьян и оспы коров. Другой антиген вируса оспы, гемагглютинин, впервые обнаруженный у ортопоксвирусов Барнетом, считался лишенным выраженной видо-специфичности, хотя ряд авторов отмечали, что титры в РТГА с гомологичным вирусом были обычно выше, чем с гетерологичным. Лишь в самое последнее время после расшифровки структуры гена гемагглютинина ряда ортопоксвирусов и кодируемых им полипептидов, удалось не только установить видоспецифические различия отдельных генов гемагглютинина, но и разработать на этой основе методы межвидовой дифференциации ортопоксвирусов (Маренникова С. С., Щелкунов С. Н., 1998).
Иммунитет к оспе может быть создан путем прививки оспенной вакцины. Однако напряженность и продолжительность такого иммунитета меньше, чем после перенесенной натуральной оспы. По данным Комитета экспертов ВОЗ по оспе (1964), иммунитет после первичной вакцинации примерно в 10 раз слабее, чем после пере-болевания оспой.
Пассивный иммунитет к ВНО может быть создан путем введения ИЛП, содержащих противооспенные антитела (сыворотки реконвалесцентов, иммуноглобулины из сывороток гипериммунизированных животных или недавно вакцинированных людей). Имеются доказательства эффективности создания таким образом иммунитета как в эксперименте, так и в эпидемиологических условиях. Пассивный иммунитет может быть также обусловлен трансплацентарным переносом антител от матери новорожденному.
Натуральная оспа повторяется у одного и того же человека очень редко — по наблюдениям Н. Ф. Гамалеи (1913), 1:3000 переболевших, но через 50 лет Комитет экспертов ВОЗ по оспе (1964) оценивал это соотношение уже как 1:1000.
Устойчивость возбудителя натуральной оспы во внешней среде. В высушенном состоянии ВНО более устойчив к воздействию высокой температуры. Так, при температуре 100°С он погибает через 10 мин, а при температуре 60 °С — через 1 ч, в то время как в жидком состоянии (суспензия) вирус инактивируется полностью при температуре 60°С через 30 мин. В паровоздушной камере полное обеззараживание достигается при температуре 96 °С при экспозиции 45 мин, а в пароформалиновой камере — при температуре 57 °С через 1 ч при введении формалина из расчета 150 мл на 1 м3 .
Для инактивирования ВНО, содержащегося в корочках больного натуральной оспой, требуется воздействие 3 %-ного раствора хлорамина в течение 1 ч, тогда как вирус в жидком состоянии погибает в 1 %-ном растворе хлорамина в течение 30 мин. Для обеззараживания выделений больного применяли растворы хлорамина в большей концентрации в связи с тем, что белковые субстанции выделений создают защитный барьер. Для обеззараживания слюны требовался 2 %-ный раствор хлорамина с экспозицией 30 мин, а для обеззараживания мокроты — 3 %-ный раствор и экспозиция 1 ч, 5 %-ный раствор хлорамина инактивирует вирус в клетках ХАО в течение 2 ч. Губительно действуют на вирус 3 %-ные растворы фенола и лизола в течение 30 мин, осветленный 1 %-ный раствор хлорной извести, 1 %-ный раствор хлор-|3-нафтола и 0,5 % гексилрезорцина в течение 1 ч. Чувствителен ВНО к сулеме и окислителям типа марганцовокислого калия. ВНО неустойчив к действию света. На свету он погибает через 35 сут, а при хранении в темноте — через 84 сут. В течение нескольких лет вирус выживает в 50 %-ном глицерине, не теряя активности. Оптимальной зоной pH для ВНО является 7—7,4. Изменение pH как в щелочную, так и особенно в кислую сторону, приводит к снижению активности вируса. При pH 3 ВНО инактивируется в течение 1 ч.
Наиболее длительно ВНО сохраняется в оспенных корках. По данным Е. Ф. Беланова с соавт. (1997), проведших исследование оспенных корочек, хранившихся 26 лет при температуре — 20 °С, жизнеспособный вирус был выделен практически из всех семи изученных проб от разных больных. На основании сделанных расчетов авторы пришли к выводу, что продолжительность сохранения жизнеспособности ВНО, находящегося в подобных условиях, может быть более 100 лет и таким образом имеются реальные шансы обнаружить живой вирус в трупах жертв оспы, захороненных в мерзлотных грунтах.
Находясь во взвеси ХАО, ВНО выдерживает прогревание при температуре 50 °С в течение двух часов без резкого снижения инфекционной активности. Однако дальнейшее повышение температуры оказывается критическим: при температуре 60 °С он инактивируется за 10 мин, а при температуре 70°С — за 5 мин. Кипячение разрушает вирус практически сразу. Высушивание вируссодержащих культур (из замороженного состояния под вакуумом) значительно увеличивает устойчивость вируса к температуре (Маренникова С. С., Щелкунов С. Н., 1998).
Антивирусные препараты. В отличие от бактериальных инфекций, контролировать с помощью химиотерапевтических препаратов вирусные инфекции очень сложно. Бактерии, инфицировавшие клетку, для своей репликации используют собственные метаболические пути, и на них можно влиять с помощью антибиотиков и химиопрепаратов. Вирусы реплицируются в клетке с использованием ее собственных метаболических путей. Механизмы действия антивирусных препаратов и механизмы резистентности к ним у вирусов, обобщены в табл. 2.9.
Выбор химиопрепаратов для лечения поксвирусных инфекций основывался на результатах изучения особенностей репликационного цикла поксвирусов и синтеза вирусных белков, позволяющих осуществить их избирательный таргетинг, не нарушая метаболических процессов инфицированной клетки. Ниже, в основном, по работе К. Sliva и В. Schnierle (2007), приведено краткое описание препаратов, обладающих активностью в отношении инфекций, вызываемых поксвирусами.
Метисазон (methisazonum, 2-(1,2-дигидро-1-метил-2-оксо-ЗН-индол-3-илиден)-гидразинкарботиоамид; синонимы: kemoviran, marboran, metisazon, viruzona, мербо-ран) — нарушает процесс сборки вирионов, угнетает синтез вирусных структурных белков. До 1960-х гг. рассматривался как противотуберкулезный препарат. В 1960 гг. активно изучался как препарат для химиотерапии натуральной оспы. Клинически было доказано, что этот препарат не эффективен при лечении развившейся болезни, но снижает заболеваемость и смертность, при введении с профилактической целью людям, контактировавшим с больными натуральной оспой. Наиболее оптимальным считался прием per os 3 г препарата двумя дозами с интервалом 8 ч (McClain D. J., 1997). Препарат используется для лечения больных с поствакцинальными осложнениями (вакцинальная экзема, гангренозная вакцина и др.).
Рифампицин (rifampicinum, rifampin; 3-[[(4-метил-1 -пиперазинил)имино]метил]) — подавляет ДНК-зависимую РНК-полимеразу микроорганизмов. Противотуберкулезный препарат. Размножение поксвирусов рифампицин блокирует, предотвращая расщепление прекурсорных белков. Клиническая эффективность показана только при применении очень высоких доз, что исключает его широкое применение.
Рибавирин (ribavirin, copegus, rebetol, ribasphere, vilona, virazole) — синтетический аналог нуклеозидов, антивирусный препарат с плохо изученным механизмом действия в отношении ДНК-вирусов.
Цидофовир (CDV-Vistide, вистид) — ациклический нуклеозид фосфонат ( acyclic nucleosidephosphonate) . Селективно ингибирует вирусную ДНК-полимеразу, тем самым блокирует вирусную репликацию и транскрипцию. Рекомендуется для лечения поксвирусных инфекций, в том случае, если гипериммунный противооспенный иммуноглобулин оказывается неэффективным. Путем присоединения липида к молекуле цидофовира создан модифицированный препарат, который в 100 раз более эффективно, чем исходный, блокирует размножение ВНО в культурах клеток. В опытах на мышах показана его значительно более высокая и длительная профилактическая эффективность при ингаляционном введении (Bray М., Roy С., 2004). Механизмы резистентности поксвирусов к цидофовиру показаны на рис. 2.20.
Адефовир (adefovir dipivoxil, HEPSERA, ЕЕПСЕРА) — ациклический аналог адено-зина монофосфата. В клетке фосфорилируется под действием клеточных киназ в активный метаболит — адефовира дифосфат. Он ингибирует ДНК-полимеразу ДНК-вирусов (обратную транскриптазу), конкурируя с естественным субстратом дезоксиаде-нозина трифосфатом и вызывая обрыв цепи ДНК после его инкорпорации в вирусную ДНК. В условиях in vitro показывает значительную активность в отношении поксвирусов. Хорошо переносится человеком при приеме per os.
Новое направление в разработке антипоксвирусных препаратов включает разработку киназных ингибиторов , ранее применявшихся только для лечения онкологических болезней. Это новый класс препаратов, не ингибирующих репликацию поксвирусов, но уменьшающий их способность передаваться между клетками через блокирование полимеризации актина, играющего важную роль в межклеточной адгезии и передаче вирусов. Среди таких препаратов наиболее изучен противолейкозный цитостатический препарат иматиниб (Gleevec, STI-571, imatinib mesylate или Glivec). На рис. 3.101 приведено схематическое изображение цикла репликации поксвирусов с указанием «точек воздействия» антипоксвирусных препаратов.
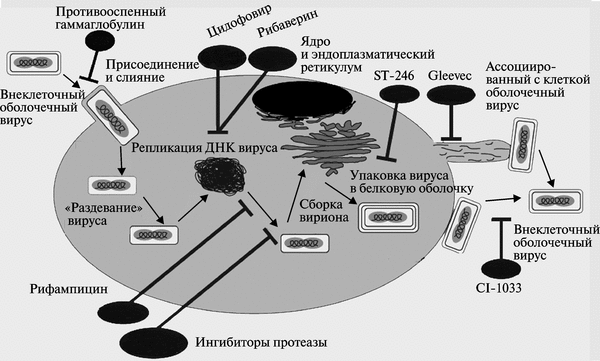
Рис. 3.101. Схематическое изображение цикла репликации поксвирусов с указанием «точек воздействия» антивирусных препаратов. По К. Sliva, В. Schnierle (2007)
Обнаружение генетически измененных штаммов ортопоксвирусов. Коллекции ВНО хранятся в двух государственных лабораториях в России и США, и теоретически ВНО не доступен для террористов. К тому же он не имеет «недостатков», которые могут вызвать у преступников желание вмешаться в его геном, а потом запутаться в разнообразных рукотворных эффектах при культивировании и хранении полученного штамма вируса. Значительно большую опасность, чем генетически измененные штаммы, представляют природные антигенно-атипичные штаммы ВНО, обнаруженные в средине 1970-х гг. (см. работу Маренниковой С. С., Щелкунова С. Н., 1998). В отношении таких вирусов вакцинация может оказаться малоэффективной. Более вероятно, что объектом генно-инженерного вмешательства преступников станет не ВНО, а другие патогенные и даже непатогенные для человека ортопоксвирусы. В разд. 2.2.2 «Механизмы вмешательства в геном вирусов» приводится описание таких экспериментов. Подозрение о применении генетически модифицированных или специально селекционированных ВНО и ВОО должно возникнуть при:
1) обнаружении у заболевших людей штаммов вирусов, резистентных к препаратам, обычно используемым для лечения поксвирусных инфекций;
2) установлении низкой защитной эффективности вакцинации, проведенной живыми противооспенными вакцинами.
Достоверно установить же факт вмешательства в геном ортопоксвируса, использованного для совершения преступления, можно по результатам секвенирования, сопоставив выявленную нуклеотидную последовательность с эталонной. Интерес у экспертов должны вызвать нуклеотидные последовательности генов токсинов эукариотических организмов; генов других вирусов, особенно когда обнаруживаются реп-ликоны этих вирусов; гены белков, участвующих в регуляции иммунных ответов, но отсутствующие в геноме эталонного вируса; гены прионовых белков.
Патогенез ортопоксвирусных инфекций. Общим для всех генерализованных орто-поксвирусных инфекций, включая натуральную оспу и оспу обезьян, является ступенеобразный характер распространения вируса по организму, проходящий три основных этапа: инфицирование клеток, репликация вируса и его «выброс» в кровеносное русло. Заражение человека происходит через слизистые оболочки верхних дыхательных путей, куда ВНО проникает воздушно-капельным или воздушно-пылевым путем. Не исключено также заражение через поврежденную кожу. Если заражение произошло через поврежденную кожу, то первоначально возникает локальное поражение на месте внедрения вируса с последующей генерализацией процесса. Подобный путь заражения возможен, но для вспышек естественного происхождения он не имеет практического значения и встречается чрезвычайно редко.
Первыми клетками, вступающими в контакт с ортопоксвирусами, являются поли-морфоядерные лейкоциты (макрофаги и моноциты). За счет градиента продуцируемых ими хемоаттрактантов они «притягивают» другие фагоцитирующие клетки и запускают каскад самых разнообразных реакций, которые «в сумме» рассматриваются учеными как «иммунные». В составе макрофагов и моноцитов вирус достигает дренажных лимфатических узлов примерно через 8 ч. Разрушившиеся фагоцитирующие клетки становятся источником вируса, а через 2—3 сут его обнаруживают уже в крови (первичная виремия), костном мозге, печени и селезенке. В пробах крови больного натуральной оспой в этот период можно обнаружить как инфицированные, так и неин-фицированные лейкоциты, но в основном репликация ВНО происходит в моноцитах/макрофагах, тогда как Т-лимфоциты остаются неинфицированными, но при этом имеет место выраженная лимфопения. У больного наблюдается первый подъем температуры до 39,5-40,5°С, сопровождающийся ознобом, тошной, рвотой, мучительной головной болью.
Вирус распространяется из лимфатических узлов фагоцитирущими клетками крови по внутренним органам через выносящие (эфферентные) лимфатические сосуды. Обладая выраженным тропизмом к тканям эктодермального происхождения, вирус проникает в эпителий кожи и слизистых, в печень, костный мозг и другие ткани и органы ретикулоэндотелиальной системы, где начинается его репликация. Количество вируса через 4-5 сут уже превышает емкость ретикуло-эндотелиальной системы, и он вновь проникает в кровяное русло.
Вторичная виремия обычно соответствует началу клинической манифестации болезни. Развиваются паренхиматозные изменения во внутренних органах. Е1а коже начинается циклическое развитие папулезной и везикуло-пустулезной сыпи (экзантем), заканчивающееся образованием корок. В тканях слизистых оболочек рта, языка, зева, гортани, трахеи и др. появляются внутренние сыпи — энантемы.
Начальный элемент сыпи на коже — макула (лат. macula — пятно) — пятно бледно-красного цвета, слегка возвышающееся над нормальной кожей. Развивается вследствие гиперемии дермы. Далее наступают отек, воспалительная инфильтрация сосочкового слоя эпидермиса и пролиферация глубоких слоев, создающая утолщения, что ведет к образованию бесполостных узелков или папул (лат. papula — узелок) на 3-7 сут болезни, более темного цвета и диаметром около 3 мм. Эпителиальные клетки глубокого слоя подвергаются коагуляционному некрозу и отчасти вакуольному перерождению, при котором протоплазма клеток разжижается, отходит от ядра, образуя перенуклеарные пространства, которые заполняются жидкостью. Клетки теряют ядра, оболочки их разрываются, и на 7-8 сут болезни образуется пузырек — везикула {лат. vesicula — пузырек), т. е. элемент, имеющий дно, покрышку и полость. Образование везикул сопровождается дискомплекцией эпидермальных клеток, расслаиванием эпидермиса и формированием длинных тяжей, направленных от основания пузырька к его верхушке и делящих его на камеры. Пролиферация клеток эпителия по периферии пузырька образует валик, приподнимая его края. В центре сохраняются тяжи, которые втягивают поверхностную оболочку пузырька. Это ведет к образованию оспины — везикулы с центральным (пупкообразным) западанием.
Западание в центре оспин характерно только для оспы. Оно не встречается при пустулезных дерматитах иной этиологии. Нарастающие явления воспаления в сосочковом слое дермы и миграции лейкоцитов из капилляров в экссудат, заполняющий пузырек, придают последнему молочно-мутный оттенок. Содержимое везикулы, как правило, подвержено вторичному инфицированию стафилококками, стрептококками и другими микробами, поэтому на 9-10 сут экссудат становится серозно-гнойным и приобретает серовато-желтую окраску; центральное западание исчезает, формируется оспенная пустула {лат. pustule — гнойничок). При повышенной проницаемости сосудов в экссудат проникает большое количество эритроцитов, пустула становится геморрагической.
Увеличение количества экссудата ведет к истончению стенки покрова пустулы с последующим нарушением его целостности. Через поврежденную стенку покрова содержимое вытекает из пустулы и, подсыхая, образует оспенную корку. Цвет корок зависит от состава экссудата: если в нем преобладает серозно-гнойное содержимое, то оно, подсыхая, образует серовато-бурые, а при геморрагическом компоненте — черные корки.
Второй подъем температуры наступает на 9—10 сут болезни. Он обусловлен нагноением содержимого пустул и связанного с ним всасывания пирогенных веществ, образующихся при разрушении клеток, а также вследствие присоединившейся вторичной инфекции. У больных, ослабленных оспенной инфекцией, вторичная инфекция может послужить причиной серьезных осложнений — вызвать флегмоны, абсцессы, рожистое воспаление, бронхопневмонию и т. д.
В основе патогенеза поксвирусных инфекций лежит способность вирусов к интерференции с защитными иммунными механизмами макроорганизма. Такая стратегия поксвирусов включает синтез инфицированными фагоцитирующими клетками вирусных гомологов хемокинов или хемокиновых рецепторов и других белков, связывающих хемокины, синтезируемые неинфицированными фагоцитирующими клетками. Она не оригинальна; применительно к фагоцитирующим клеткам такая стратегия используется большинством ДНК-вирусов (рис. 3.102; табл. 3.29).
Рис. 3.102. Модуляция хемокиновой системы ортопоквирусами. А. Экспрессия вирусных гомологов хемокинов, рецепторов хемокинов и хемокинсвязывающих белков. Б. Частный случай антихемокиновой стратегии — ингибирование миграции созревающих дендритных клеток (DC). Вирусные хемокинсвязывающие белки интерферируют с хемокинами CCL3 и CCL5. Несозревшие DC экспрессируют воспалительные хемокиновые рецепторы (CCR1, CXCR1) и мигрируют в инфицированные ткани в ответ на такие хемокины, как CCL3 и CCL5. Созревшие DC экспрессируют CCR7 и CXCR4 и мигрируют во вторичные лимфоидные органы в ответ на CCL19 и CXCL12, где они представляют антиген «наивным» Т-клет-кам. 1 — вирусный хемокин (антагонист); 2 — вирусный хемокин (агонист); 3 — хемокиновый рецептор; 4 — рецептор вирусного хемокина; 5 — сигнальная трансдукция и биологический эффект; 6 — клеточная миграция. По A. Alcami (2007)
Таблица 3.29. Портрет серийного убийцы: иммуномодулирующие гены ВНО*
|
Иммуномодулирующее действие |
Variola major |
Variola minor |
Комментарии |
|
IFN-a/p-ингибитор |
B20R |
D9R |
He проверено |
|
IFN-у-ингибитор |
B9R |
H9R |
Ингибирование человеческого IFN-y |
|
е1Р2а-мимикрия |
C3L |
D3L |
He проверено |
|
dsRNA-BP |
E3L |
C3L |
He проверено |
|
Ингибитор фактора некроза опухолей |
G2R |
G2R |
He проверено |
|
Ингибитор NF-kB |
P1L |
P1L |
He проверено |
|
TLR сигнальный ингибитор |
A52R |
A56R |
He проверено |
|
IL-18-связывающий белок |
D5L |
B6L |
Ингибитор человеческого IE-18 |
|
Хемокинсвязывающие белки |
G3R |
A46L |
G3R ингибирует у людей хемокины СС |
|
Фактор роста вирусов |
G3R |
B3R |
Связывает и активирует человеческий EGF-R (erbBl) |
|
Ингибитор комплемента/SPICE |
D12L |
B18L |
Ингибирует каскад комплемента у людей |
|
GM-CSF/IL-2 ингибитор |
A46R |
A49L |
Не проверено |
|
Семафорин |
A42R |
A45R |
Не проверено |
|
Серпины |
B13R, B25R, C2L |
D14R, D2R |
Не проверено |
* Такое название таблице дал ее составитель — G. McFadden (2004).
Постоянно находясь во влажной среде, слизистые оболочки верхних дыхательных путей мацерируются, изъязвляются, и заразное содержимое, выделяясь на влажную поверхность слизистой оболочки, инфицирует секрет и служит материалом для образования капельной инфекции. Выделение вируса из зева отмечалось, начиная с 3-4 сут, т. е. практически с появления энантемы, и продолжалось в течение 7-9 и даже 13 сут в зависимости от тяжести болезни и ее типа.
Циркулирующие в крови специфические антитела выявляются уже на 7 сут после инфицирования человека ВНО, и их максимальный уровень достигается на 14 сут. Одновременно с нарастанием количества специфических антител, происходит снижение количества вируса в тканях.
Клиническая и патологоанатомическая картина натуральной оспы у человека при естественном инфицировании. 4 Течение типичных форм болезни средней тяжести у непривитых включает три периода:
1) инкубацию;
2) болезнь;
3) выздоровление.
Инкубационный период чаще всего длится 9-12 сут. Максимальная его продолжительность — 15 сут.
Период болезни подразделяется на:
а) стадию предвестников (продром), в среднем длящуюся 2-4 сут;
б) стадию высыпания продолжительностью 4-5 сут;
в) стадию нагноения длительностью 7-10 сут.
Период выздоровления длится 20-30 сут. В нем выделяют стадию подсыхания и стадию отпадения корок. В целом заболевание средней тяжести продолжается около 6 недель, но иногда принимает затяжное течение и длится до 3 месяцев и дольше. Легкие формы болезни имеют меньшую продолжительность. Известны легкие заболевания, которые длятся один день (эфемерные формы оспы).
Клиническая картина натуральной оспы обусловливается тяжестью развивающегося инфекционного процесса. Существуют разные классификации клинических форм натуральной оспы. В табл. 3.30 приведена классификация из работы С. С. Маренниковой и С. Н. Щелкунова (1998). Ниже приведена классификация и клиническое описание П. Н. Бургасова, Г. П. Николаевского (1972). Эти авторы различают следующие формы натуральной оспы:
1. Тяжелые
Геморрагическая оспа:
оспенная пурпура — purpura variolosa;
пустулезно-геморрагическая или черная оспа — Variola pustulosa haemorrhagika;
сливная оспа — variola confluens.
2. Средней тяжести
Рассеянная оспа — variola vera discreta.
3. Легкие
вариолоид — variolois;
оспа без сыпи — variola sine exanthemate;
оспа без температуры — variola afebrilis.
Геморрагическая форма оспы — тяжело протекающая болезнь с наличием геморрагического диатеза. Если кровоизлияния появляются в раннем периоде предвестников, болезнь принимает крайне тяжелую форму с летальностью до 100 %, известную ную в клинике как оспенная пурпура (purpura variolosa).
Таблица 3.30. Классификация клинических типов большой оспы (variola major)*
|
Тип |
Основные особенности |
|
Обычная |
Распространенная сыпь, элементы которой проходят характерную эволюцию (макула —» папула —» везикула —» пустула —» корки). Подтипы: сливная — сливная сыпь на лице и разгибательных поверхностях конечностей, дискретная на остальных частях тела; полусливная — сливная сыпь на лице и дискретная на теле и конечностях; дискретная — оспины рассеяны по всему телу с нормальной кожей между ними |
|
Модифицированная (вариолоид) |
Подобна обычной (может быть сливной, полусливной и дискретной), но отличается ускоренным течением и отсутствием токсикоза |
|
Оспа без сыпи |
Лихорадка и другие продромальные симптомы, оспенная сыпь не развивается; наблюдается у лиц с высокой напряженностью иммунитета, однако в редких случаях встречается и у невакцинированных; диагноз подтверждается серологически |
|
Плоская |
Элементы сыпи плоские, как бы утоплены в коже и в большинстве случаев, не имеющие характерного западения в центре. Пустулы наблюдаются очень редко. Заболевание протекает на фоне высокой температуры и тяжелого токсикоза и часто сопровождается осложнениями со стороны легких. Могут наблюдаться отслоения кожи в местах поражений. В отличие от геморрагических форм оспы большую часть больных плоской формой оспы составляют дети. Летальность очень высока, при сливном типе плоской оспы — 100 %. Подтипы: сливная, полусливная, дискретная |
|
Геморрагическая |
Распространенные геморрагии в кожу и/или слизистые оболочки в одной или другой стадиях болезни ранняя — развитие геморрагии на коже и слизистых, начиная с продромальной стадии, всегда смертельна поздняя — геморрагии на коже и/или слизистых после появления сыпи, обычно смертельна |
* По С. С. Маренниковой и С. Н. Щелкунову (1998).
Появление кровоизлияний в более поздний период болезни, в стадии пустул, ведет к развитию пустулезно-геморрагической оспы (variola pustulosa haemorrhagica) с летальностью от 70 до 100 % (рис. 3.103).
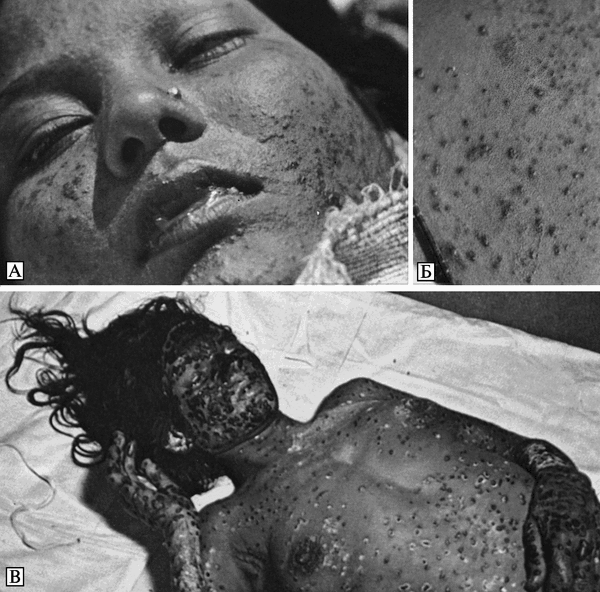
Рис. 3.103. Геморрагическая натуральная оспа. А и Б. Ранняя стадия геморрагической натуральной оспы у беременной 18-летней женщины. Тяжелая токсемия, петехиальные экзантемы, кровотечения из полостей тела. Снимок сделан за час до смерти пациентки. В. Поздняя стадия геморрагической натуральной оспы у молодой женщины. Кровотечения у основания пустул и общий геморрагический диатез. По F. Fenner et al. (1988)
При оспенной пурпуре инкубационный период длится не более 6-9 сут. Температура в первый день болезни поднимается до 41-42°С. Характерным для этой формы натуральной оспы является развитие множественных кровоизлияний в кожу и слизистые оболочки, важным симптомом являются кровоизлияния в субконъюнкти-вальную слизистую оболочку. Возникают обильные кровотечения из носа, рта, дыхательных путей, желудка, почек и других внутренних органов. Смерть обычно наступает на 2-3 сут болезни еще до развития оспенных высыпаний от резкого упадка сердечной деятельности.
Для пустулезно-геморрагической оспы также характерны укороченный инкубационный период, высокая температура, токсикоз. Геморрагии могут появиться в первые дни болезни, в период образования папул, но, как правило, геморрагический диатез развивается на 8-10 сут и совпадает с образованием пустул. Кровоизлияния в содержимое пустул придают им вначале темно-коричневый, а позже черный цвет, что и послужило причиной названия черная оспа (variola nigra) (см. рис. 3.103).
В это время у больных появляется кровь в мокроте, моче, рвотных массах. Особенно тяжело протекает заболевание у беременных женщин. В результате токсикоза возникают кровоизлияния в матке, что ведет к самопроизвольному аборту и профуз-ному кровотечению. При пустулезно-геморрагической форме оспы смерть наступает на 8-12 сут болезни.
Сливная оспа (variola confluens). Начало болезни характеризуется высокой температурой (41-42 °С), сильными головными болями, тошнотой, рвотой, болями в мышцах, особенно в области крестца. Сыпь, появившись, быстро распространяется по всему телу, особенно поражая волосистую часть головы, лицо, слизистые оболочки верхних дыхательных путей и конъюнктиву глаз (рис. 3.104).
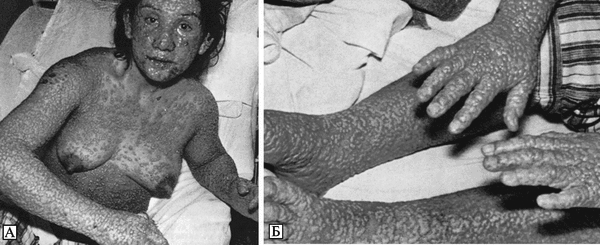
Рис. 3.104. Сливная форма натуральной оспы у невакцинированной женщины. Снимок сделан на девятые сутки от начала болезни. На лице пустулы слились, на туловище, руках и ногах они дискретны. По F. Fenner et al. (1988)
Для сливной оспы характерно образование большого количества высыпных элементов и ускоренное образование пустул, процесс развития которых заканчивается к 5-6 сут болезни. В периоде нагноения отдельные пустулы сливаются и образуют сплошные пузыри, заполненные гноем, иногда величиной больше ладони. Увеличивающееся количество гнойного экссудата растягивает и истончает стенку пузыря; целостность ее легко нарушается, и содержимое вытекает наружу. Подсыхая, гной образует корки, которые, как панцирем, сковывают тело больного. С появлением высыпных элементов температура понижается незначительно, оставаясь в пределах 40 °С. Не отмечается повышения ее и в период нагноения пустул. Поэтому типичная для заболевания оспой двухволновая температурная кривая отсутствует. У больных отмечается сильная интоксикация организма, появляется бред, наступает коматозное состояние и с нарастающими явлениями упадка сердечной деятельности больные часто погибают. Летальность при сливной форме оспы достигает 30 %. В случае выздоровления на кожных покровах и, особенно на лице, остаются глубокие обезображивающие рубцы.
Оспа средней тяжести (variola vera discreta). Инкубационный период продолжительностью обычно 14 сут; иногда он может быть короче — 5-7 сут, а в редких случаях может затянуться до 17-22 сут. В инкубационном периоде заразившийся человек чувствует себя вполне удовлетворительно. Болезнь начинается внезапно потрясающим ознобом. Это начальный, или продромальный, период заболевания, который длится 3-4 сут. У больного резко поднимается температура, достигая 39,5-40,5 °С, иногда 41 °С, учащаются пульс и дыхание, наблюдается тошнота, рвота, мучительная головная боль и характерная боль в области крестца. Слизистые оболочки мягкого неба, носоглотки и зева резко воспалены, язык сухой, обложенный. У детей могут появиться судороги. Печень и селезенка увеличены, диурез уменьшается, удельный вес мочи высокий. Таким образом, уже в начальном продромальном периоде ярко выступают признаки тяжелой интоксикации организма.
На 2-3 сут болезни примерно у 40 % больных появляется продромальная, или токсическая, сыпь, известная в клинике под названием «реш» (rose rash). Высыпания появляются вначале на лице, затем на конечностях (как правило, на разгибательной поверхности) и на туловище. Единичные петехии могут быть и на конъюнктивах. Продромальная сыпь, имея вид мелких красных пятен, может по своему характеру быть похожа на коревую или скарлатинозную — петехиальную. Характерна локализация сыпи. Она располагается в области бедренного треугольника Симона: основанием треугольника служит поперечная линия на уровне пупка, а вершина находится в области коленных суставов, включая переднюю поверхность бедер, или в области большой грудной мышцы (грудной треугольник). Особенно резко сыпь выступает на участках кожи, где в инкубационном периоде применялись механические или химические раздражители (наложение горчичников, повязок, смазывание йодом и другими раздражающими кожу веществами) (рис. 3.105).
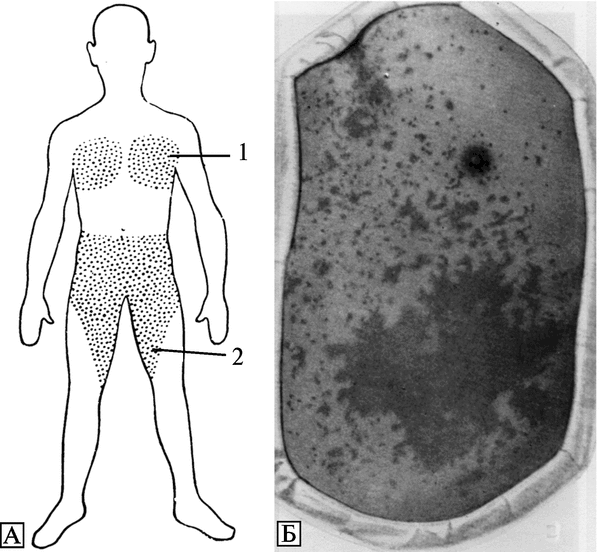
Рис. 3.105. Продромальная сыпь у больного натуральной оспой. А. Локализация продромальной сыпи. 1 — грудные треугольники; 2 — треугольник Симона. Б. Кореподобная продромальная сыпь на латеральной стороне туловища на четвертые сутки болезни. По F. Fenner et al. (1988)
Обратное развитие продромальной сыпи происходит быстро, обычно в течение 12-24 ч. Сыпь бледнеет и исчезает, но иногда следы ее в виде мелких буроватых пятен сохраняются до появления типичных оспенных высыпаний. К концу 4 сут в период продромальных явлений у больного резко снижается температура почти до нормы, улучшается общее состояние, и на этом фоне появляется характерная для натуральной оспы сыпь.
Такое улучшение состояния больного в период появления сыпи патогномонично только для натуральной оспы и не встречается при других инфекциях, сопровождающихся экзантемами и энантемами. Высыпания появляются не только на кожных покровах, но и на слизистых оболочках конъюнктив, щек, мягкого неба, носоглотки, бронхов, пищевода и т. д. Раньше всего сыпь появляется на лице, волосистой части головы, шее, затем на руках, туловище и ногах. Наиболее интенсивна сыпь на лице, предплечьях и тыльной поверхности кисти. На ногах сыпь обильнее на голенях, чем на бедрах. На конечностях высыпаний значительно больше на разгибательной стороне, чем на сгибательной. На ладонях и подошвах также наблюдаются высыпные элементы. Обнаружение их является важным диагностическим симптомом натуральной оспы. На туловище и животе, как правило, элементы сыпи менее выражены. Подобная локализация указывает на центробежное распределение сыпи, т. е. преобладание высыпаний на периферии (рис. 3.106).
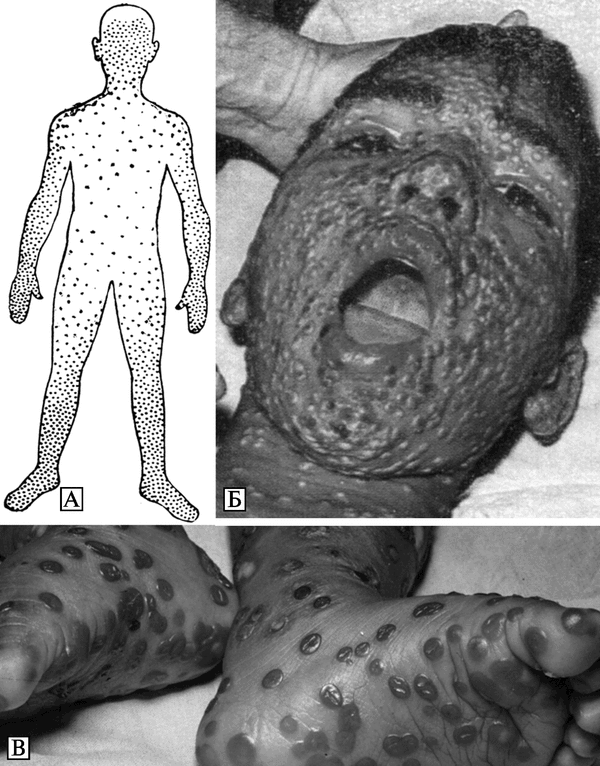
Рис. 3.106. Сыпь у больного натуральной оспой. А. Характерная локализация сыпи. Б. Раньше всего сыпь появляется на лице. По П. Н. Бургасову, Г. П. Николаевскому (1972). В. Сыпь на ладонях и подошвах характерна для натуральной оспы и оспы обезьян. По F. Fenner et al. (1988)
С образованием пустул начинается период нагноения. Он сопровождается вторичным подъемом температуры и резким ухудшением состояния больного. Температура держится в течение нескольких дней вплоть до подсыхания пустул. Присоединяющаяся вторичная инфекция отягощает клиническую картину болезни. В этот период наступает отек кожи, особенно на лице. Отек настолько силен, что больной не может открыть глаза. Оспенная сыпь, располагаясь по краю века, травмирует роговицу, а последующая вторичная инфекция вызывает воспаление роговицы и радужной оболочки. Часто наблюдаются кровоизлияния в субконъюнктивальную слизистую оболочку. Это ведет к развитию панофтальмита, кератита и ирита, что в дальнейшем может привести к потере зрения. Гнойным экссудатом заполнены носовые ходы; слизистая оболочка верхних дыхательных путей резко отечна, с многочисленными эрозиями. Обилие высыпаний создает напряжение воспаленной кожи, а сильная отечность фактически лишает больного активных движений. Резкая боль и отек настолько сильны, что больной не может шевелить пальцами.
В этот период больные часто погибают от бронхопневмонии, ослабления сердечной деятельности и от сепсиса, вызываемого вторичной инфекцией. С 12-14 сут гнойное содержимое пустул начинает подсыхать с образованием плотных корок, которые постепенно отпадают. Процесс обратного развития оспин протекает в том же порядке, что и процесс высыпания, т. е. начинается с лица, а затем переходит на туловище и конечности. Дольше всего оспины остаются на подошвах и ладонях. Из-за плотности эпидермального слоя гнойный экссудат не вытекает наружу, а медленно рассасывается, оставляя плотные темные пятна. Отечность, воспаление кожи и слизистых оболочек постепенно исчезают, общее состояние больного улучшается, температура снижается, и после полного подсыхания содержимого пустул кожа становится нормальной. В этот период появляется мучительный нестерпимый зуд кожи и часто, расчесывая ее до крови, сдирая корки, больной вносит инфекцию, что вновь вызывает нагноение и подъем температуры. На месте отпавших корок остаются красноватые пятна, а у людей со смуглой кожей — пятна депигментации, впоследствии проходящие. В том случае, если нагноением были затронуты глубокие слои кожи, то после отпадения корок образуются стойкие обезображивающие рубцы, особенно заметные на лице. Развитие рубцов в глазу ведет к частичной или чаще к полной потере зрения. В неосложненных случаях болезнь обычно продолжается 5—6 нед. Летальность при этой форме оспы составляет до 15 %.
Легкие формы оспы. Вариолоид (variolois ). Вариолоид — видоизмененная стертая форма оспы с легким и коротким течением болезни, незначительным и абортивным развитием сыпи. Это заболевание иногда называют оспой привитых, тем самым подчеркивая, что оно часто встречается у лиц, привитых против оспы.
Продолжительность инкубационного периода при вариолоиде, как и при натуральной оспе, длится около 2 нед. Продромальный период мало отличается от такового при типичной форме заболевания, но симптомы менее выражены, а сыпь, имеющая пятнистый (эритематозный) характер, часто отсутствует. Заболевание начинается внезапно с резкого подъема температуры, которая в редких случаях превышает 39 °С. У больного появляются головная боль, небольшое раздражение слизистых оболочек глотки, зева, трахеи, боль при кашле и глотании. Большинство больных жалуются на боли в области крестца, что характерно для оспы. Сильный токсикоз развивается крайне редко. Сыпь появляется на 3-4 сут болезни. Она представляет собой мелкие красные пятна, быстро переходящие в папулы и пузырьки, расположенные более поверхностно, чем при натуральной оспе. Пузырьки окружены узким красным венчиком. Характерное для оспы центральное втяжение, как правило, отсутствует. На 7-8 сут содержимое пузырька подсыхает и образуется корочка, которая быстро отпадает. На месте отпавшей корочки остается исчезающее пигментное пятно. Рубец при вариолоиде формируется очень редко. С появлением сыпи на 3-4 сут болезни температура быстро нормализуется и больше не поднимается, так как период нагноения отсутствует. В редких случаях имеет место нагноительный процесс, но он всегда выражен крайне слабо, что ведет к незначительному и кратковременному подъему температуры. С установлением нормальной температуры исчезают и общие явления — головная боль, раздражение слизистых оболочек. Болезнь заканчивается на 7-8 сут, и лишь в тяжело протекающих случаях бывают смертельные исходы. Летальность при вариолоиде 1,5-3 %.
Оспа без сыпи (variola sine exanthemate) — легко протекающая болезнь, при которой в начальном периоде наблюдаются характерные для натуральной оспы симптомы: повышение температуры, головная боль, боль в области крестца и иногда как результат токсикоза продромальная сыпь, однако характерная оспенная сыпь отсутствует. Заболевание заканчивается через 3—4 сут.
Оспа без температуры {variola afebrilis). При этой форме оспы на теле больного появляется скудная, быстро проходящая узелково-пузырчатая сыпь. Заболевание проходит без повышения температуры и нарушения общего состояния заболевшего.
С. С. Маренникова и С. Н. Щелкунов (1998) упомянули в своей работе об интересном наблюдении Kempe et al. (1969), которые отметили у 21 из 55 контактировавших с больными натуральной оспой развитие конъюнктивита, явившегося единственным проявлением оспенной инфекции. У 12 из 21 обследованного оспенная природа конъюнктивита была подтверждена выделением из конъюнктивального экссудата вируса оспы. В другой серии наблюдений этой же группы авторов вирус был обнаружен в слезах у таких лиц. При натуральной оспе описаны и так называемые субкли-нические формы, при которых не обнаруживается никаких клинических проявлений и диагноз может быть установлен только на основании серологического обследования. Наличие таких форм было установлено как во время вспышек variola major , так и variola minor.
О существовании врожденной формы натуральной оспы было известно еще с середины XVIII в. Ее неоднократно наблюдали как при вспышках variola major, так и variola minor. Известны два варианта врожденной натуральной оспы: истинная, когда плод рождается с явными признаками болезни; и ложная — развивающаяся уже после родов (в пределах инкубационного периода). Описаны случаи рождения двойни, когда один из новорожденных появлялся на свет с кожными проявлениями оспы, а другой оставался здоровым (Маренникова С. С. и Щелкунов С. Н., 1998).
Основные патологоанатомические изменения происходят в коже. Они характеризуются двумя видами нарушений, развивающихся в клетках эпидермиса: баллонирую-щей дегенерацией и ретикулярной колликвацией. Баллонирующая дегенерация обнаруживается в нижних слоях эпидермиса (зародышевый и частично шиловидный слои). Она проявляется в набухании и округлении клеток эпителия, потере ими межклеточных связей. В результате этого клетки напоминают скопления «баллонов» в межэпителиальном пространстве. Ядра клеток увеличены, в цитоплазме обнаруживаются тельца Гварниери. В верхних слоях эпителия развивается ретикулярная дегенерация с образованием небольших вакуолей в цитоплазме; протоплазма пораженных клеток приобретает сетчатый вид. Постепенно границы клеток исчезают. За счет поступления экстрацеллюлярной жидкости из окружающих тканей и дискомплексации эпителия с образованием вертикальных тяжей формируется увеличивающаяся многокамерная полость. Эта стадия соответствует образованию папул на коже больного. В дальнейшем поступление экссудата увеличивается, и папулы постепенно переходят в везикулы. Верхняя часть везикулы образуется из клеток зернистого и рогового слоя эпидермиса, который не затрагивается существенно патологическим процессом. Уже в начале формирования везикулы обнаруживается центральное западение, выявляющееся при макроскопическом наблюдении. Основание везикулы образуется клетками кориума, иногда сохраняются и элементы герминативного слоя. Одновременно с развитием дегенеративных изменений в оспенном элементе по периферии пузырька происходит пролиферация. Проникновение лейкоцитов в везикулу превращает ее в пустулу. Затем происходит постепенное подсыхание элемента с превращением его в корочку. Заживление может идти двояко. Если в процессе образования оспины не был задет слой собственно кожи (сохранилась хотя бы часть клеток зародышевого слоя), восстановление целостности эпидермиса происходит без образования рубца. Если же в процесс была вовлечена собственно кожа (особенно при вторичной инфекции), образуется характерный соединительнотканный рубчик.
Разрушительные изменения особенно выражены на лице, где много сальных желез, погибающих в результате патологического процесса. Потовые железы обычно не повреждаются. В волосяных фолликулах может быть баллонирующая дегенерация, но материнский, основной слой не повреждается, благодаря чему волосяные фолликулы полностью восстанавливаются.
Патогистология оспенных элементов на слизистых оболочках в основных чертах напоминает процесс их развития на коже. Различия заключаются в изъязвлении элементов оспенной энантемы, обусловленной отсутствием рогового слоя эпителия. Изменения на слизистых оболочках обычно заканчиваются к 3-й неделе без образования рубцов. Во внутренних органах (печени, почках, сердце) наблюдаются дистрофические изменения, в костном мозгу — участки некроза, пролиферативные изменения. Селезенка увеличена. Часто находят орхит, воспаление яичников и слизистых оболочек труб матки. Могут иметь место очаговые пневмонии в нижних долях легких. До применения антибиотиков у умерших от натуральной оспы нередко находили пневмонии, связанные с аспирацией отмершей ткани и вторичной инфекцией, нередко с исходом в абсцесс или гангрену легких.
При геморрагических формах оспы изменения носят более тяжелый характер. В коже наблюдаются распространенные кровоизлияния, отек. В трахее и желудочно-кишечном тракте обнаруживают субмукозные геморрагии. Кровоизлияния могут быть под эндокардом, в почках, яичниках и тестикулах. Универсальная гиперплазия лимфатических узлов. Полнокровие и отек легких. Оспенные элементы на коже не успевают проделать полную эволюцию; они наблюдаются (если имеются) лишь до стадии папул.
Клиническая и патологоанатомическая картина оспы обезьян у человека при естественном инфицировании 5 . Клиника оспы обезьян у людей различается в зависимости от того, к какой кладе принадлежит вызвавший болезнь вирус. ВОО, циркулирующие среди обезьян, обитающих в бассейне реки Конго, вызывают опасные клинические формы болезни, сходные с натуральной оспой; ВОО из Западной Африки вызывают у людей легкие формы оспы обезьян.
Инкубационный период оспы обезьян укладывается в 7-19 сут. Болезнь, как правило, начинается с подъема температуры, слабости, недомогания, головной боли, иногда появляются боли в горле, кашель. Особенностью клинического течения оспы обезьян у человека, отличающей ее от натуральной оспы, являются лимфадениты, которые наблюдаются у 86,4 % заболевших. Они появляются, как правило, одновременно с лихорадкой, за 1—2 сут до высыпания и иногда совпадают с его началом. В ряде случаев лимфадениты служат поводом для обращения за медицинской помощью. Их локализация варьирует (подчелюстные, шейные, подмышечные, паховые), причем, иногда они двусторонние, иногда односторонние. В 11 % случаев лимфадениты возникают в лимфоузлах разных областей (например, на шее и в подмышечной области), чаще всего (в 63,9 %) развивается генерализованная лимфаденопатия. Через 2-4 сут от начала болезни появляется сыпь. Сыпь локализуется на всем теле с преимущественным поражением лица и конечностей, включая ладони и подошвы. Как и при оспе, высыпания отмечаются и на слизистых оболочках, а также языке. Элементы сыпи мономорфны и претерпевают те же стадии развития (папулы — везикулы — пустулы — корки). После отпадения корок на коже остаются депигментированные участки, на месте которых формируются отчетливые, но неглубокие рубцы, или ги-перпигментированные пятна. Болезнь обычно длится 2—4 недели в зависимости от клинического течения и других факторов.
В целом по характеру клинического течения оспа обезьян у человека напоминает тип натуральной оспы, преобладавший на африканском континенте, давая картину, близкую к обычной дискретной, полусливной и сливной ее формам (рис. 3.107).
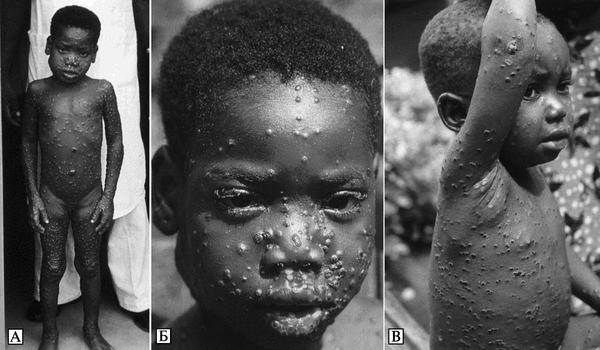
Рис. 3.107. Оспа обезьян у жителей Заира. А и Б. Семилетняя девочка на 7 сут болезни. Хорошо заметна паховая билатеральная аденопатия и увеличение подчелюстных лимфатических узлов на правой стороне лица. Пустулярные поражения губ. Локализация сыпи такая же, как и при натуральной оспе. В. Трехлетний мальчик с сыпью на стадии корок. Аксиллярные лимфатические узлы все еще увеличены. По F. Fenner et al. (1988)
Помимо этих основных форм, встречаются и другие. Имеется информация о геморрагической форме оспы обезьян у ребенка, протекавшей аналогично оспенной геморрагической пурпуре и закончившейся летальным исходом. Наблюдалось и очень легкое течение оспы обезьян по типу вариолоида с единичными кожными элементами. При оспе обезьян встречается субклиническая форма болезни, описанная при натуральной оспе. О наличии этой формы судят по появлению антител у лиц, имевших контакт с заболевшими оспой обезьян. Был зарегистрирован случай врожденной инфекции у младенца, родившегося от матери, незадолго до родов перенесшей оспу обезьян. Подобного рода наблюдения неоднократно описывались при натуральной оспе. Среди осложнений при оспе обезьян наиболее часто встречается вторичная бактериальная инфекция кожи, бронхопневмония, диарея и связанная с ней дегидратация, кератиты. Последние в части случаев заканчиваются потерей зрения или его ослаблением.
В 2003 г. оспу обезьян среди жителей штата Висконсин (11 заболевших) вызвал ВОО, циркулирующий в Западной Африке, поэтому среди заболевших не было смертельных случаев. Первыми признаками болезни у них были поражении кожи в участке места или царапины, нанесенных больными животными, головная боль, повышенная температура тела (более 38 °С), профузный пот и сильный озноб. У 73 % заболевших болезнь проявила себя сильным кашлем, у 55 % лимфоаденопатией и язвами в гортани, у 27 % наблюдали фарингит, у 18 % диарею. Легкие, сердце, органы брюшной полости, нервная система — без изменений. У пяти пациентов, преимущественно с кожными поражениями, имела место узловая припухлость вокруг мест укусов и царапин. У шести пациентов, не имевших видимых следов укусов или царапин, обнаружены от 1 до 50 оспин (от папул до везикулопустул) в течение 7 сут от начала болезни на лице, коже черепа, кистях руках, ногах, туловище, промежности, конъюнктиве (рис. 3.108).
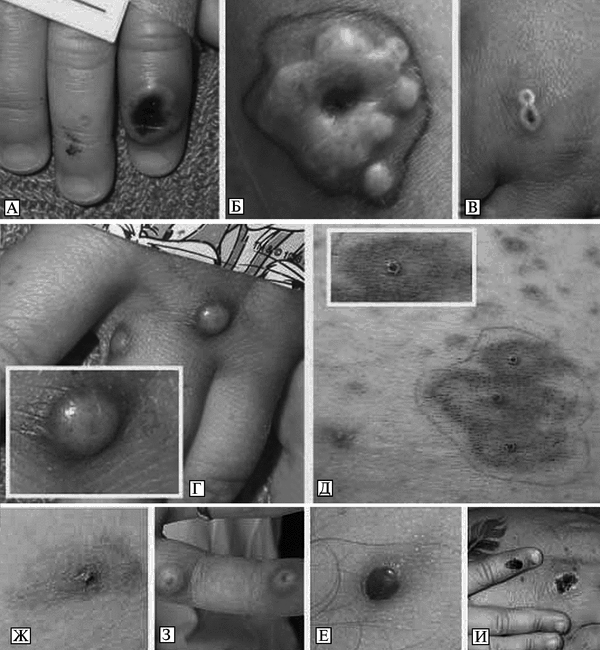
Рис. 3.108. Кожные поражения при оспе обезьян вокруг участков укусов и царапинужителей штата Висконсин (США). А, Б, В. Узловая припухлость вокруг участков укусов и царапин. Г. Оспопоподобные высыпания. Д. Высыпания, сходные с ветряной оспой. Ж. Кожное поражение менее чем через 24 ч после его появления. 3. Поражение через 6 сут. Е. Поражение через 96 ч. И. Поражение более чем через 9 сут. По К. D. Reed et al. (2004)
Клиническая картина и патоморфология натуральной оспы и оспы обезьян у животных при искусственном инфицировании. Натуральную оспу воспроизвести у традиционных лабораторных животных (грызуны, кролики) сложно, так как они маловосприимчивы к ВНО, и если у них удается вызвать болезнь, то она протекает в мягкой форме и быстро обрывается. К ВОО эти животные более чувствительны, однако не настолько, чтобы считаться оптимальной моделью. Для моделирования клиники и патогенеза натуральной оспы и оспы обезьян используют три подхода:
1) подбирают дозу и способ заражения, вызывающие у приматов болезнь, сходную по патогенезу и клинике с моделируемой болезнью;
2) модельное животное заражают не ВНО или ВОО, а другим ортопоксвирусом, вызывающим у него инфекционный процесс, аналогичный натуральной оспе или оспе обезьян, т. е. проводят исследование «по аналогии»;
3) используют для заражения иммунодефицитных животных, например, мышей линии C57BL/6, утративших STAT1 — белок, участвующий в регуляции синтеза интер-
феронов.
В табл. 3.31 обобщены основные поражения у модельных животных при различных путях заражения вирусами натуральной оспы и оспы обезьян.
Таблица 3.31. Основные поражения у модельных животных при различных путях заражения вирусами натуральной оспы и оспы обезьян*
|
Вирус |
Модельное животное |
Вид животных |
Путь заражения |
Доза (штамм) |
Основные поражения |
|
ВНО |
Обезьяны Macaque |
cynomolgus |
В/в |
10 9 КОЕ (Harper, India) |
Геморрагии во внутренних органах, на коже, слизистых; геморрагические выпоты, ранние энантемы/экзантемы; смерть |
|
10 8 КОЕ (Harper, India) |
Энантемы/экзантемы |
||||
|
Ингаляционно |
10 8 ' 5 КОЕ (Yamada, Lee) |
Общая инфекция, легочные поражения, экзантемы |
|||
|
Yamada |
Общая инфекция, возможные поражения легких, редкие энантемы/экзантемы |
||||
|
l,8xl0 6 —3,4xl0 6 (Lee); 5xl0 5 —2xl0 6 (Yamada) |
Умеренный бронхит без некроза, лимфоидная гиперплазия, экзантемы |
||||
|
ВОО |
Обезьяны Macaque
|
cynomolgus |
В/в |
5xl0 7 КОЕ |
Везикулопустулярная сыпь, лимфо-аденопатия, спленомегалия |
|
rhesus |
2x10 7 КОЕ |
Везикулопустулярная сыпь, лимфоаденопатия |
|||
|
cynomolgus |
Ингаляционно |
ЮхЮ 3 —141xl0 3 КОЕ |
Фибринонекротическая бронхопневмония, пролиферативный и некротизирующий дерматит, лимфоидный некроз |
||
|
И/т |
10 7 КОЕ |
Фибринонекротическая бронхопневмония, пролиферативный и некротизирующий дерматит, трахеит, некротизирующий лимфаденит и спленит |
|||
|
10 6 КОЕ |
Умеренная некротизирующая бронхопневмония, трахеит, лимфаденит |
||||
|
Земляные белки |
13 линия |
В/б |
12,6xl0 3 КОЕ |
Некроз центральной доли печени, интерстициальная пневмония, мультифокальный некроз селезенки |
|
|
П/к |
100 КОЕ |
Мультифокальный некроз печени и селезенки, легочная геморрагия, отек и острое воспаление |
|||
|
И/н |
25,2xl0 3 КОЕ |
Диффузный некроз печени, интерстициальная пневмония, мультифокальный некроз селезенки |
|||
|
Луговые собачки |
чернохвостые |
В/б |
12,6xl0 3 КОЕ |
Некроз селезенки, некроз центральной доли печени, умеренная интерстициальная пневмония |
|
|
В/в |
25xl0 3 КОЕ |
Выраженный отек легких, геморрагии и некрозы |
* J. L. Chapman et al. (2010).
Вызвать у приматов болезнь, сходную по патогенезу и клинике с натуральной оспой, можно внутривенным введением 10 9 КОЕ ВНО (штаммы Harper или India). У макак развивается смертельная болезнь, сходная с геморрагической формой натуральной оспы у людей. Уменьшение дозы вируса на порядок (10 8 КОЕ) позволяет получить у приматов клиническую форму болезни, соответствующую variola vera discrete у человека.
У животного развивается петехиальная сыпь, затем появляются везикулы и пустулы с таким же центробежным распределением, как и при натуральной оспе. У погибших животных на вскрытии обнаруживают петехиальные геморрагии на поверхности слизистых и серозных тканей, геморрагический некроз висцеральных лимфатических узлов. Гистологически обнаруживают лимфоидное истощение и лим-фоцитолиз лимфоидной ткани, селезенки, периферийных и висцеральных лимфатических узлов, кишечника и костного мозга, дегенерацию почечных канальцев и гепа-тоцеллюлярную дегенерацию, аналогичную таковым, наблюдаемым при натуральной оспе у людей. Кожа и слизистая поверхность ротовой полости включают очаги эпидермальной/эпителиальной дегенерации и некроза с формированием везикул и пустул, аналогичных тем, что развиваются у людей при натуральной оспе (рис. 3.109).

Рис. 3.109. Внешние проявления патологического процесса у обезьяны, вызванного заражением ВНО. А. Диффузные геморрагии на серозной поверхности дистального отдела кишечника и увеличение кишечных лимфатических узлов через 6 сут после заражения. Б. Геморрагический колит, геморрагические поражения кишечных лимфатических узлов. В. Верхняя губа и ноздря обезьяны через 11 сут после заражения. Синхронное развитие пустул, некоторые из них еще сохранили пупкообразное запа-дение. Г. Ладонная поверхность левой верхней конечности обезьяны, 11 сут после инфицирования. Дискретные и сливающиеся пустулы сохранили целостность из-за сильно ороговевшего эпидермиса. По P. Jahrling et al. (2004)
М. С. Lancaster et al. (1966) исследовали патологические изменения у экспериментальных животных, образующиеся после инфицирования мелкодисперсными (1 мкм) аэрозолями вирусов группы оспы. Ими установлено, что при ингаляционном экспонировании кроликов к аэрозолю вируса кроличьей оспы (Myxoma virus, MYX) 6 , первые поражения в легочной ткани кролика отмечали на 4 сут. В альвеолах они представлены участками геморрагий с миграцией воспалительных клеток из соседних кровеносных сосудов. На следующие сутки макроскопически видимые поражения появились на поверхности легкого, а при микроскопическом исследовании на бронхиолах можно было увидеть типичные пустулы. Обнаруживались явная геморрагия и гиперемия капилляров соседних альвеол. Поражения были окружены зоной нейтрофильной инфильтрации и подобную инфильтрацию отмечали на поверхности наружного слоя стенок соответствующих артерий. На 6 сут на бронхиолах появились самые крупные пустулы, они были обнаружены также и на альвеолах; эти пустулы, хотя и были меньше по сравнению с поражениями бронхиол, показали типичную картину центрального некроза с окружающей инфильтрацией нейтрофилов. Наблюдались пролиферативные изменения во внутренних оболочках бронхиальных артерий с отеком и нейтрофиль-ной инфильтрацией наружного слоя стенки кровеносного сосуда. На 8 сут, несмотря на то, что пустулы, прогрессировали в своем развитии, создавая большие очаги некроза, наиболее ярко выраженным признаком являлся широко распространенный острый артериит с пролиферацией клеток эндотелия, макроскопическим отеком мышечной оболочки и некрозом и нейтрофильной инфильтрацией наружного слоя стенки кровеносных сосудов. К 10 сут острая воспалительная реакция распространилась на большие участки альвеол, заполненные отечной жидкостью, нейтрофилами, макрофагами и эритроцитами. Самые ранние признаки рассасывания появились только на 20 сут. Стенки артерий были очень отечными с воспалительными клетками в эндотелии, в то время как вместо нейтрофилов в альвеолярных поражениях появились лимфоциты. Даже на 62 сут были заметны остатки пустул; центральная некротическая зона содержала теперь отложения кальция и все еще была окружена зоной альвеолярных макрофагов и лимфоцитов. Отмечали повторное разрастание эпителия бронхиол, но упорно продолжалось утолщение мышечной оболочки стенок артерий за счет ее инфильтрации лимфатическими клетками из адвентициального слоя. Альвеолярные очаги представляли собой скопление лимфоцитов и гигантских клеток.
У обезьян, инфицированных ВНО ингаляционно, через 5 сут после заражения было хорошо заметно образование пустул в легочной ткани. Они представляли собой типичную широкую центральную зону некроза, внутри которой обнаруживались не-кротизированные элементы бронхиол; их окружала внешняя зона, образованная нейтрофилами и макрофагами. Соседние альвеолы были гиперемированы и заполнены отечной жидкостью, нейтрофилами и свободными альвеолярными фагоцитами. Участки очагов деструкции эпителия и нейтрофильной инфильтрации также появились и в основных бронхах. Имела место пролиферация во внутренней оболочке и отек мышечной оболочки и адвентициального слоя стенки артерий, находящихся вблизи поражений. Очень тяжелые поражения обнаружили на 3 сут, когда пустулы представляли собой обширные очаги некроза, окруженные широкими зонами альвеол, заполненных эксудатом. Просветы бронхов были заполнены нейтрофилами и продуктами клеточного распада. Обнаружены выступающие макроскопические поражения на плевральной поверхности, но они были, по-видимому, связаны с кровеносными сосудами, а не с первичной инфекцией альвеол. На 12 сут отмечали рассасывание поражений. Вместо нейтрофилов на внешних зонах пустул появлялись лимфатические клетки, и начиналось восстановление бронхиального эпителия.
Изменения в других тканях были обнаружены у кроликов, зараженных вирусом кроличьей оспы; наиболее заметными оказались изменения надпочечных желез и тестикул. Поражения представляли собой типичные пустулы, которые в надпочечной железе были ограничены поверхностным слоем органа. При микроскопическом исследовании поражения можно было обнаружить только в том случае, когда в тканях находились большие количества вирусов.
Внутримышечное заражение обезьян Cynomolgus macaques ВОО приводит к развитию системной инфекции с широким распространением везикулопустулезной сыпи и образованием участка мышечного некроза в месте введения вируса. Внутривенное введение больших доз BOO (2х 10 7 КОЕ) вызывает у обезьян типичную генерализованную везикулопустулезную сыпь и выраженную лимфоаденопатию. На вскрытии: лимфоаденопатия, спленомегалия, отек легких. Введение в легкие обезьяны ВОО в составе мелкодисперсного аэрозоля вызывает у них системную диссеминацию вируса, сходную с таковой у людей. У погибших животных на вскрытии обнаруживают фибронекротическую бронхопневмонию, некротические изменения в лимфоидных органах, коже, слизистых, репродуктивных органах. Особенностью таких поражений является пролиферация эпителия в участках поражения кожи и слизистых. Остальные поражения были идентичны таковым при в/в введении ВЕЮ или ВОО обезьянам или при естественном заражении человека этими вирусами. Интраназалъное и интратра-хеалъное заражение ВОО вызывает у приматов поражения, сходные с получаемыми в результате заражения аэрозолем BOO (Chapman J. L. et al., 2010).
Хотя в результате интратрахеального, ингаляционного ив/в введения ВОО у приматов возможно вовлечение легких в инфекционный процесс и развитие пневмонии, эта патология имеет свои особенности для каждого из путей введения вируса. Аэро-золирование и интратрахеальное введение вируса в период от 9 до 17 сут вызвало первичную фибронекротическую бронхопневмонию с системной диссеминацией возбудителя болезни и смерть животного. Внутривенное введение ВОО вызывало у животных интерстициальную пневмонию, развившуюся в результате вторичного инфицирования (Goff A. J. et al. 2011).
Клиническая картина натуральной оспы у людей при искусственном инфицировании. Искусственное инфицирование здоровых людей содержимым оспенных пустул, взятых от лиц, переносящих болезнь в легкой форме, широко применялось в XVTII в. с целью предотвращения у заболевания оспой в тяжелой форме. Способ назывался вариоляцией. Смертность среди привитых достигала 10 %, но страх перед натуральной оспой был настолько велик, что такая «цена» не казалась чрезмерной. В 1796 г. этот способ был заменен более безопасным — вакцинацией, т. е. прививкой содержимого оспенных пустул на вымени коров. Патогенез заражения через кожные покровы (например, при вскрытии погибших от оспы и т. д.) принципиально не отличается от такового при воздушно-капельном инфицировании через дыхательные пути. Однако наличие первичного поражения на коже, появляющегося на 3-4 сут, ускоряет развитие инфекционного процесса. Инкубационный период болезни укорачивается до 5-7 сут (Маренникова С. С., Щелкунов С. И., 1998).
Диагностика искусственного поражения возбудителем натуральной оспы. Появление единственного случая натуральной оспы — чрезвычайное происшествие мирового масштаба. Любую внезапно возникшую вспышку натуральной оспы целесообразно рассматривать, как искусственно вызванную. Из-за отсутствия у врачей эпидемической настороженности по натуральной оспе, вспышка может развиваться единичными случаями болезни в течение несколько месяцев, маскируясь под диагнозами «корь», «скарлатина», «токсический капилляротоксикоз», «ветряная оспа», «болезнь Лайма» и др. Поэтому для установления масштабов и времени совершения преступления, необходимо изучить истории болезни людей с такими диагнозами, обратившимися в местные лечебные учреждения не менее чем за три месяца, предшествующих выявленному случаю натуральной оспы. Особое внимание надо обратить на больных, имевших патологию органов дыхания (бронхит, пневмония) и сыпь. У них необходимо проанализировать сроки появления и характер сыпи (см. рис. 3.103-3.106), исходы болезни и данные объективного исследования в динамике (рентгенография, компьютерная томография, серология). Можно предположить, что будут выявлены два типа заболевших натуральной оспой: первично инфицированные, т. е. экспонированные к мелкодисперсному аэрозолю ВНО; и вторично инфицированные, т. е. те, кто заразился ВНО воздушно-капельным путем от первично инфицированных больных. Соответственно будут и два пика заболеваемости: первый, наибольший, вызванный экспонированием людей к мелкодисперсному аэрозолю; и второй, более растянутый по времени, включающий вторично инфицированных лиц.
Для первично-инфицированных пациентов будет характерна «невозможная клиника болезни» — быстрое (в течение 3-5 сут от начала первых симптомов) развитие легочного поражения, начинающееся с очаговой пневмонии в нижних отделах легкого, переходящее в фибронекротическую бронхопневмонию и системные поражения с развитием энантем и экзантем, с некротическими изменениями в лимфоидных органах, коже, слизистых, репродуктивных органах. В случаях массированного заражения ВНО болезнь будет развиваться без второй фазы подъема температуры. При однократном применении ВНО для такой вспышки будет характерна сжатая эпидемическая кривая с пиком заболеваемости, «укладывающимся» в средние значения инкубационного периода при натуральной оспе (эпидемиология «точечного источника») и относительная локализованность эпидемического очага, т. е. выявленные пораженные должны «пересекаться» в одно и то же время на одной территории. Необходимо отличать натуральную оспу, вызванную ингаляцией мелкодисперсного аэрозоля ВНО от:
1) так называемой легочной формы оспы, когда у больных при отсутствии кожных элементов развивается пневмония;
2) осложнений со стороны легких при плоской форме оспы.
Для вторично-инфицированных пациентов будет характерно типичное течение натуральной оспы, при которой основными являются поражения кожи и слизистых. Поражения же легких развиваются позже как вторичные, и чаще в период нагноения. Локализованный эпидемический очаг возможен только в организованных коллективах. Учитывая длительный инкубационный период болезни и возможность нескольких генераций передачи ВНО, вторично-инфицированных больных натуральной оспой, скорее всего, придется разыскивать по всей территории России.
При выявлении случаев обезьяньей оспы среди людей, прежде всего надо искать контакты таких больных с животными, зараженными ВОО (обезьяны, белки, грызуны). Отсутствие таких контактов можно рассматривать как «невозможную эпидемиологию болезни». Типы больных будут те же, что и для натуральной оспы, если для преступления использован штамм ВОО, происходящий из долины реки Конго.
В месте накожного введения ВНО или ВОО быстро развиваются оспины с обширной зоной гиперемии. Под этим участком формируется плотный и отечный инфильтрат, который является «подножьем» для побочных оспин, одновременно развивается лимфаденит и системная инфекция. Подкожное введение вирусов приводит к местному поражению с образованием участка некроза, отека, гиперемии, побочных оспин и системной инфекции. Внутривенное введение вызывает типичную системную инфекцию, тяжесть которой зависит от дозы введенного вируса. Скорее всего, больные, зараженные внутривенно, не будут представлять опасности в эпидемическом плане.
Обнаружение генетически измененных штаммов ВНО или ВОО однозначно свидетельствует об искусственном происхождении вспышки болезни.
Иммунопрофилактика натуральной оспы. Подробно о кандидатах в противооспенные вакцины и об их роли в связанных с биотерроризмом стратегиях вакцинации, см. в работе I. Wiser et al. (2007). Для вакцинации против натуральной оспы и оспы обезьян в Российской Федерации используют три типа вакцин.
ОспаВИР — вакцина оспенная инактивированная, лиофилизат для приготовления раствора для подкожного применения. Представляет собой вирус вакцины, выращенный на коже телят, обработанный фреоном 113 и инактивированный у-излучением 60 Со. Одна доза препарата содержит инактивированный антиген вируса — 50 мг и стабилизаторы. Препарат применяется в двухэтапном методе вакцинации для создания бустериммунитета с последующим введением вакцины оспенной живой. Производится в Томске филиалом ФГУП «НПО «Микроген».
Вакцина оспенная живая сухая, лиофилизат для приготовления раствора для накожного применения — препарат представляет собой вирус осповакцины, выращенный на скарифицированной коже телят, частично освобожденный от бактериальной флоры обработкой фенолом или хлоргексидина биглюканатом. Препарат содержит от 1x10 8 до 2х10 9 оспообразующих единиц (ООЕ) в 1 мл. Одна прививочная доза содержит не менее 1х10 6 ООЕ. Вакцину применяют накожно, скарификационным методом. Производится в Томске филиалом ФГУП «НПО «Микроген».
Вакцина ТЭОВак — вакцина оспенная эмбриональная живая. Представляет собой высушенный со стабилизатором (лактоза) вирус вакцины, выращенный в ХАО и плодике куриного эмбриона и спрессованный с наполнителем в таблетки. Производится в виде таблеток, покрытых оболочкой, делимых. Прививочная доза препарата содержит 1 х 10 6 до 2х 10 7 ООЕ вируса вакцины. Препарат дозируют согласно инструкции, содержащейся в упаковке. Таблетку разжевывают и держат во рту до полного растворения, но не менее 2—3 мин, после чего в течение 30 мин не рекомендуется принимать пищу. Препарат предназначен для ревакцинации взрослых против натуральной оспы по эпидемическим показаниям и плановой ревакцинации лиц, работающих с ВНО, ВОО, ВОВ и другими ортопоксвирусами, патогенными для людей. Производитель Вирусологический центр НИИ микробиологии МО РФ, г. Сергиев Посад-6.
При вакцинации лиц, ранее никогда не прививавшихся против натуральной оспы и не имеющих вакцинальных знаков, ее проводят двухэтапным методом:
первый этап вакцинации — подкожное введение инактивированной оспенной вакцины ОспаВИР;
второй этап вакцинации — накожная прививка живой оспенной вакцины. Экспериментально и практикой подтверждено, что, как правило, через 4-5 лет, даже после успешной вакцинации, коллективный иммунитет резко снижается, если не исчезает полностью. Снижение специфического иммунитета происходит еще интенсивнее, если в промежутках между вакцинациями имели место какие-либо массовые инфекционные заболевания: грипп, корь и др. У отдельных лиц, успешно привитых за год и даже менее года до эпидемической вспышки натуральной оспы, при очень тесном контакте с больным натуральной оспой вакцинальный иммунитет не может предупредить возникновение и развитие заболевания оспой. В этом случае характер клинических проявлений заболевания находится в зависимости от уровня остаточного вакцинального иммунитета и вирулентности циркулирующего ВНО. Частота различных клинических типов variola major и летальность среди непривитых и привитых против натуральной оспы, приведены в табл. 3.32.
Таблица 3.32. Частота различных клинических типов variola major и летальность среди непривитых и привитых против натуральной оспы*
|
Клинический тип |
Невакцинированные |
Вакцинированные |
||
|
Частота (% от общего количества)** |
Летальность (%) |
Частота (% от общего количества)*** |
Летальность (%) |
|
|
Обычная |
88,8 |
30,2 |
70,0 |
3,2 |
|
сливная |
22,8 |
62,0 |
4,6 |
26,3 |
|
полусливная |
23,9 |
37,0 |
7,0 |
8,4 |
|
дискретная |
42,1 |
9,3 |
58,4 |
0,7 |
|
Модифицированная |
2,1 |
0 |
25,3 |
0 |
|
Плоская |
6,7 |
96,5 |
1,3 |
66,7 |
|
Геморрагическая |
2,4 |
98,4 |
3,4 |
93,9 |
|
ранняя |
0,7 |
100,0 |
1,4 |
100 |
|
поздняя |
1,7 |
96,8 |
2,0 |
89,8 |
|
Всего |
35,5 |
6,3 |
||
* По С.С. Маренниковой и С.Н. Щелкунову (1998).
** Общее количество больных — 3544.
*** Общее количество больных — 3398.
Имеются данные о низкой эффективности массовых вакцинаций против оспы обезьян, проведенных живыми оспенными вакцинами в регионах Африки, эндемичных по BOO (Karem К. L. et al., 2007).
Для лечения и профилактики натуральной оспы, для лечения поствакцинальных осложнений после вакцинации живой оспенной вакциной, используется иммуноглобулин человека противооспенный.
Он представляет собой концентрированный раствор очищенной фракции иммуноглобулинов, выделенной методом фракционирования этиловым спиртом при температуре ниже 0°С из плазмы крови здоровых доноров, содержащей антитела к ортопоксвирусам в титре не менее 1:200. Препарат содержит антитела к ортопоксвирусам в титре не менее 1:4000 и глицин в качестве стабилизатора. Производится в Томске филиалом ФГУП «НПО «Микроген». Иммуноглобулин вводят внутримышечно. Для экстренной профилактики однократно в дозе 3 мл, для лечения натуральной оспы — в дозе 0,5-1,0 мл/кг веса больного в зависимости от тяжести клинического течения болезни один раз в сутки или дробно.
Осложнение после вакцинации:
глазная вакциния — возникает из-за случайного занесения в глаз живой противо-оспенной вакцины. Развивается сильный конъюнктивит с везикулами и пустулами. Могут появиться кератит и изъязвление роговицы;
генерализованная вакциния — характеризуется умеренными органическими симптомами и генерализованной везикулярной сыпью. Из везикул и из сыворотки больных с этим состоянием вирус вакцины методом культивирования не выделяется. Патогенез неизвестен, но возможно обусловлен иммунологическим механизмом. Обычно это самоограничиваюгцаяся реакция, и лечение не показано, но в тяжелых случаях рекомендуется применение противооспенного иммуноглобулина;
поствакцинальный энцефалит — патогенез неизвестен, но может быть обусловлен иммунопатологическим механизмом, так как из ткани мозга и спинномозговой жидкости пациентов вирус вакцины методом культивирования не выделяется. При этом осложнении летальность равна 10-30 %, а у выживших больных наблюдаются неврологические последствия. Рекомендуется поддерживающая терапия;
eczema vaccinatum — тяжелый дерматит, характеризующийся репликацией вируса вакцины в местах экземы, псориазных, ожоговых и других хронических или сильных кожных повреждений. Для лечения показан противооспенный иммуноглобулин.
vaccinia necrosum — состояние характеризуется сильной реакцией в месте вакцинации, прогрессирующей до локального некроза кожи. Развивается у иммуноослаб-ленных вакцинируемых. Может привести к летальному исходу. Для лечения назначается противооспенный иммуноглобулин через каждые 2-3 сут внутримышечно в дробных дозах в разные места на протяжении 24-36-часового периода пока не наступит несомненное клиническое улучшение.
В результате введения вируса вакцины беременным женщинам может развиться вакциния плода, прогноз плохой.
Профилактика после экспонирования к ВНО и ВОО и лечение развившейся болезни. Army FM 8-284 (2000) рекомендует:
1) в течение 1-7 сут подвергнуть всех лиц, экспонированных или возможно экспонированных к ВНО, активной иммунизации живой вакциной, и пассивной иммунизации противооспенным иммуноглобулином;
2) вакцинировать всех контактных лиц, включая медицинских работников, если они не были вакцинированы или ревакцинированы в течение трех последних лет;
3) наложить карантин на всех лиц, непосредственно контактировавших с любым больным натуральной оспой не менее чем на 17 сут.
Лечение натуральной оспы и оспы обезьян симптоматическое. Профилактика заражения ВОО аналогично таковому при натуральной оспе. ВИЧ-инфицированным и лицам с другими иммунодефицитами вводить следует только противооспенный иммуноглобулин.
Библиографическое описание. Супотницкий МВ. Натуральная оспа, оспа обезьян. В кн.: Супотницкий МВ. Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений. М.: "Кафедра", "Русская панорама"; 2013. С. 834–886.
1 Для названий штаммов ВНО, вызывающих малую оспу, установлены терминологические разграничения, обусловленные различиями в их биологических свойствах и происхождении: variola minor используется для обозначения африканских штаммов, a alastrim — для штаммов, выделенных в Южной Америке. Различий в клиническом течении вызываемой ими болезни не установлено.
2 Yu Li et al. (2007), на основе анализа SNP, переносят время проникновения ВНО в человеческие популяции из популяций грызунов еще на более ранний срок — 68 тыс. лет до н. э. Появление в Южной Америке вируса алястрима они рассматривают как результат дивергенции ВНО, но датируют VI тысячелетием до н. э., т. е. еще до открытия Америки европейцами.
3 Алексей Алексеевич Кокорекин (1906-1959) — советский график. Заслуженный деятель искусств РСФСР (1956). Лауреат двух Сталинских премий (1946, 1949).
4 Для описания клиники и патанатомии натуральной оспы в основном использовались работы Э. А. Гальперина (1962); П. Н. Бургасова, Г. П. Николаевского (1972); С. С. Маренниковой, С. Н. Щелкунова (1998). Классификация клинических форм натуральной оспы взята из работы П. Н. Бургасова, Г. П. Николаевского (1972), параллельно приведена классификация из работы С. С. Маренниковой и С. Н. Щелкунова (1998).
5 Для описания оспы обезьян у людей в основном использовалась работа С. С. Маренни-ковой и С. Н. Щелкунова (1998).
6 Эту модель авторы считали более соответствующей течению натуральной оспы у людей при ингаляционном заражении, чем приматов, зараженных ВНО.
