Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений: монография. 3.2. Чума
Микробиология Y. pestis. Происхождение и молекулярная эпидемиология. Экология и естественная эпидемиология Y. pestis. Внутривидовая таксономия. Восприимчивость и чувствительность животных к возбудителю чумы. Инфицирующие дозы. Иммунитет. Устойчивость Y. pestis во внешней среде и в трупах погибших. Антибиотикорезистентность. Обнаружение генетически измененных штаммов Y. pestis. Патогенез. Клиническая картина чумы у людей при естественном инфицировании Y. pestis. Моделирование искусственного заражения Y. pestis. Диагностика искусственного поражения возбудителем чумы. Иммунопрофилактика. Лечение.
Библиографическое описание. Супотницкий МВ. Чума. В кн.: Супотницкий МВ. Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений. М.: "Кафедра", "Русская панорама"; 2013. С. 644–706.
Чума (pestis, plague, black death) — опасная сапрозоонозная инфекционная болезнь людей и животных, вызываемая неспорулируюгцейся бактерий Yersinia pestis. Характеризуется острым началом, тяжелой интоксикацией, лихорадкой, септицемией, помрачением сознания, возникновением бубонов и карбункулов. Протекает в кожной, легочной и септицемической формах. Карантинная инфекция. Российские санитарно-эпидемиологические правила СП 1.3.2322-08 относят возбудитель чумы к I группе патогенности. По степени важности для национальной безопасности США Y. pestis относится к биологическим поражающим агентам категории А (см. табл. 2.2). Особую опасность возбудителю чумы придает его способность при легочный форме болезни передаваться между людьми.
Попытки диверсионного применения культур Y. pestis и зараженных чумой грызунов замечены еще в годы Первой мировой войны. С начала 1930-х гг. и до окончания Второй мировой войны возбудитель чумы активно исследовался японскими военными как потенциальный поражающий агент БО. Он неоднократно применялся ими в варварских экспериментах на людях и для осуществления биологических диверсий против китайских войск и мирного населения. В США и в Соединенном Королевстве со средины 1940-х гг. возбудитель чумы изучался как летальный агент БО. Для его боевого применения разрабатывались специальные рецептуры и боеприпасы. В первой половине 1952 г. Y. pestis использовалась армией США для поражения войск и населения Северной Кореи и Северо-Восточного Китая. До 1968 г. рецептуры на основе возбудителя чумы находились на вооружении американской армии под шифром «N». В 1995 г. обнаружена заинтересованность радикальных организаций в использовании чумы в террористических целях. В США за попытку приобретения культуры Y. pestis по почте был арестован некий Ларри Уэйн Харрис, связанный с труппой «Арийская нация». Харрис не скрывал своего намерения осуществить биотеррористический акт против федеральных структур.
Наиболее вероятно применение Y. pestis посредством использования линейных и многоточечных источников и диверсионными (террористическими) методами.
Микробиология Y. pestis. Y. pestis — относится к роду Yersinia семейства Enterobac- teriaceae. Факультативный анаэроб. Растет на обычных жидких и плотных питательных средах при температуре 25—30 °С и pH 6,9—7,2. На бульоне культура растет в виде поверхностной пленки со спускающимися вниз нитями, напоминающими сталактиты, и хлопьевидного осадка на дне пробирки. Из «природных источников» возбудитель чумы выделяется в своей типичной R-форме (шероховатой). Приросте бактерий на питательных средах может происходить диссоциация их колоний от R-форм, к авирулентным S-формам, образующим на плотном агаре гладкие, ахромогенные колонии, а в бульоне равномерное помутнение. Но и R-формы Y. pestis могут необратимо утрачивать вирулентность. Среди таких штаммов обычно ищут штаммы, пригодные для применения в качестве вакцинных (Николаев Н. И., 1968).
Бактерии Y. pestis эндоспор не образуют, не имеют жгутиков и лишены активной подвижности. В организме больных чумой, а также на искусственных питательных средах при определенных условиях развития могут образовывать капсулу. Специфическая окраска для чумных микробов не разработана. Они легко окрашиваются карболовыми и щелочными растворами анилиновых красок, при окраске по Граму обесцвечиваются. На их форму, размеры и окраску существенное влияние оказывают условия развития микробной популяции. В мазках из агаровых культур, выращенных при температуре 26—28 °С, Y. pestis имеет форму прямых или слегка изогнутых палочек с закругленными полюсами длиной 0,8—2,0 мкм и диаметром 0,5—0,7 мкм. На поверхности препарата они располагаются без определенной закономерности и окрашены преимущественно равномерно. Возможно образование небольшого количества нитей и цепочек различной длины. В мазках из агаровых и бульонных культур, полученных в результате выращивания при температуре 37—39 °С, а также в мазках крови и мокроты людей и животных, погибших от чумы, или в мазках — отпечатках их органов, микробы Y. pestis имеют вид небольших палочек, овоидов или бочкообразных клеток с закругленными полюсами, многие из которых окрашены биполярно, что проявляется в преимущественном окрашивании полюсов и появлении неокрашенной крупной вакуоли в центре клеточного тела. Биполярными чаще всего выглядят микробы, развившиеся на искусственных питательных средах при температуре 37—39 °С или в организме больных чумой при остром течении инфекционного процесса (Золотарев А. Г. с соавт., 2006) (рис. 3.26, А).
В случаях затянувшейся чумы (нагноившиеся, вскрывшиеся бубоны и язвы) либо при неблагоприятных условиях роста (воздействие бактериофага, суббактериостатические дозы антибиотиков и солей, неоптимальное осмотическое давление) чумные микробы утрачивают биполярность и превращаются в гетероформные структуры в виде шаров, нитей или теней клеток (Золотарев А. Г. с соавт., 2006).
Капсулу микробы Y. pestis образуют в организме восприимчивых животных или после выращивания при температуре 37—39 °С на питательных средах определенного состава. У клеток культур, полученных при температуре 26—28 °С, капсула отсутствует. Микроскопическая картина и размеры капсулы зависят, с одной стороны, от штаммовых особенностей культур, а с другой — от методики приготовления препарата. ЕГаиболее оптимальные условия для выявления капсулы у чумных микробов обеспечивает прижизненная фазово-контрастная микроскопия препаратов, приготовленных по влажному тушевому методу.
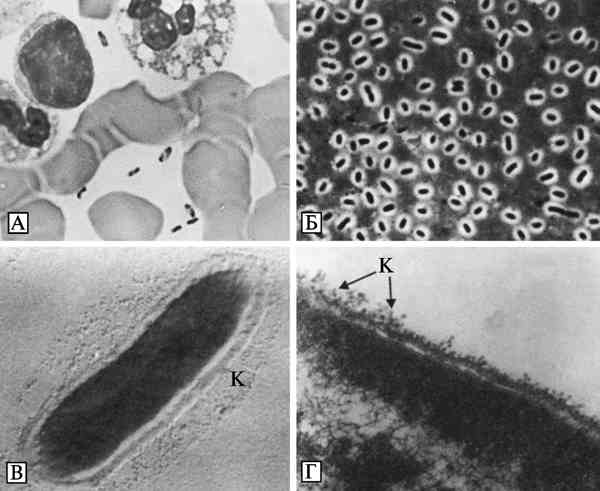
Рис. 3.26. Микроскопическое изображение Y. pestis. А. Биполярные палочки Y. pestis в крови пациента с септической формой чумы. Окрашивание по Wright-Giemsa. Увеличение в 1000 раз. По Т. Inglesby et al. (2000). Б. Капсула живых Y. pestis, выращенных в течение 24 ч при температуре 37—39 °С в переваре Хоттингера с добавлением витаминов и ионов кальция. Вирулентный штамм 1300. Увеличение в 1350 раз. Фазовый контраст. В. Электронно-микроскопическое изображение клеток Y. pestis, выращенных в бульоне Хоттингера при температуре 37—39 °С. Штамм 1300. Снаружи от клетки имеются остатки капсулы (К). Контрастировано напылением хромом, увеличение в 15 тыс. раз. Г. Электронно-микроскопическое изображение ультра- тонкого среза клетки Y. pestis, обработанной специфическими анти-Fl-иммуноглобулинами, меченными ферритином. Показано равномерное расположение ферроиммуноглобулинов. Увеличение в 100 тыс. раз. По А. Г. Золотареву с соавт. (2006)
В таких препаратах капсула наблюдается в виде прозрачной светлой зоны между клетками и темным фоном, создаваемым частицами туши. Толщина капсулы у живых Y. pestis вирулентных штаммов возбудителя чумы колеблется примерно от 1,2 до 0,3 мкм (Золотарев А. Г. с соавт., 2006) (см. рис. 3.26, Б).
Под электронным микроскопом в препаратах, оттененных хромом, у чумных бактерий определяются цилиндрическая форма, сферические полюса, гладкая, без резких возвышений и углублений поверхность и равномерная электронно-оптическая плотность цитоплазмы. По периферии клеток, особенно на полюсах, протопласт несколько отходит от клеточной стенки с образованием полупрозрачной каймы, в которой видны ровные внешние контуры клеточной стенки и цитоплазматической мембраны. Снаружи клеточной стенки находится капсула, отличающаяся низкой плотностью по отношению к электронам. По степени выраженности капсулы Y. pestis гетерогенны (Золотарев А. Г. с соавт., 2006) (см. рис. 3.26, В).
В капсуле чумных бактерий располагается оболочечный или капсульный антиген F1. Его детерминанты взаимодействуют с меченными ферритином специфическими иммуноглобулинами. На ультратонких срезах клеток, предварительно обработанных такими меченными антителами, гранулы комплекса ферритин — иммуноглобулин обнаруживаются как на поверхности клеточной стенки, так и на материале капсулы. Наличие меченых специфических иммуноглобулинов на клеточной стенке и в кап- суде Y. pestis указывает на то, что антиген F1 является компонентом, участвующим в образовании этих структур (Золотарев А. Г. с соавт., 2006) (см. рис. рис. 3.26, Г).
Наиболее благоприятные условия для выращивания бактерии Y. pestis обеспечиваются при свободном доступе кислорода и температуре инкубирования от 26 до 28 °С. При таких условиях Y. pestis уже через 10—12 ч роста образует на плотной питательной среде характерные микроколонии в виде плоских сложных образований с неровными краями, напоминающие кружевные платочки. Примерно к 20—24 ч выращивания у микроколоний формируются выпуклый зернистый желтый, бурый или темно-коричневый центр и плоская тонкая бесцветная, почти прозрачная фестончатая периферическая зона — кружевная каемка (рис. 3.27, А, Б).
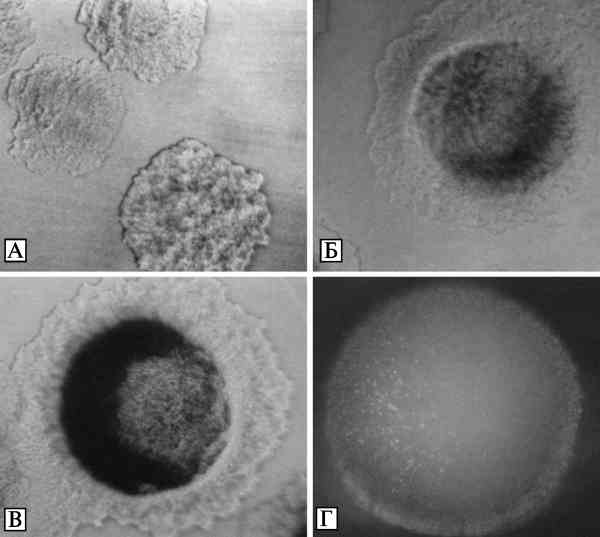
Рис. 3.27. Макроскопические изображения колоний Y. pestis. А, Б. Микроколонии возбудителя чумы, выращенные на агаре Хоттингера при температуре 26—28 °С. Вирулентный штамм 1300. Макрофотосъемка в падающем свете. Увеличение в 56 раз. На фотографии А микроколонии через 10—12 ч выращивания, на фотографии Б микроколонии через 20—24 ч выращивания. У микроколонии формируется выпуклый желтый, бурый или темно-коричневый центр и тонкая, почти прозрачная фестончатая периферическая зона. В. Двухсуточная колония Y. pestis в проходящем свете (условия выращивания и штамм см. выше). Увеличение в 13 раз. Г. Двухсуточная колония Y. pestis в падающем свете (условия выращивания и штамм см. выше). Увеличение в 13 раз. По А. Г. Золотареву с соавт. (2006)
К исходу вторых суток вырастают выпуклые, округлые колонии, которые имеют диаметр 2,5—3,0 мм и макроскопически в проходящем свете кажутся серовато-белыми с голубым оттенком, а при падающем свете — беловато-серыми. При микроскопическом исследовании в проходящем свете они хромогенные и нередко напоминают по внешнему виду цветы ромашек или маргариток. Центр у них может быть выпуклым или запавшим, коричневым либо желтым, зернистым или бугристым, тогда как периферическая часть полупрозрачная и кружевная (см. рис. 3.27, В). В падающем свете эти колонии выглядят серо-желтыми и имеют форму полусфер с мелкозернистой поверхностью и ровными или слегка фестончатыми краями (см. рис. 3.27, Г) (Золотарев А. Г. с соавт., 2006).
Морфология колоний чумных бактерий зависит от многих факторов. При удлинении сроков культивирования до 72—96 ч центр колонии уплощается или западает, а периферическая кружевная зона становится плотной либо узкой, а может и вовсе отсутствовать. Поверхность колоний зернистая, а иногда исчерченная (феномен Творта). На морфологию колоний Y. pestis влияют также температура выращивания и состав питательной среды (Золотарев А. Г. с соавт., 2006).
Биохимически возбудитель чумы активен: восстанавливает нитраты в нитриты, ферментирует с образованием кислоты без газа глюкозу, левулезу, мальтозу, галактозу, ксилозу и манит, продуцирует ферменты типа дегидрогеназ и уреаз. Хорошо растет на синтетических средах с аминокислотами (в качестве источников азота) и ферментируемыми углеводами. В витаминах и азотистых основаниях, как правило, не нуждается. Аминокислотные потребности у штаммов из разных природных очагов сильно варьируют. Кроме того, они могут меняться в зависимости от температуры культивирования.
Характерными признаками вирулентных штаммов Y. pestis являются:
наличие капсулы и V- и W-антигенов (антифагоцитарное действие);
способность синтезировать пурины (генерализация инфекции);
образование пигментированных колоний на среде с гемином (генерализация инфекции);
пестициногенность;
неспособность расти на средах при температуре 37 °С в отсутствие ионов кальция;
наличие «рН-6-антигена» (играет роль Fc-рецептора, связывается с IgG человека и приводит к образованию псевдоиммунных комплексов).
Менее ясен ответ на вопрос, какие «факторы вирулентности» нужны Y. pestis для того, чтобы она оказалась способной вызвать вспышку чумы у людей. В этой связи
Н. И. Николаев (1968) и И. В. Домарадский (1998) отмечают, что основное отличие авирулентных штаммов чумного микроба от вирулентных заключается в способности последних размножаться в организме человека. Штаммы, вызывающие вспышки чумы у людей, и штаммы, циркулирующие в природных очагах чумы среди грызунов, по наличию известных факторов вирулентности не отличаются друг от друга. Подробно факторы вирулентности возбудителя чумы описаны в работе А. П. Анисимова (2002).
Происхождение и молекулярная эпидемиология. Y. pestis является типовым видом рода Yersinia, относящимся к семейству Enterobacteriaceae. Помимо возбудителя чумы, к этому роду относятся еще шесть видов бактерий: Y. pseudotuberculosis, Y. enterocolitica, Y. intermedia, Y. ruckeri, Y. frederiksenii и Y. kristensenii. По культурально-биохимическим и некоторым другим свойствам ближе всего к чумному микробу стоят первые два вида, из которых Y. pseudotuberculosis называют даже его двойником. Однако по эпидемиологическим особенностях и патогенезу вызываемой инфекции Y. pseudotuberculosis и Y. enterocolitica существенно отличаются от Y. pestis (Домарадский И. В., 1998).
М. Achtman et al. (1999) высказали предположение, что Y. pestis является клоном Y. pseudotuberculosis. Аллели Y. pestis были идентичны или почти идентичны таковым у 12 штаммов Y. pseudotuberculosis. Согласно таксономическим стандартам, Y. pestis можно рассматривать как Y. pseudotuberculosis, но из-за больших различий в проявлениях болезни и роли Y. pestis в истории эпидемий, этой классификации не придерживаются. А. P. Anisimov et al. (2004) считают, что различия в плазмидном составе и, возможно, другие небольшие генетические различия, ответственны за особенности эпидемиологии и патогенеза инфекций, вызываемых Y. pestis и Y. pseudotuberculosis.
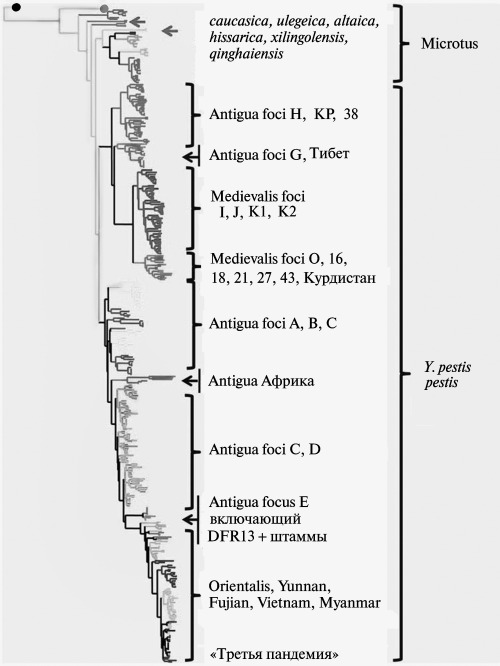
Филогенетическое древо Y. pestis, построенное М. Achtman et al. (2004) на основе сопоставительного анализа нуклеотидных последовательностей, включает три ветви: 0, 1 и 2. Большинство изолятов биовара Orientalis соответствуют монофилетической группе, обозначенной как 1.0RI. Большинство штаммов биовара Medievalis соответствуют второй монофилетической группе — 2.MED. Изоляты биовара Antiqua находят среди штаммов обеих ветвей —1 (1.ANT) и 2 (2.ANT). Штаммы Y. pestis биовара Pestoides кластированы вдоль ветви 0 (0.РЕ1-0.РЕ4). Биохимические различия между биоварами и регионы их выделения показаны в табл. 3.7; филогенетическое древо приведено на рис. 3.28.
Таблица 3.7
Биовары Y. pestis, идентифицированные на основе ферментации глицерина, восстановления нитратов и окисления аммония*
|
Биовар |
Различие |
Регион, в котором был выделен штамм |
||||
|
Ферментация глицерина |
Восстановление нитратов |
Окисление аммония |
Активность уреазы |
Ферментация мелибиозы |
||
|
Antiqua |
+ |
+ |
+ |
- |
- |
Центральная Африка, Центральная и Северная Азия, Китай (Маньчжурия), Монголия |
|
Medievalis |
+ |
- |
- |
- |
± |
Бывший Советский Союз (регион Каспийского моря) |
|
Orientalis |
- |
+ |
± |
± |
- |
Бирма, Южный Китай, Индия, Южная Африка, Южная Америка, Калифорния |
* За основу взята таблица из работы А. P. Anisimov et al. (2004).
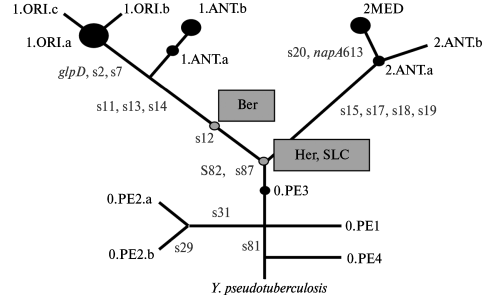
Рис. 3.28. Схематическое изображение филогенетического древа Y. pestis. Вдоль каждой ветви указаны снипсы, использованные для его построения. По М. Achtman et al. (2004)
S. Haensch et al. (2010), используя ДНК, выделенную из останков людей, умерших от чумы во время второй пандемии (двое — из Англии, 6 — из Голландии, один — из Франции), показали, что генотипы Y. pestis, индентифицированной в археологических образцахXIVв., отличаются от современных Orientalis (1 .ORI), Medievalis (2.MED), Antiqua (l.ANT, 2.ANT) (см. рис. 3.28). Можно предположить, что в работе S. Haensch et al. (2010) описаны штаммы Y. pestis, поддерживающиеся в неизвестных первичных резервуарах очагов чумы европейского континента, угасших в начале XIX в.
Молекулярная эпидемиология Y. pestis более точно устанавливается методами MLVA-анализа. Полученные этим способом данные представлены на рис. 2.29 и 3.30.
Рис. 3.29. Дендрограмма Y. pestis, основанная на 25 локусах VNTR. Псевдотуберкулезному микробу соответствует черный круг в левом верхнем углу дендрограммы. В правой части дендрограммы указаны новые биовары Y. pestis. Цифровые и буквенные обозначения очагов чумы соответствуют приведенным в табл. 3.9 и на рис. 3.30. По Li Y. et al. (2009)Рис. 3.30. Географическое распределение штаммов возбудителя чумы различных биоваров. Подписаны очаги, включающие штаммы биовара Microtus. Цифровые и буквенные обозначения очагов чумы соответствуют приведенным в табл. 3.9 и на рис. 3.30. По Li Y. et al. (2009)
УY. pestis под разными названиями описаны три типовые плазмиды: 9,5 т. п. о. (pPst, pPla, pPCPl или pYP: кодирует пестициногенность, фибринолизин и плазмокоагулазу); 70—75 т. п. о. (pCDl, pCad, pVW, pYV или pLcr: определяет зависимость штамма от кальция, синтез VWa и других поверхностных белков); и 100—110 т. п. о. (pFra/Tox, pFra, рТох, pMTl или pYT: кодирует F1, «мышиный» токсин). Плазмидные профили у штаммов, выделенных в различных природных очагах чумы, можно сравнить между собой по электрофоретической подвижности в агарозном геле, а выделив отдельные плазмиды, сравнить их по результатам рестрикционного анализа.
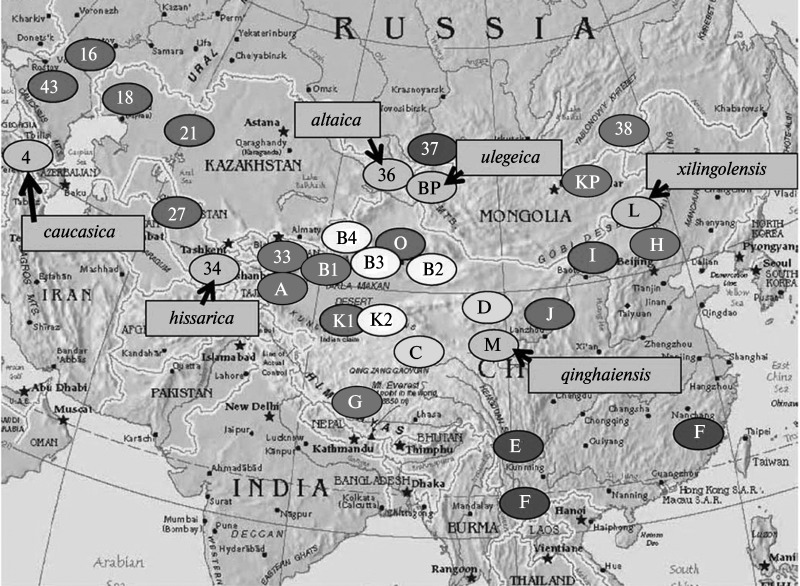
Рис. 3.30. Географическое распределение штаммов возбудителя чумы различных биоваров. Подписаны очаги, включающие штаммы биовара Microtus. Цифровые и буквенные обозначения очагов чумы соответствуют приведенным в табл. 3.9 и на рис. 3.30. По Li Y. et al. (2009)
Для штаммов, полученных в России и Азии, характерна значительная изменчивость плазмидного состава. До 18 % изолятов из Волго-Уральского песчаного очага (очаг 16)[1] и 43 % изолятов из Таласского очага (очаг 40) содержали криптические плазмиды, обычно с ММ 20 мДа. У некоторых штаммов из Таласского, Центрально-Кавказского и Прибалхашского очагов (очаги 40, 1 и 30 соответственно), а из Сенегала, Шри-Ланки и Индонезии обнаружены криптические плазмиды с ММ 1,6—31 мДа. У отдельных штаммов отмечалось отсутствие одной или двух типовых плазмид (Anisimov А. P. et al., 2004).
Кроме того, размер плазмид может изменяться, что затрудняет получение ответа на вопрос о том, является ли плазмида, идентифицированная в клиническом изоляте, природным вариантом или же генно-инженерным вариантом с возможными дополнительными факторами вирулентности. Понимание причины изменений размера плазмид, обнаруженных у различных изолятов Y. pestis, важно для того, чтобы отличить естественное изменение от генно-инженерного, потенциально обусловливающего повышенную вирулентность или полиантибиотикорезистентность у штаммов, содержащих такие теоретические конструкции. ММ классических плазмид Y. pestis, характерных для штаммов различных подвидов, приведены в табл. 3.8.
Таблица 3.8
Молекулярные массы типовых плазмид Y. pestis, характерных для штаммов различных подвидов *
|
Подвид Y. pestis |
Биовар |
Название/номер очага |
Основной хозяин |
ММ (мДа) |
||
|
pPst ** |
pCad |
pFra |
||||
|
Y. pestis подвид apestis |
Antiqua |
Большинство очагов, кроме Тувы и Алтая |
Грызуны различных видов |
6,4 |
47 |
67 |
|
Medievalis |
Все очаги, кроме очагов песчаночного типа |
Грызуны, за исключением песчанок |
6,4 |
47 |
67 |
|
|
Orientalis |
Большинство очагов |
Грызуны различных видов |
6,4 |
47 |
64 |
|
|
Antiqua |
Тува/37, 41 |
Citellus undulatus |
6,4 |
46 |
67 |
|
|
Алтай/35 |
Marmota caudata |
6,4 |
48 |
67 |
||
|
Medievalis |
Все очаги песчаночного типа |
Песчанки различных видов |
6,4 |
48 |
67 |
|
|
Y. pestis подвида altaica |
Medievalis |
Горный Алтай/36 |
Ochotom pricei |
6,4/— |
48 |
72 |
|
Medievalis |
Южно-Кангайский, Монголия |
Microtus brandti |
6,8 |
48 |
72 |
|
|
Y. pestis подвида ulegeica |
Medievalis |
Северо-Восточная Монголия, пустыня Гоби |
Ochotom pricei |
6,4 |
47 |
67 |
|
Y. pestis подвида hissarica |
Medievalis |
Гиссарский/34 |
Microtus carruthersi |
6/4 |
47 |
70 |
|
Y. pestis подвида talassica |
Medievalis |
Талас/40 |
Microtus gregalis*** |
6,4 |
46 |
70 |
|
Y. pestis подвида caucasica |
Antiqua |
Ленинакан/4; Присеванский/5; Занзегур - Карабах/6; Дагестанское нагорье/39 |
Microtus arvalis |
|
50 |
82 |
* Таблица составлена А. P. Anisimov et al. (2004) по работам разных авторов.
** Количества pPst-изолятов Y. pestis подвида Altaica изменяются и в отдельные годы они составляли до 10 % от общего количества изолятов.
*** Основным хозяином в этом очаге может быть Marmota caudata.
Экология и естественная эпидемиология Y. pestis. О том, что экология и эпидемиология возбудителя чумы далеко не так просты, как это обычно излагается в учебниках для студентов, свидетельствует большое количество разных точек зрения на экологию и эпидемиологию Y. pestis, существующую у чумологов, и высказываемых обычно в специализированной научной литературе (см., например, монографии Сунцова В. В. и Сунцовой Н. И., 2006; Козлова М. П. и Султанова Г. В., 2003; Домарадского И. В., 1998).
С практической точки зрения эпидемиологу, изучающему вспышку чумы на предмет возможности ее искусственного происхождения, следует иметь в виду, что дискуссии чумологов в основном касаются первичных резервуаров Y. pestis (т. е. тех, без которых не возможно существование возбудителя чумы в природе) и механизмов поддержания чумной палочки между эпизоотическими периодами. Вспышки чумы среди грызунов следует рассматривать как процесс поддержания Y. pestis во вторичном резервуаре. Чумные эпизоотии создают условия для передачи возбудителя чумы от инфицированных грызунов к людям через укусы инфицированных блох. Грызуны инфицируются Y. pestis из пока неизвестного источника в почве; в результате у них развивается чума в бубонной или септической форме. В случае септической чумы, паразитирующие на грызунах блохи инфицируются. В преджелудке блохи (сфинктер- подобный орган, разделяющий желудок и пищевод насекомого) происходит размножение Y. pestis, что вызывает его блокаду, и блоха голодает. Заражение человека происходит в результате укуса голодной блохи, вынужденной «срыгнуть» в его кровь «чумной блок». Для развития у человека чумы достаточно укуса одной чумной блохи. Более 80 видов блох могут быть переносчиками Y. pestis. Цепь, состоящую из возбудителя (Y. pestis), носителей (грызунов) и переносчиков (блох), принято называть «триадой», а определенные географические ландшафты, заселенные грызунами, видовые и межвидовые отношения которых обеспечивают непрерывную циркуляцию чумного микроба от донора через членистоногих реципиентам, называют природными очагами чумы. Существуют различные классификации очагов чумы. Самая простая предполагает их деление на очаги «дикой чумы» (эпизоотии среди диких грызунов) и «крысиной» или «городской чумы» (эпизоотии возникают среди крыс, обитающих в населенных пунктах).
По данным А. P. Anisimov et al. (2004), природные очаги «дикой чумы» занимают 6—7 % суши Земли. Сорок три таких природных очага обнаружены в южных и юго- восточных районах бывшего Советского Союза (табл. 3.9, рис. 3.31).
Таблица 3.9
Основные характеристики природных очагов чумы в бывшем Советском Союзе*
|
Очаг № |
Название очага |
Эпизоотическая активность ** |
Основной хозяин |
Основной переносчик(и) |
Страна |
|
Кавказский регион |
|||||
|
1 |
Центральный Кавказский очаг |
Постоянная |
Citellus musicus |
Citellophillus tesquorom |
Россия |
|
4 |
Закавказский высокогорный очаг (Ленинакан) |
Постоянная |
Microtus arvdis |
Callopsylla caspia, Nosopsyllus consimilis |
Армения, Грузия |
|
5 |
Закавказский высокогорный очаг (в районе Севана) |
Постоянная |
Microtus arvdis |
C. caspia, N. consimilis |
Армения, Азербайджан |
|
6 |
Закавказский высокогорный очаг (Занзегур- Карабах) |
Постоянная |
Microtus arvdis |
C. caspia, N. consimilis |
Армения, Азербайджан |
|
7 |
Приаракский очаг |
Периодическая |
Meriones vinogradov |
Xenopsylla conformis |
Армения, Азербайджан |
|
8 |
Бозчелский очаг |
Периодическая |
Meriones libicus |
X. conformis, Nosopsyllus laeviceps |
Азербайджан |
|
9 |
Кобистанский очаг |
Периодическая |
М. libicus |
X. conformis, N. laeviceps |
Азербайджан |
|
10 |
Мила-Карабахский очаг |
Периодическая |
М. libicus |
X. conformis, N. laeviceps |
Азербайджан |
|
11 |
Джейранчелский очаг |
Периодическая |
М. libicus |
X. conformis, N. laeviceps |
Азербайджан |
|
12 |
Гянджа- Казахский очаг |
Периодическая |
М. libicus |
X. conformis, N. laeviceps |
Азербайджан |
|
13 |
Иори, река |
Периодическая |
М. libicus |
X. conformis, N. laeviceps |
Азербайджан, Грузия |
|
39 |
Дагестанское нагорье |
Периодическая |
Microtus arvalis |
C. caspia |
Россия |
|
Северный Прикаспийский регион |
|||||
|
2 |
Терек-Сунжа |
Периодическая |
Citellus pygmaeus |
Neopsylla setosa, C. tesquorum |
Россия |
|
3 |
Дагестанское равнинное предгорье |
Периодическая |
C. pygmaeus |
N. setosa, C. tesquyorum |
Россия |
|
14 |
Прикаспийский северо-западный очаг |
Периодическая |
C. pygmaeus |
N. setosa, C. tesquorum |
Россия |
|
15 |
Волго-Уральская степь |
Периодическая |
C. pygmaeus |
N. setosa, C. tesquorum |
Россия |
|
17 |
Зауралье |
Периодическая |
C. pygmaeus |
N. setosa, C. tesquorum |
Россия, Казахстан |
|
43 |
Прикаспиский очаг, пески |
Периодическая |
M. meridianus |
N. laeviceps |
Россия |
|
16 |
Волго-Уральский очаг, пески |
Периодическая |
M. meridianus |
X. conformis, N. laeviceps |
Россия |
|
Центрально-Азиатский пустынный регион |
|||||
|
18 |
Междуречье Урала и Эмбы |
Постоянная |
R. opimus |
X. sktjabini |
Казахстан |
|
19 |
Область, прилегающая к плато Устюрт |
Постоянная |
R. opimus |
X. skrjabini |
Казахстан |
|
20 |
Плато Устюрт |
Периодическая |
R. opimus |
X. skrjabini |
Казахстан, Узбекистан |
|
21 |
Северное Приаралье |
Периодическая |
R. opimus |
X. skrjabini |
Казахстан, Узбекистан |
|
22 |
Зааралье |
Периодическая |
R. opimus |
X. sktjabini |
Казахстан |
|
23 |
Мангышлак, плато |
Периодическая |
R. opimus |
X. sktjabini |
Казахстан |
|
24 |
Приаралье-Кара-кум |
Постоянная |
R. opmus |
X. sktjabini |
Казахстан |
|
25 |
Каракумы, пески |
Периодическая |
R. opimus |
X. gerbili |
Туркменистан |
|
26 |
Копет-Даг, хребет |
Периодическая |
R. opimus |
X. gerbilli |
Туркменистан |
|
27 |
Кызылкум, пески |
Периодическая |
R. opimus |
X. gerbilli |
Узбекистан, Казахстан |
|
28 |
Муюнкум, пески |
Периодическая |
R. opimus |
X. gerbilli |
Казахстан |
|
29 |
Таукум, пески |
Периодическая |
R. opimus |
X. gerbilli |
Казахстан |
|
30 |
Прибалхашье |
Периодическая |
R. opimus |
X. gerbilli |
Казахстан |
|
42 |
Бет-Пак-Дала |
Периодическая |
R. opimus |
X. gerbilli |
Казахстан |
|
Центрально-Азиатский горный регион |
|||||
|
31 |
Сарыджас, река |
Периодическая |
Marmota baibadm |
Oropsylla silantiewi |
Киргизия |
|
32 |
Верхний-Нарын, река |
Периодическая |
M. baibadm |
O. silantiewi |
Киргизия |
|
33 |
Аксай, река |
Периодическая |
M. baibadm |
O. silantiewi |
Киргизия |
|
34 |
Гиссарский очаг |
Периодическая |
Microtus camithersi |
C. caspia, Amphipsylla phaiomydis, Frontopsylla elata, N. pleskei |
Таджикистан, Узбекистан |
|
35 |
Алтай, нагорье |
Периодическая |
Manmta caudata |
O. silantiewi |
Киргизия |
|
40 |
Талас, река |
Периодическая |
Microtus gregalis, Marmota caudata |
C. caspia |
Киргизия |
|
Сибирский регион |
|||||
|
36 |
Алтай, горы |
Периодическая |
Ochotom prim |
Paradaxopsyllus scorodumovi |
Россия |
|
37 |
Тува (Монгун-Тайга) |
Периодическая |
Citellus undulatus |
C. tesquorum |
Россия |
|
41 |
Тува (Саглы) |
Периодическая |
C. undulatus |
C. tesquorum |
Россия |
|
38 |
Забайкалье |
Периодическая |
Citellus dauricus |
C. tesquorum |
Россия |
* Таблица составлена А. P. Anisimov et al. (2004) по работам разных авторов. Граница очагов чумы очерчены авторами по границам чумных эпизоотий среди грызунов, зафиксирован- HBIXB XX в.
** Постоянная активность указывает на наблюдение за активность в течение всего периода эпизоотии. Периодическая активность означает, что эпизоотии прерывались 2—10-летними периодами между вспышками.
Очаги данного типа чумы охватывают более 216 х 106 га или 8,6% территории бывшего СССР. Разделение и последующую классификацию этих природных очагов чумы А. P. Anisimov et al. (2004) проводили на основе их географического распределения- с учетом основного инфицированного хозяина и основного переносчика, обнаруженных в каждом очаге[4]. Основные хозяева из различных очагов данного типа имеют несколько общих экологических характеристик, таких как большое и устойчивое количество хозяев-грызунов, инфекционная бактериемия как одна из стадий болезни, блохи-паразиты, которые являются активными переносчиками чумы, и блохи, которые могут легко выживать в норах грызунов.
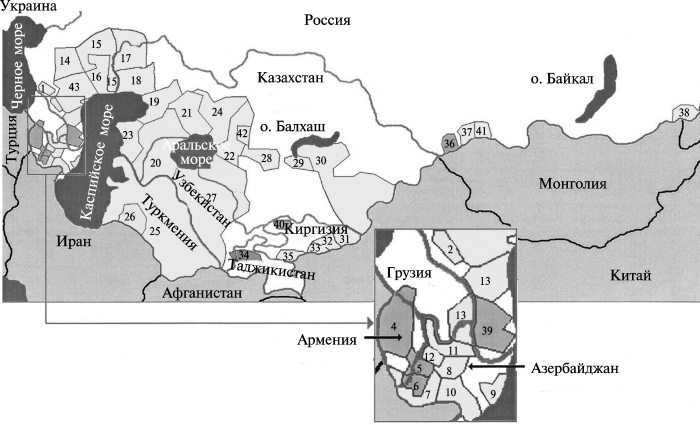
Рис. 3.31. Географическое расположение очагов чумы на территории бывшего СССР. Каждый природный очаг чумы отличается от другого видовым составом носителей и переносчиков Y. pestis, ландшафтно-географическими особенностями. Цифровые обозначения соответствуют названиям очагов, приведенных в табл. 3.9. Светло-серым выделены очаги чумы с основным подвидом Y. pestis, темно-серым — очаги с неосновными подвидами Y. pestis. По А. P. Anisimov et al. (2004)
А. P. Anisimov et al. (2004) предполагают, что адаптация к непрерывной передаче возбудителя чумы у различных видов грызунов в значительной степени способствует появлению разных подвидов Y. pestis, различаемых по ферментативной активности, потребностям в питательных веществах и по способности вызывать бактериемию и гибель различных видов животных.
Крупным эпидемиям чумы обычно предшествуют вспышки-предшественники, отражающие процесс активизации природных очагов чумы. Например, эпидемиям легочной чумы в Маньчжурии 1910 г. и 1921 г., погубивших жизни десятков тысяч человек, предшествовали локальные вспышки бубонной чумы, фиксируемые с 1860-х гг. в Забайкалье, Маньчжурии и Монголии. Они ограничивались десятками заболевших и были связаны с добыванием тарбаганов и работами местных жителей на покосах. Со средины 1890-х гг. в этих же регионах врачами выявляются локальные вспышки легочной чумы. К тому же чума стала «задерживаться» в отдельных населенных пунктах. В 1898 г. в районе Вейчан (Южная Манчьжурия) чума в течение трех лет «прореживала» жителей пяти компактно расположенных деревень, где из 550 жителей от чумы умерли не менее 400.
Активизация очагов чумы имеет пульсирующий характер: вспышки чумы сменяются периодами относительного благополучия. Южно-маньчжурский очаг чумы стал «разогреваться» с отдельных вспышек бубонной чумы, начавшихся в 1924 г. к северу и к западу от города Тунляо. В 1930-х гг. чума стала эндемичной болезнью на десятках тысяч километрах территории Внутренней Монголии и Южной Маньчжурии. Вспышки чумы 1933 г. и 1945—1947 гг., погубившие десятки тысяч жизней, зафиксировали максимальные пульсации очага, но вначале 1950-х гг. он угас.
В настоящее время мы имеем дело с «дремлющей чумой». Границы ее современных природных очагов очерчены по границам чумных эпизоотий среди грызунов, зафиксированных в XX в. По территориальным масштабам они значительно меньше тех, которые можно очертить по историческим хроникам XIV—XIX вв. Их возможные границы приведены в нашей работе (см. Супотницкий М. В., Супотницкая Н. С., 2006). Заболевания людей чумой начинаются вслед за эпизоотиями среди крыс с разрывом в 10—14 сут. Но до сих пор нет однозначного ответа на вопрос, как быстро развиваются вспышки чумы среди людей вслед за эпизоотиями среди диких грызунов. Так же неизвестен механизм «вброса» Y. pestis в популяции грызунов, обитающих на территориях очагов чумы. Периодически он приводится в действие неизвестными факторами, что проявляется крупными вспышками чумы среди людей, уже забывшими о чумных катастрофах прошлого. Вследствие этого не всякое появление чумы там, где ее «никогда не было», можно считать результатом диверсии. Эпидемиологическое расследование должно начинаться с выявление естественной эпидемиологии чумы.
Естественная эпидемиология бубонной чумы предполагает наличие не менее двух звеньев эпидемического процесса. Прежде всего, должен быть обнаружен природный источник возбудителя чумы для людей — зараженные чумой грызуны (первое звено — источник возбудителя чумы). Люди заболевают бубонной чумой на эпизоотическом фоне, т. е. с эпизоотии чумы среди грызунов («дикий очаг» чумы) или крыс («городской очаг» чумы). Наблюдается падеж грызунов и накопление инфицированных переносчиков Y. pestis — блох (второе звено — механизм передачи возбудителя чумы)[5]. Лишившиеся своих хозяев блохи нападают на животных и людей. Для сохранения активности блох требуются определенные температура и влажность. Блохи X. cheopis не могут размножаться в холодную или жаркую погоду. Благоприятная температура для развития X. cheopis около 24 °С при относительной влажности 70 %. Понижение относительной влажности ниже 40 % вызывает гибель личинок до их окукливания.
В природных очагах чумы заражение человека чумой через укусы блох сопровождается развитием бубонной и септической форм болезни. В случаях укусов блох наблюдается характерная локализация бубонов: наиболее распространены паховые и бедренные бубоны — половина всех случаев; до четверти составляют подмышечные бубоны, и до 10 % — шейные (см. Николаев Н. П., 1949). В тех очагах чумы, где дикие грызуны являются предметом охоты (сурки, суслики, зайцы и др.), инфицирование людей может происходить путем их непосредственного контакта с источником инфекции, когда охотники снимают шкурки или разделывают тушки убитых ими больных чумой животных. Люди могут заразиться чумой при снятии шкуры и разделки мяса больного чумой верблюда. В таких случаях инфицирование Y. pestis происходит через повреждения кожи рук. Первичные бубоны развиваются в группе лимфатических узлов, ближайшей к участку поврежденной кожи, через который произошло инфицирование возбудителем чумы. Характерными для заражения, вызванного разделкой больного чумой животного, являются подмышечные бубоны и вторичная чумная пневмония (Лобанов В. Н., 1968). Вторым звеном эпидемического процесса при таком пути заражения будут кровь и ткани больных чумой грызунов, с которыми человек соприкасается благодаря своей деятельности в очаге чумы. При любом из обнаруженных механизмов передачи возбудителя (через укусы блох или при контакте с кровью и шкурами инфицированных грызунов), в случае естественного происхождения вспышки бубонной чумы, должна быть выявлена чумная эпизоотия среди грызунов.
Эпидемия бубонной чумы в природном очаге чумы носит выраженный сезонный характер, и характеризуется постепенным подъемом заболеваемости. В начале чумной эпизоотии в очаге чумы имеется небольшое количество блох, способных инфицировать человека. Нарастание заболеваемости среди людей идет параллельно возрастанию гибели крыс и повышению инфекционного потенциала очага, т. е. увеличению количества блох, зараженных возбудителем чумы.
Начальная стадия чумной вспышки проходит незамеченной по разным причинам. Основная из них — психологическая. Чума — это слово-табу. Как правило, ее никто не ждет, и о ней никто не помнит. При появлении первых типичных случаев болезни, слово «чума» очень непросто произнести чиновнику или врачу, учитывая дальнейшие последствия для них в случае ошибочного диагноза.
Кроме того бубонная чума трудна для диагностики. Первые случаи могут по нескольку месяцев приниматься за неспецифические лимфадениты. Больные попадают не в инфекционные больницы, а в хирургические стационары общего профиля. И только необычно высокая смертность среди таких больных дает основание врачам заподозрить, что они имеют дело с какой-то более серьезной болезнью и предпринять бактериологическое исследование.
Развитие эпидемии чумы достигает пика, затем эпидемия постепенно угасает из- за гибели грызунов. Погибают и лишившиеся своих хозяев блохи. В городах, в которых чума вызвана завезенными чумными крысами, вспышка носит кратковременный характер. Когда в городе возникает энзоотия среди местных крыс, то заболевания людей могут иметь место в течение нескольких месяцев. В тех случаях, когда чума переходит в септическую форму с летальным исходом, и когда в жилище обитает много блох, вспышка может принять антропонозный характер и продолжаться длительное время из-за продолжительного периода блокообразования у блох (в среднем 14 сут). Если не проводить дератизацию и дезинсекцию, больные бубонной чумой появляются в одних и тех же домах в течение 2—3 мес. На продолжительность и интенсивность вспышки будет оказывать влияние величина населенного пункта, количество проживающего в нем населения, его культурный уровень, санитарное состояние жилищ и, видимо, те неизвестные факторы, которые приводят к активизации очагов чумы. В Москве эпидемия чумы, начавшаяся осенью 1770 г., закончилась в феврале 1772 г., в Одессе чума, начавшись в августе 1812 г., прекратилась через полгода.
Естественная эпидемиология легочной чумы нуждается в дальнейшем исследовании. Из исторических источников известно, что легочная чума способна «пропадать» на несколько столетий, при том, что бубонная чума за этот период времени губит жизни миллионов людей (см. у Гирша А., 1853). В настоящее время легочная чума чаще всего развивается на фоне вспышек бубонной чумы. Выделяют две клинических формы легочной чумы: первичную и вторичную. Под вторичной легочной чумой понимают чумную пневмонию, развившуюся у больных с бубонной чумой. Такие больные могут оказаться источниками воздушно-капельной инфекции для других людей. Инициация вспышки первичной легочной чумы становится возможной тогда, когда у больного вторичной легочной чумой поражение легких сопровождается приступами кашля с обильным выделением кровянистой мокроты, содержащей Y. pestis. Возможен контактно-бытовой путь передачи — возбудитель чумы со слюной больного чумой попадает в ротовую полость здорового человека (см. ниже «II. Легочная чума взрывного развития»). В обоих случаях роль ворот для инфекции играет лимфатическая система глотки, гортани, крупных бронхов. Источниками заражения для людей могут быть больные чумой кошки и собаки (Kool J. L., 2005). Легочная чума развивается по типу нисходящей бронхопневмонии. Случаи легочной чумы, вызванные воздушно-капельной и контактно-бытовой передачей возбудителя болезни от больных легочной чумой, называют первичной легочной чумой.
Эпидемиология легочной чумы существенно отличается от эпидемиологии бубонной чумы:
1) если при бубонной чуме роль больного чумой человека как источника инфекции незначительна, то при легочной чуме больной человек становится основным источником заражения Y. pestis;
2) бубонная чума не выходит за границы природных очагов чумы, легочная чума способна распространяться вместе с потоками людей далеко за их пределы;
3) бубонная чума относительно проще диагностируется, чем легочная. Ошибки в диагнозе бубонной чумы не приводят к столь серьезным эпидемическим последствиям, к которым приводит не своевременное распознание легочной чумы у больного;
4) легочная чума без лечения антибиотиками в 100 % случаев приводит больного к смерти, тогда как при бубонной чуме летальность среди заболевших 50—60 %.
Больные на ранней стадии легочной чумы (приблизительно в течение первых 20—24 ч) не представляют большой опасности из-за небольшого количества бактерий в выделениях из дыхательных путей и, как правило, отсутствия кашля. Наибольшую опасность они представляют на поздних стадиях болезни, когда при кашле выделяется обильная мокрота с видимой кровью и/или гноем. Благодаря антибиотикотера- пии, мокрота больных быстро очищается от Y. pestis. Уже через несколько часов после начала лечения эффективными антибиотиками пациент обычно становится неинфекционным (Kool J. L., 2005).
Современные вспышки легочной чумы носят локальный характер и ограничиваются единичными случаями болезни. Проследить источник возбудителя чумы очень сложно. Чаще всего врач становится перед фактом вспышки среди людей, не зная всех звеньев эпидемической цепочки распространения Y. pestis. Приведу два примера такого появления легочной чумы среди людей, одновременно показывающих, насколько различными могут быть показатели заболеваемости при одной и той же болезни.
Случай легочной чумы в Лос-Анджелесе 1924 г. (по работе Dickie W. М., 1926). В октябре 1924 г. в Лос-Анджелесе после 4-дневной болезни умерла мексиканка. Ее супруг и одна из медицинских сестер тоже заболели и умерли. Причиной смерти мужа врачи считали «двустороннюю лобулярную пневмонию». В течение двух суток имели место еще 32 смерти от легочной чумы. В число погибших вошли лица, жившие в этом доме, а также друзья и родные, посещавшие дом первого заболевшего, у которого, по- видимому, была вторичная легочная чума. Среди погибших от чумы было четверо детей в возрасте 10 лет и младше, одна женщина 50 лет, священник, медицинская сестра и водитель санитарной машины, помогавший перевозить больных с легочной чумой. У нескольких жителей этого района выявлена чума в бубонной форме. Возбудитель чумы обнаружили у городских крыс, которые, вероятно, заразились от беличьих блох. Установить, при каких обстоятельствах заразился чумой первый больной, не удалось.
Случай легочной чумы, вспыхнувшей в декабре 2004г. в Конго Субкаунти, округ Небби, Уганда (по работе Begier Е.М. et al., 2004). 26 декабря 2004 г. угандийский полицейский сообщил по телефону местному врачу Gershim Asiki о ряде случаев заболевания с быстрым летальным исходом, зарегистрированных в районе Западного Нила. В результате эпидемиологического расследования были определены две пары первичных случаев легочной чумы. Между ними не удалось установить каких-либо социальных связей.
Первой первичной больной (А1) была 22-летняя женщина, помощь ей оказывала ее 40-летняя мать (А2). По словам членов этой семьи, болезнь началась с головной боли, жара и озноба, которые сохранялись в течение нескольких дней. Увеличение лимфатических узлов впервые было обнаружено на 3 сут болезни. На 5 сут болезни у больной появился кашель, сутками позже он стал влажным, а на 7 сут уже сопровождался выделением кровянистой мокроты. На 6 сут больная женщина была осмотрена владелицей аптеки (дипломированной медицинской сестрой), которая в течение 3 сут лечила ее хлорохином от малярии. На 9 сут она стала кашлять кровью и ночью умерла. Больная А2, оказывавшая первичную помощь больной А1, заболела через 5 сут после смерти дочери. В первый день заболевания у больной А2 появились головная боль, жар, озноб, слабость, боль в груди и кашель с мокротой. Ее осмотрела та же владелица частной аптеки, которая диагностировала язвенный фарингит. Больной вводили внутримышечно пенициллин (6 раз в течение 36 ч) для лечения предположительной острой пневмонии. На следующие сутки у нее появилась обильная кровянистая мокрота, и на 3 сут болезни она умерла.
Вторым первичным больным В1 был 25-летний мужчина, которому первичную помощь оказывала его сестра, больная В2. Болезнь первичного больного В1 началась с головной боли, жара и озноба. Его семья обращалась за помощью в частную аптеку и возила его на консультацию в три государственных медицинских центра. Лимфаде- нопатия не была выявлена, лечившие его врачи специально не осматривали его с этой целью. Ему назначили противомалярийные средства и вводили внутримышечно пенициллин для лечения предположительной острой пневмонии. Е1а 5 сут болезни кашель больного В1 стал сопровождаться выделением кровянистой мокроты, а на 6 сут он умер.
Ухаживавшая за больным В1 сестра (больная В2), заболела через 5 сут после смерти В1. У нее была сильная одышка, повышенная температура и частота дыхания (39,3 °С и 56 дыханий/мин соответственно). Она не могла передвигаться самостоятельно . Лимфатические узлы не прощупывались. Е1ри исследовании легких выявлены втя- жение межреберных промежутков и двусторонние жесткие крепитирующие хрипы. Первую врачебную помощь она получила через 29 ч после начала болезни в местном медицинском центре, где ей были назначены хлорамфеникол (левомицетин), 2 г внутривенно, и доксициклин, 100 мг перорально, затем ее отправили в специализированное лечебное учреждение.
Серия из трех фронтальных рентгенограмм грудной клетки, сделанных на 2, 3 и 18 сут болезни, наглядно подтвердила много долевую пневмонию с плевральными экссудатами. Наличие Y. pestis в мокроте выжившей больной было подтверждено положительными результатами ЕГЦР-анализа маркерных генов на всех трех плазмидах Y. pestis.
Больной продолжили лечение хлорамфениколом: 1 г внутривенно каждые 6 ч в течение 48 ч, а затем 750 мг каждые 6 ч (в течение 10 сут внутривенно). Пациентка была выписана на 10 сут и принимала хлорамфеникол уже перорально, 750 мг каждые 6 ч еще 8 сут.
Лицам, имевшим тесный контакт с первичными больными А1 и В1, не было назначено профилактическое лечение антимикробными препаратами, потому что, когда было сообщено о вспышке, после смерти первичных больных прошло уже больше недели. Двадцать пять человек имели прямой контакт с одним из первичных больных (т. е. соприкасались) после появления у них кашля с выделением кровянистой мокроты и перед смертью, но заболели только два человека, оказывавшие им первичную помощь (показатель заболеваемости 2/25, 8 %).
Во время обследования в конце декабря и начале января в нескольких деревнях этого района поступили сообщения от жителей о гибели крыс, и семьи двух первичных больных также сообщили об обнаружении мертвых крыс вблизи своих жилищ накануне заболевания своих родственников. Это все, что удалось выяснить про источники инфицирования людей специалистам CDC, расследовавшим эту вспышку.
Источник инфицирования людей возбудителем чумы в Канго Субкаунти и в Лос- Анджелесе остался не установленным. Однако обе вспышки легочной чумы развились на фоне эпизоотий чумы среди грызунов, а в Лос-Анджелесе были установлены случаи бубонной чумы среди людей. Важным критерием природного характера вспышки в условиях неопределенности с источником инфекции будет отсутствие патологии мелкодисперсного аэрозоля.
Не всегда вспышка легочной чумы ограничивается единичными случаями болезни. Известны относительно недавно произошедшие вспышки легочной чумы, напомнившие современникам ужасы «черной смерти» 1346—1351 гг. Анализ научной литературы позволяет выделить три типовых сценария естественного развития крупных вспышек легочной чумы.
I. Легочная чума на фоне бубонной. Обратимся к исследованию Г. Н. Минха (1898), описавшего вспышку чумы в станице Ветлянская осенью 1878 г. Станица Ветлянская расположена на Волге, в местах повсеместных поселений малого суслика, одного из основных вторичных резервуаров Y. pestis. Какое-то заболевание, сопровождающееся развитием паховых и подмышечных бубонов, появилось в Астраханской губернии в августе 1877 г. небольшими вспышками (до 40 заболевших), не сопровождавшимися летальными исходами, что вызвало много споров среди врачей по поводу того, чума это или не чума. Так как бактериологические методы диагностики отсутствовали, эти дискуссии ясности о природе болезни не дали.
Эпидемию чумы в станице Ветлянская Минх разделил на два периода. Первый период начался в станице в конце сентября 1878 г. с единичных случаев бубонной чумы. До 17 сентября заболело 6 казаков и казачек, из них трое погибли (летальность обычная для бубонной чумы — 50 %), потом, по выражению Минха, «болезнь смягчилась» — из семи заболевших умер только один (Хритонов Макар, 27 октября). Чума «взяла паузу». Вернулась она уже в септической форме: 8 ноября скоротечно и без бубонов умерла молодая казачка, за ней при сходных обстоятельствах — молодой казак (12 ноября), на следующий день с аналогичными симптомами скончалась еще одна женщина. Со второй половины ноября, злокачественность болезни возросла, в это же время стали появляться случаи заболеваний, осложненные поражением легких. В последней декаде ноября были еще два случая затянувшейся бубонной чумы с кровохарканьем, оба больных погибли. Однако распространения легочной чумы по станице не произошло, возможно, ее вообще бы там не возникло, если бы возбудитель болезни не попал в многочисленное семейство богатого казака Осипа Белова.
Его сын Федор был женат на Марье Хритоновой. Минх, писавший свой труд еще до открытия возбудителя чумы[6], не знал о существовании вторичных крысиных очагов чумы и о возможности развития домовых эпидемий чумы. Его представления об эпидемиологии чумы строились на возможности переноса «чумного контагия». Он считал, что именно от семейства Хритоновых произошел занос «контагия» чумы в семейство Беловых. Всего у Хритоновых в первом периоде эпидемии было поражено бубонной чумой 9 человек, из которых четверо умерли, но ни один из них не страдал легочной формой болезни. В домах Беловых эпидемия проявляет себя сразу массой почти внезапных смертельных заболеваний (первыми погибли Федор и Марья) с почти полным отсутствием бубонных осложнений. Минх подчеркивал, что это обстоятельство могло бы «навести лиц, мало или совсем незнакомых с первым периодом ветлян- ской чумы, на мысль о какой-то другой, начавшейся только с Беловых, болезни».
Сегодня же можно утверждать, что, так как в семье Хритоновых легочной чумы не было (как, впрочем, и в других станичных семействах в это время), то занос возбудителя болезни в семейство Беловых мог быть осуществлен только из крысиных очагов чумы блохами. Эти очаги могли находиться как под домами Беловых, так и Хритоновых, которых «по-родственному» те посещали во время болезни. Тогда странным выглядит не типичная для данного способа заражения возбудителем чумы клиника поражения семей Беловых. Обратимся опять к работе Минха.
Исследуя отношение эпидемии по месту жительства пострадавших от болезни семейств, Минх обратил внимание на то, что близкое соседство, даже с наиболее пострадавшими от чумы семействами, не имело никакого влияния на распространение болезни по станице. Он отметил отсутствие заболевших во многих домах, расположенных вблизи тех, семейства которых поголовно вымерли. Е[росматривая метрические записи, он увидел в списке умерших все одни и те же фамилии: целые десятки Беловых, много Лобановых, Астаховых, Писаревых, Назаровых и т. д.
Вывод, который Минх сделал из этих наблюдений, состоял в том, что «только эти родословные могут досказать нам то, чего не могли открыть свидетели, что только они могли дать нам ясное представление о списке умерших, представляющемся нам, как мы сказали, без знания родословных, простым перечнем имен фамилий». Следовательно, можно предположить, что второй период ветлянской чумы — легочный, начался со случайного вовлечения в эпидемический процесс «критической массы» человеческих генотипов, у которых инфекционный процесс проявился вторично-легочной формой болезни. Относительная генетическая однородность многочисленных родов Беловых, и особенно членов семейства Белова Ивана, способствовала крайне упорному распространению вторично-легочной чумы по станице и отбору высоковирулентных штаммов ее возбудителя. После достижения «критической массы» из вторично-легочных случаев болезни, чума сформировала самостоятельные эпидемические цепочки (без участия эктопаразитов), состоящие уже из первично-легочных случаев («первичные заносы» — по определению Минха), это и привело к эпидемической катастрофе (рис. 3.32).
На схеме показаны три разные эпидемии чумы, протекающие одновременно, но вызванные одним возбудителем. Первая — бубонная чума, развивавшаяся среди жителей станицы единичными случаями с конца сентября в результате их укусов блохами, паразитировавшими на больных чумой грызунах. Вторая — «переход» бубонной чумы во вторично-легочную в семье Беловых и образование эпидемических цепочек между членами этой семьи и другими жителями станицы.
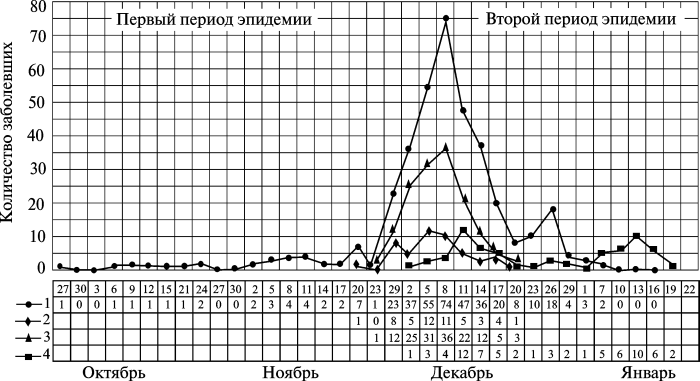
Рис. 3.32. Распространение чумы в станице Ветлянская. 1 — динамика заболеваний чумой в станице; 2 — движение чумы в домах Беловых; 3 — движение заносов (первичных) из домов Беловых; 4 — движение заносов чумы из ст. Ветлянской в другие селения. По Г. Н. Минху (1898)
Третья — формирование самостоятельных эпидемических цепочек первично-легочной чумы среди жителей станицы и других селений, начавшихся от вторично-легочных случаев в семье Беловых.
Пик эпидемии пришелся на 14 декабря — в этот день погибли 36 человек. Затем число заболеваний и смертей стало уменьшаться, 15 декабря погибли 19 человек, а 12 января 1879 г. эпидемия прекратилась[7]. В последнем периоде эпидемии (январь) преобладали случаи воспаления лимфатических узлов при лихорадочных проявлениях. Эпидемия закончилась, как и началась — бубонами. Всего в Ветлянке болело чумой 446 человек (25 % всего населения), из них выздоровели 82 человека, погибли 364 человека (82 % из числа заболевших).
В конце марта в Ветлянке наблюдалось еще несколько случаев воспаления лимфатических узлов, причем иногда температура поднималась до 39 °С и выше, в других случаях она оставалась нормальной, «опухоль желез постепенно рассасывалась». Только в одном случае нагноения шейных лимфатических узлов врачам пришлось вскрыть абсцесс. Так как во всех случаях следовало выздоровление, то их к чумным не относили.
Сходным образом развивалась чума в изолированных популяциях таджиков в кишлаке Анзоб (современный Таджикистан) в 1897 г. Сначала бубонные формы болезни, затем легочные, потом снова бубонные. Основными отличиями чумы в Анзобе от Ветлянской чумы, были: отсутствие случаев заражения от больных легочной чумой и необычная клиника легочной чумы — заболевшие люди не выглядели тяжелобольными. Ни буйного бреда, ни прострации у них не наблюдалось. Последние часы жизни они впадали в тихий бред (Супотницкий М. В., Супотницкая Н. С., 2006).
II. Легочная чума взрывного развития. Взрывному развитию легочной чумы в Маньчжурии предшествовало почти 50 лет небольших вспышек бубонной и легочной чумы («предвестников») в Маньчжурии, Монголии и Забайкальской области. Географическая изоляция, естественным образом препятствующая распространению легочной чумы между населенными пунктами, была устранена проведением Китайской-Восточной железной дороги (КВЖД). Первый раз чума (в бубонной форме) появилась на полосе отчуждения КВЖД в 1905 г. на Джаланройских каменноугольных копях, расположенных в 27 км от станции Маньчжурия. Вспышку удалось локализовать еще до того, как чума перешла на китайское население.
Точных данных, когда появились первые больные легочной чумой в Маньчжурии, нет. Но известно, что в конце лета 1910 г. одновременно в разных местах Маньчжурии появились вспышки легочной чумы. Первый бактериологически подтвержденный случай чумы констатирован врачами в поселке при станции Маньчжурия 2 октября, но начало эпидемии не совпадает с этой датой. В местности по реке Ган в Монголии против Старого Цурухайтуя весной охотники находили трупы своих товарищей и около них шкурки убитых ими сурков. Затем в конце июля верстах в двухстах от станции Маньчжурия казаки замечали, что среди сурков был мор, и они гибли в большом количестве. Видимо, и среди монголов в то время эпидемия уже свирепствовала, так как казаки обнаружили табуны скота, бродившие без присмотра.
Поданным Э. П. Хмара-Борщевского (1912), начало эпидемии чумы на ст. Маньчжурия относится к 12 октября 1910 г., когда председатель поселкового совета
А. Н. Никитин сообщил по телефону заведующему железнодорожной больницей доктору Писемскому о том, что по Александровскому проспекту, на участке № 3083, среди китайцев появились заболевания со смертельным исходом и что за последние 5 сут там умерло 9 человек. Явившись в указанный дом, доктор Писемский увидел там такую картину: барак был оставлен жильцами, на нарах валялись в беспорядке брошенные ими вещи и посуда, а в углу лежал прикрытый лохмотьями больной китаец с высокой температурой. Перкуссией и аускультацией у него было установлено воспаление правого легкого. Больной тотчас же был отправлен в железнодорожную больницу, барак заколочен и сдан под охрану полиции.
По рассказам соседей, в этом доме жили китайцы-тарбаганщики, в одной половине 25 человек, в другой — 15. Среди жильцов первой группы умерло 9, а второй — 5 человек. Перед прибытием врача все жильцы дома разбежались, бросив свое имущество. Доставленный в больницу охотник за тарбаганами был помещен в изолятор, где он и умер. Вскрытием трупа, а также бактериологическим исследованием был установлен диагноз легочной чумы.
По мнению японского профессора Абэ (1942), распространение чумы в 1910 г. началось при следующих обстоятельствах. В Даурии существовала артель плотников- китайцев, среди которых примерно в середине сентября умерло 7 человек с явлениями кровохарканья. Оставшиеся из этой артели в живых два плотника-китайца перешли на работу в другую артель на ст. Маньчжурия и здесь скончались 12 октября. Затем в этой второй артели среди 20 плотников к 25 октября умерли один за другим 9 человек. Отсюда легочная чума распространилась по всему поселку Маньчжурия (цит. по Николаеву Н. П., 1949).
Возможно, обе версии отражают части целого — реально произошедшие события. С 12 октября легочная чума начала быстро прогрессировать в поселке Маньчжурия и отсюда распространяться по железной дороге в Забайкальскую область и по всей линии КВЖД (табл. 3.10).
Таблица 3.10
Развитие эпидемии легочной чумы в полосе отчуждения КВЖД в 1910 г.*
|
Период |
Заболело |
Умерло |
Период |
Заболело |
Умерло |
|
С 13 по 17 октября |
36 |
36 |
С 8 по 14 ноября |
48 |
51 |
|
С 18 по 24 октября |
51 |
44 |
С 15 по 21 ноября |
37 |
38 |
|
С 25 по 31 октября |
85 |
73 |
С 22 по 28 ноября |
12 |
13 |
|
С 1 по 7 ноября |
86 |
98 |
С 29 по 3 декабря |
2 |
3 |
* По М. Л. Блюменфельду (1911).
К этим 356 погибшим надо добавить еще не менее 100 человек, ставших жертвами чумы с июля по октябрь (Касторский Е. С., 1911). Но и тогда приведенные сведения оказываются неточными. И. Л. Мартиневский и Г. Г. Молляре (1971) указывают на то, что в апреле 1911 г., после таяния снега, в окрестностях поселка был обнаружен 191 труп, причем 131 труп найден на полосе отчуждения и 60 трупов вне ее. Итог эпидемии: 647 погибших.
20 октября появились первые случаи заболевания легочной чумой среди китайцев на станции Даурия, 21 — в Джалайнорских копях, 26 — в Тарбагатайских копях, 27 — в Хайларе, Джалантуне, Харбине, Петровском заводе в Верхнеудинске, 31 — в Бухеду. Из этих пунктов, в особенности из Харбина, эпидемия распространилась по линиям КВЖД и Южно-Маньчжурской железной дороге.
Чума добралась до Харбина через 15 сут после ее появления на ст. Манчьжурия. Первое заболевание чумой в Харбине констатировано 27 октября у прибывшего со ст. Маньчжурия в Новый город зажиточного китайца. О больном узнал случайно бой доктора Можаева, а последний довел об этом до сведения главного врача города. Командированный для принятия соответственных мер прозектор городской больницы нашел этого китайца уже мертвым, вывел лиц, бывших с ним в контакте на обсервацию и, произведя частичное вскрытие трупа, бактериоскопически нашел биполярно окрашенные палочки возбудителя чумы. Но потом почти полмесяца чума в Харбине не показывалась.
Массовые заболевания людей легочной чумой начались в начале ноября среди населения смежного с Харбином китайского города Фуцзядяна. Кто занес туда легочную чуму, неизвестно. Первым больным, поступившим 11 ноября в чумный барак Харбина, был русский фельдшер, работавший в фуцзядянской чумной больницы. В тот же день у ворот дома № 10 на Пристани по Страховой улице поднят труп китайца, умершего от легочной чумы. 13 ноября в чумной барак доставлен китаец, накануне заболевания проведший целый день в Фуцзядяне.
С начала декабря стали систематически находить больных и трупы в кварталах торговой части города, Пристани. С 5 по 15 декабря больные и трупы были обнаружены по Японской, Русской, Корейской, Торговой и Страховой улицах. Число смертельных случаев от чумы в Харбине стало заметно увеличиваться. Контроль над легочной чумой был утрачен (рис. 3.33, с 666).
С 19 декабря в Фуцзядяне начинается интенсивный рост заболеваемости чумой. Эпидемия достигла пика в середине января, когда в течение почти двух недель ежедневная смертность в городе составляла более сотни человек. За эти две страшные недели умерло 2180 жителей, что составило 40 % от всего количества людей, умерших в эту эпидемию в городе. Но с 16 февраля, когда смертность достигла максимума, 173 человека в день, она начинает стремительно снижаться. Со 2 по 20 февраля (окончание эпидемии) умерли 273 человека. Всего же эпидемия чумы в Фуцзядяне унесла жизни не менее чем 5355 человек.
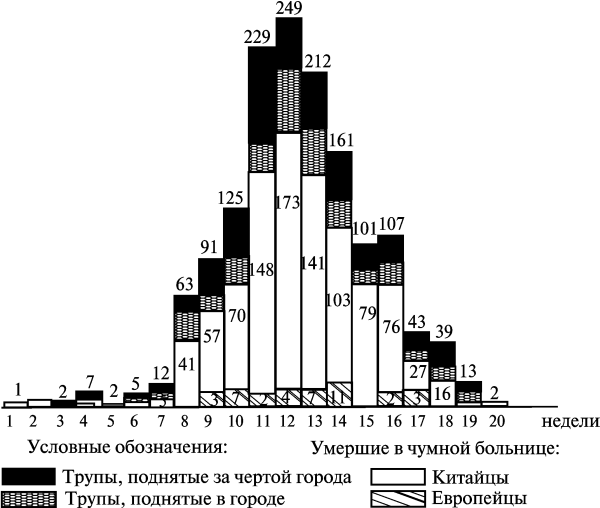
Рис. 3.33. Диаграмма смертности от легочной чумы по неделям в Харбине и окрестностях. По В. М. Богуцкому (1911)
В Харбине эпидемия достигает кульминационной точки 12 января, в этот день от чумы гибнет 51 человек. В кварталах, между улицами Водопроводная, Мостовая, Китайская и Биржевая, сформировался обширный чумной очаг самоподдерживаю- щихся домовых эпидемий, от 5 до 20 повторных заболеваний в одной квартире. Во вторую половину января смертность начинает снижаться. Всего же в течение января в Харбине от чумы погибло около 800 человек. Но потом эпидемия обрывается: 12 февраля было только два смертельных случая. Всего умерло на чумном пункте, развернутом в Харбине, 987 человек, т. е. все те, кто туда был доставлен; поднято трупов в черте города 217; поднято трупов за чертой города в полосе отчуждения 265; всего 1469 погибших от чумы (рис. 3.34).
Во время эпидемии чумы в Маньчжурии в 1910—1911 гг. роль крыс и их блох в передаче инфекции не установлена. Все усилия русских, японских и китайских врачей найти в местностях, лежащих вдоль железнодорожного пути, зараженных чумой крыс, ни к чему не привели. В лаборатории профессора Сиабуро Китазато в Мукдене было исследовано 30 тыс. крыс, из которых ни одной заболевшей чумой не обнаружено.
Максимальное количество лиц, инфицированных при непосредственном контакте с больным легочной чумой, составило 40 % (из 203 человек, находившихся в соприкосновении с больными, заболел легочной чумой 81 человек). Однако необходимо понимать, что заражение этих людей стало возможным исключительно в крайне негигиенично устроенных квартирах: почти совершенно темных, лишенных вентиляции, содержащихся жильцами в высшей степени грязно, со скученным до невероятности населением. В 80 % всех записей в регистрационных карточках больных указывалось на то, что циновка, постель, пол, одежда и руки были запачканы мокротой больного, в нескольких случаях мокротой были запачканы не только постель и руки, но и лицо; в 11 %, прилегающие к нарам стены, были покрыты кровавой мокротой.

Рис. 3.34. Апофеоз чумы в Харбине в январе 1911 г. А. Навес для хранения трупов на Московском чумном пункте. Б. Русские врачи осматривают овраг, куда китайцы тайно свозили трупы людей, умерших от чумы. По В. М. Богуцкому (1911)
Мокрота, выделенная больными чумой на предметы общего пользования, в определенных обстоятельствах приводила к вспышкам легочной чумы. Интересное наблюдение сделано доктором Р. А. Будбергом в деревне Сан-Диадзе (рис. 3.35).
Сначала легочной чумой заболел опиекурилыщик Юй Цзян, после смерти Юй Цзяна его трубкой воспользовался опиекурилыщик Дан. На третий день он заболел и умер от легочной чумы, трубка перешла к его жене, а после ее смерти к служителю опиекурильни, тоже заразившемуся чумой и умершему. Из всего имущества покойных только одна эта трубка перешла в собственность жителя той же деревни Дан Цзи-на, выкравшего ее из «выморочной» фанзы-опиекурильни. Дан заболел чумой и умер; из трубки курила его жена, также вследствие этого заразившаяся чумой и умершая; от матери заразились чумой и умерли двое ее детей; после смерти жены Дана трубка перешла к ее сестре и мужу сестры; оба умерли от чумы. Наконец трубка попала к китайцу Ли (тем же путем, что и к Дан Цзину), заболевшему чумой и умершему, потом к его жене, которая, после смерти Ли, была отдана во вторые жены к бездетному Дан Эр Ху и передала ему трубку своего первого мужа; заболели чумой и умерли все трое: Дан Эр Ху и обе его жены.
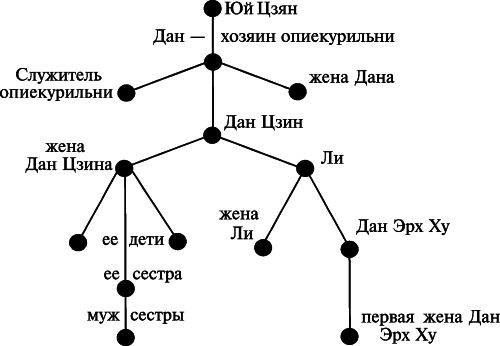
Рис. 3.35. Схема развития заболеваний чумой в деревне Сан-Диадзе. По В. М. Богуцкому (1911)
Легочная чума, развивающаяся по типу медленного горения. Рассмотрим ее на примере легочной чумы, вспыхнувшей в 1921 г. во Владивостоке. Как и чума в Харбине в 1910—1911 гг., чума во Владивостоке не появилась ниоткуда и внезапно. Ей предшествовали очень сложные эпидемические и социальные процессы, при ретроспективном анализе наглядно свидетельствующие, что для крупной вспышки легочной чумы нужны очень серьезные основания.
В апреле 1920 г. жители поселка Харанор известили Читинскую противочумную станцию о падеже среди тарбаганов. Вспышка бубонной чумы началась в конце августа 1920 г. почти одновременно в четырех пунктах: в районе станции Даурия, в поселке Абагайтуй, в поселке Каластуй и его окрестностях, в поселке Калцагайтуй и в ближайших к нему местностях. Все указанные населенные пункты расположены на правом берегу нижнего течения реки Аргунь, на расстоянии нескольких десятков верст один от другого. В районе станции Даурия в сентябре было зарегистрировано три заболевания бубонной чумой среди солдат Даурского гарнизона. В то же время обнаружено одно заболевание бубонной чумой на разъезде № 83 (между ст. Даурия и ст. Харанор), в семье путевого сторожа. Чума была установлена бактериологически. Одновременно с этим в поселке Абагайтуй зарегистрировано четыре случая также бубонной формы, в поселке Калайстуй — два случая, в поселке Калцагайтуй — семь заболеваний. Перечисленные 17 случаев наблюдались в конце августа, сентябре и начале октября 1920 г. Из 17 больных, двое выздоровели, остальные умерли. Этим закончился первый период чумной вспышки в долине реки Аргунь.
В Маньчжурии дело обстояло следующим образом. С 6 октября 1920 г. вспыхнула эпидемия бубонной чумы в Старом Хайларе (6 заболевших). Китайские власти пытались скрыть эпидемию, но она приобрела неуправляемый характер, с 15 октября по 28 октября там умерло от чумы еще 63 человека. Старый Хайлар — большой китайский город, имеющий железнодорожное сообщение на линии ст. Маньчжурия — Харбин — Владивосток. Помимо этого пути, Хайлар является конечным пунктом большого старинного китайского тракта, соединяющего этот город с целой областью поселений на запад и север от него.
В декабре, Старом Хайларе чума развивалась уже в легочной форме. С января она стала затихать, а в дальнейшем наблюдались лишь единичные привозные случаи болезни. Из Хайларачума была занесена 1 января 1921 г. в Чжалайнор (около ст. Маньчжурия), где получила среди китайских рабочих местных угольных копей значительное распространение. Болезнь протекала исключительно в легочной форме с быстрым смертельным исходом, поражала китайских рабочих, которых на копях было до 6 тыс. человек; среди европейского населении (2 тыс. человек) заболеваний не было.
25 ноября 1920 г. зарегистрирован случай чумы на ст. Маньчжурия. Эпидемии в этих двух населенных пунктах были значительными. Так, за время с 1 января по 1 марта 1921 г. на станции и в поселке Маньчжурия было 507 случаев смерти от чумы, а за такой же период времени на Чжалайнорских копях 622 случая.
По японским данным, ежедневная заболеваемость в поселке Маньчжурия в феврале 1921 г. достигла 20—50 случаев. В марте эпидемия, видимо, стала затихать. Всего на станции и в поселке Маньчжурия, с момента возникновения (12 января) по 1 марта было зарегистрировано: больных китайцев 217, европейцев 127; из них умерло: китайцев 216 и европейцев 121. Кроме того, обнаружено чумных трупов 163 (140 китайцев и 23 европейца). Здесь же в поселковой больнице умерли от чумы из медицинского персонала два фельдшера и 5 санитаров. Е. С. Касторский (1978) указывал, что в эту эпидемию от чумы умерло не менее 50 врачей.
В Цицикар легочная чума была занесена кули, ухаживавшим 18 января за чумными больными в Хайларе. По возвращении к себе домой в Цицикар этот кули и вся его семья умерли. Эпидемия охватила почти все население Цицикарской провинции. В конце января чума была уже в Фуцзядяне. В начале февраля 1921 г. легочная чума продвинулась из Хайлара по линии КВЖД далее на север и на запад и проникла на территорию Дальневосточной республики.
Е. С. Касторский (1978), наблюдавший чуму 1910—1911 г., указывал на наиболее резкие особенности в клинической картине легочной чумы в маньчжурскую эпидемию 1920—1921 гг. Это быстрота течения и отсутствие ясно выраженной локализации процесса. Больные умирали в большинстве случаев в первый день. При исследовании же и выслушивании больного каких-либо изменений в легких констатировать не удавалось, хотя в мокроте появлялась ржавчина или кровь. Очень часто в начале болезни появлялась ржавая мокрота, а затем кровавая. Обильное отхаркиванье пенистой серознокровянистой мокроты, которое считается характерным признаком чумного воспаления легких, наблюдалось далеко не всегда. Нахождение бактерий в мокроте (бактериологическое исследование) не всегда имело исчерпывающее диагностическое значение. Были случаи, когда в мокроте находили чумные бактерии, а чума у больного не развивалась, и, наоборот, бактерий не находили, а больной умирал от чумы в тот же день.
С эпидемиологической точки зрения обращала на себя внимание необыкновенная заразительность больных во время чумы 1920—1921 гг. при условии их совместного пребывания со здоровыми людьми в тесном и грязном помещении. Благодаря этому эпидемия принимала чрезвычайно опасный очаговый характер. Были случаи заболевания в один день до 40 человек в одном помещении (рабочие казармы). Касторский считал, что такая заразительность свидетельствует «об усилившейся вирулентности чумных бацилл в эпидемию 1920—1921 гг.».
Северное направление. Уже 3 февраля был отмечен первый случай чумы на ст. Борзя и два — в поселке Брусиловка; 18 февраля на ст. Мациевской (в 20 верстах от ст. Маньчжурия на линии железной дороги, по направлению к Чите) зарегистрировано первое заболевание, а 24 февраля — второе. В первых числах марта еще два случая на разъезде «1420 верста». О движении чумы на север, вверх течения реки Аргунь, имеются сведения, относящиеся только к февралю 1921 г. Судя по ним, заболевания чумой были отмечены в четырех пунктах Забайкалья: Калайстуй, в числе 25 случаев болезни за время с 1 по 20 февраля, и заимках Кыра (2 случая) и Клички (6 случаев), на Нерчинском заводе (1 случай).
Западное направление. На ст. Бухеду (расположена между Хайларом и Цицикаром) эпидемия вспыхнула с 3 февраля 1921 г. В самом начале февраля были обнаружены случаи смерти от чумы в пригородах Харбина. В самом городе Харбине чума официально началась с 13 февраля и до 18 февраля дала около 30 заболеваний; за все время эпидемии в Харбине было зарегистрировано около 1 тыс. заболеваний. Отсутствие регулярных и более точных сведений не позволяет установить действительную картину движения эпидемии в рассматриваемом направлении (рис. 3.36).

Рис. 3.36. Больной легочной чумой китаец на улице Старого Харбина, 1921 г. По U. A. Wu Lien Ten et al. (1936)
Развитие и характер эпидемии легочной чумы во Владивостоке. Потребовалось значительное время, с августа месяца 1920 г. по 10 апреля 1921 г., т. е. восемь месяцев, чтобы легочная чума от места своего «зарождения» могла дойти до Владивостока. Еженедельные сводки по смертельным случаям свидетельствуют, что эпидемия легочной чумы во Владивостоке развивалась не взрывом как в Харбине (1910), а типом «спокойного горения». Начавшись с десятка случаев на первой неделе, чума далее разгоралась постепенно увеличивающимися в течение пяти недель темпами, проявив наибольшую силу в течение шестой недели. Затем три недели чума «догорала». Но и под пеплом своих жертв она «тлела» еще тринадцать недель (рис. 3.37).
Первая неделя эпидемии (10—16 апреля 1921 г.). Первым выявленным больным легочной чумой во Владивостоке оказался Лиу Чунг Шень. 10 апреля китайцы принесли его на носилках в Морской госпиталь (эта дата считается началом эпидемии). Оттуда его направили в чумной госпиталь (Первый крепостной госпиталь), но по дороге он умер. При обследовании летучим отрядом двора дома № 193, где жил Лиу, выяснилось, что в этом же помещении 5 дней тому назад умер от неизвестной болезни другой китаец, которого похоронили на кладбище в районе 2-й речки. А10 апреля умерли еще два китайца, проживавшие совместно в доме № 112 по Светланской улице.
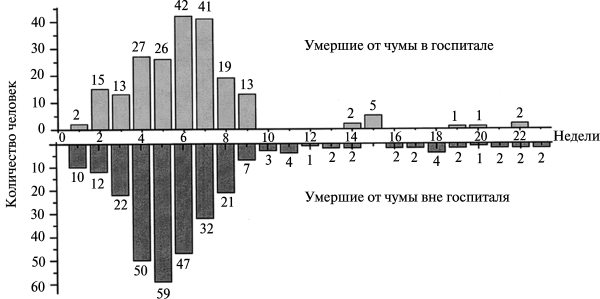
Рис. 3.37. Смертность от легочной чумы во Владивостоке в 1921 г. по неделям. По В. П. Захарову с соавт. (1922)
13 апреля летучим отрядом был обнаружен труп китайца, спрятанный в дровах на дворе дома № 98 по Светланской улице. Исследование трупа показало, что смерть наступила от чумы. В тот же день был доставлен в чумное отделение китаец Лан Гун, проживавший по Светланской улице, дом № 175, так как про него стало известно, что он часто посещал квартиру Лиу Чунг Шеня и ввиду наличия у него повышенной температуры. В ночь на 14 апреля он был убит часовым при попытке бегства из чумного госпиталя. На вскрытии трупа обнаружено прижизненное заболевание легочной чумой. Положительный результат на чуму дало и бактериологическое исследование.
14 апреля был доставлен труп китайца Лю Бен Вяна, проживавшего в доме № 42 по Корейской улице. Труп оказался чумным. При обследовании китайских квартир этого же дома был обнаружен больной китаец в тяжелом состоянии, по фамилии Тун Шу Хо, 17 лет, который проживал совместно с Лю Бен Вяном. Тун Шу-хо умер в тот же день, при явлениях легочной чумы. На следующий день в чумной госпиталь были доставлены 2 чумных трупа, выброшенных из дома № 42 по Корейской улице. Еще через день (16 апреля) в чумной госпиталь были доставлены уже 5 трупов китайцев, умерших от чумы. Всего же за первую неделю эпидемии, с 10 апреля по 16 апреля включительно, во Владивостоке было зарегистрировано два больных легочной чумой и обнаружено 10 трупов китайцев, умерших от чумы.
Вторая неделя эпидемии (17-23 апреля). 15 человек умерло в чумном госпитале, на улицах подобрано 12 чумных трупов. Болезнь развивалась быстро — четыре китайца, переведенные из изоляционного отделения в чумное, умерли в тот же день. В эту неделю зарегистрирован первый случай заражения чумой медицинского персонала — погибла медсестра Даниленко.
К концу недели стало ясно, что эпидемия вышла из-под контроля противочумной организации. Чума «пошла» в окрестности города. 17 апреля на станции Океанская, в 38 км от города, был поднят китаец в тяжелом состоянии с явными признаками легочной чумы. На полу помещения, где он лежал, была масса характерных кровянистых плевков мокроты. 19 апреля он умер.Третья неделя эпидемии (24—30 апреля). Новые случаи заболеваний легочной чумой среди медицинского персонала: умерли два санитара (Годяцкий и Мальцев). Больные чумой стали поступать из окрестностей города: с каменноугольных копей Скидель- ского (30 верст от города), с 5 версты Сучанской ветки и со станции Океанская. Чума приобрела тенденцию к распространению на побережье Приморской области.
Всего за неделю на улицах, площадях и с квартир подобрано 42 трупа, из них чумными оказались 22, и 13 человек умерли в чумном госпитале. Большинство трупов было подобрано в тех же кварталах, что и в предыдущие две недели (район скрещения улиц Семеновской и Суйфунской — 6 трупов). Стало ясно, что там находятся чумные очаги. Однако обследование 27 апреля китайского общежития в доме № 20 по Суйфунской улице, ничего не дало, трупы из него были уже выброшены. Когда через 3 дня проверку внезапно повторили, то было выявлено 8 больных чумой, 4 китайцев отправили в изоляцию, 41 — в обсервацию. Из соседних помещений китайцы успели разбежаться.
Четвертая неделя эпидемии (1—7 мая). Чума «пошла» по более широкому кругу, захватив Шлюпочную площадь бухты Золотой Рог с шаландами и шлюпками (5 трупов), Первую Речку (7 трупов), северную часть Корейской улицы (7 трупов). Прочие китайские кварталы северо-западной части города по-прежнему дали основное число трупов. По дням число трупов стало распределяться более равномерно. В чумном госпитале умерло 27 человек, с улиц и площадей города поднято 50 чумных трупов. Погиб санитар Воробьев.
Пятая неделя эпидемии (8—14 мая). Небольшое повышение заболеваемости и смертности по сравнению с четвертой. Во всех отделениях чумного госпиталя от чумы умерло 26 человек, во Владивостоке поднято 59 чумных трупов, в окрестностях — 4. Погиб фельдшер Доброжанский.
Шестая неделя эпидемии (15—21 мая). Пик развития эпидемии. Во всех отделениях чумного госпиталя за неделю умерло от чумы 42 человека, по улицам и окрестностям города поднято 47 чумных трупов. В основном больные поступали с тех же улиц, что и в предыдущие недели. Погиб фельдшер Козлов. На хуторе Сехюче 15 мая умерло четыре русских жителя. Все они имели контакты с китайцами, приезжавшими из Владивостока.
Седьмая неделя эпидемии (22—28 мая). Количество больных чумой и подобранных чумных трупов уменьшилось. Умер от чумы 41 человек, поднято 32 чумных трупа. Погиб санитар Хазов.
Восьмая и девятая недели эпидемии (29 мая— 11 июня). Во Владивостоке эпидемия неуклонно шла на убыль. От чумы умерло 32 человека, подобрано 28 чумных трупов. Погиб санитар Короткевич.
Наступил период, резко отличающийся по своему эпидемическому течению и по существу заболеваний от предшествовавшего. Его П. В. Захаров с соавт. (1922) назвали «хвостом эпидемии легочной чумы». Как оказалось, в большом городе очень трудно уловить момент прекращения эпидемии легочной чумы.
Десятая неделя эпидемии (12—18 июня). Эпидемия резко оборвалась: за неделю было зарегистрировано только три чумных трупа. В предшествовавшую девятую неделю было 20 случаев, а в восьмую — 40. Возник естественный вопрос, не конец ли это эпидемии легочной чумы, или, быть может, это только передышка? Некоторые врачи определенно утверждали, что эпидемии окончилась, и нужно готовиться, после десятисуточного срока со времени обнаружения последнего чумного трупа, объявить город угрожаемым по чуме, а затем и благополучным. Дальнейшее развитие событий показало, что такой 10-суточный срок наступил не скоро.
Одиннадцая—двадцатая недели эпидемии (19 июня—27 августа). В разных местах города выявляются единичные заболевшие чумой и поднимаются единичные чумные трупы. Дважды разрывы между зарегистрированными случаями чумы составляли 6 суток (между 11 и 13 неделями).
Двадцать первая неделя эпидемии (28 августа—3 сентября). Случаев смерти в чумном госпитале не было. Трупов было поднято два. Оба были вскрыты 30 августа в присутствии бактериолога Левашова и японского врача Гото, подтвердивших чуму.
Двадцать вторая неделя эпидемии (4—9 сентября). Количество случаев чумы вдруг возросло. В чумном госпитале от нее умерли 2 китайца, два трупа, подобранные на улицах, оказались чумными. У властей возникло опасение, что дотянувшаяся до октября месяца, т. е. до холодного времени года, эпидемия может вновь разгореться в легочной форме.
Двадцать третья неделя эпидемии (11—17 сентября). Последняя неделя эпидемии чумы во Владивостоке. Два чумных трупа, обнаруженные за неделю, были последними зарегистрированными случаями чумы. Один труп китайца был поднят 11 сентября на берегу Амурского залива против Новокорейской слободки, другой труп тоже китайца, был поднят 15 сентября с угла Суйфунской и Нагорной улиц. В эту неделю всего было поднято 4 трупа. Таким образом, последний случай чумы во Владивостоке зарегистрирован 15 сентября 1921 г.
Горючим материалом («сухими дровами») для чумы было китайское население, исключительно питавшее и поддерживавшее пожар эпидемии в городе. Однако никаких эмпирических доказательств какой-то «этнической избирательности» легочной чумы тогда получено не было. Китайцы, жившие в европейских семьях (лакеи, повара), не были затронуты болезнью. Подавляющее большинство погибших от чумы принадлежало к китайской бедноте, жившей в ночлежках, казармах, в обстановке невероятной скученности и грязи.
Касаясь вопроса заразительности легочной чумы, П. В. Захаров с соавт. (1922) отмечают, что ответ на него не так прост, как это на первый взгляд кажется. Многие факты, выявленные при изучении эпидемии легочной чумы во Владивостоке, говорят о ее высокой заразительности. Однако они также дают основание утверждать, что между фактом высокой заразительности легочной формы чумы и фактом ее малого распространения лежит нечто третье, проходя через которое, высокая степень заразительности чумы все же давала «медленное горение» такого многочисленного и компактно проживающего населения, как Владивостокские китайские кварталы.
Анализ крупных вспышек легочной чумы позволяет выявить следующие закономерности их развития. Масштабные эпидемии легочной чумы не имеют единого центра. Легочная чума распространяется небольшими вспышками по направлениям движения потоков людей с территорий, охваченных чумными эпизоотиями среди грызунов. Такие эпидемии имеют период вспышек-предшественников, длящийся иногда десятки лет. Они сигнализируют о нарастающей активизации природных очагов чумы. Переходу локальных вспышек легочной чумы в масштабную эпидемию предшествует накопление «сухих дров» эпидемии легочной чумы. Ими, как правило, становятся люди, у которых по разным причинам (генетические особенности, массивные дозы заражении вирулентными штаммами и др.) бубонная чума переходит во вторично легочную, а стереотип их социального поведения и условия жизни способствуют ее дальнейшему распространению уже в форме первичной легочной чумы. «Движение» легочной чумы по территориям происходит медленно, по выражению П. В. Захарова с соавт. (1922): «Со скоростью пешехода». Так, в 1921 г. в условиях неконтролируемого перемещения китайского населения легочная чума «прошла» 100 км от Уссурийска (тогда Никольск-Уссурийский) до Владивостока только за месяц. В механизме развития масштабной эпидемии легочной чумы заложен и механизм ее терминации. Поэтому легочная чума в крупном населенном пункте не может длиться до последнего жителя, хотя внешне все условия для ее продолжения остаются.
Внутривидовая таксономия. При идентификации и классификации штаммов возбудителя чумы, обнаруженных при расследовании актов биодиверсий и биотеррора, необходимо учитывать то обстоятельство, что большинство исследований экологии, биохимии и патогенеза Y. pestis, осуществляемых за пределами бывшего Советского Союза, было проведено с ограниченным количеством близкородственных штаммов. Ни один научно-исследовательский институт за пределами России не имеет того количества штаммов возбудителя чумы и опыта исследований Y. pestis в ее природных очагах, которые накоплены исследователями русской противочумной системы. Поэтому использование отечественной таксономической классификации, основанной на фенотипических признаках при идентификации и классификации штаммов Y. pestis, является наиболее информативным подходом из имеющихся (табл. 3.11).
Таблица 3.11
Таксономические признаки штаммов, которые различают подвиды Y. pestis, выделенные на территории бывшего СССР и Монголии, и соответствие подвидов биоварам*
|
Таксономические признаки |
Подвид Y. pestis |
||||||
|
pestis (главный) |
altaica |
caucasica** |
hissarica |
alegeica |
talassica |
||
|
Ферментация |
рамнозы |
- |
+ |
+ |
+ |
+ |
+ |
|
мелибиозы |
- |
+ |
+ |
+ |
+ |
+ |
|
|
арабинозы |
+ |
- |
+ |
- |
+ |
- |
|
|
глицерина |
± |
+ |
+ |
+ |
+ |
+ |
|
|
мелезитозы |
- |
9 |
- |
± |
? |
- |
|
|
Восстановление нитратов |
± |
- |
+ |
- |
- |
- |
|
|
Активность уреазы |
- |
- |
- |
± |
- |
+ |
|
|
Продуцирование пестицина 1 |
+ |
+ |
- |
+ |
+ |
+ |
|
|
Чувствительность к пестицину 1 |
- |
+ |
+ |
± |
±*** |
- |
|
|
Фибринолитическая активность |
+ |
+ |
- |
+ |
+ |
+ |
|
|
Активность коагулазы |
+ |
+ |
- |
+ |
+ |
+ |
|
|
Зависимость от факторов питания |
лейцин |
± |
+ |
± |
+ |
- |
+ |
|
метионин |
+ |
- |
+ |
+ |
- |
? |
|
|
аргинин |
- |
+ |
+ |
- |
- |
+ |
|
|
тиамин |
- |
- |
+ |
- |
- |
? |
|
|
цистеин |
± |
+ |
± |
+ |
+ |
+ |
|
|
фенилаланин |
± |
+ |
+ |
+ |
+ |
+ |
|
|
треонин |
+ |
? |
+ |
- |
? |
? |
|
|
тирозин |
- |
? |
? |
- |
? |
+ |
|
|
Вирулентность для морских свинок |
+ |
- |
- |
- |
- |
- |
|
|
Регион распространения |
Центральная Африка, Центральная и Северная Азия, Китай (Маньчжурия), Монголия |
Алтайские горы |
Закавказское нагорье, горные районы Дагестана |
Гиссарский хребет |
Северо-Восточная Монголия, пустыня Гоби |
Таллаский хребет |
|
|
Хозяин |
Грызуны родов Marmota, Citellus, Meriones, Rattus и т. д. |
Ochotona pricei |
Microtus arvalis |
Microtus camithersi |
Ochotona pricei |
Microtus gregalis**** |
|
|
Биовар |
Antiqua |
Medievalis |
Antiqua |
Medievalis |
Medievalis |
Medievalis |
|
*Таблица составленана основе работы А. P. Anisimov et al. (2004). Символы: —отсутствие признака; + наличие признака; ± наличие признака, но не во всех штаммах; ? — нет данных.
** Штаммы подвида caucasica не имеют плазмиды pPst.
*** Штаммы чувствителы к пестицину штаммов из подвидов pestis и altaica и так же резистентны к пестицину из штаммов своего собственного подвида.
**** Существует точка зрения, что главным хозяином в этом очаге может быть Marmota caudata.
Восприимчивость и чувствительность животных к возбудителю чумы. В чумологии принято отличать восприимчивость к инфекции от чувствительности к ней, причем под первой понимают способность заражаться, тогда, как вторая характеризует интенсивность и остроту патологического процесса. С этих позиций восприимчивость считается видовым признаком, а чувствительность индивидуальным. Вопрос о восприимчивости животных и чувствительности животных к Y. pestis обычно рассматривается с точки зрения их роли в поддержании эпизоотического процесса. Наиболее восприимчивыми к чуме являются многие виды обширного отряда грызунов. Чума справедливо считается болезнью грызунов; другие виды животных, в том числе и человек, заболевают чумой при контакте с больными грызунами. Ю. М. Елкин (1960) разделил грызунов на четыре группы:
1) высокочувствительные (домовая мышь, тамарисковая и малоазиатская песчанки, песчанка Виноградова, степная пеструшка, слепушонка);
2) залегающие в спячку с резко меняющейся по сезонам чувствительностью (сурки, суслики);
3) незалегающие в спячку, в популяциях которых всегда имеются высокочувствительные и очень резистентные особи (полуденная, большая, краснохвостая песчанки, серая крыса, обыкновенная и общественная полевки, полевка Брандта, полевая мышь);
4) чувствительные только к очень большим дозам заражения (лесная мышь) (цит. по Домарадскому И. В., 1998).
Черные и серые крысы весьма чувствительны к чуме, но в естественных условиях серые заражаются легче, чем черные. В Индии, например, были случаи, когда эпизоотии сначала начинались среди серых крыс и лишь позднее охватывали черных. В то же время по чувствительности к чуме популяции крыс столь же неоднородны, как и популяции многих других животных. Из домашних животных восприимчивы к чуме верблюды и кошки. У ослов и мулов, овец и коз, свиней, собак при введении больших доз чумного микроба в экспериментальных условиях иногда удается вызвать чумную инфекцию. Но с практической точки зрения этих животных можно считать невосприимчивыми к чуме. Лошади и крупный рогатый скот невосприимчивы к чуме. Хищники, за небольшим исключением (хорьки, лисицы, ласки, солонгои), невосприимчивы к чуме. Из насекомоядных восприимчивы к чуме землеройки. Птицы и пресмыкающиеся (змеи, черепахи) невосприимчивы к чуме. Ящерицы восприимчивы при экспериментальном заражении. Из земноводных жаб следует считать невосприимчивыми к чуме, а лягушек и тритонов — маловосприимчивыми, не имеющими значения в эпидемиологии этой инфекции. Насекомые и паукообразные хотя и маловосприимчивы к чуме, но в их организме чумные микробы могут находиться довольно продолжительное время (табл. 3.12).
Таблица 3.12
Восприимчивость к чуме насекомых и паукообразных*
|
Наименование насекомого или паукообразного |
Восприимчивость** |
Продолжительность сохранения чумного микроба (сут) |
|
Мухи |
± |
До 18 |
|
Комары |
- |
|
|
Саранча |
+ |
4 |
|
Жуки стафилины |
- |
|
|
Тараканы |
- |
|
|
Блохи |
± |
До 396 |
|
Клопы |
+ |
До 147 |
|
Вши человека: |
||
|
головные |
+ |
|
|
платяные |
+ |
|
|
Вши земляного зайца |
+ |
До 14 |
|
Вши тарбагана |
+ |
До 13 |
|
Клещи: |
||
|
Rhipicephdus Schultze Olen |
+ |
|
|
Ixodes autumnalis L. |
+ |
|
|
Dermacentor silvamm Olen |
+ |
10 |
|
Hydomma volgense Schultze |
+ |
11 |
|
Argas persicus F. |
+ |
100 |
* По В. М. Туманскому (1958).
** Условные обозначения: + восприимчивы; — невосприимчивы.
Для изучения вирулентности штаммов Y. pestis наиболее пригодны морские свинки, ибо эти животные очень восприимчивы к чуме, и слабо реагируют на токсины возбудителя чумы. Белые мыши мало пригодны для этой цели, так как они очень чувствительны к токсинам Y. pestis. Дикие грызуны, взятые из энзоотических районов, непригодны для изучения вирулентности Y. pestis, так как среди этих грызунов могут встречаться иммунные особи (Туманский В. М., 1958). Но А. P. Anisimov et al. (2004) отмечают, что в тестах на вирулентность у морских свинок большинство штаммов Y. pestis подвида pestis являются летальными, тогда как штаммы подвидов altaica, caucasica, hissarica, ulegeica и talassica, как правило, обнаруживают резкое снижение вирулентности или даже полное ее отсутствие для этих животных, тем не менее они способны вызывать вспышки чумы среди людей, сопровождающиеся развитием пневмонии. Эти авторы считают, что еще невозможно реально определить, какой именно набор генетических и фенотипических признаков указывает на вирулентность штаммов Y. pestis для лабораторных животных или людей.
Инфицирующие дозы. Вирулентность штаммов Y. pestis колеблется в широких пределах, даже если они выделены в условиях одной эпидемии или эпизоотии. Ингаляционная поражающая доза (LD100) возбудителя чумы для человека обычно находится в пределах от 100 до 3000 клеток и зависит от очень многих факторов помимо вирулентности самого штамма и дисперсности аэрозоля (Ротшильд Д., 1966; Ситников М. Н., 1968; Van Andel R. et al., 2008). К увеличению инфицирующей дозы приводят частые пересевы, хранение штаммов возбудителя чумы при высокой температуре, выращивание на средах с антисептиками и антибиотиками, глубинное культивирование, пассаж через маловосприимчивых или иммунных животных, увеличение размера частиц аэрозоля и др. Снижение инфицирующей дозы Y. pestis достигают путем пассажа через организм морской свинки или путем отбора наиболее вирулентных клеток из микробной популяции (Николаев Н. И., 1968)[8].
Иммунитет. Случаи повторного заболевания чумой после перенесенного заболевания редки, но возможны. Подробно протекгивные антигены возбудителя чумы описаны в монографии А. А. Бывалова (2011). Какому из них принадлежит решающая роль в иммуногенезе чумы, ясности нет. К тому же исследователи не всегда могут быть уверены в том, что данные, полученные на животных, безоговорочно приложимы к объяснению процессов, происходящих в организме человека. Антитела появляются на 7 сут от начала болезни. Особое значение имеет выявление IgM, как показателя недавнего контакта с источником чумы. Достоверно известно, что в иммунитете к чуме основная роль принадлежит клеточным факторам. Из всех вакцинных штаммов лучше всего зарекомендовали себя TJW и EV. В отечественной практике предпочтение отдается живой вакцине на основе штамма EV В практике научно-исследовательских организаций Министерства обороны России используется эффективный и безопасный способ массовой ингаляционной иммунизации живой чумной вакциной на основе штамма EV. Создаваемый таким способом иммунитет к возбудителю чумы, исключает возможность ингаляционного заражения человека при тех концентрациях возбудителя чумы в аэрозоле, которые можно создать при применении БО.
Устойчивость Y. pestis во внешней среде и в трупах погибших. В выделениях больных людей и животных Y. pestis может сохраняться продолжительное время, что зависит от температуры и наличия других бактерий, обладающих антагонистическим действием. В замороженной мокроте чумной микроб сохраняет свою жизнеспособность от 6 до 14 сут; в мокроте, находящейся при комнатной температуре, до 36 сут; в высушенной мокроте он погибает через 4—7 сут. В гною из бубонов вне организма чумной микроб может сохраняться до 20—30 сут. В крови, взятой у животных больных чумой, возбудитель чумы может сохраняться длительное время при защите от высыхания до 260 сут (при температуреЮ—12°С) (Туманский В. М., 1958).
В замороженных человеческих трупах Y. pestis может сохраняться 4—5 мес. В летнее время уже через 4—5 сут после смерти человека от чумы из его лимфатических узлов, крови и внутренних органов не удается выделить культуры даже при заражении восприимчивого животного способом втирания. Дольше всего Y. pestis сохраняется в костном мозгу, так как он не подвергается быстрому загниванию. В шкурках грызунов, погибших от чумы, микроб сохраняется в зависимости от условий обработки хранения этих шкурок: при комнатной температуре — до 23 сут, а при температуре 28 °С — до 17—18 сут. В жаркую летнюю погоду на солнце Y. pestis сохраняется в шкурках до 6 ч, а в тени — до 3 сут. На круто сваренном яичном белке Y. pestis сохраняется до 13 8 сут, в молоке — до 81 сут, в соленом мясе — до 13 0 сут, на черном хлебе — до 4 сут, на овощах и фруктах — 6—11 сут, на зерновых продуктах — 12—54 сут, в воде — до 75 сут. Но вспышек чумы, связанных с употреблением в пищу молочных продуктов, хлеба, овощей, фруктов и воды, не описано (Туманский В. М., 1958).
Мясо верблюда, больного чумой, в момент его разделки неоднократно было причиной инфекции, вспышек заболевания среди людей. Зерно во время больших чумных эпизоотий может быть загрязнено кровью и трупами мышей, погибших от чумы. Теоретически если это зерно в необработанном виде будет перевезено в здоровую местность, то оно может заразить грызунов и создать среди них эпизоотию. Именно такой способ пытались использовать американские военные для распространения чумы среди жителей китайских городов (см. разд. 1.10).
В почве Y. pestis сохраняется непродолжительное время, при этом сохраняемость ее зависит от активности других микроорганизмов и от температуры. При низкой температуре чумной микроб может оставаться жизнеспособным сравнительно долгое время — до 28 сут, при более высокой температуре он быстро погибает. Солнечные лучи оказывают энергичное убивающее действие на Y. pestis. Она чувствительна и к высокой температуре. При кипячении возбудитель чумы в бульонной и агаровой культуре и даже в крови погибает через несколько секунд, при этом большинство микробов гибнет раньше, чем начинает закипать жидкость (Туманский В. М., 1958).
Аэрозоли Y. pestis демонстрировали постоянную скорость распада, когда они аэрозолировались при относительной влажности 50 % из бульона с настоем сердечной мышцы. Происходила внезапная утрата живых микроорганизмов при повышении относительной влажности до величин, превышающих 50 %, особенно до 85 % (Sinclair R. etal., 2008).
В дентине зубов методами молекулярной диагностики можно обнаружить нуклеотидные последовательности Y. pestis спустя несколько столетий после гибели человека от чумы (Haensch S. et al., 2010).
Антибиотикорезистентность. Обычно изоляты Y. pestis в равной степени чувствительны ко всем антимикробным препаратам, эффективным против грамотрицательных бактерий. В 1995 г. у клинического изолята Y. pestis обнаружена высокая резистентность к антимикробным средствам, включая все лекарственные препараты, рекомендованные для профилактики и лечения чумы. Штамм (17/95) выделен в районе Амболавау в Мадагаскаре у 16-летнего юноши с симптомами бубонной чумы. Второй штамм (16/95) с высокой резистентностью к стрептомицину выделен в том же году в Мадагаскаре в районе Ампитана от 14-летнего больного бубонной чумой. Оба больных выздоровели после антибиотикотерапии, включающей внутримышечные инъекции стрептомицина (2 г/сут в течение 4 сут) и пероральное применение триметоприм-сульфаметоксазола (2 г/сут в течение 10 сут). Более подробно свойства этих штаммов рассмотрим по обобщающей работе М. Galimand et al. (2006).
Штамм 17/95 обнаружил высокую резистентность к восьми антимикробным препаратам, включая не только рекомендованные для лечения (стрептомицин, хлорам- феникол и тетрациклин) и профилактики (сульфонамид и тетрациклин) чумы, но также и возможные альтернативные средства, такие как ампициллин, канамицин и спектиномицин.
Резистентность к ампициллину, хлорамфениколу, канамицину, сульфонамиду и стрептомицин-спектиномицину носила детоксикационный характер[9]. Она была обусловлена продуцированием Y. pestis пенициллиназы ТЕМ-1, хлорамфеникол-ацетилтрансферазы типа I, аминогликозид-фосфотрансферазы типа I, резистентной к лекарственным препаратам дигидроптероат-синтазы и аминогликозид-аденилтрансферазы соответственно. Резистентность к тетрациклину у штамма 17/95 связана со способностью бактерии выкачивать тетрациклин из клетки быстрее, чем антибиотик поразит свои мишени. Изолят сохранил чувствительность к цефалоспоринам, другим аминогликозидам, хинолонам и триметоприму. Скорее всего, именно активность три-метоприма, несмотря на отсутствие синергизма с сульфонамидом, и обеспечила выздоровление больного.
Все гены резистентности штамма 17/95 содержались в конъюгативной плазмиде, обозначенной рIР1202 (примерно 150 т. п. о.). В эксперименте она могла быть перенесена с высокой частотой путем конъюгации от Y. pestis 17/95 к другим штаммам Y. pestis и Е. coli; и в обратном направлении. Плазмида рIР1202 принадлежит к группе несовместимости 1пс6-С и содержит структуру, аналогичную таковой интегронов Тп21-подобных элементов. Содержавшиеся в ней гены резистентности близкородственны по структуре переносимым плазмидами детерминантам, обычно обнаруживаемым у энтеробактерий.
Штамм 16/95 обладает устойчивостью детоксикациоиного типа к стрептомицину, но сохраняет чувствительность к спектиномицину и другим антимикробным средствам, включая рекомендованные для лечения и профилактики чумы. Гены резистентности к стрептомицину переносились между бактериями плазмидой рIР1203 (примерно 40 т. п. о.), способной конъюгировать с другими изолятами Y. pestis. Они являются частью кластера tnpR-strA-strB-IR, характерного для Тп5393-группы транспозонов. Перенос резистентности к стрептомицину от Y. pestis 16/95 к Y. pestis и Y. pseudotuberculosis происходил с высокой частотой, к Е. coli с более низкой частотой, а перенос к Y. enterocolitica вообще не удалось обнаружить. Повторный перенос рIР1203 от трансконъюгантов Y. pestis и Y. pseudotuberculosis к Y. pestis и Y. pseudotuberculosis также происходил с высокой частотой.
Антибиотико-резистентные штаммы Y. pestis имеют несколько отличий. Они были выделены в двух разных районах, расположенных на расстоянии 80 миль друг от друга. Штамм 17/95 относится к типичному риботипу В, тогда как штамм 16/95 относится к недавно описанному, Мадагаскар-специфическому риботипу Q. Плазмида рIР1202 несет гены множественной резистентности к антимикробным препаратам, принадлежит к группе 1пс6-С, тогда как рIР1203 несет только детерминанты резистентности к стрептомицину, принадлежит к группе IncP. Наконец, резистентность к стрептомицину у штамма 17/95 обусловлена аденилированием препарата, а у штамма 16/95 — фосфорилированием. Эти данные свидетельствуют о том, что антибиотикорезистентные штаммы Y. pestis возникли независимо друг от друга.
Обнаружение генетически измененных штаммов К pestis. Подходы к обнаружению генетически измененных штаммов возбудителя чумы те же, что и для обнаружения генетически-измененных штаммов В. anthracis (см. разд. 3.1). Однако необходимо учитывать, что генетика Y. pestis изучена не хуже, чем кишечной палочки. Методы генетического переноса для возбудителя чумы стали отрабатываться сразу же после обнаружения у него собственных плазмид. Для Y. pestis могут быть использованы методы генетической модификации и векторы клонирования, разработанные для Е. coli и многих других грамотрицательных микроорганизмов. В Y. pestis в условиях in vitro легко переносятся плазмиды вирулентности близкородственных микроорганизмов, и наоборот (см., например, работу Wolf-Watz Н. et al., 1985). Поэтому генетическая модификация чумного микроба, ставшего причиной намеренного заражения людей, может оказаться значительно более изощренной, чем у возбудителя сибирской язвы.
В очагах искусственно вызванных вспышек чумы с наибольшей вероятностью можно встретить штаммы возбудителя чумы со следующими модификациями (и их сочетаниями):
резистентные к антибиотикам, используемым в распространенных схемах лечения чумы (введение генов, придающих бактерии резистентность к антибиотикам преимущественно детоксикационного типа);
обладающие более высокой вирулентностью, чем исходные природные штаммы (введение в Y. pestis генов токсинов и иммунорегуляторных белков);
с измененной антигенной специфичностью, пробивающих иммунитет, создаваемый коммерческими вакцинами (получение мутантов Y. pestis с V-антигеном некоторых сероваров Y. enterocolitica или с ЛПС с высокоацетилированным липидом А).
Дифференцировать генетически измененные Y. pestis от их природных вариантов по фенотипическим признакам сложно из-за поддержания в природных резервуарах большого количества атипичных штаммов Y. pestis. Генотипическое и фенотипическое разнообразие наблюдают даже среди чумных изолятов из одного и того же природного очага. По данным А. P. Anisimov et al. (2004), в полевых условиях появление атипичных штаммов Y. pestis может коррелировать с различными фазами эпизоотического цикла. Так называемые атипичные штаммы отличаются по некоторым из основных признаков, обнаруженных в доминирующем варианте Y. pestis, выделенном в определенном очаге чумы. Экологические и другие изменения, происходящие во время эпизоотического цикла, способствуют появлению недоминирующих штаммов Y. pestis.
Анализ частоты появления разных форм Y. pestis, выделенных из разнообразных природных очагов чумы, показал, что уровень изменчивости в очагах различен и колеблется от 1,6 % (Волго-Уральский степной очаг), до 6,7 % (Гиссарский очаг). Наиболее часто атипичные штаммы выделяют на пике эпизоотии среди грызунов. Было установлено, что 24,4 % атипичных штаммов обнаруживают нехарактерные биохимические активности; 17,6 % были лизогенизированы бактериофагами; 13,5 % обнаружили измененные потребности в факторах роста; 14,27 % имели мутации в локусе hms (для «системы хранения гемина»); 16,75 % показали пониженную вирулентность для лабораторных животных; 9,93 % были F1-; 2,36 % оказались дефицитны по пестицину; и 0,4 % были резистентны к литическому действию диагностических фагов (Anisimov А. P. et al., 2004).
Ответ на вопрос о том, является ли штамм Y. pestis, выделенный от жертв биотер- рористического акта, атипичным или генетически модифицированным, затруднен еще и отсутствием согласованной бактериальной систематики, что не позволяет определить основную единицу биологического разнообразия — вид, не говоря уже о подвиде. Нет ясности и по факторам вирулентности Y. pestis. Скорее всего, для ответа на него необходимо:
установить прототипный (наиболее близкий) природный штамм Y. pestis;
затем провести сравнение его генома с геномом штамма Y. pestis, использованного для преступления;
пользуясь знаниями о существующих в природных экосистемах генах патогенности (антибиотикорезистентности) и механизмах их передачи, провести экспертную оценку возможности или, наоборот, невозможности искусственного происхождения данного штамма. Например, наличие у штамма Y. pestis резистентности к стрептомицину, вызванной приобретением им конъюгативной плазмиды с кластером tnpR-strA- strB-IR, объяснимо на основе знаний о генетическом обмене среди бактерий семейства Enterobacteriaceae.Однако обнаружение этого же кластера в геноме Y. pestis в составе интегративного вектора с известной историей конструирования (см. разд. 2.2.2 «Технологии рекомбинантной ДЕ1К в получении штаммов бактерий с неправильной эпидемиологией») требует уже поиска лаборатории, где этот штамм был получен.
Патогенез. Отдельного «фактора патогенности», определяющего способность возбудителя чумы вызывать инфекционный процесс у человека, не описано (Анисимов А. П., 2002). По мнению Е. П. Шуваловой с соавт. (2001), в основе патогенеза чумы лежат два связанных между собой процесса — септический и токсический. Септический процесс определяется способностью Y. pestis размножаться в фагоцитирующих клетках. После укуса блохи возбудитель чумы попадает в региональные лимфатические узлы, где происходит его бурное размножение (1—3 сут). В этот процесс вовлекается все большее число нейтрофилов, возбудитель находится в первичном очаге (если он формируется) и региональных лимфатических узлах. Затем происходит стремительное вовлечение в процесс все возрастающего числа нейтрофилов, выход в кровь их костномозгового резерва. Болезнь начинается остро. У больного высокая температура, симптомы выраженной интоксикации и нейтрофильный лейкоцитоз.
Основу токсических проявлений инфекции, вызываемой возбудителем чумы, составляет действие эндотоксина — ЛПС бактериальной стенки. Клетки Y. pestis частично разрушаются, и освобождается ЛПС, действующий непосредственно на клетки крови, тканей, эндотелий сосудов и опосредованно, активируя систему комплемента и нейтрофилы. Последние выделяют биологически активные вещества, изменяющие микроциркуляцию и нарушающие баланс систем свертывания и противосвертывания. Вначале это реакция местная и соответствует инкубационному периоду. Но с достижением определенного количественного уровня ЛПС переводит инфекционный процесс в иное качество — начинаются клинические проявления чумы[10].
Бурное и интенсивное накопление ЛПС и соответственно продуктов дегрануляции нейтрофилов приводит к развитию синдрома внутрисосудистого свертывания крови (ДВС-синдром) и инфекционно-токсического шока, т. е. процесса, вызванного лавинообразной экспрессией провоспалительных цитокинов, основным из которых является TNF-a. Шок проявляется тахикардией, заторможенностью, гипотонией, реже рвотой. С нарастанием тяжести течения чумы появляются такие симптомы, как бред, снижение температуры тела, петехии, понос, глухость тонов сердца, олигу- рия. У некоторых больных развиваются одышка, судороги, акроцианоз, боли в животе, явления отека легких.
Клиническая картина чумы у людей при естественном инфицировании Y. pestis[11].
В клинике чумы выделяют общие явления, характерные для всех форм болезни, и частные, на основании доминирования которых у отдельных больных, создаются клинические классификации чумы.
Инкубационный период Y. pestis составляет 1—6 сут. В большинстве случаев болезнь начинается остро, с сильного озноба и быстрого повышения температуры тела до 39—40°С. Уже на первый день болезни характерны озноб, чувство жара, миалгии, мучительная головная боль, головокружение. Характерен внешний вид больного: лицо и конъюнктивы гиперемированы, губы сухие, язык отечный, сухой, дрожащий, обложен густым белым налетом (как бы натерт мелом), увеличен. Речь больного смазанная, неразборчивая, он заторможен или, наоборот, возбужден, бредит, стремится убежать, у него нарушена координация движения (иногда такие больные производят впечатление пьяных), на лице появляется выражение страха и ужаса («facies pestica»). На лбу выступают крупные капли пота («роса чумы»).
За счет поражения ССС, границы сердца расширены, тоны сердца глухие, прогрессивно нарастает тахикардия (до 120—160 ударов/мин), появляются цианоз, аритмия пульса, значительно снижается АД. На ЭКГ чаще всего бывает синусовая тахикардия, иногда с изменением интервала S— Т(уменьшение зубца Т). У некоторых больных обращают на себя внимание преждевременные сокращения предсердий, а также высокий зубец Р и отклонение оси вправо. Эти изменения ЭКГ трактуются как указание на corpulmonale, хотя изменений в легких еще может не быть (Домарадский И. В., 1998).
При тяжелом течении чумы отмечается кровавая или цвета кофейной гущи рвота, жидкий стул со слизью и кровью. В моче находят примеси крови и белок, развивается олигурия. Печень и селезенка увеличены. В крови нейтрофильный лейкоцитоз со сдвигом формулы влево, СОЭ повышена. Количество эритроцитов и гемоглобина изменяется незначительно.
Смерть больного чумой наступает при прогрессирующей циркуляторной недостаточности, часто с отеком легких.
В соответствии с классификацией Г. П. Руднева (1970) различают следующие клинические формы чумы:
Преимущественно локальные формы: кожная, бубонная, кожно-бубонная.
Внутренне диссеминированные, или генерализованные, формы: первично-септическая, вторично-септическая.
Внешне диссеминированные (центральные, чаще с обильной внешней диссеми- нацией): первично-легочная, вторично-легочная, кишечная. Кишечная форма как самостоятельная большинством авторов не признается.
Описаны стертые, легкие, субклинические формы чумы.
Бубонная чума. Важнейшим признаком бубонной формы чумы является бубон — резко болезненное увеличение лимфатических узлов. Бубон появляется на первый день болезни. Уже в первые часы развития бубона в месте его образования больной чувствует сильную боль, которая затрудняет движение соответствующего органа. Больной вынужден принимать неестественные позы. В первые дни на месте развивающегося бубона можно прощупать отдельные лимфатические узлы, в дальнейшем они спаиваются с окружающей клетчаткой. Маленькие бубоны обычно более болезненны, чем большие. Бубоны, появившиеся в начале болезни, называются первичными бубонами первого порядка. Они обусловливаются внедрением чумного микроба в лимфатический узел по лимфатическим путям извне через кожу (обычно при укусе зараженных блох). Первичные бубоны первого порядка в большинстве случаев единичные, в редких случаях их бывает несколько; многочисленные бубоны развиваются при одновременном внедрении чумного микроба в разных частях тела.
На месте внедрения инфекции при бубонной форме чумы обычно не наблюдается никаких поражений, и только в редких случаях на коже отмечаются ссадины или маленькие покраснения, напоминающие укусы блох. Не наблюдается также воспаления лимфатических сосудов (лимфангоитов), по которым чумной микроб проникает в регионарный лимфатический узел (лимфангоиты встречаются только в тех случаях, когда вместе с возбудителем чумы заносятся и другие микробы, но такие случаи встречаются очень редко).
Помимо первичных бубонов первого порядка, различают еще первичные бубоны второго порядка; последние развиваются в результате внедрения в железу чумного микроба по лимфатическим путям из первичного бубона первого порядка. Эти бубоны появляются в разное время: почти одновременно с первичными бубонами первого порядка, в разгар болезни и даже в конце ее. Чаще они появляются в первую неделю болезни. Вторичные бубоны, обусловливаемые заносом чумного микроба по кровеносным путям, появляются вдали от места внедрения инфекции обычно в конце болезни. При септической и легочной форме чумы они могут появиться в первые дни болезни.
Частота первичного поражения тех или иных лимфатических узлов зависит главным образом от площади, с которой собирается лимфа в лимфатический узел. Вместе с тем играют роль и другие факторы: профессия больного, бытовые условия, возраст. Чаще всего наблюдаются паховые и бедренные бубоны (55—68 %), затем подмышечные (16—22 %), шейные (5—6 %); множественные бубоны не часты (5—13 %). Подколенные и локтевые бубоны встречаются очень редко. Шейные бубоны чаще всего отмечаются у детей (рис. 3.38).
В начале образования бубона кожа над ним не изменина. По мере увеличения бубона кожа натягивается и краснеет. Над большим бубоном она болезненна, натянута и блестяща, цианотична, иногда имеет багрово-синюю окраску. При осмотре бубона на месте нахождения пораженного узла в большинстве случаев наблюдается выпуклость. Иногда же, ввиду глубокого расположения пораженного узла, этой выпуклости не удается отметить не только в первые, но и в последние дни болезни.
При прощупывании бубона в первый день болезни обнаруживается лишь небольшое, очень болезненное уплотнение. В зависимости от развития болезни, часто уже к концу первого дня ее, бубон хорошо заметен: при наружном осмотре он имеет вид опухоли. Кожа над ним гиперемирована и цианотична, в особенности в центральной части. Окружающая клетчатка отечна. Бубон при прощупывании оказывается очень плотным, имеющим консистенцию хряща. С течением времени плотность его может уменьшиться, и на участке нагноения прощупывается размягчение, а затем определяется флюктуация. Ввиду вовлечения в процесс окружающей узел ткани (периаденит), контуры бубона очень неясны, что еще более усугубляется за счет отечности окружающей клетчатки. По окончании стадии формирования бубона наступает фаза его разрешения, протекающая в одной из трех форм: рассасывание, вскрытие и склерозирование.
Рис. 3.38. Бубоны у больных чумой. А. Правый шейный бубон. По В. П. Кашкадамову (1902). Б. Больной чумой с бедренными бубонами. В. Скульптурное изображение святого Рока — защитника европейцев от чумы (XV в.). По U. A. Wu Lien-Ten et al. (1936)
Величина бубонов различна: от горошины до размеров гусиного яйца и даже больше. Она зависит главным образом от степени развития периаденита: чем больше процесс распространяется на окружающую клетчатку, тем больше бубон; чем более выражен периаденит, тем сильнее бубон спаян с окружающими тканями и кожей и менее подвижен.
Развитие бубона происходит по-разному: в некоторых случаях он увеличивается очень быстро и в 2—4 ч достигает величины куриного яйца, чаще же это происходит медленнее. Наибольшей величины бубон достигает к 8—10 сут болезни, реже — к 4—5 сут.
В случае нагнаивания бубона к чумному микробу присоединяется вторичная инфекция (стафилококк, стрептококк). В нагноившемся бубоне кожа над очагом нагноения истончается и некротизируется, иногда на большом участке. Бубон прорывается, и из него вытекает гнойная масса с примесью крови. Заживление образовавшейся полости (нередко довольно большой и глубокой) идет очень медленно, сплошь и рядом отмечается то улучшение, то ухудшение процесса заживления. Как правило, нагноение начинается с первичных бубонов первого порядка. Вторичные бубоны нагнаиваются очень редко. На месте заживления образуются рубцы (рис. 3.39).
Рис. 3.39. Характерные изъязвления кожи больных бубонной чумой. По В. П. Кашкадамову (1902)
Рассасывание бубона идет медленно; только в редких случаях наблюдается быстрое рассасывание, что расценивалось в начале XX в. как неблагоприятный прогностический признак. Иногда рассасывающиеся бубоны увеличиваются в размерах, причем это может наблюдаться неоднократно. Иногда в период увеличения рассасывающегося бубона температура повышается до 37,3—37,5 °С; может также усиливаться болезненность бубона и гиперемия кожных покровов. Иногда же увеличение рассасывающегося бубона не сопровождается этими явлениями. Рассасывание бубона нередко происходит довольно хорошо, и уже через 2—3 недели обратного развития бубона на месте его остается еле прощупываемое уплотнение. Иногда даже при хорошем самочувствии больного и нормальной температуре бубон сохраняет значительные размеры (до куриного яйца) в продолжение долгого времени. Объясняется это склеротическими изменениями в лимфатическом узле.
В зависимости от клинического течения бубонной чумы, многие авторы различают три степени ее:
1) тяжелую;
2) среднюю;
3) легкую.
В легких случаях заболевания температура повышается незначительно; иногда болезнь протекает даже при субнормальной температуре (амбулаторная форма).
Обычно же температура сразу повышается до 38—39 °С. Наблюдаются суточные колебания температуры в 1—2°С и более, при этом повышение ее бывает в вечерние, а понижение — в утренние часы (ремиттирующий тип лихорадки). В связи с ухудшением болезни, наблюдается несоответствие частоты пульса с температурой, что считается неблагоприятным прогностическим признаком.
В легких случаях течения болезни учащение пульса выражено слабее, и то только в начале заболевания. В случаях средней тяжести пульс равен 90—110/мин при температуре 38—39 °С.
Пульс является тонким показателем состояния ССС больного. Помимо учащения пульса, отмечается также его слабое наполнение, часто аритмия, иногда пульс бывает дикротичным. В последние часы жизни больного он становится нитевидным, мало ощутимым.
Со стороны органов дыхания при бубонной чуме наблюдается увеличение числа дыханий. Перед наступлением смерти в легких — застойные явления (влажные хрипы, притупления).
Со стороны нервной системы отмечается сильная головная боль, особенно выраженная в начальный период болезни. Этот симптом занимает первое место в жалобах больного. Наблюдается также головокружение, довольно часто — рвота (мозгового происхождения). Нередко больные жалуются на бессонницу. В тяжелых случаях наблюдается помрачение сознания и бред, иногда подергивания и судороги.
На коже изредка появляется геморрагическая сыпь (грудь, живот, спина, реже конечности) темно-красного, темно-бурого, иногда даже черного цвета («черная смерть») величиной от просяного зерна до двадцатикопеечной монеты. Иногда у больных отмечается желтушность кожи, которая появляется в конце острого периода болезни и держится несколько дней.
Бубонная форма чумы в некоторых случаях осложняется вторичной чумной пневмонией, иногда чумным менингитом; при генерализации процесса — вторичной септицемией. Продолжительность болезни — от нескольких дней до месяца и более. Летальность без лечения — от 30 до 90 %. При рано начатом антибактериальном и патогенетическом лечении смертельный исход наступает редко.
Ниже, по работе И. В. Страховича и В. И. Госа (1907), приводится история болезни и протокол вскрытия крестьянина Григория Тетерятникова, умершего от бубонной чумы 17.12.1901 г. через 7 сут после начала болезни. Случай интересен еще тем, что у Григория имел место патологический процесс в легких, однако клинически он не проявлялся, кашля и кровохаркания у него не было.
Григорий Тетерятников, 62 года. Заболел 10 декабря в доме Луки, куда он перешел после смерти Александры Тетерятниковой.
В первый день болезни; характерных явлений не замечается. Рвота, озноб, головная боль, температура 38,9 °С, пульс 86. Язык бледно-розового цвета совершенно чистый. Аппетит хороший. Самочувствие удовлетворительное. Сразу осунулся. Апатичное выражение лица. Железы в правом паху до лесного ореха. Область селезенки при пальпации несколько болезненна; вечером температура 39,8 °С, пульс 106.
11 декабря. Общее состояние хуже, язык покрыт серым густым налетом. Сильная жажда. Петехий нет. Железы в правом паху резко увеличены, доходя до голубиного яйца и образуя весьма болезненный продолговатый пакет, но кожа на нем не изменена. Моча выделяется свободно. Температура 39,5 °С, пульс 102, вечером температура 39,0°С, пульс 112. Сонливое состояние весь день.
12 декабря явления те же. Больной на ногах. Утром температура 39,0 °С, пульс 112; вечером температура 39,2 °С, пульс 96.
13 декабря самочувствие хорошее, аппетит тоже, жалуется на болезненность в области бубона.
14 декабря температура 39,5 °С, пульс 94. Самочувствие удовлетворительное. Язык обложен густым серым налетом, вечером температура 39,0 °С, пульс 100.
15 декабря утром температура 39,5 °С, пульс 108. Язык чище. Самочувствие хуже. Отсутствие аппетита. Упадок сил увеличивается, пульс 122.
16 декабря температура 39,2 °С, пульс частый. Аппетит лучше. Инфильтрат на верхней трети правого бедра величиною в две ладони, красного цвета, крайне болезнен. На животе и бедрах многочисленные мелкие петехии. Конъюнктивы немного иктеричны, но не инъецированы. Полное сознание, аппетит хороший. Язык растрескавшийся, но чистый. Пульс еле ощутим и не сосчитывается.
17 декабря умер в 8 ч утра в полном сознании. Перед смертью вышел из избы, вернулся, напился чаю, потребовал варенья и умер. Вскрытие произведено 19 декабря, через 52 ч после смерти. Труп сохранялся при температуре ниже О °С.
Протокол вскрытия.
Труп ниже среднего роста, правильного телосложения, плохого питания. Кожа бледно-серого цвета. В правом паху находится напряженная припухлость, подымающаяся выше пупартовой связки и вниз спускающаяся до границы верхней и нижней трети бедра. На разрезе оказывается, что припухлость состоит из целого пакета увеличенных от боба до крупной сливы величиною лимфатических желез, спаянных отечной геморрагической клетчаткой. Железы сильно гиперемированы. При разрезе пакета желез из ткани вытекает серознокровянистая, слегка мутноватая, жидкость, и края разреза расходятся. Увеличенные железы, спаянные инфилырованною отечною тканью, находятся также и выше в правом забрюшинном пространстве. Положение органов грудной полости правильное. Сердечная сумка содержит небольшое (около 60 см3) количество серозной жидкости. Висцеральный и периэтальный листки сердечной сорочки блестящи, гладки. Экхимозов нет. Длина сердца 10,0 см, ширина — 11,5 см. Полость сердца содержит кровяные сгустки темно-красного и желтого цвета. Клапаны сердца без изменений. Эндокард блестящий, гладкий. Мышца сердца буро-красного цвета с ясным желтым оттенком, дрябла. Внутренняя поверхность аорты без изменений. Правое и левое легкое плотно приращены в нижних своих долях к реберной плевре. Бронхиальные железы увеличены справа, черного цвета. В плевральных полостях по столовой ложке серозной жидкости. Левое легкое гиперемировано, отечно, при разрезе вытекает кровянистая, пенистая жидкость. Никаких фокусов уплотнения не замечается. Правое легкое в верхней и средней доле повторяет картину левого легкого. Вся нижняя доля правого легкого уплотнена, на разрезе серо-желтого, а в верхней части более красного цвета. Кусочки тонут в воде. Положение органов грудной полости правильное. Брюшинный покров блестящий, гладкий.
В полости брюшины жидкости нет. Брыжеечные железы не увеличены. Селезенка имеет в длину 12,5, в ширину 3,5 и толщину 3,0 см. Капсула слегка утолщена, морщиниста. Паренхима дрябла, темно-красного цвета, легко соскабливается. Трабекулы не утолщены. Мальпигиевы тельца не ясно выступают. Поверхность печени ровная, гладкая; в одном месте находится узелок с булавочную головку белого цвета. Общая ширина 27 см, длина правой доли 19 см, левой 17,5 см, толщина правой 6 см, левой 4 см. Паренхима дрябла, тестовата, желто-бурого цвета, малокровна. В паренхиме такой же узелок, как и на поверхности; оба на разрезе хрустят, плотны, по-видимому, содержат известь. Левая почка: длина 12,5, ширина 6,5, толщина 4,0 см. Капсула снимается легко. Корковой слой слегка утолщен 10,8 см. Бертиньевы столбы припухли, пограничная линия сглажена. Пирамида, как и корковый слой, розового цвета с ясным серым оттенком. Правая почка: длина 12,0, ширина 6,0, толщина 4,0 см. Капсула местами снимается с паренхимой, на поверхности небольшая кисточка с серозным содержимым. В остальном походит на левую почку. Желудок растянут, складки сглажены, станки атрофичны. Кишечный канал особых изменений не представляет. Половые органы без изменений. Мочевой пузырь содержит прозрачную мочу, слизистую, бледного цвета, остальные органы вскрыты не были.
Первично-септическая форма. Развивается бурно после короткой инкубации, составляющей от нескольких часов до 1—2 сут. Больной ощущает озноб, резко повышается температура, появляются сильная головная боль, возбуждение, бред. Возможны признаки менингоэнцефалита. Развивается картина инфекционно-токсического шока, быстро наступает кома. Продолжительность заболевания — от нескольких часов до трех суток. Случаи выздоровления крайне редки. Больные погибают при явлениях тяжелейшей интоксикации и выраженного геморрагического синдрома, нарастающей сердечно-сосудистой и почечной недостаточности.
Иногда болезнь заканчивается смертью через несколько часов (молниеносная форма — pestis siderans). В этих редких случаях температура у заболевшего чумой человека почти не повышается. Болезнь протекает так быстро и бурно, что его организм не успевает или оказывается не в состоянии реагировать на инфекцию. Умерших людей часто находят в свободных позах, свидетельствующих об их внезапной смерти (например, с чашкой чая в руке).
Патологоанатомические изменения скудны и малоспецифичны. Наиболее выраженное изменение отмечалось в селезенке: резкое увеличение, иногда с очажками некроза. Наблюдались точечные кровоизлияния в слизистой кишечника и плевры. Диагноз септической чумы устанавливается бактериологическими исследованиями.
По работе D. A. Margolis et al. (2008) привожу описание атипичного случая первично-септической чумы, имевший место в Восточной Калифорнии в 2008 г. В отличие от типичных случаев септической чумы, когда больной в течение 1—3 сут погибает от инфекционно-токсического шока, в данном случае, благодаря интенсивной антибиотикотерапии и патогенетической терапии, жизнь пациентке удалось продлить до 10 сут. Однако исход болезни был предопределен еще на ее начальной стадии.
Пациентке 79 лет, проживала в сельской местности. В местную больницу поступила с температурой 38,2°С, с пульсом 110/мин, АД 121/60 мм рт. ст. и насыщением крови кислородом 80 % в условиях воздуха помещения. Пациентка была возбуждена, ориентировалась только в отношения себя самой. Аускультация легких обнаружила хрипы на левой верхушке (left base), живот мягкий. Лимфоаденопатии не было. Неврологическое исследование показало отсутствие очаговых поражений со стороны ЦНС. Лейкоцитоз (46 тыс. клеток/л, 19 % из них — палочковые формы), ренальная дисфункция, высокий уровень трансаминаз и сывороточного креатина. Признаков поражения лимфатических узлов не было. Рентгенограмма грудной клетки интерпретирована лечащим врачом как свидетельствующая о левом нижнем ателектазе легкого (left lower lung atelectasis). Пациентке поставлен диагноз «пневмония» (community-acquired pneumonia, САР) и назначено лечение антибиотиками (цефтриаксолин, ампициллин/суль- бактам, левофлоксацин).
Через 48 ч после назначения антибиотиков, стала нарастать почечная недостаточность (повышение уровня креатинина в сыворотке крови), появились ацидоз и тромбоцитопения (тромбоциты, 54 тыс. клеток/л). На 3 сут болезни больная была отправлена в академический центр госпиталя для дальнейшего наблюдения. Там ей потребовалась интубация и гемодинамическая поддержка. В этот же день из другого госпиталя поступил отчет о выделенной из ее крови культуры какой-то грамотрицательной палочки. Ее интерпретировали как контаминант. Уровень лактатдегидрогеназы был повышен. Сочетание клинических и лабораторных данных дало основание поставить диагноз — тромботическая тромбоцитопеническая пурпура (thrombotic thrombocytopenic purpura). Начат плазмафорез и плазмаобмен. На груди и верхних конечностях пациентки обнаружены участки некроза кожи с эритемой по краям (рис. 3.40).
Только на седьмые сутки болезни с помощью ПЦР были получены доказательства, что грамотрицательные палочки являются ни чем иным, как возбудителем чумы. Но к этому времени на отдельных пальцах у пациентки уже началась гангрена. Прогрессировала почечная недостаточность. Компьютерная томография брюшной полости показала билатеральный ренальный кортикальный некроз. Пациентка умерла от уремии на 10 сут пребывания в больнице.
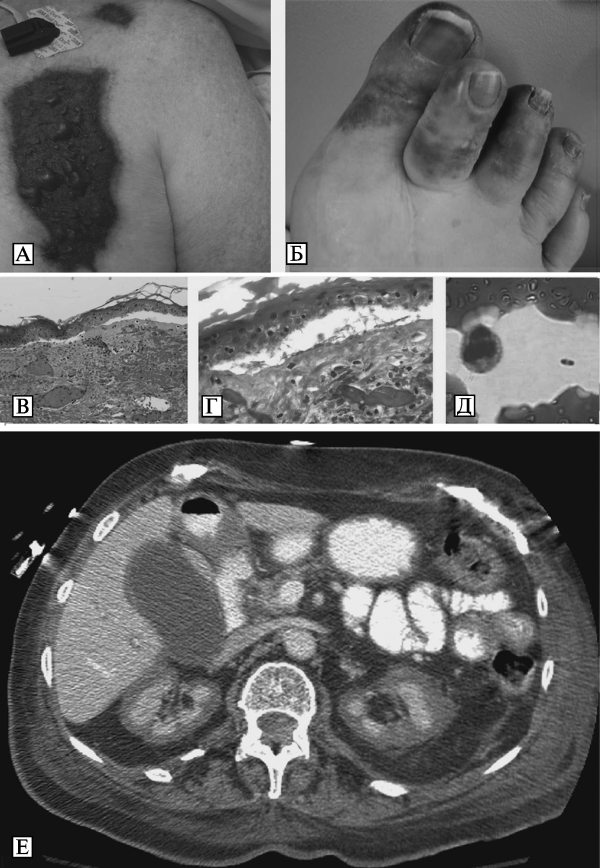
Рис. 3.40. Кожные и внутриорганные повреждения при первично-септической чуме. А. Участок некротической кожи (чумной карбункул) с зоной гиперемии вокруг. Б. Гангрена пальцев. В, Г и Д. Дермальный некроз, острое воспаление и тромбоз небольших сосудов при отсутствии видимых микроорганизмов. Субдермальное расслоение кожи в участке некроза (увеличение в 200 раз). Е. Компьютерная томограмма брюшной полости, показывающая билатеральный ренальный кортикальный некроз. По D. A. Margolis et al. (2008)
После того, как диагноз «чума» был подтвержден ПЦР, на участке, прилегающем к дому умершей от чумы пациентки, проведено эпизоотическое исследование. Отловлены калифорнийские и антилоповые суслики (Spermophilus beecheyi, Ammospermophilus leucurus), с которых сняты блохи, инфицированные Y. pestis (по данным ПЦР). Среди калифорнийских сусликов обнаружены особи с высокими титрами антител к Y. pestis. Антитела к возбудителю чумы обнаружены и у собаки пациентки.
Вторично-септическая форма. Является осложнением других клинических форм чумной инфекции. Характеризуется исключительно тяжелым течением, наличием вторичных очагов, бубонов, выраженных проявлений геморрагического синдрома.
Развитие вторичной септицемии возможно при любой форме чумы. Прижизненная диагностика этой формы затруднена. Безошибочно поставить диагноз можно после обнаружения Y. pestis в тканях и жидкостях организма.
Клиника кожной формы чумы. Несмотря на то, что кожа является наиболее частым местом проникновения возбудителя чумы в организм человека, кожная форма чумы наблюдается редко. Обычно кожа на месте внедрения чумного микроба не дает воспалительной реакции[12].
При развитии кожной формы чумы наблюдаются следующие явления: на коже в месте поражения появляется красное пятно, очень болезненное, диаметром около 1 см, напоминающее след от укуса блохи. Вскоре это пятно приобретает багровую окраску, а через несколько часов приподнимается, вследствие накопления под ним жидкости. Жидкость эта почти сразу становится мутной от примеси гноя и крови, пятно превращается в пустулу. Вокруг пустулы имеется красная воспалительная зона (ранняя фликтена — phlyctaenae praematura). Величина пустулы колеблется от размеров горошины до вишни. Жидкость пустулы содержит значительное количество вирулентной Y. pestis. С течением времени пустула и окружающая ее зона увеличиваются в размерах и превращаются в чумной карбункул, очень болезненный, в особенности при надавливании (рис. 3.41).
На месте вскрывшейся пустулы образуется язва с инфильтрированным плотным дном желтоватого цвета. Язва покрывается темным струпом, который вместе с окружающей его темно-багровой зоной дает картину, весьма напоминающую сибирскую язву — pestis anthraeicus. Таким образом, основываясь лишь на одном наружном виде чумной пустулы, без лабораторного исследования пунктата, можно довольно легко впасть в диагностическую ошибку. Размеры язв при кожной форме чумы бывают различными — от монетки до ладони взрослого человека.
Рис. 3.41. Кожная форма чумы. А. Язва. Б. Пустула. По Г. П. Рудневу (1938)
Первичных пустул и первичных карбункулов может быть несколько, причем они появляются одновременно в различных местах внедрения инфекции, т. е. в местах укуса зараженных блох. Помимо первичных, встречаются вторичные пустулы и карбункулы. Они могут наблюдаться при разных формах чумы и обычно появляются в разгар болезни или в конце ее.
Общие клинические явления при чисто кожной форме чумы такие же, как и при легких или средних по тяжести случаях бубонной чумы. Очень часто кожная форма чумы осложняется воспалительным процессом в регионарном лимфатическом узле. Нередко это осложнение наступает очень быстро, так что у больного, поступившего в госпиталь, наблюдается и первичное поражение на коже, и бубон. Последний беспокоит больше, чем первичное кожное поражение: обычно больной больше жалуется на бубон, чем на кожное поражение, а нередко и совсем не упоминает о нем. Последнее обстоятельство заставляет врача при наличии бубона тщательно искать на коже входные ворота инфекции. Осложненная бубоном кожная форма чумы носит название кожно-бубонной формы.
Кишечная форма чумы. Главным признаком кишечной формы чумы является частый понос (до 40 раз в сутки), нередко с обильной примесью слизи и крови. Дефекация сопровождается болезненными тенезмами. Тошнота, нередко многократная рвота. Все эти симптомы сопровождаются высокой температурой и прочими признаками, свойственными другим формам чумы.
Существование первичной кишечной формы чумы в настоящее время оспаривается рядом авторов. Однако при обнаружении в энзоотических районах или вблизи них таких больных, у которых наблюдаются кишечные явления невыясненного происхождения, необходимо помнить о чуме и провести тщательное клиническое обследование больного, а также бактериологическое исследование испражнений и рвотных масс.
Легочная форма чумы. Чаще всего первичная легочная чума развивается в результате капельной инфекции. Входными воротами при легочной форме чумы могут быть миндалины, слизистая трахеи и бронхов, откуда возбудитель чумы гематогенным путем попадает в перибронхиальные лимфатические узлы.
Первичная чумная пневмония начинается внезапно: у заболевшего появляется озноб, сильная головная боль, температура быстро повышается. Часто наблюдается неоднократная рвота. Затем появляются тахикардия, боли в груди и сильная одышка. Кашель в первые дни может отсутствовать, но иногда он появляется и в самом начале болезни. Кашель сначала редкий и сухой, затем с мокротой. Мокроты обычно бывает очень много, иногда же она совсем отсутствует. В начале болезни мокрота не характерна для чумной пневмонии; затем к ней примешивается кровь, и она становится розовой или красной. Мокрота содержит обычно большое количество чумных бактерий. Иногда она имеет ржавый вид, а изредка наблюдается даже обильное кровохарканье. Эти симптомы дают повод к смешению легочной чумы с крупозной пневмонией и туберкулезом легких. При объективном исследовании легких в начале болезни характерных признаков чумы обнаружить не удается. Позже дыхание учащается до 24—32 и более раз в минуту, а при выслушивании отмечаются разбросанные сухие, иногда влажные хрипы, число которых в процессе болезни увеличивается.
При перкуссии места притупления или разбросаны, или как бы совпадают с границами доли легкого. По мере развития болезни площадь притупления увеличивается, так как процесс захватывает соседние доли.
Данные объективного клинического и рентгенологического исследования легких не дают возможности дифференцировать первичную чумную пневмонию от пневмоний, вызванных другой инфекцией (пневмококк, стрептококки пр.) (рис. 3.42).
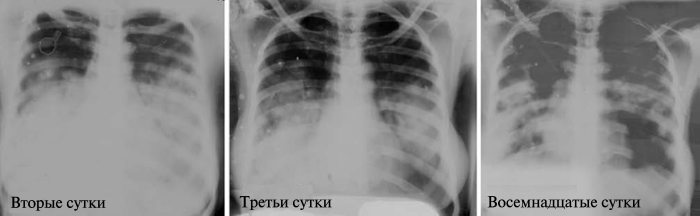
Рис. 3.42. Рентгенологическое исследование грудной клетки больной с первичной легочной чумой. Серия фронтальных рентгеновских снимков, сделанных на 2, 3 и 18 сут болезни. Показывает двустороннюю мультилобулярную пневмонию, сопровождающуюся двухсторонним плевритом (двустороннее затемнение легочной ткани преимущественно в нижних отделах легких с двусторонними плевральными выпотами, без признаков хиларной или медиастинальной лимфаденопатии). Больная получала внутривенно хлорамфеникол и перорально доксициклин. По Е. М. Begier et al. (2004)
Иногда в конце болезни, реже в середине ее, на коже появляется геморрагическая сыпь темно-красного или даже черного цвета. Продолжительность болезни в среднем 2—4 сут, иногда до 6—7 сут и дольше. В прошлом все заболевшие легочной формой чумы погибали. В настоящее время в связи с применением для лечения чумы стрептомицина почти все заболевшие первичной легочной формой чумы выздоравливают.
Первичный пневмонический очаг при легочной чуме при правильном лечении антибиотиками может рассасываться бесследно. Если лечение начато по истечении 12 ч и более от начала температурной реакции, то развитие первичного пневмонического очага происходит более активно. Поражение легких при этом более обширно, иногда процесс успевает распространиться на другое легкое. Тем не менее и в этом случае больного еще можно спасти.
Температурная кривая у больных с легочной чумой не имеет четкой картины трех волн, как это наблюдается при раннем начале лечения. Температура во время ремиссий вообще может не достигать нормы. Начиная с 5—10 сут, она изобилует многочисленными подъемами на фоне общего суточного снижения температуры. Специфический процесс иногда затягивается на месяц и более. В процессе выздоровления часто наблюдаются абсцессы в легких и бронхоэктазии. Своевременное применение антибиотиков и в этих случаях ведет к благополучному исходу указанных осложнений.
Клиническая картина первичной легочной чумы у людей, леченных стрептомицином, имеет свои особенности, которые затрудняют диагностику болезни. Если же принять во внимание, что уже через несколько часов после начала лечения количество микробов в мокроте резко падает и выделить их затруднительно, то в некоторых случаях бывает очень трудно поставить правильный диагноз болезни, в особенности у контактировавших и подвергшихся лечению (с целью профилактики) до проявления болезненных симптомов. Определить появление новых очагов в корневых лимфатических узлах и образование абсцессов и бронхоэктазов тоже затруднительно. Все это устанавливается главным образом на основании рентгенологического исследования и клинических симптомов.
Чума у вакцинированных больных. Характеризуется удлинением инкубационного периода до 10 сут и замедлением развития инфекционного процесса. В течение 1—2 сут заболевания лихорадка субфебрильная, общая интоксикация выражена нерезко, состояние больных удовлетворительное. Бубон небольших размеров, без выраженных проявлений периаденита. Однако симптом резкой болезненности бубона всегда сохраняется. Если эти больные в течение 3—4 сут не получают лечение антибиотиками, то дальнейшее развитие болезни ничем не будет отличаться от клинических симптомов у невакцинированных больных.
Патоморфологические признаки легочной чумы при инфицировании в эпидемических цепочках. По данным вскрытий 70 человек, умерших от чумы в Харбине в 1910— 1911 гг., Г. С. Кулеша (1912) нашел, что визуально на слизистых зева, дыхательного горла и бронхов удается обнаружить лишь катаральные поражения. Только в одном случае в дыхательном горле наблюдались фибринозные пленки, содержащие огромное количество Y. pestis. Однако при микроскопическом исследовании он обнаружил в тканях миндалин массовые скопления чумных палочек, особенно под самым эпителием. Поражения эпителия в таких местах иногда напоминали кожные пустулы, причем в многослойном эпителии образовывались ровной величины полости, содержащие белые кровяные тельца и чумные палочки, а подлежащая ткань миндалины густо инфильтрировалась чумными палочками и круглыми клетками. Кулеша находил массовые скопления чумных бактерий и в лимфоидной ткани миндалины в глубине органа, а также в просветах кровеносных сосудов, где нередко наблюдалось образование тромбов, содержащих чумные палочки. В некоторых случаях ему удавалось заметить, что миндалины также служат местом проникновения осложняющей течение чумы посторонней микрофлоры: ему встречались участки тканей, наполненные чумными палочками и цепочками стрептококков.
Слизистая оболочка дыхательного горла и бронхов также оказывалась значительно измененной. Эпителий и подслизистая ткань были «пропитаны» чумными палочками, которые в цилиндрических клетках эпителия образовывали яйцевидные скопления, а в подслизистых поверхностях отлагались в больших количествах и простирались вглубь, почти до самых хрящей, окружая кровеносные сосуды и прорастая в их стенки. Эти скопления чумных палочек располагались также вокруг глубоко лежащих лимфатических желез. Им сопутствовали кровоизлияния и мелкоклеточная инфильтрация в пораженной ткани, причем воспалительная инфильтрация редко была выражена особенно резко. Поражения дыхательного горла и бронхов не имели разлитого распространения, встречались очагами и в отдельных случаях были выражены различно, иногда их не было вообще. Поражения бронхиальных лимфатических узлов носили характер первичных бубонов, но разрастание Y. pestis в них не всегда простиралось за пределы сумки пораженного лимфатического узла, периаденитов практически не было. В некоторых случаях разрастания чумных палочек в ткани лимфатических узлов приобретали своеобразный вид, и при рассмотрении в бинокулярную лупу они напоминали по рисунку кожные лишаи.
В легких Кулеша всегда наблюдал долевую (лобулярную) форму воспаления, которая, по его мнению, свойственна эпидемической легочной чуме. Пораженными оказывались то одна, то несколько долей легких. Одна доля была поражена 35 раз, несколько долей — 29 раз, без поражения легких было 4 случая. Верхняя правая доля была поражена 30 раз, верхняя левая доля — 22 раза, нижняя правая — 18 раз, нижняя левая — 20 раз, средняя доля — 10 раз. Таким образом, верхние доли были поражены 52 раза, а нижние — 38 раз (на 70 исследованных случаев). Пораженной всегда оказывалась плевра, на которой обычно наблюдался нежный фибринозный налет. В 2-х случаях поражение легких сопровождалось сывороточно-фибринозным выпотом в соответствующую область плевры. Пораженные доли легких обычно были менее объемисты, чем при фибринозной пневмонии, и на разрезе не обнаруживали свойственные последней зернистости. Разрез был более или менее гладкий, что зависело от отсутствия фибрина в выпоте альвеол. Так называемое опеченение в большинстве случаев было отчетливым, и вырезанные кусочки тканей тонули в воде. По давности опеченения, в нем можно было увидеть серую и красную стадии. В светлых воспаленных участках, соответствующих красному опеченению, выпот в альвеолах состоял из сывороточной, не содержащей нитей фибрина, жидкости, в которой в огромных количествах лежали Y. pestis и эритроциты. Другие же клеточные элементы (клетки эпителия альвеол и лейкоциты) встречались обычно в ограниченном количестве. Иногда скопления Y. pestis достигали огромных количеств, включенные в эти массы клетки тесно не смешивались с ними, а располагались в особых просветах, как бы в сумках; фагоцитоза не наблюдалось.
В стадии серого опеченения состав выпота изменялся. В полость альвеолы происходила энергичная инфильтрация белых кровяных телец (лейкоцитов), причем количество Y. pestis в альвеолах резко уменьшалось, они постепенно исчезали, и альвеолы, в конце концов, оказывались заполненными почти одними лейкоцитами. В этой стадии воспаления, по-видимому, его обычным исходом было токсическое омертвение ткани, что наблюдалось под микроскопом почти в каждом исследованном случае. Омертвение сопровождалось часто обширными кровоизлияниями. Кулеша обратил внимание на то, что Y. pestis не равномерно распределялись в легочной ткани и что по большей части они скапливались в ближайшей окружности кровеносных сосудов, и последние (чаще всего вены) на препаратах, окрашенные синькой, представлялись окруженными мощными синими кольцами. Подобные же скопления Y. pestis замечались в перибронхиальной ткани и вокруг перибронхиальных кровеносных сосудов. Такие же скопления наблюдались под плеврой: как «синие реки», стекались лимфатические полосы, заполненные Y. pestis. Их в больших количествах находили и в других кровеносных и лимфатических сосудах.
Кулеша в 1912 г. не пришел к окончательному выводу, считать ли найденные им изменения слизистых поверхностей первичными или вторичными, посчитав, что окончательно характер этих явлений поможет установить только эксперимент. Однако он предположил, что для первичной легочной чумы в эпидемических очагах характерны следующие патологоанатомические явления:
1) чумные палочки могут в нескольких случаях проникать в организм уже из полости рта, вызывая специфическое поражение миндалин, или со слизистой оболочки трахеи и бронхов путем массового прорастания их сквозь неповрежденный эпителий. Легкие поражаются в таких случаях вторично через кровь либо вследствие развития нисходящего бронхита;
2) при своем эпидемическом распространении легочная чума вызывает преимущественно долевую пневмонию, правильнее плевропневмонию ввиду постоянного участия плевры. Эта чумная пневмония представляет большое сходство с фибринозной, отличаясь от нее главным образом отсутствием фибрина в выпоте.
В 1913 г., во время чумной вспышки в Уральской области, Кулеша (1924) произвел вскрытия 7 человек, умерших от легочной чумы, из которых четверо было взрослых и трое детей в возрасте от 3 до 10 лет, и получил те же результаты, что и 3 года назад в Харбине.
На слизистых оболочках при легочной чуме невооруженным глазом никаких изменений выявлено не было, кроме явлений острого катара на слизистых оболочках гортани, трахеи и бронхов, зева, полости носа и конъюнктив. Тщательная микроскопия слизистых оболочек носа и конъюнктив не дали положительных результатов в смысле нахождения свойственных только чуме поражений. В миндалинах, в слизистой трахеи и крупных бронхов при изучении их под микроскопом Кулеше вновь удалось обнаружить изменения, аналогичные тем, которые описаны им во время Маньчжурской чумы.
В эпителиальном покрове трахеи и крупных бронхов входными воротами для чумной инфекций служили главным образом бокаловидные клетки, в которых появлялись овальные или яйцевидные тела, состоящие из множества чумных палочек.
Кроме того, им замечались непрерывные тяжи Y. pestis, расположенные между эпителиальными клетками. В дальнейшем эпителиальный покров омертвевал и отслаивался, а на его месте оставался только базальный слой, по большей части также в состоянии некроза. В то же время в под слизистой ткани возникало колоссальное скопление Y. pestis, образующих сплошную подстилку эпителия и совершенно замещающих собой подлежащую ткань. Хорошо видимыми оставались только кровеносные сосуды с их кровью, включенные в эти сплошные бациллярные массы.
Из семи исследованных случаев, в одном случае найдено было только поражение миндалин и в четырех случаях поражение миндалин, трахеи и крупных бронхов.
Кулеша отметил две отличительные черты, свойственные описываемым поражениям. Первая состоит в том, что в большинстве случаев огромные отложения чумных бацилл в тканях не сопровождаются резкой реакцией со стороны последних, где видны, бывают только слабовыраженная круглоклеточная инфильтрация, незначительные кровоизлияния и более или менее явственный некроз. Вторая сказывается тем, что почти во всех мелких кровеносных сосудах, располагающихся в очагах скопления Y. pestis, замечается их обильное проникновение в эти сосуды (капилляры и мелкие вены) из окружности. Примесь Y. pestis к крови наблюдается главным образом только в сосудах, проходящих через бациллярные очаги, тогда как в подобных же сосудах, лежащих вне названных очагов, обнаружить присутствие бацилл среди элементов крови удается во много раз реже и труднее.
Последняя находка послужила ему фактическим подтверждением предположения о гематогенном происхождении чумной пневмонии, которая не только может возникать как воздушно-капельная инфекция, но появляется и в таких случаях, где об ингаляции не может быть и речи. К случаям воздушно-капельного происхождения легочной чумы Г. С. Кулеша относил лабораторную чуму, поражающую научных работников во время экспериментов с Y. pestis, а также заболевания, проявляющиеся:
1) в начале эпидемии, как ее исходные случаи, например, у охотников за тарбаганами, у лиц, соприкасающихся с мясом зараженных чумой верблюдов;
2) возникающие уже в период разгара эпидемии (например, случай, описанный Р. А. Будбергом, см. выше рис. 3.35).
К случаям же воздушно-капельного заражения человека Г. С. Кулеша отнес те, когда возбудитель чумы, находясь в воздухе в виде капельной инфекции, оседает при вдохе не в самой легочной ткани, а на слизистых оболочках рта, глотки, трахеи и крупных бронхов. Такого рода оседание Y. pestis неизбежно ведет к легочной чуме, но не прямо, а через посредство первичного поражения миндалин, слизистой трахеи и бронхов, причем чумная инфекция транспортируется в легкие уже не через воздух, а при помощи крови, т. е. гематогенно. Понятно, что заболевания такого происхождения возможны лишь при наличии больных легочной чумой, заражающих своим кашлем окружающий их воздух и обусловливающих нахождение в нем капельной инфекции. Мнение, что поражение чумой миндалин ведет не к легочной чуме, а обязательно к появлению чумных бубонов на шее, Кулеша считал неправильным, так как во всех случаях, где он установил путем микроскопического исследования наличие описанных выше чумных поражений миндалин, чумные бубоны на шее отсутствовали.
Моделирование искусственного заражения Y. pestis. Ситуация искусственного заражения Y. pestis многократно моделировалась в результате несчастных случаев, произошедших при работе с возбудителем чумы и в опытах на животных.
Подкожное инфицирование. Возможно в случае умышленного заражения инъекционным путем. По данным М. Finegoldetal. (1968), в участке введения возбудителя чумы у экспериментального животного наблюдался некроз подкожной клетчатки. Клиника болезни при подкожном инфицировании возбудителем чумы мало отличается от клиники бубонной чумы. Разница в том, что если при бубонной чуме чаще всего основным признаком болезни будет бубон в паховой области (блохи обычно пьют кровь у человека в области нижних конечностей), то при подкожном инфицировании он развивается в группе лимфатических узлов, ближайшей к участку инфицирования.
Энтеральное инфицирование. Возможно, при намеренном подмешивании в пищу возбудителя чумы. Клиника чумы при таком пути проникновения Y. pestis в организм человека напоминает нисходящую бронхопневмонию, описанную Г. С. Кулешей. В качестве примера рассмотрим случай, имевший место в феврале 1907 г. в Кронштадте на форту «Александр I» (Берестнев Н. М., 1907).
12 февраля 1907 г. доктор М. Ф. Шрейбер собирал эмульсии Y. pestis с агаровых разводок и, случайно набрав много эмульсии чумных бацилл в пипетку, замочил вату; при этом какое-то количество клеток Y. pestis попало ему в рот. Шрейбер промыл ротовую полость сулемой, но никому о происшедшем не рассказал и сыворотки себе не ввел.
14 февраля вечером Шрейбер почувствовал общее недомогание, озноб, ломоту в ногах, небольшой насморк, отсутствие аппетита, в 9 ч вечера температура была 39,4 °С. Ночью появилось колотье в правом боку и небольшой кашель без мокроты. На утро температура была 39,1°С, общее самочувствие удовлетворительное, колотье в боку больной относил к мышечным болям. В 11 ч утра он в присутствии заведующего чумной лабораторией на форте, Н. М. Берестнева, легко выделил в стерилизованную чашку Петри плевок слизисто-гнойной кровавой мокроты. При перкуссии грудной клетки справа сзади в области лопатки было отмечено небольшое притупление, при выслушивании — легкое ослабление дыхания и единичные сухие хрипы. После исследования мокроты, в которой оказалось громадное количество овальных микробов с полюсной окраской, не красившихся по Граму, в чумном характере заболевания не было сомнения. Ему было введено 80 мл3 сыворотки. Температура вечером 39,8 °С, пульс 140/мин; дыхание утром и днем 28/мин; вечером 34/мин. Кашель днем усилился, обильная кровянисто-гнойная мокрота отделялась довольно легко. К вечеру, в связи с высокой температурой, одышкой и слабостью сердца, общее состояние и самочувствие ухудшились. Объективные явления со стороны легких за день без особых перемен; притупление в области лопатки и спереди в области грудной мышцы более выражено. К вечеру справа спереди появились влажные средне- и мелкопузырчатые хрипы.
16 февраля днем сильный кашель, обильная мокрота с меньшим содержанием крови в первую половину дня. Больной очень ослабел, пульс 120—130/мин; появились клокочущие хрипы, мокрота стала жиже и пенистой, количество мокроты значительно увеличилось; кофеин и камфора под кожу, но явления слабости сердца и отек легких тем не менее усилились. При выслушивании в правом легком в верхней доле больше влажных хрипов, появились хрипы в нижней доле левого легкого. Дыхание в верхней доле правого легкого с бронхиальным оттенком, притупление звука небольшое. Сознание полное.
Ночь на 17 февраля Шрейбер провел без сна, был возбужден, ослабел настолько, что был не в состоянии отплевывать мокроту в ведро с сулемой. Появилась синюха на концах пальцев. Днем температура снова поднялась до 39,9°С, кашель и одышка усилились, масса жидкой кровянистой мокроты. Днем больной не отпускал своих коллег от себя, много говорил и был в полном сознании; в 11,5 часов ночи наступила смерть при явлениях отека легких и паралича сердца.
Чумная инфекция у Шрейбера сопровождалась поражением почек, мочи за сутки было около 500—300 см3 с большим количеством белка. Белок появился в моче 15 февраля, причем количество его с каждым днем увеличивалось. Жидкие, довольно обильные испражнения, были 16-го утром и 17-го днем.
На вскрытии найдено следующее: оба легких плотно сращены с ребрами и диафрагмой, плевра на обоих легких фиброзно утолщена особенно на местах отпечатков ребер. Явлений старого фиброзного плеврита не заметно лишь на передних краях легких, которые были резко эмфизематозны. На плевре переднего края верхней доли правого легкого несколько точечных кровоизлияний и по местам нежные фибринозные отложения.
Правое легкое: верхняя его доля, за исключением переднего края, занята сплошным пневмоническим фокусом красно-серого цвета. Поверхность разреза имеет мраморный вид, серый цвет чередуется с красным, в некоторых дольках особенно резко выражены кровоизлияния. Кровоизлияния в легком в его периферических частях по местам заметны через утолщенную плевру. Передняя часть верхней правой доли отечна, гиперемирована, пронизана кровоизлияниями, в ней находится несколько бронхо-пневмонических фокусов красновато-серого цвета величиною от горошины до лесного ореха.
С поверхности разреза верхней доли соскабливается много довольно жидкого слизистого красновато-серого сока. Средняя и нижняя доля этого легкого сильно отечны и гиперемированы.
Левое легкое отечно, в его нижней доле, пронизанной кровоизлияниями, несколько мелких бронхопневмонических фокусов, таких же, какие найдены в передней части верхней доли правого легкого. В крупных бронхах, особенно в правом легком, кровянистая слизисто-гнойная пенистая мокрота. Бронхиальные железы с крупный лесной орех величиной пронизаны кровоизлияниями.
Сердце увеличено раза в полтора, перикардий без изменений, в его полости столовая ложка прозрачной серозной жидкости. Мускулатура сердца буро-красного цвета с сальным блеском, в папиллярных мышцах тонкие продольные полосы желтого цвета жирно-перерожденных волокон. Клапаны аорты слегка склерозированы, в дуге аорты рассеяны мелкие склеротические бляшки.
Печень увеличена раза в полтора, довольно плотная, резко застойная, желтоватого цвета. Правая доля печени в виде купола сильно вдается в грудную полость, на ее поверхности замечается некротический участок неправильной четырехугольной формы.
Селезенка буро-красного цвета, увеличена раза в два, довольно плотная, пульпа соскабливается в небольшом количестве.
Почки увеличены в размере, беловато-желтого цвета. Корковый слой утолщен, мелкие вены переполнены кровью. Капсула снимается легко; в лоханках кровоизлияний нет. Мочевой пузырь содержит небольшое количество мочи, на поверхности слизистой оболочки пузыря несколько точечных кровоизлияний. Предстательная железа без изменений.
Обе миндалины сине-красного цвета, несколько увеличены. Лимфатические железы под челюстью и на шее увеличены очень незначительно. В желудке небольшое количество жидкого содержимого и кровянистой мокроты. Слизистая оболочка его слегка набухла. В тонких кишках немного жидкого содержимого желтоватого цвета. Брыжеечные железы в норме.
Полость черепа: черепная крышка толще раза в 1,5 нормальной. Тонкие мозговые оболочки фиброзно утолщены, особенно по ходу сосудов, под ними значительное количество прозрачной отечной жидкости. Сосуды основания мозга без изменений. В боковых желудках около 2 столовых ложек прозрачной, серозной жидкости в каждом. Мозг застоен, отечен.
На срезах, окрашенных полихромной синькой и водным эозином, было найдено следующее: в легких — правое легкое, верхняя доля {главный первичный пневмонический фокус): типичная картина чумной пневмонии. Многие альвеолы почти сплошь выполнены массами чумного микроба, таких альвеол особенно много было под плеврой, в других преобладал клеточный экссудат; и в них находились чумные палочки, разбросанные между клетками экссудата; по местам альвеолы были выполнены кровью; в некоторых альвеолах наблюдались одновременно кучки чумных микробов, клеточный экссудат и кровоизлияния. Сосуды в альвеолярных стенках резко гиперемированы; некоторые альвеолы были разорваны излившейся кровью. На срезах, окрашенных по Граму и по Weigerte'y с дополнительной окраской пикрокармином, не было констатировано ни микробов, красящихся по Граму, ни нитей фибрина. Такая же микроскопическая картина, в общем, наблюдалась и в небольших бронхопневмонических фокусах нижней доли левого легкого. Бронхиальные железы резко гиперемированы, пронизаны кровоизлияниями и содержали массы микробов, которые в виде причудливых сплошных тяжей пронизывали железу во всех направлениях, особенно много микробов было в корковом слое желез. Миндалевидные железы сильно гиперемированы, но не имели вида первичного чумного бубона, в фолликулярном аппарате их находились лишь кое-где отдельные короткие бациллы, не окрашивающиеся по Граму, зато в складках слизистой оболочки встречались лимфатические сосуды, сплошь набитые палочковидными микробами, не окрашивавшимися по Граму, по всей вероятности, чумными. На основании этой микроскопической картины можно заключить, что миндалины не представляли первичного места внедрения чумного бацилла и что они лишь реагировали на заразное начало, выделяемое из легких с мокротою.
В печени на срезах возбудитель чумы не удалось обнаружить. Печеночные клетки были жирно перерождены. Вены печени были переполнены кровью. В почках найдена картина резко выраженного паренхиматозного нефрита, нигде в сосудах (в клубочках) микроорганизмов не было найдено. В сердечной мышце на срезах видно перерождение мышечных волоконец и отложение бурого пигмента. В папилярных мышцах полному жировому перерождению были подвергнуты тяжи волоконец, что резко бросалось в глаза при наружном осмотре сердца.
Вскрытие подтвердило прижизненную диагностику первичной чумной пневмонии, осложненной паренхиматозным нефритом и паренхиматозным и жировым перерождением печени и сердца.
Инфицирование мелкодисперсным аэрозолем. Возможно в случае применения террористами специальных рецептуру возбудителя чумы. Поражения мелкодисперсными аэрозолями смоделированы в опытах на животных. Приоритет в таких исследованиях принадлежит русскому ученому В. И. Госу (см. разд. 1.5). Впоследствии его данные, полученные на мышах, были многократно воспроизведены западными исследователями с использованием других животных, включая приматов. Ниже я приведу их в сравнении с более поздними и детализирующими данными М. J. Finegola (1968), полученными на макаках-резус (Масаса mulatta).
По данным В. И. Госа, воспалительные изменения в альвеолах и бронхах на начальной стадии развития инфекции у мышей (до 12 ч) были незначительны. Реакция со стороны бронхов выражалась в основном в усилении секреции слизистой оболочки и некотором перибронхиальном скоплении лейкоцитов. Альвеолярная ткань только кое-где давала более или менее отчетливую картину воспаления (присутствие в альвеолах более значительного числа клеток, состоящих из спущенного эпителия и белых кровяных телец).
М. J. Finegola обнаружил, что на этой стадии инфекции у макак каких-либо клинических признаков инфекции не наблюдалось. Животные казались внешне здоровыми. В легких обезьян при макро- и микроскопическом исследовании не выявлено патологических изменений. У части животных отмечали повышение температуры до 40,0—40,5 °С между 60 и 72 ч и незначительное тахипноэ (60—70 дыханий/мин). В других отношениях они были клинически здоровы без каких-либо признаков апатии или потери аппетита. Но при аутопсии соотношение веса легкого и веса тела одного из животных, превышало среднюю нормальную величину, что свидетельствовало о начавшемся отеке альвеол. В срезах тканей периферических бронхов, бронхиол, альвеол, венул, вен и лимфатических сосудов ни микроорганизмов, ни структурных изменений в этот период обнаружено не было даже с использованием электронно-микроскопического исследования.
В дальнейших стадиях воспаления (24, 48 и 72 ч после инфицирования животного)
В. И. Гос обнаружил, что воспалительные явления нарастали не одинаково. Расширение кровеносных сосудов достигало значительной степени. Благодаря расширенным капиллярам, границы альвеол резко выступали (особенно при дополнительной окраске эозином). Через 24 ч был заметен очаговый характер воспаления. В экссудате альвеол кое-где наблюдалась значительная примесь красных кровяных телец. В отдельных участках легочной ткани образовывались мельчайшие геморрагии. Скопления лейкоцитов вокруг сосудов продолжали увеличиваться, тогда как лимфатические узелки паренхимы легкого оставались в том же виде, как через 12 ч после заражения. В бронхах же воспалительные явления прогрессировали очень незначительно (24 ч). Тяжесть течения болезни не соответствовала тяжести поражения легких.
У каждой из 4 обезьян, забитых через 72 и 96 ч, М. J. Finegola так же отмечал пневмонию, причем у одной из, них, забитой через 72 ч, наиболее обширная пневмония представляла собой сливные очаги серого опеченения правой нижней доли с центральным разжиженным некрозом этого участка; лежащая над ним плевра была тусклой и непрозрачной с геморрагическими очагами. В левой верхней доле легкого этой обезьяны обнаружили участок с повышенной плотностью и избыточным содержанием жидкости. Аналогичные очаги, сходные с ранними признаками долевой пневмонии, отмечали еще у 3 животных.
По данным В. И. Госа, с наибольшей интенсивностью при поражении аэрозолем чумы процесс воспаления шел в альвеолах. Группы альвеол образовывали воспалительные узелки, которые постепенно распространялись на все большие участки легкого, сливаясь между собой и давая пеструю картину воспаления (48 ч). Рядом с группой альвеол, теряющей уже альвеолярную структуру, попадались альвеолы с начальными явлениями воспаления. В местах их наибольшего воспаления особенно ясно выступала разница в степени воспаления альвеолярной ткани и бронхов: среди резко измененных альвеол, переполненных экссудатом, выступали просветы бронхов и бронхиол с едва измененным эпителием и незначительным количеством экссудата (48 ч).
Через 72 ч явления воспаления становились еще резче. Очаги воспаления увеличивались, попадались узелки, распространяющиеся на протяжении 10—20 альвеол в диаметре, причем форма их разнообразная, то округлая, то продолговатая или неправильно угловатая. Но встречались и явления, не наблюдаемые ранее. Экссудат, заключенный в альвеолах, кое-где принимал диффузную бледную окраску гематоксилином, содержал мало форменных элементов крови. Местами тянулись полосы неправильной формы таких диффузно-окрашенных масс, т. е. наблюдалось явление нарастающего отека. Во многих местах легкого были заметны капиллярные геморрагии, в экссудате альвеол примеси крови. Соединительная ткань, окружающая бронхи и сосуды, не принимала активного участия в процессе воспаления. Ее клетки всюду сохраняли свой вид. Среди воспалительных фокусов встречались бронхи до альвеолярных ходов включительно, в которых воспалительные явления ничтожны и которые совершенно не содержали экссудата.
М. J. Finegola, также как и В. И. Гос, обнаружил обширные альвеолярные отеки, содержащие огромное количество микробных клеток и вариабельной лейкоцитарной инфильтрациеи перегородок и альвеол (рис. 3.43, А и Б).
В некоторых участках альвеолярных перегородок капилляры содержали очень незначительное количество полиморфноядерных нейтрофилов, но на других участках, отдельные альвеолы были заполнены этими клетками. Первоначально в стенках альвеол никаких изменений не было обнаружено, но после исследования электронных микрофотографий появилась возможность с помощью световой микроскопии установить наличие подэпителиальных пузырьков на участках отека (рис. 3.43, В).
Подэпителиальные пузырьки представляли собой круглые возвышения стенки альвеол диаметром 7—12 мкм, содержащие эозинофильную жидкость. Их природу можно было установить только с помощью электронного микроскопа. Периваскулярные и перибронхиальные лимфатические сосуды вблизи ранних поражений оказались растянутыми в результате заполнения жидкостью. Кроме подэпителиальных пузырьков альвеол характерными признаками, прогрессирующей чумной долевой пневмонии, вызванной мелкодисперсным аэрозолем Y. pestis, на гистологии являются: альвеолярные уплотнения (по В. И. Госу, «воспалительные узелки»), вызванные миграцией полиморфноядерных нейтрофилов и небольшого количества одноядерных клеток; обширная инфильтрация перегородок и междольчатой, перибронхиальной и периваскулярной соединительной ткани этими же клетками; значительный рост чумных палочек в альвеолах и лимфатических сосудах; очаги воспаления и некроза эпителия бронхиол. В центрах сливных участков пневмонии отмечали значительные геморрагии и очаговый некроз альвеолярных перегородок (рис. 3.43, Г).
Срезы участков альвеолярного отека, обнаруженного при световой, микроскопии, выявили обилие чумных палочек внутри альвеол, однако непосредственно в тканях ни одного чумного микроорганизма отмечено не было. При микроскопии выявлялось много участков без каких-либо морфологических изменений, несмотря на наличие микроорганизмов (рис. 3.44, А).
По мере развития пневмонии интерстициальный отек становился более обширным и распространялся от околостволовой зоны на тонкие участки альвеолярных перегородок.
Рис. 3.43. Патоморфологические изменения в легком обезьяны, пораженной мелкодисперсным аэрозолем возбудителя чумы, различаемые с помощью оптического микроскопа. А. Легочный отек. Адвентиция вены, перивискулярные лимфатические сосуды и многие альвеолы растянуты эозинофильной жидкостью. Заметна лейкоцитарная инфильтрация и очаговое кровоизлияние (эритроциты). Окраска гематоксилин-эозином. Увеличение в 68 раз. Б. Ранняя лобулярная пневмония. Альвеолы и альвеолярные ходы заполнены эозинофильной жидкостью, содержащей большое количество Y. pestis, Лейкоциты обнаружены в умеренных количествах в перегородках и альвеолах. Перегородки интактны. Окраска гематоксилин-эозином. Увеличение в 210 раз. В. Эпителиальные пузырьки. Два заполненных жидкостью пузырька выступают внутрь альвеол из перегородки. Интерстициальная локализация жидкости заметна при электронной микроскопии. Окраска гематоксилин-эозином. Увеличение в 500 раз. Г. Некротизирующая пневмония. Структура альвеол стерта. Имеет место огромное количество нейтрофилов, в периваскулярных лимфатических сосудах заметны скопления Y. pestis. Окраска гематоксилин-эозином. Увеличение в 210 раз. По М. J. Finegola (1968)
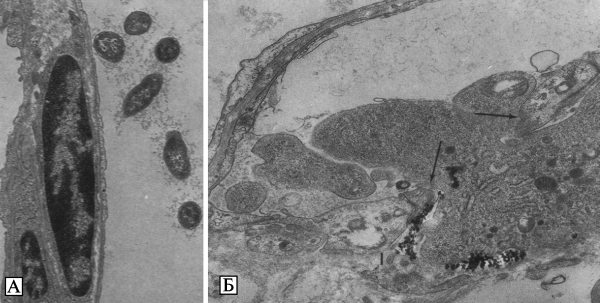
Рис. 3.44. Патоморфологические изменения в легком обезьяны, пораженной мелкодисперсным аэрозолем возбудителя чумы, различаемые с помощью электронного микроскопа. А. Несколько Y. pestis находится внутри альвеолы около перегородки, которая выглядит интактной. Увеличение в 9000 раз. Б. Миграция лейкоцитов. Пространство (стрелки) в капилляре альвеолярной перегородки занято моноцитом, часть которого остается в просвете капилляра, тогда как другая его часть находится в интерстициальном пространстве. Частицы угля, введенные внутривенно, сопровождают лейкоциты вследствие повреждения эндотелия. Увеличение в 16100 раз. По М. J. Finegola (1968)
В эндотелии капилляров обнаружили незначительные очаговые цитоплазматические изменения на участках отека. Прогрессирующее поражение эндотелия наблюдали на участках некроза, где были вовлечены все элементы ткани. Эти изменения представляли собой набухание клеток, помутнение материала цитоплазмы, образование вакуолей митохондрий и деструкцию клеточных оболочек.
С помощью светового и электронного микроскопов на некоторых участках отмечали экстравазацию эритроцитов (выход из сосудов в ткани). Миграцию лейкоцитов можно было проследить от капилляров и более часто от венул в промежуточное пространство и отсюда в альвеолы (см. рис. 3.44, Б).
Бронхиальные лимфатические узлы были увеличены, с участками жидкого некроза (liquefactive necrosis) и геморрагиями. Повреждения печени минимальны. На поверхности почек были заметны геморрагические фокусы, на срезах обнаружен тромбоз гломерулярных сосудов. Так же были тромбированы отдельные афферентные артериолы и интертубулярные и медуллярные капилляры. При выраженном тромбозе наблюдался кортикальный некроз.
Картина воспаления альвеолярной ткани, вызванная инфицированием мелкодисперсным аэрозолем возбудителя чумы, установленная В. И. Госом и М. J. Finegola, отличается от той, которую описывают в природных очагах чумы при вспышках первично-легочной чумы и относится к «невозможной клинической форме болезни» (см. разд. 2.3.1). При типичных чумных бронхопневмониях, характерных для воздушнокапельной передачи чумных бацилл, воспалительный процесс в бронхах и в альвеолярной ткани выражен одинаково сильно, причем часто воспалительный процесс с бронхов переходил на окружающие альвеолы. При чумной пневмонии, развивающейся вследствие проникновения возбудителя непосредственно в альвеолы, на первое место выступает воспалительный процесс в альвеолах, развивается пневмония. Изменения же бронхов незначительны. Характер пневмонии десквамативный, причем интерстициальная ткань не принимает активного участия в процессе.
Обобщая результаты своих экспериментов, Гос сделал вывод, что чумная пневмония (под таковой он понимал пневмонию, полученную в результате инфицирования мелкодисперсным аэрозолем возбудителя), имеет характер катаральной узелковой пневмонии в чистом виде, т. е. без значительного поражения бронхов и без образования фибрина. Характер экссудата — десквамативный с примесью лейкоцитов и эритроцитов. Последние появляются в альвеолах из расширенных ad maximum капилляров. Этим объясняется кровавый характер мокроты при чумной пневмонии. Быстроту развития процесса он объяснил отсутствием интерстициальных явлений.
Поражение только легочной ткани при инфицировании человека мелкодисперсным аэрозолем возбудителя чумы, показанное В. И. Госом и некоторыми другими исследователями, нельзя понимать буквально как единственный возможный исход такого нападения. В экспериментах, выполненных на Масаса fascicularis, R. Van Andel et al. (2008) показали дозозависимый эффект ингаляционных поражений возбудителем чумы при среднем размере частиц аэрозоля 2—5 мкм. ED50 (т. е. доза, при которой у экспериментального животного обнаруживается лихорадка и другие клинические признаки) для М. fascicularis составила около 66 колониеобразующих единиц (КОЕ). Если ингалирование экспериментальным животным 479 КОЕ возбудителя чумы (7 ED50) вызывало у них мультифокальную двустороннюю гнойную пневмонию и сред- невыраженную спленомегалию, то при дозе 759 КОЕ (11 ED50) в инфекционный процесс вовлекались трахобронхиальные лимфатические узлы, а при дозе 3050 КОЕ у обезьян развивались фибринозные плевральные отеки. Это важное наблюдение R. Van Andel et al. (2008), показывающее зависимость патологоанатомической структуры первичных поражений мелкодисперстным аэрозолем возбудителя чумы от ингалированной дозы, при массовых жертвах биотеррористического нападения позволяет определять относительную близость людей к источнику аэрозоля и направление движения аэрозоля.
Теперь сопоставим патологоанатомическую картину чумы, наблюдаемой при естественном инфицировании в очагах (воздушно-капельная инфекция) и искусственно созданным мелкодисперсным аэрозолем (табл. 3.13).
Таблица 3.13
Сопоставление патологоанатомической картины легочной чумы при естественном и искусственном инфицировании*
|
Поражение |
Естественное заражение в очагах чумы |
Искусственно созданным аэрозолем |
|
Общий характер поражения |
Вторичное (гематогенное) развитие нисходящего бронхита, клиническая картина соответствует тяжести поражения легких |
Первичное поражение легких, клиническая картина не соответствует тяжести поражения легких |
|
Слизистая верхних дыхательных путей |
Катаральные изменения, эпителий и подслизистая ткань «пропитаны» чумными палочкам |
Не вовлечена |
|
Лимфоидная ткань миндалин |
Густая инфильтрация возбудителем чумы, воспалена |
Не вовлечена |
|
Характер пневмонии |
Долевая форма пневмонии с преимущественным поражением верхних долей |
В основном катаральная узелковая пневмония. Преимущественно поражаются нижние доли легкого. При гистологическом исследовании в альвеолах могут быть обнаружены подэпителиальные пузырьки и др. изменения, характерные для поражения мелкодисперсным аэрозолем (см. выше) |
|
Плевра |
Обычно поражена (фибринозный налет) |
Вовлекается только при очень больших дозах заражения |
|
Перибронхиальная ткань |
Скопления чумных палочек, особенно вокруг перибронхиальных кровеносных сосудов; перибронхиальные узлы могут быть значительно увеличены, спаяны в пакет, отечны, геморрагичны, окружают трахею, на разрезе мозговидной консистенции. Отдельные лимфатические узлы величиной в сливу, розового цвета, с кровоизлияниями |
Воспалительные процессы мало выражены. Их выраженность зависит от доз заражения |
* Составлена по работам В. Госа (1907), Г. С. Кулеши (1912, 1924), М. J. Finegola (1968) и R. Van Andel et al. (2008).
Диагностика искусственного поражения возбудителем чумы. Принципы диагностики искусственного поражения возбудителем чумы те же, что описаны в подразделе 3.1 для поражения возбудителем сибирской язвы. В их основе лежит выявление неправильной эпидемиологии и невозможной клиники болезни. Но есть и некоторые особенности, характерные для чумы. Естественной вспышке чумы среди людей (в бубонной, септической и легочной формах), даже ограничившейся единичными случаями болезни, должны предшествовать чумные эпизоотии среди грызунов. Должна прослеживаться и эпидемическая цепочка от местностей, где чумные эпизоотии замечены, к людям, инфицированным возбудителем чумы. Появление больных чумой грызунов и инфицированных Y. pestis блох на территории, длительное время «свободной от чумы», может свидетельствовать об активизации древнего и забытого очага чумы. Поэтому, прежде чем делать предположение о возможности ее искусственного происхождения, необходимо по историческим источникам убедиться в том, что вспышки чумы на данной территории имели место в прошлом. Крупным естественным вспышкам легочной чумы предшествуют локальные вспышки бубонной и легочной чумы на территориях активизировавшихся природных очагов чумы. «Движение» легочной чумы в таких случаях прослеживается по больным легочной чумой, выявленным на транспортных коммуникациях. Обычно крупные естественные вспышки легочной чумы не имеют единого центра развития и представляют собой растянутый во времени процесс распространения бронхолегочной чумы. Крупные эпидемии бубонной и легочной чумы имеют длительный период (до нескольких десятилетий) небольших вспышек-предшественников, свидетельствующих о постепенном «разогреве» природного очага чумы.
Подозрения об искусственном характере вспышки бубонной чумы обоснованы при обнаружении в общественных местах блох, инфицированных Y. pestis, связь которых с больными чумой грызунами установить не удается. Такие вспышки ограничиваются единичными заболевшими.
В природных очагах чумы вторично-легочная чума развивается на фоне вспышек бубонной чумы. Первично-легочная чума, возникшая у человека в результате воздушно-капельной инфекции, в основном развивается как нисходящая бронхопневмония. В инфекционный процесс вовлекаются слизистая верхних дыхательных путей, лимфоидная ткань миндалин, плевра, перибронхиальные лимфатические узлы. На рентгенограммах выявляются затемнения долей легких и признаки экссудативного плеврита. В отличие от нее, случаи первично-легочной чумы, развившиеся в результате непосредственного экспонирования человека к мелкодисперсному аэрозолю возбудителя чумы, преимущественно будут представлены «невозможными клиническими формами болезни» (см. разд. 2.3.1) — очаговыми поражениями в нижних долях легких (очаговые затемнения легочной ткани на рентгенограмме) без вовлечения в инфекционной процесс слизистой верхних дыхательных путей, лимфоиднай ткани миндалин, листков плевры, перибронхиальных лимфатических узлов. Тяжесть таких поражений у отдельного человека (при прочих равных условиях) будет зависеть от ингалированной им дозы возбудителя чумы, вирулентности штамма и дисперсности аэрозоля. Вторичные случаи первично-легочной чумы в очаге поражения мелкодисперсным аэрозолем, т. е. возникшие в результате воздушно-капельной передачи возбудителя болезни от людей, заболевших легочной чумой в результате экспонирования к аэрозолю, будут протекать как типичная чумная бронхопневмония.
Наличие двух типов течения первично-легочной чумы (как очаговой пневмонии и как бронхопневмонии) позволит выявить лиц, ставших непосредственными жертвами биологического нападения, и лиц, заразившихся чумой воздушно-капельным путем уже от них.
Иммунопрофилактика. Для специфической профилактики чумы в России применяется вакцина чумная живая лиофилизат и вакцина чумная живая таблетированная. Вакцина чумная живая лиофилизат выпускается двумя предприятиями: ФГУЗ Став-НИПЧИ Роспотребнадзора и ФГУ «48 ЦНИИ Минобороны России». Таблетированную вакцину выпускает ФГУ «48 ЦНИИ Минобороны России». Вакцинация лиофилизованной вакциной осуществляется накожным, подкожным и ингаляционным способами. Ревакцинация обеими вакцинами осуществляют через год. При неблагоприятной эпидемиологической обстановке — через 6 мес. Дозы живой вакцины при иммунизации взрослых пациентов составляют ЗООхЮ6 живых микроорганизмов в 0,5 см3 и Зх 109 живых микроорганизмов в 0,15 см3 для подкожного и накожного способов применения соответственно. При ингаляционной иммунизации доза должна составлять (5±3) х 106 живых микроорганизмов штамма EV. Последний способ считается патогенетически более корректным для предупреждения первично-легочной чумы. Российские вакцины защищают от ингаляционного заражения возбудителем чумы. Американская инактивированная чумная вакцина USP не эффективна в отношении воздушно-капельного и ингаляционного заражения Y. pestis. В США выпуск этой вакцины был прекращен в 1998 г. По мнению многих специалистов, эра убитых вакцин заканчивается (Бывалов А. А., 2011).
Лечение. Лечение чумы антимикробными средствами было начато в 1938 г. с сульфонамида (сульфамид), а в августе 1947 г. русскими врачами Н. И. Николаевым, Д. А. Федориновым и В. И. Гороховым для лечения легочной чумы впервые использован стрептомицин. Применение стрептомицина привело к резкому снижению летальности у людей. На сегодняшний день показатель летальности при чуме в мировом масштабе снизился до 8 %. Тремя основными антимикробными препаратами, рекомендованными для лечения чумы, являются стрептомицин, тетрациклин и хлорамфеникол (левомицетин). Предпочтительным по-прежнему остается стрептомицин, тогда как хлорамфеникол чаще всего применяется для лечения менингита. Из- за ограниченного запаса стрептомицина в некоторых странах в качестве заменителя используется гентамицин, и имеются данные, подтверждающие, что гентамицин или его комбинация с тетрациклином могут служить эффективными средствами лечения чумы у людей. Фторхинолоны рассматриваются в качестве альтернативного средства для лечения чумы на основании результатов исследований in vitro и экспериментов на мышах, в которых их эффективность оказалась аналогичной таковой аминогликози- дов. Однако за исключением одного единственного случая чумы, которая была успешно вылечена при помощи ципрофлоксацина, нет сведений об эффективности этого препарата. Назначение одного, двух или трех препаратов зависит от тяжести симптомов. Шансы больного на выздоровление непосредственно связаны со своевременностью антибиотикотерапии, особенно при более тяжелых формах чумы, легочной и септицемической.
Экстренная неспецифическая профилактика предусматривает применение сульфонамида, триметоприм-сульфаметоксазола или тетрациклина. Назначается лицам, тесно контактирующим с больными легочной чумой, или родственникам больных бубонной чумой, живущим с ними вместе или по соседству.
В случае биологического нападения с использованием аэрозолированного возбудителя чумы рабочая группа по противобиологической защите гражданского населения США рекомендовала при лечении пострадавших в специально отведенном для этого месте (т. е. при небольших количествах больных, нуждающихся в лечении) в первую очередь применять стрептомицин или гентамицин, а уже в качестве альтернативных средств — доксициклин, ципрофлоксацин или хлорамфеникол. При массовом поражении рекомендовано пероральное применение доксициклина, тетрациклина или ципрофлоксацина. Предотвратить передачу инфекции от человека к человеку больными легочной чумой можно при помощи стандартных мер изоляции, по крайней мере, в течение четырех дней после начала антибиотикотерапии.
Хотя цефалоспорины иногда относили к числу неэффективных лечебных средств против чумы у людей, но без документального подтверждения. Кроме того, в исследованиях в условиях in vitro и в экспериментах на мышах эффективность этого антимикробного препарата оказалась аналогичной таковой фторхинолонов и аминогликозидов.
[1] Территориальные границы очагов чумы, расположенных на территории бывшего СССР, приведены ниже.
[4] Ответ на вопрос, кто «главный или энзоотический хозяин, ответственный за поддержание Y. pestis в природных очагах», и кто, соответственно, «неглавный или эпизоотический хозяин», до сих пор не получил ответа, удовлетворяющего всех чумологов. А. P. Anisimov et al. (2004), чей работой я здесь пользуюсь, придерживается взглядов на процесс поддержания чумы как на непрерывную эпизоотию среди «энзоотических хозяев». Другие ученые, например, И. В. Домарадский (1998), обращают внимание на то, что десятилетиями в отдельных очагах чумы могут не выявляться отдельные эпизоотии, но потом они внезапно становятся массовыми. Это говорит в пользу существования совершенно иных очагов чумы, чем поддерживающиеся среди грызунов (их границы см. в табл. 3.9). Поэтому при расследовании преступления, вызывавшего вспышку чумы, необходимо понимать, что приглашенные эксперты чумологи могут принадлежать к антагонистическим школам.
[5]В разд. 1.8 приведен пример вспышки чумы в китайском городе Чанде без чумной эпизоотии среди крыс. Вспышка была вызвана распространением японцами зараженных чумой блох.
[6] В начале 1880-х гг.
[7] На рис. 3.32 показана динамика заболеваний всеми формами чумы в ст. Ветлянская (максимум 8 декабря). Пик гибели людей смещен на несколько дней (максимум 14 декабря).
[8] Попытки японских военных ученых повысить вирулентность возбудителя чумы описаны в разд. 1.8.
[9] См. в разд. 2.2.2 «Механизмы развития резистентности к антибактериальным препаратам у бактерий».
[10] Подробно о роли ЛПС возбудителя чумы в патогенезе болезни см. в диссертационной работе Р. 3. Шахутдиновой (2008).
[11] В работе (Супотницкий М. В., Супотницкая Н. С., 2006) приведены десятки описаний клиники и патанатомии различных форм чумы, сделанных авторами, непосредственно участвовавшими в ликвидации эпидемий чумы. В данном разделе приводятся обобщенные описания, взяв за основу работы Е. П. Шуваловой с соавт. (2001) и В. М. Туманского (1958).
[12] Возможны отдельные вспышки чумы с преобладанием кожной формы болезни. Примером может служить чума 1920 г. в Батуми, где кожная форма составила до 80 % всех случаев болезни (Руднев Г. П., 1938).