Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений: монография. 3.9. Вирусные геморрагические лихорадки
Микробиология возбудителей геморрагических лихор адок. Экология и естественная эпидемиология возбудителей геморрагических лихорадок. Восприимчивость людей и животных к возбудителям геморрагических лихорадок. Иммунитет к возбудителям вирусных геморрагических лихорадок. Устойчивость возбудителей вирусных геморрагических лихорадок во внешней среде. Антивирусные препараты. Обнаружение генетически измененных штаммов возбудителей геморрагических лихорадок. Патогенез геморрагических лихорадок. Клиническая и патологоанатомическая картина вирусных геморрагических лихорадок у человека при естественном инфицировании. Клиническая картина и патоморфология вирусных геморрагических лихорадок у животных при искусственном инфицировании. Клиническая картина вирусных геморрагических лихорадок у людей при искусственном инфицировании. Диагностика искусственного поражения возбудителями геморрагических лихорадок. Иммунопрофилактика вирусных геморрагических лихорадок. Лечение вирусных геморрагических лихорадок.
Библиографическое описание. Супотницкий МВ. Вирусные геморрагические лихорадки. В кн.: Супотницкий МВ. Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений. М.: "Кафедра", "Русская панорама"; 2013. С. 887–927.
Вирусные геморрагические лихорадки (viral haemorrhagic fever, VHF, ВГЛ) — группа мало отличающихся друг от друга по клинике зоантропонозных острых инфекционных болезней, вызываемых оболочечными РНК-вирусами семейств: аренавирусы (вирус Ласса, вирус Хунин, вирус Мачупо, вирус Гуанарито, вирус Сэбия); буньявирусы (вирус геморрагической лихорадки с почечным синдромом, вирус Конго-Крымской лихорадки, вирус лихорадки долины Рифт); филовирусы (вирус Марбург, вирус Эбола); флавивирусы (вирус болезни леса Киассанур, вирус омской геморрагической лихорадки, вирус желтой лихорадки, вирус лихорадки Денге). Первичный резервуар этих вирусов не известен. Передача вирусов в природных очагах из вторичных резервуаров среди млекопитающих к людям происходит либо артроподами-переносчиками (вирусы Конго-Крымской лихорадки, желтой лихорадки, лихорадки Денге, лихорадки долины Рифт, омской геморрагической лихорадки, болезни леса Киассанур), либо в результате непосредственного контакта с больными или погибшими животными (вирусы Ласса, Эбола, Марбург). Вирусы Ласса, Эбола и Марбург могут передаваться между людьми воздушно-капельным путем. На территории России имеются природные очаги вирусов, вызывающих геморрагическую лихорадку с почечным синдромом (Башкортостан, Удмуртия, Марий-Эл, Мордовия, Чувашия, Ульяновская и Пензенская области), Конго-Крымскую лихорадку (Краснодарский и Ставропольский края, Астраханская, Волгоградская и Ростовская области, республики Дагестан, Калмыкия и Карачаево-Черкесия), омскую геморрагическую лихорадку (степные и лесостепные районы Омской, Новосибирской, Тюменской, Курганской и Оренбургской областей). Инкубационный период болезни у человека после заражения вирусами геморрагических лихорадок составляет от 2—21 сут. Основными клиническими проявлениями ВГЛ являются лихорадка, астения, тошнота, рвота, диарея, макулопапулезная сыпь, геморрагический диатез и шок.
Общий анализ крови в большинстве случаев выявляет вначале лейкопению, затем тромбоцитопению. Большинство больных умирают в состоянии ступора с проявлениями интоксикационного шока. Главной причиной гибели при ВГЛ является развитие синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдром, коагулопатия, тромбогеморрагический синдром), отека легких и головного мозга. ДВС-синдром был описан при лихорадках долины Рифт, Марбург и Эбола, но при большинстве ВГЛ этиология коагулопатии является многофакторной (например, поражение печени и первичное повреждение костного мозга с нарушением процесса мегакариоцитопоэза). Вакцин, позволяющих эффективно осуществлять специфическую профилактику в природных очагах ВГЛ, нет. Исключение составляет инактивированная вакцина против желтой лихорадки. Специфическое лечение ВГЛ не отработано (Kortepeter М. et al., 2001; Borio Г. et al., 2002; Борисевич И. В. с соавт., 2006).
Количество видов и даже семейств вирусов, вызывающих геморрагические лихорадки, неустановленно. Они могут проявлять себя локальными смертельными вспышками, и лишь случайно распознаваться, как, например, Lujo virus (семейство Arena-viridae). В Йоханнесбурге этот вирус в сентябре и октябре 2008 г. вызвал пять случаев геморрагической лихорадки, четыре из которых закончились смертью заболевших (Paweska J. et al., 2009). Краткая характеристика наиболее изученных вирусов, возбудителей геморрагических лихорадок, приведена в табл. 3.33.
Таблица 3.33. Вирусы, вызывающие геморрагические лихорадки*
|
Семейство |
Род |
Вид |
Вызываемая болезнь |
Переносчик в природе |
Географическое распределение очагов болезни |
|
Filoviridae |
Filovirus |
Ebola субтипы: Zaire, Sudan, Cote d'Ivoire (Ivory Coast), Bundi-bugyo, Lloviu и Reston |
Лихорадка Эбола. Субтипы Lloviu и Reston для человека не опасны |
He известен |
Африка (в основном Судан, Заир, Кот-д'Ивуар, Уганда). Север Испании и Филиппины — субтипы Lloviu и Reston соответственно |
|
Marburg |
Лихорадка Марбург |
He известен |
Африка (в основном Ангола, Уганда, Судан, Кения, ЮАР) |
||
|
Arenaviridae |
Arenavirus |
Lassa |
Лихорадка Ласса** |
Грызуны |
Западная и Центральная Африка |
|
New World Arenaviridae** |
Геморрагические лихорадки Нового Света*** |
Грызуны |
Американский континент |
||
|
Bunyaviridae |
Nairovirus |
Crimean-Congo hemorrhagic fever |
Конго-Крымская геморрагическая лихорадка |
Клещи |
Африка, Центральная Азия, Восточная Гвропа, Средний Восток |
|
Phlebovirus |
Rift Valley fever |
Лихорадка долины Рифт |
Комары |
Африка, Саудовская Аравия, Йемен |
|
|
Hantavirus |
Agents of hemorrhagic fever with renal syndrome |
Известно более 25 серологически и генетически отличающихся друг от друга хантавирусов и две клинические формы хантавирусной инфекции у людей: геморрагическая лихорадка с почечным синдромом (ГЛПС), возбудителем которой являются вирусы Hantaan, Seul, Puumala, и Dobrava/ Belgrade; и хантавирусный пульмональный синдром, вызываемый хантавиру-сами Sin-Nombre, Black Creek, New York, Bayou, Andes, Laguna Negra |
Основным носителем вируса Хантаан служит полевая мышь. Основным вторичным резервуаром вируса Пуумала является рыжая полевка |
Вирус Хантаан циркулирует в природных очагах Дальнего Востока, России, Южной Кореи, КНДР, Китая, Японии. Вирус Пуумала обнаружен в Финляндии, Швеции, в России, Франции, Бельгии. Вариант Dobrava/Belgrade — циркулирует на Балканах |
|
|
Flaviviridae |
Flavivirus |
Dengue |
Лихорадка Денге, Денге геморрагическая лихорадка, шоковый синдром при лихорадке Денге |
Комары |
Южная и Юго-Восточная Азия, Африка, Океания, Карибский бассейн |
|
Yellow fever |
Желтая лихорадка |
Существует в двух эпидемических формах: лихорадки джунглей (передается комарами от зараженных обезьян) и лихорадки населенных пунктов (передается комаром Aedes aegypti от больного человека здоровому) |
Африка, тропические зоны американского континента |
||
|
Omsk hemorrhagic fever |
Омская геморрагическая лихорадка |
Резервуаром инфекции в природе являются в основном водяная крыса, рыжая полевка, ондатра, а также клещи D. pictus, D. marginatus, которые могут передавать вирус потомству трансовариально |
Природные очаги выявлены в степных и лесостепных районах Омской, Курганской, Новосибирской, Тюменской, Оренбургской областей РФ |
||
|
Kyasanur Forest disease |
Болезнь Киясанурского леса |
Клещи вида Haemaphysalis spinigera |
Северная часть Индии |
* За основу взята работа L. Borio et al. (2002).
** Относится к вирусам геморрагических лихорадок Старого Света (Old World complex). В эту же группу входят вирус лимфоцитарного хориоменингита (Lymphocytic choriomeningitis, LCMV), вирусы Мопея (Mopeia virus, MOPV), Мобала (Mobala virus, MOBV), Иппи (Ippy virus, IPPV), Луджо (Lujo virus, LUJV).
*** Группа New World Arenaviridae (Аренавирусы Нового Света) включает вирус Machupo (Мачупо), вызывающий Боливийскую геморрагическую лихорадку; вирус Junin (Хунин), вызывающий Аргентинскую геморрагическую лихорадку; вирус Guanarito (Гуанарито), вызывающий Венесуэльскую геморрагическую лихорадку; вирус Sabia (Сэбия), вызывающий Бразильскую геморрагическую лихорадку и др.
Российские санитарно-эпидемиологические правила СП 1.3.2322-08 относят филовирусы (вирус Марбург, вирус Эбола) и аренавирусы (вирус Ласса, вирус Хунин, вирус Мачупо, вирус Гуанарито, вирус Сэбия) к I группе патогенности. По степени важности для национальной безопасности США к группе А относятся филовирусы, включая вирусы геморрагических лихорадок Эбола и Марбург, и аренавирусы, включая вирусы лихорадок Ласса, Аргентинской геморрагической лихорадки и связанные с ними вирусы (см. табл. 2.2).
Как потенциальные агенты БО возбудители геморрагических лихорадок стали упоминаться в научной литературе после вспышки болезни, вызванной вирусом Эбола в Южном Судане и Заире в 1976 г. В течение нескольких недель вирус вызвал вспышки геморрагической лихорадки на территории 3 тыс. км. кв., погубив жизни 435 человек. Летальность среди заболевших составила 71 %, что, естественно, произвело впечатление на военных специалистов (см. Гайслер Э. с соавт., 1986). Но об исследованиях возбудителей ВГЛ как потенциальных агентов БО, включающих масштабные эксперименты в полигонных условиях, не известно. С 1972 г. действует Конвенция о запрещении биологического оружия, поэтому если такие исследования и проводились в США, то они не афишировались.
Секта «Аум-Синрикё» на пике западной дезинформационной кампании о доступности странам Третьего мира «дешевого оружия массового поражения» предприняла попытку подготовить террористический акт с использованием вируса Эбола, но переоценила умственные возможности своих «биотеррористов». После гибели их ведущего вирусолога, интерес к возбудителям ВГЛ у сектантов пропал. Военные специалисты проводят оценку потенциальной опасности возбудителей ВГЛ, исходя из общих требований к потенциальным агентам БО. Вирусы Денге и желтой лихорадки считаются ими непригодными для ведения биологической войны из-за высокой ингаляционной дозы. Возбудители Конго-Крымской геморрагической лихорадки и геморрагической лихорадки с почечным синдромом, также не рассматриваются ими как перспективные агенты БО из-за технических трудностей, возникающих при масштабировании производства. К наиболее пригодным для использования в целях биологической войны они относят вирусы Эбола, Марбург, Ласса, Мачупо и Хунин (Borio Г. et al., 2002). Основной способ их применения для поражения людей — создание аэрозоля (см. Army FM 8-284, 2000).
Микробиология возбудителей геморрагических лихорадок. Вирусы геморрагических лихорадок размножаются в культурах клеток. Выбор культур клеток зависит от задач эксперимента и биологических особенностей вируса. Например, для размножения вируса лихорадок Эбола, Марбург и Ласса, используют клетки Vero (Halfmann P. et al., 2008; Alves D. A. et al., 2010; Fukashevich I. S. et al., 2005 соответственно). При имитации природных резервуаров, способных поддерживать длительную персистенцию вируса Эбола, используют мышиные линии клеток NIH 3F3 и RAW264.7 (линии клеток фибробластов и макрофагов мышей соответственно) и линию клеток мексиканского складчатогуба (Strong J. Е. et al., 2008). Пассируются вирусы геморрагических лихорадок на морских свинках и в культуре перевиваемых клеток почки зеленой мартышки. Их основные микробиологические свойства приведены в табл. 3.34.
Таблица 3.34. Микробиологические свойства вирусов геморрагических лихорадок*
|
Семейство
|
Диаметр частицы, нм
|
Морфология
|
Геном |
||
|
Размер, т. п. о. |
Свойства |
Сегментированность |
|||
|
Filoviridae |
80 |
В форме бациллы |
19 |
РНК(-), одноцепочечная |
Несегментированный (1 — сегмент) |
|
Arenaviridae |
110-130 |
Сферическая |
11 |
РНК(±), одноцепочечная |
Сегментированный (2 ± сегмента) |
|
Bunyaviridae |
80-120 |
Сферическая |
11-19 |
РНК(-), одноцепочечная |
Сегментированный (3 — сегмента) |
|
Flaviviridae |
40-50 |
Изометрическая |
10-12 |
РНК(+), одноцепочечная |
Несегментированный (1 + сегмент) |
* По L. Borio et al. (2002).
Экология и естественная эпидемиология возбудителей геморрагических лихорадок. Из-за огромного видового и штаммового разнообразия и существования в разных географических районах в качестве эндемиков, детальное изложение таксономии, происхождения, экологии и эпидемиологии вирусов, возбудителей ВГЛ, в данной работе невозможно. Ниже будут приведены типовые примеры природных вспышек, вызванных этими вирусами, необходимые для понимания эпидемиологических данных, собранных при расследовании вспышки на территории России.
Filoviridae: вирусы Эбола и Марбург. Семейство вирусов Filoviridae известно с 1967 г., когда ранее неизвестный вирус вызвал вспышку геморрагической лихорадки в Марбурге (ФРГ) среди работников предприятия по производству вакцин, ассоциированную с контактным заражением от приматов, привезенных из Уганды. Филовирусы являются членами порядка Mononegavirales. Их название происходит от лат. filum (нить), отражающего их уникальную нитчатую морфологию. Семейство Filoviridae включает только один род, Filovirus, состоящий из двух видов — вирусы Эбола и Марбург. Эти виды имеют сходную геномную организацию, но в значительной степени отличаются друг от друга по нуклеотидной последовательности и лишены антигенной перекрестной реактивности. Вирус Эбола имеет не менее шести субтипов (Zaire, Sudan, Cote d'Ivoire, Bundibugyo, Lloviu и Reston). У вируса Марбург (Lake Victoria) субтипы не известны, но выделены от больных людей и животных, как минимум, девять генетически отличающихся изолятов (Ci6777, Popp, Musoke, Ravn, Angola и др.). Наиболее вирулентным для человека среди субтипов вируса Эбола является Zaire, среди изолятов вируса Марбург — Angola. Основываясь на сопоставлении летальных исходов среди заболевших людей, D. A. Alves et al. (2010) 1 считают изолят Angola вируса Марбург более вирулентным для людей, чем субтип Zaire вируса Эбола.
Большинство случаев филовирусной инфекции распознается только в условиях больших вспышек и при наличии эпидемической настороженности у врачей. Еще несколько лет назад считалось, что филовирусы циркулируют в прилегающих с юга к Сахаре странах Африки, вызывая масштабные вспышки тяжелых форм геморрагических лихорадок; и на Филиппинах, где обнаружен не опасный для человека субтип Reston вируса Эбола (рис. 3.110).
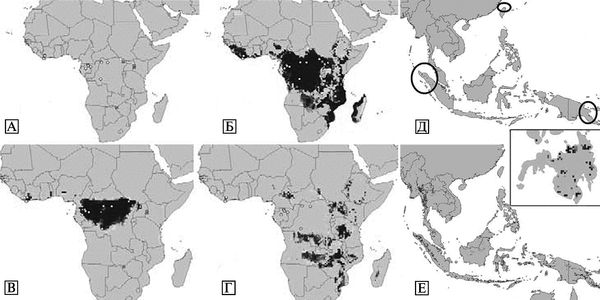
Рис. 3.110. Известная и предполагаемая география распространения филовирусов. А. Карта известных эпидемических вспышек геморрагических лихорадок, вызванных филовирусами с вирусологическим подтверждением диагноза. Б. Географические проекции экологических ниш, где могут поддерживаться филовирусы, построенные на основе географической локализации известных вспышек филовирусных инфекций. В и Г. Географические проекции возможных экологических ниш филовирусов, построенные на основе географической локализации известных вспышек лихорадок Эбола и Марбург соответственно. Д и Е. Географические проекции возможных экологических ниш филовирусов на Филиппинах и в Юго-Восточной Азии, основанные на проекции экологических ниш возбудителей лихорадки Марбург и Эбола в Африке соответственно. Большая плотность серого цвета означает большую вероятность присутствия в регионе природных очагов филовирусов. Кольца и треугольники на карте африканского континента означают географическую локализацию регионов, где встречается заболеваемость лихорадки Эбола и Марбург соответственно. По A. Townsend Peterson et al. (2004)
Однако Филиппинами и Юго-Восточной Азией географическое распространение филовирусов не ограничивается. В трупах летучих мышей Miniopterus schreibersii (обыкновенный длиннокрыл), собранных в одной из пещер в испанской провинции Астурия, обнаружен новый филовирус, названный Lloviu ( Lloviu virus , LLOV). Название вируса происходит от названия пещеры Cueva del Lloviu. Вирус выделен из пневмонических очагов в легких М. schreibersii. Хотя пещеру часто посещают люди, случаев болезни, вызванных вирусом Lloviu, у них не выявлено. Это второй известный филовирус, не опасный для людей. Филогенетический анализ указывает на существование в прошлом общего предка всех филовирусов, от которого Lloviu отделился, по крайней мере, 150 тыс. лет назад (Negredo A. et al., 2011). Возможно обнаружение других очагов филовирусов на европейском континенте.
На электронных микрофотографиях филовирусные вирионы представляют собой длинные нити. Длина вирусных частиц варьирует в пределах от 800 до 1400 нм, но они имеют постоянный диаметр, равный 80 нм. Филовирусы — относительно простые вирусы, имеющие геном 19 т. п. о., кодирующий, по меньшей мере, 8 белков: нуклеопротеид (NP), вирионные белки (VP35, VP40, VP30 и VP24), белок с полимеразной активностью (L), трансмембранный гликопротеид (GP) и растворимый гликопротеид (sGP). Все гены расположились в одной цепи отрицательной-смысловой РНК. Гen gp кодирует оба гликопротеида и является самым вариабельным участком генома вируса Эбола. Доминирующим продуктом гена является гликопротеид sGP. Синтез GP происходит в результате корректировки РНК. Белки Np30, VP30, VP35 и L объединяются с вирусной геномной РНК, образуя рибонуклеопротеидный комплекс (центральный рибонуклеопротеидный кор), тогда как белки VP40, VP24 и GP ассоциируются с вирусной мембраной (Warfield К. L. et al., 2006; Melito P. L. et al., 2008). Белок VP35 вируса Эбола (Zaire) функционирует аналогично белку NS1 вируса гриппа, препятствующего индукции интерферона типа I в инфицированных клетках. Белок VP35 может действовать путем связывания с двунитевой РНК, препятствуя таким образом активации днРНК-ассоциированной фосфокиназы и, возможно, других антивирусных белков.
Линейное расположение вирусных генов напоминает таковое у рабдо- и парамик-совирусов. 3'- и 5'-концы генома содержат консервативные, комплементарные последовательности, которые являются важными цис -действующими регуляторами геномной репликации, транскрипции и, возможно, упаковки вирусной частицы. Транскрипция отдельных генов регулируется некодирующими участками на 3'- и 5'-концах, содержащих короткие консервативные последовательности (Bray М., Paragas J., 2002).
Цикл репликации у филовирусов похож на таковой у хорошо изученных рабдо- и парамиксовирусов. Репликация начинается с прикрепления вириона к рецептору на поверхности клетки (предположительно а-фолатный рецептор). После связывания с рецептором вирус проникает в клетку путем рецептор-опосредованного эндоцитоза. В результате слияния вирусной оболочки с мембраной эндосомы, центральный рибонуклеопротеидный кор высвобождается в цитоплазму Транскрипция начинается на З'-конце генома посредством вирусной РНК-зависимой РНК-полимеразы и приводит к синтезу лидерной РНК и семи полиаденилированных мРНК. Аккумуляция первых двух белков, кодируемых на З'-конце генома (NP и VP35), каким-то образом стимулирует продуцирование положительно-смысловых «антигеномов» полной длины, которые, в свою очередь служат в качестве матриц для синтеза генома. Вирион состоит из центрального рибонуклеопротеидного кора, связанного с двумя матричными белками, VP24 и VP40, покрытого двойным липидным слоем, содержащим гликопротеид, полученным от клетки-хозяина. Гликопротеид образует на поверхности вириона тримерные шипы (Bray М., Paragas J., 2002).
В случае вируса Эбола, но не вируса Марбург, первичный продукт, кодируемый геном gp , является усеченным белком, лишенным С-терминального гидрофобного мембранного якоря. Этот «растворимый GP» (sGP) высвобождается из инфицированных клеток. Синтез GP вируса Эбола полной длины требует вставки дополнительного аденозина в «редактирующем сайте» в процессе транскрипции. Во время прохождения через аппарат Гольджи, GP обильно гликозилируется и расщепляется клеточным фуриноподобным ферментом на две единицы: внеклеточный GFl и трансмембранный GP2 , которые остаются связанными дисульфидной связью в виде GP1,2 . Сборка новых вирусных частиц происходит на внутренней поверхности плазматической мембраны, где VP24 и VP40 связываются, по-видимому, не только с новым центральным рибонуклеопротеидным кором, но и с цитоплазматическим хвостом GP2 . Полный цикл репликации длится примерно 12 ч.
Вирусы Эбола и Марбург происходят от одного предка. Несинонимические замены в гене gp вирусов Эбола и Марбург оцениваются как 3,6х10-5 на сайт/год (per site per year). Что в сотни раз медленнее, чем у ВИЧ или у вируса гриппа, но примерно соответствует скорости несинонимических замен у вируса гепатита В, имеющего ДНК-геном. Дивергенция вирусов Эбола и Марбург произошла тысячи лет назад (Suzuki Y., Gojobori Т., 1997). Их филогенетическое древо приведено на рис. 3.111.
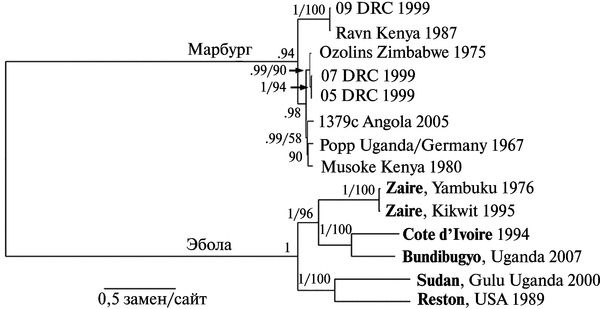
Рис. 3.111. Филогенетическое древо вирусов Эбола и Марбург. Сравнение полных геномов обоих вирусов разного географического происхождения выполнено с помощью Bayesian analysis (байесовский анализ). Серым цветом выделен субтип Вип-dibugy вируса Эбола, обнаруженный авторами данной статьи во время большой вспышки геморрагической лихорадки в Западной Уганде в ноябре 2007 г. Субтипы филовирусов выделяются в том случае, если их геномы различаются один от другого, по крайней мере, на 30—40 %. По J. S. Towner et al. (2008)
Особенности этиологии, эпидемиологии и клиники геморрагических лихорадок Эбола и Марбург приведены в табл. 3.35.
Таблица 3.35. Особенности этиологии, эпидемиологии и клиники филовирусных геморрагических лихорадок Эбола и Марбург*
|
Критерий |
Характеристика |
Эбола |
Марбург |
|
Этиология |
Возбудитель |
Частица 800 нм, полиморфен, не менее 8 белков |
Частица 750 нм, полиморфен, не менее 8 белков |
|
Эпидемиология
|
Эпидемии (количество заболевших) |
1976-1978 гг. - Судан, Заир (602); 1985 г. — Кения (?); 1994-1995 гг. — Заир (297), Кот д'Ивуар (3); 1994-1996 гг. - Габон (90), ЮАР (>17); 2001 г. — Кения; 2003 г. — Габон (135); 2004 г. — Судан (> 20?) |
1967 г. — ФРГ, СФРЮ (31); 1975-1990 гг. — Родезия (2), Кения (1); 1999 г. — Конго (Заир) (70); 2004-2005 гг. — Ангола (308, из них 284 смертельных исходов) |
|
Сезонность |
Весна — лето |
Весна — лето? | |
|
Генерации |
До 5-8 |
2-3 (до 7-8 в Конго) |
|
|
Летальность |
60-100 % |
28-100 % |
|
|
Источник |
Больные люди, обезьяны, летучие мыши, грызуны, растения? |
Больные люди, обезьяны, растения? |
|
|
Путь передачи |
Контакты (в т.ч. половые), ингаляционно, инъекции |
Контакты (в т.ч. половые), ингаляционно |
|
|
Контагиозность |
23 % в семье, 81 % среди медицинского персонала |
Невысокая (Конго — высокая) |
|
|
Заболеваемость |
10-81 % |
Нет данных |
|
|
Заразный период |
1-27 сут болезни (до 2-3 мес. при половой передаче) |
1-27 сут болезни (до 2-3 мес. при половой передаче) |
|
|
Клиника |
Инкубационный период |
4-20 сут |
3-20 сут |
|
Начало |
Острое |
Острое |
|
|
Первичные симптомы |
Лихорадка, фарингит, тошнота, боль в животе |
Лихорадка, боли, прострация |
|
|
Фаза разгара |
Мелена (2-3 сут), сыпь (4-6 сут), диарея, возбуждение, кровотечения и кровоизлияния (3-5 сут) |
Фарингит, воспаление половых органов, сыпь, геморрагический диатез (8-13 сут), поражение печени и почек, миокардит |
|
|
Причина гибели |
ДВС-синдром, отек легких и мозга, шок (8-9 сут) |
ДВС-синдром, отек легких и мозга, шок (8-17 сут) |
|
|
Длительность заболевания |
2-3 нед |
3-4 нед (до 2 мес.) |
|
|
Длительность реконвалес- ценции |
2-3 мес. |
2-3 мес. |
|
|
Осложнения |
Анорексия, психозы |
Гепатит, орхит, миелит, психозы |
* По И. В. Борисевичу с соавт. (2006) с дополнениями из работы P. L. Melito et al. (2008).
Первичный природный резервуар филовирусов неизвестен. В течение длительного времени считалось, что подобно некоторым другим классическим вирусным зоонозам, вирусы Эбола и Марбург поддерживаются у некоторых видов позвоночных в виде хронической/персистирующей инфекции, которая не вызывает заболевание. Причем и вид-резервуар, и вирус сохраняются в течение достаточного периода времени, чтобы обеспечить передачу другим восприимчивым хозяевам. Предполагалось, что резервуарами являются многие виды позвоночных, включая летучих мышей, мышей, землероек и других, живущих на земле животных, но, несмотря на интенсивный поиск, было обнаружено, что ни одно из них не продуцировало живые вирусы в естественных условиях. Хотя вспышки лихорадок Эбола и Марбург часто ассоциировались с контактами с низшими приматами, но эти виды не являются природными резервуарами фило-вирусов, поскольку и у них наблюдается высокая летальность при заражении. Местное население мало чем способно помочь исследователям при установлении эпидемических цепочек филовирусов. Традиционные поверья, распространенные в Центральной Африке, связывают болезнь с колдовством или отравлением, но не с вирусом.
После вспышек лихорадки Эбола в 1994 г. в республике Кот-д'Ивуар и в 1995 г. в Демократической Республике Конго, были предприняты интенсивные попытки идентифицировать природные резервуары филовирусов. Однако они не дали ответа на вопрос, кто из животных или растений является первичным резервуаром 2 . Некоторые ученые по-прежнему настаивают на том, что резервуаром, из которого происходит инфицирование людей, являются летучие мыши. J. S. Towner et al. (2009) приводят доказательства длительного поддержания вируса Марбург в колониях египетских фруктовых летучих мышей (Rousettus aegyptiacus ). Возможные модели трансмиссионных циклов филовирусов приведены на рис. 3.112.
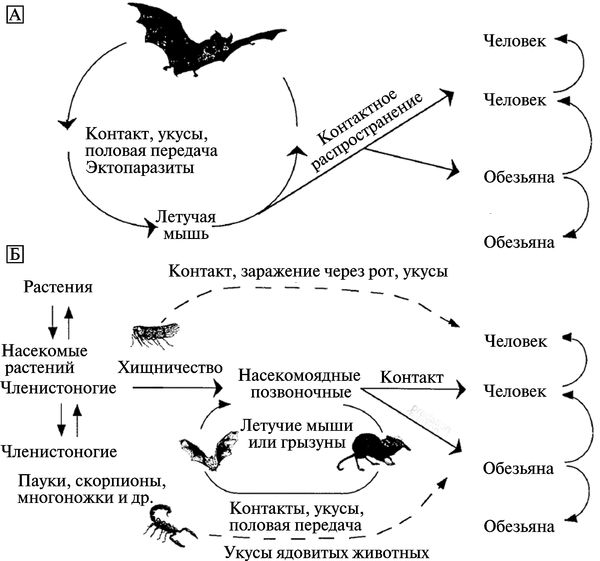
Рис. 3.112. Возможные модели трансмиссионных циклов филовирусов. А. С доминированием летучих мышей. Б. С доминированием артроподов и насекомоядных. По Т. М. Monath (1999)
До настоящего времени не идентифицированы членистоногие-переносчики, и какие-либо другие механизмы передачи филовирусов из природного резервуара людям и низшим приматам. Неясными остаются механизмы, лежащие в основе высокой чувствительности людей и низших приматов к вирусам Эбола и Марбург дикого типа по сравнению с другими видами (т. е. мышами и, возможно, летучими мышами).
Эксперименты на приматах показали, что животные заболевают после интрана-зального, перорального и конъюнктивального ведения вирусов Марбург и Эбола. У людей такой путь занесения инфекции в организм возможен, но прямые доказательства отсутствуют, полученные в очагах болезни, отсутствуют. Воздушно-капельный путь заражения скорее исключение, чем правило. В природе, судя по патологоанатомической картине болезни у погибших животных, вирус передается через пищу. У них нет поражений альвеол и бронхов, в основном в патологический процесс вовлечены кишечные лимфатические узлы, печень и селезенка (Wyers М. et al., 1999).
Больные лихорадками Эбола и Марбург очень опасны для медицинского персонала. Например, в 2000 г. во время вспышки лихорадки Эбола в Уганде (погибло 224 человека) из 22 человек медицинского персонала заболело 14 (64 %). Первичными больными с филовирусной инфекцией чаще всего были мужчины, которые работали в лесах, котлованах или рудниках. Вирусы лихорадок Эбола и Марбург могут в течение 101 сут и 83 сут, соответственно, выделяться с семенной жидкостью реконва-лесцентов. Доказаны случаи полового заражения этими вирусами (Borio L. et al., 2002; Peterson A. T. et al. 2004). Ниже рассмотрим пример молекулярной эпидемиологии естественных вспышек лихорадки Эбола (рис. 3.113).
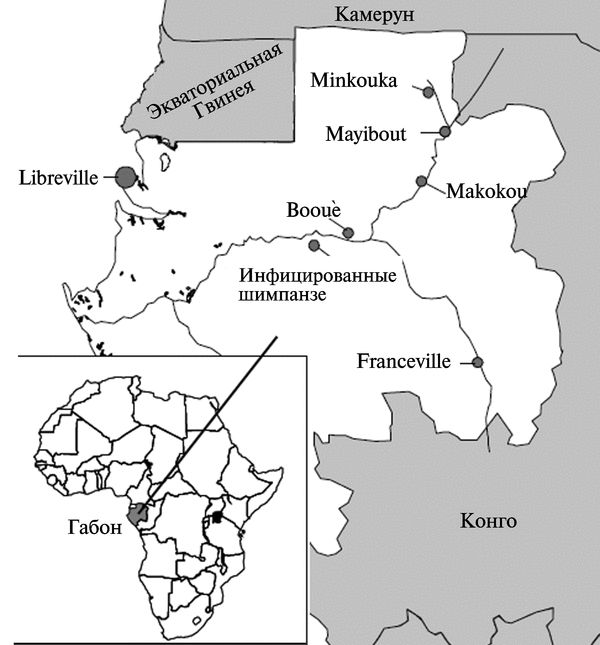
Рис. 3.113. Географическое распределение трех эпидемий геморрагической лихорадки Эбола в Габоне. Район Minkouka — первая вспышка. Mayibout — вторая вспышка. Вооиё — третья вспышка. По М. С. Georges-Courbot et al. (1997)
Циркуляция вируса Эбола среди населения Габона серологически показана еще в 1982 г. В 1994—1994 гг. были зарегистрированы три независимые друг от друга вспышки геморрагической лихорадки Эбола у людей в северо-восточной части Габона, в районе лесов экваториальной провинции Огуо-Ивиндо. Каждая вспышка сопровождалась гибелью приматов. Первая из них началась в декабре 1994 г. в сезон дождей (декабрь и февраль) в лагере золотодобытчиков на северо-востоке Габона в районе Minkouka между 1'24" и 1'44" с. ш. и 12'59" в. д. около реки Нуна. Вторая — в начале февраля 1996 г. в селении Mayibout (1'07" с. ш. и 13'06" в. д.) около реки Ивиндо (37 случаев болезни). Наиболее близкий к ним город Makokou, расположенный в 0'ЗЗ" с.ш. и 12'50" в.д., имел свой госпиталь, куда доставлялись больные и контактировавшие с ними жители. Третья вспышка началась в июле 1996 г. в поселке Вооиё (0'06" ю.ш. и 11'57" в.д.), где выявлено большинство заболевших. Также были диагностированы отдельные случаи болезни в близлежащих городах и поселках. Всего за время третьей вспышки зарегистрировано не менее 43 летальных случаев геморрагической лихорадки Эбола. Вирус Эбола легко выделялся из крови людей в культуре клеток Vero Е6 при единственном пассаже. У вирусов, выделенных от больных, определялась последовательность гена gp. Филогенетический анализ выявил общее эволюционное происхождение вирусов, вызвавших вспышки в Габоне и Заире. Кроме того, полученные данные подтвердили независимость друг от друга трех вспышек в Габоне. Ген gp вирусов, выделенных во время весенней вспышки 1996 г. в Габоне, отличался от последовательности гена gp вирусов вспышки конца 1994 г. четырьмя дополнительными нуклеотидами. Между вирусными последовательностями, полученными непосредственно из клинического материала и путем пассирования в тканевой культуре, или между последовательностями от первичных и вторичных случаев заболевания, различий не было. Наличие постоянных вирусных последовательностей и отсутствие генетического разнообразия между штаммами, выделенными в пределах отдельной вспышки, было показано в 1995 г. во время вспышки геморрагичекой лихорадки Эбола в селении Киквит (Заир) и подтверждено в Габоне.
Полученные М. С. Georges-Courbot et al. (1997) данные показали, что вирусы, вызвавшие вспышки лихорадки Эбола на разных эндемичных территориях, отличаются друг от друга по нуклеотидным последовательностям гена gp, однако генетического разнообразия между штаммами, выделенными в пределах отдельной вспышки обычно не наблюдается. Возможны вспышки, вызванные рекомбинантами, образовавшимися в пределах одного субтипа вируса Эбола (Wittmann Т. J. et al., 2007).
Arenaviridae. Название семейству было дано по структуре вириона, который внешне выглядит так, как будто посыпан песком (лат. arena — песок). Семейство состоит из одного рода (Arenavirus), включающего не менее 23 идентифицированных вирусов, подразделенных на основе их антигенных свойств на две группы:
1) серокомплекс Такарибе (или группа Нового Света), включающий вирусы, характерные для Северной и Южной Америки;
2) серокомплекс Ласса-лимфоцитарный хориоменингит (группа Старого Света). Включает вирусы, характерные для Африки.
Повсеместно распространен только вирус лимфоцитарного хориоменингита. Географическое распространение каждого аренавируса определяется диапазоном его носителей в природе. Наиболее важными вирусными антигенами являются нуклео-протеид и гликопротеид, причем антигены нуклеопротеиды наиболее консервативные среди антигенов аренавирусов. Точная идентификация аренавирусов достигается путем исследования в реакциях нейтрализации, которые зависят от высокоспецифических эпитопов оболочечных гликопротеидов. Генетическая классификация аренавирусов соответствует результатам серологических исследований. Семейство состоит из 4 филогенетических линий вирусов (Charrel R. N., de Lamballerie X., 2003).
Особенности этиологии, эпидемиологии и клиники аренавирусных геморрагических лихорадок Ласса, Боливийской и Аргентинской приведены в табл. 3.36.
Таблица 3.36. Особенности этиологии, эпидемиологии и клиники аренавирусных геморрагических лихорадок Ласса, Боливийской и Аргентинской*
|
Критерий |
Характеристика |
Лихорадки Ласса |
Боливийская и Аргентинская лихорадки |
|
Этиология |
Возбудитель |
Частица 50 нм, сферичен, 10-15 гранул; 13 белков |
Частица 70 нм, сферичен, 2-10 гранул; 13 белков |
|
Эпидемиология |
Эпидемии |
Постоянно с 1969 г.; до 2-3 млн человек в год |
Постоянно; 10-30 человек в год |
|
Завозы |
1969-1988 гг. — около 20 случаев в США, Европе, Японии, Израиле |
Нет данных |
|
|
Сезонность |
Отсутствует |
Весна - лето? |
|
|
Генерации |
ДоЗ |
1-2 |
|
|
Летальность |
0,1-0,2 % (20-30 % среди госпитализированных) |
5-30 % (10 %) |
|
|
Источник |
Крысы Mastomys, больные люди |
Хомячки Calomys, больные люди |
|
|
Путь передачи |
Контакты, алиментарно, аэрозольно |
Контакты, алиментарно, аэрозольно |
|
|
Контагиозность |
Средняя |
Средняя |
|
|
Заболеваемость |
Высокая |
Низкая |
|
|
Заразный период |
До 70 сут |
До 2-3 нед |
|
|
Клиника |
Инкубационный период |
3-21 сут (7-14 сут) |
3-21 сут (14 сут) |
|
Начало |
Постепенное |
Постепенное |
|
|
Первичные симптомы |
Лихорадка, недомогание, конъюнктивит |
Лихорадка, фарингит, головная боль, гингивит |
|
|
Фаза разгара |
Интоксикация, язвенный фарингит, сыпь, геморрагические проявления, лимфаденит |
Полиаденит, сыпь, энцефалит, геморрагические проявления |
|
|
Причина гибели |
Некрозы внутренних органов (7-14 сут), острая почечная недостаточность, шок |
Сопутствующие осложнения (аутоиммунные) (10-14 сут), нарушение сердечнососудистой деятельности |
|
|
Длительность болезни |
До 1 мес. |
До 1 мес. |
|
|
Длительность реконвалесценции |
До 2-3 мес. |
1-1,5 мес. |
|
|
Осложнения |
Глухота, облысение, астения |
Гиперчувствительность, нарушения статики, параличи |
* По И. В. Борисевичу с соавт. (2006).
Вирион аренавируса покрыт плотной оболочкой, включающей липиды, и имеет крупные шипы на поверхности. Вирионы полиморфны, их диаметр в пределах 62-200 нм, в среднем, около 110 нм. Геномная (минус)РНК аренавирусов двуцепочечная, содержит два однонитевых сегмента (bi-segmented genom). Каждый сегмент кодирует два различных белка в двух неперекрывающихся рамках считывания с противоположной полярностью, разделеных некодирующим межгеномным регионом (non-coding intergenic region, IGR): S-сегмент — 3,5 т. п. о., кодирует, два полипептида: NP — нуклеопротеин (63 кДа) и прекурсор поверхностного гликопротеина (surface glycoprotein precursor, GPC; 75 кДа). GPC разрезается на два гликопротеида GP1 и GP2;
L-сегмент — 7,3 т. п. о., кодирует два белка — РНК-полимеразу и Z-белок, содержащий «Zn-связывающий палец».
Некодирующий межгеномный регион имеет стабильную шпилечную структуру. 5'- и З'-концы каждого сегмента являются некодирующими, и 19 терминальных нуклеотидов одного конца, соответствуют обратной комплементарной последовательности из 19 нуклеотидов на другом конце. Геномная (минус)РНК реплицируется в (плюс)антигеномную и далее транслируется (минус)мРНК. Жизненный цикл аренавирусов ограничен цитоплазмой клетки (рис. 3.114).
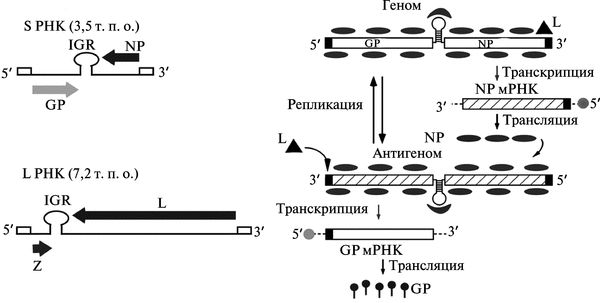
Рис. 3.114. Организация генома и репликация аренавирусов. А. Организация генома аренавирусов. Б. Репликация аренавирусов на примере S-сегмента. РНК-полимераза, ассоциированная с рибонуклеопротеидным комплексом вируса (ribonucleo-protein, RNP), инициирует транскрипцию от геномного промотора, локализованного в участке З'-конца (обозначен треугольником). Начальная транскрипция приводит к синтезу мРНК NP (или мРНК L в случае L-сегмента). Затем вирусная полимераза начинает действовать как репликаза и перемещается вдоль межгеномного региона (IGR), образуя полную копию антигенома (antigenome, ag) S-РНК (или ag L-PHK). Эта ag S-PHK служит матрицей для синтеза GP мРНК (ag L-PHK служит матрицей для синтеза Z мРНК). По J.С. de la Torre (2008)
В природе источником аренавирусов для людей являются инфицированные грызуны. Заражение происходит алиментарным, контактным, через микротравмы кожи, а также воздушно-пылевым (ингаляционным) путями. Благодаря высокой устойчивости аренавирусов в окружающей среде и низкой инфицирующей дозе, ингаляционное заражение человека может произойти на расстоянии, измеряемом десятками метров от источника аэрозоля. При загрязнении предметов обихода или инструментария выделениями (кровавая мокрота, кровавая рвота) или непосредственно кровью больных, содержащими вирус, возможна контактная передача возбудителя болезни, а также заражение через медицинский инструмент. Попадание в пищу или воду зараженной вирусом мочи, носового и ротового отделяемого грызунов или носоглоточного отделяемого больных людей также ведет к заражению. Хотя больной человек может служить источником заражения для других людей, но при повторных передачах от человека к человеку инфекция угасает, и в человеческой популяции длительной циркуляции аренавирусов не происходит. При расследовании внутрибольничных вспышек механизм передачи вируса часто остается неизвестным. Во время первой вспышки лихорадки Лacca в нигерийской больнице 1969 г. в населенном пункте Ласса, среди пациентов выявлено 16 вторичных случаев болезни, однако не было доказано воздушно-капельной передачи инфекции. Нет документального подтверждения передачи аренавирусов от людей, находящихся в инкубационном периоде болезни. В то же время вирус Ласса может выделяться спермой пациента в течение 3 мес. и мочой более месяца от начала болезни (Шувалова Е. П. с соавт., 2001; Borio L. et al., 2002). Все аре-навирусы, исследуемые в вирусологических лабораториях, оказывались инфекционными для человека в тех случаях, когда существовала возможность ингаляционного заражения (Charrel R. N., de Lamballerie X., 2003).
Лихорадка Ласса встречается в Западной (Нигерия, Сьерра-Леоне, Сенегал, Мали, Гвинея) и Центральной (Заир, Центрально-Африканская Республика, Буркина-Фасо) Африке, где регистрируется в виде спорадических случаев и небольших вспышек на территории природных очагов. В Западной Африке ежегодно инфицируются вирусом Ласса от 2 до 3 млн человек, из них от 5 до 10 тыс. погибает (Fichet-Calvet Е., Rogers D. J.,2009) (рис. 3.115).
Вирус Ласса (LASV) передается людям от многососковых крыс (Mastomys spp.) при непосредственном контакте с фекалиями инфицированных животных и/или при их попадании на слизистую оболочку (рис. 3.116).
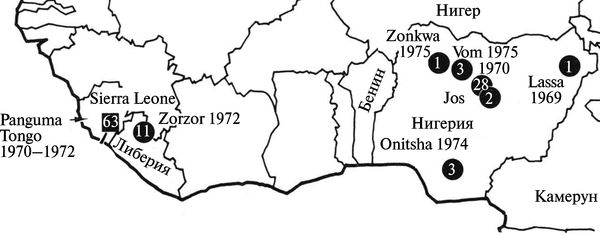
Рис. 3.115. География вспышек лихорадки Ласса в Западной Африке в 1969—1975 гг. Лихорадка Ласса была многократно описана у заболевших людей еще в 1930-х гг. под названием «тиф саванны», но ее этиология не была установлена. Кружком обозначены преимущественно внутрибольничные вспышки болезни, квадратом — вспышки в общинах на территориях, эндемичных по вирусу Ласса. По Т. P. Monath (1975)
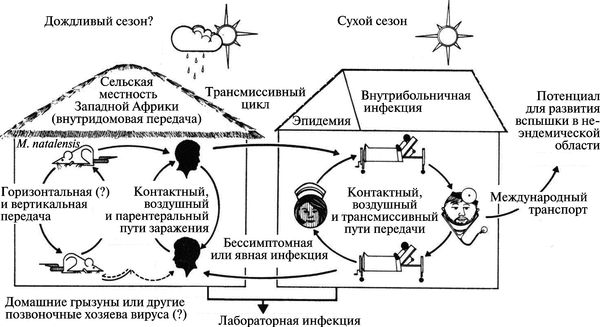
Рис. 3.116. Схематическое изображение трансмиссии вируса Ласса из природного резервуара среди грызунов в популяции людей. По Т. P. Monath (1975)
Хотя и считается, что резервуаром вируса Ласса является Mastomys natalensis 3 , однако в этом утверждении есть противоречие. Ареал М. natalensis включает не только Западную Африку, но и Восточную, Центральную и Южную, но вспышки лихорадки Ласса среди грызунов географически локализованы в отдельных регионах Западной Африки. М. natalensis не разносит вирус Ласса по своему ареалу. Значит, есть какой-то другой источник вируса (первичный резервуар), локализованный в отдельных регионах Западной Африки, из которого вирус проникает в популяции М. natalensis.
Филогенетический анализ показал, что вирусы Ласса состоят из четырех линий, три из которых циркулируют среди грызунов в Нигерии, и четвертая — среди грызунов Гвинеи, Либерии и Сьерра-Леоне. Сравнительный анализ последовательностей генов белков GP1 и GP2 позволяет предположить, что нигерийские штаммы вируса Ласса были предками штаммов, циркулирующих в Гвинее, Либерии и Сьерра-Леоне. Генетическое расстояние между штаммами Ласса коррелирует с географическим расстоянием, но не со временем (Bowen М.D. et al., 2000). Отсутствие доказательств работы «молекулярных часов» вызвано низкой скоростью мутирования вируса. Скорость образования мутаций у вируса Ласса в пределах от 5,6х10-4 до 17,6х 10-4 нуклеотидных замен на сайт/год (per site per year) (Ehichioya D.U. et al., 2011). Штаммы вируса Ласса, выделенные от жертв вспышки, идентичны, если они произошли из одного источника заражения людей (Bowen М.D. et al., 2000). Возможность рекомбинации между штаммами вируса Ласса разных линий, циркулирующих в природных резервуарах, не доказана (Ehichioya D.U. et al., 2011).
Восприимчивость людей и животных к возбудителям геморрагических лихорадок. Для испытания антивирусных препаратов и вакцин и для изучения филовирусного патогенеза используются три типа лабораторных животных — мыши, морские свинки и низшие приматы. У этих разных видов животных аналогичные клетки-мишени, с которыми специфически взаимодействую вирусы, и, соответственно, сходная симптоматика болезни. Низшие приматы крайне чувствительны ко всем филовирусам, в то время как морские свинки и иммунокомпетентные мыши обладают врожденной резистентностью к филовирусной инфекции. Это основное различие между животными моделями может стать причиной расхождений в результатах при проверке эффективности лекарственных препаратов и вакцин.
Мыши. Вирусы, возбудители лихорадок Марбург и Эбола, вызывают летальное заболевание у новорожденных мышей, но не вызывают явного заболевания у взрослых иммунокомпетентных мышей. Однако в результате последовательного пассирования вируса Эбола (Zaire 76) на взрослеющих мышах-сосунках был получен вариант вируса, который вызывает скоротечную летальную инфекцию у взрослых мышей при интраперитонеальном заражении. Патологические признаки инфекции, вызванной этим «адаптированным к мышам вирусом», сходны с таковыми у приматов, за исключением менее выраженной коагулопатии. У мышей отсутствует такой характерный признак лихорадки Эбола как генерализованный тромбогеморрагический синдром, обнаруживаемый на последней стадии в поражениях у людей и нечеловекообразных приматов (Geisbert Т.W. et al., 2002). Мышиная модель используется для предварительной оценки вакцин и антивирусных препаратов и для изучения филовирусного патогенеза. У мышей с иммунодефицитом, лишенных либо врожденных, либо антиген-специфических иммунных ответов, заражение вирусами Марбург и Эбола вызывает быстрый летальный исход.
Морские свинки. После заражения вирусом Марбург или вирусом Эбола (Zaire) или Эбола (Sudan) у морских свинок развивается слабо выраженная лихорадка. В результате переноса вируса от животного к животному постепенно повышается его вирулентность в отношении морских свинок, и после нескольких пассажей можно отобрать штамм вируса, который постоянно вызывает инфекционный процесс, заканчивающийся гибелью животного. Основные патологические признаки летальной инфекции у морских свинок сходны с таковыми у мышей и приматов. Морские свинки используются для испытания вакцин, но из-за их размера они в меньшей степени пригодны для предварительной оценки экспериментальных препаратов, которые обычно имеются лишь в небольшом количестве.
Низшие приматы. Все филовирусы вызывают у низших приматов тяжелую геморрагическую лихорадку. Наиболее вирулентным является вирус Эбола (Zaire), вызывающий летальное заболевание у африканских зеленых мартышек, обезьян цино-молгус, макак-резус и павианов. У обезьян циномолгус, являющихся широкораспространенной моделью, эта инфекция характеризуется повышением температуры и снижением активности на 3-4 сут после заражения; появлением с 4-5-х сут на туловище сыпи в виде красно-фиолетовых пятен; притуплением чувствительности на 6 сут и летальным исходом на 7-8 сут. Первоначально вирус обнаруживается в сыворотке на 3 сут, а к 5-м сут титры могут превысить 10 КОЕ/мл. Высокие концентрации вируса обнаруживаются также в печени, селезенке и других тканях. Изменения в количествах клеток крови и других параметрах клинических лабораторных, исследований сходны с таковыми у людей. Обычно наблюдаются слабые кровотечения, а обильное кровотечение является редким явлением. Вирусы Эбола (Sudan), Эбола (Reston) и Марбург также вызывают у низших приматов тяжелую геморрагическую лихорадку, отличающуюся лишь большей продолжительностью болезни и летальностью, приближающейся к 100 % (Bray М., Paragas J., 2002).
При инфицировании аэрозолем вируса Эбола (Zaire) с дисперсностью частиц 0,8-1,2 мкм, LD100 для макак-резус не превышала 400 КОЕ (Johnson Е. et al., 1995).
При ингаляционном заражении макак-крабоедов (Масаса fascicularis) разными дозами вируса Марбург (MARV-Angola), составлявшими 2-14 КОЕ и 99-705 КОЕ, обезьяны погибали все от любой дозы. Разница была только в продолжительности жизни после заражения на одни сутки (Alves D.A. et al., 2010).
Парентеральное введение обезьянам 1-10 КОЕ вирусов Эбола (Zaire) или Марбург (Musoki) обычно приводит их к смерти (Johnson Е. et al., 1995).
К вирусу Ласса чувствительны приматы и морские свинки. LD100 (штамм Josiah) для обезьян М. fascicularis весом 2-3,5 кг не превышает 465 КОЕ при дисперсности аэрозольных частиц меньше 4,5 мкм. При заражении этим же аэрозолями инбредных морских свинок линии Hartley определить LD50 оказалось затруднительно, так как летальность среди экспонированных животных никогда не превышала 50 %. Среднее время до гибели (23-37 сут) не обнаруживало значительной зависимости от концентрации вируса в аэрозоле. У инфицированных морских свинок находили лишь минимальные симптомы болезни, такие как всклоченность шерсти и затрудненность дыхания в последние 24-48 ч жизни. Однако морские свинки этой линии считаются высокочувствительными к ингаляционному заражению вирусом Ласса, так как ID50 для них составляет 15 КОЕ (Stephenson Е. et al., 1984).
Более точно воспроизвести в эксперименте клинику и патогенез лихорадки Ласса у человека, можно подкожным заражением макак-резусов (Gallis R. Т. et al., 1982).
Иммунитет к возбудителям вирусных геморрагических лихорадок. При отдельных филовирусных, флавивирусных и буньявирусных инфекциях ответы со стороны иммунной системы человека на возбудитель инфекции мало похожи на те, что описаны в учебниках по иммунологии для студентов. Основную роль в них играют феномены антителозависимого усиления инфекции (antibody-dependent enhancement, ADE) и антигенного импринтинга (другое название — феномен первичного антигенного греха, phenomenon of original antigenic sin, OAS).
Феномен ADE заключается в том, что вирусспецифические антитела усиливают проникновение вируса в фагоцитирующие клетки посредством взаимодействия с рецептором FcR и/или рецепторами комплемента на поверхности фагоцитирующих клеток. Поэтому феномен наблюдается в двух вариантах:
а) комплемент-опосредованное антителозависимое усиление инфекции (complement-mediated ADE; C-ADE);
б) независящее от комплемента и связанное с Fc-рецептором усиление инфекции (Fc-receptor-mediated ADE; FcR-ADE) (Takada A., Kawaoka Y., 2003; Tirado S. М., Yoon K. S., 2003).
Особенности вирусов, вызывающих феномен ADE, следующие:
а) обычно такие вирусы реплицируются в макрофагах;
б) они индуцируют продукцию большого количества антител с плохой способностью к нейтрализации гомологичных вирусов;
в) способны к персистентной инфекции, характеризующейся продолжительной виремией (Tirado S. М., Yoon К. S., 2003). Феномен ADE проявляется в ответ на образование антител изотипа IgGl (Elenchal Е. A.et al., 1985).
A. Takada et al. (2001, 2002) обнаружена способность сыворотки реконвалесцен-тов, переболевших лихорадкой Эбола (Zaire), увеличивать инфекционность вируса в отношении клеток 293-й линии, клеток почек обезьян и эндотелиальных клеток пупочной вены человека. Исследователями показано, что основную роль в этом процессе играют отдельные анти-IgM, специфичные к GP, и что выраженность феномена ADE различна у сывороток, взятых от разных пациентов. Аналогичные данные получены ими с сывороткой, взятой от мышей, иммунизированных ДНК-вакциной с клониро-ваным геном gp. Феномен ADE был менее выражен для субтипа вируса Reston, чем для вирусов субтипов Zaire и Sudan. Авторы данных работ предположили, что феномен ADE играет важную роль в патогенезе лихорадки Эбола (рис. 3.117).
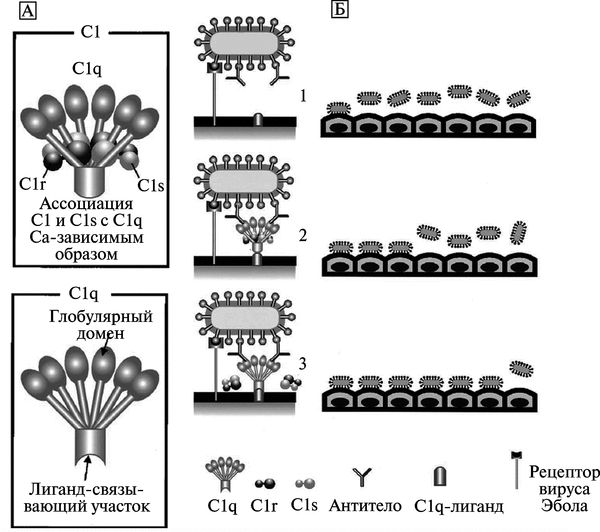
Рис. 3.117. Модель C-ADE (Clq-ADE) при лихорадке Эбола. А. Схематическое изображение белков комплемента С1 и Clq. Молекула Clq включает глобулярный и лигандсвязывающий домены. Елобулярный домен состоит из шести глобулярных набалдашников (globular heads), которые связываются с Fc-учаетком антитела. Лигандсвязывающий домен Clq взаимодействует с лигандом на поверхности фагоцитирующей клетки. Аффинитет Clq к лиганду снижается при ассоциации с Clr и Cls (сериновые протеазы). Б. Механизм ADE при лихорадке Эбола. Вирус Эбола инициирует инфекционный процесс путем связывания со специфическими рецепторами на поверхности фагоцитирующей клетки (1). Clq связывает комплекс «вирус-антитело» с Clq-лигандами, расположенными на поверхности клеток, вызывая взаимодействие между вирусом и рецептором (2). Диссоциация Clr nClsoTClq увеличивает связывающий аффинитет молекулы Clq с лигандами на поверхности фагоцитирующей клетки (3). По A. Takada et al. (2003)
В дальнейшем A. Takada et al. (2007) показали в условиях in vitro, что ADE при инфекционном процессе, вызванном вирусом Эбола (Zaire), развивается в результате взаимодействия вирусспецифических антител с вирусом и Fc-рецептором, или компонентом комплемента Clq и его рецептором (С-ADE вариант феномена). ADE GP-антисыворотки связана с уровнями IgG2a и IgM, но не с уровнями IgGl. Используя моноклональные антитела, авторы определили эпитопы GP вируса субтипа Zaire, отвечающие за индукцию антител, вызывающих ADE. Они также сконструировали химерные эпитопы, индуцирующие продукцию антител у мышей со сниженной способностью вызывать ADE, но обладающих нейтрализующей активностью в отношении вируса субтипа Zaire.
Для лихорадки Марбург феномен ADE был описан в 2011 г. Так же как для вируса Эбола, показана связь между ADE и вирулентностью штаммов вируса Марбург. Авторами делается вывод, что феномен ADE лежит в основе патогенеза не только лихорадок Марбург и Эбола, но и других филовирусных лихорадок (Nakayama E. et al., 2011).
Среди инфекционных процессов, вызываемых флавивирусами, феномен ADE наиболее изучен при лихорадке Денге и желтой лихорадке. Первая инфекция, вызванная вирусом Денге, чаще всего протекает у человека бессимптомно и дает пожизненный иммунитет к вирусу серотипа, ее вызвавшего. Однако если он сталкивается с вирусом другого серотипа, то благодаря FcR-ADE, болезнь протекает в тяжелой форме с большой вероятностью летального исхода (до 50 %) (Boonnak К. et al., 2008). ADE рассматривается как основная причина нейровирулентности вируса и тяжелого течения желтой лихорадки. Показана связь ADE с антителами (нейтрализующими, не нейтрализующими и протективными) к гликопротеину Е вируса желтой лихорадки (Barrett A. D. Т., Gould А.,1986; Goulld Е A. et al., 1989). При лихорадке Западного Нила ADE вызывают субклассы IgG, обладающие высокой афинностью к фактору комплемента Clq (Mehlhop Е. et al., 2007).
При инфекционных процессах, вызываемых вирусами семейства Bunyaviridae, феномен ADE остался не изученным. ADE смоделирован в условиях in vitro для инфекционного процесса, вызванного вирусом Хантаан, но на этом его исследования прекратились (Yao J. S. et al., 1992).
Феномен ОAS состоит в том, что при повторном контакте иммунной системы с вирусом или вакциной, иммунная система может не воспринимать различия между вариантом эпитопа, с которым уже познакомилась ранее, и его новым вариантом. И тогда активизируются В-клетки памяти, «запомнившие» предыдущий антиген. Выработка антител происходит в отношении этого антигена, хотя реально иммунная система с ним не контактирует. Образующиеся антитела не способны нейтрализовать вирус, выработка же специфических антител тормозится из-за подавления «наивных» В-клеток активизировавшимися В-клетками памяти. Феномен OAS детально изучен при инфекционных процессах, вызванных ВИЧ, вирусом гриппа А, лимфоцитарного хориоменингита, лихорадки Денге и некоторых тога-, парамикс- и энтеровирусами. Вирус лимфоцитарного хориоменингита (LCMV) в настоящее время единственный из аренавирусов, для которого установлена способность вызывать данный феномен. P. Klenerman и R. М. Zinkernage (1998) показано, что последовательное введение мышам различных штаммов LCMV, вызывало у них образование CTL-кле-ток, специфичных только в отношении штамма LCMV, введенного первым. Среди ВГЛ, вызванных флавивирусами, феномен OAS наблюдается при лихорадке Денге (HalsteadS. В. et al., 1983).
Исследования роли OAS и ADE в эпидемических и инфекционных процессах, и ответах на вакцинацию малоинтересны создателям вакцин 4 из-за опасений лишиться финансирования, поэтому они носят выборочный характер.
Устойчивость возбудителей вирусных геморрагических лихорадок во внешней среде. Преобладание ингаляционного пути заражения возбудителями ВГЛ среди других механизмов заражения людей свидетельствует в пользу того, что выделяясь с экскретами больных животных, они способны длительно сохраняться во внешней среде. Основными причинами высокой резистентности к внешним воздействиям вирусов, возбудителей геморрагических лихорадок, является наличие плотной липидной оболочки и РНК-генома, который менее чувствителен к физическим факторам, чем геном ДНК-вирусов.
Стабильность и инфекционность аэрозолей возбудителей геморрагических лихорадок изучены на примере вируса Ласса. Е. Stephenson et al. (1984) показали, что через 4 мин после перевода суспензии вируса в аэрозоль с дисперсностью частиц менее 4,5 мкм, при температуре окружающей среды 24°С и относительной влажности 55 %, 75,3+9,6 % частиц сохраняли инфекционность. При повышении температуры окружающей среды до 38 °С при той же относительной влажности инфекционность аэрозоля падала до 33,7 %. Периоды биологического полураспада аэрозоля вируса как при температуре окружающей среды 24 °С, так и при 32 °С, составляли от 10,1 до 54,6 мин, в зависимости от относительной влажности воздуха, но в любом случае инфекционность аэрозолей была достаточной для поражения людей на значительном расстоянии от аэрозольного генератора.
Антивирусные препараты. Лицензированных препаратов, оказывающих эффективное профилактическое и терапевтическое действие при инфекциях, вызванных филовирусами, нет. В некоторых случаях были использованы сыворотка и цельная кровь реконвалесцентов, но без убедительных доказательств их эффективности. При лабораторных исследованиях терапевтической эффективности поли- и моноклональных антител на обезьянах циномолгус обнадеживающих результатов получено не было. Попытку лечения нескольких больных с использованием а-интерферона, рекомбинантного интерферона и экстракорпоральной крови с гемосорбентами и диализом, можно считать успешной, но неясно, были ли только эти меры ответственны за благоприятный исход болезни. Нуклеозидный аналог рибавирин (ribavirin, Rib; 1-p-D-ribofuranosyl-1,2,4-triazole-3-carboxamide), эффективный при некоторых других вирусных геморрагических лихорадках (см. ниже) и поксвирусных инфекциях (см. разд. 3.8), не оказывает ингибирующего воздействия на филовирусы. Удачными оказались эксперименты по терапевтическому применению антисмысловых олигонуклеотидов и молекул короткой интерферирующей РНК (siRNA). Антисмысловые фосфородиами-дат-морфолино-олигомеры, направленные на предполагаемые последовательности в мРНК трех вирусных генов, защищали 75 % макак-резусов от вируса Эбола подтипа Zaire, когда лечение начинали до заражения. Лечение siRNA было успешным у морских свинок. Эффективность этих подходов может быть повышена благодаря усовершенствованным системам доставки и комбинациям молекул, нацеленных на большое количество вирусных генов. Но, несмотря на некоторые достижения в лечении филовирусных инфекций, следует признать, что лечение имело успех, если оно начиналось либо до, либо вскоре после заражения вирусом (Bausch D. G. et al., 2008).
Профилактическое и терапевтическое действие при инфекциях, вызванных аре-навирусами, оказывает рибавирин. Эффективность препарата доказана экспериментально в условиях in vitro и in vivo, и он лицензирован для лечения лихорадки Ласса. В основе механизма действия рибавирина — подавление синтеза вирусной РНК. Ри-бовирин активен и в отношении Bunyaviridae (включая CCHF), но не эффективен по отношению к Filoviridae или Flaviviridae. Рибавирин не проникает через гематоэнце-фалический барьер и, следовательно, не эффективен при неврологических нарушениях, вызванных арена- и буньявирусами. Внутривенное введение рибаверина в первые шесть суток лихорадочного состояния у больного с лихорадкой Ласса, с высоким уровнем виремии, снижало летальность с 76 до 9% (Borio L. et al., 2002).
В последние два десятилетия активно идет поиск более эффективных препаратов, способных блокировать инфекционные процессы, вызываемые аренавирусами. Среди них: ингибиторы IMP-дегидрогеназы (IMP-dehydrogenase), S-аденозилгомоцистеин-гидролазы (S-adenosylhomocysteine hydrolase), фенотиазидные соединения (phenotia-zines compounds), брассиностероиды (brassinosteroids), муристиковая кислота (myris-tic acid), отдельные антиретровирусные препараты, производные пиразина (Т-705; 6-fluoro-3-hydrody-2-pyrazinecarboxamide), бензимидазола (ST-193; benzimidazole derivative), фосфоротиоатные олигонуклеотиды (phosphorothioate oligonucleotides) и амфипатические ДНК-полимеры (amphipathic DNApolymers) (Lee А.М. et al., 2011).
Обнаружение генетически измененных штаммов возбудителей геморрагических лихорадок. Возбудители геморрагических лихорадок Марбург, Эбола и Ласса, имеют еще меньше «недостатков», чем ортопоксвирусы, которые бы могли вызвать у террористов желание подвергнуть себя дополнительному риску, вмешиваясь в их геном. Кроме того, геном этих вирусов значительно меньше, чем геном ортопоксвирусов (10-19 и 144-289 т. п. о.), и представлен РНК, а не ДНК, что значительно снижает возможности генных инженеров по получению генетически измененных штаммов возбудителей геморрагических лихорадок Марбург, Эбола и Ласса.
Обнаружение более вирулентных для людей рекомбинатов, образовавшихся между вирусами Эбола одного субтипа, не следует рассматривать как проявление деятельности человека, так как такие рекомбинанты встречаются в природе. Генетическое конструирование филовирусов в основном идет в направлении получения «псевдо-типированых вирусов», использующих механизм репликации вируса везикулярного стоматита, вируса лейкемии мышей или ВИЧ-1, упаковывающихся в вирион вируса Марбург или Эбола (см. табл 2.23). Такие «вирусы» не представляют опасности для людей. С ними работают для изучения механизмов проникновения вирусов Марбург и Эбола в клетки-мишени (Chan S. Y. et al., 2000; Bray М., Paragas J., 2002).
Значительно большую опасность, чем генетически модифицированные филовирусы, представляют лентивирусные векторы, псевдотипированные с гликопротеинами оболочки вирусов Эбола и Марбург, предназначенные для введения в легочную ткань через апикальную поверхность эпителия дыхательных путей (см. табл. 2.23), но их рассмотрение не входит в задачу данного раздела монографии.
Геном аренавирусов консервативен. Рекомбинанты, образовавшиеся между штаммами вируса Ласса разных линий, циркулирующих в природных резервуарах, неизвестны. Но аренавирусы могут обмениваться сегментами генома (реассортировать) в культурах клеток, коинфицированных разными видами аренавирусов. Этот простой методический прием, хорошо отработанный еще в 1960-х гг. при конструировании гриппозных вакцин, в настоящее время используется учеными для конструирования вакцин против вируса Ласса. I.S. Lukashevich et al. (2005) описали реассортантный клон ML29 (MOPV/LASV), содержащий L-сегмент РНК из невирулентного для морских свинок вируса Мопея (MOPV) и S-сегмент РНК из вируса Ласса (LASV). Репликация ML29 в организме морских свинок и низших приматов была слабой. Все морские свинки линии 13, вакцинированные клоном ML29, выживали, по меньшей мере, через 70 сут после заражения вирусом Ласса, не обнаруживая никаких признаков болезни или патологических гистологических изменений. Но возможны и другие комбинации сегментов, например, комбинация L-сегмента из вируса Ласса и S-сегмента из другого вирулентного для человека аренавируса. Количество видов аренавирусов точно неизвестно и постоянно открываются новые, и весьма опасные для человека. Например, Lujo vims, открытый в 2008 г., вызывает болезнь, приводящую в 75 % случаях к летальному исходу. А так как S-сегмент содержит гены, определяющие антигенные свойства вируса, то в рамках данного методического приема открываются широкие горизонты для фантазии преступников.
Естественная реассортация наблюдается для некоторых вирусов геморрагических лихорадок (Bunyaviridae), таких как вирусы лихорадки долины Рифт, Конго-Крымской геморрагической лихорадки, но для аренавирусов она не описана (Lukashevich I.S. et al., 2005 ).
Подозрение о применении генетически модифицированного возбудителя лихорадки Ласса должно возникнуть при обнаружении у жертв вспышки болезни штаммов вирусов, являющихся реассортантантами с другими аренавирусами или рекомбинантами штаммов вируса Ласса разных линий. Такое же подозрение должны вызвать штаммы вируса Ласса, резистентные к рибовирину, если неизвестно о применении рибовирина в данном очаге для лечения людей и при отсутствии сведений об эпизоотии Ласса среди грызунов.
Достоверно установить факт вмешательства в геном вирусов, вызывающих геморрагические лихорадки, можно по результатам секвенирования, сопоставив выявленную нуклеотидную последовательность вируса с эталонной.
Патогенез геморрагических лихорадок. Исследования на моделях низших приматов показали, что моноциты, макрофаги и дендритные клетки, «вездесущие сторожа», которые обычно охраняют организм от микробной инвазии, являются главными местами репликации филовирусов и играют центральную роль в патогенезе болезни. Хотя лимфоциты не инфицируются, они разрушаются в огромных количествах в ходе болезни в результате апоптоза, что аналогично процессу, наблюдаемому при септическом шоке. Филовирусы распространяются по организму циркулирующими моноцитами и макрофагами. Вирионы, высвободившиеся из этих клеток, инфицируют соседние клетки, включая гепатоциты, клетки коры надпочечника и фибробласты (рис. 3.118).
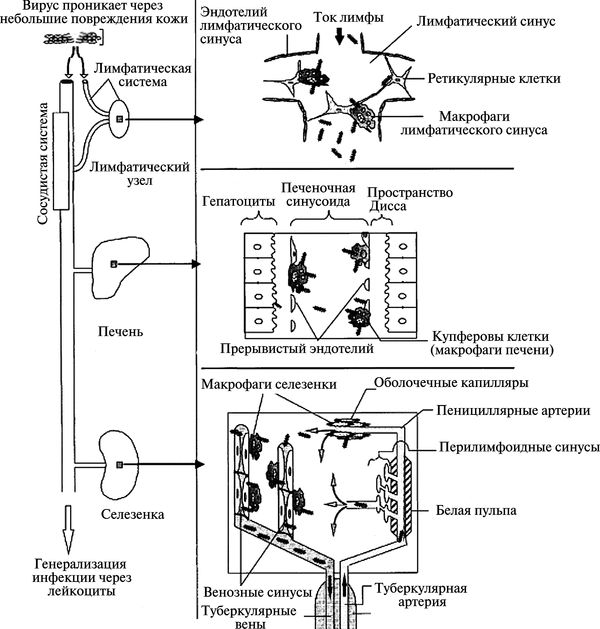
Рис. 3.118. Схематическое изображение генерализации вирусов Эбола и Марбург в организме хозяина. По Н. Schnittler и Н. Feldmann (1998)
Виремия и высвобожденые инфицированными клетками провоспалительные цитокины и хемокины (включая альфа-ФНО), вызывают лихорадку, повышают проницаемость эндотелиальной выстилки кровеносных сосудов. У больного развиваются гипотензия, шок и системное поражение органов. Синтез клеточно-поверхностного тканевого фактора запускает внешний механизм коагуляции. На моделях геморрагической лихорадки Эбола у низших приматов диссеминированную внутрисосудистую коагуляцию наблюдали на второй день после инфицирования по появлению D-ди-меров 5 (образуются при расщеплении молекул фибрина) в плазме. Отмечали обширный некроз, особенно в печени, хотя обычно не в такой степени, чтобы быть причиной смерти.
Роль специфических антител в патогенезе лихорадок Марбург и Эбола не имеет ничего общего с их ролью при таком опасном заболевании, как натуральная оспа.
Специфические антитела либо не успевают образоваться, либо усиливают инфекционный процесс. Больные погибают при наличии высокого уровня вирусемии.
Клиническая и патологоанатомическая картина вирусных геморрагических лихорадок у человека при естественном инфицировании. Сравнение клинических характеристик геморрагических лихорадок различной этиологии приведено в табл. 3.37.
Таблица 3.37. Клиническая характеристика геморрагических лихорадок различной этиологии*
|
Вирус |
Особенности клиники болезни |
Возможность передачи от человека к человеку |
Инкубационный период, сут |
Летальность, % |
Лечение |
|
Эбола |
Высокая температура и глубокая прострация. Диффузная мукулопапулярная сыпь, появляющаяся на 5 сут болезни. Кровотечения и диссеминированная интравас-кулярная коагуляция |
Возможна |
2-21 |
50-90 |
Поддерживающее |
|
Марбург |
Высокая температура, миалгия. Незудящая макулопапулезная сыпь на лице, шее, туловище и плечах. Кровотечения и диссеминированная интраваскулярная коагуляция |
То же |
2-14 |
23-70 |
То же |
|
Ласса |
Постепенное развитие лихорадки, тошнота, боли в области живота, сильная боль в горле, кашель, конъюнктивит, изъязвление слизистой оболочки рта, экссудативный фарингит, шейная лимфоаденопа-тия. Позднее появляются выраженные признаки отека головы и шеи; плевральные и перикардиальные выпоты. Геморрагически осложнения менее выражены чем при филовирусных инфекциях |
То же |
5-6 |
15-20 |
Рибавирин, поддерживающая терапия |
|
New World Arenaviruses |
Постепенное развитие лихорадки, тошнота, боли в области живота, конъюнктивиты, гиперемия лица и туловища, генерализованная лим-фоаденопатия. Могут развиваться петехии и кровотечения, поражения ЦНС (тремор языка и верхних конечностей, миоклонические движения, дизартрия, генерализованные судороги) |
То же |
7-14 |
15-30 |
То же |
|
Лихорадки долины Рифт |
Лихорадка, головная боль, ретро-орбитальная боль, светобоязнь, желтушность кожных покровов, в 1 % случаев развиваются геморрагии или энцефалит. В 10 % случаев развивается ретинит (острый период болезни или в течение 4 нед от начала болезни) |
Невозможна |
2-6 |
Менее 1 |
То же |
|
Желтой лихорадки |
Лихорадка, головная боль, гиперемия кожи лица, конъюнктивальные инъекции. Больные либо выздоравливают, либо у них наступает период короткой ремиссии, за которой следует лихорадка. У больного развиваются брадикардия, желтушность кожных покровов, почечная недостаточность и геморрагические осложнения |
То же |
3-6 |
20 |
Поддерживающая |
|
Омской геморрагической лихорадки |
Высокая температура, кашель, конъюнктивит, папуловезикулярная сыпь на мягком небе, гиперемия лица и туловища без образования сыпи, генерализованная лимфо-аденопатия и спленомегалия. У некоторых пациентов развивается пневмония и нарушения ЦНС |
То же |
2-9 |
0,5-10 |
То же |
|
Болезни Киасанурского леса |
Сходная с Омской геморрагической лихорадкой, но течение болезни двухфазное. Первая фаза длится 6-11 сут, за ней следует афибрильный период продолжительностью 9-21 сут, после чего лихорадка возобновляется. У почти 50 % пациентов с рецидивом болезни развивается менингоэнцефалит |
То же |
2-9 |
3-10 |
То же |
* По L. Borio et al. (2002).
Лихорадки Марбург и Эбола 6 . Вирусы Марбург и Эбола вызывают у людей клинически сходные геморрагические лихорадки. Продромальный период отсутствует. Болезнь начинается остро, после примерно 6-суточного инкубационного периода. У заболевшего поднимается температура, появляются сильные головные боли, боли в мышцах, чувство жара, тошнота и рвота, боли в животе, выраженное общее недомогание. Через несколько дней развиваются геморрагический синдром, обезвоживание, нарушается сознание. Больные жалуются на головную боль разлитого характера, боль в груди колющего характера, усиливающуюся при дыхании, загрудинные боли. Могут появиться кровоизлияния в конъюнктиву, фарингит и эритематозная и макуло-папулезная сыпь, которые являются отличительными особенностями этих лихорадок и могут учитываться при постановке диагноза. У некоторых больных на фоне маку-лопапулезной сыпи отмечаются везикулезные элементы. При осмотре больного выявляются гиперемия слизистой оболочки глотки, кончик и края языка красные, на твердом и мягком небе, языке появляются везикулы, при вскрытии которых образуются поверхностные эрозии.
На 3-4 сут болезни на фоне болей в животе схваткообразного характера, стул становится жидким, водянистым, у половины больных отмечается примесь крови в стуле или появляются признаки желудочно-кишечного кровотечения. Может также быть рвота с примесью желчи и крови в рвотных массах. Понос длится около недели; рвота продолжается 4-5 сут. Сыпь распространяется на верхние конечности, шею, лицо.
При развитии геморрагического синдрома появляются кровоизлияния в кожу, в конъюнктиву, слизистую оболочку полости рта, часто носовые, маточные, желудочно-кишечные кровотечения. Нарастает интоксикация. На 7—9 сут заболевания интоксикация достигает максимального развития, появляются симптомы дегидратации, при тяжелом течении развивается инфекционно-токсический шок. Могут появиться судороги, потеря сознания. На высоте этих проявлений больные нередко умирают.
Стандартные лабораторные исследования позволяют выявить следующие нарушения: раннюю лимфопению, сопровождающуюся нейтрофилией, выраженную тромбоцитопению и пролонгацию времени свертывания, наличие циркулирующих продуктов распада фибрина и другие признаки диссеминированной внутрисосуди-стой коагуляции. В сыворотке крови обнаруживаются повышенные уровни связанных с печенью ферментов, в частности аспартат-аминотрансферазы и аланинамино-транферазы, причем первая имеет стабильно высокий уровень и может служить диагностическим признаком. У некоторых больных заметно повышено содержание сывороточной амилазы, что свидетельствует о развивавшемся остром панкреатите. У ряда больных наблюдали гипопротеинемию, которая приводила к образованию отеков разной степени.
Геморрагический синдром проявляется в виде петехий, кровоподтеков, кровоизлияний в конъюнктиву и кровотечений из мест венопункции. Обильное кровотечение наблюдается редко. Сильная тошнота и рвота, крайняя слабость, тахипноэ, анурия и понижение температуры тела свидетельствуют о клиническом ухудшении. Смерть от шока обычно наступает через 6-9 сут после появления первых симптомов болезни.
У переживших критический период болезни пациентов постепенно клинические симптомы затухают, период выздоровления затягивается на 3-4 нед. В это время могут периодически беспокоить боли в животе, ухудшение аппетита, длительные психические расстройства, а также облысение.
Патологоанатомические изменения свидетельствуют о пантропности вирусов Эбола и Марбург. Они поражают все органы, но наиболее сильно печень и селезенку. Происходит стимуляция ретикулоэндотелиальной системы и ингибирование лимфатической системы, одновременно развиваются сосудистые изменения, ведущие к геморрагиям и к образованию тромбов в сосудах.
Почти во всех органах, за исключением поперечнополосатой мускулатуры, легких и костной системы, появляются очаговые некрозы, которые, как правило, не сопровождаются значительными воспалительными реакциями. Самые обширные некрозы отмечаются в печени и лимфатической системе. Во всех органах поражены в основном клетки паренхимы, в то время как мезенхимальные структуры поражены в меньшей степени. Патологоанатомы находят у умерших пациентов обширные участки ЖКТ, наполненные жидкостью, напоминающей кофейную гущу и частично испражнениями, похожими на деготь, при этом источник кровоизлияния, например, язвы или эрозии, не удается обнаружить. Печень и селезенка увеличены, темного цвета. На разрезе селезенки отмечается присутствие фолликул; пульпа мягкая и пористая. Печень рыхлая, при разрезе из нее свободно выливается кровь, и орган принимает светло-желтый оттенок.
При гистологическом исследовании селезенки наблюдается значительная гиперемия и стаз, пролиферация ретикулоэндотелиальных элементов в красной пульпе и образование большого количества макрофагов. Некроз красной пульпы сопровождается разрушением лимфоидных элементов. В мальпигиевых тельцах количество лимфоцитов заметно уменьшено.
При гистологическом исследовании печени отмечается обширная дегенерация и некроз клеток, гиалиновые изменения. В нескольких случаях обнаружены эозинофильные гиалиновые некротические тельца, сходные с тельцами Кунцильмана при желтой лихорадке. Купферовские клетки выглядят набухшими, с выпячиваниями, и заполнены фрагментами клеток и эритроцитами. Синусы также заполнены фрагментами клеток и в околоворотных пространствах наблюдаются скопления одноядерных клеток. Даже в момент наибольшей активности некротического процесса в печени находят регенерацию печеночных клеток. Мононуклеарная трансформация лимфоидной ткани, а также некротические поражения обнаруживаются не только в печени и селезенке, но и в почках, поджелудочной железе, половых железах, надпочечниках, гипофизе, щитовидной железе, почках и коже.
В легких находят мало последствий патологического процесса, за исключением небольших геморрагий и признаков эндартериита, особенно в небольших артериолах. Редко отмечают в различной степени выраженную бронхопневмонию.
Нейропатологические изменения ограничиваются преимущественно глиальными элементами, рассеянными по всему мозгу В веществе головного мозга наблюдаются множественные геморрагии. Глиальные поражения имеют либо пролиферативный характер в виде глиальных узлов, узелков и розеток; либо дегенеративный, проявляющийся в пикнозе или фрагментации ядра. Мозговой отек распространяется на все исследуемое вещество мозга. Отчетливая гиперемия мягкой мозговой оболочки .
Выявляемые у людей, умерших от геморрагических лихорадок Эбола и Марбург, патологические изменения ни по отдельности, ни в комбинации не характерны и не дают возможности составить определенную картину болезни. При каждой аутопсии, наряду с определением основной болезни, возможных осложнений и сопутствующих заболеваний, у патологоанатомов встает вопрос о непосредственной причине смерти. Но ее не всегда удается установить.
Лихорадка Ласса. Инкубационный период болезни продолжается от 3 до 21 сут, чаще — 7-10 сут. Болезнь начинается относительно постепенно без продромальных явлений. Ежедневно нарастают лихорадка (температура тела через 3-5 сут достигает 39-40 °С) и симптомы общей интоксикации (астенизация, мышечная боль, расстройства сознания). С первого дня болезни пациенты отмечают общую слабость, разбитость, недомогание, умеренную мышечную и головную боль. Выявляется генерализованная лимфаденопатия, в конце 1-й нед появляется сыпь розеолезного, папулезного или макулезного характера.
Длится лихорадка 2-3 нед. Характерен общий вид больного: лицо и шея гиперемированы, иногда пастозны, сосуды склер инъецированы, в 80 % случаев выявляются характерное поражение зева — на дужках миндалин и мягком небе отмечаются очаги некротически-язвенных изменений желтовато-сероватой окраски, окруженные зоной яркой гиперемии, которые могут сливаться.
'По работам W. С. Winn, D. Н. Walker (1975, 1982); R. Т. Callis et al. (1982); Е. П. Шуваловой с соавт. (2001); И. В. Борисевича с соавт. (2006).
На 5-6 сут болезни нередко появляются боль в подложечной области, тошнота, рвота, обильный жидкий, водянистый стул, иногда развивается обезвоживание. В тяжелых случаях развиваются отеки, инфекционно-токсический шок, острая сердечная недостаточность
На 2-й нед заболевания резко усиливаются симптомы интоксикации, присоединяются пневмония, отек легкого, миокардит, отек лица и шеи, геморрагический синдром, которые могут обусловить летальный исход. При обследовании в этот период клинически и рентгенологически может выявляться пневмония, нередко плевральный выпот. Пальпируется увеличенная печень, возможен асцит. Повышается активность AJIT и ACT. В крови лейкопения, тромбоцитопения, увеличивается концентрация азота мочевины.
Патологоанатомические находки не отражают тяжести клинической картины при лихорадке Ласса. Постоянными, но неспецифическими находками патологоанатомов являются следующие: гиперемия внутренних органов; отеки мягких тканей; наличие петехий, особенно их много в органах ЖКТ; плевральные выпоты; асцит; кровь в просвете тонкого кишечника, но внутреннего массивного кровотечения, объясняющего шоковое состояние больного, не обнаруживали; почки увеличены, могут иметь место геморрагии; мозг обычного веса, сосуды мозговых оболочек переполнены кровью; отек голосовых связок. Основной причиной смерти бывает острая дыхательная недостаточность и, возможно, ларингоспазм.
При гистологическом исследовании в сердечной мышце находят небольшой интерстициальный отек без признаков миокардита. В легких невыраженный отек без значительных геморрагий, в некоторых случаях слабо выраженный интерстициальный пневмонит с мононуклеарными клетками и мегакариоцитоз. Иногда обнаруживают фокальные интерстициальные скопления мононуклеарных клеток, но без классической интерстициальной пневмонии. В почках находят тубулярный и гломерулярный некрозы, типичный ишемический некроз не встречается. Селезенка уплотнена, имеется атрофия белой пульпы, скопление эозинофильного материала в белой пульпе, инфильтрация интимы селезеночных вен лимфоидными клетками. В лимфатических узлах лимфоидное истощение и дегенерация, эритрофагоцитоз. На слизистой ЖКТ обнаруживают петехии и признаки воспаления. Мозг обычно без изменений. Наиболее распространенным и заметным гистологическими изменениями при лихорадке Ласса являются многоочаговый некроз печени (небольшие очаги некроза разбросаны по долькам печени без зонального распределения, как это бывает при желтой лихорадке) и эозинофильный некроз гепатоцитов. Эти изменения сходны с теми, что наблюдаются у людей, умерших от Боливийской и Аргентинской лихорадок.
Клиническая картина и патоморфология вирусных геморрагических лихорадок у животных при искусственном инфицировании. Такие исследования проводятся для понимания механизмов инфицирования людей возбудителями ВГЛ в природных очагах, изучения патогенеза болезни и оценки эффективности схем специфического и неспецифического лечения и профилактики.
Моделирование лихорадки Эбола. В экспериментах Е. Johnson et al. (1995) изучались клиника, патологическая анатомия и патоморфология, болезни, вызванной у обезь-ян-резусов (Масаса mulatta) аэрозолем вируса Эбола (подтип Zaire) с дисперсностью частиц 0,8-1,2 мкм. Животным вводилось не менее 400 КОЕ вируса. В опытах использовано 6 обезьян. Обезьяны оставались активны и не проявляли никаких признаков болезни до начала лихорадки (39,9-40,2°С) между четвертыми и шестыми сутками после заражения. Лихорадка сопровождалась анорексией, летаргией, развитием кожной сыпи на морде, туловище и проксимальных участках конечностей. Обезьяна, получившая самую высокую дозу вируса (1465 КОЕ), погибла на третьи сутки от начала болезни (8 сут после заражения аэрозолем вируса); остальные были умерщвлены на 7, 8 и 9 сут после заражения аэрозолем вируса, когда летальный исход болезни был очевиден. Гематогические изменения заключались в лейкоцитозе и абсолютных нейтрофилии и лимфопении. На 7 сут после заражения аэрозолем вируса количество тромбоцитов падало от 288х10 3 до 124х10 3/мм3 , уровень лактатдегидрогеназы повышался в 12-16 раз, AJIT в 5 раз.
Патогистологическое исследование легких и легочных лимфатических узлов показало отчетливые признаки патологии мелкодисперсного аэрозоля (см. раз. 2.3.1.). У всех обезьян, экспонированных к аэрозолю вируса Эбола, развилась интерстициальная пневмония, совершенно отчетливо ориентированная вокруг терминальных бронхиол (бронхиолоцентрическая модель пневмонии). Обнаружены диффузный лейкоцитоз, васкулит, мульфокальный септальный некроз (multifocal septal necrosis), тромбозы, геморрагии, отек и увеличенное количество альвеолярных макрофагов. В циркулирующих и альвеолярных макрофагах найдены крупные аморфные или плеоморфные ацидофильные включения. Бронхиолоцентрическая модель пневмонии 7 , по мнению авторов исследования, характерна для ингаляционного поражения приматов мелкодисперсным аэрозолем, содержащим вирус Эбола. При иммуногистохимическом исследовании легких этих животных распределение вирусного антигена в легочной ткани также соответствовало бронхиолоцентрической модели пневмонии. Наибольшая концентрация антигенного материала располагалась в участках терминальных бронхиол. Бронхиальный и бронхиолярный эпителий, альвеолярные пневмоциты (alveolar pneumocytes) и альвеолярные макрофаги были положительны на вирус Эбола при иммунохимическом окрашивании (рис. 3.119).
Рис. 3.119. Гистология легких обезьяны, экспонированной к аэрозолю вируса Эбола. А. Окрашивание проведено смесью, содержащей мАТ к оболочке вируса Эбола. Бронхоцентрическое расположение поражения, локализованное вокруг терминальных бронхиол. Легочные макрофаги в просвете альвеол специфически окрашены. Увеличение в 100 раз. Б. Внеклеточные созревшие вирионы (V) в альвеолярных пространствах (alveolar sac, AS) и в интерстициальном пространстве (interstitial space, IS) между эпителиальными клетками I или II типа (Ер) и базальная пластинка (basal lamina). Вирусные капсиды в цитоплазме эпителиальной клетки показаны стрелкой, и участок септальной клетки (двойная стрелка). Е — эритроциты; Еп — эндотелиальные клетки. Увеличение в 15000 раз. По Е. Johnson et al. (1995)
Большое количество внеклеточного антигена вируса Эбола обнаружено на слизистой поверхности носовой полости, глотки, гортани и дыхательных путей. В трахеобронхиальных лимфатических узлах было обнаружено лимфоидное истощение, участки некроза, васкулиты, трахеиты, тромбозы и геморрагии различной степени выраженности. Цитоплазматические включения обнаружены в циркулирующих и фиксированных макрофагах. Поражения трахеобронхиальных лимфатических узлов были сопоставимы с поражениями мезентериальных узлов, что при парэнтеральном заражении не наблюдается (см. Baskerville A. et al. 1978).
Внелегочные поражения у обезьян, инфицированных аэрозолем вируса Эбола, не отличались значительно от тех, которые описали A. Baskerville et al. (1978), заражавшие обезьян внутрибрюшинно. По их данным, у обезьян-резус, забитых на вторые и четвертые сут после внутрибрюшинного инфицирования, макроскопических поражений не обнаружили. У обезьян, погибших с 5 по 12 сут после инфицирования, имела место кожная сыпь различной интенсивности на лбу, морде и щеках, на внутренней поверхности передних и задних конечностей и на груди. Кроме того, у этих четырех обезьян-резус, и двух зеленых мартышек наблюдались висцеральные петехии, хотя их распределение не было постоянным. Они чаще всего обнаруживались на деснах, слизистой оболочке рта, на плевральной поверхности и поверхности срезов легких, на поверхности серозной оболочки кишечника, в слепой и толстой кишках и в оболочке яичек. У животных имели место геморрагии в просвете тонкого кишечника и толстой кишки с изъязвлением слизистой. У одного животного были обнаружены массивные геморрагии из левого легкого в грудную полость. В желудочно-кишечном тракте животных имелись лишь небольшие количества пищи. У трех из обезьян-резус и обеих зеленых мартышек развился перитонит с локализованными ранними спайками, причем в некоторых случаях они имели место в области печени и селезенки. Печень всех погибших обезьян оказалась темной, пятнистой и рыхлой. Брыжеечные лимфатические узлы были увеличенными и геморрагическими.
Гистологические исследования печени позволили обнаружить многочисленные небольшие очаги некроза, произвольно локализующиеся в долях печени и зоны коагуляционного некроза диаметром до 0,8 мм и геморрагии на поверхности капсулы. В более сильно пораженной ткани печени четырех обезьян имел место тромбоз центральной и воротной вен. В капиллярах небольшого количества клубочков почки были обнаружены тромбы фибрина, но преобладающее поражение охватывало канальцы и более крупные кровеносные сосуды. Отмечался некроз канальцев с пикнозом ядер и фрагментацией соединительнотканных мембран под эпителием. Это поражение обнаруживалось в петлях Шумлянского — Генле и имело несимметричное очаговое распределение. Телец включений наблюдать не удалось. В прямых мочевых канальцах почек и протоках обычно обнаруживались амфорные отложения, цилиндры фибрина и пробки из осколков клеток. Клеточная инфильтрация отсутствовала.
У различных животных степень поражения легких значительно варьировала. Легкие обезьян , забитых на второй и четвертый день, были непораженными. В легких трех обезьян имели место лишь небольшие отдельные очаги некроза межальвеолярных перегородок и внутриальвеолярное образование отеков, но у остальных трех животных было обнаружено сильное спадение легкого, некроз межальвеолярных перегородок, образование отеков, отложение фибрина и геморрагии в альвеолах. В цитоплазме некоторых эпителиальных клеток альвеол в зонах повреждения были обнаружены тельца включения. Эпителий бронхов и бронхиол оказался неповрежденным во всех случаях, повреждение имело место лишь на уровне альвеол и сосудов.
Некроз лимфоидной ткани мальпигиевых телец селезенки имел место до некоторой степени у всех обезьян, он сопровождался уменьшением количества лимфоцитов в большинстве фолликулов и гиперемией красной пульпы. У пяти животных с наиболее тяжелой формой болезни, мальпигиевы тельца содержали скопления эозинофильного аморфного материала. Кроме того, имел место некроз клеток и соединительной ткани красной пульпы.
Лимфоидная ткань имела все признаки генерализованного истощения; многие лимфоидные фолликулы подвергались очаговому некрозу. Наиболее сильно пораженные лимфатические узлы, например брыжейки, имели большие участки коагуляционного некроза ткани коркового слоя и нередко также геморрагии в подкапсульных и медуллярных синусах.
У погибших животных обнаружили гиперемию и небольшие геморрагии из кровеносных сосудов слизистой и под слизистой оболочек в желудке, в подвздошной и толстой кишках. В кишечнике большинства обезьян имел место некроз с изъязвлением поверхностного эпителия, ткани слизистых желез и lamina propria. В случаях некроза слизистой оболочки он нередко распространялся на лежащие под ней пейеровы бляшки. В пораженных участках ворсинки были сморщенными и имели неправильную форму.
При микроскопическом исследовании сыпи в кожном покрове были обнаружены гиперемированные капилляры и вены и небольшие геморрагии. В некоторых участках имели место отслойка и десквамация поверхностных слоев эпидермы от базального слоя. Клеточной воспалительной реакции не отмечали.
Небольшие геморрагии были обнаружены между мышечными волокнами желудочков сердца, некоторые волокна сердечной мышцы подверглись гиалиновому перерождению. Клеточные инфильтраты отсутствовали.
Моделирование лихорадки Марбург. В экспериментах D. A. Alves et al. (2010) изучались клиника, патологическая анатомия и патоморфология болезни, вызванной у обезьян-циномолгусов ( Cynomolgus macaques) аэрозолем вируса Марбург (MARV-An-gola). Дисперсность частиц аэрозоля не указана. Животным вводилось от 2 до 705 КОЕ вируса. Температура у животных появилась в период 2-4 сут после заражения, за ней следовали кожные высыпания, сходные с теми, что бывают при парентеральном заражении. У животных развилась выраженная макулопапулярная кожная сыпь (macu-lopapular cutaneous rash), преимущественно вокруг глаз и на подбородке, на туловище, подмьшках и паховой области. К девятым суткам после заражения все животные погибли (рис. 3.120).
Рис. 3.120. Геморрагические высыпания у макак-резусов, вызванные внутримышечным заражением вирусом Марбург (Angola). А. Сыпь на 8 сут после заражения. Б и В. Сыпь на верхней конечности обезьяны на 7 и 8 сут после заражения соответственно. Заражающая доза — 1000 КОЕ. По Т. W. Geisbert et al. (2007)
Патологические изменения были сходны с теми, что наблюдали у обезьян, погибших после экспонирования к аэрозолю вируса Эбола. Поверхность легких гипере-мирована и отечна, перикардиальный выпот 3-5 мл сероангинозной жидкости, лимфатические узлы увеличены, уплотнены, имеют геморрагии, печень увеличена и выглядит жирной, пилop и дуоденум гиперемированы либо имеют геморрагии. В легких фибринозная интерстициальна пневмония, внутриальвеолярные геморрагии, разрушение альвеолярных септ различной выраженности, фокальное перибронхиальное/перибронхиолярное воспаление, включающее главным образом мононуклеарные клетки и немногочисленные нейтрофилы, смешанные с некротическим дебрисом. В одном случае воспаление распространилось на бронхиальный субэпителий с разрушением и утратой покрывающего бронхиального эпителия.
Периваскулярный отек и пульмонарную гиперемию с увеличением количества циркулирующих нейтрофилов и мононуклеарных клеток наблюдали у всех инфицированных животных. Лимфоцитолиз и лимфоидное истощение наблюдали в трахеобронхиальных, медиастинальных лимфатических узлах, селезенке и миндалинах. Поражения печени были относительно мягкими. Наблюдали умеренную гепатоцеллю-лярную цитоплазмическую вакуолизацию (hepatocellular cytoplasmic vacuolation), интерпретированную как жиро/липоидная дегенерация. В почках тубулярная дегенерация с отложением фибрина.
Моделирование лихорадки Ласса. Описание патологии, вызванной ингаляционным заражением вирусом Ласса, в открытой литературе найти не удалось. Поэтому ниже будет приведено только описание патологии, вызванной подкожным заражением макак-резусов (М. mulatto) вирусом Ласса (Josian), сделанное R. Т. Callis et al. (1982).
Обезьянам вводили по 10 5,1 КОЕ вируса Ласса, у всех животных на четвертые сутки после заражения развивались летаргия, афагия, запор и лихорадка. На седьмые сутки обнаруживались легкий конъюнктивит и высыпания на коже в виде многочисленных красных пятен неправильной формы диаметром до 1 мм, которые особенно были выражены на лице и веках. Максимальная температура тела 40,6-41,1 °С отмечалась перед понижением до субнормального уровня, после чего следовала смерть. Среднее время до гибели составляло 11 сут.
Макроскопические повреждения были вариабельными и, как правило, слабыми. Они представляли собой гиперемию легких, плевральный выпот, перикардиальный отек и гиперемии внутренних органов.
У всех животных наиболее выраженным микроскопическим поражением был многоочаговый некроз клеток печени. Распределение некротических очагов было произвольным, их размер варьировал. Они содержали от отдельных, до небольших групп гепатоцитов, подвергающихся коагулятивному некрозу, не затрагивающему опорную строму. Как правило, воспалительные клетки, инфильтрующие участки некроза, были малочисленными, представляли собой нейтрофилы и мононуклеары, которые обнаруживались также в окружающих синусоидах. Купферовские клетки в очагах некроза или поблизости от них содержали продукты клеточного распада, а иногда и эозинофильные тельца, подобные таковым Кунцильмана. У большинства животных в воротной и печеночной венах имелись небольшие субэндотелиальные мононуклеарные инфильтраты.
Другим поражением, обнаруженным у всех животных, была интерстициальная пневмония различной степени тяжести. Пневмония характеризовалась утолщением альвеолярных стенок, являющимся результатом оседания внутри перегородок эозинофильного белкового материала и (или) мононуклеарной инфильтрации. Кроме того, в некоторых перегородках имелся клеточный детрит, который вызывал предположение о некрозе эндотелиальных клеток, смешанных с инфильтратом. Содержимое альвеол варьировало: у большинства обезьян альвеолы сказались слабо инфилырован-ными макрофагами и содержали варьирующие количества отечной жидкости и/или фибрина. У некоторых обезьян были обнаружены очаговые альвеолярные геморрагии. В легочных сосудах некоторых животных наблюдали многоочаговые периваскуляр-ные, а иногда субэндотелиальные инфильтраты одноядерных воспалительных клеток.
У шести животных из девяти имели место поражения сердца. Они представляли собой многоочаговые мононуклеарные инфильтраты (от минимальных до слабых) в эпикарде и миокарде, а в некоторых случаях и в эндокарде. Эти инфильтраты состояли преимущественно из лимфоцитов с незначительным количеством плазматических клеток и макрофагов. Кроме того, у двух животных оказались слабо инфилырованными лимфоцитами и плазмацитами перикардиальные автономные ганглии.
В тонком кишечнике всех обезьян обнаруживали эритроциты, клеточный детрит и макрофаги в lamina propria кончиков ворсинок. У нескольких обезьян была отмечена минимальная периваскулярная инфильтрация одноядерных клеток в подслизистую.
Селезенки всех животных содержали относительно повышенные количества одноядерных клеток, которые концентрировались вокруг кровеносных сосудов трабекул и в трабекулярных венах субэндотелия. У пяти обезьян в мальпигиевых тельцах в центре или по периферии обнаруживался аморфный эозинофильный материал. Поражения в лимфатических узлах были незначительными и вариабельными, в основном они сводились к уменьшению количества лимфоцитов и увеличению содержания ретикулоэндотелиальных клеток.
У всех животных обнаружены поражения почек. Они выражались в многоочаговой инфильтрации вокруг кровеносных сосудов в зоне кортикомедуллярного соединения, которая распространялась на междольковые сосуды и иногда захватывала соседний интерстиций. У семи из девяти животных имели место поражения ЦНС. Они характеризовались слабыми скоплениями лимфоцитов вокруг отдельных кровеносных сосудов головного мозга, спинного мозга и мягких мозговых оболочек.
Клиническая картина вирусных геморрагических лихорадок у людей при искусственном инфицировании. Работа с вирусом Эбола строго регламентируется санитарными правилами, однако человеческий фактор не позволяет полностью исключить внутрилабораторные заражения. Одна из таких аварий произошла в Государственном научном центре вирусологии и биотехнологии «Вектор» в 2004 г 8 .
Из истории болезни: больная П., 1958 г. р., была доставлена в стационар особо опасных инфекций МСЧ № 163 (п. Кольцово, Новосибирская область).
Эпидемиологический анамнез: при подготовке использованных (для взятия крови у животных, инфицированных вирусом Эбола) инъекционных игл к утилизации сотрудница П. уколола ладонную поверхность левой кисти.
При поступлении (через 3 ч 40 мин после аварии): пострадавшая жалоб не предъявляет. При осмотре: состояние удовлетворительное, температура тела 36,4 °С, по органам без патологии, показатели гемодинамики в пределах нормы. Status localis: на ладонной поверхности левой кисти точечный след от укола.
С учетом данных эпидемиологического анамнеза и осмотра констатировано: состояние после лабораторной аварии (при работе с культурой вируса Эбола), назначено общеклиническое и вирусологическое обследование. Пациентка помещена в мельце-ровский бокс стационара особо опасных инфекций. При поступлении в приемном покое стационара пациентке была проведена специфическая профилактика иммуноглобулином Эбола из сыворотки крови лошадей (суммарная доза 12 мл) и начата комплексная терапия: противовирусный препарат (рибаверин 600 мг/сут per os), иммунологические препараты (реаферонпо 1000000 ME 2 раза в сут per os, полно кси-доний 0,006 г/сут внутримышечно), общеукрепляющие препараты (рибоксин, аско-рутин), тавегил. С момента поступления пациентки медицинский персонал стационара работал в защитных противочумных костюмах.
В течение 5 сут (инкубационный период) состояние пациентки оставалось стабильным, показатели термометрии и гемодинамики, данные лабораторных исследований — в пределах нормы. На правом предплечье (в месте проведении кожной пробы на переносимость лошадиного белка) сохранялась гиперемия диаметром 1,5 см. На 6 сут пятно с четкими, ровными краями на правом предплечье увеличилось до 2,5x3 см, не возвышающееся над поверхностью, горячее на ощупь. Появились зудящие, пятнистые высыпания на правой ягодице (в месте введения иммуноглобулина) размерами: основное пятно 1,0х 1,5 и 5 дочерних — до 0,5 см. Состояние расценено как сывороточная болезнь легкой степени. Пациентке скорригирована терапия: супрастин по 1 таб. 2/сут, местно — гидрокортизоновая мазь, амиксин 0,125 г/сут per os, тактивин по 0,5 мл/сут подкожно, общеукрепляющие препараты.
На 7 сут в 6 ч отмечен первый подъем температуры до 37,2 °С. При осмотре: жалоб нет, небные дужки и миндалины умеренно гиперемированы, имеются пятнистые высыпания на правом предплечье и ягодице. Больной поставлен диагноз: геморрагическая лихорадка Эбола (?). Сывороточная болезнь легкой степени. К терапии добавлены дексаметазон 16 мг/сут внутривенно, ципробай по 200 мг 2/сут внутривенно (для профилактики бактериальных осложнений), аскорбиновая кислота 5 % — 10 мл 2/сут внутривенно. Больной после повышения температуры до 39,1 °С (в 15 ч 30 мин) произведена катетеризация правой подключичной вены и выполнен сеанс дискретного плаз-мафереза (взято крови 530 мл, эксфузия плазмы 320 мл). Назначена инфузионная терапия: поляризующая смесь 400 мл 3/сут, раствор Рингера 400 мл + трентал 5 мл 3/сут, реополиглюкин 400 мл/сут, гепарин по 2500 ЕД 4/сут. В результате проводимой терапии состояние пациентки улучшилось, нормализовалась температура, уменьшились (регрессировали) пятнистые высыпания, однако в 0 ч температура повысилась до 38 °С. На второе введение ципробая отмечалась выраженная побочная реакция (тошнота, рвота), в связи с чем он заменен на абактал 400 мг 2/сут внутривенно.
В течение 3 сут состояние больной стабильно тяжелое, сохранялась температура до 38 °С, инъекция сосудов склер, кожные покровы чистые, бледные, небные дужки и миндалины умеренно гиперемированы, экхимозы (сине-черного цвета) в местах инъекций. В анализах отмечено увеличение СОЭ до 20 мм/ч, повышение уровня АЛТ и ACT до 58 и 215 ед/л, снижение количества тромбоцитов до 176 х 10 9 /л, общего белка до 53,8 г/л, протромбинового индекса (ПТИ) до 75,9 %, появились токсигенная зернистость нейтрофилов, белок в моче 0,07 г/л. Ежедневно проводились сеансы дискретного плазмафереза с увеличением объема до 0,5 объема циркулирующей плазмы (ОЦП) в сутки.
На 9 сут были получены результаты вирусологического обследования пациентки П. двумя независимыми лабораториями: в крови больной выявлено наличие геномной PНК вируса Эбола ПЦР-методом и наличие антигена иммуноферментным методом.
Утром на 11 сут на фоне субфебрильной температуры появились: слабость, мелкоточечная, макулопапулезная сыпь без геморрагического компонента на лице и туловище, однократная рвота «кофейной гущей» с прожилками алой крови около 200 мл, кровоточивость и экхимозы в местах инъекций, экхимозы на нижних конечностях в местах соприкосновения с твердыми предметами. В связи с развернутой клиникой геморрагической лихорадки Эбола пациентке изменена терапия. Отменены антикоагулянты прямого действия и дезагреганты, все внутримышечные и подкожные инъекции, начата профилактика ДВС-синдрома и печеночной недостаточности. Дискретный плазмаферез с замещением свежезамороженной одногруппной донорской плазмой до 0,5 ОЦП ежедневно, гемостатическая терапия (дицинон 2 мл 4/сут, глюконат кальция по 10 мл 4/сут, аминокапроновая кислота по 100 мл 3/сут), гордокс 800 тыс. ЕД/сут. Продолжена интенсивная инфузионная терапия с увеличением объема до 3,5 л/сут (реамберин, аминоплазмальгепа, 5 % раствор глюкозы, гидроксиэтил крахмал, солевые растворы).
В 16 ч 30 мин отмечен подъем температуры до 39,7 °С, однократная рвота слизью с гемолизированными сгустками крови в скудном количестве. Появились боль в горле, сухость и боль при глотании, на коже лица и туловища обильная макулопапулезная сыпь, местами сливная, на верхних и нижних конечностях мелкоточечная макулопапулезная сыпь. При осмотре состояние больной тяжелое. Отмечаются отечность век, носа, губ, гиперемия лица в виде «бабочки», склеры инъецированы, иктеричны; яркая гиперемия мягкого неба, язычка, миндалин, дужек, задней стенки глотки. В легких дыхание жесткое, хрипов нет; край печени выступает из-под реберной дуги на 2,5 см, при пальпации безболезненный; из мест инъекций серозно-геморрагическое отделяемое.
На 12 сут состояние больной оставалось стабильно тяжелым, беспокоили выраженная слабость, тахипноэ (ЧДД 30—32/мин), сухость и боль в горле, отсутствие аппетита. Пациента была заторможена, адекватна, астенична, в контакт вступала неохотно. При осмотре: температура 39,9°С, отмечалась желтушность кожных покровов, обильная макулопапулезная сыпь распространилась на кисти и голени, экхимозы в местах инъекций (от лилового до черного цвета) в размерах не увеличились, кровоточивости нет; периферические лимфоузлы не увеличены; показатели гемодинамики в пределах нормы. В течение суток прогрессировало увеличение размеров печени (край печени выступал из-под реберной дуги утром на 2,5 см, вечером — на 4 см). Печень безболезненная при пальпации и перкуссии, к вечеру изменился цвет мочи на темный («цвета пива»), диурез достаточный, стул 3/сут, оформленный, обычного цвета.
По лабораторным данным: в анализе крови снизился уровень гемоглобина до 103 г/л, СОЭ увеличилось до 38 мм/ч, токсигенная зернистость^^; время свертываемости крови (5 мин — 6 мин 30 с), время кровотечения увеличено (4 мин 30 с); в биохимическом анализе крови общий билирубин 85 ммоль/л, прямой — 35 ммоль/л, непрямой — 50 ммоль/л, AJIT — 444 ед/л, ACT — 1650 ед/л, ЛДЕ — 12180 ед/л, ЕЕТП — 970 ед/л, ЩФ — 1130 ед/л, фибриноген-сгусток не образовался, ПТИ — 51,8 %. Учитывая отсутствие геморрагического синдрома и прогрессирование печеночной недостаточности, врачебным консилиумом решено продолжить терапию за исключением гепатотоксичных препаратов (рибавирин, абактал), увеличить число сеансов дискретного плазмафереза до 2/сут. Вечером для профилактики почечной недостаточности назначен допамин 200 мг в 400 мл физиологического раствора (1—3 мкг/кг в мин) через дозатор.
На 13 сут состояние крайне тяжелое, резкая слабость, сохраняется стойкая гипертермия (39,2—39,9 °С). Больная испытывала трудности при разговоре, глотании слюны и воды из-за выраженной сухости и боли в горле. Пациентка была в сознании, заторможена, вялая, адинамичная, на вопросы отвечала скупо, чаще кивала головой.
При осмотре: лицо отечное, гиперемированное, губы цианотичные, склеры жел-тушны, инъецированы, слева — небольшие участки кровоизлияний. Слизистая полости рта сухая, язык обложен густым бело-желтым налетом, гиперемия менее яркая. Кожные покровы желтушные, новых высыпаний нет, ранка после взятия крови из пальца не кровоточит, кровоизлияния регрессируют, новых нет. Тоны сердца приглушены, ритмичные. АД 90/60 мм рт. ст., ЧСС 108/мин, ЦВД 120 мм вод. ст. (допамин 4,5 мкгДкг мин)). В дыхании участвует вспомогательная мускулатура. В легких дыхание жесткое, поверхностное, ослабленное в нижних отделах, хрипов нет. ЧДД в покое 32—36/мин, при вставании до 40/мин. SaО2 2 92-94 % на фоне ингаляции увлажненного кислорода через назальный катетер. Живот вздут, безболезненный при пальпации, перистальтика вялая. Печень выступает из-под реберной дуги на 4 см, безболезненная при пальпации и перкуссии. Газы отходят, стул самостоятельный, жидкий, зеленоватого цвета, без примеси крови. Мочится самостоятельно, диурез снижен (стимуляция лазиксом 20 мг 2/сут).
По лабораторным данным: в моче увеличилось содержание белка до 0,800 г/л. В клиническом анализе крови НЬ 93 г/л, эритроциты 2,7х 10 12 /л, лейкоциты 13,5х 10 9 , тромбоциты 180х 10 9 /л, лейкоциты палочкоядерные 25 %, лейкоциты сегментоядерные 65 %, эозинофилы 1 %, базофилы 2 %, лимфоциты 4 %, моноциты 3 %, СОЭ 42 м/ч, время свертывания 5—6 мин. Биохимический анализ крови: общий белок 59,8 г/л, альбумины 25,7 г/л, мочевина 5,4 ммоль/л, креатинин 90 мкмоль/л, AJIT — 540 ед/л, ACT — 2160 ед/л, ЛДГ — 16740 ед/л, ГГТП — 660 ед/л, фибриноген 0,4 г/л, ПТИ — 52,9 %, билирубин 99 ммоль/л, прямой — 38,6 ммоль/л, непрямой — 54,4 ммоль/л.
Тяжесть состояния больной обусловливали интоксикационный синдром, печеночно-клеточная недостаточность, паренхиматозная желтуха, дыхательная недостаточность, нарастающая почечная недостаточность, водно-электролитные нарушения. К лечению добавлен антибактериальный препарат: максипин по 2 г 2/сут.
В 17 ч состояние больной резко ухудшилось, появились боли в животе, сильная тошнота, позывы на рвоту. По всей поверхности тела появилась геморрагическая сыпь, мелкоточечные кровоизлияния, на левом глазном яблоке свежие кровоизлияния в белочную оболочку, акроцианоз. Живот умеренно вздут, при пальпации болезненный в правом подреберье и мезогастрии, симптомов раздражения брюшины нет. Печень при пальпации мягкая плотная, эластической консистенции, выступает из-под края реберной дуги на 4,5 см, перкуссия над поверхностью печени резко болезненна (патогно-моничный симптом). АД 110/60 мм рт. ст., ЧСС 125/мин. Мочится самостоятельно, в течение дня 1,1 л мочи.
В 21 ч при проведении планового вечернего сеанса дискретного плазмафереза (сеанс начат без инфузионной под держки ввиду высокого риска развития отека легких) при взятии крови состояние ухудшилось, появилось головокружение, ЧДД возросла до 40/мин (Sa0 2 — 88 %), АД снизилось до 60/40 мм рт. ст. (ЦВД — 120 мм вод. ст.), ЧСС 120/мин, из места взятия крови из пальца началась сильно выраженная кровоточивость. В связи с этим принято решение отказаться от проведения плазмафереза. Доза допамина была увеличена до 10 мкгДкг мин), назначена инфузия свежезамороженной донорской плазмы и эритроцитной массы, продолжена гемостатическая терапия. Больная попросила отдых и уснула. В 2 ч ночи (14 сут) была констатирована биологическая смерть. Заключительный клинический диагноз: геморрагическая лихорадка Эбола. Инфекционно-токсический шок. Прогрессирующая полиорганная недостаточность. Острая гепато-целлюлярная недостаточность. Паренхиматозная желтуха. Респираторный дистресс-синдром. Геморрагический синдром.
Вскрытие больной не проводилось по соображениям эпидемиологической безопасности. В табл. 3.38—3.41 приведены динамические показатели клинических анализов крови и мочи, биохимического анализа крови, времени свертываемости и времени кровотечения.
Таблица 3.38. Динамика клинических показателей крови у больной геморрагической лихорадкой Эбола
|
Показатель |
Норма |
Сутки |
|||||||
|
1 -е |
3-е |
7-е |
8 -е |
9-е |
12 -е |
13-е (утро) |
13-е (вечер) |
||
|
Гемоглобин, г/л |
120-140 |
128 |
136 |
140 |
130 |
120 |
103 |
93 |
83 |
|
Эритроциты, млн |
3,9 |
4,0 |
4,5 |
4,6 |
4,1 |
3,9 |
3,4 |
2,7 |
2,1 |
|
Цветной показатель |
0,85-1,05 |
0,96 |
0,9 |
0,91 |
0,95 |
0,92 |
0,9 |
1,03 |
0,8 |
|
Ретикулоциты, % |
2-10 |
- |
30/00 |
20/00 |
90/00 |
80/00 |
- |
70/00 |
- |
|
Тромбоциты, тыс. |
180-320 |
290,0 |
220,0 |
300,0 |
220,0 |
176,0 |
- |
180,0 |
102,0 |
|
Лейкоциты, тыс.: |
4-9 |
4,4 |
4,0 |
4,5 |
4,7 |
4,2 |
8,0 |
13,5 |
- |
|
палочкоядерные, % |
1-6 |
3 |
2 |
7 |
8 |
203 |
- |
25 |
- |
|
сегментоядерные, % |
47-52 |
66 |
63 |
67 |
72 |
58 |
- |
65 |
- |
|
эозинофилы, % |
0,5-5 |
1 |
2 |
1 |
1 |
1 |
- |
1 |
- |
|
базофилы, % |
0-1 |
- |
1 |
1 |
- |
1 |
- |
2 |
- |
|
лимфоциты, % |
19-37 |
27 |
28 |
18 |
17 |
14 |
- |
4 |
- |
|
моноциты, % |
3-11 |
3 |
4 |
6 |
2 |
53 |
- |
3 |
- |
|
Плазматические клетки, % |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
|
СОЭ, мм/ч |
2-15 |
6 |
6 |
10 |
20 |
9 |
38 |
42 |
- |
|
Токсогенная зернистость |
- |
- |
- |
- |
- |
+ |
+++ |
- |
- |
Таблица 3.39. Динамика показателей свертываемости крови у больной геморрагической лихорадкой Эбола
|
Сутки |
Показатель (норма) |
|
|
Время свертывания (8-12 мин) |
Время кровотечения (1-3 мин) |
|
|
1 |
2'50"-3'10" |
- |
|
3 |
1'50"-2'30" |
0'З0" |
|
7 |
2'30"-3'08" |
2 ' 00 " |
|
8 |
11 '00 "- 12 ' 00 " |
2 ' 00 " |
|
9 |
11'10"-12'20" |
4'00" |
|
10 |
5'00"-б'З0" |
4'30" |
|
13 (утро) |
5'00"-б'00" |
- |
|
13(вечер) |
б'З0"-7'20" |
24'30" |
Таблица 3.40. Динамика клинических показателей мочи у больной геморрагической лихорадкой Эбола
|
Показатель |
Сутки |
||||||
|
1 -е |
3-е |
7-е |
8 -е |
9-е |
10 -е |
13-е |
|
|
Цвет |
с/ж |
с/ж |
с/ж |
с/ж |
с/ж |
с/ж |
с/ж |
|
Прозрачность |
прозр. |
прозр. |
прозр. |
прозр. |
прозр. |
прозр. |
мутн. |
|
Отн. плотность |
1021 |
1006 |
1017 |
- |
- |
- |
- |
|
Реакция |
кисл. |
щел. |
кисл. |
кисл. |
кисл. |
кисл. |
щел. |
|
Белок |
abs |
abs |
abs |
0,07 г/л |
0,11 г/л |
0,18 г/л |
0,80 г/л |
|
Глюкоза |
abs |
abs. |
abs |
abs |
abs |
СЛ.+ |
СЛ.+ |
|
Эпителий плоский |
един. |
един. |
един. |
един. |
един. |
един. |
много |
|
Лейкоциты |
един. |
един. |
2-3 |
2-3 |
един. |
2-3 |
2-3 |
|
Эритроциты |
abs |
abs |
abs |
abs |
abs |
abs |
Неизм. един. |
Таблица 3.41. Динамика биохимических показателей в сыворотке крови у больной геморрагической лихорадкой Эбола
|
Показатель |
Норма |
Сутки |
|||||||||
|
1 -е |
3-е |
6 -е |
7-е |
8 -е |
9-е |
10 -е |
11 -е |
12 -е |
13-е |
||
|
Общ. белок |
65-85 г/л |
77,6 |
72,8 |
80,7 |
78,5 |
63,7 |
60,3 |
53,8 |
67,6 |
65 |
59,8 |
|
Альбумин |
55-62,7 % |
46,4 |
38,8 |
43,0 |
40,3 |
35,3 |
34,9 |
29,6 |
32,0 |
30,6 |
25,7 |
|
Мочевина |
2,8 - 6,6 ммоль/л |
6,1 |
5,6 |
4,8 |
5,3 |
6,8 |
4,9 |
4,4 |
3,6 |
4,0 |
5,4 |
|
Креатинин |
44-97 мкмоль/л |
66 |
82 |
100 |
117 |
92 |
94 |
91 |
70 |
60,0 |
90 |
|
Билирубин общий: |
до 20,5 мкмоль/л |
9,6 |
12,0 |
14,6 |
13,3 |
8,2 |
7,6 |
12,3 |
14,0 |
85,0 |
99 |
|
прямой |
до 4,5 мкмоль/л |
4,9 |
35 |
38,6 |
|||||||
|
непрямой |
9,7 |
50 |
54,4 |
||||||||
|
АЛТ |
0-40,6 ед/л |
13 |
13 |
И |
И |
12 |
24 |
58 |
202 |
444 |
540 |
|
ACT |
0-39,0 ед/л |
22 |
22 |
22 |
39 |
49 |
83 |
215 |
720 |
1560 |
2160 |
|
лдг |
248-496,9 ед/л |
- |
1481 |
12180 |
16740 |
||||||
|
ггд |
7-50 ед/л |
- |
970 |
660 |
|||||||
|
ЩФТ |
80-295 ед/л |
83 |
85 |
67 |
68 |
116 |
260 |
ИЗО |
|||
|
Амилаза |
0-220 ед/л |
120 |
105 |
98 |
108 |
127 |
163 |
218 |
246 |
||
|
Тимоловая проба |
0-4 ед. |
1,3 |
1,3 |
1,5 |
0,8 |
0,8 |
0,5 |
0,1 |
0,3 |
2,9 |
|
|
ПТИ |
80-100 % |
115 |
105 |
108 |
99,3 |
101 |
84,7 |
75,9 |
74,1 |
51,8 |
52,9 |
|
Фибриноген |
2-4 г |
3,3 |
2,7 |
3,8 |
3,3 |
2,7 |
2,7 |
2,2 |
1,11 |
сгустка нет |
до 0,4 |
|
Глюкоза |
4,44-6,66 ммоль/л |
4,8 |
5,9 |
||||||||
Опыт ведения больной лихорадкой Эбола показал неэффективность использованных схем специфической профилактики и лечения даже при немедленном установлении факта заражения.
Диагностика искусственного поражения возбудителями геморрагических лихорадок. Должна проводиться на основе установления «невозможной эпидемиологии болезни» и «невозможной клинической формы болезни» (см. разд. 2.3.1).
Любой иммунологически и генетически подтвержденный диагноз геморрагической лихорадки, возбудитель которой не встречается на территории России, служит основанием для предположения о совершенном биологическом нападении, если:
1) заболевший в течение месяца перед появлением лихорадки не выезжал в страны, эндемичные по данной болезни;
2) в этот же период времени он не находился в контакте с таким же больным, который мог контактировать с лицами, приехавшими из стран, где распространена данная болезнь;
3) заболевший не работал с возбудителем данной болезни в вирусологической лаборатории;
4) не контактировал с животным, привезенным из местности, эндемичной по данной болезни.
При расследовании такого преступления необходимо иметь в виду, что парентеральное введение возбудителей лихорадок Эбола, Марбург и Ласса не оставляет следов, так как очагов некроза в месте инъекции вируса не образуется. Клиническая картина болезни в этом случае не отличается наблюдаемой у пациентов, заразившихся в природных очагах болезни. Основными критериями установления преднамеренного распространения возбудителей геморрагических лихорадок будут анамнез пациента (упоминание им медицинских манипуляций, сопровождающихся парентеральным введением каких-то «лекарств») и доказанная «невозможная эпидемиологии болезни». Для доказательства последней надо учитывать сложность экологии возбудителей геморрагической лихорадок и возможность расширения их ареалов в связи с изменением климата и техногенного воздействия на окружающую среду. Прежде чем выдвинуть предположение о «невозможной эпидемиологии» обнаруженной/новой геморрагической лихорадки, необходимо провести исчерпывающее эпидемиологическое исследование и убедиться в том, что вирус не имеет на территории, где зарегистрирована вспышка вызванной им болезни ранее неизвестного природного резервуара. Обнаружение уже задепонированных в зарубежных коллекциях штаммов вирусов свидетельствует о «невозможной эпидемиологии» вспышки.
Поражение мелкодисперсными аэрозолями вирусов Эбола и Марбург можно предположить по наличию характерного патологического процесса в легких («невозможная клиническая форма болезни»). У людей, заразившихся этими вирусами в природных очагах, легочная ткань обычно оказывалась не вовлеченной в первичный инфекционный процесс. Поражения легких у них были вызваны гематогенным заносом возбудителя болезни в легочную ткань и повышением проницаемости эндотелиальной выстилки кровеносных сосудов из-за высвобождения цитокинов и хемокинов инфицированными макрофагами. Поэтому для таких поражений характерны мало-выраженные геморрагии в легочной ткани и эндартериит небольших артериол.
Моделирование заражения мелкодисперсными аэрозолями вирусов Эбола и Марбург, выполненное на приматах, позволяет предположить, что при поражении мелкодисперсными аэрозолями этих вирусов у погибших людей на вскрытии будет обнаружена выраженная интерстициальная пневмония, ориентированная вокруг терминальных бронхиол (бронхиолоцентрическая модель пневмонии). Возможно обнаружение некротических изменений в эпителии бронхиол и мелких бронхов, и в трахеобронхиальных и медиастинальных лимфатических узлах, сопоставимых с поражениями лимфатических узлов брюшной полости. Установить по клинической и патологоанатомической картине болезни факт ингаляционного поражения человека вирусом Ласса сложно. Результаты моделирования болезни на приматах показывают, что легкие могут вовлекаться в инфекционный процесс и при парэнтеральном заражении. Для доказательства ингаляционного поражения человека вирусом Ласса недостаточно установить только факт развития интерстициальной пневмонии. У людей, заразившихся вирусом лихорадки Ласса в природном очаге болезни, пневмония начинается на второй неделе болезни. Можно предположить, что у людей, пораженных мелкодисперсным аэрозолем вируса Ласса, пневмония будет развиваться как первичный процесс, и поэтому она может быть обнаружена рентгенологически еще в первую неделю болезни, после появления лихорадки. У погибших пациентов, кроме очагов интерстициальной пневмонии, возможно обнаружение обширных поражений трахеобронхиальных и медиастинальных лимфатических узлов.
Обнаружение генетически измененных штаммов возбудителей ВГЛ, однозначно свидетельствует об искусственном происхождении вспышки болезни.
Иммунопрофилактика вирусных геморрагических лихорадок. Не разработана, и, видимо, будет разработана еще не скоро из-за особенностей иммунных ответов на возбудители этих болезней (см. «Иммунитет к возбудителям ВГЛ»).
Лечение вирусных геморрагических лихорадок. Лечение ВГЛ в основном сводится к поддерживающей терапии, поддержанию водно-солевого баланса и гемодинамики. Army FM 8-284 (2000) рекомендует обратить особое внимание на поддержание баланса жидкостей и электролитов, противошоковые мероприятия, возмещение потери крови, предотвращение развития почечной недостаточности у пациентов. Лечение таких больных может потребовать интенсивный уход и специфические вмешательства, такие как механическая вентиляция легких, диализ и неврологическая помощь. При диссеминированной внутрисосудистой коагуляции рекомендуется терапия гепарином. Но ее роль считается не бесспорной, и ее рекомендуется применять только у больных с клинически значимым кровотечением и лабораторным подтверждением диссеминированной внутрисосудистой коагуляции. Аспирин и другие препараты, обладающие антиагрегантным действием, противопоказаны, как и любые внутримышечные инъекции. Использование внутрисосудистых устройств рекомендуется рассматривать в контексте соотношения потенциальной пользы и риска кровотечения.
Возможности специфической антивирусной терапии ограничены. Препаратов, эффективных в отношении филовирусных инфекций, нет. Определенные надежды возлагаются в отношении препаратов, эффективных против Arenaviridae и Bunya-viridae, в частности, на рибавирин. Результаты исследований эффективности рибавирина в условиях in vitro и клинических исследований, свидетельствуют в пользу в/в введения рибавирина при лечении лихорадки Ласса, ГЛПС (вирус Хантаан) и ККГЛ. При лихорадке Ласса и ККГЛ назначается ударная доза рибавирина, 30 мг/кг в/в, с последующими 16 мг/кг в/в каждые 6 ч в течение 4 сут, а затем 8 мг/кг в/в каждые 8 ч в течение 6 сут для завершения 10-дневного курса лечения. Лечение больных с ГЛПС может дать положительный результат, если лихорадка длилась не более шести дней. Назначается ударная доза рибавирина, 33 мг/кг в/в, с последующими 16 мг/кг в/в каждые 6 ч в течение 4 сут, а затем 8 мг/кг в/в каждые 8 ч в течение 3 сут для завершения 7-суточного курса лечения.
В качестве химиопрофилактики после экспонирования для Конго-ККГЛ и лихорадки Ласса Army FM 8-284 (2000) рекомендует использовать рибавирин, 500 мг перорально каждые 6 ч в течение 7 сут.
Библиографическое описание. Супотницкий МВ. Вирусные геморрагические лихорадки. В кн.: Супотницкий МВ. Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений. М.: "Кафедра", "Русская панорама"; 2013. С. 887–927.
1 Сотрудники US Army Medical Research Institute of Infectious Diseases, Fort Detrick, Maryland, США.
2 Считаю существенным упущением этих исследований то, что не были изучены почвенные простейшие как возможный первичный резервуар филовирусов. Если исследователей заинтересовала резервуарная роль растений, значит связь между ними и заражением позвоночных животных предполагалась. Филовирусы не живут в растительных клетках, но они могут проникнуть в растения вместе с почвенной водой, содержащей инфицированные простейшие.
3 В московских зоомагазинах М. natalensis продают как корм для рептилий.
4 Прежде всего они «не интересны» разработчикам вакцин против гриппа (феномен OAS), ВИЧ (феномены OAS и ADE), гепатита С (феномен ADE) и энцефалитов, вызываемых флавивирусами (феномен ADE).
5 Выявление в плазме крови D-димера свидетельствует об активации фибринолиза. Определение в плазме D-димера используется для исключения тромбоза и диагностики ДВС-синдрома.
6 По работам Marburg and Ebola... (1977); Е. П. Шуваловой с соавт. (2001); L. Borio et al. (2002); И. В. Борисевича с соавт. (2006).
7 Термин «бронхиолоцентрическая модель пневмонии», предложенный Е. Johnson et al. (1995), можно рассматривать как синоним используемого в этой книге термина «патология мелкодисперсного аэрозоля».
8 Использована работа А. А. Акинфеевой с соавт (2005).
