Почему мы не победим вич, спид-пандемию
PDF версия статьи на украинском языке:
Часть I. Iнфекцiйнi хворобию. — 2012. — № 1 (67). — С. 88–96.
Часть II. Iнфекцiйнi хворобию. — 2012. — № 2 (68). — С. 104–114.
Принципиальное отличие ВИЧ/СПИД-пандемии от пандемических процессов, в борьбе с которыми были достигнуты успехи в ХХ столетии, заключается в том, что она вызвана вирусом из семейства ретровирусов. Ретровирусы представляют собой древние инструменты эволюции. Вызываемые ими эпидемии (эпизоотии) составляют основной механизм прерывистой эволюции видов. Этот механизм реализуется эндогенизацией ретровирусов в геноме выживших видов и наращиванием их генома посредством образования новых копий ретроэлементов; усложнением генома путем образования новых экзонов из интронов и/или увеличения количества генов, подвергающихся альтернативному сплайсингу. Эволюционное прошлое иммунной системы многоклеточных организмов свидетельствует о закреплении за ней естественным отбором резервуарной роли по отношению к ретровирусам. Благодаря клеткам иммунной системы происходит размножение и накопление экзогенных ретровирусов до какой-то критической массы, которая позволяет некоторым из них эндогенизироваться в зародышевой линии отдельных особей инфицированного вида, и в дальнейшем передаваться вертикально, меняя его эволюционную траекторию. ВИЧ/СПИД-пандемия среди вида Homo sapiens — частное проявление этого процесса в эволюции таксона приматов. Инфекционный и эпидемический процессы, вызванные ВИЧ, представляют собой многокомпонентные нециклические процессы, не имеющие механизмов терминации. Для борьбы с ними не применим опыт, накопленный в ХХ столетии при ликвидации натуральной оспы или при осуществлении контроля над вспышками гриппа, чумы и других циклических инфекций. Приведенные в статье данные показывают необходимость разработки самостоятельной стратегии борьбы с нециклическими многокомпонентными эпидемическими процессами.
Библиографическое описание: Супотнiцький М.В. Чому ми не здолаемо ВIЛ/СНIД (Почему мы не победим ВИЧ/СПИД-пандемию) // Iнфекцiйнi хворобию. — 2012. — № 1 (67). — С. 88–96; № 2 (68). — С. 104–114.
SUMMARY. The principal difference between HIV/AIDS pandemic on pandemic processes in dealing with what were the achievements of the twentieth century is that it is caused by a virus from a family of retroviruses. Epidemics (epizootics) caused by retroviruses, is the main mechanism of intermittent evolution of species. This mechanism is endogenous of retroviruses in the genomes of species that survive, and to increase their genome through the formation of new copies retroelements; complexity of the genome through formation of new exons from introns and/or increasing the number of genes undergoing alternative splicing. History evolution of the immune system is a multicellular organisms suggests fixing her natural selection as a tank to retroviruses. Cells of the immune system is reproduct and accumulat of exogenous retroviruses to some critical mass witch gets some of them to endogenous response in the germ line of individuals infected species continue to be transmitted vertically, changing its evolutionary trajectory locus. HIV/AIDS pandemic among the species of Homo sapiens — a single manifestation process in the evolution of primate taxon. Infectious and epidemic processes caused by HIV, is a multicomponent acyclic processes that don't have mechanisms for termination. By combat of them, can not apply the experience gained in the twentieth century with the elimination of smallpox or by monitoring the outbreak of influenza, plague and other cyclical infections.
Bibliographical description: Supotnitskiy М.V. Why we can not fight HIV/AIDS pandemic // Infectious Diseases (Ukraine). — 2012. — № 1 (67). — P. 88–96; № 2 (68). — P. 104–114.
Ситуация с распространением ВИЧ/СПИД-пандемии на территории России и Украины с каждым годом ухудшается. В тоже время со стороны эпидемиологического сообщества обеих стран не наблюдается никаких попыток переосмыслить общепринятое понимание этой пандемии, как типовой медицинской проблемы. В качестве примера успешности ее преодоления нам приводят результаты борьбы с натуральной оспой и с другими инфекциями, способными к самоограничению и контролируемыми вакцинацией. Учебные пособия, по которым ведется подготовка будущих врачей, не дают им понимания даже того, что ВИЧ/СПИД-пандемия чем-то отличается от других пандемических процессов. Цель настоящей работы — показать, что проблема ВИЧ/СПИД-пандемии не просто выходит за рамки подходов, позволивших добиться успехов в снижении инфекционной заболеваемости в ХХ в., но и имеет принципиально иной характер.
Прежде всего, в понимании сложности проблемы ВИЧ/СПИД-пандемии игнорируется то, что вызвавший ее вирус иммунодефицита человека (ВИЧ) представляет собой ретровирус — т. е. он относится к семейству РНК-вирусов, образующих с помощью фермента обратной транскриптазы ДНК-копию своего генома (провирус), интегрирующуюся с геномом человека в единую молекулу ДНК. Ни один из других ранее открытых вирусов, вызывающих пандемии и эпидемии (натуральной оспы, гриппа и др.), такой способностью не обладает. До завершения проекта «Геном человека» в 2000 г. это обстоятельство принималось во внимание только как особенность самого ВИЧ. Но после того как геном человека был расшифрован, стало ясно, что, структуры, подобные провирусу ВИЧ, обобщенно называемые ретроэлементами, занимают не менее 42% генома человека, т. е. почти его половину [1] . Все они, как и ВИЧ, экспрессируют (либо экспрессировали раньше) обратную транскриптазу и распространяются (распространялись) по геному в два этапа: образование РНК-транскрипта и его транскрибировавание «обратно» в ДНК-транскрипт, встраивающийся в хромосому (Bannert N., Kurth R., 2004).
Что бы понять насколько близко друг от друга по структуре и механизму функционирования находятся ВИЧ и ретроэлементы генома человека, сопоставим их организацию.
ВИЧ имеет три основных структурных гена, кодирующих вирусные протеины в следующем порядке: 5'-gag-pol-env-3':
ген gag — кодирует белки, формирующие «сердцевину» вируса (необходимы для внутриклеточной сборки вируса и его высвобождения из клетки);
ген pol — кодирует ферментную систему вируса (обратную транскриптазу — p66/51; интегразу — p31/33; рибонуклеазу — p31/33);
ген env — определяет способность вируса выходить за пределы клетки и инфицировать другие клетки. Кодирует белки предшественника оболочки вируса — gp160, расщепляющиеся на gp120 и gp41.
Имеются последовательности, необходимые для реализации механизма обратной транскрипции:
1) прямые повторы на 5'- и 3'-концах РНК (LTR — он действует как единица промоции, необходим для транскрипции всего вирусного генома и начала транскрипции отдельных вирусных генов);
2) последовательность из 80–120 нуклеотидов, соседствующая с 5'-концевым прямым повтором (U5);
3) последовательность из 170–1200 нуклеотидов, соседствующая с 3'-концевым прямым повтором (U3);
4) последовательность из 15–20 нуклеотидов (Р), в пределах которой клеточная тРНК спаривается с ретровирусной РНК, что создает праймер для синтеза первой цепи ДНК;
5) сегмент Рu, находящийся непосредственно перед повтором U3 и являющийся сайтом для праймирования второй цепи ДНК.
У ВИЧ шесть регуляторных генов:
tat (transactivator of transcription) — кодируемый им белок является наиболее активным регулятором, обеспечивающим усиление в 1000 раз репликации вируса и регулирующий экспрессию клеточных генов;
rev (regulator of expression of virus proteins) — кодируемый им белок избирательно активирует синтез структурных белков вируса, обеспечивает экспорт из ядра длинных молекул вирусной РНК. На поздних стадиях ВИЧ-инфекции он замедляет синтез регуляторных белков;
nef (negative regulatory factor) — при взаимодействии с LTR кодируемый им белок замедляет транскрипцию вирусных генов. Синхронная функция nef и tat регулируют репликацию вируса таким образом, чтобы она не приводила к гибели клетки-хозяина. Экстрацеллюлярный белок Nef увеличивает миграцию моноцитов, тем самым, способствуя распространению по организму ВИЧ и прогрессированию болезни;
vif (virion infectivity factor) — кодируемый им белок необходим для образования функционально полноценных вирусов в определенных типах клеток на поздней стадии инфекции. Белок Vif включается в состав новых вирусов;
vpr — кодируемый им белок вызывает остановку клеточного цикла, способствует входу в ядро прединтеграционного комплекса. Vpr включается в новые вирусы в большом количестве, способен в некоторой степени усиливать экспрессию генов ВИЧ и нарушать экспрессию отдельных клеточных генов;
vpu для ВИЧ-1 (vpx для ВИЧ-2) — кодируемый им белок разрушает комплекс gp120/CD4; снижает экспрессию CD4; способствует высвобождению вируса; усиливает продукцию вируса в клетке.
Длинные концевые повторы или LTR (long terminal repeats) — это прямые повторяющиеся последовательности на концах ДНК-копии генома ретровирусов. Каждый такой повтор состоит из трех элементов: U3-R-U5, длина которых составляет соответственно 170–1250, 10–80 и 80–100 т. п. н.; 3'-конец U5 сам содержит короткий инвертированный повтор, гомологичный последовательности на 5'-конце элемента U3, т. е. сама последовательность LTR фланкирована короткими инвертированными повторами; LTR участвуют в интеграции ДНК-копии генома ретровируса в геном клетки-хозяина, кроме того, область U3 каждого LTR несет промотор, причем промотор левого LTR участвует в транскрипции ДНК провируса, а промотор правого — последовательности ДНК клетки-хозяина вблизи сайта интеграции ретровируса. LTR фланкируют сложные элементы генома и участвуют в процессе их транспозиции (Khodosevich K. et al., 2002).
Ретротранспозируемые элементы (ретроэлементы) генома человека делят на две большие группы: способные к автономному существованию и неавтономные.
Выделены два класса автономных ретроэлементов:
LTR-элементы (LTR-elements) — составляют до 8,3 % генома человека. К ним относятся ретротранспозоны (retrotransposons), эндогенные ретровирусы (endogenous retroviruses, ERVs), человеческие эндогенные ретровирусы (human endogenous retroviruses, HERVs) и повторяющиеся элементы эндогенных ретровирусов человека (repeat elements with HERV origin), такие как SINE-R ретропозоны (SINE-R retroposons);
не-LTR (non-LTR) — очень древние ретроэлементы. Широко представлены в геноме простейших организмов. В геноме человека на них приходится 33,9% ДНК. Это короткие вставочные элементы (short interspersed elements, SINE; их еще называют короткими ретропозонами) с преобладанием Alu- и MIR-повторов; и длинные терминальные вставочные повторы (long-terminal interspersed elements, LINE), представленные автономными L1 и L2 последовательностями.
Неавтономные ретротроэлементы не кодируют белков. К ним относятся Alu-повторы (в геноме человека их более миллиона); псевдогены, образовавшиеся в результате обратной транскрипции; и SVA-элементы (аббревиатура от заглавных букв SINE-R, VNTR и Alu, описаны как «композитные ретропозоны»). Для своей транспозиции они нуждаются в активности автономных ретроэлементов. Например, SVA-элементы ретротранспозируются с помощью L1-транспозонов (Ostertag E . M ., Kazazian H ., 2001). Классификация и взаимосвязь ретроэлементов приведены на рис. 1.
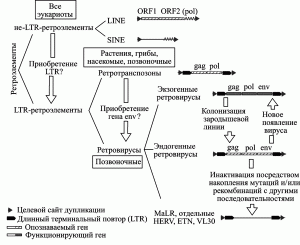 Рис. 1. Классификация и взаимосвязь ретроэлементов. Короткие прямые повторы фланкируют все ретроэлементы, интегрировавшиеся с геномом хозяина через транспозицию. ORF — открытая рамка считывания. VL30, ETN — повторяющиеся LTR-элементы, найденные у мышей. MaLR — LTR-ретротранспозон, обнаруженный у млекопитающих. По N. de Parseval и T. Heidmann (2005)
Рис. 1. Классификация и взаимосвязь ретроэлементов. Короткие прямые повторы фланкируют все ретроэлементы, интегрировавшиеся с геномом хозяина через транспозицию. ORF — открытая рамка считывания. VL30, ETN — повторяющиеся LTR-элементы, найденные у мышей. MaLR — LTR-ретротранспозон, обнаруженный у млекопитающих. По N. de Parseval и T. Heidmann (2005)
Границы между эндогенными и экзогенными ретровирусами, между ретротранспозонами и ретровирусами, между LTR- и не LTR-элементами, можно провести только на момент времени, воспринимаемый человеком. По мере масштабирования времени в пределы, вмещающие геологические эпохи, границы между ними становятся менее ясными. Геном человека представляет собой единственную правдивую летопись, в которую вписаны все события, совершавшиеся в ходе его эволюции. Рассмотрим их на примере трех ретроэлементов из представленных на рис. 1.
Эндогенные ретровирусы. «Молодые» HERV структурно почти ничем не отличаются от интегрировавшейся с геномом человека ДНК копии ВИЧ, за исключением мутаций, блокирующих их способность образовывать вирусные частицы (например, в гене env) и, соответственно, передаваться горизонтально, как это происходит при ВИЧ-инфекции.
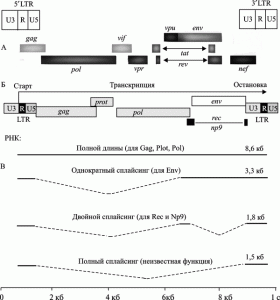 Рис. 2. Схема генома ВИЧ и эндогенного ретровируса HERV-K (HML-2). А. Геном ВИЧ. По S. McBurney, T. Ross (2008). Б. Геном «молодого» эндогенного ретровируса HERV (HML-2). В. Различные типы провирусных транскриптов. По A. Buzdin (2008)
Рис. 2. Схема генома ВИЧ и эндогенного ретровируса HERV-K (HML-2). А. Геном ВИЧ. По S. McBurney, T. Ross (2008). Б. Геном «молодого» эндогенного ретровируса HERV (HML-2). В. Различные типы провирусных транскриптов. По A. Buzdin (2008)
«Молодыми» эндогенные ретровирусы считаются, если им менее 5–6 млн. лет, т. е. они интегрировались с геномом гоминоидов уже после дивергенции каких-то предковых видов приматов на гоминоидов и современных обезьян. Эндогенизация экзогенных ретровирусов (типа современного ВИЧ), происходит через их проникновение в зародышевую линию. Процесс носит случайный характер, и о нем мало что известно. По крайней мере, представители 31 семейства HERV, обнаруженные в геноме современного человека, интегрировались с геномом его эволюционных предков в результате самостоятельных инфекционных процессов (Belshaw R. et al., 2005). Наиболее молодое семейство эндогенных ретровирусов — HERV-K, проникло в геном современного человека 100 тыс. лет назад. Провирус локализован в хромосоме 19 (19p13.11) и не полностью зафиксирован в человеческих популяциях. Провирус весьма распространен среди людей, живущих в Африке, Азии и Полинезии. HERV сохраняют свою активность в геноме человека, например, HERV-К10 способен формировать ретровирусные частицы. Индукция его мРНК возможна в клетках рака молочной железы человека путем добавления прогестерона и эстрадиола. Рассмотрение механизмов активации HERV не входит в задачу данной работы.
Показательна история эндогенного ретровируса семейства ERV9 (рис. 3).
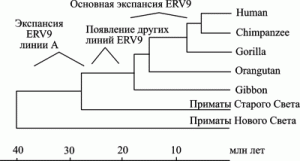 Рис. 3. Эволюционная история эндогенного ретровируса семейства ERV9 на фоне эволюционного древа приматов. По J. Costas, H. Naverira (2000)
Рис. 3. Эволюционная история эндогенного ретровируса семейства ERV9 на фоне эволюционного древа приматов. По J. Costas, H. Naverira (2000)
Экспансия ERV9 (линия А ретровируса) в геноме предковых видов современных приматов Старого Света началась 38-30 млн. лет назад. Но наиболее активно экспансия ERV9 по геному приматов осуществлялась в период их дивергенции от гиббонов на высшие виды обезьян (16–6 млн лет назад). Максимум транспозиционной активности семейством ERV9 достигнут 8–6 млн лет назад, затем это ретровирусное семейство «угасло». В геноме современного человека сохранились более сотни дефектных ERV9 и, по крайней мере, 4 тыс. одиночных LTR (solitary LTRs), возникших благодаря гомологичной рекомбинации между 5'- и 3'-LTR полноразмерных ERV9, рассеянных по геному приматов в эволюционном прошлом (Lopez-Sanchez P. et al., 2005).
Ретровирусы могут возвращаться в эволюционную линию. Семейство HERV-K(HML-2) впервые интегрировалось с геномом приматов, предков современного человека, около 30 млн лет назад. Отдельные провирусы, сохранившиеся с первого «пришествия» этого семейства, у современного человека напоминают о себе вирусоподобными частицами, продуцируемыми клетками злокачественной опухоли — тератокарциномы (human teratocarcinoma cells). HERV-K(HML-2) «вернулся» в геном приматов Старого Света 6 млн лет назад. Зародышевую линию человека семейство инфицировало 100 тыс. лет назад (HERV-K113) (Turner et al., 2001). Каким образом HERV управляют генами своего нового хозяина, показано на схеме (рис. 4).
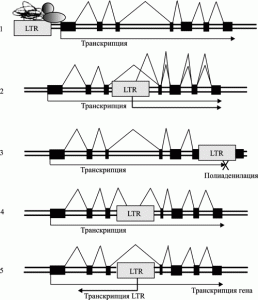 Рис. 4. Потенциальные механизмы контроля генов генома человека эндогенными ретровирусами. 1. Регуляция транскрипции генов через активность энхансеров. 2. Введение новых промоторов. 3. Введение новых полиаденилационных сигналов (терминируют действие РНК-полимеразы второго типа). 4. Разрушение интрон-экзонной структуры существовавших генов. 5. Регулирование экспрессии генов посредством РНК-интерференции. По A. Buzdin (2008)
Рис. 4. Потенциальные механизмы контроля генов генома человека эндогенными ретровирусами. 1. Регуляция транскрипции генов через активность энхансеров. 2. Введение новых промоторов. 3. Введение новых полиаденилационных сигналов (терминируют действие РНК-полимеразы второго типа). 4. Разрушение интрон-экзонной структуры существовавших генов. 5. Регулирование экспрессии генов посредством РНК-интерференции. По A. Buzdin (2008)
Так как область U3 каждого LTR несет промотор, то LTR не только фланкируют сложные элементы генома и участвуют в процессе их транспозиции, но и включаются в управление генами, прилегающими к области U3 HERV (табл. 1).
Таблица 1
Примеры вовлечения ретровирусных последовательностей в регуляцию генов клеточных белков*
|
Элемент |
Ген (промотор) |
Функциональная роль |
|
HERV-E |
Mid1 |
Opitz-syndrome |
|
HERV-E |
Аполипротеин С1 |
Печень и другие ткани |
|
HERV-E |
Эндотелин-В рецептор |
Плацента |
|
HERV-E |
Плелотрофин |
Трофобласты |
|
HERV-L |
бета1,3-галактозилтрансфераза |
Толстая кишка, молочная железа |
|
ERV II |
BAAT (трансфераза) |
Метаболизм |
|
ERV I |
Ароматаза |
Плацентарный эстрогенный синтез |
|
ERV III |
Карбоновая ангидраза 1 |
Эритроид-карбон метаболизм |
|
LTR + LINE-2 |
Шаперонин (сhaperonin) |
McKausick-Kaufman синдром |
|
HERV |
INSL4 (семейство инсулинов) |
Плацента |
* По N. Bannert, R. Kurth (2004).
Интересна роль эндогенных ретровирусов в размножении плацентарных животных и человека. В плаценте оболочечные белки эндогенных ретровирусов выполняют роль белков слияния. Они экспрессируются в синцитиотрофобластном слое (syncytiotrophoblast layer), образованном посредством слияния мононуклеарных цитотрофобластов, и образуют участки синцития в тех участках плаценты, где начинается взаимодействие матери и плода (Dunlap K. et al., 2006). Эти данные свидетельствуют о том, что информация, определяющая целостное развитие эмбриона человека, хотя и содержится в зиготе, но только как некая потенция, которая не реализуется без участия эндогенных ретровирусов матери.
Прежде чем мы перейдем к пониманию роли транспозируемых элементов в эволюции человека, отмечу, что большинство из «недавно» проявивших активность ретроэлементов составляют L1 и Alu. «Пик» их размножения в эволюционно предшествующих человеку видах имел место 60 млн лет назад (Deininger Р., Batzer М., 2002). Их активности предшествовала активность ДНК-транспозонов. Основная масса ДНК-транспозонов (85 %; примерно 291 тыс. элементов) распространились среди млекопитающих — эволюционных предков человека еще в Меловом периоде (135–66 млн лет назад), когда происходило вымирание рептилий. Исследователи не обнаружили в геноме приматов ДНК-транспозоны «моложе» 37 млн лет (Pace II J. K., Feschotte С., 2007).
Ретротранспозоны L1. Обнаруженные в геноме современного человека L1-ретротранспозоны имеют свою собственную эволюционную историю, насчитывающую не менее 100–150 млн лет (Furano A.V., 2000; Han K. et al., 2005); т. е. в известном нам виде они существовали у класса млекопитающих еще во времена господства рептилий. Образуют 16 различных семейств (L1PA16–L1PA1). Их активность в геноме человека значительно большая, чем HERV. Вставочная история L1-элементов генома человека в основном написана семейством Ta-1, составляющим до 90 % их популяции. Это семейство содержит значительно большее количество полноразмерных транспозонов, чем другие. Эффективно дуплицируя сами себя, L1 играют ключевую роль в увеличении генома вида посредством размножения нетранспозируемых Alu- и SVA-элементов и образования ретропсевдогенов.
Кроме увеличения генома L1 способны управлять генами. Отдельные L1 имеют антисмысловые Pol II-промоторы, которые влияют на экспрессию находящихся в непосредственной близости генов. Другие L1 могут выполнять функции энхансеров и регулировать гены, находящиеся на некотором расстоянии от них. L1 Случайно вставившись в последовательность гена, L1 может блокировать его экспрессию и вызвать генетическую болезнь. Такой же эффект может иметь место в результате дупликации или делеции гена после неправильной гомологичной рекомбинации, спровацированной активностью L1 (Ostertag E. M., Kazazian H., 2001).
Примером участия L1-ретротранспозонов в эволюции человека является образование секретируемых форм человеческого трансмембранного белка аттрактина (attractin). L1-ретротранспозируемый элемент обеспечил преждевременный стоп-кодон и полиаденилационный сайт, ответственные за синтез усеченного растворимого аттрактина. Обе формы, трансмембранный и растворимый белки, вовлекаются в клеточные взаимодействия в течение воспалительного процесса. Таким образом, вставки L1-ретроэлементов в данном конкретном случае создали для вида Homo sapiens более тонкие механизмы регуляции воспалительных ответов (Tang W. et al., 2000).
Alu-ретроэлементы. Среди других семейств ретроэлементов, Alu наиболее многочисленны в геноме современного человека. Они представлены более чем 1,4 млн копий, которые соответствуют 10 % всей массы генома человека. Их число продолжает расти, и они встраиваются во все новые сайты генома с частотой примерно одно новое встраивание на 100–200 новорожденных (Аст Г., 2005).
Alu-ретроэлементы играют основную роль в процессе образования экзонов в интронных областях благодаря существованию у них участков (motifs), имеющих сходство с сайтами сплайсинга, или они образуют такой сайт посредством вариаций отдельных нуклеотидов интегрировавшимся в интрон Alu-элементом. Вставки Alu-экзонов так же вводят преждевременные терминальные кодоны или рамки считывания, а сами Alu-элементы генома человека действуют как очень большой резервуар альтернативных экзонов.
Приведенные выше данные должны показать врачам, что ВИЧ/СПИД-пандемия это не первая пандемия, в которой участвуют ретровирусы. Они сопровождали человека на протяжении всей его эволюции. Кроме того, такие эпидемии составляют основной механизм прерывистой эволюции видов, когда в их эволюции чередуются длительные периоды стабильности, когда основные черты вида сохраняются неизменными; и короткие периоды быстрых изменений (в геологических масштабах времени), в ходе которых вид преобразуется — либо целиком превращается в другой вид, либо делится на новые виды, либо «отпочковывает» их от себя. Этот эволюционный механизм реализуется после массовых ретровирусных эпизоотий, заканчивающихся эндогенизацией ретровирусов в геноме выживших видов и наращиванием генома вида-хозяина путем образования новых собственных копий ретроэлементов; его усложнения путем образования новых экзонов из интронов и/или увеличения количества генов, подвергающихся альтернативному сплайсингу.
К отдельным механизмам этого процесса мы вернемся ниже, а сейчас перейдем к основной надежде наших врачей в борьбе с ВИЧ — к многократно обещанной нам ВИЧ-вакцине. Создатели таких вакцин пытаются нас лукаво приучить к мысли, что раз они уже получили иммуноглобулины, узнающие поверхностные белки ВИЧ, то и дело осталось за малым — научить их блокировать ВИЧ-инфекцию. Вот поэтому мы, сначала углубимся в эволюционную историю системы иммуноглобулинов человека.
Суперсемейство иммуноглобулинов (Ig-SF) представляет собой огромное семейство белков адгезии, название которого более известно по названию одного из факторов иммунной системы позвоночных — иммуноглобулиновых антител, эволюционно появившихся в этом семействе последними. По данным, обобщенным В. Г. Галактионовым (2005), J. Klein и H. Nicjladis (2005), прародителем V-генов [2] Ig-SF был ген белка Thy-1. Он образовался не менее 2 млрд лет назад в результате дивергенции какого-то другого более древнего гена белка, послужившего прототипом V- и С-доменов легкой цепи иммуноглобулинов.
Но прежде чем возникло основное свойство Ig-SF — разнообразие специфического взаимодействия с высокомолекулярными структурами, должно было произойти другое важное эволюционное событие — фрагментация V-гена. Ждать его после появления гена белка Thy-1 пришлось всего 1,5 млрд лет. Главным «виновником» формирования современного Ig-SF вновь оказался ретровирус, внедрившийся в единый V-ген предков позвоночных животных около 450 млн лет назад. Это событие привело к расщеплению V-гена на собственно V-ген, и D- и J-сегменты. Геномные участки, оказавшись самостоятельными, подвергались обычным генетическим процессам — в первую очередь транслокациям, тандемным дупликациям, рекомбинациям и случайным мутациям, инициируемым ретроэлементами.
Сначала многообразие таких структур увеличивалось за счет транслокаций (например, члены Ig-SF, имеющие V2-C2- и V1-C1-комбинации доменов) и тандемных дупликаций, включающих не только отдельные С- и V-гены, но и генные блоки V-C, в том числе те, которые усложнены включением D- и J-сегментов (V-D-J-C) или (V-J-C). В результате сформировался кластерный тип контроля над специфичностью антиген-распознающих молекул. Однако подобный тип формирования Ig-SF имел пределы, обусловленные величиной генома и невозможностью бесконечного наращивания кластерного типа организации генов.
Очередная ретровирусная атака какого-то предкового вида первых позвоночных привела к интродукции в их геном генов рекомбиназ ретровирусов RAG-1 и RAG-2, процесс реорганизации V-, D-, J-генных сегментов иммуноглобулинов и Т-клеточных рецепторов ускорился. Случайность объединения V-, D-, J-генных сегментов определила множественность синтезируемых V-доменов и возможность дальнейшей эволюции системы специфического иммунитета. Сколько потребовалось миллионов лет для реализации такой «случайности», неизвестно, но их уже не приходилось «ждать» миллиарды лет — эволюционный маховик начал раскручиваться. Возникло множество V-генов (у млекопитающих в настоящее время их более 500). С закреплением естественным отбором механизма V(D)J-рекомбинации, стало возрастать количество структур, способных к специфическому узнаванию «своего» (гомофильное узнавание) и «чужого» (гетерофильное узнавание). Дупликации и перестановки экзонов генов Ig-SF дали естественному отбору больше альтернатив в выборе конкурентоспособных многоклеточных структур. Эволюция живых существ теперь могла идти не только по пути наращивания структур, устроенных по одному образцу, но и по пути их дифференциации. Как частный вывод из этой истории участия ретровирусов в создании Ig-SF может быть предположение, что иммунная система человека отвечает на инфекцию, вызванную ретровирусами, совсем не так, как, например, на вирус натуральной оспы (ВНО).
Основное объяснение неудач у создателей ВИЧ-вакцин — это то, что «вирус постоянно меняется». Но давайте внимательно посмотрим, каким образом он меняется, и кто его меняет у так называемых умеренных прогрессоров (moderate progressors) ВИЧ-инфекции. R. Shankarappa et al. (1999) у таких пациентов в пределах асимптоматической стадии ВИЧ-инфекции выделяют три фазы дивергенции и три фазы роста разнообразия ВИЧ. Под дивергенцией (divergence) они понимают различия между нуклеотидной последовательностью исходного вируса и последовательностью вируса, полученного от ВИЧ-инфицированного человека через какое-то время после инфицирования. Под разнообразием (diversity) — различия в нуклеотидных последовательностях ВИЧ в данной временной точке.
На ранней фазе инфекции развиваются оба процесса; промежуточная фаза характеризуется непрерывным увеличением дивергенции ВИЧ, но стабилизацией или даже снижением его разнообразия; поздняя фаза проявляется снижением темпа или даже стабилизацией процессов дивергенции и формирования разнообразия вируса (рис. 5).
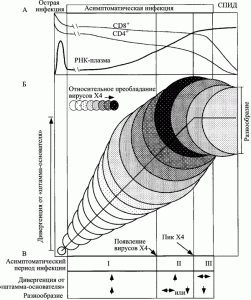 Рис. 5. Схематическое изображение развития ВИЧ-инфекции у умеренных прогрессоров. А. Клинические стадии ВИЧ-инфекции, динамика CD4+ и CD8+ T-клеток и нагрузки вирусной РНК в плазме. Б. Эволюция вирусных последовательностей в пределах асимптоматического периода ВИЧ-инфекции. Диаметры кругов приблизительно соответствуют разнообразию (diversity) вирусной популяции от сероконверсии (первый круг). Вертикальное смещение кругов показывает степень дивергенции вирусной популяции (divergence) от предкового штамма (founder strain). Затенения соответствуют пропорции вирусной популяции, представленной X4-генотипом. Вертикальные линии (начиная с левой стороны схемы) соответствуют: окончанию стадии острой инфекции; пику вирусного разнообразия; стабилизации дивергенции от предкового штамма; развитию СПИДа. В. Характерные изменения вирусной эволюции во время асимптоматического периода ВИЧ-инфекции, разделенные на три фазы. По R. Shankarappa et al. (1999)
Рис. 5. Схематическое изображение развития ВИЧ-инфекции у умеренных прогрессоров. А. Клинические стадии ВИЧ-инфекции, динамика CD4+ и CD8+ T-клеток и нагрузки вирусной РНК в плазме. Б. Эволюция вирусных последовательностей в пределах асимптоматического периода ВИЧ-инфекции. Диаметры кругов приблизительно соответствуют разнообразию (diversity) вирусной популяции от сероконверсии (первый круг). Вертикальное смещение кругов показывает степень дивергенции вирусной популяции (divergence) от предкового штамма (founder strain). Затенения соответствуют пропорции вирусной популяции, представленной X4-генотипом. Вертикальные линии (начиная с левой стороны схемы) соответствуют: окончанию стадии острой инфекции; пику вирусного разнообразия; стабилизации дивергенции от предкового штамма; развитию СПИДа. В. Характерные изменения вирусной эволюции во время асимптоматического периода ВИЧ-инфекции, разделенные на три фазы. По R. Shankarappa et al. (1999)
Следовательно, именно активность иммунной системы человека способствует дивергенции и увеличению разнообразия ВИЧ и появлению наиболее опасных Т-тропных вариантов ВИЧ (T-tropic или X4), элиминирующих Т-клетки-хелперы, после чего болезнь входит в стадию СПИДа. Основным местом размножения ВИЧ становятся макрофаги с заблокированной им системой апоптоза, дивергенция вируса замедляется, его разнообразие поддерживается в основном за счет ошибок при обратной транскрипции.
Но каким образом активность иммунной системы человека способствует дивергенции и увеличению разнообразия ВИЧ на стадии бессимптомной инфекции? Дело тут в том, что у ВИЧ-инфицированного человека нейтрализующие антитела играют совершенно иную роль, чем у человека, инфицированного ВНО, возбудителями сибирской язвы или чумы. До 90% всех обнаруживаемых у ВИЧ-инфицированного человека антител направлены на консервативный участок домена V3 поверхностного гликопротеина gp120. Домен V3 состоит из тримера гетеродимеров (trimer of heterodimers), сформированных двумя гликопротеинами, gp120 и gp41. Гликопротеин gp120 представляет собой высокогликозилированный белок, приблизительно половина массы которого составляют карбонгидраты, присоединенные к N-концу молекулы (Poignard P. et al., 2001). Анализ последовательностей различных изолятов ВИЧ позволил установить у gp120 вариабельные (V1-V5) и консервативные (С1-С5) регионы (рис. 6).
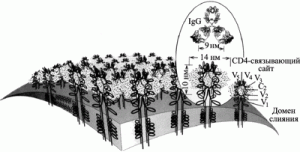 Рис. 6. Топография поверхности вириона ВИЧ-1. Оболочечные гликопротеины (gp120/gp41) — изображены как тетрамерные олигомеры. Карбонгидратный комплекс, включающий преимущественно олигоманнозу, изображен в виде «облака» вокруг гликопротеина. Показано антитело IgG. Оно не может взаимодействовать с gp120/gp41, потому что гликопротеин экранирован карбонгидратным комплексом. В то же время сайт связывания с рецептором CD4 Т-лимфоцитов остается открытым. По P. L. Nara et al. (1991)
Рис. 6. Топография поверхности вириона ВИЧ-1. Оболочечные гликопротеины (gp120/gp41) — изображены как тетрамерные олигомеры. Карбонгидратный комплекс, включающий преимущественно олигоманнозу, изображен в виде «облака» вокруг гликопротеина. Показано антитело IgG. Оно не может взаимодействовать с gp120/gp41, потому что гликопротеин экранирован карбонгидратным комплексом. В то же время сайт связывания с рецептором CD4 Т-лимфоцитов остается открытым. По P. L. Nara et al. (1991)
Консервативность отдельных консервативных доменов гликопротеина ВИЧ не имеет ничего общего с консервативным белком L1 ВНО, антитела к которому блокируют инвазию ортопоквирусов в клетки (Su H. et al., 2005). Относительно консервативный сайт связывания гликопротеина ВИЧ с рецептором клетки CD4 «заглублен» и малодоступен для антител. А консервативный корецепторный сайт является наиболее недоступным для антител на мономерном gp120 (Zwick M. B. et al., 2004).
Казалось бы, шанс для разработчиков ВИЧ-вакцин дает консервативный участок домена V3 gp120. Его консервативность обусловлена ролью в процессе проникновения ВИЧ в клетку. Корецепторы CCR5 и CXCR4 посредством V3-домена gp120 катализируют слияние вируса с мембраной клетки-мишени (Berger E.A. et al., 1999). Но с иммунологической точки зрения он оказался более сложным явлением, чем простой линейный эпитоп с такой же аминокислотной последовательностью или консервативный белок L1 ВНО. Оказалось, что домен представляет собой «шарнир», у которого консервативный участок V3 может оставаться неизменным в ходе инфекционного процесса, но конформация самого домена многократно меняется из-за большого количество замен аминокислот молекулы gp120 как впереди, так и позади консервативного участка. В результате «поворачивания шарнира» валентность его взаимодействия со специфическим антителом снижается (Wei X. et al., 2003). Скорость появления как ВИЧ-нейтрализующих антител, так и избегающих их вирусов сильно варьируют у разных лиц, сам же цикл многократно повторяется на протяжении жизни ВИЧ-инфицированного и больного СПИДом (Frost S. et al., 2005). Данный феномен нейтрализационной резистентности известен уже не менее 30 лет и характерен для инфекционных процессов, в которых участвуют ретровирусы. Ранее был описан для близкородственных ВИЧ ретровирусов — вируса кошачьей лейкемии, вызывающего лейкемию у кошек (Nicolaisen-Strouss K. et al., 1987); и вируса висны, поражающего ЦНС овец (Stanley J. S., 1987).
Но может быть тот относительно короткий период бессимптомного течения ВИЧ-инфекции, когда консервативный участок V3 доступен для нейтрализующих антител, станет решающим для блокирования ВИЧ-инфекции, если, например, путем добавления к вакцине иммуномодуляторов увеличить их количество? Это действительно прогрессивная идея, имеющаяся во всех учебниках по иммунологии, ее приверженца никто не заподозрит в ненаучности или в отсутствии здравого смысла. Такие антитела к различным белкам ВИЧ у мышей и добровольцев можно получать годами за счет денег налогоплательщиков и в иммуноблоте доказывать их специфическое взаимодействие с каким-либо белком ВИЧ, выдавая эти эксперименты за «создание и испытание кандидатных вакцин против ВИЧ/СПИДа» (например, см. работу Сидоровича И. Г. с соавт., 2010).
Но на пути реализации и этой «прогрессивной идеи» есть препятствие — блокирования ВИЧ-инфекции нейтрализующими антителами в условиях vivo не происходит и не может происходить в принципе. Их «нейтрализующее действие» проявляется феноменом антителозависимого усиления инфекции ( ADE). Суть феномена заключается в следующем. Фагоцитирующие клетки экспрессируют на своей поверхности Fc-рецептор (FcR), предназначенный для взаимодействия с Fc-областью иммуноглобулина G (Tirado S. M., Yoon K. S., 2003). Fc-область вирусспецифических антител взаимодействует с Fc-рецептором и/или рецепторами комплемента на поверхности фагоцитирующих клеток, стимулируя поглощение этими клетками интактного вируса, т. е. антитела образуют мост между вирусом и Fc-рецептором (рецепторами факторов комплемента) на поверхности фагоцитирующей клетки, облегчая ему взаимодействие со специфическим рецептором. Феномен наблюдается в двух вариантах: а) комплемент-опосредованное антителозависимое усиление инфекции (complement-mediated ADE; C-ADE); и б) независящее от комплемента и связанное с Fc-рецептором усиление инфекции (Fc-receptor-mediated ADE; FcR-ADE). У ВИЧ-инфицированных людей соблюдается определенная очередность проявления вариантов развития ADE. На ранней стадии инфекции феномен реализуется через V3-петлю gp120 (по типу FcR-ADE). По типу C-ADE феномен проявляется перед клиническим прогрессированием ВИЧ-инфекции, в его реализации задействован иммунодоминантный регион gp41 (Fust G., 1997: Thomas H. I. et al., 1996).
В результате совпадения обоих явлений: проявления ADE на ранней стадии инфекционного процесса и шарнирного строения консервативного участка V3-петли gp120, возникает феномен «инфекционно-эволюционных качелей». В низких концентрациях нейтрализующие ВИЧ антитела усиливают инфицированность фагоцитирующих клеток. Когда их количество достигает какого-то порога, «шарнир поворачивается», и валентность антител по отношению к консервативному участку V3-петли gp120, снижается, но при этом формируется новый консервативный эпитоп, в отношении которого иммунная система немедленно начинает вырабатывать новые «нейтрализующие» антитела, те, в свою очередь, вызывают феномен ADE. Цикл повторяется, клеточный тропизм ВИЧ, его антигенные свойства и вирулентность меняются, запускается механизм дивергенции и роста разнообразия ВИЧ (см. рис. 4). P. Nara et al. (1991) считают, что этот механизм лежит в основе способности ВИЧ приобретать тропность то к макрофагам, то к В- и Т-клеткам.
Данная схема подтверждается клинической практикой. Zhang H. et al. (2005) обнаружили, что увеличение генетического разнообразия вируса субтипа С у детей зависит от антител с широким нейтрализующим действием. Чем выше титр таких антител, тем больше на данный момент времени вирусы различаются между собой.
На пути разработчиков вакцин стоит еще и феномен антигенного импринтинга или первичного антигенного греха (phenomenon of original antigenic sin, OAS [3] ). Суть феномена заключается в следующем. Отдельные карбонгидратные антигены, антигены со структурной и функциональной гомологией (в их числе иммунодоминантные регионы gp41 и gp120 ВИЧ), индуцируют мало отличающиеся иммунные ответы. Когда в процессе повторной антигенной стимуляции таким антигеном активизируются В-клетки памяти, «запомнившие» предыдущий антиген (например, введенный человеку в результате вакцинации), имеющий аналогичную структурную и функциональную гомологию, то выработка антител происходит в отношении предыдущего антигена, хотя реально иммунная система с ним не контактирует. Выработка же специфических антител к новому для иммунной системы антигену тормозится из-за подавления «наивных» В-клеток активизировавшимися В-клетками памяти. Как заметили Kim J. M. et al. (2009), в данном случае В-клетки памяти формируют «слепое пятно» («blind spot») иммунной системы [4] .
- Nara et al. (1991) «вышли» на феномен OAS при ВИЧ-инфекции, случайно. Первоначальной целью их экспериментов было расширение иммунного ответа на ВИЧ-вакцину на основе gp120 таким образом, чтобы нейтрализации антителами подвергались вирусы различного географического происхождения. Введя экспериментальным животным gp120, полученный из штамма ВИЧ-1 IIIB, они исследовали кинетику, напряженность и продолжительность штаммоспецифического иммунного ответа. Через 175 сут они начали вторую серию опытов по иммунизации животных gp120 штамма ВИЧ-1 RF, имеющего другое географическое происхождение. После примирующей иммунизации (7–14 сут) исследователи неожиданно для себя, так как они основывались «на представлениях о штаммоспецифическом гуморальном ответе на ВИЧ», обнаружили рост титров антител к gp120 штамма IIIB. Проведенный этими авторами ретроспективный анализ научной литературы показал, что феномен OAS уже был описан для других ретровирусных инфекций, в частности, вызываемыхвирусом висны у овец(Narayan O. et al., 1978) и вирусом инфекционной анемии у лошадей (Kono Y. et al., 1971).
В соответствии с представлениями о роли иммунной системы в защите макроорганизма от патогенных микроорганизмов, сложившимися в начале ХХ столетия и до сегодняшнего дня переписываемыми из учебника в учебник, комплемент должен контролировать ВИЧ-инфекцию, как и любую другую. Тем более что процесс развивается медленно, не сопровождается симптомами шока (как, например, это происходит при натуральной оспе или чуме). Но и комплемент при ВИЧ-инфекции ведет себя «не так». Плазма крови человека усиливает инфекционность ВИЧ в отношении мононуклеарных клеток и моноцит-производных макрофагов почти в 30 раз (Wu S. et al. (1995). В более детальных исследованиях установлено непосредственное связывание СI-домена gp120 ВИЧ с фактором Н комплемента (негативный регулятор активности комплемента, синтезируется макрофагом) и увеличение формирования синтиция CD4-зависимым образом (Pinter C. et al. 1995).
Приведенные данные показывают, что иммунная система человека не воспринимает ВИЧ как нечто для нее чужое и не вступает в борьбу с ним, что действительно противоречит общепринятым взглядам на функционирование его иммунной системы, однако это противоречие исчезает, если учитывать роль самих ретровирусов в ее эволюции. Но давайте посмотрим еще и на то, как функционируют так называемые «антиретровирусные системы» человека.
Таких систем, как минимум, две: AID/APOBEC и TRIM5-альфа.Они самостоятельны и не зависят ни друг от друга, ни от иммунной системы человека. Ген APOBEC/3G (apolipoprotein B mRNA-editing enzyme, catalytic polypeptide-like 3G) кодирует белок, который упаковывается в ретровирусные частицы, где дезаминирует цитозин на урацил в минус цепи вирусной ДНК в процессе обратной транскрипции. В результате чего в плюс цепи кДНК гуанозин заменяется аденином, и репликация ВИЧ останавливается (Wahl S. et al., 2006; Cullen B. G., 2006).
TRIM5-альфа (tripartite interaction motif5-альфа) является тримерным белком и взаимодействует с гексамерным капсидом вируса через пролиновые пептидные группы, находящиеся в cis-конформации. Формирование комплекса «вирус-TRIM5альфа» блокирует этап «раздевания» вируса и перенос его нуклеиновой кислоты в ядро клетки. Инфекция блокируется еще до обратной транскрипции вирусной РНК.
На первый взгляд существование таких систем в Т-клетках-хелперах и в макрофагах понятно, оно предполагает наличие у них защиты от ретровирусов. Но от каких? Белок, кодируемый локусом генов APOBEC 3G, «работает» только с ВИЧ, утратившими ген белка Vif (фактор инфекционности вируса), и не влияет на продукцию вируса с полноценным Vif (Wahl S. et al., 2006; Cullen B. G., 2006). Следовательно, его основная функция заключается в устранении не всех ВИЧ, а только тех, которые не могут распространяться по популяциям человека. А TRIM5альфа «отсекает» от ядра клетки человека не ВИЧ-1, а «чужие» для него ретровирусы, например, SIV и ВИЧ-2 (Li X. et al., 2007; Kaiser S. M. et al., 2007).
Обе системы можно рассматривать не столько «антиретровирусными», сколько фильтрами, отделяющими «свои» ретровирусы (т. е., ВИЧ-1 и возможно другие, еще нам неизвестные), от каких-то других, присутствие которых в геноме современного вида человека «непредусмотренно» эволюционным процессом задолго до его появления.
Почему так работают антиретровирусные системы человека? Причина, скорее всего та же, что заставляет иммунную систему человека участвовать в размножении и распространении ВИЧ — эти системы созданы самими ретровирусами и предполагают существование каких-то механизмов конкуренции между самими ретровирусами за геном хозяина. Остатки ретровирусов с повторяющимися элементами (главным образом, LTR из ERV класса I) в сумме составляют до 19 % полного локуса APOBEC3 человека. Наиболее интенсивно они представлены в регионах, фланкирующих APOBEC3G и APOBEC3H (Conticello S. G. et. al., 2005).
Эволюционная история TRIM5альфа изучена лучше, чем APOBEC3. По данным S. M. Kaiser et al. (2007) современный вариант этого белка унаследован человекам от какого его эволюционного предка, подвергшегося селективному давлению со стороны ретровируса PtERV1 не позже 3–4 млн лет назад и представлявшего угрозу для австралопитеков. Эпизоотии, вызванные ретровирусом PtERV1, привели к отбору человекообразных приматов, носителей гена белка TRIM5альфа, у которого в 332-й позиции находился аминокислота аргинин. У более ранних предков человекообразных в этой позиции находилась аминокислота глютамин. Это предковое состояние сохранилось у гиббонов, орангутанов и горилл. Поэтому TRIM5альфа человека эффективен против PtERV1, но бессилен против ВИЧ. В геномах шимпанзе и гориллы сохранились остатки провируса PtERV1. В геноме человека эндогенного варианта этого ретровируса нет. Возможно, селективное давление ВИЧ на популяции людей, в отдаленной перспективе и приведет к отбору каких-то человеческих линий с TRIM5альфа предкового типа, как это предполагают S. M. Kaiser et al. (2007), но цену, которую заплатит наш вид за такую «эволюцию», трудно даже представить.
Если в сравнительном аспекте рассматривать инфекционный процессы, вызванные ВИЧ, и инфекционным процессом, вызванным ВНО, и почему-то столь показательным для разработчиков ВИЧ-вакцин, то мы обнаружим, что они на любом этапе противоположны друг другу [5] .
Инфекционный процесс, вызванный ВНО — это процесс диссеминации вируса фагоцитирующими клетками по органам и тканям, сопровождающийся выбросом молекул межклеточного общения (хемокинов и лимфокинов) в количествах, значительно превышающих физиологическую норму, и, соответственно, проявляющийся развитием патологических реакций (т. е. болезни). Но его продолжительность лимитируется Т- и В-клеточными составляющими иммунной системой хозяина. При рассмотрении инфекционного процесса данного типа речь идет не о конкретном количестве суток, в течение которых начинается и прекращается инфекционный процесс, а о способности клеточной и гуморальной иммунной системы его контролировать. Для инфекционной болезни, развивающейся вследствие инфекционного процесса, лимитируемого клеточной и гуморальной иммунной системой, характерны следующие периоды: инкубационный, продромальный, нарастания симптомов, разгара болезни, угасания клинических проявлений болезни, выздоровления (реконвалесценции) с формированием стерильного иммунитета. Поэтому такие инфекционные процессы я предлагаю назвать циклическими инфекционными процессами. Как правило, они представляют собой монопроцессы, т. е. вызываются одним микроорганизмом. Эпидемии, вызываемые микроорганизмами, использующими такую стратегию (стратегия первого типа), обычно прекращаются из-за формирования иммунной прослойки среди населения, угасания активности природного очага или в результате противоэпидемических мероприятий, направленных на разрыв эпидемической цепи. Они и есть те эпидемии, на борьбу с которыми направлены современные противоэпидемические мероприятия (рис. 7).
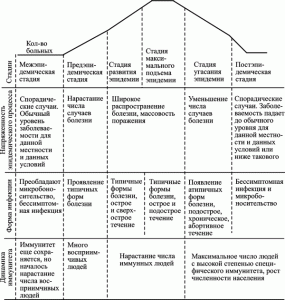 Рис. 7. Схематическое изображение типовых периодов эпидемического процесса, вызванного микроорганизмом, использующим первую стратегию паразитизма (за основу взята схема Бакулова И. А. с соавт., 1997)
Рис. 7. Схематическое изображение типовых периодов эпидемического процесса, вызванного микроорганизмом, использующим первую стратегию паразитизма (за основу взята схема Бакулова И. А. с соавт., 1997)
Ответы иммунной системы человека на ВНО и ВИЧ эффективны, но прямо противоположны по содержанию. В отличие от ВНО, пролиферация ВИЧ не контролируется Т- и В-клеточными составляющими иммунной системы. Наоборот, иммунная система помогает вирусу расширить свой ареал за счет фагоцитирующих клеток. Вызываемый таким паразитом инфекционный процесс не блокируется Т- и В-клеточными составляющими иммунной системы. Поэтому он не носит циклический характер, не предполагает периода угасания клинических проявлений болезни и выздоровления больного (реконвалесценции). Передача паразита между хозяевами происходит растянутым во времени, но всегда реализуемым путем — половым, без которого вид не может размножаться. Такая стратегия (стратегия второго типа) дает преимущества паразиту среди особей малочисленных популяций хозяев, обитающих на обширных территориях (рис. 8).
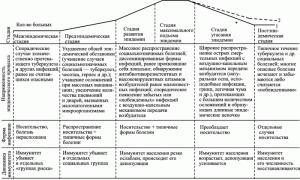 Рис. 8. Схематическое изображение стадий эпидемического процесса, вызванного микроорганизмом, использующим вторую стратегию паразитизма. 1 — кривая торможения пандемии; 2 — кривая вымирания H. sapiens; «звездочка»— изменение эволюционной траектории H. sapiens. По М. В. Супотницкому (2009)
Рис. 8. Схематическое изображение стадий эпидемического процесса, вызванного микроорганизмом, использующим вторую стратегию паразитизма. 1 — кривая торможения пандемии; 2 — кривая вымирания H. sapiens; «звездочка»— изменение эволюционной траектории H. sapiens. По М. В. Супотницкому (2009)
По мере развития ВИЧ-инфекции фагоцитирующие клетки, утратившие контроль со стороны Т- и В-клеточными составляющими иммунной системы, начинают играть в инфекционном процессе ту же роль «мусорщиков», которую они играли у первых многоклеточных животных, что проявляется множеством вялых инфекционных процессов, называемых СПИД-ассоциируемыми. Взаимодействие вызывающих их возбудителей между собой, с ВИЧ и клетками иммунной системы, носит специфический характер, прослеживаемый по крайней мере, на надклеточном, клеточном и генетическом уровнях.
Как пример надклеточного специфического взаимодействия можно привести участие белка SP-A в развитии туберкулеза. Присутствующий в бронхоальвеолярной жидкости ВИЧ-инфицированных людей, усиливает прикрепление M. tuberculosis к альвеолярным макрофагам (Downing J. P. et al., 1995).
Клеточное специфическое взаимодействие иллюстрируется следующими примерами: CDKN1A/p21 — классический ингибитор G1-фазы клеточного цикла индуцируется как ВИЧ, так микобактериями, но одновременно он является стимулятором жизненного цикла и ВИЧ, и микобактерий в макрофагальной клетке (Vazquez N. et al., 2005); индукция M. avium основного транскрипционного активатора воспалительных цитокинов, NF-кB, ведет к увеличению экспрессии CCR5 и цитокинов, стимулирующих репликацию ВИЧ (Wahl S. M. et al., 2000; Wahl S. et al., 2003; Vazquez N. et al., 2005); экспрессия генов ВИЧ, регулируемая посредством LTR, может быть трансактивирована регуляторными генами многих ДНК-вирусов; они же способны повысить чувствительность к ВИЧ у CD8+ T-клеток и NK-клеток; «переключить» тропность ВИЧ с корецептора CCR5 на корецептор CXCR4 (Urnovitz H. B., Murphy W. H., 1996; Lusso P. et al., 2007).
Очень сложны взаимоотношения между эндогенными и экзогенными ретровирусами на уровне генома. Эндогенные ретровирусы и ретроэлементы участвуют в комплементации нарушенных функций экзогенных ретровирусов. Отдельные HERV-K имеют транскрипционно активные открытые рамки считывания и кодируют собственную протеазу, идентичную протеазе ВИЧ. Протеаза HERV-K может комплементировать функцию протеазы ВИЧ у ВИЧ-инфицированных пациентов, подвергнутых лечению ингибиторами протеаз, и тем самым значительно снизить эффективность таких препаратов (Padow M. еt al., 2000). Экзогенные ретровирусы активизируют эндогенные ретровирусы и ретроэлементы. J. J. Goedert et al. (1999) показали усиление экспрессии генов эндогеного ретровируса K10 (HERV-K10) у ВИЧ-инфицированных людей и больных СПИДом, и, соответственно, повышение риска развития у них тестикулярного рака (testicular cancer). ВИЧ индуцирует появление вирусных частиц HERV-K(HML-2) в сыворотке человека (Contreras-Galindo R. et al., 2006; 2007).
Следовательно, инфекционный процесс, вызванный ВИЧ, является многокомпонентным и не имеет никаких механизмов самоограничении. Его сложность нарастает по мере ослабления контроля над фагоцитирующими клетками со стороны Т- и В- составляющими иммунной системы. Чтобы понятийно отделить такие процессы от инфекционных процессов, контролируемых Т- и В-составляющими иммунной системы, целесообразно ввести термин «многокомпонентный нециклический инфекционный процесс».
Отдельную проблему составляют «молчащие педиатрические инфекции» («silent pediatric infections»). По данным Р. Vаzquez et al. (2006) суть феномена заключается в обнаружении провирусной ДНК ВИЧ в мононуклеарных клетках крови серонегативных детей, родившихся от ВИЧ-инфицированных родителей три и более лет назад. Эпидемическая опасность и масштабы распространения феномена, неясны. Является ли такой тип течения ВИЧ-инфекции абортивным, или это проявление эндогенизации вируса, или еще что-то другое, станет окончательно ясно только через несколько десятилетий, когда удастся проследить наследование провирусной ДНК ВИЧ у следующих поколений людей.
В табл. 2 представлен краткий сравнительный анализ биологических свойств ВНО и ВИЧ, показывающий, что проблема ВИЧ/СПИД-пандемии имеет принципиально иной характер, чем эпидемии периода «до ВИЧ», и читателю целесообразно самому себе задать себе вопрос: «Можем ли мы бороться с ВИЧ/СПИД-пандемией по лекалам, разработанным для борьбы с принципиально иными инфекциями?»
Таблица 2
Принципиальные отличия биологических свойств ВНО и ВИЧ
|
Свойства |
ВНО |
ВИЧ |
|
Таксономия |
Семейство Poxviridae |
Семейство Retroviridae |
|
Механизм проникновение в организм человека |
Воздушно-капельным путем |
Половым, от матери к плоду и через инфицированную кровь |
|
Репликация на начальном этапе инфекционного процесса (первичная виремия) |
Преимущественно в моноцитах/макрофагах |
Преимущественно в фагоцитирующих клетках (макрофаги, моноциты, дендритные клети) и Т-хелперах |
|
Течение инфекционного процесса |
Циклический монопроцесс |
Многокомпонентный нециклический процесс |
|
Развитие стерильного иммунитета |
Возможно |
Невозможно |
|
Т- и В-клеточные ответы |
Сохранены |
Нарушены |
|
Взаимоотношения с фагоцитирующими клетками |
Паразитические |
Преимущественно симбиотические |
|
Основная антигеная детерминанта |
Консервативный белок L1. Необходим для сборки вириона, поэтому не подвергается конформационным изменениям |
Консервативный домен V3 гликопротеина gp120. Относится к структурам, связывающимся с рецепторами на поверхности макрофагов и Т-хелперов, подвержен конформационным изменениям |
|
Роль в инфекционном процессе антител к основным антигенным детерминантам |
Блокируют инфекционный процесс |
Усиливают инфекционный процесс |
|
Феномен антитело-зависимого усиления инфекции |
Не наблюдается |
Наблюдается |
|
Феномен первичного антигенного греха |
Не наблюдается |
Наблюдается |
|
Феномен инфекционно-эволюционных качелей |
Не наблюдается |
Наблюдается |
|
Феномен молчащей педиатрической инфекции |
Не наблюдается |
Наблюдается |
|
Роль комплемента в инфекционном процессе |
Блокирует инфекционный процесс |
Усиливает инфекционный процесс |
|
Наличие в геноме человека подобных структур |
Нет |
Не менее 42% >генома составляют эндогенные ретроэлементы |
|
Взаимодействие с системой APOBEC макрофагов и Т-хелперов |
Нет |
Система поддерживает варианты вируса с интактным геном vif (вирулентности) |
<p '="" style="font-family: Arial, Helvetica, sans-serif; margin-left: 18.8594px; margin-right: 94.3438px; text-align: justify; color: rgb(0, 0, 0); font-size: medium; font-style: normal; font-variant-ligatures: normal; font-variant-caps: normal; font-weight: 400; letter-spacing: normal; orphans: 2; text-indent: 0px; text-transform: none; white-space: normal; widows: 2; word-spacing: 0px; -webkit-text-stroke-width: 0px; text-decoration-thickness: initial; text-decoration-style: initial; text-decoration-color: initial;"> <p '="" style="font-family: Arial, Helvetica, sans-serif; margin-left: 18.8594px; margin-right: 94.3438px; text-align: justify; color: rgb(0, 0, 0); font-size: medium; font-style: normal; font-variant-ligatures: normal; font-variant-caps: normal; font-weight: 400; letter-spacing: normal; orphans: 2; text-indent: 0px; text-transform: none; white-space: normal; widows: 2; word-spacing: 0px; -webkit-text-stroke-width: 0px; text-decoration-thickness: initial; text-decoration-style: initial; text-decoration-color: initial;">Мы же вновь обратимся к опыту борьбы с натуральной оспой. При всем обилии лжи, окружающей антиВИЧ-мероприятия¸ самой удручающей является ложь о роли вакцинации в ликвидации натуральной оспы. Удручающей эта ложь является потому, что легко опровергается путем обращения к документам ВОЗ начала 1980-х гг., причем сами эти документы есть в медицинских библиотеках [6] .
Фактически вся стратегия Программы ликвидации натуральной оспы в глобальном масштабе, провозглашенной ВОЗ в 1959 г., на её первом этапе сводилась к массовой вакцинации населения. Но в реальных условиях ликвидации оспы в развивающихся странах использование только массовых прививок оказалось недостаточным. Например, начиная с 1962 г. кампания массовой вакцинации в Индии не привела к сколько-нибудь заметному снижению заболеваемости оспой к 1967 г. Наоборот, через пять лет после начала национальной кампании по ликвидации оспы в 1962 г. число регистрируемых случаев в Индии было выше уровней, отмечавшихся за любой год после 1958 г. В Индонезии на острове Ява, где охват вакцинацией населения превышал 90 %, продолжалась трансмиссия оспы (Глобальная ликвидация…, 1980; Маренникова С.С., Щелкунов С.Н., 1998).
На заседании научной группы по ликвидации оспы (октябрь, 1967 г.) эксперты рассмотрели ход выполнения как отдельных национальных программ, так и Программы в целом с обращением особого внимания на факторы, оказывающие отрицательное влияние на ее развитие. Наиболее существенным было то, что эта научная группа впервые подчеркнула важное значение эпидемиологического надзора. Эпиднадзор стал основным компонентом второго этапа Программы во всех ее фазах. Проведение систематической вакцинации населения стало рассматриваться как поддерживающая мера. Опыт ряда стран Западной Африки показал, что введение системы активного эпиднадзора позволяет быстро выявлять вспышки оспы и проводить эффективные меры по их ограничению и подавлению с помощью экстренной вакцинации населения этих районов. Новая для программы система оказалась более эффективной для прерывания трансмиссии оспы, чем «поголовная» вакцинация даже в тех случаях, когда было вакцинировано менее половины населения на данной территории. С учетом этих данных Комитет экспертов определил эпиднадзор как краеугольный камень стратегии ликвидации оспы (Глобальная ликвидация…, 1980; Хендерсон Д. А., 1980; Маренникова С.С., Щелкунов С.Н., 1998).
Помимо переоценки роли эпиднадзора, сделанной научной группой в 1967 г. и Комитетом экспертов по ликвидации оспы в 1972 г., чрезвычайно значение имели рекомендация о необходимости введения оценки и контроля каждого компонента Программы и развитие службы регистрации и оповещения о случаях заболевания. Именно контроль за результатами проведенной работы обеспечил реальную базу для принятия правильных решений. Через год, в декабре 1979 г., Глобальная комиссия по удостоверению ликвидации оспы пришла к выводу об успешном завершении Программы в глобальном масштабе (Глобальная ликвидация…, 1980; Хендерсон Д. А., 1980; Маренникова С.С., Щелкунов С.Н., 1998).
Теперь давайте посмотрим, что на практике означает перенос этого опыта на борьбу с ВИЧ-пандемией. Возможно ли это в принципе? Сначала придется многократно исследовать сложными иммунологическими и молекулярно-биологическими методами (а не только путем осмотра санитаром кожных покровов) население каждого города или деревни на носительство ВИЧ. Затем выявленных ВИЧ-инфицированных жителей изолировать до конца их жизни (а не на 5–10 сут, как это делали в очагах натуральной оспы в Индии), и только потом оставшееся население многократно вакцинировать ВИЧ-вакциной, если такая вдруг будет создана. Можно ли «изъять» почти 50 млн ВИЧ-инфицированных человек из эпидемических цепочек? Нет. Тогда зачем «пускать пыль в глаза» бесконечными разговорами типа: «Вот создадим ВИЧ-вакцину и покончим с ВИЧ, как с натуральной оспой»? Не покончим! Не покончим с ВИЧ/СПИД-пандемией и путем ее тщательного замалчивания, как это имеет место в настоящее время.
Приведенные в статье данные показывают необходимость разработки стратегии борьбы с нециклическими многокомпонентными эпидемическими процессами — это уникальная и не имеющая аналогов в истории медицины задача. Какой будет эта стратегия, пока можно только предполагать. Но нужно прекратить недооценивать и замалчивать проблему ВИЧ/СПИДа, «мир без ВИЧ» остался в нашем победном прошлом.
Литература
Альтернативный геном // В мире науки. — 2005. — № 7. — С. 37—43.
Бакулов И. А., Ведерников В.А., Семенихин А.Л. Эпизоотология с микробиологией. — М., 1997.
Галактионов В. Г. Эволюционная иммунология. — М., 2005.
Глобальная ликвидация оспы. Заключительный доклад Глобальной комиссии по удостоверению ликвидации оспы. Женева, декабрь 1979 г. — ВОЗ, Женева, 1980.
Маренникова С.С., Щелкунов С.Н. Патогенные для человека ортопоксвирусы. — М., 1998.
Сидорович И. Г., Бурменская О. В., Гасанов В. А. с соавт. Создание и испытание кандидатных вакцин против ВИЧ/СПИДа // Рабочее совещание по рассмотрению итогов выполнения распоряжений Правительства Российской Федерации от 25 декабря 2007 г. № 1905-р. Сборник докладов и материалов. 17–19 ноября 2010 г., Новосибирск. — Новосибирск, 2010. — С. 33–85.
Супотницкий М. В. Микроорганизмы, токсины и эпидемии. — М., 2000, 2005.
Супотницкий М.В. Эволюционная патология. — М., 2009.
Хендерсон Д. А. Победа всего человечества // Здоровье мира. — 1980. — Май. — С. 3–5.
Bannert N., Kurth R. Retroelements and the human genome: New perspectives on an old relation // Proc. Natl. Acad. Sci. USA. — 2004. — Vol. 101, Suppl. 2. — P. 14572–14579.
Belshaw R., Katzourakis A., Pacees J. et al. High copy number in human endogenous retrovirus families is associated with copying mechanisms in addition to reinfection // Mol. Biol. Evol. — 2005. — Vol. 22, № 4. — P. 814–817.
Berger E. A., Murphy P. M., Farber J. M. Chemokine receptors as HIV-1 coreceptors: roles in viral entry, tropism, and disease // Annu. Rev. Immunol. — 1999. — Vol. 17. — P. 657–700.
Buzdin A. Human-specific endogenous retroviruses // Expert Rev Vaccines. — 2008. — Vol. 7. — P. 1405–1417.
Conticello S. G., Thomas C., Petersen-Mahrt S. Evolution of the AID/APOBEC family of polynucleotide (Deoxy)cytidine deaminases // Mol. Biol. Evol. — 2005. — Vol. 22, № 2. — Р . 367–377.
Contreras-Galindo R, Kaplan M.H, Markovitz D. M et al . Detection of HERV-K(HML-2) viral RNA in plasma of HIV type 1-infected individuals // AIDS Res. Hum. Retroviruses. — 2006 — Vol. 22, № 10. — P. 979–984.
Contreras-Galindo R., Lopes P., Veles R. et al. HIV-1 infection increases expression of human endogenous retroviruses type K (HERV-K) in vitro // AIDS Res. Hum. Retroviruses. — 2007. — Vol. 23, № 1. — Р. 116–122.
Costas J., Naverira H. Evolutionary history of the human endogenous retrovirus family ERV9 // Mol. Biol. Evol. — 2000. — Vol. 17, № 2. — P. 320–330.
Cullen B. G. Role and mechanism of action of the APOBEC3 family of antiretroviral resistance factors // J. Virol. — 2006. — Vol. 80, №. 3. — P. 1067–1076.
de Parseval N., Heidmann T. Human endogenous retroviruses: from infectious elements to human genes // Cytogenet Genome Res — 2005. — Vol. 110. – P. 318–332.
Deininger P., Batzer M. Mammalian retroelements // Genome Res. — 2002. — Vol. 12. — P. 1455–1465.
Downing J. F ., Pasula R ., Wright J. R et al. Surfactant protein a promotes attachment of Mycobacterium tuberculosis to alveolar macrophages during infection with human immunodeficiency virus // Proc. Natl. Acad. Sci. U S A. — 1995. — Vol. 92, № 11. — P. 4848–4852.
Dunlap K., Palmarini M., Varela M. et al. Endogenous retroviruses regulate periimplantation placental growth and differentiation // Proc. Natl . Acad . Sci . USA . — 2006 — Vol . 103, № 39. — Р. 14390–14395.
Frost S., Wrin T., Smith D. M. et al . Neutralizing antibody responses drive the evolution of human immunodeficiency virus type 1 envelope during recent HIV infection // Proc. Natl. Acad. Sci. USA. — 2005. — Vol. 102, № 51. — P. 18514–18519.
Furano A. V. The biological properties and evolutionary dynamics of mammalian LINE-1 retrotransposons // Prog. Nucleic Acids Res. Mol. Biol. 2000. — Vol. 64. — P. 255–294.
Fust G . Enhancing antibodies in HIV infection // Parasitol. — 1997. — Vol. 115, Suppl: S 127–140.
Goedert J. J., Sauter M., Jacobson L. P. et al. High prevalence of antibodies against HERV-K10 in patients with testicular cancer but not with AIDS // Canc. Epidemiol., Biomark. & Prevent. — 1999. — Vol. 8. — P. 293–296.
Han K., Sen S., Wang J. et al. Genomic rearrangements by LINE-1 insertion-mediated deletion in the human and chimpanzee lineages // Nucleic Acids Research. — 2005. — Vol. 33, № 13. — P. 4040–4052.
Hughes J. F., Coffin J. M. Human endogenous retroviral elements as indicators of ectopic recombination events in the primate genome // Genetics . — 2005. — September 12.
Kaiser S. M., Malik H. S., Emerman M. Restriction of an extinct retrovirus by the human TRIM5xZI2OaXwo4C5MptyHQ945; antiviral protein // Science. — 2007. — Vol. 316. — P.1756–1758.
Khodosevich K., Lebedev Y., Sverdlov E. Endogenous retroviruses and human evolution // Comp. Funct. Genom. — 2002. — Vol. 3. — P. 494–498.
Kim J.H., SkountzouI., Compans R. et al. Original antigenic sin responses to influenza viruses // J. Immunol. — 2009. — Vol. 183. — P. 3294–3301.
Klein J., Nicolaidis N. The descent of the antibody -based immune system by gradual evolution // Proc. Natl. Acad. Sci. USA. — 2005. — Vol. 102, № 1. — P. 169–174.
Kono Y., Kobayashi K., Fukunaga Y. Serological comparison among various strains of equine infectious anemia virus // Arch. Gesamte Virusforsch. — 1971. — Vol. 34. — P. 202–208.
Li X., Gold B., O'Huigin C. et al . Unique features of TRIM5alpha among closely related human TRIM family members // Virol. — 2007 . — Vol. 360, № 2 . — P. 419–33.
Lopez-Sanchez P., Costas J., Naveira H. Paleogenomic record of the extinction of human endogenous retrovirus ERV9 // J. Virol. — 2005. — Vol. 79, № 11. — Р . 6997–7004.
Lusso P., Crowley R. W., Malnati M. S. et al . Human herpesvirus 6A accelerates AIDS progression in macaques // Proc. Natl. Acad. Sci. USA. — 2007. — Vol. 104, №. 12. — P. 5067–5072.
McBurney S., Ross T. Viral sequence diversity: challenges for AIDS vaccine designs // Expert. Rev. Vaccines. — 2008. — Vol. 7, № 9. — P. 1405–1417.
Nara P. L., Garrity R. R., Goudsmit J. Neutralization of HIV-1: a paradox of humoral proportions // FASEB J. — 1991. — Vol. 5. — P. 2437–2455.
Narayan O., Griffin D. E., Clements J. E. Virus mutation during «slow infection»: temporal development and characterization of mutants of visna virus recovered from sheep // J. Gen. Virol. — 1978. — Vol. 41. — P. 343–352.
Nicolaisen-Strouss K., Kumar H. P. M., Fitting T. et al . Natural feline leukemia virus variant escapes neutralization by a monoclonal antibody via an mino acid change outside the antibody-binding epitope // J. Virol. — 1987. — Vol. 61. — P. 3410–3415.
Ostertag E. M., Kazazian H. Biology of mammalian L1 retrotransposons // Annu. Rev. Genet. — 2001. — Vol. 35. — P. 501–538.
Pace II J, K., Feschotte C. The evolutionary history of human DNA transposons: evidence for intense activity in the primate lineage // Genome Res . — 2007. — Vol. 17. — P. 422–432.
Padow M., Lai L., Fisher R. J. et al. Analysis of human immunodeficiency virus type 1 containing HERV-K protease // AIDS Res. Hum. Retrovir. — 2000. — Vol. 16, № 18. — P. 1973–1980.
Pinter C., Siccardi A. G., Longhi R. et al . Direct interaction of complement factor H with the C1 domain of HIV type 1 glycoprotein 120 // AIDS Res. Hum. Retrovir. — 1995. — Vol. 11. — P. 577–588.
Poignard P., Saphire E. O., Parren P. W. е t al. gp120: Biologic aspects of structural features // Annu. Rev. Immunol. — 2001. — Vol. 19. — P. 253–274.
Shankarappa R., Margolick J.B., Gange S. et al. Consistent viral evolutionary changes associated with the progression of human immunodeficiency virus type 1 infection // J. Virology. —1999. — Vol. 73. — № 12. — P. 10489–10502.
Stanley J. S., Bhaduri L. M., Narayan O. et al . Topographical rearrangements of visna virus envelope glycoprotein during antigenic drift // J. Virol. — 1987. — Vol. 61. — P. 1019–1028.
Su Hua-Poo., Garman S., Allison T.J. et al. The 1.51-A structure of the poxvirus L1 protein, a target of potent neutralizing antibodies // Proc. Natl. Acad. Sci. USA. — 2005. — Vol. 102. — № 12. — 4240–4245.
Tang W., Gunn T. M., McLaughlin D. F. et al . Secreted and membrane attractin result from alternative splicing of the human ATRN gene // Proc. Natl. Acad. Sci. USA. — 2000. — Vol. 97. — P. 6025–6030.
Tirado S. M., Yoon K. S. Antibody-dependent enchancement of virus infection and disease // Viral. Immunol. — 2003. — Vol. 164, № 1. — P. 69–86.
Thomas H. I., Wilson S., O”Tolle C. M. et al. Differential maturation of avidity of IgG antibodies to gp41, p24 and p17 following infection with HIV-1 // Clin. Exp. Immunol. — 1996. — Vol. 103. — P. 185–191.
Turner G., Barbulescu M., Su Mei et al. Insertional polymorphisms of full-length endogenous retroviruses in humans // Current Biology. — 2001 — Vol. 11, № 19. — P. 1531–1535.
Urnovitz H., Murphy W. Human endogenous retroviruses: nature, occurrence, and clinical implications in human disease // Clin. Microbiol. Rev. — 1996. — Vol. 9, № 1. — P. 72–99.
Vazquez N., Greenwell-Wild T., Marinos N. J. et al . Human Immunodeficiency virus type 1-induced macrophage gene expression includes the p21 gene, a target for viral regulation // J. Virol. — 2005. — Vol. 79, № 7. — P. 4479–4491.
Vazquez P., Basualdo S., Reyes-Teran G. et al. Human Immunodeficiency virus type 1 in seronegative infants born to HIV-1-infected mothers // Virol. J. — 2006. — Vol. 3, № 52 (http://www.virologyj.com/content/3/1/52).
Wahl S., Greenwell-Wild T., Gang Peng et al. Viral and host cofactors facilitate HIV-1 replication in macrophages // J. Leukoc. Biol. — 2003. —Vol. 74. — P. 726–735.
Wahl S., Greenwell-Wild T., Vazquez N. HIV accomplices and adversaries in macrophage infection // J. Leukoc. Biol. — 2006. — Vol. 80. — P. 973–983.
Wahl S., Greenwell-Wild T., Vazquez N. HIV accomplices and adversaries in macrophage infection // J. Leukoc. Biol. — 2006. — Vol. 80. — P. 973–983.
Wei X., Decker J.M., Hui H. et al. Antibody neutralization and escape by HIV-1 // Nature. — 2003. — Vol. 422, № 6929. — P. 307–312.
Wyatt R., Kwong P.D., Desjardins E. et al. Structure of an HIV gp120 envelope glycoprotein in complex with the CD4 receptor and a neutralizing human antibody // Nature. — 1998. — Vol. 393. — P. 705–711.
Zhang H., Hoffmann F., He J. et al . Evolution of subtype C HIV-1 Env in a slowly progressing Zambian infant // Retrovirology. — 2005 (http://www.retrovirology.com/content/2/1/6).
Zwick M.B., Saphire E.O., Burton D.R. gp41: HIV's shy protein // Nat. Med. — 2004. — Vol. 10. — P. 133–134.
Библиографическое описание:
Супотнiцький М.В. Чому ми не здолаемо ВIЛ/СНIД (Почему мы не победим ВИЧ/СПИД-пандемию) // Iнфекцiйнi хворобию. — 2012. — № 1 (67). — С. 88–96; № 2 (68). — С. 104–114.
[1] Уже только одно это обстоятельство должно было заставить задуматься научный истеблишмент, а действительно ли ВИЧ/СПИД-пандемия представляет собой только медицинскую проблему, которую можно решить в рамках имеющихся представлениях об инфекционных и эпидемических процессах.
[2] V-гены гены кодируют вариабельные области L- и H-цепей иммуноглобулинов — от их взаимодействия между собой зависит специфичность иммуноглобулиновых белков.
[3] Для образования термина T. Francis использовал библейское выражение «original sin», означающее «первородный (прародительский, первичный) грех» Адама, отразившийся на всех его потомках. Более благозвучное название феномена — «antigenic imprinting» («антигенный отпечаток») используется редко.
[4] Для российской иммунологии феномены OAS и ADE являются своего рода «слепыми пятна». Ни в одном труде, посвященном разработкам ВИЧ-вакцин, я не обнаружил даже намека на их существование.
[5] Подробное сравнение инфекционных и эпидемических процессов, вызванные ВИЧ и ВНО, приведено в монографиях: М. В. Супотницкий (2000) и М. В. Супотницкий (2009).
[6] Например, в Центральной научной медицинской библиотеке Московской медицинской академии им. И. М. Сеченова имеется документ ВОЗ «Глобальная ликвидация оспы. Заключительный доклад Глобальной комиссии по удостоверению ликвидации оспы» (1980). Его шифр: ООН 19/26.

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2012