Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. 2.3. Архейские предки иммунной системы человека
2.3. Архейские предки иммунной системы человека
Обычно в монографиях, описывающих функционирование иммунной системы человека (см., например, обстоятельную работу Белоцкого С. М. и Авталиона З. З., 2006), ее организация представляется законченной и продуманной схемой, в соответствии с которой все ее звенья дружно противостоят враждебному проникновению опасных микроорганизмов. Общепринятое понимание функционирования иммунной системы иммунологами предполагает исключительно дословное толкование латинского термина immunitas — невосприимчивость организма по отношению к возбудителям заразных болезней. Подразумевается, что где инфекция, там и иммунитет. Отсюда следует убеждение многих ученых в том, что иммунная система человека борется с ВИЧ-инфекцией, и надо только ей помочь в этой борьбе, однако практически сделать это не удается. Для понимания причин этих неудач нам надо заглянуть в прошлое нашей иммунной системы.
Локус генов Rag1/2. Это гены ферментов, являющихся ключевыми участниками V(D)J-рекомбинации (см. Словарь терминов). Традиционно считается, что гуморальная иммунная система, в основе которой лежит V(D)J-рекомбинация, — эволюционное приобретение позвоночных (см. у Купера Э., 1980). Может быть, так оно и есть на самом деле, но вот сам локус генов Rag1/2 имеет гораздо более древнее происхождение, чем позвоночные, и в эволюционный период «до позвоночных» он играл роль рекомбиназы ретровирусов (Fugmann S. D. et al., 2006).
Обнаружено значительное структурное сходство между RAG-белками и белками, принадлежащими к суперсемейству интеграз ретровирусов. Для них установлены общие механизмы рассечения цепей ДНК (одноцепочечный разрыв через гидролиз и перенос нити через трансэстерификацию); потребность в дивалентных ионах металлов (Mg2+ или Mn2+); способность использовать альтернативные нуклеофилы, такие как алкоголь; образование шпилек ДНК; и способность к обратной реакции (disintegration) (Polard P., Chandler M., 1995; Landree M. A. et al., 1999).
Суперсемейство иммуноглобулинов (Ig-SF). Это огромное семейство белков адгезии, название которого более известно по названию одного из факторов иммунной системы позвоночных — иммуноглобулиновых антител, эволюционно появившихся в этом семействе последними. Основными критериями включения белков в суперсемейство являются определенная пространственная организация молекул и статистически достоверная гомология с известными иммуноглобулинами. Каждый домен, входящий в состав иммуноглобулина, представляет собой двухслойное молекулярное образование, построенное по принципу нескольких антипараллельных бета-структур, стабилизированных связями —S—S—. Так образуется молекулярная конформационная структура, свойственная только членам суперсемейства иммуноглобулинов. В англоязычной литературе она получила обозначение Ig-fold (иммуноглобулиновая складчатость) (рис. 36).
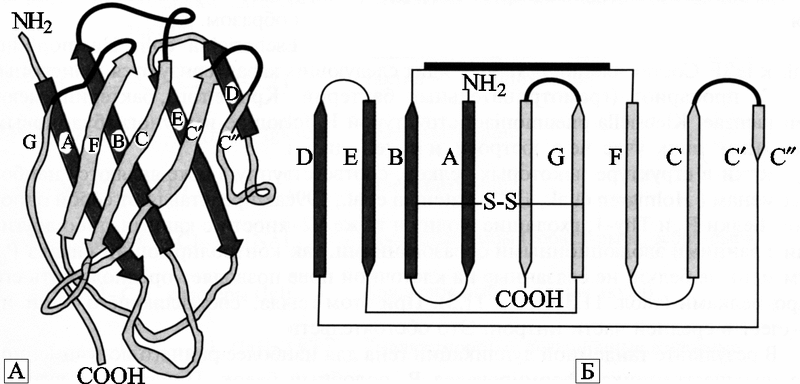
Рис. 36. Структурная организация V-демена по A. N. Barclay (1999)
А - диаграмма кристаллографического анализа V-домена тяжелой цепи миеломного белка New человека, демонстрирующая характер двухслойной складчатости типа Ig-fold данного домена.
Б - схема связи между бета-структурными слоями и альфа-спиральными положениям Ig-fold. Черные линии - гипервариабельные участки (рисунок из книги Галактионова В. Г., 2005).
В аспекте понимания происхождения самих белков Ig-SF любопытно то, что и они не являются оригинальными структурами, появившимися исключительно для осуществления разнообразных механизмов клеточной адгезии. Да и появиться «ниоткуда» они не могли, природа экономна в том, что касается базовых структур поддержания живой материи. Их происхождение уходит к очень древним белкам адгезии — гистонам, осуществляющим управление работой генов и стабилизирующим вторичную структуру ДНК и хроматина (см. подглаву 1.1). Гистоны управляют скоростью V(D)J-рекомбинации у индивидуума (Espinoza C., Feeney A., 2005). Но Ig-SF в «гистоновом мире» играет более древнюю роль, чем сами гистоны — роль шаперонов, т. е. структур, поддерживающих конформацию эгистонов и определяющих характер гистон/гистонового взаимодействия (рис. 37).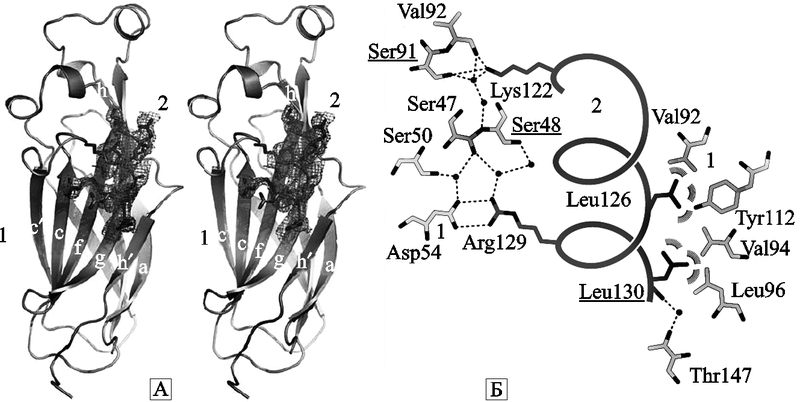
Рис. 37. Ig-SF шаперонов гистоновых белков
А. Общая структура шаперона Asf1N, связывающего гистоновые белки H3альфа3. 1 — Asf1N, связывающийся со спиралью H3альфа3; 2 — бета-цепи (обозначены посредством номенклатуры, принятой для переключающегося типа Ig-подобной складчатости; switched-type Ig-like folds).
Б. Структурные детали взаимодействия шаперона Asf1N с гистоновыми белками. 1 — Asf1N; 2 — гистоновые белки H3альфа3. Ван-дер-Вальсовые взаимодействия показаны полукружиями. Ионное спаривание и взаимодействие за счет образования водородных связей показаны пунктирными линиями (по Antczak A. J. et al., 2006).
Следовательно, конформационная структура типа Ig-fold берет свое начало еще в эпоху протоклеточных образований, когда каждый домен гистонового белка образовывался в результате ретротранспозиционной активности первых ретроэлементов. Сформировавшиеся на основе структур типа Ig-fold гидрофобные белки оказались востребованными эволюцией как строительный материал многоклеточности. Посредством дупликаций и перестановок генов, кодирующих Ig-fold, сформировалось суперсемейство иммуноглобулинов.
Сегодня к этому семейству относятся молекулы Т-клеточного антигенраспознающего комплекса, молекулы I и II классов МНС, корецепторы Т-клеток CD4 и CD8, однодоменные белки — Thy-1, b2-м, Р0, различные адгезины и рецепторные молекулы, способствующие контактному взаимодействию иммунокомпетентных клеток или адсорбции различных классов иммуноглобулинов на клеточной поверхности. На лимфоидных клетках одна треть поверхностных молекул — это члены суперсемейства иммуноглобулинов (Галактионов В. Г., 2005).
Наиболее древними в этом суперсемействе являются белки Р0 и Thy-1, так как они представляют собой однодоменные белки, не связанные на клеточной поверхности с какими-либо другими. При этом ген, контролирующий синтез Р0, имеет в средней части интрон. Данное обстоятельство, по мнению В. Г. Галактионова (2005), позволяет предположить его происхождение от гена для полудоменного пептида, составляющего один из бета-структурных слоев в современных доменах IgSF. В результате тандемной дупликации гена для наиболее раннего полудоменного предшественника сформировался Р0-подобный белок. Прошедшая делеция интронной части гена Р0 обеспечила возникновение гена-предшественника для антигена Thy-1. Это событие произошло не менее 2 млрд лет назад. Полипептиды, серологически родственные белку Thy-1 млекопитающих, обнаружены у одноклеточных эукариот и прокариот, дождевых червей, головоногих и брюхоногих моллюсков, рептилий, рыб, птиц. О генной организации и распространенности других членов Ig-SF можно прочитать в книге В. Г. Галактионова (2005), мы же пока остановимся на антигене Thy-1. Его функциональное предназначение точно не определено. Крайне раннее его появление в филогенезе связано с процессом возникновения многоклеточных организмов, когда он выступал в качестве одного из поверхностных молекулярных факторов межклеточной адгезии, используя механизм гомофильного межклеточного взаимодействия, т. е. контактного взаимодействия «своего» со «своим» (Barclay A. N., 1999).
Реликтовая иммунная система человека. В подглаве 2.1 («Простейшие и их паразиты») мы привели экспериментальные данные S. Blazquez et al. (2006), показывающие существование ответных реакций у амеб на фактор некроза опухолей (TNF), интерлейкин-1бета (IL-1бета), интерлейкин-8 (IL-8) и циклооксигеназу-2, аналогичные таковым у нейтрофилов и макрофагов многоклеточных организмов. Следовательно, не только эти хемокины и цитокины стали «средством общения» между эукариотами-простейшими задолго до появления нейтрофилов и макрофагов как клеток иммунной системы позвоночных организмов, но и рецепторы, посредством которых осуществлялось взаимодействие простейших. Эти же рецепторы за миллиарды лет совместной эволюции научились использовать внутриклеточные прокариотические паразиты простейших. В ходе эволюции многоклеточных форм жизни они были унаследованы «все пакетом».
Хемокины. Даже сам термин «хемокин» был применен к этим молекулам, поскольку считали, что их основная биологическая активность является хемотаксической, т. е., направляющей движение клеток по градиентам концентрации хемокинов во время воспалительных реакций. Хотя хемокины представляют только один класс многих типов известных хемотактинов (chemotactins), включающих широкий молекулярный спектр веществ от липидов до нуклеотидов, они выгодно отличаются от остальных благодаря своей молекулярной стабильности и специфичности клеток-мишеней. Любопытно и то, что хемокины представляют собой гомологичное суперсемейство сравнительно небольших белков от 8 до 17 кДа, появившееся в результате дупликации и модификации одного анцестрального гена (Chensue S. W., 2001).
Сравнительный анализ аминокислотных последовательностей млекопитающих и примитивных позвоночных показывает, что группы СХС и СС хемокинов разошлись от предкового гена еще до появления самих позвоночных (Najakshin A. M. et al., 1999) (рис. 38).
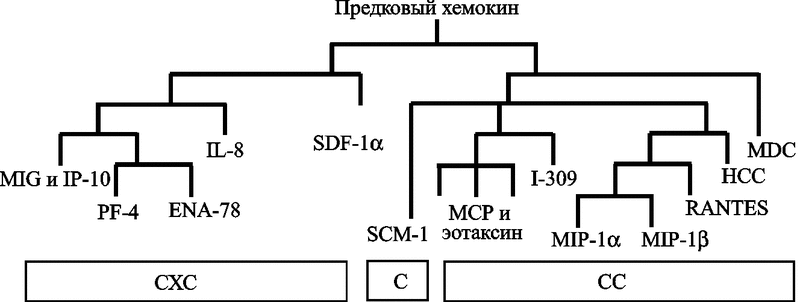
Рис. 38. Эволюция семейств хемокинов
Суперсемейство хемокинов делится на подклассы (подсемейства) на основе расположения цистеиновых остатков, локализованных в N-терминальной области этих молекул. Подклассы обозначены как С, СС, СХС и СХХХС, где С означает количество цистеиновых остатков в N-терминальной области, а Х представляет количество лежащих между ними аминокислот. Подсемейство СХС разделяется иногда еще на типы ELR и non-ELR на основании присутствия или отсутствия последовательности из трех аминокислот (Глу-Лей-Арг), которая предшествует первому цистеиновому аминокислотному остатку первичной структуры этих хемокинов. Присутствие последовательности сообщает ангиогенную функцию этому типу хемокинов, тогда как ELR-отрицательные хемокины обнаруживают ангиостатические свойства. Все основные подсемейства хемокинов сформировались еще до появления позвоночных животных (Najakshin A. M. et al., 1999).
Рецепторы хемокинов. Впервые они были описаны на «опережающем объекте» таких исследований, на лейкоцитах. Впоследствии рецепторы хемокинов обнаружены на эндодермальных, мезенхимных, эктодермальных и нейроэктодермальных клетках многоклеточных организмов. Однако если сопоставить данные, приведенные на рис. 38, с данными, обобщенными в табл. 9, то следует сделать вывод, что основные подсемейства лимфокинов, взаимодействующих с клетками современных позвоночных, и соответственно их рецепторы существовали еще до сформирования этого таксона, и при определенной настойчивости их всех можно найти и у простейших. Работа S. Blazquez et al. (2006) — это сигнал о «созревающем» направлении таких исследований.
Таблица 9
Рецепторы хемокинов*
|
Рецептор |
Лиганды |
Экспрессия |
Хромосома** |
|
Подсемейство СХС |
|
||
|
CXCR1
|
IL-8, KC, MIP-2 GCP-2
|
Нейтрофилы, моноциты, базофилы, тучные клетки, эндотелиальные клетки, Т-клетки, NК-клетки |
2 (Ч) |
|
CXCR2
|
IL-8, GRO-альфа, NAP-2, ENA-78 |
Нейтрофилы, моноциты, базофилы, тучные клетки, эндотелиальные клетки, Т-клетки, NK-клетки, астроциты, нейроны |
2,1 (Ч,М) |
|
CXCR3 |
IP-10, MIG, I-TAC |
Активированные клетки Th1 |
Х (Ч,М) |
|
CXCR4 (фузин) |
SDF-1альфа |
Миелоидные клетки, Т-клетки, В-клетки, эпителиальные клетки, эндотелиальные клетки, дендритные клетки |
2, 1 (Ч,М) |
|
CXCR5 (BLR1) |
BLC/BCA-1
|
В-клетки |
11, 9 (Ч,М) |
|
DARC (антиген
Duffy) |
IL-8, GRO-альфа, RANTES, MCP-1, TARC |
Эритроциты, эндотелиальные клетки, Т-клетки |
1 (Ч) |
|
Подсемейство СС |
|
||
|
CCR1 |
MIP-1альфа, RANTES, MCP-3, MPIF-1, HCC-1 |
Нейтрофилы, моноциты, тучные клетки, Т-клетки, В-клетки, клетки NK, астроциты, нейроны |
3,9 (Ч,М) |
|
CCR2a, CCR2b |
MCP-1, MCP-3, MCP-4 |
Моноциты, Т-клетки, В-клетки, базофилы |
3,9 (Ч,М) |
|
CCR4 |
MDC, TARC |
Базофилы, клетки NK, дендритные клетки, клетки Th1, клетки Th2 |
3,9 (Ч,М) |
|
CCR3 |
Эотаксин 1-3, RANTES, MCP-3, MCP-4 |
Клетки Th2, эозинофилы, базофилы |
3,9 (Ч,М) |
|
CCR5 |
RANTES, MIP-1альфа, MIP-1бета |
Моноциты, дендритные клетки, клетки Th1, эпителиальные клетки |
3,9 (Ч,М) |
|
CCR6
|
LARC/MIP-3альфа/Exodus |
Лимфоциты, дендритные клетки |
6(Ч) |
|
CCR7 |
SLC/6Ckine/Exodus2/TCA4,
CКbeta-11/MIP-3beta/ELC |
Т-клетки, В-клетки, моноциты, клетки NK, дендритные клетки
|
17(Ч)
|
|
CCR8 |
1309/mТCA3,TARC |
Моноциты, клетки Th2, клетки гладкой мышцы, тимоциты |
3(Ч) |
|
CCR9 |
TECK,RANTES MIP-1альфа,
MIP-1бета |
Тимоциты, дендритные клетки, активированные макрофаги |
3(Ч) |
|
CCR10 |
CTACK/ILC |
Т-клетки, фибробласты, меланоциты, клетки Лангерганса, плацентарные клетки, клетки печени |
3(Ч) |
|
Подсемейство XCR |
|||
|
ХCR (GPR5) |
Лимфотактин |
Т-клетки, В-клетки, клетки NK |
3(Ч,М) |
|
Подсемейство СХ3CR1 |
|||
|
CX3CR1 (V28) |
Fractalkine |
Клетки NK, моноциты, Т-клетки |
3(Ч) |
* По Chensue S. W., 2001.
** Ч = человеческие; М = мышиные.
Хемокины оказывают действие на фагоцитирующие клетки единообразно — через рецепторы, связанные с гуанозиннуклеотидом-белком (guanosine nucleotide-protein-coupled receptor; GPCR). Подобно всем рецепторам, связанным с GPCR, рецепторы хемокинов имеют семь трансмембранных гидрофобных доменов с тремя внутриклеточными и тремя внеклеточными гидрофильными петлями. Потенциально гликозилированная внеклеточная аминотерминальная область участвует в связывании хемокина, тогда как внутриклеточная карбокситерминальная область участвует в связывании с белком G и подвержена регуляторному фосфорилированию. Активация рецепторов хемокинов начинается со связывания с внеклеточным лигандом, что инициирует взаимодействие с внутриклеточными покоящимися ГДФ-несущими тримерными белками G. Это приводит к обмену ГДФ на ГТФ, вызывая распад белка G на субъединицы альфа-G и бета/гамма-G. Последняя субъединица, в свою очередь, активирует такие ферменты как фосфолипаза С и фосфоинозитид-3-киназа, которые конвертируют фосфотидилинозитол-4,5-дифосфат (IP2) в фосфотидилинозитол-1,4,5-трифосфат (IP3) и диацилглицерин (DAG). IP3 стимулирует приток ионов кальция, и DAG активирует изоформы протеинкиназы С (РКС). Таким образом, подготавливается внутриклеточная среда для фосфорилирования с участием ряда киназ (например, активированная митогеном протеинкиназа, протеин-трипсин-киназа) и небольших ГТФаз (например, Ras и Rho), которые в конечном счете оказывают влияние на клеточные функции, такие как адгезия, хемотаксис, дегрануляция и взрыв респираторной активности (Luttrell L. M. et al., 1997).
Белки трансдукции сигналов. Интересным аспектом биологии макрофагов было обнаружение связи их рецепторов с белками G, представляющими большой класс белков трансдукции клеточных сигналов (Locati M., Murphy P. M., 1999). Но и у этих белков эволюционная история начинается в архее. Анализ последовательностей альфа-субъединиц гетеротримерного G-белка Protozoa, проведенный D. C. New и J. T. Wong (1998), показал, что они имеют не только обширную гомологию со своими двойниками у млекопитающих, но и абсолютную гомологию последовательностей наиболее значимых функциональных регионов этих белков.
GPCR относятся к суперсемейству родственных рецепторов, участвующих в трансдукции широкого спектра внеклеточных сигнальных молекул, таких как гормоны, нейротрансмиттеры, цитокины (интерлейкины, факторы некроза опухоли и интерфероны — способны регулировать экспрессию хемокинов и наоборот), ароматизаторы, свет и др. Рецепторы хемокинов имеют длину от 320 до 380 аминокислот. Также как и сами хемокины, они обнаруживают значительную гомологию последовательностей. Всего их более тысячи, и их рассмотрение не входит в задачу этой работы (более подробно о рецепторах хемокинов см. у Chensue S. W., 2001).
Как «не по учебнику» в отношении некоторых бактерий и вирусов ведут себя мобилизованные хемокинами фагоцитирующие клетки позвоночных, мы уже кратко рассмотрели выше (см. подглаву 2.1). Но выбросы фагоцитирующими клетками хемокинов дают и другие эффекты, обычно не включаемые в однозначные схемы функционирования иммунной системы, предназначенные для студентов. Например, этиологический агент болезни Лайма, Borrelia burgdorferi, стимулирует синтез MIP-1альфа, IL-8, GRO-альфа, MCP-1 и RANTES человеческими моноцитами. Но их появление в крови в повышенных количествах не только не приводит к эффективной элиминации макрофагами бореллий из организма человека, но и вызывает повреждение его тканей и хронический артрит (Sprenger H. et al., 1997). H. Yoneyama с сотр. (1998) продемонстрировали, что внезапно и быстро развивающийся гепатит, индуцированный Propionibacterium acnes и эндотоксином, зависел от TARC — лиганда CCR4, ответственного за мобилизацию печеночных СD4+ Т-клеток ССR4+ хозяина. Мобилизация иммунных клеток ассоциировалась с печеночной недостаточностью, приводящей к летальным исходам. Здесь важно отметить и другую сторону повреждения паразитическим организмом тканей хозяина и следующего за этим летального исхода болезни — они оказываются совершенно бессмысленными для поддержания в природе самого паразита.
Нет необходимости приводить такие наблюдения дальше. Их более чем достаточно, что бы усомниться в «разумном устройстве» (с точки зрения человека, конечно) организации нашей иммунной системы на уровне взаимодействия фагоцитирующих клеток между собой и с паразитическими микроорганизмами. Да и сами паразиты не могут «похвастать» целесообразным поведением в отношении макрофагов. Впрочем, эту иммунную систему специально никто и не создавал по какому-то заранее продуманному плану, предполагая, что ее основное предназначение состоит в элиминации патогенных микроорганизмов. Она случайно сложилась из клеток, первоначально предназначенных выполнять всего лишь роль «мусорщиков» у первых многоклеточных организмов (как, например, это делают блуждающие амебоциты у губок), но в ходе эволюции хордовых закрепилась за ними естественным отбором. В интересах дальнейшего изложения материала назовем ее реликтовой иммунной системой.
«Сборка» многоклеточных организмов. Архейская жизнь предполагала сложную систему отношений между одноклеточными организмами. Они «общались» между собой с помощью сигнальных молекул, известных нам сегодня под общими названиями хемокинов и лимфокинов. Их рецепторы воспринимали химические сигналы, поступавшие из окружающей среды, а белки трансдукции сигналов управляли клеточными функциями. Ни центральной нервной системы, ни «мыслительной деятельности» для существования таких организмов в течение сотен миллионов лет не требовалось. Но такого количества жизни, которое существовало в конце Архея и в Протерозое, на планете никогда больше не было, чему есть следующее подтверждение.
В 1990-е гг. на архипелаге Шпицберген открыта уникальная по полноте последовательность позднепротерозойских осадков, отлагавшихся в период с 850 до 600 млн лет назад. Исследовав эти осадки на предмет изотопного отношения 12C/13C, Э. Нолль (1996) установил, что на протяжении всего этого времени темпы захоронения органического углерода оставались самыми высокими за всю историю Земли (цит. по работе Еськова К. Ю., 2004). Несомненно то, что жизнь именно тогда пережила свой период количественного «расцвета».
И такая жизнь могла бы быть вполне самодостаточной, если бы в ее организацию не вмешивалась ретровирусная эволюция (см. подглаву 1.1). Антиэнтропийные процессы наращивания и усложнения генома одноклеточных организмов, вызванные увеличением числа копий их генов и появлением новых экзонов, продолжались (их механизмы см. в подглаве 1.2) — эволюционный маховик раскручивался; 840-740 млн лет назад появились первые эволюционные пробы многоклеточности. Ими были бесскелетные организмы, названные по месту обнаружения хайнаньской биотой — первый акт творения многоклеточной жизни. Для них характерно членистое строение, отражающее дупликацию генетического материала, осуществляемую ретроэлементами.
Однако сложные многоклеточные формы жизни, как и миллиарды лет до этого (в нашем ощущении времени), все еще не закреплялись естественным отбором. Демону Дарвина не хватало механизма поддержания «многоклеточности», предполагающего соединение в единое целое «своих» и исключение «не своих» клеток. Этот механизм мог сформироваться на основе молекул специфической адгезии. Но для того чтобы такая «специфичность» появилась у поверхностных белков сотен разных клеток, формирующих целостный организм, естественный отбор должен был «перепробовать» миллионы вариантов адгезионных молекул. Выбирать же Демону Дарвина было пока не из чего, о чем свидетельствуют окаменелые останки так называемой эдиакарской фауны, сменившие хайнаньскую биоту 620-600 млн лет назад (более подробно о них см. в работе Иванцова А. Ю., 2001). Система вновь достигла равновесного, стабильного состояния.
Второй акт творения многоклеточной жизни обозначил себя организмами, форма тела которых была построена по типу «стеганого одеяла», т. е. оно состояло из однообразных члеников, устроенных по одному образцу — различные варианты широкой ленты со вздутиями. Наличие повторов таких сложных структур, как членики, свидетельствует о первых пробах кластерной организации генов. Видовое разнообразие на этом уровне дифференциации многоклеточных организмов еще было незначительным (рис. 39).

Рис. 39. Эдикарская фауна — пример игр ретроэлементов в эволюцию
Сприггина — по-видимому, кольчатый червь, начавший эволюционировать в сторону членистоногих (образовался головной щит, почти как у трилобита). «Существа» строятся за счет повторов кластеров генетической информации. Питаясь путем диффузии через поверхность тела, они не нуждались во внутренних органах; и, возможно, были не многоклеточными, а синцитиальными (многоядерными). Рисунок с сайта: http://www.macroevolution.narod.ru/_pediacara.htm.
Нельзя считать, что и та эволюционная игра ретроэлементов была неудачной. Эдикарская фауна существовала десятки миллионов лет и оставила след в геологических отложениях. Такие «стеганые одеяла» достигали до полутора метров в длину и, возможно, они до сих пор качались бы в морской толще, если бы не накопившаяся критическая масса ретроэлементов. Из них и благодаря им начал формироваться механизм генных перестановок, известный сегодня как V(D)J-рекомбинация. Этот процесс, как впрочем, и все остальное в эволюции, начался со случайности.
По данным, обобщенным В. Г. Галактионовым (2004, 2005), J. Klein и H. Nicjladis (2005), прародителем V-генов суперсемейства иммуноглобулинов (вариабельные области L- и H-цепей иммуноглобулинов — от их взаимодействия между собой зависит специфичность иммуноглобулиновых белков) был ген белка Thy-1. Он образовался не менее 2 млрд лет назад в результате дивергенции какого-то другого более древнего гена белка, послужившего прототипом V- и С-доменов (см. «Суперсемейство иммуноглобулинов»).
Но прежде чем возникло основное свойство Ig-SF — разнообразие специфического взаимодействия с высокомолекулярными структурами, должно было произойти другое важное эволюционное событие — фрагментация V-гена. Ждать его после появления гена белка Thy-1 пришлось всего 1,5 млрд лет. Главным «виновником» формирования современного Ig-SF оказался ретровирус, который внедрился в единый V-ген предков позвоночных животных около 450 млн лет назад. Это событие привело к расщеплению V-гена на собственно V-ген и D- и J-сегменты. Геномные участки, оказавшись самостоятельными, подвергались обычным генетическим процессам — в первую очередь транслокациям, тандемным дупликациям, рекомбинациям и случайным мутациям, инициируемым ретроэлементами.
Сначала многообразие таких структур увеличивалось за счет транслокаций (например, члены Ig-SF, имеющие V2-C2- и V1-C1-комбинации доменов) и тандемных дупликаций, включающих не только отдельные С- и V-гены, но и генные блоки V-C, в том числе те, которые усложнены включением D- и J-сегментов (V-D-J-C) или (V-J-C); т. е. в организации таких генов можно увидеть аналогию со «стегаными одеялами» эдикарской фауны. В результате сформировался кластерный тип контроля над специфичностью антиген-распознающих молекул. Однако подобный тип формирования Ig-SF имел пределы, обусловленные величиной генома и невозможностью бесконечного наращивания кластерного типа организации генов. И вновь эволюции жизни помогла «случайность» ретровирусной эволюции, обусловленная активностью ретроэлементов генома простейших и первых многоклеточных.
Интродуцировавшиеся в геном первых позвоночных ретровирусные гены рекомбиназ RAG-1 и RAG-2 ускорили процесс реорганизации V-, D-, J-генных сегментов (см. «Локус генов Rag1/2»). Случайность объединения V-, D-, J-генных сегментов определила множественность синтезируемых V-доменов и возможность дальнейшей эволюции специфического иммунитета. Сколько потребовалось миллионов лет для реализации такой «случайности», неизвестно, но их уже не приходилось «ждать» миллиарды лет — эволюционный маховик начал раскручиваться. Возникло множество V-генов (у млекопитающих в настоящее время их более 500). Недавние исследования последовательностей генома человека показали, что Ig-домены кодируют не менее 765 генов из 24 тыс. (Lander E. S. et al., 2001). Подробно об этих процессах можно прочитать в работах В. Г. Галактионова (2005) и J. Klein и H. Nicjladis (2005), ниже мы приводим только схему эволюции Ig-SF (рис. 40).
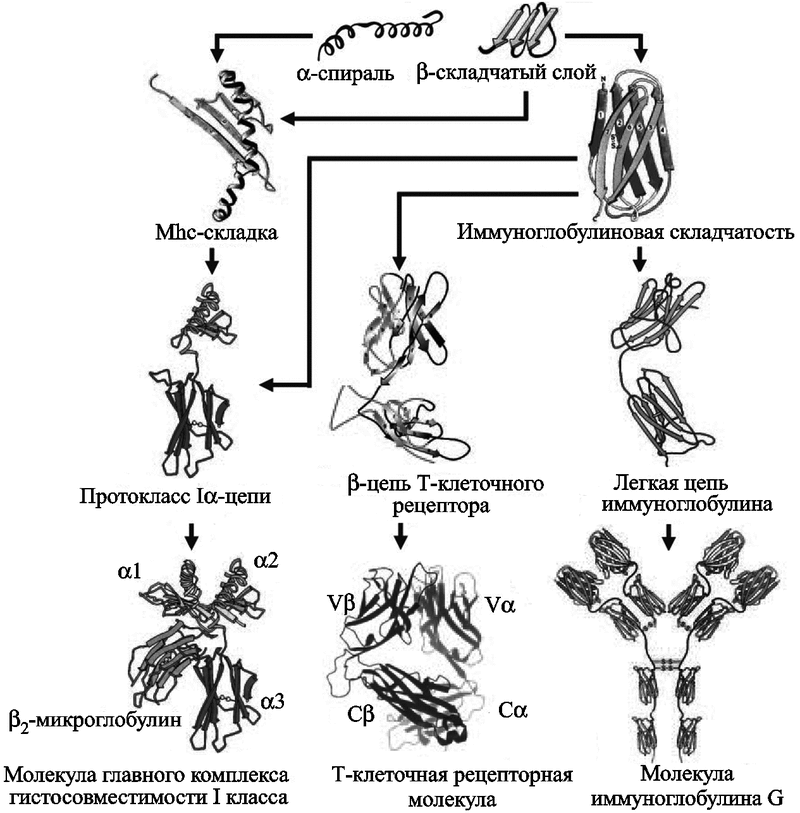
Рис. 40. Схема эволюции Ig-SF по J. Klein и H. Nicjladis (2005)
Молекулы ГКГС, рецепторов Т- и В-клеток появляются в результате процессов, за которыми всегда стоят ретроэлементы — дупликации и рекомбинации общих (анцестральных) генов. В данном случае это были гены, кодирующие бета-структурные слои и альфа-спиральные положения Ig-fold.
С закреплением естественным отбором механизма V(D)J-рекомбинации, стало возрастать количество структур, способных к специфическому узнаванию «своего» (гомофильное узнавание) и «чужого» (гетерофильное узнавание). Дупликации и перестановки экзонов генов Ig-SF дали естественному отбору больше альтернатив в выборе конкурентоспособных многоклеточных структур. Эволюция живых существ теперь могла идти не только по пути наращивания структур, устроенных по одному образцу, но и по пути их дифференциации (табл. 10).
Таблица 10*
Антигенраспознающие рецепторы и иммуноглобулинподобные белки с гомофильной и гетерофильной формами взаимодействия в различных систематических группах
|
Молекулярная формула |
Обозначение |
Таксономическая группа |
Взаимодействие с лигандом |
|
V2 |
Thy-1, Po |
От одноклеточных до млекопитающих |
Гомофильное |
|
V2-V2 |
RTK, SAM |
Губки |
Гомофильное |
|
V2-V2 |
DTRK |
Насекомые |
Гомофильное |
|
V2-V2/C2 |
NITR |
Костистые рыбы |
Гомофильное |
|
V1-C1-C1-C1-C1-C1 |
NAR |
Хрящевые рыбы |
Гетерофильное |
|
(Vl-D-J-Cl)n |
Ig, TKP |
Хрящевые рыбы |
Гетерофильное |
|
Vln-Dn-Jn-Cln |
Ig, TKP |
Челюстноротые позвоночные |
Гетерофильное |
* По В.Г. Галактионову (2005).
Осуществляющие функцию фагоцитоза симбионты-простейшие (выше их совокупность в пределах многоклеточного организма мы условились называть реликтовой иммунной системой), по-прежнему, как и в архее (см. подглаву 2.2), использовались отдельными паразитическими микроорганизмами для размножения, но уже в пределах многоклеточного организма. Естественный отбор не мог предложить многоклеточным организмам альтернативу Ig-SF, выходящую за рамки организации сложившихся межклеточных взаимодействий.
Многоклеточность могла «работать» против ретровирусов, если бы она не закреплялась естественным отбором параллельно с системами репродукции и иммунитета. Этот механизм очень важно понять.
Среди простейших эукариотов ретровирусы передавались как вертикально при их делении (эндогенные ретровирусы и ретроэлементы), так и горизонтально (экзогенные ретровирусы путем взаимодействия с рецепторами на поверхности клеток или прямой передачей по филоподиям; см. подглаву 1.1). По мере усложнения многоклеточной жизни эти механизмы распространения ретровирусов должны были потерять свое значение по следующим причинам.
Во-первых, специализация клеток (тканей) вела к тому, что многоклеточные организмы неизбежно должны были получить некую оболочку, отграничивающую их от окружающей среды. Тем самым блокировался бы и доступ к рецепторам клеток, в которых происходит их персистирование и размножение, т.е. в фагоцитирующих клетках, теперь уже специализирующихся в роли «мусорщиков». Что и произошло в отношении других паразитов свободноживущих простейших, например, возбудителей чумы, сибирской язвы, туляремии, ортопоксвирусных инфекций и др., не способных интегрироваться с геномом хозяина. Случайно попав в организм многоклеточного животного, они либо вызывают его гибель, либо элиминируются клетками иммунной системы, осуществляющими функцию «присмотра» за их потенциальными хозяевами — фагоцитирующими клетками (см. ниже «Иммунная система»). Использовать его для собственного поддержания в природе они не могут (см. подглаву 2.2).
Во-вторых, «унаследованные» многоклеточными организмами ретровирусы и другие ретроэлементы без механизма их обмена с другими многоклеточными организмами, подверглись бы нейтральной эволюции и генетико-автоматическим процессам.
Оба этих явления, разумеется, имели место в ходе эволюции многоклеточных форм жизни постоянно, но они компенсировались горизонтальной передачей экзогенных ретровирусов и их последующей (а иногда и повторной) эндогенизацией (см. подглаву 1.2). А вот ответ на вопрос — почему естественный отбор закрепил горизонтальную передачу ретровирусов за многоклеточными, может быть следующим. Он не мог отобрать другие формы многоклеточной жизни — без ретровирусов они не «собрались» в единое целое и не размножались.
Эндогенные ретровирусы активны на всех этапах репродукции многоклеточных организмов: сперматогенез и овуляция, регуляция экспрессии генов плаценты, трофоэктодермальный рост и дифференциация (trophectoderm growth and differentiation), взаимодействие между плодом и матерью, подавление иммунных реакций со стороны организма материи в отношении плода, дифференциация тканей плода и др. (см. работы Arimi M. M. et. al., 2006; Prudhomme S. et al., 2005). Уже у кольчатых червей (Annelida, сегментированные черви) многочисленные фагоцитирующие клетки не способны поглощать живые сперматозоиды своего вида, но активно устраняют погибшие клетки и сперматозоиды других видов (Купер Э., 1980).
Показателен и сам механизм участия эндогенных ретровирусов в формировании плода. В плаценте оболочечные белки ретровирусов выполняют ту же роль белков слияния, что и при формировании протоклеточных образований в архее; и при переходе одноклеточных форм жизни в многоклеточные во времена так называемой эдиакарской фауны (см. рис. 39). Они экспрессируются в синцитиотрофобластном слое (syncytiotrophoblast layer), образованном посредством слияния мононуклеарных цитотрофобластов, и образуют участки синцития в тех участках плаценты, где начинается взаимодействие матери и плода (Dunlap K. et al., 2006). Уже эти данные свидетельствуют о том, что информация, определяющая целостное развитие многоклеточного организма, хотя и содержится в зиготе, но только как некая потенция, которая не реализуется без участия ретровирусов матери.
Путь экзогенным ретровирусам в многоклеточный организм прокладывается и подстраховывается самим многоклеточным организмом посредством полового процесса. Феномен хорошо изучен у людей. Семянная жидкость содержит большое количество различных иммуносупрессивных агентов. Они подавляют иммунные реакции на аллогенные белки, представленные на поверхности сперматозоидов и в семянной жидкости, со стороны слизистых поверхностей нижних половых путей женщины. Это увеличивает продолжительность жизни сперматозоидов и гарантирует зачатие (Kelly R. W. et al., 1991). Но одновременно семянная жидкость препятствует устранению инфицированных вирусами макрофагов посредством киллерной активности Т-клеток и натуральных киллерных клеток (NK-клетки), так как действие цитокинов, вызывающих такие реакции, переключается макроорганизмом «с точностью наоборот». Активность этих клеток стимулируется интерлейкином 12 (IL12) и подавляется интерлейкином 10 (IL10), однако в нижних родовых путях женщины активность IL12 подавлена, а IL10 стимулирована (Kelly R. et al., 1997).
Сами сперматозоиды к передаче экзогенных ретровирусов между особями вида Homo sapiens отношения не имеют. По данным A. J. Quayle et al. (1997), в 75 % исследованных им образцов спермы ВИЧ-серопозитивных людей ВИЧ были инфицированы Т-клетки, и в 38 % образцов — макрофаги. Но ими ни в одном эксперименте не была обнаружена ДНК ВИЧ в подвижных сперматозоидах. По данным же P. L. Vernazza et al. (1997), количество РНК ВИЧ крови коррелирует с количеством РНК ВИЧ семянной жидкости, т.е. по отношению к ВИЧ кровь и семянная жидкость являются «сообщающимися сосудами».
Система иммунитета , которую привычно называют «врожденной» (фагоцитоз, комплемент), также соблюдает интересы ВИЧ, а не человека. По данным H . Bouchlal et al . (2002), оба, X 5- и R 5-тропные штаммы вируса проникают через слизистую и инфицируют эпителий половых путей благодаря активации факторов комплемента, содержащихся в семянной жидкости. Благодаря опсонизации они инфицируют клетки, имеющие рецептор комплемента на своей поверхности.
Еще более надежно «подстраховывается» иммунной системой человека передача ВИЧ от матери к плоду. Его транспорт через синцитиотрофобластный слой осуществляется с помощью антител к gp120 и gp41 по обоим механизмам, объединенным под названием «феномен антителозависимого усиления инфекции» (см. Toth F. D. et al., 1994; и подглаву 3.2 «Феномен антителозависимого усиления инфекции»).
Третий акт творения — «кембрийский взрыв». Теперь, когда иммунная система первых позвоночных «научилась» поддерживать их целостную структуру и одновременно стала средой размножения ретровирусов, вращение маховика эволюции еще более ускорилось. Палеонтологи отмечают, что 490—435 млн лет назад (Кембрий) на планете появились многоклеточные организмы современного типа, начался их выход из морей на материки и освоение ими всей поверхности Земли — этот феномен назван учеными Кембрийским взрывом. В триасе (Триасовый период, 230—190 млн лет назад) вращение маховика эволюции достигло своего максимума. В эволюции таксонов дупликации отдельных генов уступают их кластерной организации, теперь уже кластеры генов дуплицируются ретроэлементами, что периодически проявляется «неадаптивными признаками» у стремительно появляющихся новых многоклеточных видов. По суше затоптались животные причудливых форм и огромных размеров, само существование которых трудно объяснить «дарвиновской приспособленностью»: диплодки — нелепые травоядные гиганты с маленькой головой на тонкой длинной шее из десятков повторяющихся позвонков, поворачивающихся только в горизонтальном направлении. При наличии длинной шеи тяжелому диплодку пришлось миллионы лет питаться низкорослой растительностью на болотах; стегозавры — массивные травоядные ящеры с двумя рядами асимметрично повторяющихся тонких треугольных костяных пластин на спине, предназначение которых до сих пор вызывает споры среди ученых; и др. В конце юра (Юрский период, 190—136 млн лет назад) рыбу в морях ловили летающие ящеры-птеранодоны с размахом крыльев до 18 метров. И ответ на вопрос, кто тут к кому «приспосабливался» — вид к «неадаптивному признаку» или «неадаптивный признак» к виду, а вместе — к условиям окружающей среды, никак однозначно не следует из дарвиновских представлений об «эволюции без скачков». Но такое буйство разнообразия жизни должно было когда-то кончиться. Оно и кончилось — маховик эволюции «пошел в разнос» в меловом периоде (136—66 млн лет назад), что проявилось, прежде всего, вымиранием рептилий. Им на смену в высвободившиеся экологические ниши пришли млекопитающие (Палеогеновый период, 66—25 млн лет назад). Но их «золотой век» оказался еще короче, они стали угасать в неогене (Неогеновый период, 25—1,8 млн лет назад). Ныне живущие слоны, носороги, лошадиные лишь жалкие остатки палеогеновой фауны млекопитающих.
Торможение эволюции. Разумеется, некоторые палеонтологи объясняют массовые вымирания видов (кризисы биоразнообразия) тектоническими катастрофами и климатическими изменениями, и, в частности похолоданием климата. При этом они как бы не замечают того, что эти «вымирания» растягивались на десятки миллионов лет. Продолжительность же ледниковых эр на Земле составляет не менее трети всего времени ее эволюции за последние 2,5 млрд лет. А если учесть длительные начальные фазы зарождения оледенения и его постепенной деградации, то эпохи оледенения займут почти столько же времени, сколько и теплые, безледные, условия. Интересно то, что великое оледенение Пермского периода (закончилось 270 млн лет назад) не привело к принципиальному изменению фауны (более подробно о ледниковых периодах в истории Земли см. в кн. Б. Джона с соавт., 1982).
Сегодня (Кайнозой) условия для существования жизни лучше, чем в конце Архея и в Протерозое, однако биологическое разнообразие на планете снижается. И тому должны быть более серьезные основания, чем деятельность человека, так как и ему самому она не дает идеальной адаптации к факторам внешней среды. За последние 30 тыс. лет из трех видов «мыслящих» приматов, вымерли два, но и они уже не отражали того многообразия «мыслящей жизни», которое породили среди приматов толчки ретровирусной эволюции 5-2 млн лет назад (см. подглаву 1.2 и и рис. 6).
Когда эволюционисты пишут о неадаптивных признаках или видах, то обычно подразумевается то, что их должен устранить естественный отбор и, естественно, немедленно. Но в эволюции «немедленно» может соответствовать геологическим периодам или даже эпохам. Поэтому палеонтологи только фиксируют выборку видов-долгожителей из общей массы когда-либо возникавших форм. Быстро эволюционирующие виды наряду с быстро вымирающими видами не оставляют заметных следов в истории биосферы (рис. 41).
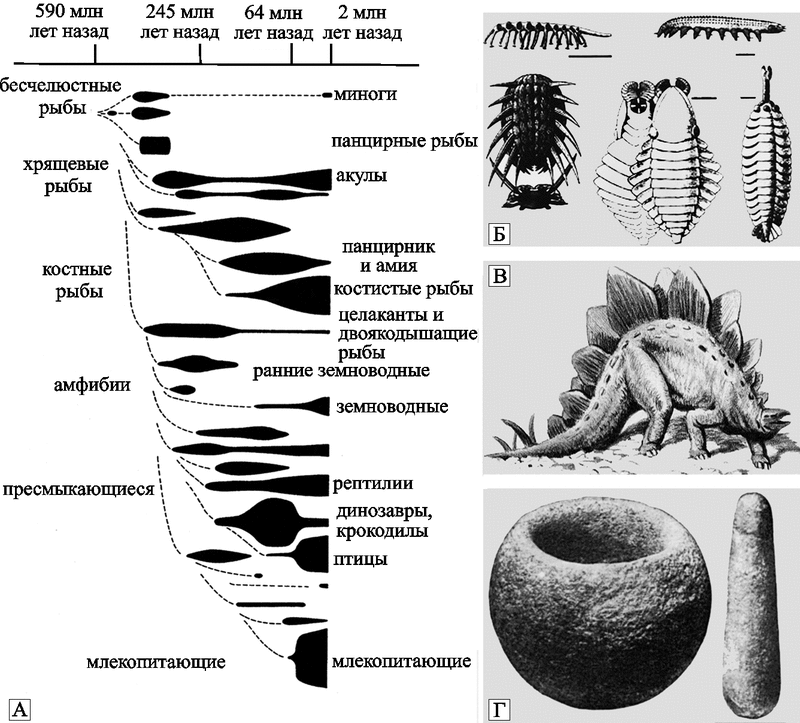
Рис. 41. Эволюция позвоночных
А — Многообразие групп позвоночных с отсутствующими звеньями быстро вымерших видов (пунктирные линии).
Б - кембрийская фауна; естественный отбор «экспериментирует» дупликациями генетического материала.
В — Триас; ящер-стегозавр с «неадаптивными» метровыми позвонками, образующими гребень с натянутой перепонкой - естественный отбор «манипулирует» уже кластерами генов и дупликациями генетического материала, ящер же долго не задержался.
Г — конец палеогена; каменные ступка и пестик, найденные в 1877 г. в породе, возраст которой насчитывает не менее 33 млн лет. Совсем не обязательно в этой находке видеть артефакт — в подглаве 1.2 приведены данные, показывающие, что активность мозга зависит от сценариев активности HERV-K и Alu-элементов. Предметы могли быть сделаны мыслящими существами палеогена, но не обязательно людьми. Интеллект — это не самый надежный адаптивный признак даже для человеческого общества. Для естественного отбора плоская голова может оказаться предпочтительней «мыслящей». Рисунки из книг Бэджента М., 2004; Яблокова А. В. и Юсуфова А. Г., 1998.
Если использовать терминологию, предложенную создателем неравновесной термодинамики И. Пригожиным (см., Пригожин И., Стенгерс И., 1986), то быстро эволюционирующие и быстро вымирающие виды можно назвать диссипативными , т. е. они представляют собой безвозвратные потери энергии (диссипации), затраченной в ходе ретровирусной эволюции на самоорганизацию живого. На эволюционном древе, если таковое удается построить, диссипативные виды занимают место коротких боковых побегов от основного ствола, оборвавшихся по неясным причинам.
Торможение маховика эволюции осуществлялось теми же разнонаправленными механизмами, какими он раскручивался, поменялся только их суммарный вектор. Ретровирусы, реплицирующиеся в цитоплазме клеток иммунной системы многоклеточных организмов, распространялись между особями половым путем, приводя к вымираниям те виды, где они не смогли пройти через процесс эндогенизации. Раскручивание маховика эволюции привело к переизбытку экзогенных ретровирусов, и, соответственно, к чрезмерному вымиранию молодых видов. Их эволюция обрывалась, биологическое разнообразие на планете сокращалось. Эндогенизировавшиеся ретровирусы увеличивали пластические возможности генома таксона и способствовали его эволюции по пути анагенеза или кладогенеза (см. подглаву 1.2). Однако и этот процесс оказался с «изнанкой».
Эндогенизация ретровирусов имела свои пределы из-за ограниченной емкости генома данного таксона — ретровирусная эволюция уступала место нейтральной (более подробно о феномене нейтральной эволюции см. в работе Masatoshi N., 2005). Но сами эндогенные ретровирусы не являлись статическими объектами. Они участвовали в неаллельных гомологических рекомбинациях генома хозяина (non-allelic homologous recombination), интегрировались с функционирующими генами, блокируя их функцию, тем самым снижали жизнеспособность отдельных особей (см. подглаву 4.2.4.). К тому же они и наследовались в последующих поколениях по законам Менделя. Их накопление в крупных панмиксических популяциях выше какого-то критического предела делало пластичность генома чрезмерной для дальнейшего существования вида.
Большое количество активных ретроэлементов способствовало избыточному синтезу обратной транскриптазы. Она транскрибировала случайным образом и с большим количеством ошибок (неправильные вставки оснований в растущей цепи кДНК с частотой от 1 на 1700 до 1 на 4000 оснований) уже не только ретровирусную РНК, но и другие клеточные РНК, обычно транскрибируемые РНК-полимеразой III. В результате активные транскрибируемые гены замещались псевдогенами, и эффективные метаболические процессы, лежащие в основе гигантизма триасовой жизни и великолепных форм юра, тормозились. На смену причудливым гигантам пришли «приглаженные» естественным отбором невзрачные мелкие особи с геномом, «забитым» псевдогенами (табл. 11).
Таблица 11
Псевдогены у человека и грызунов*
|
Ген |
Число генов |
Число псевдогенов |
|
ЧЕЛОВЕК |
||
|
Аргинино-сукцинат синтетаза |
1 |
14 |
|
В-актин |
1 |
20 |
|
В-тубулин |
2 |
15-20 |
|
Cu/Zn супероксид-дисмутаза |
1 |
4 |
|
Цитохром С |
2 |
20-30 |
|
Дигидрофолат-редуктаза |
1 |
5 |
|
Немускульный тропомиозин |
1 |
3 |
|
Глицеральдегид-3-фосфат дегидрогеназа |
1 |
25 |
|
Фосфоглицерат-киназа
(ген и ретроген) |
2 |
1 |
|
Рибосомальный белок L32 |
1 |
20 |
|
Триозо-фосфат изомераза |
1 |
5-6 |
|
МЫШЬ |
||
|
А-глобин |
2 |
1 |
|
Цитокератин эндо-А |
1 |
1 |
|
Глицеральдегид-3-фосфат дегидрогеназа |
1 |
200 |
|
Миозин (легкая цепь) |
1 |
1 |
|
Пропиомеланокортин |
1 |
1 |
|
Рибосомальный белок L7 |
1-2 |
20 |
|
Рибосомальный белок L30 |
1 |
15 |
|
Рибосомальный белок L32 |
1 |
16-20 |
|
КРЫСА |
||
|
А-тубулин |
2 |
10-20 |
|
Цитохром С |
1 |
20-30 |
*С сайта: http://humbio.ru/humbio/molevol/000fda4a.htm.
Введенное мною положение о ретровирусной эволюции (см. подглаву 1.1) возможно поможет найти некоторый консенсус в спорах между эволюционистами и креационистами (антиэволюционистами), касающихся причин якобы отсутствия промежуточных видов, подтверждающих сам феномен эволюции, и невозможности наблюдать эволюционные процессы сегодня. По первому предмету спора я писал выше. По второму выскажу только осторожное предположение. Массового видообразования в четвертичном периоде палеонтологи не фиксируют из-за исчерпания емкости генома большинства существующих таксонов позвоночных, о чем косвенно свидетельствуют псевдогенизация эволюционно наиболее активных их генов и возраст наиболее распространенных ретроэлементов (см. подглаву 1.2); но по этим же причинам палеонтологи имеют возможность фиксировать вымирание отдельных видов как часть эволюционного процесса.
Гуморальная и клеточная иммунные системы. Простейшие —фагоцитирующие эндосимбионты многоклеточных образований не могли при дальнейшем усложнении многоклеточной жизни защитить ее от случайного проникновения отдельных прокариотов и одноклеточных эукариотов. Отработанные в течение миллиардов лет совместной эволюции механизмы лиганд-рецепторного узнавания между этими формами жизни продолжали действовать и в новых условиях. Благодаря им реликтовая иммунная система играла роль Троянского коня для многоклеточного организма (см. подглаву 2.2). Поэтому преимущество под давлением естественного отбора стали получать многоклеточные виды, у которых формировались взаимосвязанные системы по узнаванию и элиминации инфицированных фагоцитирующих клеток. У позвоночных они сложились еще в одну систему иммунитета, которую ученые условно делят на гуморальную и клеточную.
Паразит (микоплазма, бактерия или вирус), попав в организм позвоночного животного, встречает там уже не только своих «старых знакомых» по архейской эре — фагоцитирующие клетки, но и нечто качественно иное — иммунную систему — т. е. комплекс взаимосвязанных реакций органов и тканей макроорганизма на такое проникновение. И если судить по работе Marketon M. et al. (2005), он «не узнает» клетки иммунной системы, эволюционировавшие уже в многоклеточных организмах. В селезенке мыши при экспериментальной чумной инфекции практически не поражаются Т- и В-клетки, составляющие там большинство. Зато «в полном составе» гибнут все фагоцитирующие клетки. «В упор не замечает» лимфоциты и возбудитель натуральной оспы (McFadden G., 2004).
Паразит, сумевший «незамеченным» проникнуть в фагоцитирующую клетку, становится слишком заметным иммунной системе, начав размножаться. Синтезирующиеся вирусные белки либо ЛПС бактерий образуют комплексы с поверхностными антигенами клетки (антигены гистосовместимости или трансплантационные антигены), а те распознаются Т-лимфоцитами. Активировавшиеся Т-лимфоциты связываются своими рецепторами с инфицированной фагоцитирующей клеткой и убивают ее посредством апоптоза и особых литических белков — перфоринов и цитолизинов, поэтому такое звено иммунитета называют клеточным.
Микроорганизм, сумевший размножиться в макрофаге, в дальнейшем имеет дело с неизвестными ему из архейской жизни клонами узкоспециализированных В-лимфоцитов, запускающих синтез антител, специфичных к его поверхностным белкам. Сам по себе В-лимфоцит для такого паразита безвреден, но связанный антителом, синтезированным В-лимфоцитом, он легко становится «добычей» тех, кого привык использовать для собственного обитания, питания и размножения. Эту часть иммунных реакций (включая активизацию системы комплемента) исследователи традиционно относят к гуморальному иммунитету.
Общим для генетических систем, кодирующих антитела, рецепторы В- и Т-клеток и трансплантационные антигены является их сложная интрон-экзонная организация и выраженная полигенность. Репертуар антител ученые затрудняются определить, считая, что он «насчитывает миллионы специфичностей». Ни одна другая генетическая система организма не имеет такого количества аллельных форм определенного гена, как трансплантационные антигены. В систему входят около 400 генов, обнаружено 3,6 млн строительных блоков ДНК, общее число фенотипов HLA составляет около 20 млрд. Системы не дублируют друг друга по специфичности распознавания антигенов. Сложная интрон-экзонная организация генов — это обычный результат деятельности ретроэлементов (см. рис. 7, 13 и 15). Более подробно об эволюции иммунной системы позвоночных можно прочитать в работах Албертса Б. с совт., 1994; Ройта А. с соавт., 2000; Стила Э. с соавт., 2002; Галактионова В.Г., 2004, 2005; Clark R., Kupper T., 2005 и др. В следующей главе мы рассмотрим «ответы» иммунной системы на ретровирусы, которые подтверждают высказанное выше положение о причастности ретровирусов к созданию иммунной системы многоклеточных организмов вообще, и человека в частности. Но прежде чем перейти к столь непопулярной у разработчиков ВИЧ-вакцин теме, я хочу обратить внимание читателя на роль в инфекционных и эпидемических процессах, вызываемых ретровирусами, так называемых антиретровирусных систем (факторов) клеток.
Белки AID/APOBEC. Семейство AID/APOBEC включает белки, способные деаминировать цитозин на урацил у однонитевых полинуклеотидов. Они выполняют разные физиологические функции в клетке. APOBEC1 (обнаружен первым) редактирует посредством этого механизма мРНК аполипопротеина В (ApoB), внедряя преждевременный стоп-кодон и индуцируя продукцию «обрезанного» ApoB, который имеет уже другую функцию. Роль APOBEC2 остается неясной, но эволюционно он считается «родительским» для всего семейства (Cullen B. G., 2006).
Активационно-индуцируемая деаминаза (activation-induced deaminase, AID) также имеет древнее происхождение. Она функционирует в активированных В-клетках, где случайным образом редактирует дезоксицитизин (deoxycytidine) в дезоксиуридин (deoxyuridine) в локусах иммуноглобулиновых генов и является триггером активации процесса соматической гипермутации (somatic hypermutation, SHM) Ig-вариабельного региона генов, которые кодируют антиген-связывающие сайты. Если активность AID оказывается направленной на не Ig-гены, то это приводит к злокачественному перерождению В-клеток, но механизм, отвечающий за «нацеливание» SHM на Ig-гены, неизвестен (Ronai D. et al., 2005).
Ген APOBEC 3G (apolipoprotein B mRNA-editing enzyme, catalytic polypeptide-like 3G) кодирует белок, который упаковывается в ретровирусные частицы, где дезаминирует цитозин на урацил в минус цепи вирусной ДНК в процессе обратной транскрипции. В результате чего в плюс цепи кДНК гуанозин заменяется аденином, и репликация ВИЧ останавливается. Этот механизм распространяется только на ВИЧ, лишенные гена белка Vif (фактор инфекционности вируса), и не влияет на продукцию вируса с полноценным Vif. Ген APOBEC 3G функционирует одинаковым образом как в Т-клетках-хелперах, так и в макрофагах (Wahl S. et al., 2006).
Геном человека и других приматов кодирует, по крайней мере, пять, а возможно, и семь таких белков, сгруппированных в отдельный генный кластер на хромосоме 22. Любопытно то, что белки APOBEC3 всегда (!) неэффективны в отношении ретровирусов, обычно инфицирующих Т-хелперы и макрофаги данного вида, но, как правило, оказываются эффективными в отношении гетерологичных ретровирусов (Cullen B. G., 2006). Если отказаться от антропоцентрических надежд на то, что иммунная система человека предназначена для существования только его самого, то придется признать, что благодаря белкам APOBEC3 Т-хелперы и макрофаги устраняют мутантные формы ВИЧ, не способные распространяться по популяциям вида Homo sapiens. По своей сути этот странный механизм компенсирует ошибки в гене vif, допущенные обратной транскриптазой при синтезе ДНК на матрице РНК.
Эволюционное происхождение APOBEC неясно. Гомологи APOBEC2 обнаружены у костных рыб, но APOBEC3 у рыб и птиц не выявлено. Скорость несинонимичных замен у APOBEC3 приматов значительно выше синонимичных, что свидетельствует о постоянном селективном давлении на них (Cullen B., 2006). В этой связи посмотрим на эволюцию и организацию всего семейства APOBEC3 генов (рис. 42).
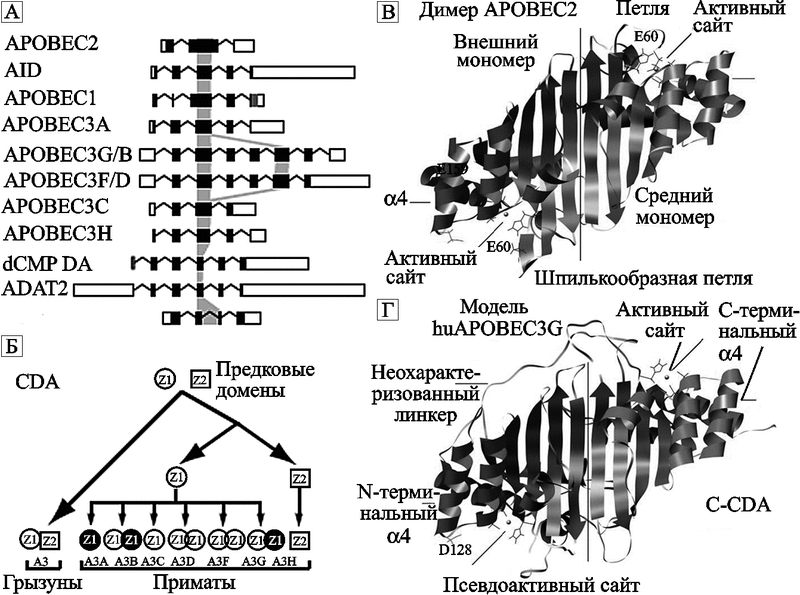
Рис. 42. Эволюция и организация APOBEC3
Левая часть рисунка: (A) Транслируемые и нетранслируемые участки транскриптов показаны заполненными и пустыми прямоугольниками соответственно. Экзоны, кодирующие цинккоординирующие домены (zinccoordinating domain — их использовали для построения эволюционного древа), затенены серым цветом. Заполненный серым цветом прямоугольник APOBEC1 соответствует участку последнего экзона без соответствующих последовательностей в других AID/APOBEC генах. (Б) Гипотетическая схема происхождения и дивергенции семейства APOBEC3 у млекопитающих, стартовавшая с двух анцестральных доменов (Z1 [круг] и Z2 [квадрат]), каждый из которых составляет двудоменный APOBEC3 или два отдельных, дивергировавших однодоменных APOBEC3. Z1 у приматов является весьма разнообразным. Он включает вариант, дивергировавший на субтипы Z1a (открытые круги) и Z1b (заполненные круги). По Conticello S. G. et. al., 2005.
Правая часть рисунка: (В) APOBEC2 «гомо»-димер. (Г) huAPOBEC3G (hu — человеческий). Выделены 6 активных и псевдо-активных сайтов, два цинк-иона и положение остатка D128, ключевого для взаимодействия с Vif. APOBEC3G имеет два домена цитозиндеаминазы (cytosine deaminase, CDA) — показаны антипараллельными бета-слоями; каталитически неактивный домен (N-CDA), содержит домен, взаимодействующий с Vif, необходимый для энкапсидации APOBEC3G. C-CDA — каталитически активный домен. Остатки с 124 по 127 играют активную роль в упаковке APOBEC3G в вирион ВИЧ. Остатки с 128 по 130 критичны для взаимодействия ВИЧ с Vif. По Zhang Kun-Lin et al., 2007.
S. G. Conticello et. al. (2005) считают такую организацию локуса APOBEC3 приматов следствием неправильного кроссовера и рекомбинации, характерных для ретровирусной активности. Во всяком случае, остатки ретровирусов с повторяющимися элементами (главным образом, LTR из ERV класса I) в сумме составляют до 19 % полного локуса APOBEC3 человека. Наиболее интенсивно они представлены в регионах, фланкирующих APOBEC3G и APOBEC3H. В пользу своей гипотезы S. G. Conticello et. al. (2005) приводят тот факт, что псевдогены APOBEC3 на хромосоме 12 происходят от ретротранспозиционных актов.
В свете приведенных данных по элиминации Т-клетками дефектных ВИЧ, представление о том, что ВИЧ поражает Т-клетки для того, чтобы размножаться, будет упрощением проблемы необратимости ВИЧ-инфекции. Надо отнестись серьезно к возможности и того, что в эволюционном прошлом позвоночных ретровирусы «создали» APOBEC3 «под себя», и эти белки продолжают играть какую-то не совсем понятную для нас роль в их собственной эволюции, происходящей уже с нашим участием. В этом аспекте проблемы любопытны данные M. C. Mikl et al. (2005), не обнаруживших фенотипические отклонения у мышей с разрушенным геном белка APOBEC3. К тому же остается неясным фактор, оказывающий селективное давление на эти гены в течение миллионов лет.
TRIM5альфа. Антиретровирусный белковый комплекс, названный трехсоставным взаимодействующим мотивом 5альфа (tripartite interaction motif 5альфа, TRIM5альфа), идентифицирован M. Stremlau et al. (2004) в клетках обезьян-резусов, обладающих способностью ингибировать активность ВИЧ-1. Вскоре разные группы исследователей продемонстрировали, что антиретровирусные факторы, известные как Ref1 (human antiviral factor; антивирусный фактор людей) и Lv1 (simian factor; обезьяний фактор), являются вариантами TRIM5альфа, специфичными для отдельных видов млекопитающих (Towers G. J., 2007). TRIM5 (также известен как RBCC-домен; RBCC domain), включает RING-домен (RING domain), B-бокс 2-домен (B Box 2 domain; Box — в данном случае это научный сленг, речь идет об экзоне, на схеме обозначенном квадратом) и свернутое кольцо (coiled coil), благодаря которому этот комплекс получил такое странное название. RING является цинк-связывающим доменом, обычно вовлеченным в специфические белок-белковые взаимодействия. Многие RING-домены обладают Е3-убиквитинлигазной активностью (E3 ubiquitin ligase activity), т. е. способностью метить субстраты для протеаз, тем самым повышая специфичность их действия. Поэтому TRIM5 вызывает RING-зависимую аутоубиквитинилацию белков (auto-ubiquitinylation) — он вносит в молекулу оболочечного белка вируса сигналы протеолитической деградации. B-бокс существует в двух альтернативных вариантах — либо B-бокс 1, либо B-бокс 2. TRIM5 включает B-бокс 2. B-боксы имеют цинк-связывающий мотив и вовлечены в белок-белковые взаимодействия. Два типа В-боксов имеют различающиеся первичные последовательности, но в третичных структурах, образуемых RING, в их конформации особых отличий нет (Towers G. J., 2007).
мРНК TRIM5 подвергается многократному сплайсингу, образуя семейства изоформ, каждая из которых короче другой от С-конца. Наибольшая по длине изоформа, TRIM5альфа, кодирует C-терминальный B30.2-домен, взаимодействующий с вирусным капсидом и определяющий антивирусную активность TRIM5. Самые короткие изоформы, TRIM5гамма и TRIM5бета, не имеют B30.2-доменов и действуют как ограничители активности TRIM5альфа при сверхэкспрессии TRIM5. Если предположить, что короткие изоформы TRIM5 формируют гетеромультимеры посредством сворачивания кольца (via the coiled coil) и конкурируют за связывание с вирусом с B30.2-доменами, то можно также предположить и то, что антиретровирусная активность регулируется через сплайсинг РНК TRIM5. Кроме того, отдельный белок TRIM, обладающий антиретровирусной активностью, может блокироваться в результате воздействия на него других TRIM-белков. Например, экспрессия TRIM34 может уменьшить антиретровирусную активность TRIM5 через их гетеромультимеризацию (Zhang F. et al., 2006; Towers G. J., 2007).
TRIM5альфа является тримерным белком и взаимодействует с гексамерным капсидом вируса через пролиновые пептидные группы, находящиеся в cis-конформации. Он способен быстро «обвиться» вокруг капсида вируса перед его взаимодействием с протеасомой и внести «сигналы» для протеолиза посредством RING-зависимой аутоубиквитинилации (см. выше). Формирование комплекса «вирус-TRIM5альфа» блокирует этап «раздевания» вируса и перенос его нуклеиновой кислоты в ядро клетки. Инфекция блокируется еще до обратной транскрипции вирусной РНК. Исследование TRIM5альфа у близкородственных приматов показало, что различия между ними, определяющие антивирусную специфичность, обнаруживаются в участках B30.2-домена. Судя по высокому соотношению dN/dS, эти участки белка, соответствующие его поверхностным петлям, в ходе эволюции приматов подверглись позитивной селекции (Towers G. J., 2007).
Протеиновое семейство TRIM возникло в результате дупликации последовательности предкового гена, что характерно для активности ретроэлементов. Ген TRIM5 человека расположен на хромосоме 11 в пределах группы тесно связанных TRIM, включающих TRIM 5, 6, 34 и 22. Эти TRIM либо не имеют, либо имеют относительно слабую антиретровирусную активность против близких ретровирусов (ВИЧ-1, ВИЧ-2, SIVmac, EIAV и MLV). Трудно сказать, почему это происходит. Возможно, они имеют какую-то другую, альтернативную функцию, или они просто неактивны против этой «выборки» ретровирусов. Во всяком случае, TRIM 6, 22 и 34, непохожие на TRIM5, не имеют B30.2 доменов, что предполагает в эволюционном прошлом отсутствие на них того селективного давления, которому подвергался TRIM5 (Li X. et al., 2007).
Взаимодействие между ВИЧ-1 и TRIM5альфа в клетках приматов Старого Света возможно благодаря циклофилину А (сyclophilin A, CypA). CypA — пептидилпролилизомераза (peptidyl prolyl isomerase), выполняющая цис/транс-изомеризацию (сis/trans isomerisation) пролиновых пептидных групп (proline peptide bonds) белков. CypA взаимодействует с молекулами gag лентивируса в инфицированных клетках, приводя их к рекрутингу в «нарождающиеся» вирионы (Thali M. et al., 1994). CypA также взаимодействует с проникшим в клетку кором ВИЧ-1. И такое взаимодействие более важно для поддержания инфекционности вируса, чем взаимодействие циклофелина с «собирающимся» кором (Towers G. J. et al., 2003). CypA выполняет cis/trans-изомеризацию пептидных групп G89-P90 на наружной поверхности капсида ВИЧ. Эта активность пополняет cis-конформацию капсида и вовлекает капсид в рестрицирующийся комплекс с TRIM5альфа. Если активность CypA в клетке-мишени снижена, то TRIM5альфа не может взаимодействовать с капсидом, по большей части находящимся в trans-конформации (Towers G. J., 2007).
Тот факт, что гены TRIM 10, 15, 26, 27, 31, 38, 39 и 40 ассоциированы с главным комплексом гистосовместимости на хромосоме 6 и во время гриппозной инфекции их экспрессия усиливается, позволяет предположить возможность их участия в работе системы гуморального и клеточного иммунитета (Nisole S. et al., 2005). Однако активность CypA не связана с активностью TRIM5альфа. Поэтому Z. Keckesova et al. (2005) считают антиретровирусную активность TRIM5альфа не зависящей от реакций иммунной системы человека.
Оба известных антиретровирусных фактора, TRIM5альфа в комплексе с CypA и APOBEC3, защищают клетки только от «чужеродных» для них ретровирусов. В отношении же «своих» ретровирусов они являются фильтрами, гарантирующими виду, что другие экзогенные ретровирусы не могут составить им конкуренцию. Для вида Homo sapiens антиретровирусные факторы TRIM5альфа и APOBEC3 являются гарантами успешности его инфицирования ВИЧ-1. С антропоцентрической точки зрения их существование с такой функцией бессмысленно. Однако если посмотреть на распространение ретровирусов в эволюционном аспекте проблемы, то смысл в поддержании естественным отбором TRIM5альфа и APOBEC3 все же есть. Они обеспечивают условия для эндогенизации в зародышевую линию хозяина экзогенных ретровирусов, что происходит в ходе процесса, который мы понимаем как пандемический. Чем более масштабный характер принимает пандемия, тем больше генетическое разнообразие как самих ретровирусов, так и взаимодействующих с ними хозяев. Эндогенизация происходит случайно, но это такая же случайность, как и выстрел из револьвера при игре в «русскую рулетку», когда заполнение патронами барабана и нажатие на курок происходят со все возрастающей скоростью.
***
Эволюционное прошлое иммунной системы многоклеточных организмов свидетельствует о закреплении за ней естественным отбором резервуарной роли по отношению к ретровирусам. Поэтому можно утверждать, что эволюционный процесс среди многоклеточных организмов (по крайней мере, из царства животных) реализуется через клетки, которые мы относим к иммунной системе. В нашем восприятии времени мы видим только одну их функцию — защиту организма от антигенно-чужеродных веществ. Но благодаря клеткам иммунной системы происходит размножение и накопление экзогенных ретровирусов до какой-то критической массы, которая позволяет некоторым из них эндогенизироваться в зародышевой линии отдельных особей инфицированного вида, и в дальнейшем передаваться вертикально, меняя его эволюционную траекторию по механизму аллопатрического или симпатрического видообразования. ВИЧ/СПИД-пандемия среди вида Homo sapiens — частное проявление этого процесса в эволюции таксона приматов.
Метки: чума
