Микроорганизмы, токсины и эпидемии. 1.7. Инфекции у иммунодефицитных людей
Что бы понять, какие возможности для размножения и расширения ареала предоставляет паразитическим микроорганизмам иммунодефицитность человеческих популяций, вернемся к условиям, при которых возможна инфекционная болезнь. Среди них выделяют три: вирулентность микроорганизма, способ его передачи и чувствительность хозяина [Morris J.G., Morris P., 1997]. Если у иммунокомпетентных организмов для возникновения инфекционной болезни требуется сочетание всех трех условий, то для иммунодефицитных организмов последнее условие становится предопределяющим для действия первых двух.
Увеличение чувствительности организма к возбудителю инфекции можно выразить через понятие «инфицирующей дозы». Эта доза резко снижается для организмов, ранее неизвестных в качестве патогенов людей. Организм сталкивается с совершенно новыми для него факторами вирулентности паразитов, паразиты же приобретают совершенно новые для себя пути переноса в организм хозяина. Какой возбудитель вызовет инфекцию в конкретном случае, зависит от этиологии и патогенеза иммунодефицита.
Иммунодефицитные состояния. Иммунодефицитность — понижение функциональной активности основных компонентов иммунной системы, ведущее к нарушению защиты организма от микробов и проявляющееся в повышенной инфекционной заболеваемости [Хаитов P.M., Пинегин Б.В., 1999].
Все иммунодефицитные состояния делятся на две большие группы: врожденный (наследственно обусловленный иммунодефицит) и приобретенный иммунодефицит [Галактионов В.Г., 1998].
Нарушения в работе иммунной системы могут быть связаны либо с одной из клеточных популяций (Т-клетками, В-клетками, макрофагами), либо с комплексными нарушениями, затрагивающими многие звенья иммунитета [Галактионов В.Г., 1998]. При дефиците гуморального иммунитета преобладают бактериальные инфекции, при дефиците клеточного — вирусные, протозойные, грибковые [Лысенко А.Я. и др., 1996].
В основе наследственно обусловленного иммунодефицитного состояния лежат дефекты генов, контролирующих работу определенных звеньев иммунной системы. В настоящее время идентифицировано более 70 врожденных дефектов иммунной системы и, вероятно, с улучшением методов молекулярной диагностики, их число будет расти. Общей чертой всех видов приобретенных иммунодефицитов является наличие рецедивирующих, хронических инфекций, поражающих различные органы и ткани, и, как правило, вызываемые микроорганизмами с низким уровнем вирулентности [Хаитов Р.М., Пинегин Б.В., 1999]. Однако различные механизмы развития первичных иммунодефицитов приводят к развитию различной инфекционной патологии. В табл. 8 перечислены наследственно обусловленные состояния и наиболее характерные для них инфекционные болезни [Галактионов В.Г., 1998]. Как следует из приведенных данных, атипичное и упорно течение инфекций, вызываемых маловирулентными микроорганизмами, также латентные и персистентные инфекции, обычно вызываемые возбудителями, использующими первую стратегию паразитизма, могут быть следствием нераспознанных иммунодефицитных состояний. Среди них не только врожденные, но и приобретенные.
Таблица 8
Иммунодефицитные состояния человека и чувствительность к возбудителям инфекционных болезней
|
Название иммунодефицита |
Основное нарушение |
Повреждение в иммунной системе |
Чувствительность к патогенам |
|
Х-сцепленная агаммаглобулинемия |
дефект синтеза btk-тирозинкиназы |
Отсутствие В-клеток |
внеклеточные бактерии, вирусы |
|
Общий варьирующий иммунодефицит |
неизвестно, сцеплено с Х-хромосомой |
Дефект гуморального ответа на полисахариды |
внеклеточные бактерии |
|
Селективный дефицит IgA |
Неизвестно, сцеплено с МНС |
Отсутствие синтеза IgA |
возбудители респираторных инфекций, вирусы |
|
Селективный дефицит иммуноглобулинов |
делеция С-генов иммуноглобулинов |
Дефект образования одного или более изотипов иммуноглобулинов |
инкапсулированные внеклеточные бактерии |
|
Синдром Wiskott-Aldrich |
неизвестно, сцеплено с Х-хромосомой |
Дефект гуморального ответа на полисахариды |
внеклеточные бактерии |
|
Синдром Х-сцепленной гиперпродукции IgM |
дефект в CD40-лиганде |
Отсутствие переключения изотипов |
общая |
|
Синдром DiGeorge |
аплазия тимуса |
Отсутствие Т-клеток |
общая |
|
Cиндром обнаженных лимфоцитов |
резко сниженная экспрессия молекул II класса МНС |
Отсутствие CD4-T-клеток |
вирусы |
|
Дефицит молекул I класса МНС |
мутация ТАР-гена |
Отсутствие CD8-T-клеток |
вирусы |
|
Тяжелые комбинированные иммунодефициты |
Х-сцеплено, дефицит гамма-цепи рецептора для ИЛ-2 (IL-2гамма) |
Отсутствие Т-клеток |
общая |
|
аутосмальные дефекты репарации ДНК |
Отсутствие Т- и/или В-клеток |
общая |
|
|
дефицит аденозиндезаминазы |
Отсутствие Т-клеток |
общая |
|
|
дефицит пуриннуклеотидфосфорилазы |
Отсутствие Т-клеток |
общая |
|
|
Дефицит фагоцитоза |
многие повреждения |
Отсутствие фагоцитарной активности |
внеклеточные бактерии |
|
Дефицит комплемента |
многие повреждения |
Отсутствие специфических компонентов комплемента |
внеклеточные бактерии |
|
Дефект натуральных киллеров |
неизвестно |
Отсутствие функции натуральных киллеров |
вирусы герпеса |
|
Дефицит белков, связывающих маннозу |
Неизвестно |
Низкий уровень связывания маннозы белками |
внеклеточные бактерии |
Приобретенный иммунодефицит является результатом воздействия факторов внешней среды на клетки иммунной системы. Из наиболее изученных факторов, следует отметить облучение, действие лекарственных препаратов, недоедание, СПИД, микоплазмы. Для приобретенных иммунодефицитов так же характерна ассоциируемость не со всеми, а с отдельными возбудителями инфекционных болезней. Ниже мы рассмотрим это явление на примере СПИД-ассоциируемых инфекций. Однако сначала рассмотрим структуру иммунодефицитных популяций населения.
Составляющие иммунодефицитных популяций. Еще несколько десятилетий назад иммунодефицитность населения не играла сколько-нибудь серьезной роли в возникновении и распространении возбудителей новых инфекций. При исследовании доноров примерно у 0,3% из них находили врожденную дефицитность по иммуноглобулину А. У таких людей отмечали повышенную чувствительность к респираторным и диарейным болезням [Buckley R., 1996]. Однако серьезной проблемой для здравоохранения их инфекционная патология не представляла. Повышенной чувствительностью к возбудителям инфекций страдали люди, ослабленные из-за недостатка питания. Но и это не было проблемой развитых стран, потому изучению особенностей инфекционной заболеваемости в таких популяциях серьезно не занимались. Ситуация стала меняться после появления новых методов лечения ранее неизлечимых соматических болезней, распространения СПИДа (рис. 33) и увеличения средней продолжительности жизни людей.
![Рис. 33 Причины смерти лиц от 25 до 44 лет в США. Величина смертности на 100000 человек [Morris J.G., Morris P., 1997]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-33.gif)
Рис. 33 Причины смерти лиц от 25 до 44 лет в США. Величина смертности на 100000 человек [Morris J.G., Morris P., 1997]
Больные СПИДом и ВИЧ-инфицированные. В 1997 г. в мире насчитывалось более чем 30 млн. ВИЧ-инфицированных и больных СПИДом людей [Kaplan J. et al., 1998]. В 1996 г. в США насчитывалось более 223 тыс. человек больных СПИДом. ВИЧ стал причиной наибольшего числа смертей среди лиц от 25 до 44 лет [Morris J.G., Morris P., 1997]. Пути проникновения возбудителей инфекций в эту группу лиц будут рассмотрены ниже.
Увеличение использования иммуносупрессивных агентов. Вызвано, с одной стороны, успехами в лечении онкологических больных, с другой, увеличением абсолютного количества таких больных и органных трансплантаций. Например, в США количество случаев выявления рака у мужчин возросло с 364 в 1972 г. до 462 на 100000 человек в 1994 г. У женщин, с 292 случаев до 347 на 100000 человек за этот же период. Увеличилась и продолжительность жизни больных. Это было достигнуто за счет использования более токсичных, чем в прошлом лекарственных препаратов, вызывающих глубокую нейтропению. Одновременно резко увеличилось количество трансплантаций сложных органов (легких, сердца, печени и др.), что, в свою очередь, привело к увеличению случаев применения иммуносупрессивных препаратов длительное время (рис. 34).
![Рис. 34. Количество трансплантаций органов в США. 1 — сердце-легкие; 2 — легкие; 3 — сердце; 4 — поджелудочная железа; 5 — печень; 6 — почки [Morris J.G., Morris P., 1997]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-34.gif)
Рис. 34. Количество трансплантаций органов в США. 1 — сердце-легкие; 2 — легкие; 3 — сердце; 4 — поджелудочная железа; 5 — печень; 6 — почки [Morris J.G., Morris P., 1997]
Многие, если не большинство из этих пациентов, были подвергнуты лечению антимикробными препаратами, которые одновременно оказывают сильный эффект на бактериальную флору кишечного тракта. Это привело к изменению микробной экологии, замещению нормальной микрофлоры патогенной и к повреждениям слизистой кишечника, облегчившим проникновение в кровь иммуносупрессированных лиц патогенов, обычно попадающих в организм с продуктами питания (сальмонеллы, листерии, токсоплазмы и др.) [Morris J.G., Morris P., 1997].
Увеличения средней продолжительности жизни людей. За последние четыре десятилетия в развитых странах резко возросло количество людей старше 74 лет. Например, в США их количество возросло с 3,8 млн. человек в 1950-м г. (2,6% от всей популяции), о 14,7 млн. человек в 1995 г. (5,6% популяции). Как результат старения, у таких людей резко уменьшена функциональная способность лимфоидной ткани кишечного тракта, снижены количества выделяемых в желудок пепсина и соляной кислоты. Это серьезно слабило барьерную функцию желудочно-кишечного тракта на пути проникновения патогенов в организм людей данной возрастной группы (рис. 35) [Bennett R., 1993].
![Рис. 35. Снижение барьерной функции желудочно-кишечного тракта в зависимости от возраста. Соотношение изолятов Salmonella, полученных из крови пациентов к общему числу изолятов [Morris J.G., Morris P., 1997]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-35.gif)
Рис. 35. Снижение барьерной функции желудочно-кишечного тракта в зависимости от возраста. Соотношение изолятов Salmonella, полученных из крови пациентов к общему числу изолятов [Morris J.G., Morris P., 1997]
Недоедание. Постоянное недоедание увеличивает чувствительность человеческой популяции к возбудителям инфекций по различным механизмам. Прежде всего, недоедание ослабляет целостность эпителиальных тканей и оказывает глубокое действие на клеточно-опосредованный иммунитет. Белковая недостаточность приводит к функциональным дефицитам иммуноглобулинов и дефектам фагоцитоза. Недоедание способно приводить к образованию «порочного круга», когда развившаяся болезнь способствует дальнейшему ухудшению питания [Santos J., 1994].
Оппортунистические инфекции при СПИДе. Такие инфекции определяют исход СПИДа. Те из них, которые характерно сопровождают терминальную стадию ВИЧ-инфекции, представляют собой особую, четко очерченную группу оппортунистических инфекций, называемых «СПИД-индикаторными» или «СПИД-ассоциируемыми» [Лысенко А.Я., Лавадовская М.В., 1992]. Как следует из табл. 9, хотя возбудителями СПИД-ассоциируемых инфекций и выступают условно-патогенные паразиты, не все из них могут вызвать СПИД-индикаторные болезни. Иными словами, между условно-патогенными паразитами и СПИД-ассоциируемыми инфекциями нет обязательной обусловленности [Лысенко А.Я. и др., 1996].
Таблица 9
Классификация возбудителей СПИД-индикаторных инфекций
|
Простейшие |
Грибы |
Бактерии |
Вирусы |
|
Toxoplasma gondii |
Candida albicans |
Salmonella sp. |
Herpes simplex |
|
Isospora belli |
Cryptococcus neoformans |
Mycobacterium avium complex |
Cytomegalovirus hominis |
|
Cryptosporidium spp. |
Histoplasma capsulatum |
Mycobacterium tuberculosis |
|
|
Pneumocystis carinii |
Coccidioides immitis |
|
|
Примечание: по данным европейских специалистов, этот перечень должен быть дополнен возбудителями висцерального лейшманиоза, бластоцитоза, акантамебиаза, стронгилоидоза и норвежской чесотки (Лысенко А.Ф., 1995).
Пути и сроки проникновения в организм возбудителей «СПИД-ассоциированных инфекций». Более половины из них проникает в организм человека еще внутриутробно или интранатально (табл. 10), однако их манифестация ограничивается клеточным иммунитетом [Лысенко А.Я. и др., 1996]. По данным этих же авторов, возбудители «СПИД-ассоциированных» инфекций используют только фекально-оральный и аспирационный пути передачи. Набор таких инфекций варьирует в зависимости от региона, поскольку в разных местностях существуют свои микробы-эндемики [Милз Д., Мазур Г., 1990].
Таблица 10
Вероятные сроки проникновения возбудителей СПИД-ассоциируемых инфекций в организм человека
|
Периоды |
||
|
Антенатальный |
Интранатальный |
Постнатальный |
|
Кандида |
Кандида |
Кандида |
|
Цитомегаловирус |
Цитомегаловирус |
Цитомегаловирус |
|
Вирус простого герпеса |
Вирус простого герпеса |
Вирус простого герпеса |
|
Токсоплазма |
|
Токсоплазма |
|
Вирус герпеса зостер |
|
Криптоспоридий |
|
|
|
Пневмоциста |
|
|
|
Изоспора |
|
|
|
Античные микобактерии |
|
|
|
Сальмонеллы |
|
|
|
Криптококк |
Установлено, что развитие определенных оппортунистических инфекций связано с количеством в крови CD4+ Т-лимфоцитов. У здоровых людей в 1 мм3 содержится около 1000 таких клеток. А у ВИЧ-инфицированных их число падает на 40–80 единиц ежегодно. Когда хелперных Т-лимфоцитов становится меньше 400–200 на 1 мм3, появляются первые инфекционные болезни — обычно не опасные, но беспокоящие больных инфекции кожных покровов и слизистых оболочек [Милз Д., Мазур Г., 1990]. Наиболее чувствительными к ослаблению иммунной защиты организма являются вирус герпеса зостер (опоясывающий лишай), кандида (молочница), вирус Эпштейна-Варра (волосатая лейкоплакия полости рта), туберкулезная палочка [Лысенко А.Я. и др., 1996]. Когда появляются такие симптомы, то это свидетельствует о наличие у человека связанного со СПИДом комплекса (стадия пре-СПИДа). То же относится к людям, которые страдают необъяснимыми лихорадками, диареей, ночными потами теряют в массе [Милз Д., Мазур Г., 1990]. На фоне прогрессирующего паралича иммунной системы (ранняя стадия СПИДа) активируются пневмоцисты, гистоплазмы, кокцидии, криптококки, токсоплазмы, вирус простого герпеса, криптоспоры. Поздняя стадия СПИДа (число Т4-лимфоцитов снижается до минимума) сопровождается активацией цитомегаловируса и атипичных микобактерий — предвестников фатального исхода [Лысенко А.Я. и др., 1996].
Особенности клинического течения. Иммунодефицитное состояние обостряет течение «СПИД-ассоциируемых» латентных инфекций. Однако своеобразие иммунодефицитного состояния при СПИДе, приводит к необычному течению таких инфекций, что особенно заметно при их сравнении у лиц с иммунологической дисфункцией (табл. 11). А.Я. Лысенко и соавт. (1996) выделяют следующие особенности течения инфекций у лиц с приобретенным иммунодефицитом:
1) инфекции имеют тенденцию протекать с опасной для жизни пациента остротой;
2) имеют тенденцию к диссеминации возбудителя с обнаружением его в эктопических органах и тканях;
3) слабую податливость специфической терапии с тенденцией к множественным рецедивам, что особенно характерно для пневмоцистоза, токсоплазмоза, криптоспоридоза, атипичных микобактериозови др;
4) слабый иммунный ответ на оппортунистического возбудителя.
Таблица 11
Характерные симптомы и признаки СПИД-ассоциируемых инфекций у людей различным иммунным статусом
|
Вид возбудителя |
Здоровье |
С иммунологической дисфункцией |
С приобретенным иммунодефицитом, в том числе вызванным ВИЧ |
|
Cryptosporidium spp. |
В подавляющем большинстве случаев — бессимптомное носительство |
Преходящая самокупирующая диарея |
Персистирующая водянистая диарея, диссеминация (холангит: холецистит, реактивный панкреатит, пневмония) |
|
Toxoplasma gondii |
У 99% — бессимптомное носительство, около 1% лимфаденопатия |
Лимфаденопатия, хроническая инфекция с органными поражениями, в том числе ЦНС |
Менингеальные знаки, двигательные расстройства (очаговая дистония, гемибаллизм), пневмония, хориоретинит |
|
Pneumocystis carinii |
В подавляющем большинстве случаев — бессимптомное носительство |
Интерстициальная пневмония |
Рецидивирующая интерстициальная пневмония, кавернизация легких, диссеминация с эктопическими поражениями (кожи, костей, сетчатки, щитовидной железы, кишечника, гепатобилиарной сисемы, костного мозга) |
|
Isospora belli |
Носительство или кратковременная самокупирующаяся диарея |
Хроническая диарея с признаками мальабсорбации |
Хроническая рецидивирующая диарея с диссеминацией возбудителя в лимфатические узлы |
|
Leishmania infantum |
У взрослых — латентная инфекция |
Лихорадка, гепато- и спленомегалия, панцитопения, иммуносупрессия |
Диссеминация с эктопическими поражениями (легочные инфильтраты, плевральные выпоты, эзофагогастродуоденит, поражение гепатобилиарной системы, кожные поражения). Характерно: часто нет спленомегалии, отсутствуют специфические антитела в сыворотке |
|
Acanthamoeba spp |
Носительство |
Изъязвление роговицы, гранулематозный энцефалит |
Энцефалит, некротическая пневмония, панникулиты |
|
Blastocystis nominis |
Носительство |
Легкая самокупирующаяся диарея |
Хроническая рецидивирующая диарея |
|
Strongyloides stercoralis |
В 50% случаев бессимптомно, линейная крапивница, бронхообструктивный синдром, легкая диарея, эозинофилия |
Гиперинвазивный и диссеминированный с присоединением бактериальной инфекции с септицемией, эозинофилия, парез кишечника |
Чаще всего диссеминированный стронгулоидоз: истощение, хроническая диарея: асцит, пневмония, нефрит, менингит, хроническая линейная крапивница |
|
Sarcoptes scabiei |
Чесоточные ходы, зуд |
Диссеминированная инвазия с тяжелыми кожными поражениями |
Диссеминированная инвазия, может служить ко-фактором сепсиса с летальным исходом |
|
Candida albicans |
В подавляющем большинстве случаев носительство |
Стоматит, эзофагит, хронический гранулематозный кандидоз кожи, диссеминированный (кандидемия, кандидоз ЦНС, гломерулонефрит, эндофтальмит, эндокардит, холецистит, гепатит) |
Стоматит, эзофагит, вагинит, кандидоз кожи, пневмония, очень редко кандидоз ЦНС |
|
Cryptococcusneoformans |
Чаще всего — бессимптомно, реже – менингит, острый бронхит |
Острый менингоэнцефалит, лихорадка, фунгемия, криптококкома кожи, остеомиелит, целлюлит, спондилит |
Подострый менингоэнцефалит, диссеминированная инфекция (миокардит, медиастенит, плеврит, интерстициальная пневмония, тиреоидит, панкреатит, нефрит, эндофтальмит) |
|
Histoplasma capsulatum |
В большинстве случаев — бессимптомно, 1% — острый диссеминированный |
Хронический легочный или хронический прогрессирующий диссеминированный гистоплазмоз |
Диссеминированный гистоплазмоз (истощение, лихорадка, гепатоспленомегалия, панцитопения, ДВС синдром, поражение кожи, менингит, хориоретинит) |
|
Coccidioides immitis |
В 50% случаев — бессимптомно, в 0.2–10% — абсцессы кожи, мягких тканей, л/узлов, костей, бронхопневмония |
Пневмония, лихорадка, лимфаденопатия, менингит, кардиомиопатия, спондилит |
Чаще всего кокцидиоидный “сепсис” — пневмония, абсцессы мозга, мягких тканей, кожи, почек, гепатит, панкреатит, поражение КМ, селезенки |
|
Cytomegalovirus hominis |
В подавляющем большинстве случаев — носительство |
Пневмония, гепатит, стоматит, эзофагит: “мононуклеозоподобный” синдром, виремия, анемия, тромбоцитопения |
Интерстициальная пневмония, стоматит, эзофагит, колит, проктит, менингоээнцефалит, полирадикуломиелит, адреналит хориоретинит, нефрит |
|
Herpes simplex |
Практически всегда — носительство, редко — гингивостоматит, локальные везикулярные высыпания на коже |
Стоматит, эзофагит, гепатит, пневмония, распространенные везикулярные высыпания на коже, часто рецидивирующего характера |
Стоматит, эзофагит, ретинит, менингоэнцефалит, пневмания, проктосигмоидит, перианатальный герпес, диссеминированное поражение кожи, гепатит, нечасто – генерализованная герпетическая инфекция |
|
Mycobacterium avium complex |
Носительство |
Хронический легочный, вялотекущий процесс |
Хроническая диарея, гепатоспленомегалия, лимфаденопатия, бактериемия, колит, поражение лимфоузлов (часто мезентериальных), редко – поражение легких |
|
Myco-bacterium tuberculosis |
Чаще всего – носительство, реже – туберкулез бронхов, очаговый, инфильтративный процесс в легких, разрешающийся полностью после адекватной терапии |
Очаговый, инфильтративный, склонность к развитию каверн, миллиарный туберкулез, довольно часто внелегочные формы (кости, ЦНС) |
Неблагоприятно протекающий, ранее приобретенный туберкулез, торпидность к общепринятой терапии, отрицательная кожная проба с туберкулином, часто туберкулез легких протекает по типу диффузной интерстициальной пневмонии, нередко внелегочные формы (поражение селезенки, лимфоузлов, почек, костей, кишечника, менингоэнцефалит) |
|
Salmonella spp. |
Очень часто носительство, редко – диарея, рвота, лихорадка, обезвоживание |
Пневмония, нефрит, гастроэнтероколит, септицемия, септикопиемия |
Практически всегда генерализованная форма, редко - гастроэнтероколит |
Причины «СПИД-ассоциируемости». Из приведенных выше данных следует, что только небольшая часть возбудителей оппортунистических инфекций способна генерализоваться на фоне иммунодефицита, индуцированного ВИЧ. Этому вопросу посвящено большое количество противоречивых публикаций, подробно проанализированных А.Я. Лысенко и соавт. (1996).
Исследователей поражает то обстоятельство, что нет никакой логики в «подборе» перечня «СПИД-ассоциируемых» инфекций. Возбудители крайне таксономически неоднородны, отсутствуют видимые признаки сходства в жизненных циклах и экологии (см. табл. 9). Между тем, данный перечень все же информативен. По нему, по крайней мере, можно судить о том, что таксономия, жизненный цикл экология этих возбудителей не являются предопределяющими в роли в развитии СПИДа, а причину «СПИД-ассоциируемости» надо искать среди каких-то эндогенных факторов инфицированного организма.
Выше мы отметили, что ВИЧ индуцирует синтез цитокинов (TNF, интерлейкины) инфицированными макрофагами, клетками микроглии и астроцитами. В последние годы появились доказательства того, что цитокины могут использоваться в качестве факторов роста для бактерий и паразитов [Denis M. et al., 1991]. Например, было показано, что IL2 и IL3 являются сильными факторами роста для Leismania major в условиях in vitro и in vivo [Mazingue et al., 1989]. Лейшмания относится к кандидатам на включение в перечень СПИД-индикаторных инфекций [Denis M. et al., 1991]. Также было показано, что сыворотки больных СПИДом, способные резко повышать чувствительность человеческих макрофагов к M. avium, содержат повышенные количества IL6 [Crowle et al., 1989]. Можно предположить, что не только концентрация Т4-лимфоцитов, но и разная специфичность взаимодействия с интерлейкинами, определяют спектр оппортунистических инфекций. Поэтому, во многом сходные с токсоплазмами по своим жизненным циклам и адаптированности к органам и тканям человеческого организма Entamoeba histolytica или Lamblia intestinalis versus, не стали возбудителями «СПИД-ассоциируемых» инфекций.
Другой, недавно открытый механизм «подбора» оппортунистических инфекций, предполагает участие различных структур самого ВИЧ. При сравнительном исследовании макрофагов бронхоальвеолярного лаважа ВИЧ-инфицированных и здоровых лиц, было выявлено, что присутствие gp120 ВИЧ усиливает размножение M. avium [Denis M., 1994]. Также было установлено присутствие в бронхоальвеолярных смывах лиц, инфицированных ВИЧ, сурфактантного белка A (SP-A) — фактора увеличивающего прикрепление М. tuberculosis к альвеолярным макрофагам. Причем повышение количества этого фактора в легких находится в обратной зависимости от количества CD4+ Т-лимфоцитов [Downing J.P. et al., 1995]. Учитывая, что микобактерии являются основной причиной гибели больных СПИДом людей, то такая «коэволюция» нам кажется не случайной и имеющей у приматов очень древнюю историю.
Эти данные позволяют предположить наличие и других эндогенных механизмов, регулирующих проникновение, рост и размножение различных паразитических организмов при СПИДе.
Эволюционные процессы в иммунодефицитных популяциях. Этот вопрос еще менее изучен, чем природа оппортунистических инфекций в таких популяциях. Однако постепенно накапливаются факты, свидетельствующие об очень опасных тенденциях в эволюции возбудителей инфекций, соприкоснувшихся со средой, где отсутствует давление со стороны иммунной системы (рис. 36).
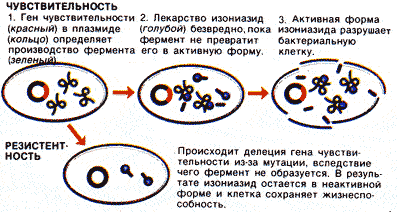
Рис. 36. Развитие лекарственной устойчивости у М. tuberculosis в организме больного СПИДом.
Резистентность М. tuberculosis к изониазиду у иммунодефицитиых людей развивается не путем приобретения новых генов, а утратой имеющихся [Бердсли Т., 1993]. Это тот же механизм дегенеративной эволюции, что использует демон Дарвина для развития специализации к человеку у осповирусов (разрушение рамок считывания ряда генов ВНО) и у ленточных червей (упрощение до предела нервной системы и исчезновение пищеварительной). Отбор более специализированных дегенеративных вариантов осуществляется в организме больных СПИДом из большого количества мутантов неспециализированных микроорганизмов-оппортунистов, активно размножающихся в отсутствии селективного давления иммунной системы. Видимо это распространенный механизм эволюции паразитов в иммунодефицитных организмах. Согласно правилу «прогрессирующей специализации» Ш. Депре (1876), «группа, вступившая на путь специализации, в дальнейшем развитии будет идти по пути все более глубокой специализации». Для микроорганизмов это означает отбор из ранее не специализированных предков более вирулентных и контагиозных антропонозных вариантов, способных к воздушно-капельной передаче
Условия для эволюции. Такую возможность микроорганизмам-оппортунистам предоставляют высокий темп размножения и высокая плотность их популяций в иммунодефицитном хозяине. Эти же два фактора способствуют накоплению мутаций в популяциях микроорганизмов, колонизировавших эктопические органы и ткани. Так как практически все микроорганизмы, за исключением ретровирусов, гаплоидны, то новые признаки немедленно проявляются фенотипически и участвуют в естественном отборе.
Проникновение микроорганизма в новую для него экологическую нишу — организм человека и его проникновение в ранее недоступную для него среду организма, сопровождаются явлением, известным эволюционистам как популяционная волна или «волна жизни» [Яблоков А.В., Юсуфов А.Г., 1998]. Такие волны являются самостоятельными факторами эволюции микроорганизмов в иммунодефицитных хозяевах и касаются колебаний численности сразу многих их мутантных производных.
Поэтому, действие любых факторов, снижающих численность паразитов (действие лекарственных препаратов или сохранившихся звеньев иммунной системы, вытеснение другим паразитическим видом и др.), приводит к тому, что от многочисленной популяции могут остаться отдельные особи, имеющие уже измененный набор генов. Снятие такого давления, например, из-за прекращения введения лекарственного препарата после исчезновения клинических признаков болезни, дальнейшего нарастания иммунодефицита, либо прекращения колонизации органа (ткани) другим паразитом, приводит росту численности уже измененного возбудителя. Концентрация редких, ранее присутствующих в небольших количествах мутаций, может свестись к минимуму. Концентрация мутаций, способствующих закреплению адаптивного признака, резко возрасти. У факультативных микроорганизмов, вызывающих инфекционный процесс у иммунокомпетентного хозяина, обычно имеется возможность только для одной эволюционной волны, в результате которой должна произойти его передача новому хозяину, а затем либо наступит смерть хозяина, либо иммунная система очистит организм от возбудителя инфекции. Но поскольку иммунодефицитность — это не состояние, а процесс, то в иммунодефитных хозяевах такие волны будут повторяться многократно, каждый раз в различных условиях, периодически меняя генотипический состав одних и тех же возбудителей, и способствуя отбору более «удачных».
Для иммунодефицитных хозяев характерна не только борьба паразита с иммунной системой, но и борьба паразитов между собой. А поскольку пищевые ресурсы хозяина истощаются одновременно со снижением его способности противостоять паразитическим видам, то это приводит к дифференцированному размножению более адаптированных паразитов.
Важным элементом среды обитания формирующихся в иммунодефицитных популяция паразитов является градиент иммунодефицитности в эпидемических цепочках. Практически нельзя найти двух ВИЧ-инфицированных людей с одинаковой степенью иммунодефицитности. Это создает условия для последовательного пассирования вирулентных микроорганизмов через особи с большим иммунодефицитом, к ос обям с меньшим иммунодефицитом, а потом и через иммунокомпетентных хозяев.
Проявления эволюции. Кого же отбирает демон Дарвина в иммунодефицитных популяциях для распространения в иммунокомпетентных? Посмотрим отбор по фенотипам:
1) антибиотикоустойчивые штаммы возбудителей инфекций, распространенных среди иммунокомпетентных людей — сальмонеллеза, туберкулеза и др. [Morris J.G., Morris P., 1997]. Интересно, что резистентность к химиопрепаратам и антибиотикам у микроорганизмов, формируется в иммунодефицитных популяциях значительно быстрее, чем в иммунокомпетентных популяциях [Бердсли Т., 1993]. Видимо, это связано с большими возможностями по отбору вариантов и отсутствием давления на них со стороны иммунной системы;
2) устойчивые штаммы возбудителей «СПИД-ассоциируемых» инфекций, например, изолятов Candida, устойчивых к флюконазолу. Чем выраженнее иммунодефицитное состояние, тем более резистентные штаммы выделяют из этих больных [Ampel N., 1996];
3) более вирулентные штаммы возбудителей малоизвестных инфекций, не считавшихся ранее серьезной проблемой для иммунокомпетентных лиц. Например, было показано, штаммы грамположительной коккобациллы Rhodococcus eque, выделенные от больных СПИДом, почти в сто раз более вирулентны, чем штаммы этого же микроорганизма, полученные от иммунокомпетентных людей [Pakai S. et al., 1995]. Для эпидемиологов это давно известное явление — в более чувствительных популяциях отбираются более вирулентные штаммы, в иммунных популяциях — маловирулентные [Беляков В.Д. и др., 1987];
4) возбудителей инфекций, ранее не встречавшихся клиницистам. Например, широкое применение у ВИЧ-инфицированных с целью подавления инфекций, вызываемых грибковыми микроорганизмами нового препарата триазола флюконазола, привело к заметному увеличению количества больных, инфицированных более устойчивой к этому препарату Candida krusei. Раньше она считалась микроорганизмом, имеющим второстепенную клиническую значимость [Samaranayake Y., Samaranayake L., 1994];
5) возбудителей забытых инфекционных болезней при достижении иммунодефицитной популяцией определенной плотности. Например, рост случаев туберкулезной инфекции в США в начале 1990-х годов, был полной неожиданностью для здравоохранения этой страны. В США даже не оказалось производителей двух лекарств, прежде использовавшихся против туберкулеза, — стрептомицина и n-аминосалицилата натрия [Бердсли Т., 1993];
6) возбудителей инфекций, способных распространяться воздушно-капельным путем. Среди них возбудители пневмонии — P. carnii, менингита — C. neoformans, туберкулеза — М. tuberculosis;
7) не забыл он и распространенные возбудители инфекционных болезней. Эпидемиологами Лос-Анджелеса, обнаружен почти 35-кратный рост среди больных СПИДом числа лиц, инфицированных Campylobacter jejuni [Sorvillo F. et al., 1991]. В Сан-Франциско количество лиц инфицированных Listeria среди ВИЧ-инфицированных, превышало этот показатель для иммунокомпетентных людей в 280 раз [Schuchat A., 1992].
Роль иммунодефицитных популяций в проникновении в человеческое общество возбудителей новых инфекций, в последние десятилетия чрезвычайно возросла. Различные механизмы развития иммунодефицитной патологии способствуют конкуренции патогенов за новую для них среду обитания. В организме больных СПИДом и другими иммунодефицитами создаются условия для дегенеративной эволюции возбудителей инфекционных болезней. Отбор более специализированных дегенеративных вариантов осуществляется в организме больных СПИДом из большого количества мутантов неспециализированных микроорганизмов-оппортунистов, активно размножающихся в отсутствии селективного давления иммунной системы. Связь между отдельными паразитами и иммунодефицитными состояниями у приматов и людей имеет древнюю историю. Как следствия многочисленных циклов расширения и «схлопывания» Иммунодефицитных популяций среди людей, можно рассматривать циркуляцию среди них строгих и высокоспециализированных антропонозов, способных к передаче воздушно-капельным путем.
