Микроорганизмы, токсины и эпидемии. 1.6. Патогенность вирусов
Вирусы для человека и животных являются облигатными паразитами. Они используют обе стратегии паразитизма и в столь разнообразных проявлениях, что объем данной книги не позволяет даже кратко остановиться на этом. Мы ограничимся сравнением патогенных свойств двух, крайне опасных для людей вирусов — ВНО и ВИЧ. Первый уже унес десятки миллионов жизней, второму, видимо, еще предстоит это сделать. Эти вирусы используют альтернативные стратегии паразитизма, у них совершенно несходные пути передачи, эпидемиология, патогенез и многое другое. Однако их сближает удивительная адаптированность к человеку, необычайно высокая способность распространяться в человеческих популяциях, продолжительность поддержания эпидемических очагов без постоянной циркуляции в природных резервуарах и, еще, видимо, древность, то есть способность появляться как бы ни откуда, собирать свою смертельную жатву, а затем исчезать на столь длительное время, что для потомков людей, переживших вызванные ими эпидемии они становятся возбудителями новых болезней (рис. 22).

Рис. 22. Древность возбудителей натуральной оспы и СПИДа. Мумия Рамзеса V, умершего в 1157 г. до н.э. Четко видны следы оспенных пустул — археологическое подтверждение существования оспы в древнем Египте. Однако живший 7 столетий позже Гиппократ (IV век до н.э.) об оспе ничего не знает. И только спустя еще 6 столетий, натуральную оспу описывает римский врач Гален (II век). Тогда она не кажется современникам грозной болезнью. Но в XVII столетии оспа превращается в то страшное бедствие — черную смерть, которое, как мы считаем сегодня, побеждено навсегда.

Американский исследователь R. Ablin (1996) считает, что СПИД задокументирован в этих иероглифах из древнеегипетских папирусов Эберса. Geiger (1994), нашел описание СПИДа в древних китайских трактатах по медицине под названием «Киу Лао», означающее «пустоту» или истощение». Там же описаны и симптомы столь знакомой сегодня болезни: похудание, припухлость лимфатических узлов, ночные поты, выпадение волос, понос и др. В качестве лечебного средства древние китайцы использовали сборы трав, стимулирующих иммунную систему.
Происхождение вирусов. По мнению J. Lederberg (1997), как само происхождение жизни, так и происхождение вирусов, пока остаются предметом рассмотрения многих теорий (табл. 4). Каждый вирус отличается от другого. Очень мало известно об их филогенезе и сегодня трудно даже доказать различие между сотнями их категорий. Мы не знаем их происхождения, но знаем, что они взаимодействуют с нашим геномом многими способами. Вирусные частицы могли бы произойти из любого генома, став свободно живущими (т.е., независимыми, автономно реплицирующимися единицами в клетке хозяина), реинтегрируя в геном хозяина как ретровирусы (что возможно делают и другие вирусы) и повторяя эти циклы тысячи раз.
Таблица 4*
Происхождение вирусов
|
Вирусы являются фрагментами генома, способными к репликации только в пределах интактной живой клетки, следовательно, они не могут быть предшественниками клеток |
|
В пределах взятого вида, вирусы могут возникать как генетические фрагменты или редуцированные версии хромосом, плазмид или РНК: |
|
1) хозяина или близкородственных видов; |
|
2) отдаленных видов; |
|
3) более крупных паразитов этого или другого хозяина; |
|
4) дальнейшей эволюции или генетического обмена между существующими вирусами |
|
В прошлом они уже могли иметь жизненный цикл в геноме хозяина как интегрирующаяся эписома. В геноме они могут выполнять определенные генетические функции и, в принципе, способны вновь появляться в виде новых вирусов |
|
Существование таких циклов показано в мире бактериальных вирусов, однако мы не имеем четких данных, объясняющих происхождение вирусов животных и растений |
*По Lederberg J. (1997)
Общие принципы вирусного патогенеза. Для того, что бы быть патогенными, вирусы, так же как и бактерии, должны инфицировать слизистые поверхности; проникать в хозяина через эти поверхности; вступать в контакт с чувствительными тканями; размножаться во внутренней среде хозяина; противодействовать его защитным механизмам и причинять ему вред. Необходимость в выполнении первых двух требований отпадает, если вирусы проникают в ткани через альвеолы (в составе мелкодисперсного аэрозоля), поврежденную переносчиком кожу или через слизистые.
Общие принципы вирусного патогенеза представлены в упрощенной схеме (табл. 5). В правом столбце таблицы перечислены события, происходящие внутри клетки с момента начала ее инфицирования. Эти внутриклеточные стадии репликации вирусов, в конечном счете, определяют судьбу инфицированной клетки, т.е. ведут к ее гибели; клеточной трансформации, характеризующейся снятием ограничения роста; персистентной или латентной инфекции. В левом столбце приведены события на уровне организма или ткани, ведущие к инфицированию клеток и включающие иммунный ответ хозяина [Филдс Б. и др., 1989]. Схема развития острой вирусной инфекции показана на рис. 23.
Таблица 5
Хозяйские и клеточные стадии вирусного патогенеза*
Организм |
Клетка |
|
Проникновение вируса в хозяина |
Адсорбция |
|
Первичная репликация |
Проникновение |
|
Распространение вируса внутри хозяина |
Раздевание |
|
Клеточный и тканевой тропизм и клеточные рецепторы |
Транскрипция |
|
Повреждение клеток |
Трансляция |
|
Иммунный ответ и другие защитные факторы хозяина |
Сборка вируса |
|
Персистенция вируса, латентность и медленные вирусные инфекции |
Выход из клетки |
По Филдс Б. и др. (1989).
![Рис. 23. Схема развития острой вирусной инфекции. [По Н.А. Гавришевой и Т.В. Антоновой (1999)]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-23.gif) Рис. 23. Схема развития острой вирусной инфекции. [По Н.А. Гавришевой и Т.В. Антоновой (1999)]
Рис. 23. Схема развития острой вирусной инфекции. [По Н.А. Гавришевой и Т.В. Антоновой (1999)]Вирусы, так же как и бактерии, должны быть способными преодолеть слизистые барьеры и проникнуть в те органы и ткани, где происходит их репликация. Прежде чем распространиться по организму, они могут реплицироваться в месте первичного проникновения и в ближайших регионарных лимфатических узлах. В отличие от бактерий, вирусы могут использовать нейрональный путь проникновения в поражаемые ими органы-мишени (вирус бешенства) и тем самым избежать противодействия иммунной системы. Однако чаще всего они, как и бактерии, распространяются с кровью и лимфой (вирусемия). С наибольшим постоянством вирусемия наблюдается при острых инфекциях, особенно тяжелых формах болезни. Однако циркуляция вирусов в крови установлена и при многих латентных, хронических инфекциях. Вирусы, свободно циркулирующие в плазме, представляют плазменный тип вирусемии (вирус Синдбис, ВЭЛ, японского энцефалита). Более распространенным является клеточный тип вирусемии, при котором вирусы циркулируют в тесной связи с клетками крови. ВНО циркулируют, адсорбируясь на лимфоцитах и моноцитах крови, возбудители кори, гриппа, аденовирусы тесно связываются с полиморфно-ядерными лейкоцитами [Гавришева Н.А., Антонова Т.В., 1999]. Специфическое сродство вирусов к клеткам и тканям определяется присутствием на клеточной поверхности особых рецепторов. Отдельные; вирусы, после проникновения в клетку, могут индуцировать образование на ее поверхности дополнительных рецепторов, которыми «пользуются» другие вирусы [Филдс Б. и др., 1989]. Метаболизм вирусов направлен на использование структур цитоплазматического или ядерного белкового скелета клеток. Вирусспецифический цитопатический эффект обусловлен не бессмысленным для вируса повреждением клетки, а специфической перестройкой элементов клеточного скелета, цель которой — создание условий для размножения вируса [Маренникова С.С., Щелкунов С.Н., 1998]. Основным внешним проявление вирулентности вируса, являются разрушение инфицированных вирусом клеток в тканях-мишенях и возникающие в результате разрушения тканей физиологические изменения в организме хозяина [Филдс Б. и др., 1989].
У иммунокомпетентного хозяина большинство вирусных инфекций, возбудители которых используют первую стратегию паразитизма, самоограничиваются. Смертельные исходы в эпидемических очагах могут достигать очень высоких значений, однако в крупных популяциях людей они никогда не достигают 100%. При недостаточности иммунной системы хозяина, эти же вирусы могут вызывать персистентные или латентные инфекции.
Персистирующая инфекция. Это бессимптомная персистенция вируса, сопровождающаяся его выделением в окружающую среду. В механизме развития вирусной персистирующей инфекции значительная роль отводится особому состоянию возбудителя — дефектным интерферирующим частицам вируса или его мутантам, а также блокированию апоптоза клеток хозяина. Персистирующий инфекционный процесс лежит в основе латентной инфекции [Гавришева Н.А., Антонова Т.В., 1999].
Латентная инфекция. Это бессимптомная персистенция вируса, не сопровождающаяся его выделением в окружающую среду. При латентной инфекции вирус не удается обнаружить с помощью диагностических приемов в связи с тем, что он находится в дефектной форме или интегрирован в геном клетки. Этот процесс плохо изучен. Значительно большая ясность имеется в вопросе реактивации вируса. Считается, что для этого необходимо действие одного или нескольких активирующих факторов (травма, стресс, иммуносупрессия, суперинфицирование и др.). В результате латентная инфекция переходит манифестную форму — развиваются симптомы, свойственные острой инфекции. Примерами латентных инфекций служат герпесвирусные (рис. 24), цитомегаловирусные инфекции, сывороточные гепатиты и ряд других [Гавришева Н.А., Антонова Т.В., 1999]. Однако нельзя полностью согласиться с вышеуказанными авторами, утверждающими, что латентную инфекцию можно рассматривать как фазу инфекционного процесса. Способность вызывать персистирующую или латентную инфекцию не является общим свойством для всех вирусов. Например, ВНО и отдельные возбудители геморрагических лихорадок либо вызывают смерть инфицированного, либо разрешаются с развитием стерильного иммунитета. Сколь бы многочисленной не осталась пережившая эпидемию популяция, они в ней не сохраняются, а для их поддержания в природе используются другие механизмы. Поэтому, можно считать, что способность вызывать латентные инфекции является проявлением более глубокой специализации к хозяину вируса, утратившего связь с первичным резервуаром. Латентность этих вирусов необходимо рассматривать только как их свойство, проявляющееся в иммунокомпетентном хозяине, т.е. вирусы такого типа способны использовать обе стратегии паразитизма, но в разной степени. Основную для них вторую стратегию они используют в иммунокомпетентных хозяевах, а в иммунодефицитных вынужденно проявляют первую.
![Рис. 24. Схема патогенеза простого герпеса. У большинства лиц с момента первичного инфицирования происходит пожизненная персистенция, находящегося в организме в латентном состоянии вируса. Под воздействием различных активирующих факторов, к которым относятся дефекты иммунной системы, вирус по аксонам выходит из нервных ганглиев, поражая участки кожи и слизистых оболочек, иннервируемые соответствующим нервом. По мере прогрессирования иммуносупрессии активация вируса становится все более частой, в процесс могут вовлекаться все новые ганглии, что приводит к изменению локализации и увеличению распространенности очагов поражения кожи и слизистых оболочек [Гавришева Н.А., Антонова Т.В., 1999]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-24.gif)
Рис. 24. Схема патогенеза простого герпеса. У большинства лиц с момента первичного инфицирования происходит пожизненная персистенция, находящегося в организме в латентном состоянии вируса. Под воздействием различных активирующих факторов, к которым относятся дефекты иммунной системы, вирус по аксонам выходит из нервных ганглиев, поражая участки кожи и слизистых оболочек, иннервируемые соответствующим нервом. По мере прогрессирования иммуносупрессии активация вируса становится все более частой, в процесс могут вовлекаться все новые ганглии, что приводит к изменению локализации и увеличению распространенности очагов поражения кожи и слизистых оболочек [Гавришева Н.А., Антонова Т.В., 1999]
Медленные инфекции. Их вызывают паразитические микроорганизмы, использующие только вторую стратегию паразитизма. Медленные инфекции характеризуются длительным инкубационным периодом, прогрессирующим течением и неизбежной смертью. Кроме вирусов, медленные инфекции вызывают прионы — инфекционные безнуклеиновые структуры, состоящие из низкомолекулярного белка, молекулярная масса которого составляет 27...30 кд. Прионы имеют свойства, типичные для обычных вирусов, однако отличаются от них выраженной устойчивостью к действию многих физических факторов. Они не имеют сердцевины из нуклеиновых кислот, окруженных протеинами, а также липидной оболочки, в связи с чем при электронной микроскопии не распознаются как вирусы. Характеристика медленных инфекций, вызываемых прионами, представлена в табл. 6.
Таблица 6
Характеристика медленных инфекций, вызванных прионами*
|
Нозологическая форма |
Источник и факторы передачи |
Клинические проявления |
Патоморфология |
|
Болезнь Крейтцфельда-Якоба |
Животные, органы и ткани которых заражены прионами; мясо, сырые морепродукты |
Прогрессирующее слабоумие, миоклонус, прогрессирующие двигательные нарушения, атаксия, бульбарные нарушения — афония, дисфагия. Средняя продолжительность — 6 месяцев |
Демиелинизация передних рогов спинного мозга; комбинированные поражения коры, гипоталамуса, базальных ганглиев, мозжечка и спинного мозга |
|
Куру |
Умершие от куру люди; факторы передачи — их ткани (особенно мозг). Каннибализм |
Нарушение походки, дрожание туловища, конечностей, головы. Повышенная возбудимость, необоснованный смех. У обездвиженных больных присоединяется вторичная инфекция. Средняя продолжительность клинических проявлений — 6–9 месяцев |
Губкообразная энцефалопатия: в коре, подкорке, подбугровой области и мозжечке вакуолизация дендритов, аксонов и тела нейронов. Из-за выраженной вакуолизации серое вещество больших полушарий приобретает вид губки |
|
Синдром Герстманна-Штреуслера |
Не установлен |
Мозжечковые нарушения, слабоумие, пирамидные знаки, очень медленное прогрессирование заболевания. Средняя продолжительность — 60 месяцев |
Медленное формирование многочисленных и распространенных во всей ткани мозга амилоидных бляшек |
|
Амиотрофический лейкоспонгиоз |
Не установлен |
Слабость в кистях рук, затем — в ногах, параличи конечностей, затем брюшных мышц и мышц грудной клетки, спинальный тип нарушения дыхания |
Поражение центральных и периферических двигательных нейронов, дегенерация и перерождение клеток передних рогов и боковых столбов спинного мозга |
* Гавришева Н.А., Антонова Т.В., 1999
Медленные инфекции могут вызывать некоторые вирусы, использующие первую стратегию паразитизма (например, вирусы кори — подострый склерозирующий панэнцефалит, клещевого энцефалита — прогредиентная форма клещевого энцефалита). Но это не является всеобщей закономерностью и происходит только при определенном состоянии иммунной системы, когда эффективные иммунные реакции макроорганизма на вирус заблокированы.
Для поддержания в природе возбудителей инфекций, использующих стратегию паразитирования II типа, размер инфицированной популяции имеет значительно меньшее значение, чем для возбудителей, использующих стратегию I типа.
Теперь попробуем понять, как эти стратегии реализуются в инфекционных процессах и жизненных циклах ВНО и ВИЧ.
Особенности строения геномов ВНО и ВИЧ, предопределяющие стратегии паразитизма. Геномы вирусов сформированы различными типами нуклеиновой кислоты. У ВНО — ДНК, у ВИЧ — РНК. Уже это предопределяет различную стратегию преодоления противодействия защитных механизмов хозяина.
РНК-вирусы имеют определенный лимит генетической сложности, обусловленный небольшими размерами их геномов — от 3 до 30 кб. Однако они более эффективно, чем ДНК-вирусы используют мутационный процесс для изменения своей антигенной структуры и тропизма в организме хозяина, а также для уклонения от антител и цитотоксических лимфоцитов. Высокую частоту мутаций у РНК-вирусов обычно объясняют отсутствием механизмов корректировок в синтезе РНК. Все молекулы вирусной РНК обычно реплицируют через ассиметричную транскрипцию от одной цепи, исключающую большинство корректирующих механизмов, характерных для репликации молекул ДНК. S. Holland и соавт. (1982) экспериментально доказали, что вероятность ошибки во время копирования РНК-молекулы будет в 105—107 раз больше, чем при копировании ДНК-молекулы. Ими также была установлена средняя частота мутаций для РНК-вирусов, составляющая приблизительно 10-4,5. Это означает, что до 10% всех молекул РНК в популяции вируса, могут содержать мутации.
Репликация ДНК-вирусов сопровождается проверочным считыванием и пострепликационной репарацией. Поэтому механизм мутационной изменчивости играет меньшую роль в их стратегиях противодействия иммунной системе хозяина. Зато эволюцией за ними были закреплены другие изощренные механизмы выживания. Например, белки ЕЗ/19К и Е1а аденовирусов, супрессируют поверхностные молекулы, необходимые для Т-клеточного распознавания [Murphy P., 1993]. Белок BCRF1 вируса Эпштейна-Барра является гомологом интерлейкина-10 (IL-10) и взаимодействует с его рецептором [Domingo E. et al., 1998]. Филогенетический анализ генов герпесвирусов, способных инфицировать широкий круг хозяев, позволил сделать вывод о совместной эволюции этих вирусов и их хозяев. Свои гены-двойники в геноме хозяина имеются и у РНК-вирусов (например, вирусы саркомы и лейкемии). Однако использование в стратегиях инвазии захватов ДНК хозяина и антигенной мимикрии белков, более характерно для ДНК-вирусов.
Различия в организации геномов ВНО и ВИЧ. В отличие от большинства ДНК-содержащих вирусов животных, жизненный цикл поксвирусов проходит в цитоплазме клетки в значительной степени автономно от ее ядра (рис. 25). Для этого они, как и бактерии (!), располагают своими ферментативными системами синтеза РНК и ДНК (рис. 26).
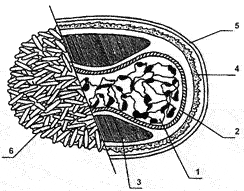
Рис. 25. Структура внеклеточного вириона ортопоксвирусов. 1 — сердцевина, 2 — мембрана сердцевины, 3 — боковые тела, 4 — поверхностная мембрана IMV, липопротеидная оболочка EEV, 6 — трубчатые структуры поверхностной мембраны IMV.
![Рис. 27. Структура вириона ВИЧ. В морфологическом отношении ВИЧ-1 и ВИЧ-2 сходны с другими ретровирусами. Наружная оболочка заимствуется вирионом из мембраны клетки хозяина при отпочковывании. Она пронизана вирусными белками: трансмембранными (гликопротеин gp41) и внешним (gp120). Оба называются оболочечными (кодируются геном env) и участвуют в прикреплении к мембране клетки-хозяина, выполняя функцию иммуногенной детерминанты. С внутренней стороны липидной оболочки расположен матриксный каркас, образованный белком р17. Он окружает внутреннюю структуру вириона — нуклеотид или сердцевину (англ. — core). Собственная оболочка сердцевины образована «коровым» белком р24. Внутри нуклеотида различают геном вируса, состоящий из двух цепочек РНК, окруженных белками р7 и р9. Вблизи молекул РНК расположены различные ферменты (обратная транскриптаза или ревертаза, РНКаза Н, протеаза). Большинство изображенных на рисунке морфологических элементов являются антигенами [Лысенко А.Я. и др., 1996]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-26.gif)
Рис. 26. Жизненный цикл осповирусов. Вирионы, содержащие двухцепочечную геномную ДНК, ферменты, факторы транскрипции, адсорбируются на клетке (1) и сливаются с плазматической мембраной клетки, высвобождая сердцевины в цитоплазму (2). Сердцевины синтезируют ранние мРНК, с которых транслируются различные белки, включая факторы роста, молекулы защиты от иммунной системы, ферменты и факторы для репликации ДНК и транскрипции промежуточных генов (3). Происходит раздевание сердцевины (4) и вирусная ДНК реплицируется, формируя конкатемерные молекулы (5). Промежуточные гены транскрибируются на дочерних молекулах ДНК и с этих мРНК транслируются факторы поздней транскрипции (6). Затем транскрибируются поздние гены. С их мРНК транслируются вирионные структурные белки, ферменты и факторы ранней транскрипции (7). Сборка вирионов начинается с образования дискретных мембранных структур (8). Конкатемерные промежуточные формы вирусной ДНК разделяются на единичные геномы и упаковываются в незрелые вирионы (9). Созревание приводит к образованию внутриклеточных зрелых вирионов (10). Эти вирионы покрываются модифицированными мембранами аппарата Гольджи и перемещаются к периферии клетки (11). Слияние таких вирионов с плазматической мембраной завершается высвобождением внеклеточных вирионов. Хотя размножение вируса происходит полностью в цитоплазме, ядерные факторы могут быть вовлечены в процессы транскрипции генов и сборки вирионов [Маренникова С.С., Щелкунов С.Н., 1998]
Инфекционные частицы поксвирусов содержат в своем составе полную ферментативную систему транскрипции, способную синтезировать функциональную мРНК в полиаденилированной, кэпированной и метилированной форме [Маренникова С.С, Щелкунов С.Н., 1998]. Это позволяет ВНО:
1) самостоятельно осуществлять эффективную защиту от ранних специфических реакций на инфекцию и противодействовать развивающимся позже специфическим реакциям;
2) размножаться до высокого уровня, обеспечивающего быструю передачу другому хозяину.
В отличие от других РНК-вирусов, ВИЧ, как и остальные ретровирусы, является примитивным «половым» организмом и способен к примитивному «половому воспроизведению» [Burke D., 1997]. Каждая вирусная частица содержит две РНК-цепи положительной полярности, полной длины и способные к репликации (рис. 27 и 28). В природе не существует других диплоидных семейств ДНК- или РНК-вирусов [Coffin J., 1992].
![Рис. 27. Структура вириона ВИЧ. В морфологическом отношении ВИЧ-1 и ВИЧ-2 сходны с другими ретровирусами. Наружная оболочка заимствуется вирионом из мембраны клетки хозяина при отпочковывании. Она пронизана вирусными белками: трансмембранными (гликопротеин gp41) и внешним (gp120). Оба называются оболочечными (кодируются геном env) и участвуют в прикреплении к мембране клетки-хозяина, выполняя функцию иммуногенной детерминанты. С внутренней стороны липидной оболочки расположен матриксный каркас, образованный белком р17. Он окружает внутреннюю структуру вириона — нуклеотид или сердцевину (англ. — core). Собственная оболочка сердцевины образована «коровым» белком р24. Внутри нуклеотида различают геном вируса, состоящий из двух цепочек РНК, окруженных белками р7 и р9. Вблизи молекул РНК расположены различные ферменты (обратная транскриптаза или ревертаза, РНКаза Н, протеаза). Большинство изображенных на рисунке морфологических элементов являются антигенами [Лысенко А.Я. и др., 1996]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-27.gif)
Рис. 27. Структура вириона ВИЧ. В морфологическом отношении ВИЧ-1 и ВИЧ-2 сходны с другими ретровирусами. Наружная оболочка заимствуется вирионом из мембраны клетки хозяина при отпочковывании. Она пронизана вирусными белками: трансмембранными (гликопротеин gp41) и внешним (gp120). Оба называются оболочечными (кодируются геном env) и участвуют в прикреплении к мембране клетки-хозяина, выполняя функцию иммуногенной детерминанты. С внутренней стороны липидной оболочки расположен матриксный каркас, образованный белком р17. Он окружает внутреннюю структуру вириона — нуклеотид или сердцевину (англ. — core). Собственная оболочка сердцевины образована «коровым» белком р24. Внутри нуклеотида различают геном вируса, состоящий из двух цепочек РНК, окруженных белками р7 и р9. Вблизи молекул РНК расположены различные ферменты (обратная транскриптаза или ревертаза, РНКаза Н, протеаза). Большинство изображенных на рисунке морфологических элементов являются антигенами [Лысенко А.Я. и др., 1996]
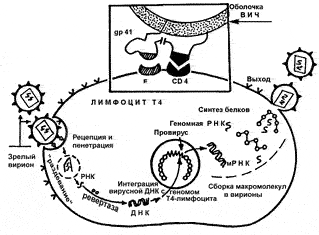
Рис. 28. Жизненный цикл ВИЧ. На врезке показано, что связывание вириона с мембраной клетки (рецепция) возможно только при слиянии вирусного gp120 со специфическим рецептором на мембране клетки хозяина (см. рис. 51). После проникновения вириона, происходит его «раздевание», когда вследствие точечного протеолиза освобождается вирусная РНК. Центральным событием является синтез ДНК на матрице РНК. Уникальный фермент ретровирусов — обратная транскриптаза или ревертаза — разрушает нити РНК и синтезирует новую нуклеиновую кислоту, ДНК. Зрелые вирионы, образовавшиеся в клетке хозяина, отпочковываются, разрушая при этом клетку. Очень существенно, что репликация вируса с образованием множества вирионов, происходит только тогда, когда инфицированная клетка хозяина находится в активированном состоянии. В неактивированной клетке ВИЧ может находиться в латентном состоянии (в стадии провируса) неопределенно долго и с этим связана его кардинальная особенность его эпидемиологии как медленного вируса [Лысенко А.Я. и др., 1996]
Обычно обе цепи РНК в ретровирусной частице являются производными от одного родительского провируса. Однако если инфицированная клетка одновременно содержит два различных провируса, то их РНК-транскрипты могут сформировать отдельный гетерозиготный вирион. После проникновения в новую клетку, под действием обратной транскриптазы, заново синтезированная ретровирусная последовательность будет рекомбинантом двух родительских. Сходство с половым процессом здесь в том, что:
1) обе цепи РНК как две родительские гаметы сливаются в одну;
2) генетическая информация потомков будет рекомбинантной
3) последующие «поколения» будут нести информацию обоих родителей [Temin Н., 1991].
«Половой процесс» дает ВИЧ ряд существенных преимуществ перед другими РНК-вирусами. Легко возникающие мутации, способствуют отбору и закреплению вариантов РНК-вируса, наиболее «удачно» использующих данного хозяина. Но для любого микроорганизма, который достиг пика на «ландшафте приспособленности», новая мутация не создает однозначных преимуществ. Более того, для него это ступенька на нижний уровень приспособленности. Генетическая рекомбинация может создать условия для регенерации геномов более «удачливых» ретровирусов из предковых геномов вирусов, менее адаптированных из-за мутаций. Однако, при смене условий существования такая консервация на высоте адаптивного пика превращается для вируса в ловушку. Рекомбинация между РНК-геномами двух высокоадаптированных ВИЧ, дает возможность рекомбинанту «сесть» на другой адаптивный пик, более соответствующий изменившимся условиям. Т.е., как заметил S. Kaufman (1993), помочь ему совершить «эволюционно широкий прыжок».
Сравнение патогенезов. Патогенез ВНО определяется необходимостью его быстрого размножения до количеств, позволяющих смену хозяина в течение короткого промежутка времени — от момента его инфицирования до его гибели или выздоровления. Выздоровление — это процесс разрешения от инфекции, осуществляемый иммунной системой хозяина.
ВНО variola maior обуславливает генерализованную инфекцию, которая в высоком проценте случаев завершается летальным исходом. Для этого вирус располагает беспрецедентным, по сравнению с вирусами других семейств, набором генов, белковые продукты которых эффективно изменяют многочисленные защитные реакции организма (рис. 29).
![Рис. 29. Общая схема синтеза ВНО молекулярных факторов, обеспечивающих вирусу преодоление защитных барьеров человека. Вирус располагает беспрецедентным, по сравнению с вирусами других семейств, набором генов, белковые продукты которых эффективно изменяют многочисленные защитные реакции организма [Маренникова С.С., Щелкунов С.Н., 1998]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-29.gif)
Рис. 29. Общая схема синтеза ВНО молекулярных факторов, обеспечивающих вирусу преодоление защитных барьеров человека. Вирус располагает беспрецедентным, по сравнению с вирусами других семейств, набором генов, белковые продукты которых эффективно изменяют многочисленные защитные реакции организма [Маренникова С.С., Щелкунов С.Н., 1998]
Первым неспецифическим и, возможно, самым древним барьером, который вынужден преодолевать ВНО, является программированная гибель клеток (апоптоз). Инфицирование клетки запускает механизм ее самоубийства, благодаря чему предотвращается размножение вируса и его распространение среди соседних клеток. ВНО располагает, по крайней мере, четырьмя генами, белковые продукты которых ингибируют апоптоз по альтернативным и дублирующим механизмам [Маренникова С.С., Щелкунов С.Н., 1998].
Вторым неспецифическим барьером являются местные воспалительные процессы. Они быстро индуцируются для ограничения распространения вируса в первые часы и дни после инфицирования, пока формируется полноценный иммунный ответ. ВНО несет гены не менее чем пяти белков, блокирующих различные этапы развития воспаления в участках размножения вируса (SPI-2, G3R, растворимых аналогов рецепторов фактора некроза опухолей — TNF и гамма-интерферона — гаммаlFN) и предотвращающих развитие системных реакций (растворимый рецептор интерлейкина-1бета — IL-1 бета). Как правило, все эти белки обладают одновременно несколькими активностями. Например, TNF-связывающий белок необходим еще и для развития генерализованной инфекции, столь характерной для ВНО. Поэтому эти белки считаются факторами вирулентности ВНО [Маренникова С.С., Щелкунов С.Н., 1998].
Система блокирования интерферона у ВНО также мультигенна (не менее 5 белков), поэтому он очень устойчив к его действию. Синтезируемые вирусом аналоги растворимых рецепторов IFN обоих типов, интерферируют с IFN, связывая его клеточные рецепторы. Это приводит к блокированию антивирусного состояния клетки и предотвращает лейкоцитарную инфильтрацию в участки вирусной репликации [Alcami A., Smith G., 1996].
Для облегчения распространения ВНО по тканям организма хозяина, в его геноме содержится ген C11R VAC-COP, кодирующий белок VGF, отнесенный к семейству эпидермального фактора роста. Он стимулирует рост и/или метаболическую активность неинфицированных клеток, обеспечивая тем самым распространение ВНО по организму. На эффективность диссеминации ВНО в организме человека также влияют белки оболочки внеклеточных вирионов (прежде всего, гемагглютинин) и анкиринподобные белки (определяют круг хозяев вируса). Пока не идентифицированы вирусные белки, подавляющие созревание гликопротеидов главного комплекса гастосовместимости класса I и тем самым снижающих эффективность представления на поверхности инфицированной клетки вирусных антигенов специфическим цитотоксическим Т-лимфоцитам [Маренникова С.С., Щелкунов С.Н., 1998].
Однако большое количество синтезируемых ВНО белковых структур неизбежно обнаруживаются иммунной системой хозяина, Поэтому патогенез ВНО построен на компромиссе между скоростью развития иммунного ответа хозяина (индуцируется полный спектр клеточно-опосредованных и гуморальных иммунных ответных реакций) и скоростью размножения вируса до количеств, достаточных для его передачи другому реципиенту. Например, ранее всех появляющиеся антигемагглютинины (2–3 день болезни), достигают своего максимума между 12 и 15 днями, а максимальные титры вируса в зеве определяются на 3-й и 4-й дни и держатся до 8-го дня у 95–100% больных. Затем они начинают снижаться [Маренникова С.С., Щелкунов С.Н., 1998]. У переболевших оспа оставляет длительный, стойкий и стерильный иммунитет, что исключает возможность повторного использования вирусом для своего размножения того же хозяина. Эта та цена, которую вирус платит за сложность своего генома иммунной системе человека. Однако заболевший успевает инфицировать от 5 (в среднем) до 38 человек, из них не менее трети погибнет — это уже цена, которую платим мы за тоже самое (рис. 30).
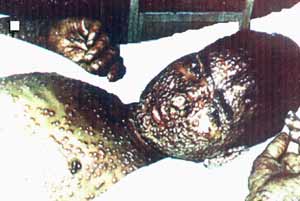
Рис. 30. Внешний вид больного натуральной оспой. Оспенные папулы. Возбудитель максимально накапливается на ранней стадии инфекции, стремясь успеть сменить хозяина до развития у него иммунитета. Используемый ВНО воздушно-капельный механизм передачи позволяет одному больному инфицировать десятки людей. Но эта цепочка рано или поздно прервется либо из-за гибели инфицированных либо из-за приобретения иммунитета чувствительной популяцией. Рисунок из книги Е.П. Шуваловой (1974)
Патогенез ВИЧ определяется его стратегией, заключающейся, прежде всего, в необычайной длительности персистирования в организме человека, не сопровождаемое специфическими клиническими, проявлениями. Но длительность этого состояния, это ничто иное, как наше субъективное восприятие процесса, протекающего в иных временных измерениях. Патогенность для ВИЧ означает «захват власти» над геномом хозяина [Лем С., 1989], где он становится одним из его оперонов и наследуется в цикле деления клеток. Однако для того, что бы быть не узнанным иммунной системой человека, ВИЧ должен хорошо укрыться.
Укрытие ВИЧ осуществляется, по меньшей мере, на двух уровнях — генетическом и клеточном. Генетическая маскировка вируса заключается в том, что его ДНК-форма (провирус), встроенная в геном хозяина, не имеет антигенов и для иммуноглобулинов недоступна [Медников Б.М., 1990].
На клеточном уровне ВИЧ не распознается иммунной системой благодаря тому, что:
1) зрелый вирион ВИЧ покрыт мембраной и гликопротеидной оболочкой из организма хозяина (на собственную оболочку у него не хватает «средств», т.е. генов), а поэтому они не могут быть антигенами;
2) те немногие участки аминокислотных последовательностей гликопротеидов ВИЧ — gp120 и gp 41, которые не экранированы и могут быть антигенами, сильно вариабельны (петлеобразный участок gp120);
3) кроме Т-хэлперов ВИЧ проникает и в другие клетки — как содержащие на своей поверхности рецепторы CD4 (глиальные клетки мозга), так и способные к фагоцитозу, в первую очередь моноциты в макрофаги. Именно последние захватывают комплексы ВИЧ—антитело. Поэтому иммуноглобулины, в конечном итоге, не подавляют инфекцию, а способствуют ей [Медников Б.М., 1990].
Если для существования ВИЧ в хозяине ему достаточно интегрироваться с его геномом, то для смены хозяина он должен воспроизвести свое потомство и найти наиболее эффективный для своей стратегии паразитизма механизм передачи. Т.е. он неизбежно должен воспользоваться ресурсами своего хозяина, а, следовательно, повредить его, не обладая теми мощными арсеналами генов, которыми располагают возбудители быстрых инфекций. Клинически повреждения при СПИДе проявляется столь большим количеством патологических симптомов, что объяснить их только действием малочисленных продуктов генов ВИЧ (как это мы делали в отношений ВНО), не удается. Также трудно свести всю обнаруживаемую патологию к последствиям паразитизма многочисленных возбудители сопутствующих инфекций.
Наиболее ярким показателем патогенного воздействия вируса является прогрессивное уменьшение числа CD4+ Т-лимфоцитов крови — основная причина постепенного угнетения иммунной системы [Лысенко А.Я. и др., 1996]. ВИЧ разрушает Т-клетки непосредственно, когда размножается в них, и когда размножившиеся частицы вируса покидают клетку, разрушая клеточную мембрану. Нo ВИЧ может уничтожать CD4+ Т-лимфоциты и опосредовано. На поверхности зараженной клетки располагается вирусный белок gр120, обладающий высоким сродством к рецепторному белку поверхности CD4+ Т-лимфоцитов (CD4). Из-за этого нормальные CD4+ Т-лимфоциты присоединяются к инфицированным клетками и сливаются с ними, образуя нежизнеспособную многоклеточную структуру — синтиций. Вместе с пораженными Т-лимфоцитами гибнут все здоровые, включившиеся в синтиций. Также ВИЧ вызывает нормальный клеточный иммунный ответ. При этом цитотоксические клетки (с помощью антител или сами по себе) уничтожают инфицированные CD4+ Т-лимфоциты, на поверхности которых имеются вирусные белки. При ВИЧ-инфекции в крови может циркулировать свободный белок gp120. Он способен связываться с молекулами CD4 нормальных клеток, в результате иммунная система принимает их за инфицированные клетки и атакует [Редфитд Р., Берке Д., 1988]. Кроме того, gp120 сходен со многими другими рецепторами человека (гормонов, регуляторов роста тканей и др.). Поэтому, антитела к нему атакуют большое количество тканей, подавляя биосинтез самых различных веществ, и, в результате, вызывают полное истощение организма больного (рис. 31).
![Рис. 31. Внешний вид больного СПИДом. Вирусный gp120 сходен со многими рецепторами человека (гормонов, регуляторов роста тканей и др.). Поэтому антитела к нему атакуют большое количество тканей, подавляя биосинтез самых различных веществ, и, в конце концов, вызывают полное истощение организма больного [Кульберг А.Я., 1988], Для смены хозяина вирус использует половой путь передачи, одновременно необходимый для сохранения вида хозяина — разорвать такую эпидемическую цепочку невозможно. Рисунок книги В.И. Покровского и В.В. Покровского (1988)](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-31.jpg)
Рис. 31. Внешний вид больного СПИДом. Вирусный gp120 сходен со многими рецепторами человека (гормонов, регуляторов роста тканей и др.). Поэтому антитела к нему атакуют большое количество тканей, подавляя биосинтез самых различных веществ, и, в конце концов, вызывают полное истощение организма больного [Кульберг А.Я., 1988], Для смены хозяина вирус использует половой путь передачи, одновременно необходимый для сохранения вида хозяина — разорвать такую эпидемическую цепочку невозможно. Рисунок книги В.И. Покровского и В.В. Покровского (1988)
Любопытно проявление феномена апоптоза при взаимодействии клетки и паразита II типа. Оно полностью противоположно тому, которое демонстрирует ВНО и другие возбудители, использующие первую стратегию паразитизма. ВИЧ не располагает собственными генами, кодирующими белки, которые бы каким-либо образом участвовали в этом процессе. Однако инфицированные им CD4+ Т-лимфоциты при контакте способны быстро уничтожать такие же, но не инфицированные соседние клетки. Причем в условиях in vitro, этот процесс наблюдается до образования синтициев. Интересно, что цитолизу при явлениях апоптоза, подвергались как активированные, так и покоящиеся CD4+ Т-лимфоциты [Nardelli В. et al., 1995].
У ВИЧ совершенно противоположное, чем у ВНО взаимодействие с цитокиновым комплексом. Он не подавляет их, синтезируя растворимые рецепторы, а наоборот, индуцирует в ЦНС человека синтез самих цитокинов (TNF, интерлейкины) инфицированными макрофагами, клетками микроглии и астроцитами, тем самым, вызывая сильное нейротоксическое действие [Levy J.A., 1989]. В норме цитокины действуют в основном в месте локализации антигена. Их действие на уровне центральных органов иммунитета является быстротечным и импульсным. При ВИЧ-инфекции они продуцируются непрерывно, постоянно оказывая токсическое действие на организм человека [Лысенко А.Я. и др., 1996].
И уж почти мистически выглядит обоснованное предположение А.Я. Лысенко (1990) о преимущественной элиминации ВИЧ тех клонов Т-клеток, которые до инфицирования вирусом длительно накапливались в большом количестве как противодействие патогенному потенциалу популяций микроорганизмов-оппортунистов. Первоочередная селективная деструкция ВИЧ именно таких клонов Т-клеток, создает необходимые благоприятные условия для проявления оппортунистами своих патогенных потенций.
Эти примеры наглядно показывают, что «захват власти над геномом хозяина» позволяет паразитическому микроорганизму изощренно и разнообразно противодействовать хозяину.
Элиминация же CD4+ Т-лимфоцитов ведет к потере контроля над проникающими в организм возбудителями грибковых, протозойных и других инфекций, а также за трансформированными вирусом злокачественными клетками. По мере исчерпания резерва CD4+ Т-лимфоцитов и снижения концентрации вируснейтрализующих антител, у всех ВИЧ-инфицированных лиц формируется манифестная, четко диагностируемая по наличию характерных оппортунистических заболеваний, стадия — собственно СПИД (рис. 32).
![Рис. 32. Исход контакта с ВИЧ. Схема течения ВИЧ-инфекции: ± — стадия, развивающаяся не у всех инфицированных; ПГЛП — прогрессирующая генерализованная лимфаденопатия [Лысенко А.Я. и др., 1996]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-32.gif)
Рис. 32. Исход контакта с ВИЧ. Схема течения ВИЧ-инфекции: ± — стадия, развивающаяся не у всех инфицированных; ПГЛП — прогрессирующая генерализованная лимфаденопатия [Лысенко А.Я. и др., 1996]
У кого же способ смены хозяина эффективнее — у ВНО или ВИЧ? Выше мы отметили, что используемый ВНО воздушно-капельный механизм передачи позволяет одному больному инфицировать десятки людей. Но эта цепочка либо из-за гибели инфицированных, либо из-за приобретения чувствительной популяцией иммунитета, рано или поздно прервется. Однако наиболее распространенный механизм передачи ВИЧ — половой, одновременно необходим для сохранения вида-хозяина. Поэтому, если в природе отсутствует механизм ограничения численности ВИЧ-инфицированных людей, то один больной способен инфицировать все человечество. Растянутость этого процесса во времени не имеет значения за пределами человеческих ощущений.
Эволюционная цена, уплаченная обоими паразитами демону Дарвина. Выше мы уже отметили, что осповирусы по ряду свойств аналогичны бактериям. Если рассматривать их в ряду бактерий, то, по мнению В.М. Жданова (1988), последовательность эволюционных событий будет выглядеть следующим образом: риккетсии — хламидии — вирусы оспы, т.е. налицо дегенеративная эволюция, когда большая адаптация к конкретному хозяину сопровождается упрощением строения паразита. Для большинства риккетсии внутриклеточный паразитизм обязателен, у хламидий он неизбежен, поскольку они не имеют митохондрий и потому являются энергетическими паразитами. Вирусы оспы с их сложной структурой и автономной репликацией ДНК (практически ничем не отличающейся от бактериальной), можно представить как дальнейший этап дегенеративной эволюции, сопровождающейся потерей синтезирующего белок аппарата.
Далее это упрощение происходит уже на межвидовом и межштаммовом уровне. Особенно наглядно дегенеративная эволюция наблюдается при сравнении геномов ВНО с геномами других осповирусов, имеющих более широкий круг хозяев. И здесь для исследователя, привыкшего считать, что патогенность микроорганизмов случайна, временна и обусловлена наличием каких-то дополнительных факторов патогенности, может возникнуть необходимость преодоления психологического барьера. Оказывается, совсем не обязательно, что геномы более вирулентных видов организованы более сложно и имеют больше генов, ответственных за синтез и регуляцию «факторов патогенности», чем менее патогенные виды этого семейства.
Например, у ВНО разрушена открытая рамка считывания (ОРТ) гена белка, обладающего IL-1бета-связывающей активностью. Однако вирус вакцины синтезирует этот белок, считающийся фактором патогенности. Тогда почему ВНО вирулентней для человека? С.С. Маренникова и С.Н. Щелкунов (1998) считают, что из-за блокирования у ВНО IL-1бета-связывающего белка не ингибируются системные реакции организма, в то время как снижение местных воспалительных реакций белком SPI-2, приводит к более активному размножению вируса. Неконтролируемое же развитие системных реакций ослабляет общую устойчивость организма, и патогенное действие вируса усиливается. У ВНО утратил свое значение и ген 3бета-гидро-ксистероиддегидрогеназы (3бета-HSD), играющий важную роль в биосинтезе стероидных гормонов. Зачем? Стероидные гормоны так же обуславливают столь необходимые ВНО имуносупрессию и противовоспалительное действие! Оказывается, это вызвано различиями гормонального регулирования у грызунов и человека. Поэтому рассматриваемый ген утратил свое значение у такого строго антропоноза, каким является ВНО [Маренникова С.С., Щелкунов С.Н., 1998]. В отличие от вируса вакцины и вируса оспы коров, у ВНО разрушены ОРТ всех белков межклеточных каналов (всего семейства!). С.С. Маренникова и С.Н. Щелкунов (1998) обратили внимание и на то, что по сравнению с вирусом вакцины, у ВНО за счет мутационных изменений разрушено значительное число других ОРТ.
У ВНО существует механизм, ограничивающий возможность его генетической рекомбинационной изменчивости по сравнению с другими видами ортопоксвирусов, характеризующимися относительно высоким уровнем перестроек геномов. У него необычайно маленького размера инвертированные терминальные повторы (TIR) — от 518 до 1051 пн, у вируса вакцины на порядок больше: 10–12 тпн. Кроме того, у штаммов вируса вакцины они содержат различающиеся наборы генов. У ВНО TIR — это минимальный теломерный элемент, необходимый для репликации поксвирусной ДНК. С.С. Маренникова и С.Н. Щелкунов (1998) считают, что столь малый размер TIR существенно ограничивает возможность генетической рекомбинации ВНО. Такая консервативность свидетельствует о необычайно глубокой адаптации ВНО к организму человека. Разрушение же рамок считывания ряда генов, это такой же процесс, как и утрата внутренними паразитами органов чувств, упрощение до предела нервной системы и исчезновение пищеварительной у ленточных червей — они им больше не нужны, т.е. отбор перестал следить за формированием структуры, и этого оказалось достаточно, что бы она исчезла.
Определить цену, заплаченную ВИЧ демону Дарвина за столь совершенный механизм паразитизма, гораздо труднее, так как мы вообще еще плохо знаем, что такое ретровирусы в эволюционном аспекте.
Есть основания полагать, что РНК, как более просто построенная и менее устойчивая полимерная структура, предшествовала ДНК и белкам в эволюции. В любой клетке существует самостоятельный «мир РНК», который занимает центральное положение в процессах жизнедеятельности, а остальные структуры клетки оказываются как бы эволюционной надстройкой [Гладилин К.Л., Суворов А. Н., 1995]. Позже образовавшаяся обратная транскриптаза, видимо, стала одним из тех инструментов, которым демон Дарвина пользовался на ранних этапах биологической эволюции. Три уникальные ферментативные активности обратной транскриптазы (результат влияния трех генов, образовавшихся в разные геологические эпохи белков), позволили ей сыграть важную роль при переходе из царства РНК к царству ДНК:
1) ДНК-полимеразная — синтезирует одноцепочечную ДНК, комплементарную РНК;
2) рибонуклеазная — расщепляет исходную РНК;
3) интегразная — позволяет интегрироваться синтезированной на матрице РНК новой ДНК, с ДНК, уже закрепленной естественным отбором.
Своим появлением живые системы обязаны ретроэлементам, составляющим значительную часть геномов позвоночных [Leilb M.C., Seilarth W., 1996]. Следы древних процессов, в которых участвовали ретроэлементы и ретровирусы, запечатлены и в нашем геноме (табл. 7). В ДНК 19-й хромосомы человека содержится около 700 nef-подобных элементов (nef — это ген негативного регуляторного фактора ВИЧ, определяющего его способность прекращать размножение и переходить в состояние покоя), а также 16 участков, где с nef соседствует область, гомологичная env ВИЧ [Несмеянов Х.М. и Тарантул В.З., 1997]. По данным L. Roswitha и соавт. (1996), на долю последовательностей эндогенных ретровирусов HERV приходится около 1% генома человека и они необходимы для поддержания его пластичности. Ретропозиция считается главным регулятором темпа эволюции, включая видообразование [Jurgen В., Henri Т., 1996]. Поэтому, можно предположить, что ретровирусы являются древнейшими паразитами, появившимися одновременно с геномами, имеющими интрон-экзонную структуру (древнейшие из известных — архебактерии: 3,8 млрд. лет). Что они потеряли, а что приобрели за этот период, судить трудно. Эти древние формы жизни, хотя и являются облигатными паразитами, более адаптированы к существованию на планете чем человек и, даже, позвоночные. Но для частного случая — механизма передачи, определить уплаченную ими цену, видимо, можно. Это касается различных предположений о том, что бы было, если бы ретровирусы передавались воздушно-капельным путем [Лем С., 1989].
Таблица 7
Количество копий ретроэлементов в геноме человека
|
Типы ретроэлементов |
Ретроэлементы |
Количество копий |
% от генома |
|
С-тип-связанные HERV |
HERV-ERI cуперсемейство |
|
0,07% |
|
HERV-E (4-1, ERVA, NP-2) |
35–50 |
|
|
|
HERV-E LTR |
500–600 |
|
|
|
51-1 |
35–50 |
|
|
|
ERV1 |
10–15 |
|
|
|
HERV-R (ERV3) |
10 |
|
|
|
RRHERV-I |
20 |
|
|
|
S71 |
15–20 |
i |
|
|
S71 LTR |
50–100 |
|
|
|
ERV-FRD |
5–7 |
i |
|
|
ERV9 |
30–40 |
0,2% |
|
|
ERV9 LTR |
3000–4000 |
|
|
|
HERV-P (HuERS-P1, HuERS-P2, HuERS-P3/HuRRS-P) |
50–90 |
0,01% |
|
|
HERV-I (RTVL-I) |
25–50 |
001% |
|
|
ERV-FTD |
5–7 |
|
|
|
С-тип и HTLV-связанные HERV |
HERV-H (RTVL-H, RGH) |
900–1000 |
0,2% |
|
HERV-H-LTR |
1000 |
|
|
|
HRES1 |
2 |
i |
|
|
A-,B- и D-типо-связанные HERV |
HML семейства 1–6 |
50 |
0,5% |
|
HERV-K (HM, HLM, HML-1 |
|
|
|
|
HERV-K LTR |
10,000–25,000 |
|
|
|
ERV-MLN (HML-4) |
20–25 |
|
|
|
THE-1 элементы |
THE 1 |
10,000 |
1% |
|
THE-1 LTR |
30,000 |
|
|
|
Невирусные ретротранспозоны |
LINE-1 |
100,000 |
5% |
|
Alu |
500000 |
5% |
|
|
SINE-R |
5000 |
0:1% |
i — невозможен подсчет из-за небольшого количества копий [Leib-Mosch С., Seifarth W., 1996].
Действительно, ретровирусы в лабораторных условиях легко инфицируют модельных животных через дыхательные пути. В естественных условиях этот путь передачи не только им не нужен, но и противоречит их стратегии паразитизма. Для воздушно-капельной передачи необходимо бурное накопление вируса в верхних дыхательных путях, которое бы еще сопровождалось разрушением этого эпителия. Однако для этого ретровирус должен иметь гены, дополнительные к имеющимся (например, кодирующие белки, участвующие в лизисе клетки). Но этими белками он обозначит свое присутствие иммунной системе. Интенсивное размножение и деструкция тканей уже сами по себе являются мощными раздражителями местных неспецифических и специфических иммунных реакций. Для их подавления ВИЧ так же должен иметь гены, продукты которых будут блокировать эти реакции. Т.е. для того, чтобы ВИЧ смог «научиться передаваться по воздуху», он должен стать совершенно другим вирусом и изменить стратегию паразитизма.
Какая стратегия «лучше» для паразитов? Естественно, какая хуже для человечества? По отношению к природе очень трудно использовать категории добра и зла. Эти стратегии используются паразитами миллиарды лет. Вопрос больше заключается в том, почему они их изменяют в отношении нас. Т.е. когда преимущество имеют паразиты с одной стратегией, а когда с другой? Но об этом мы поговорим в другом разделе книги.
***
Вирусы являются облигатными паразитами, использующими генетические ресурсы хозяина в значительно большей степени, чем бактерии и микоплазмы. Внешним проявлением вирулентности вируса являются разрушение инфицированных вирусом клеток и возникающие в результате разрушения тканей физиологические изменения в организме хозяина. Вирусы способны использовать первую и вторую стратегию паразитизма. Первая стратегия создает преимущества вирусу в высокоплотных популяциях хозяев. Вторая, наоборот, оптимальна для паразитирования в редких, разбросанных на больших территориях, популяциях хозяев. В иммунодефицитных особях вирусы могут проявлять отдельные элементы обоих стратегий, однако это не является всеобщей закономерностью в их взаимоотношениях с хозяином. Наличие же в природе вирусов, использующих для увеличения численности своих популяций и расширения ареала двух взаимоисключающих и предельно эффективных стратегий паразитизма, позволяет сделать предположение о взаимной регуляции их численности в бесконечно больших панмиксных популяциях хозяев.
