Токсичность наночастиц
(доклад подготовлен в соавторстве с Д. Л. Поклонским и С. А. Паныгиной)
Федеральное государственное учреждение «42 Научно-исследовательский центр биологической безопасности Министерства обороны Российской Федерации»
Federal State Establishment «42 Research Center on Biological Security of the Ministry of Defense of the Russian Federation»
Специальная комиссия НАТО недавно пришла к выводу о высокой опасности создания новых видов химического и биологического оружия на основе наночастиц. К тому же с развитием в нашей стране нанотехнологий мы неизбежно столкнемся и с распространением различных наноматериалов, и технологий их получения. Поэтому целью данной работы является выявление тех особенностей наночастиц, которые обуславливают их токсичность.
Границы наномира. Наномир представлен структурами, характерные размеры которых представлены нанометрами (1 нм = 10-9 м = 10-6 мм = 10 -3 мкм), но это не значит, что если объект измерять нанометрами, то мы проникнем в наномир. Размер атомов и атомных молекул около 0,1 нм, но наноструктурой отдельный атом не является. В химии принято считать, что наноструктурой становится результат самоконденсации атомов и молекул в малые атомные агрегации (кластеры), являющиеся промежуточным звеном между изолированными атомами и молекулами (с одной стороны), и массивным (объемным) твердым телом, с другой. Отличительной чертой кластеров атомов (молекул) от исходных атомов (молекул) является «немонотонная зависимость свойств от количества атомов в кластере». Переход к твердому телу осуществляется через укрупнение кластеров — минимальное число атомов в кластере равно двум, верхняя граница соответствует числу атомов, когда добавление еще одного атома не меняет свойства кластера, так как переход количественных изменений в качественные уже закончился. Обычно такая структура соответствует 1–2 тыс. атомов и она является границей между кластером и изолированной наночастицей (рис. 1)
Рис. 1. Классификация веществ и материалов по размеру D частиц. По [1].
Так мы очертили нижнюю границу наночастицы — она начинается в диапазоне размеров от 1 до 4 нм, т. е. с образованием твердого тела. Верхняя граница наночастицы определяется свойствами ее приповерхностного слоя. Доля атомов (α), находящихся в тонком приповерхностном слое (~ 1 нм), растет с уменьшением размеров частицы вещества R, поскольку α ≈ S/V ≈ R2/R3 ≈ 1/R (здесь S — поверхность частички, V — ее объем). Но атомы, дислоцирующиеся на поверхности частицы, обладают свойствами, отличающимися от «объемных», поскольку они связаны с окружающими их атомами по-иному, нежели в объеме. В результате ненасыщенности связей на поверхности наночастицы может произойти атомная реконструкция и появится новый порядок расположения атомов; на свободных поверхностях могут находиться атомы и молекулы, адсорбированные из внешней среды; дополнительные особенности появляются в окрестностях атомов, находящихся на краях моноатомных террас, уступов и впадин. Взаимодействие электронов со свободной поверхностью тоже приводит к возникновению специфических приповерхностных явлений. Возникают и другие эффекты, более подробно о них можно узнать в специальной литературе (например, из [1]). Важно другое, все это, вместе взятое, дает основание химикам рассматривать приповерхностный слой частиц, у которых соотношение числа атомов (молекул), лежащих на поверхности, больше или равно объемным, как некое новое состояние вещества. Внешне оно проявляется резким увеличением химической и каталитической активности поверхности, увеличением ее сорбционной емкости и другими эффектами. Поэтому в химии под наночастицами понимают те, у которых отношение числа поверхностных атомов (молекул) к объемным ≥ 1. При таком определении наночастицами низкомолекулярных веществ считаются объекты с размером до 10 нм, для высокомолекулярных — до 100 нм. Эти размеры и являются верхней границей наномира.
Особенности наночастиц, обуславливающие их токсичность. Прежде всего, это химическая и каталитическая активность поверхности наночастиц, отсутствующая у этого же вещества, имеющего более крупную дисперсность. Второй особенностью наночастиц, проявляющейся их токсичностью, является их высокая концентрация в воздухе при незначительном количестве самого распыленного вещества. И третья особенность наночастиц — это их способность к ингаляционному, трансдермальному, транснейральному и энтеральному проникновению в любые органы и ткани человека, включая ЦНС. Наночастицы по размеру сходны с рецепторами клеток и молекулами, осуществляющими сигнальную функцию. Исследования, проведенные в условиях in vitro с использованием различных клеточных систем, показали развитие у клеток, экспонированных к наночастицам, прововоспалительных и связанных с окислительным стрессом реакций [2, 3] (рис. 2).
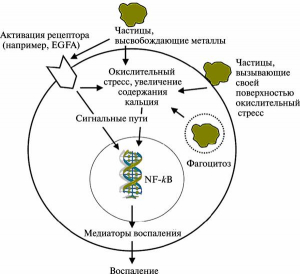 Рис. 2. Гипотетический механизм взаимодействия клетки с частицами наноразмера. Окислительный стресс, вызванный активной поверхностью наночастиц, приводит к увеличению внутриклеточного кальция и к активации отдельных генов. Проникшие в клетку частицы металла приводят клетку к окислительному стрессу, увеличивая, в свою очередь, внутриклеточное содержание кальция и активируя отдельные гены. Клеточный рецептор, активированный металлом, высвободившимся из наночастицы, приводит к активации отдельных геннов. EGFR (epidermal growth factor receptor) — рецептор эпидермального фактора роста. NF-kB (ядерный фактор кВ) — основной транскрипционный активатор воспалительных цитокинов. По [16].
Рис. 2. Гипотетический механизм взаимодействия клетки с частицами наноразмера. Окислительный стресс, вызванный активной поверхностью наночастиц, приводит к увеличению внутриклеточного кальция и к активации отдельных генов. Проникшие в клетку частицы металла приводят клетку к окислительному стрессу, увеличивая, в свою очередь, внутриклеточное содержание кальция и активируя отдельные гены. Клеточный рецептор, активированный металлом, высвободившимся из наночастицы, приводит к активации отдельных геннов. EGFR (epidermal growth factor receptor) — рецептор эпидермального фактора роста. NF-kB (ядерный фактор кВ) — основной транскрипционный активатор воспалительных цитокинов. По [16].
В опытах на лабораторных животных был подтвержден высокий воспалительный потенциал наночастиц, и было установлено, что он тем выше, чем меньше размер частиц, к которым экспонировано животное. Также было установлено значительное разрушительное действие наночастиц на легочную ткань [4].
Показано, что введение в организм млекопитающих полимерных наночастиц, несущих нуклеиновые кислоты, помимо специфического действия, обусловленного экспрессией нуклеиновых кислот, вызывает целый ряд неспецифических генерализованых реакций, а именно: синтез цитокинов, скоротечную лимфопению, тромбоцитопению, канцерогенные и острые токсические эффекты [5, 6].
В патологическом эффекте нанообъектов прослеживается определенная специфичность, обусловленная их структурой и химическим строением. Например, агрегированные одностеночные углеродные нанотрубки в легочной ткани мышей индуцируют образование гранулем, главным образом связанных с гипертрофией эпителиальных клеток, Эти же трубки, но в диспергированном состоянии, вызывают развитие диффузного интерстициального фиброза с утолщением стенок альвеол [7].
Пути проникновения наночастиц в организм человека. Их четыре — через легкие, обонятельный эпителий, кожу и желудочно-кишечный тракт.
Наиболее доступны для наночастиц легкие. Они состоят из двух различных частей — воздушных путей, транспортирующих воздух в легочную ткань (трахеобронхиальный и назофарингеальный регионы), и составляющих легочную ткань альвеол, где происходит газообмен. Легкие человека содержат около 2300 км воздушных путей и 300 млн альвеол. Общая поверхность легких взрослого человека 140 м2, что больше теннисного корта. Воздушные пути хорошо защищены от проникновения крупных частиц благодаря активному эпителию и вязкому слизистому слою на его поверхности. Но в газообменной области альвеол барьер между альвеолярной стенкой и капиллярами очень тонок, всего 500 нм и легко для них проницаем (рис. 3).
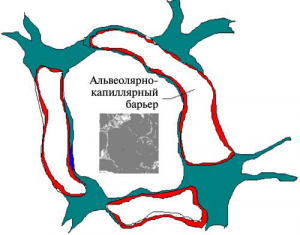 Рис. 3. Схематическое изображение строения альвеолы По [17].
Рис. 3. Схематическое изображение строения альвеолы По [17].
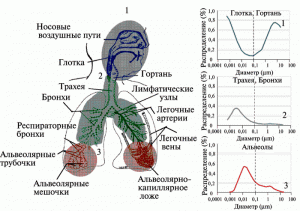
Распространение наночастиц по дыхательным путям может показаться весьма неожиданным для специалистов, привыкших моделировать эти процессы в диапазоне 1–10 мк (рис. 4).
Рис. 4. Предпочтительное фракционное отложение ингалированных частиц в назофарингеальном, трахеобронхиальном и альвеолярном регионах респираторного тракта человека при носовом дыхании. По [8].
Например, до 90% ингалированных 1-нм частиц оседает в назофарингеальном тракте, до альвеол они «не доходят». 5-нм частицы распределяются относительно равномерно по назофарингельному тракту, трахеобронхиальному тракту и альвеолам (~ по 30%). Частицы диаметром в 20 нм наиболее эффективно оседают в альвеолах (~ 50%). В тоже время в трахеобронхиальном и назофарингеальном регионах задерживается ~ по 15 % от их общего количества. Такое дифференцированное распределение наночастиц разных размеров в различных разделах легких неизбежно сказывается на их экстрапульмонарном распределении (рис. 5).
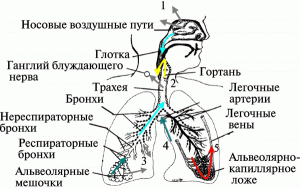
Рис. 5. Экстрапульмонарное распределение наночастиц разных размеров. 1 – проникновение в сенсорные нейроны через обонятельный эпителий; 2 –проникновение в желудочно-кишечный тракт; 3 – проникновение интерстиций; 4 – проникновение лимфатические узлы; 5 – проникновение кровеносное русло. По [8].
Наночастицы после ингаляции проникают в кровеносное русло по разным механизмам. Скорость этого процесса может варьировать для наночастиц разных размеров и химического состава. Но в некоторых случаях этот процесс может осуществляться очень быстро. Например, ингалированные углеродные частицы размером менее 100 нм уже через одну минуту после экспозиции можно обнаружит в крови экспериментального животного [9].
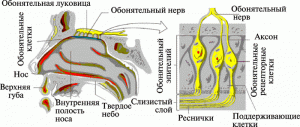
«Новинкой», характерной именно для частиц нанодиапазона, является возможность их проникновение в организм человека по нервным волокнам, идущим от обонятельного эпителия; и через кожу. Еще 60 лет назад было установлено, что полиовирус (30 нм), введенный экспериментальному животному интраназально, может через луковицу обонятельного нерва проникать непосредственно в ЦНС [10]. Но, как оказалось, наночастицы способны проникать в ЦНС этим же путем.
Рис. 6. Проникновение наночастиц в мозг через обонятельный эпителий носовых ходов. По [8].
Cкорость транспорта полиовирусов и наночастиц по обонятельному нерву примерно одинакова — 2,4…2,5 мм/час [11]. Помимо транснейронального проникновения в ЦНС, наночастицы легко преодолевают гематоэнцефалический барьер [12].
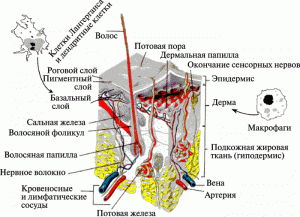
Возможны три пути проникновения наночастиц через кожу: между клеток, через клетки и через волосяные фолликулы. Например, липосомы с размерами в пределах от 20 нм до 200 нм легко «проходят» между клетками. Проникновение в организм человека через кожные покровы для наночастиц облегчается тонкостью верхнего слоя кожи — эпидермиса. Лежащий же под ним слой — дерма — очень богат макрофагами крови и тканей, лимфатическими узлами, дендритными клетками, в него «выходят» окончания сенсорных нервов пяти различных типов; все эти «обитатели» дермального слоя способны поглощать и распространять нанообъекты за пределы их первоначальной аппликации (рис. 7).
Рис. 7. Проникновение наночастиц через кожу. По [8].
То, что любые незначительные механические повреждения кожи делают ее «проницаемой» для наночастиц, понятно. Но Tinkle et al. (2003) продемонстрировали, что неповрежденная кожа в местах сгиба, например, в области запястья, может становиться проницаемой для наночастиц [13]. Уже в 2008 г. опубликованы экспериментальные данные, показывающие, что ультрафиолетовое облучение кожи значительно повышает ее проницаемость для наночастиц [14]. Видимо, в ближайшие годы будут обнаружены и другие сюрпризы подобного рода, так как изучение проблемы проникновения в организм человека объектов наноразмера, еще только начинается.
Патологическое действие веществ субмикронного диапазона не является чем-то неожиданным для токсикологов. После появления в 1916 г. на фронтах Мировой войны у воюющих армий угольных противогазов, многим специалистам казалось, что теперь «противогаз победил газ». Однако в июле 1917 г. германской армией во Фландрии впервые были применены новые отравляющие вещества раздражающего действия — арсины (дифенилхлорарсин, адамсит, дифенилцианарсин). В отличие от использовавшихся ранее фосгена, хлора, синильной кислоты, арсины — это твердые вещества. Они диспергировались специальными снарядами до образования частиц субмикронного диапазона, преодолевавших противодымные фильтры противогазов. Борьба с такими «дымами» оказалась более сложной, чем с ОВ, применявшимся в газообразном состоянии. До конца войны не было создано удовлетворительных противодымных фильтров [15].
Заключение
Сегодня мы наблюдаем новую технологическую революцию, вызванную развитием нанотехнологий. Однако научная литература, и особенно выходящая на русском языке, рассматривает нанотехнологии как панацею всех существующих в России технологических проблем и не касается исходящих от нее опасностей для здоровья людей и сохранности окружающей среды. Данные по токсическим свойствам наночастиц нами взяты из англоязычных источников. Накопленный же в прошлом опыт внедрения новых технологий, например, таких как ядерные технологии, генная инженерия, биотехнология и та же компьютерная революция, имели своим следствием появление не только новых благ, но и новых долговременных угроз для человечества. Поэтому научно-исследовательским организациям Войск РХБ защиты России будет весьма полезным найти свое место в оценке новых угроз, исходящих от нанотехнологий.
Список использованных источников
1. Гусев А. И. Наноматериалы, наноструктуры, нанотехнологии. — М., 2007.
2. Brown D. M., Wilson M. R., MacNee W. et al. // Toxicol. Appl. Pharmacol. — 2001. — Vol. 175. — P. 191–199.
3. Li N., Sioutas C., Cho A. et al. // Env. Heal. Persp. — 2003. — Vol. 111. — P. 455–460.
4. Medina C., Santos-Martinez M. J., Radomski A. et al. // British J. Pharm. – 2007. — Vol. 150. — P. 552–558.
5. Toussignant J., Gates A., Ingram L., et al. // Hum. Gene Ther. — 2000. — Vol. 11. — P. 2493–2513.
6. Dokka S., Toledo D., Shi X., et al. // Pharm. Res. — 2000. —Vol. 17. — P. 521–525.
7. Shvedova A., Kisin E., Mercer R. et al. // Am. J. Physiol. Lung. Cell. Mol. Physiol. — 2005. — Vol. 289. — L698–L708.
8. Oberdörster G., Oberdörster E., Oberdörster J. // Environ. Health. Perspect. — 2005. — Vol. 113. — P. 823–839.
9. Nemmar A., Hoet P., Vanquickenborne B. et al. // Circulat. — 2002. — Vol. 105. — P. 411–414.
10. Bodian D., Howe H. A. // Bull. Johns Hopkins Hosp. — 1941. — Vol. 69. — P. 248–267.
11. de Lorenzo A. J. // In: Taste and Smell in Vertebrates (Wolstenholme G, Knight J, eds). — London, 1970. - P. 151–176.
12. Borm P., Robbins D., Haubold S. et al. // Part. and Fib. Toxicol. — 2006. — Vol. 3.
13. Tinkle S. S., Antonini J. M., Rich B. A. et al. // Environ. Health. Perspect. — 2003. — Vol. 111. — P. 1202–1208.
14. Mortensen L. J., Oberdorster G., Pentland A. P. et al. // Nano Lett. — 2008. — Aug 8.
15. Де-Лазари А. Н. Химическое оружие на фронтах Мировой войны 1914–1918 гг. Редакция и коммент. М. В. Супотницкого. — М., 2008.
16. Donaldson K., Tran T. Inflammation caused by particles and fibers // Inhal. Toxicol. — 2002. — Vol. 14. — P. 5–27.
17. Hoet P., Bruske-Hohlfeld I., Salata O. Nanoparticles – known and unknown health risks // Journal of Nanobiotechnology. — 2004. — Vol. 2.
Библиографическое описание:
Супотницкий М. В., Поклонский Д. Л., Паныгина С. А. Токсичность наночастиц // Актуальные проблемы биологической защиты войск и населения. Материалы Всероссийской научно-практической конференции, посвященной 60-летию филиала ФГУ «48 ЦНИИ Минобороны России — ЦВТП БЗ». — Екатеринбург, 2009. — С. 41–44.

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2009