Бактериальные токсины. Их природа, механизмы действия, возможности конструирования гибридных и модифицированных токсинов
Организация бактериальных токсинов характерна для сигнальных молекул, способных действовать на большом расстоянии от источника без ослабления силы сигнала. Их эволюция происходила путем нарастания сложности молекул, вызванной дупликациями и слияниями генов, кодирующих отдельные домены. Древность происхождения бактериальных токсинов ставит под сомнение не только антропонозный характер многих инфекционных болезней, в развитии которых токсины определяют основные симптомы, но и существующие представления о поддержании в природе их возбудителей. По механизму действия токсины могут быть разделены на 5 групп: повреждающие мембраны, ингибиторы белкового синтеза, активаторы иммунного ответа, протеазы, активаторы вторичных мессенджеров. Общая для всех бактериальных токсинов структура, в которой одна из субъединиц играет роль лиганда, другая вызывает токсический эффект, позволяет вести исследования, направленные на получение нового поколения медицинских иммунобиологических препаратов, не имеющих аналогов в природе. В настоящее время разработаны подходы для вмешательства в структуру молекул токсинов, позволяющие получать иммунотоксины для прицельного терапевтического воздействия на злокачественные клетки крови, и токсины с измененной специфичностью и/или с более высокой токсичностью в отношении отдельных видов насекомых. Максимально возможная токсичность для природных, гибридных и модифицированных токсинов ограничена невозможностью дальнейшего усложнения их молекулярной структуры и не будет превышать токсичности ботулинического токсина.
Супотницкий М. В. Бактериальные токсины. Их природа, механизмы действия, возможности конструирования гибридных и модифицированных токсинов // Биопрепараты. — 2011. — № 1. — С. 6-15.
Organization of bacterial toxins is specific for signaling molecules, that are able to act far from the source without loosing the signal intensity. They evolved by growing molecular complexity, caused by duplication and fusion of genes encoding separate domains. Antiquity of the origin of bacterial toxins not only puts in doubt anthroponosis type of many infectious diseases, in the progress of which the symptoms are defined by toxins, but also existing perceptions about sustention of their pathogenic agents in nature. Toxins can be divided into 5 groups according to their mode of action: damage membranes, inhibit protein synthesis, activate immune response, protease, activate second messenger pathways. The structure is common for all bacterial toxins: one of the subunits acts as a ligand, the other causes toxic effect. This allows to perform studies, aimed at obtaining new generation of immunobiological medicines, that don't have analogues in nature. At present there have been developed approaches for intervention into the structure of toxin's molecules, which allow to obtain immunotoxins for targeted therapeutic action at cancerous blood cells and toxins with modified specificity and/or with higher toxicity with respect to individual insect species. Maximum potential toxicity for native, hybrid and modified toxins is limited because of the impossibility of further amplification of their molecular structure and does not exceed botulinum toxin's toxicity.
Supotnitskiy M. V. Bacterial toxins. Their nature, modes of action, opportunities of creating hybrid and modified toxins // Biopreparats (Biopharmaceuticals). — 2011. — № 1. — С. 6-15.
Токсинами после открытия Эмилем Ру и Александром Иерсиным в 1888 г . дифтерийного токсина традиционно называют белковые вещества, образуемые преимущественно микроорганизмами и некоторыми животными, и обладающие ядовитым действием. Токсины определяют основные симптомы дифтерии, коклюша, холеры, сибирской язвы, ботулизма, столбняка, гемолитического уремического синдром и некоторых других инфекционных болезней человека и животных. К настоящему времени накоплены данные, показывающие возможность выполнения токсинами функций, не имеющих отношения к инфекционным процессам. Среди них: использование бактериями токсинов как средства антагонизма в микробных сообществах (холерный токсин оказывает ингибирующее действие на ряд бактерий); участие токсинов в авторегуляторных процессах в бактериальных популяциях (энтеротоксин C. perfringens) и др. [5]. Достижения генной и белковой инженерии открыли ученым возможности по конструированию новых медицинских иммунобиологических препаратов (МИБП) на основе производных бактериальных токсинов, не имеющих аналогов в природе. Целью работы является обобщение данных по природе, механизмам действия и возможностям конструирования гибридных и модифицированных токсинов бактерий.
Организация молекул бактериальных токсинов
Токсины бактерий представляют собой либо отдельные белки, либо олигомерные белковые комплексы, организованные в А-В-структуры. Такая структура молекулы токсина предполагает наличие двух компонентов: А- и В-субъединиц, поэтому их еще называют бинарными. А-субъединица обладает энзиматиче- ской (токсической) активностью в клетке. В-субъединица доставляет А-субъединицу в клетку-мишень. В-субъединица состоит из двух функциональных доменов: рецептор-связываю- щего домена, определяющего тропизм молекулы токсина к определенным клеткам; и транслокационного домена, доставляющего А-субъединицу через липиднный бислой, либо на плазматическую мембрану или в эндосому клетки-мишени. Структура В-доменов тесно связана со структурой рецепторов-мишеней, с которыми взаимодействует токсин. А-субъединицы более консервативны, чем В-субъединицы, особенно в участках, критических для проявления их ферментативной активности [20] (рис. 1).
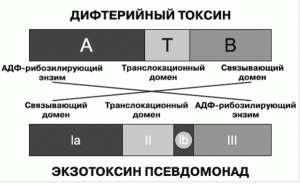 Рис. 1. Схематическая структура бактериальных токсинов. Дифтерийный токсин представляет собой полипептидную цепь из 535 аминокислот и состоит из энзиматического домена А (аминокислотные последовательности 1-193) и связывающего домена B (аминокислотные последовательности 482-535). Транслокационный или трансмембранный домен T расположен между ними. Токсин Pseudomonas представляет собой отдельную белковую цепь из 613 аминокислот, включающую три фунциональных домена. Домены Ia (аминокислотные последовательности 1-252) и Ib (аминокислотные последовательности 365-399) представляют собой связывающий домен; домен II (аминокислотные последовательности 253-364) — транслокационный домен; домен III (аминокислотные последовательности 400-613) включает АДФ-рибозилирующий фермент (ADP ribosylating enzyme), вызывающий гибель клетки путем инактивации в цитозоле фактора элонгации 2 (EF2). Домен Ib отделен от доменов II и III. По [22].
Рис. 1. Схематическая структура бактериальных токсинов. Дифтерийный токсин представляет собой полипептидную цепь из 535 аминокислот и состоит из энзиматического домена А (аминокислотные последовательности 1-193) и связывающего домена B (аминокислотные последовательности 482-535). Транслокационный или трансмембранный домен T расположен между ними. Токсин Pseudomonas представляет собой отдельную белковую цепь из 613 аминокислот, включающую три фунциональных домена. Домены Ia (аминокислотные последовательности 1-252) и Ib (аминокислотные последовательности 365-399) представляют собой связывающий домен; домен II (аминокислотные последовательности 253-364) — транслокационный домен; домен III (аминокислотные последовательности 400-613) включает АДФ-рибозилирующий фермент (ADP ribosylating enzyme), вызывающий гибель клетки путем инактивации в цитозоле фактора элонгации 2 (EF2). Домен Ib отделен от доменов II и III. По [22].
Кроме взаимодействия с рецептором клетки-мишени, по мнению Ю.В. Вертиева [3], В-субъединица имеет еще одну важную функцию — предохранителя, предотвращающего «случайный выстрел». Она экранирует ферментативную субъединицу, исключая случайное ее взаимодействие с субстратом в собственной клетке и за пределами клетки-мишени. Активация токсической субъединицы происходит после протеолитического расщепление В-субъединицы (В-прекурсора), наступающего после ее взаимодействия с клеткой-мишенью (рис. 2).
Частным случаем А-В-структур являются трехкомпонентные токсины со структурой типа A 1- B - A 2, где В — субъединица, участвующая в связывании токсина с рецептором; А1 и А2 — субъединицы, проявляющие различную энзиматическую (токсическую) активность в клетке хозяина. Трехкомпонентные токсины используют общую В-субъединицу, обеспечивающую ферментативным субъединицам единый механизм проникновения в цитозоль. Такая организация молекулы необходима для проявления синергидного эффекта токсического действия ферментативных субъединиц [5]. Наиболее изученным токсином данного типа является сибиреязвенный.
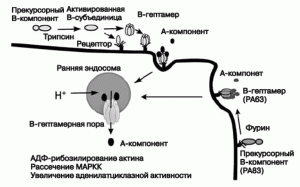 Рис. 2. Механизм клеточной интоксикации бинарными токсинами Clostridium и Bacillus. Связыванию с клеткой B-прекурсоров предшествует их активация через протеолитическое расщепление непосредственно на поверхности клетки. Расщепление фурином (сериновая протеаза) протективного антигена (PA83) B.anthracis в межклеточной жидкости является своего рода уникальным случаем, так как другие B-прекурсоры активируются только после связывания с поверхностью клетки. Активированные В-субъединицы токсинов взаимодействуют со специфическим рецептором на поверхности клетки либо уже сформировавшимся кольцевым гептамером, либо мономерами, формирующими гептамеры в последующем. Ферментативная А-субъединица погружается в клетку вместе с гептамером и комплекс «рецептор-голотоксин» захватывается ранними эндосомами через рецептор-опосредованный эндоцитоз. Внутренняя среда этих вакуолей затем закисляется АТФазами, что индуцирует конформационные изменения В-гептамера и последующую его вставку в эндосомальную мембрану с формированием канала. Через него А-субъединица транспортируется в цитозоль. По [10 ]
Рис. 2. Механизм клеточной интоксикации бинарными токсинами Clostridium и Bacillus. Связыванию с клеткой B-прекурсоров предшествует их активация через протеолитическое расщепление непосредственно на поверхности клетки. Расщепление фурином (сериновая протеаза) протективного антигена (PA83) B.anthracis в межклеточной жидкости является своего рода уникальным случаем, так как другие B-прекурсоры активируются только после связывания с поверхностью клетки. Активированные В-субъединицы токсинов взаимодействуют со специфическим рецептором на поверхности клетки либо уже сформировавшимся кольцевым гептамером, либо мономерами, формирующими гептамеры в последующем. Ферментативная А-субъединица погружается в клетку вместе с гептамером и комплекс «рецептор-голотоксин» захватывается ранними эндосомами через рецептор-опосредованный эндоцитоз. Внутренняя среда этих вакуолей затем закисляется АТФазами, что индуцирует конформационные изменения В-гептамера и последующую его вставку в эндосомальную мембрану с формированием канала. Через него А-субъединица транспортируется в цитозоль. По [10 ]
Наличие А- и В-субъединиц (доменов) в структурах молекул подавляющего большинства белковых токсинов бактерий свидетельствует о том, что они, как правило, являются крупными функциональными белковыми агрегатами. Эволюционно образование таких агрегатов стало возможным путем объединения двух или более белков в результате как нековалентных взаимодействий (сибиреязвенный, коклюшный и другие токсины), так и путем образования ковалентной связи между ними (ботулинический и столбнячный токсины). В свою очередь отдельные субъединицы токсинов так же состоят из некогда различных белков, объединенных в пептид, проявляющий несколько активностей сразу. Например, тяжелые цепи ботулинического и столбнячного токсинов содержат два домена — регион, необходимый для транслокации токсина; и регион, необходимый для связывания с клеткой. Белки такого типа образуются слиянием соответствующих генов в один ген, кодирующий большую полипептидную цепь.
Для бактериальных токсинов характерно сходство их субъединиц на молекулярном и макромолекулярном уровнях. Оказалось, что хотя холерный токсин и относящийся к его семейству температуролабильный энтеротоксин кишечной палочки (LT-токсин) имеют по пять идентичных В-субъединиц, а коклюшный токсин имеет четыре различных В-субъединицы, но две из В-субъединиц коклюшного токсина свертываются аналогично В-субъединичным пентамерам семейств холерного токсина и шига-токсина [18].
Сходство обнаружено как между ферментативными субъединицами токсинов бактерий, так и ферментами эукариотов. По крайней мере пять АДФ-рибозилирующих токсинов (коклюшный, холерный и дифтерийный токсины, LT-токсин кишечной палочки и экзотоксин А псевдомонад) имеют общий НАД-связывающий сайт [18]. Участок протяженностью в 100 аминокислот ферментативного домена CNF1 (цитотоксический некротизирующий фактор первого типа), гомологичен участку ферментативного домена дермонекротического токсина бордетелл. Оба одинаковых участка выполняют одинаковую функцию — активируют Rho (субсемейство маленьких ГТФ-связывающих белков, участвующих в модификации регуляторов актина цитоскелета) и являются активными сайтами токсинов [24]. Отечный фактор сибиреязвенного микроба представляет собой аденилатциклазу, которая не только по кинетическим, но и по антигенным свойствам имеет сходство с действующей на ту же мишень кальмодулинзависимой аденилатциклазой эукариотических клеток [23, 32]. Сходство между А- и В-субъединицами токсинов различных бактерий, между ними и различными белками вирусов или эукариотических организмов, выполняющих сходную функцию, скорее является проявлением конвергентной гомологии молекул, подвергавшихся однонаправленному действию естественного отбора, чем свидетельством их общего происхождения [5].
Ю.В. Вертиев [3] обратил внимание ученых на то, что бактериальные токсины, интерфероны, бактериоцины и гормоны обнаруживают сходство в отношении целого ряда важных свойств: 1) синтезируются одним типом клеток, в то время как воздействуют на другие типы клеток; 2) действуют на клетки в чрезвычайно низкой концентрации (10-11 -10 -14 М ); 3) обладают сходной молекулярной организацией: т. е. состоят как минимум из двух функционально и структурно различных белков (доменов) — энзиматического и рецепторного; 4) имеют сходные звенья молекулярного механизма действия (связывание с рецепторами, активация, транслокация внутрь клетки и модификация клеточных мишеней); 5) обнаруживают сходную кинетику биологического эффекта — одноударный эффект; 6) все эти вещества токсичны.
Двухкомпонентный состав и одноударность действия бактериальных токсинов можно объяснить, сделав предположение, что способность синтезировать токсины позволяла бактерии реализовывать какую-то сигнальную функцию в их экосистемах, сформировавшихся еще до появления сложных многоклеточных организмов с дифференцированными тканями (высшие растения, хордовые). Преимущество такой структуры для передачи сигналов в том, что при ее распространении из центра, сигнал не ослабляется на большом расстоянии. Если бы передача сигнала осуществлялась структурами, не способными к лиганд-специфическому взаимодействию, то сигнал ослабевал бы по мере диффузии сигнальных молекул. Отсюда, как следствие, способность воздействовать на другие типы клеток в чрезвычайно низких концентрациях.
Механизм действия и сроки появления наиболее изученных токсинов также свидетельствуют в пользу гипотезы выполнения ими сигнальной функции еще в одноклеточных экосистемах. Например, токсины B. anthracis действуют на организм человека опосредованно, через эволюционных потомков простейших — макрофаги. Когда у мышей удаляли макрофаги, они приобретали устойчивость к сибиреязвенному токсину. Альвеолярные макрофаги, подвергнутые действию летального токсина, не утрачивают способности поглощать споры возбудителя сибирской язвы, однако в значительной мере теряют способность освобождаться от них [5]. Анализ молчащих замещений нуклеотидных последовательностей генов холерного, LT- и ST-токсинов кишечной палочки показал, что эти гены дивергировали не менее чем 130 млн лет назад — в эпоху расцвета пресмыкающихся [3]. И уже в знакомом нам «виде» они пережили не только их вымирание, но и расцвет млекопитающих в миоцене, и их массовое вымирание в конце плиоцена.
Появление же прототипного холерного токсина теряется где- то в глубине геологического времени. А ведь до сих пор возбудитель холеры считается врачами антропонозом [7]. О древности известных бактериальных токсинов говорит удивительно точная «пригнанность» их структур к выполняемой ими функции. Даже одиночные замены в S1-субъединице коклюшного токсина снижают ее ферментативную активность и токсичность в 1000 раз, множественные — в 106 раз. Одновременно резко снижается ее иммуногенность [28], нарушается пространственная структура и способность взаимодействовать с олигомером [27].
Классификация бактериальных токсинов
Бактериальные токсины некоторыми исследователями подразделяются на группы по секреторным механизмам (типы I-VII), посредством которых токсины выходят за пределы синтезирующих их бактериальных клеток (например, [20]). В данной работе используется классификация С. Schmitt et al. [36], подразделяющая все токсины на пять групп по механизму действия, и упрощающая понимание их поражающего действия (таблица и рис. 3).
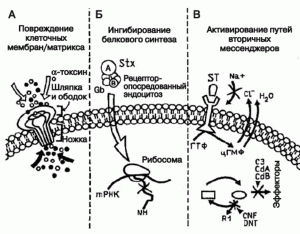 Рис. 3. Сопоставление механизма действия бактериальных токсинов разных групп. А. Повреждение клеточных мембран альфа-токсином S. aureus. После связывания и олигомеризации, ножка похожего на шампиньон гептамера альфа-токсина вставляется в клетку-мишень и вызывает приток, или наоборот, отток из клетки ионов (обозначены как темные и светлые кружки, соответственно). Б. Ингибирование белкового синтеза клетки шига-токсином (Stx). Голотоксин, который состоит из энзиматически активной субъединицы (А) и пяти связывающих субъединиц (B), входит в клетку через глоботриазилцерамидный рецептор (Gb). Затем А-субъединица, обладающая N-гликозидной активностью, отсекает аденозиновый остаток с 28S рибосомальной РНК, что останавливает белковый синтез. В. Примеры бактериальных токсинов, активирующих пути вторичных мессенджеров. Связывание термостабильного энтеротоксина (ST) с рецептором гуанилатци- клазы приводит к увеличению количества цГМФ, который обращает в обратную сторону ток электролитов. Посредством АДФ-рибозилирования или гликозилирования (соответственно), экзоэнзим С3 C. botulinum и токсины A (CdA) и В (CdB) C. difficile, инактивируют небольшие Rho ГТФ-связывающие белки. Цитотоксический некротизирующий фактор (CNF) E . coli и дермонекротический токсин (DNT) бактерий рода Bordetella, активируют Rho через дезаминирование. Для всех токсинов характерна «мультидоменная» структура. Это означает, что разные их части состоят из некогда отдельных глобулярных белков, объединенных естественным отбором в ходе эволюции. По [36].
Рис. 3. Сопоставление механизма действия бактериальных токсинов разных групп. А. Повреждение клеточных мембран альфа-токсином S. aureus. После связывания и олигомеризации, ножка похожего на шампиньон гептамера альфа-токсина вставляется в клетку-мишень и вызывает приток, или наоборот, отток из клетки ионов (обозначены как темные и светлые кружки, соответственно). Б. Ингибирование белкового синтеза клетки шига-токсином (Stx). Голотоксин, который состоит из энзиматически активной субъединицы (А) и пяти связывающих субъединиц (B), входит в клетку через глоботриазилцерамидный рецептор (Gb). Затем А-субъединица, обладающая N-гликозидной активностью, отсекает аденозиновый остаток с 28S рибосомальной РНК, что останавливает белковый синтез. В. Примеры бактериальных токсинов, активирующих пути вторичных мессенджеров. Связывание термостабильного энтеротоксина (ST) с рецептором гуанилатци- клазы приводит к увеличению количества цГМФ, который обращает в обратную сторону ток электролитов. Посредством АДФ-рибозилирования или гликозилирования (соответственно), экзоэнзим С3 C. botulinum и токсины A (CdA) и В (CdB) C. difficile, инактивируют небольшие Rho ГТФ-связывающие белки. Цитотоксический некротизирующий фактор (CNF) E . coli и дермонекротический токсин (DNT) бактерий рода Bordetella, активируют Rho через дезаминирование. Для всех токсинов характерна «мультидоменная» структура. Это означает, что разные их части состоят из некогда отдельных глобулярных белков, объединенных естественным отбором в ходе эволюции. По [36].
Характеристика бактериальных токсинов
|
Микроорганизм / Токсин |
Механизм действия |
Мишень |
Болезнь |
Участие токсина в болезни |
LD50 на кг |
|
ПОВРЕЖДАЮЩИЕ МЕМБРАНЫ |
|||||
|
Aeromonas hydrophila/ Аэролизин |
Пороформирующий |
Гликопротеин |
Диарея |
(да) |
~7 мкг (м) |
|
Clostridium perfringens/ Перфринголизин O |
То же |
Холестерин |
Газовая гангрена |
? |
— |
|
Escherichia coli/ Гемолизин d |
-II- |
Плазматическая мембрана |
Инфекция уринарного тракта |
(да) |
— |
|
Listeria monocytogenes/ Листериолизин О |
-II- |
Холестерин |
Системные пищевые инфекции, менингиты |
(да) |
3-12 мкг (м) |
|
Staphylococcus aureus/ Альфа-токсин |
-II- |
Плазматическая мембрана |
АбсцессыC |
(да) |
40-60 нг (м) |
|
Staphylococcus pneumoniae/ Пневмолизин |
-II- |
Холестерин |
ПневмонияC |
(да) |
~1,5 мкг (к) |
|
Streptococcus pyogenes/ Стрептолизин О |
-II- |
Холестерин |
Стрептококовая ангина, скарлатинаC |
? |
~8 мкг (м) 1-2 мкг (к) |
|
|
ИНГИБИТОРЫ БЕЛКОВОГО СИНТЕЗА |
||||
|
Сorynebacterium diphtheriae/ Дифтерийный токсин |
АЭФ-рибозилтрансфереза |
Фактор элонгации 2 |
Дифтерия |
Да |
~1,6 мкг (м) 100 нг (ч) |
|
E. coli, Shigella dysenteriae /Шига-токсин |
N-гликозидаза |
28S pPHK |
Геморрагический колит, гемолитический уремический синдром |
Да |
— |
|
Pseudomonas aeruginosa / Экзотоксин А |
АДФ-рибозилтрансфераза |
Фактор элонгации 2 |
ПневмонияC |
(Да) |
~3 мкг (м) |
|
|
АКТИВАЦИЯ ПУТЕЙ ВТОРИЧНЫХ МЕССЕНДЖЕРОВ |
||||
|
E. coli: Цитотоксический никротизирующий фактор |
Деамидаза |
RhoG-белки |
Инфекция уринарного тракта |
? |
- |
|
Термолабильный токсин |
АДФ-рибозилтрансфераза |
G-белки |
Диарея |
Да |
— |
|
Температурно стабильный токсин d |
Стимуляция гуанилатциклазы |
Гуанилатциклазный рецептор |
То же |
Да |
— |
|
Цитолетальный растягивающий токсин d |
Блокирование G2 |
Неизвестна |
-II- |
(Да) |
— |
|
EAST |
ST-подобный? |
Неизвестна |
-II- |
? |
— |
|
Bacillus anthracis/ Отечный фактор |
Аденилатциклаза |
АТФ |
Сибирская язва |
Да |
— |
|
Bordetella pertussis/ Коклюшный токсин |
АДФ-рибозилтрансфераза |
G-белки |
Коклюш |
Да |
21 мкг (м) |
|
Дермонекротический токсин |
Деамидаза |
RhoG-белки |
Риниты |
(Да) |
— |
|
Clostridium botulinum/ C2-токсин |
АДФ-рибозилтрансфераза |
Мономерный G-актин |
Ботулизм |
? |
— |
|
C. botulinim/C3 токсин |
То же |
RhoG-белок |
Ботулизм |
? |
— |
|
Clostridium difficile/ Токсин А |
Гликозилтрансфераза |
RhoG-белок(и) |
Диарея/ PC |
(Да) |
— |
|
Токсин В |
То же |
То же |
То же |
? |
— |
|
Vibrio cholerae/ Холерный токсин |
АДФ-рибозилтрансфераза |
G-белокМ |
Холера |
Да |
~250 мкг (м) |
|
|
|
АКТИВАТОРЫ ИММУННОГО ОТВЕТА |
|
|
|
|
S. aureus/ Энтеротоксины |
Суперантиген |
TCR и MHC II |
Пищевое отравление |
Да |
20-50 мкг (о) |
|
Эксфолиативный токсин |
Суперантиген (и сериновая протеаза?) |
То же |
Синдром шелушения кожи |
Да |
— |
|
S. pyogenes/ Пирогенный экзотоксин |
То же |
-II- |
Скарлатина/синдром токсического шокаC |
Да |
3-6 мг (м) |
|
Токсин синдрома токсического шока |
Суперантиген |
-II- |
Синдром токсического шокас |
Да |
— |
|
|
ПРОТЕАЗЫ |
||||
|
B. anthracis/ Летальный фактор |
Металлопротеаза |
MAPKK1/MAPKK2 |
Сибирская язва |
Да |
<11-4 мкг (м) |
|
C. botulinum / Нейротоксины А-С |
Цинк-металлопротеазы |
VAMP/ синаптобревин, SNAP-25, синтаксин |
Ботулизм |
Да |
0,5-1,2 нг (м) |
|
Clostridium tetani/Столбнячный токсин |
То же |
VAMP / синаптобревин |
Столбняк |
Да |
~1 нг(м) |
Примечание:
Да — строго доказанная связь между токсином и болезнью; (Да) — роль в патогенезе была показана на животных моделях или клеточных культурах; ? — неизвестно; с — другие болезни также ассоциированы с этим организмом; d — токсин продуцируется и другими семействами бактерий; (м) — мышь; (к) — кролик; (ч) — человек; (о) — обезьяны. По [36].
Порообразующие токсины
К ним относят бактериальные токсины, которые формируют посредством вставки в плазматическую мембрану хозяина функционирующие трансмембранные поры (каналы), приводящие клетку к лизису. Такие токсины еще называют RTX-семейством (repeats in toxin) из-за наличия в их молекулах большого количества повторов [18]. Механизм их действия хорошо прослеживается на примере альфа-токсина S. aureus, рассматриваемого как прототип олигомеризующегося пороформирующего цитотоксина [36]. Альфа-токсин синтезируется как прекурсорная молекула из 319 аминокислот, содержащая N-концевую последовательность из 26 аминокислот. Секретируемый бактерией «зрелый» токсин (протомер), является гидрофильной молекулой с массой 33 кДа, утратившей цистеиновые остатки [12]. Протомер «узнает» клетку-мишень по высокоаффинным рецепторам или неспецифически сорбируется в участках плазматической мембраны, содержащих фосфатидилхолин или холестерин. На мембране семь протомерных токсинов собираются в пору, формируя грибоподобный гептамер (232 кДа), включающий три различных домена [38]. Шляпка и ободочная область гептамера альфа-токсина располагаются на поверхности плазматической мембраны, в то время как ножка служит трансмембранным каналом. Образовавшаяся пора позволяет маленьким молекулам и ионам двухстороннее движение, что, в конечном итоге, приводит клетку к вздутию и гибели от осмотического шока [36]. Альфа-токсин действует цитолитически в отношении различных типов клеток (рис. 4).
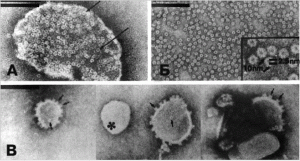 Рис. 4. Действие альфа-токсина S. aureus на эритроциты кролика и искусственные липидные мембраны. А. Фрагмент эритроцита кролика, лизированный альфа-токсином S . aureus . На поверхности мембраны наблюдаются многочисленные кольцеобразные структуры размером 10 нм (показаны стрелками). Б. Изолированные гексамеры токсина в растворе детергента. В. Лектиновые липосомы, включающие реинкорпорированные гексамеры токсина (последние выглядят как штырьки вдоль краев липосомной мембраны — показаны стрелками). Липосома, избежавшая включения молекул альфа-токсина, показана звездочкой. Черные полосы соответствуют 100 мкм. По [12].
Рис. 4. Действие альфа-токсина S. aureus на эритроциты кролика и искусственные липидные мембраны. А. Фрагмент эритроцита кролика, лизированный альфа-токсином S . aureus . На поверхности мембраны наблюдаются многочисленные кольцеобразные структуры размером 10 нм (показаны стрелками). Б. Изолированные гексамеры токсина в растворе детергента. В. Лектиновые липосомы, включающие реинкорпорированные гексамеры токсина (последние выглядят как штырьки вдоль краев липосомной мембраны — показаны стрелками). Липосома, избежавшая включения молекул альфа-токсина, показана звездочкой. Черные полосы соответствуют 100 мкм. По [12].
Альфа-токсин S. aureus способен лизировать моноциты, лимфоциты, эритроциты, тромбоциты, и эндотелиальные клетки человека [11], но его роль в развитии стафилококковых инфекций неизвестна.
К другим членам RTX-семейства относят гемолизин E. coli (HlyA), аденилатциклазу В. pertussis, лейкотоксин Pasterella haemolitica. Это семейство токсинов является также частью консервативного механизма секреции I типа, отвечающего за их транспорт из бактериальной клетки. Образование поры включает каскад вторичных реакций, приводящих к другим патологическим последствиям. Среди них активация эндонуклеаз, высвобождение цитокинов и медиаторов воспаления, синтез эйкозаноидов и др. [11].
Способность формировать белковые каналы в клеточной мембране не является уникальным свойством бактериальных токсинов. Посредством поры осуществляется транспорт специфических ионов через мембраны эукариотических и про- кариотических организмов. К образованию пор способны белки слияния вирусов. Аналогичным образом «действуют» цитолитические белки ядов животных [5, 6].
Токсины, ингибирующие синтез белка
Субстратами для этих токсинов служат факторы элонгации и рибосомальная РНК. Дифтерийный токсин и экзотоксин А псевдомонад являются дифтамид-специфическими АДФ- рибозилтрансферазами, которые рибозилируют фактор элонгации-2 и, таким образом, инактивируя его, подавляют синтез белка в клетках. Шига-токсин (Stx -токсин) продуцируется S. disenteriae первого серотипа и Stx-продуцирующими штаммами E. coli (STEC). На рис. 5 показаны механизмы интоксикации клеток-мишеней дифтерийным токсином и экзотоксином псевдомонад.
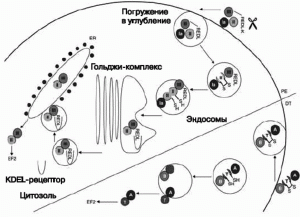 Рис. 5. Механизмы интоксикации клеток-мишеней дифтерийным токсином (DT) и экзотоксином псевдомонад (PE). После интернализации PE и DT подвергаются протеолизу и редукции дисульфидных групп, благодаря чему из связывающих доменов (домен Ia для PE, B-цепь для DT) обнажаются каталитические домены (домен III у PE , A-цепь у DT). PE подвергается обоим процессам — редуцированию карбоксильной группы у терминальной молекулы лизина и процессингу между остатками 279 и 280, в результате чего образуется 37 кДа фрагмент токсина с концевой карбоксильной группой (carboxy terminal toxin fragment ), заканчивающийся остатком REDL (Arg-Glu-Asp-Leu). Этот фрагмент транспортируется внутрь клетки через KDEL (Lys-Asp-Glu-Leu)-рецептор от Гольджи-комплекса до эндоплазматического ретикулума, где он транслоцируется в цитозоль. DT подвергается процессингу между остатками 193 и 194. Каталитическая A-цепь (аминокислоты 1-193) затем транслоцируется в цитозоль через эндосому с помощью транслокационного домена T (остатки 326-347 и 358-376), которые формируют ионный канал. Клеточная гибель, вызванная токсином, осуществляется по механизму апоптоза. EF2 — фактор элонгации 2. По [21].
Рис. 5. Механизмы интоксикации клеток-мишеней дифтерийным токсином (DT) и экзотоксином псевдомонад (PE). После интернализации PE и DT подвергаются протеолизу и редукции дисульфидных групп, благодаря чему из связывающих доменов (домен Ia для PE, B-цепь для DT) обнажаются каталитические домены (домен III у PE , A-цепь у DT). PE подвергается обоим процессам — редуцированию карбоксильной группы у терминальной молекулы лизина и процессингу между остатками 279 и 280, в результате чего образуется 37 кДа фрагмент токсина с концевой карбоксильной группой (carboxy terminal toxin fragment ), заканчивающийся остатком REDL (Arg-Glu-Asp-Leu). Этот фрагмент транспортируется внутрь клетки через KDEL (Lys-Asp-Glu-Leu)-рецептор от Гольджи-комплекса до эндоплазматического ретикулума, где он транслоцируется в цитозоль. DT подвергается процессингу между остатками 193 и 194. Каталитическая A-цепь (аминокислоты 1-193) затем транслоцируется в цитозоль через эндосому с помощью транслокационного домена T (остатки 326-347 и 358-376), которые формируют ионный канал. Клеточная гибель, вызванная токсином, осуществляется по механизму апоптоза. EF2 — фактор элонгации 2. По [21].
Токсины, генерирующие образование вторичных мессенджеров (посредников)
Бактериальные токсины могут влиять на функцию отдельных белков эукариотической клетки, не приводя ее к гибели. Для этого они активируют так называемых вторичных посредников, способных в большой степени усиливать и искажать клеточную реакцию на внеклеточные сигналы [36]. Рассмотрим механизм действия таких токсинов на примере цитотоксического некротического фактора (CNF).
CNF первого и второго типов (CNF1/2) относятся к группе бактериальных токсинов, модифицирующих Rho [8]. Ген CNF1 у E. coli закодирован на хромосоме и располагается на «острове па- тогенности» [13]. Синтезируемый токсин представляет собой гидрофильный полипептид (115 кДа). Он остается цитоплазма- тическим из-за отсутствия сигнальной последовательности и имеет связывающий (N-концевая половина CNF1) и ферментативный (С-концевая половина CNF1) домены [24]. В клетки хозяина токсин попадает с помощью секреторного механизма III типа. Было показано, что CNF1 деаминирует глутаминовый остаток Rho в положении 64. Такая модификация приводит к преобладанию активности Rho, не способного гидролизовать связанный с ним ГТФ. Эукариотические клетки, подвергнутые воздействию CNF1, приобретают характерный вид. У них наблюдается «рифление» мембраны, формируется локальное сжатие актиновых нитей. Репликация ДНК при отсутствии клеточного деления, приводит к образованию многоядерных клеток. Внутрикожное введение CNF1 вызывает длительное воспаление и образование некротического очага [36].
Установлена критическая роль небольших ГТФ-связывающих белков не только в регуляции цитоскелета (семейство белков Rho), но и в везикулярном транспорте (семейство Rab), и в регуляции роста и дифференциации клеток (семейство Ras). Поэтому не исключено, что существуют пока еще неизвестные нам токсины, способные воздействовать на основные клеточные процессы через эти белки [18].
Протеолитические токсины
Ботулинический и столбнячный токсины (оба цинкметаллоэндопротеазы) в опытах на животных показывают наименьшую из известных LD50 . Удивительно, насколько различную клиническую картину дают поражения этими токсинами, имеющими столь значительное сходство в структуре, энзиматической активности и мишенях среди клеток нервной системы, но различающиеся путями проникновения в макроорганизм. Например, ботулинический токсин проникает в организм энте- рально и вызывает вялые параличи периферических нервов. Столбнячный же токсин, образуясь на поверхностях ран, колонизированных C. tetani, приводит к спастическим параличам через поражение ЦНС [18].
Эти самые смертельные для человека токсины имеют и наиболее сложные молекулы среди известных токсических молекул. Оба синтезируются в виде неактивных полипептидов массой 150 кДа (прототоксины) и высвобождаются из лизировавшихся клеток. Затем прототоксины активируются посредством протеолитического расщепления открытой петли в структуре своей молекулы. Каждая активная молекула нейротоксина включает тяжелую (100 кДа) и легкую (50 кДа) цепи, связанные посредством межцепочечной дисульфидной связи. Тяжелые цепи обоих токсинов содержат два домена — регион, необходимый для транслокации токсина (N-концевая последовательность) и регион, необходимый для связывания с клеткой (С-концевая последовательность). Легкие цепи обоих токсинов содержат цинк-связывающий мотив, необходимый для цинк-зависимой протеазы, активирующей молекулу [34].
Ботулинические токсины связываются с рецепторами на поверхности пресинаптической мембраны двигательных нейронов периферической нервной системы и вызывают протеолиз белков в нейронах. Это приводит к ингибированию высвобождения ацетилхолина и к предотвращению мышечных сокращений — возникает вялый паралич [19]. Столбнячный токсин сначала связывается с рецепторами на пресинаптической мембране моторных нейронов, но затем, с помощью ретроградного везикулярного транспорта, он перемещается в нейроны спинного мозга. Спастический паралич возникает из-за того, что рассечение везикуло-ассоциированных белков и синаптобревина в нейронах нарушает высвобождение глицина и гамма-амино-битуриковой кислоты, прекращающих мышечное сокращение [9].
Активаторы иммунного ответа
Отдельные бактериальные токсины могут действовать непосредственно на Т-клетки и антигенпрезентирующие клетки иммунной системы. Самое большое семейство токсинов данного типа называют пирогенными токсинами-суперантигенами (PTSAg). Это стабильные, секретируемые токсины с ММ в пределах от 22 до 30 кДа. К ним относятся стафилококковые энте- ротоксины серотипов A-E, G и H; пирогенные экзотоксины стрептококков группы A серотипов A-C и F; стафилококковый TSST-1. Как правило, иммуностимулирующий потенциал таких токсинов является следствием их способности связывать различные участки белков главного комплекса гистосовместимости II типа, экспрессированных на поверхности антигенпрезентирующих клеток и Vбета-элементы на Т-клеточном рецепторе [36]. В частности, В-домен стафилококкового TSST-1 связывает альфа-цепь антигена DR1 человеческого лейкоцита. Одновременно его А-домен специфически связывается с Vбета- элементами Т-клеточного рецептора. Связывание TSST-1 с Vбета2 приводит к массивной пролиферации более 20% периферических Т-клеток. Следствием Т-клеточной экспансии является массивное высвобождение интерлейкинов (1, 2 и 6 типов), гамма-интерферона, факторов некроза опухолей (альфа и бета) и др. [35]. Совместно эти цитокины вызывают гипотензию, высокую температуру и диффузные эритематозные высыпания [36].
Гибридные и модифицированные токсины
К ним относятся токсины, состоящие из субъединиц разных токсинов или включающие модифицированные субъединицы. При описании экспериментов по созданию гибридных и модифицированных токсинов, исследователи единодушно проявляют скромность в отношении публикации данных по их поражающему действию, когда оно оценивается на лабораторных животных. В то же время этими данными они обстоятельно делятся в тех случаях, когда такие токсины создаются для более эффективного истребления насекомых. Инсектицидные токсины отличаются от токсинов, поражающих млекопитающих, только иной специфичностью действия.
Повышение поражающего действия токсинов
Опережающим объектом среди инсектицидных токсинов, исследование развития которого позволяет заглянуть в непубликуемые результаты аналогичных работ по рекомбинантным токсинам, опасным для людей и животных, являются порообразующие токсины семейства Cry (Bt -токсины, дельта-эндотоксины). Они продуцируются Bacillus thuringiensis (Bt) и используются в сельском хозяйстве как безопасные для окружающей среды средства контроля над численностью насекомых. По механизму действия на клетки такие токсины схожи с порообразующими токсинами стафилококков (см. рис. 4).
Cry-токсины представляют собой семейство глобулярных белков, включающее три домена, объединенных через простой линкер. Их организация типична для бинарной А-В-структуры бактериальных токсинов. Роль токсической субъединицы (А) играет порообразующий домен I; роль связывающей субъединицы (В) — домены II и III. Домен I представляет собой разветвляющуюся структуру, состоящую из 7 альфа-спиралей из которых центральная спираль (альфа 5-спираль) окружена внешними спиралями. Альфа 5-спираль высококонсервативна в пределах всего семейства Cry-токсинов. Этот домен вовлечен в формирование ионной поры в клеточной мембране эпителия кишечника насекомого. Домен II состоит из трех антипараллельных бета-слоев, упакованных вокруг гидрофобного центра, формирующего бета-структурную призму. Домен II определяет специфичность токсина и является наиболее вариабельным из его доменов. Аминокислотные остатки, вовлеченные в контакт между доменами I и II (находятся в альфа7-спирали и бета1-слое), высококонсервативны для всего семейства Cry -токсинов. Домен III сформирован двумя антипараллельными бета-слоями. Этот домен участвует в специфическом узнавании клеток-мишеней токсином. Высококонсервативны белковые последовательности, создающие контакт между доменами II и III (соответствует бета 11-слою и бета 12-слою) и образующие внутреннее пространство домена III (соответствует бета 17-слою и бета 23-слою) [16].
Прототоксин Cry1A, синтезируемый Bt, представляет собой параспоральный (локализованный рядом со спорой) восьмигранный кристалл. Проглоченный гусеницей чешуекрылого насекомого, он растворяется в содержимом его среднего кишечника и рассекается протеазами, активируя 60 кДа мономерный токсин. Активированный токсин связывается со специфическим рецептором на поверхности клеток, выстилающих средний отдел кишечника гусеницы [16]. Рецептор индуцирует второе протеолитическое расщепление токсина, удаляющее альфа 1-цепь. После чего молекула токсина становится полностью активна и, ассоциируясь с другими такими молекулами, формирует олигомерную структуру с ММ 250 кДа — препору (prepore). Аффинитет олигомера к вторичному рецептору возрастает более чем в 200 раз по сравнению с аффинитетом отдельной субъединицы токсина. Вставка препоры в микродомены клеточной мембраны ведет к формированию полноценной литической поры и к гибели клетки [30].
Первичными рецепторами для Cry1A-токсина являются белки, сходные с кадхеринами (cadherins, CADR) — трансмембранными кальций-зависимыми гликопротеинами, осуществляющими адгезивные межклеточные контакты. Большинство кадхеринов представляют собой однократно пересекающие плазматическую мембрану гликопротеины (700-750 аминокислот). Большая внеклеточная часть полипептидной цепи обычно свернута в пять доменов (около 100 аминокислот каждый), часть из которых гомологична и содержит кальций-связывающие сайты. Внеклеточный домен, наиболее удаленный от плазматической мембраны, опосредует межклеточную адгезию. Взаимодействие Cry-токсинов с кадхерином осуществляется через комплекс связывающих сайтов: CADR 7, CADR 11 и CADR 12 [31].
Вторичными рецепторами для Cry1A-токсина являются два протеина, «заякоренных» через мостик в мембране клетки-мишени: гликозилфосфатидилинозитол (glycosylphosphatidyl-inositol, GPI) и либо аминопептидаза N (aminopeptidase N, APN), либо щелочная фосфатаза (alkaline phosphatase, FAL) [14].
Отдельные насекомые имеют видовую устойчивость к Cry-токсинам, либо приобретают ее в результате систематического применения таких токсинов для регуляции их численности. В этом случае в популяциях насекомых накапливаются особи с мутировавшими кадхериновыми рецепторами, не взаимодействующими с токсином. Разработчики инсектицидных токсинов вынуждены решать две технические задачи: расширять спектр поражающего действия Cry-токсинов и увеличивать их токсичность в отношении конкретных видов насекомых. К настоящему времени разработано несколько экспериментальных подходов, позволяющих решать эти задачи (рис. 6).
 Рис. 6. Механизм действия Cry-токсинов и экспериментальные подходы к повышению их инсектицидной активности. 1. Кристалл токсина растворяется в среднем отделе кишечника насекомого. 2. Происходит активация прототоксина и его транслокация через перитрофную мембрану (peritrophic membrane). 3. Токсин связывается с основным рецептором и протеаза рассекает спираль альфа-1 домена I. 4. Происходит олигоимеризация токсина и связывание олигомера (препоры) с вторичными рецепторами. 5. Токсин (препора) вставляется в мембрану и формирует пору. Для повышения эффективности Cry-токсина в отношении насекомых, используются следующие приемы: А. К токсину добавляется хитиназа, облегчающая сборку токсина на эпителиальной мембране; Б. К токсину добавляются ингибиторы сериновых протеаз, снижающие возможность деградации токсина и рецепторов, с которыми токсин взаимодействует; В. В молекулу токсина вводится сайт расщепления, улучшающий его связывание с рецептором; Г. К токсину добавляются добавочные связывающие сайты, такие как CR12-МРЕ-пептид из кадхеринового рецептора или CytlA-токсин, улучшающие его контакт с рецепторами; Д. Из домена I удаляется участок молекулы, формирующий спираль альфа-1, что вызывает олигомеризацию токсина и способствует его взаимодействию с кадхерином. По [31].
Рис. 6. Механизм действия Cry-токсинов и экспериментальные подходы к повышению их инсектицидной активности. 1. Кристалл токсина растворяется в среднем отделе кишечника насекомого. 2. Происходит активация прототоксина и его транслокация через перитрофную мембрану (peritrophic membrane). 3. Токсин связывается с основным рецептором и протеаза рассекает спираль альфа-1 домена I. 4. Происходит олигоимеризация токсина и связывание олигомера (препоры) с вторичными рецепторами. 5. Токсин (препора) вставляется в мембрану и формирует пору. Для повышения эффективности Cry-токсина в отношении насекомых, используются следующие приемы: А. К токсину добавляется хитиназа, облегчающая сборку токсина на эпителиальной мембране; Б. К токсину добавляются ингибиторы сериновых протеаз, снижающие возможность деградации токсина и рецепторов, с которыми токсин взаимодействует; В. В молекулу токсина вводится сайт расщепления, улучшающий его связывание с рецептором; Г. К токсину добавляются добавочные связывающие сайты, такие как CR12-МРЕ-пептид из кадхеринового рецептора или CytlA-токсин, улучшающие его контакт с рецепторами; Д. Из домена I удаляется участок молекулы, формирующий спираль альфа-1, что вызывает олигомеризацию токсина и способствует его взаимодействию с кадхерином. По [31].
Методические подходы, использованные для вмешательства в структуру молекул токсинов семейства Cry, включают сайт-направленный мутагенез отдельных доменов токсина, конструирование гибридных токсинов, внедрение в молекулу токсина сайтов для расщепления протеазами, делеции его отдельных регионов и др. (рис. 7).
Сайт-направленный мутагенез используется для изучения структуры Cry-токсинов более 20 лет. D. Wu и A. Aronson [41] описали мутацию (H168 R) в спирали альфа-5 домена I Cry1 Aa-токсина, вызывающую трехкратное возрастание его активности против личинок каролинского бражника Manduca sexta [40]. В доменах II и III токсина обнаружены мутации, увеличивающие токсичность Cry1Ab в отношении личинок отдельных видов насекомых. Так, мутации N372A или N372G , локализованные в петле 2 домена II, ведут к восьмикратному увеличению токсичности Cry1Ab по отношению к непарному шелкопряду Lymantria dispar [37]. Тройной мутант — N372A, A282G и L283S показывает 36-кратное увеличение токсичности по отношению к этим же насекомым [33] (рис. 7А). У Cry3A-токсина важную роль в связывании токсина с рецептором играет петля 1. Получены два мутанта этой петли, названные A1 и A2. Каждый мутант содержит несколько мутаций: A1 — R 345A, Y350F, Y351F; A2 — R345A и делецию AY350Y35. Они показали 3- и 11-кратное увеличение токсичности против жесткокрылого насекомого — большого мучного жука (Tenebrio molitor). Мутации в петле 3 Cry3A-токсина проявили себя умеренным увеличением поражающего действия токсина (в 2,4 раза) по отношению к личинкам T. molitor [26] (рис. 7Б).
Конструирование гибридных токсинов направлено на создание новых токсинов с широким спектром целей или повышенной токсичностью. В отношении Cry-токсинов оно осуществляется посредством замены домена III на такой же домен из токсина, обладающего нужной исследователям специфичностью (рис. 7А). Отдельные Cry1-токсины с низкой специфичностью по отношению к Spodoptera exigu , включая Cry 1 Ab , Cry1Ao, Cry1Ba и Cry1Ea, становятся для них токсичными, если домен III будет заменен аналогичным доменом из Cry1Ca . Например, Cry1Ab-токсин не токсичен для S. exigua, но замена его III-домена на III-домен Cry1C приводит почти к десятикратному росту его токсичности для S. еxigua [17]. Замена участка молекулы Cry1Aa -токсина в пределах аминокислотных остатков 450-612 (домен III) на такие же из Cry1Ac-токсина, ведет к 300-кратному увеличению токсичности Cry1Aa в отношении табачной огневки Heliothis virescens [15, 31].
Активация токсина в новом для него хозяине может быть достигнута внедрением в его молекулу сайта для расщепления протеазами. Вставка в петлю Cry3A-токсина между спиралью альфа-3 и спиралью альфа-4 сайта для хемотрипсин/катепсина ( chymotrypsin/cathepsin G-сайта), позволило в три раза увеличить его токсичность для личинок D. virgifera [39] (см. рис. 7Б).
Делеция в аминотерминальном регионе, включающая спираль альфа-1 Cry1A-токсинa, делает возможной олигомеризацию токсина в отсутствие кадхеринового рецептора. Такие модифицированные токсины (Cry1AMod) убивают насекомых, у которых развилась резистентность к Cry1A-токсинaм, вызванная мутациями в гене кадхерина. Олигомерные структуры, формируемые Cry1AMod-токсинaми, обладают пороформирующей активностью, сходной с таковой у природного («дикого») токсина (см. рис. 7А).
Токсичность Cry2-токсинa была повышена для египетской хлопковой совки (Spodoptera littoralis) и совки ипсилон (Agrotis ipsilon) не менее чем в четыре раза делецией 42 аминокислот из N-концевого региона молекулы, предшествующих аминокислотным последовательностям, формирующим альфа-1 спираль. Этот участок молекулы прототоксина в кишечнике насекомого отщепляется трипсином, после чего «обнажается» прежде закрытый регион токсина, соответствующий связывающему региону Cry2-токсинa [29] (см. рис. 7В).
Иммунотоксины
Как частный случай гибридного токсина могут рассматриваться иммунотоксины — химерные белки, включающие два домена, один из которых обладает свойствами антитела, а другой свойствами ферментативной субъединицы токсина. Первый домен обеспечивает связывание химерного белка со специфической молекулой или клеткой, второй инактивирует молекулу-мишень или убивает клетку.
Иммунотоксины — первое поколение МИБП, полученных на основе производных бактериальных токсинов, не имеющих аналогов в природе. Появление иммунотоксинов вызвано трудностями прицельного терапевтического воздействия на злокачественно переродившиеся клетки крови. Первым таким средством были немеченые мАт, индуцировавшие апоптоз клеток-мишеней после взаимодействия с их рецепторами или вызывавшие их гибель по другим механизмам (rituximab и alemtuzumab). Однако в процессе клинических испытаний выяснилось, что более чем у половины пациентов раковые клетки устойчивы к действию мАт. Тогда их стали конъюгировать с радионуклидами. Эти агенты оказались эффективными для лечения пациентов со злокачественными новообразованиями, резистентными к мАт, но не могли использоваться широко из-за их дозозависимой токсичности для клеток костного мозга. Третий тип препаратов для прицельного терапевтического воздействия на злокачественные клетки представлял собой мАт с конъюгированными химиопрепаратами. Они оказались более эффективными и вызывали меньшее количество неспецифических осложнений при лечении острой миелоидной лейкемии (acute myelogenous leukemia, AML), чем мАт, конъюгированные с ради- онуклеотидами. Но и к ним были обнаружены резистентные опухолевые клетки, что потребовало дальнейшего совершенствование препаратов, действующих через специфическое узнавание рецепторов на поверхности опухолевых клеток [21].
Способность иммунотоксинов к прицельному уничтожению раковых клеток начинается с одной молекулы ферментативной субъединицы токсина, доставленной к поверхности клетки-мишени специфическим антителом. Поэтому иммунотоксины представляют собой некий предел в развития таких средств терапии злокачественных опухолей крови. В качестве ферментативной молекулы при конструировании иммунотоксинов используют ферментативные субъединицы (домены) токсинов, блокирующие белковый синтез в клетках. Среди растительных токсинов наиболее часто используются рицин и абрин; среди бактериальных — одноцепочечные токсины: дифтерийный и экзотоксин псевдомонад.
Разработчики иммунотоксинов учитывают то обстоятельство, что обе субъединицы токсина содержат большое количество карбоксильных групп, связывающих их с неизмененными тканями, и, в частности, с тканями печени и почек. Поэтому прежде чем конъюгировать их с антителом, субъединицы дегликозилируют различными способами (получая рекомбинантные формы токсина в кишечной палочке, химическим путем и др.). Оптимальным объектом для лечения иммунотоксинами являются опухолевые заболевания системы крови. Злокачественные клетки расположены внутри сосудов и доступны для препарата при внутривенном введении. К тому же иммунная система таких пациентов часто утрачивает способность к эффективному антительному ответу на сам иммунотоксин. Конструирование иммунотоксинов, используемых в медицинских целях, предполагает повышение их специфичности именно к опухолевым клеткам и как можно большую их безопасность для клеток нормальных тканей. В клинике токсичность таких препаратов оценивают по так называемой максимальной переносимой дозе (maximum tolerated dose, MTD). Признаки ее превышения неспецифические: астения, подъем уровня печеночных трансаминаз в крови, гипотензия. При появлении таких симптомов дозу препарата снижают. При более высокой дозе иммунотоксина у пациента может развиться синдром пропускания сосудов (vascular leak syndrome, VLS; Clarkson syndrome), вызванный высвобождением цитокинов после гибели периваскулярных Т-клеток. Основные симптомы: гипотензия, гипоальбуминемия без альбуминурии, генерализованный отек, низкий гематокрит. Количества иммунотоксинов, вызывающих осложнения, находятся в пределах десятков мкг на кг веса пациента [21].
Максимально возможная токсичность
Выше мы уже приводили примеры повышения поражающего действия токсинов, но где пределы их «усовершенствования»?
Пытаясь понять причину остановки роста токсичности новых боевых отравляющих веществ (ОВ) во второй половине ХХ в., Н.С. Антонов [2] исследовал имеющиеся в научной литературе данные по токсичности большого количества структурно-родственных веществ со сходным характером токсического действия. Он установил, что каждая такая группа веществ имеет границу минимальных летальных доз (ГМЛД), которая в логарифмических координатах «LD50 (моль/кг) — молекулярная масса» представляет собой параболовидную кривую, причем наиболее токсичным веществам множества соответствуют строго определенные значения молекулярной массы. Используя приемы математической статистики, Антонов установил еще одну закономерность. Если на евклидовой поверхности в логарифмических координатах «LD50 — молекулярная масса» отобразить весь массив веществ, для которых летальные дозы экспериментально установлены, то плоскость графика оказывается разделенной на две части: на одной из них сосредоточены отображения всех взятых веществ, в то время как другая часть плоскости графика остается свободной, ибо в природе не существует веществ, которые по величине летальной дозы и молекулярной массы соответствовали бы этой части плоскости графика (рис. 8).
 Рис. 8. График токсоиды по Н.С. Антонову. Максимальная токсичность «супертоксинов» достигается за счет предельного увеличения размеров и сложности их молекул [2].
Рис. 8. График токсоиды по Н.С. Антонову. Максимальная токсичность «супертоксинов» достигается за счет предельного увеличения размеров и сложности их молекул [2].
Между указанными частями плоскости графика отчетливо прослеживается граница, формируемая отображениями наиболее токсичных веществ в соответствующих интервалах изменения величины молекулярной массы. Сохранены отображения только наиболее токсичных веществ и проведена кривая, огибающая эти отображения со стороны минимальных летальных доз. Эта кривая названа им «токсоидой». Наиболее токсичному веществу — ботулиническому токсину, соответствует и наибольшая молекулярная масса.
Эффект возрастания биологической активности по мере увеличения молекулярной массы отмечался ранее Н.И. Кобозевым у алкалоидов, гликозидов, гормонов, витаминов и синтетических лекарственных веществ. Им было показано, что путем вариации состава и строения молекул можно добиться некоторого увеличения активности веществ. Но если требуется добиться увеличения активности в десятки и более раз, одних структурных изменений молекул уже недостаточно, требуется переход к соединениям с большей величиной молекулярной массы [2], т. е. более сложно организованных.
ММ ботулинического токсина составляет 150 кДа [4]. ММ типичной белковой цепи достигает 50 кДа, размер лишь немногих пептидов превышает эту среднюю величину [1]. ММ ботулинических токсинов приближается к верхнему пределу возможных молекулярных масс белков. Из закономерностей, установленных Н.С. Антоновым и Н.И. Кобозевым, следует, что ММ токсинов с LD50 , меньшей на один порядок, чем у ботулинического, должна превышать 1,5 мДа (описано лишь несколько белков с такой массой), — на два порядка — 15 мДа (такие белки не описаны).
Заключение
Структура, механизмы действия и древность происхождения бактериальных токсинов свидельствуют о том, что их эволюция началась еще в сообществах одноклеточных микроорганизмов, где они играли роль сигнальных молекул, способных действовать на большом расстоянии от бактериальной клетки без ослабления силы сигнала. Эволюция токсинов происходила путем нарастания сложности их молекул, вызванной дупликациями и слияниями генов, кодирующих белки их отдельных доменов. Древность бактериальных токсинов позволяет поставить под сомнение антропозность отдельных инфекционных болезней, например, холеры, коклюша и дифтерии. Видимо целесообразно вести поиск природных резервуаров возбудителей этих болезней в сообществах простейших организмов. Субъединичная структура токсинов, где одна из субъединиц играет роль лиганда, другая вызывает токсический эффект, позволяет осуществлять исследования, направленные на получение нового поколения медицинских иммунобиологических препаратов, не имеющих аналогов в природе. В настоящее время разработаны подходы для вмешательства в структуру молекул токсинов, позволяющие получать иммунотоксины для прицельного терапевтического воздействия на злокачественные клетки крови, и токсины с измененной специфичностью и/или с более высокой токсичностью в отношении отдельных видов насекомых. Токсичность ботулинического токсина предельна не только для бактериальных токсинов, но и для природных токсических веществ. При модификации токсинов наиболее вероятно изменение спектра их целей. LD 50гибридных и модифицированных токсинов даже при повышении их токсичности для отдельных экспериментальных животных, будет находиться в пределах, характерных для токсических веществ данного диапазона молекулярных масс.
* Сигнал — событие, имеющее регуляторное/управленческое значение в той системе, в которой оно опознаётся и потому значимо для неё. В живой клетке сигнал — это событие, имеющее регуляторное значение для функционирования клетки.
* В России ботулинический нейротоксин типа A зарегистрирован под торговыми наименованиями «Диспорт» и «Ботокс». Препараты ботулинического токсина применяются для временного сглаживания межбровных морщин, лечения косоглазия, блефароспазма и блокирования повышенного потоотделения.
Литература:
1. Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки: В 3 т. // Пер. с англ. под ред. Г.П. Георгиева и Ю.С. Ченцова. — М., 1994.
2. Антонов Н.С. Химическое оружие на рубеже двух столетий. М., 1994.
3. Вертиев Ю.В. Бактериальные токсины: биологическая сущность и происхождение // Журн. микробиол. — 1996. — № 3. — С. 43-46.
4. Езепчук Ю.В. Патогенность, как функция биомолекул. — М., 1985.
5. Супотницкий М.В. Микроорганизмы, токсины и эпидемии. М., 2005.
6. Филдс Б., Найп Д., Ченок Р. и др. Вирусология: В 3 т. // Пер. с англ. под ред. Н.В. Каверина, Л.Л. Киселева. — М., 1989.
7. Шувалова Е.П. и др. Инфекционные болезни. — Ростов на Дону, 2001.
8. Aktories K. Rho proteins: targets for bacterial toxins // Trends Microbiol. — 1997. — Vol. 5, № 2. — P. 282-288.
9. Arnon S. Human tetanus and human botulism // The clostridia: molecular biology and pathogenesis / Ed. Rood J.I., McClane B.A., Songer J.G., Titball R.W. San Diego: Academic Press: 1997. — P. 95-115.
10. Barth H., Aktories K., Popoff M.R. et al. Binary bacterial toxins: biochemistry, biology, and applications of common Clostridium and Bacillus proteins // Microbiol. Mol. Biol. Rev. — 2004. — Vol. 68, № 3. — P. 373-402.
11. Bhakdi S., Bayley H., Valeva A. et al. Staphylococcal alpha- toxin, streptolysin-O and Escherichia coli hemolysin: prototypes of pore-forming bacterial cytolysins // Arch. Microbiol. — 1996. Vol. 165, № 1. — P. 73-79.
12. Bhakdi S., Tranum-Jensen J. Alpha-toxin of Staphylococcus aureus // Microbiol. Rev. — 1991. — Vol. 55, № 4. — P. 733-751.
13. Blum G., Falbo V. , Caprioli A. et al. Gene clusters encoding the cytotoxic necrotizing factor type 1, Prs-fimbriae and -hemolysin form the pathogenicity island II of the uropathogenic Escherichia coli strain J96 // FEMS Microbiol. Lett. — 1995. — Vol. 126, № 1. — P. 189-196.
14. Bravo A., G mez I., Conde J. et al. Oligomerization triggers binding of a Bacillus thuringiensis Cry1Ab pore-forming toxin to aminopeptidase N receptor leading to insertion into membrane microdomains // Biochim. Biophys. Acta. — 2004. — Vol. 1667. P. 38-46.
15. Caramori T., Albertini A.M., Galizzi A. In vivo generation of hybrids between two Bacillus thuringiensis insect-toxin- encoding genes // Gene. — 1991. — Vol. 98. — P. 37-44.
16. De Maagd R.A., Bravo A., Creckmore N. How Bacillus thuringiensis has evolved specific toxins to colonize the insect world // Trends in Genet. — 2001. — Vol. 17. — P. 193-199.
17. De Maagd R.A., Kwa M.S.G., Van der Klei H. et al. Domain III substitution in Bacillus thuringiensis delta-endotoxin Cry1Ab results in superior toxicity for Spodoptera exigua and altered membrane protein recognition // Appl. Environ. Microbiol. — 1996. — Vol. 62. — P. 1537-1543.
18. Finlay B., Falkow S. Common themes in microbial pathogenicity // Microbiol. Rev. — 1997. — Vol. 53, № 2. — P. 210-230.
19. Halpern J., Neale E. Neurospecific binding, internalization and retrograde axonal transport // Curr. Top. Microbiol. Immunol. 1995. — Vol. 195, № 1. — P. 221-241.
20. Henkel J.S., Baldwin M.R., Barbieri J.T. Toxins from bacteria // EXS. — 2010. — № 100. — P. 1-29.
21. Kreitman R.J. Immunotoxins for targeted cancer therapy // The AAPS Journal ( http://www.aapsj.org ). — 2006. — Vol. 8, N 3. E532-E551.
22. Kreitman R.J. Recombinant immunotoxins containing truncated bacterial toxins for the treatment of hematologic malignancies // BioDrugs. — 2009. — Vol. 23, N 1. — P. 1-13.
23. Lacy D.B., Lin H., Melnyk R.A. et al. A model of anthrax toxin lethal factor bound to protective antigen // Proc. Natl. Acad. Sci. USA. — 2005. — Vol. 102. — P. 16409-16414.
24. Lemichez E., Flatau G., Bruzzone M. et al. Molecular localization of the Escherichia coli cytotoxic necrotizing factor CNF1 cell- binding and catalytic domains // Mol. Microbiol. — 1997. — Vol. 24, N 7. — P. 1061-1070.
25. Lemichez E., Flatau G., Bruzzone M. et al. Molecular localization of the Escherichia coli cytotoxic necrotizing factor CNF1 cell- binding and catalytic domains // Mol. Microbiol. — 1997. — Vol. 24, N 7. — P. 1061-1070.
26. Liu X. S., Dean D.H. Redesigning Bacillus thuringiensis Cry1Aa toxin into a mosquito toxin // Prot. Eng. Design. Selec. — 2006. Vol. 19. — P. 107-111.
27. Lobet Y, Cieplak W., Smith S.G. et al. Effects of mutations on enzyme activity and immunoreactivity of the S1 subunit of pertussis toxin // Infec. Immun. — 1989. — Vol.57, N11. — P. 3660-1668.
28. Loosmore S., Zealy G.R., Boux H.A. et al. Engineering of genetically detoxified pertussis toxin analogs for development of a recombinant whooping cough vaccine // Infec. Immun. — 1990. — Vol. 58, N 5. — P. 3653-3662.
29. Mandal C.C., Gayen S., Basu A. et al. Prediction based protein engineering of domain I of Cry2A entomocidal toxin of Bacillus thuringiensis for the enhancement of toxicity against lepidopteran insects// Prot. Eng. Design. Selec. — 2007. — Vol. 20. — P. 599-606.
30. Pardo-Lpez L., Gomes I., Rausell C. et al. Structural changed of of the eCry1Ac oligomeric pre-pore from Bacillus thuringiensis induced by N-acetygalactosamine facilitates toxin membrane insertion // Biochem. — 2006. — Vol. 45. — P. 10329-10336.
31. Pardo-L pez L., Mu oz-Garay C., Porta H. Strategies to improve the insecticidal activity of Cry toxins from Bacillus thuringiensis // Peptides. — 2009. — Vol. 30, N 3. — P. 589-595.
32. Petosa C., Collier P., Klimpel K. R. et al. Crystal structure of the anthrax toxin protective antigen // Nature. — 1997. — Vol. 385, N 6619. — P. 833-838.
33. Rajamohan F., Alzate O., Cotrill J.A. et al. Protein engineering of Bacillus thuringiensis delta-endotoxin: mutations at domain II of CryIAb enhance receptor affinity and toxicity toward gypsy moth larvae// Proc. Natl. Acad. Sci. USA. —1996. — Vol. 93. — P. 14338-14343.
34. Schiavo G., Montecucco C. The structure and mode of action of botulinum and tetanus toxins // The clostridia: molecular biology and pathogenesis / Ed. Rood J., McClane B., Songer J., Titball R. San Diego: Academic Press; 1997. — P. 295-322.
35. Schlievert P. Searching for superantigens // Immunol. Infec. — 1997. — Vol. 26, N 2. — P. 283-290.
36. Schmitt C.K., Meysick K.C., Brien A.D. Bacterial toxins: friends or foes? // Emerg. Infect. Dis. — 1999. — Vol. 5, N 2. — P. 224-234.
37. Schnepf E., Crickmore N., Van Rie J. et al. Bacillus thuringiensis and its pesticidal crystal proteins // Microbiol. Mol. Biol. Rev. 1998. — Vol. 62. — P. 705-806.
38. Song L., Hobaugh M., Shustak C. et al. Structure of staphylococcal alpha-hemolysin, a heptameric transmembrane pore // Science. — 1996. — Vol. 274, N 14. — P. 1859-1866.
39. Walters F.S., Stacy Ch.M., Lee M.K. et al. An engineered chymotrypsin/cathepsin G site in domain I renders Bacillus thuringiensis Cry3A active against western corn rootworm larvae // Appl. Environ. Microbiol. — 2008. — Vol. 74. — P. 367-374.
40. Wirth M.C., Georghiou G.P., Federici B.A. CytA enables CryIV endotoxins of Bacillus thuringiensis to overcome high levels of CryIV resistance in the mosquito Culex quinquefasciatus // Proc. Natl. Acad. Sci. USA. — 1997. — Vol. 94. — P. 10536-10540.
41. Wu D., Aronson A.I. Localized mutagenesis defines regions of the Bacillus thuringiensis deltaendotoxin involved in toxicity and specificity // J. Biol. Chem. — 1992. — Vol. 267. P. 2311-2327
Библиографическое описание:
Супотницкий М. В. Бактериальные токсины. Их природа, механизмы действия, возможности конструирования гибридных и модифицированных токсинов // Биопрепараты. — 2011. — № 1. — С. 6-15.
Bibliographical entry:
Supotnitskiy M. V. Bacterial toxins. Their nature, modes of action, opportunities of creating hybrid and modified toxins // Biopreparats (Biopharmaceuticals). — 2011. — № 1. — С. 6-15.

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2011

