ДНК-иммунизация в профилактике инфекционных болезней сельскохозяйственных животных
ДНК-иммунизация — новый высокоэффективный способ специфической профилактики инфекционных болезней, при котором плазмиду, экспрессирующую гены антигенов, вводят в ткани животного или человека. Способ выходит за рамки традиционной иммунопрофилактики и относится к технологиям соматической генной терапии. Российские ветеринарные специалисты недостаточно знакомы с преимуществами ДНК-иммунизации.
ДНК-вакцины. Для экспрессии генов антигенов большинство исследователей используют эукариотические плазмидные векторы, несущие ранний промотор человеческого цитомегаловируса (НСМ), который вызывает экспрессию высокого уровня во многих типах клеток. Под его контролем, как правило, находится полная нуклеотидная последовательность гена хорошо охарактеризованного антигена (табл. 1) [12].
Таблица 1
Направления конструирования ДНК-вакцин
|
Патоген |
Клонированный ген |
Экспериментальная модель |
Достигнутая защита |
Источник |
|
Вирус бычьего герпеса |
Гликопротеин |
Мыши |
Частичная |
17 |
|
Вирус гепатита В |
Капсид (коровый антиген) |
Мыши |
Исследовали титры антител |
17 |
|
Вирус гепатита В |
Оболочечный белок (поверхностный антиген) |
Кролики, мыши, крысы, шимпанзе |
Полная |
17 |
|
Вирус гепатита С |
Кор (нуклеокапсид) |
Мыши |
Исследовали титры антител |
17 |
|
Вирус простого герпеса |
Гликопротеин В, гликопротеин D, ICP 27 |
Мыши |
Частичная |
17 |
|
Вирус иммунодефицита человека первого типа |
Оболочечный гликопротеин, gp 160 |
Мыши, нечеловекообразные приматы |
Исследовали титры антител |
17 |
|
Возбудитель лейшманиоза типа major |
Главный поверхностный гликопротеин |
Мыши |
Полная |
17 |
|
Вирус лимфоцитарного хориоменингита |
Гликопротеин, нуклеопротеин |
Мыши |
Частичная |
17 |
|
Mucobactenum tuberculosis |
М. leprae hsp 65 |
Мыши |
Мыши |
17 |
|
Salmonella typhi |
Порообразующий белок |
Мыши |
Исследовали титры антител |
14 |
|
Папилломавирус |
Главный капсидный белок L1 |
Кролики |
Полная |
17 |
|
Plasmodium yoelii |
Белок циркумспорозоита |
Мыши |
Частичная |
17 |
|
Вирус бешенства |
Гликопротеин |
Мыши |
Полная |
17 |
|
Обезьяний вирус иммунодефицита |
Env, gag |
Обезьяны |
Исследовали титры антител |
17 |
|
Schistosoma japonicum |
Парамиозин (Sj 97) |
Мыши |
Исследовали титры антител |
17 |
|
Вирус гриппа |
Гемагглютинин, матриксный белок, нуклеопротеин |
Цыплята, хорьки, мыши, нечеловекообразные приматы |
Полная |
10, 17 |
|
Вирус клещевого энцефалита |
Гликопротеины Е и N 91 |
Мыши |
Мыши |
3 |
|
Mycoplasma pulmonis |
Экспрессионная библиотека |
Мыши |
Мыши |
7 |
Разрабатывают и более эффективные системы — промотор бета-актина [14], введение интронных последовательностей [8] и др., способные осуществлять экспрессию как отдельных генов антигенов, так и их сочетаний [13]. Иммунный ответ вызывают инъекцией «голой (naked)» ДНК в солевом растворе или в комплексе с липидами. Менее распространенные способы — введение ДНК в легочную ткань в составе мелкодисперсного аэрозоля или с частицами золота непосредственно в эпидермис кожи под давлением воздуха. Плазмидная ДНК при внутрикожной инъекции способна индуцировать более длительный и сильный антигенспецифический иммунный ответ, чем при прямом введении в скелетную мышцу, даже при значительно меньшем ее количестве — 1/500 часть [11, 15]. Разрабатывают подходы к введению плазмидной ДНК через поверхности слизистых оболочек с помощью мутантов Shigella, разрушающихся после проникновения в эпителий кишечника, а также в составе липосомных носителей [9, 12]. По сравнению с «голой» ДНК, способность ДНК-липидного комплекса к экспрессии гена антигена в мышечной ткани понижена, однако при внутривенном его введении экспрессия генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке [18]. В таблице 2 приведен сопоставительный анализ свойств традиционных и ДНК-вакцин [12].
Таблица 2
Сопоставительный анализ свойств вакцин разных типов
|
Свойство
|
Тип вакцины |
|||
|
Цельная живая ослабленная |
Живая рекомбинантная |
Убитая (химическая, субъединичная) |
ДНК-вакцина |
|
|
Синтезируемый эндогенно антиген ассоциирует с МНС класса I и индуцирует СД8 + ЦТЛ (клеточное звено иммунитета) |
Да |
Да |
Обычно нет |
Да |
|
Антиген взаимодействует МНС класса II и индуцирует СД4 + Т-хэлперные клетки (гуморальное звено иммунитета) |
Да |
Да |
Да |
Да |
|
В иммунный ответ вовлекаются все протеины патогена |
Да |
Редко |
Да (но не для субъединиц) |
Потенциально |
|
Слабый иммунный ответ на вектор позволяет его повторно использовать для различных вакцин |
Нет |
Сомнительно |
Неприменимо |
Да |
|
Антигенная конкуренция между вектором и антигеном |
Нет |
Возможна |
Нет |
Нет |
|
Безопасность для беременных и иммунодефицитных больных |
Нет |
Нет |
Возможна |
Возможна |
|
Риск реверсии патогенности |
Да |
Да |
Нет |
Нет |
|
Риск контаминации посторонним агентом |
Да |
Да |
Нет |
Нет |
|
Снижение эффективности иммунизации из-за материнских антител |
Да |
Да |
Да |
Нет |
|
Легкость приготовления и очистки |
Нет |
Нет |
Нет |
Да |
|
Температурная стабильность |
Обычно нет |
Обычно нет |
Нет |
Да |
Особенности иммунного ответа . Механизмы иммунного ответа на введение ДНК-вакцин, не исследованы. При иммунизации убитыми (химическими, субъединичными) вакцинами экзогенные антигены разрушаются до пептидов внутри эндосомных компартментов клетки. Далее они появляются на поверхности этих клеток в соединении с молекулами главного комплекса гистосовместимости II класса (МНС-И). Их распознавание СД4 + Т-хэлперными лимфоцитами (Th) побуждает последних к секреции растворимых факторов (цитокинов), регулирующих эффекторные механизмы гуморального иммунного ответа [2, 12].
По мнению D.E. Hassett и J.Т. Whitton (1996), прямая инокуляция плазмидной ДНК, содержащей открытую рамку считывания с соответствующими эукариотическими транскрипционными и трансляционными факторами с контролирующими сигнальными элементами, должна приводить к синтезу белков in vivo, конформационная и посттрансляционная модификация которых идентична синтезируемым при инфекционном процессе. В.Г. Дебабов (1997) считает, что дальнейшее развитие процесса сходно с таковым при вирусной инфекции.
Антигенные белки синтезируются в цитозоле, протеолитически расщепляются до пептидов и переносятся в эндоплазматический ретикулум. Затем они взаимодействуют с молекулами главного комплекса гистосовместимости класса I (MHC-I) и транспортируются к клеточной поверхности, где распознаются Th-лимфоцитами класса СД8 + [2]. Последние организуют иммунный ответ, стимулируя выработку антител В-клетками, клональную экспансию цитотоксических лимфоцитов (ЦТЛ) и активируют макрофаги-киллеры [2].
Однако D.E. Hassett и J.Т. Whitton (1996) отмечают, что при наличии генной экспрессии в мышечной ткани после введения в нее плазмидной ДНК и индукции антигенспецифических ЦТЛ доказательств представления мышечными клетками антигенов СД8 + Тh-лимфоцитам не получено. Поэтому пока делать вывод о том, какие клетки отвечают за индукцию Т-клеточных ответов в иммунизированном ДНК-вакциной организме, преждевременно. Эти же авторы обращают внимание на неясный механизм повышения уровня специфических антител [12].
Кожа богата антигенпредставляющими клетками (клетки Лангерганса), синтезирующими МНС-II молекулы. Поэтому ДНК, введенная непосредственно в кожу, может быть легко ими захвачена. Однако мышечные ткани небогаты антиген-представляющими клетками (АПК) и их способность к экспрессии высокого уровня МНС-II молекул не описана. Секретируемые белки (поверхностный антиген гепатита В) после синтеза могут высвобождаться из мышечных клеток и захватываться немногочисленными локальными АПК. В то же время появление выраженного гуморального иммунитета в отношении несекретируемых белков трудно объяснить [12]. Если эти белки нецитоплазматические, то они могут не иметь доступа во внеклеточное пространство и не вовлекаться в механизм взаимодействия с МНС-II [12, 17].
Уровень антител повышается ступенчато, достигая максимума через 6 нед. после однократной иммунизации ДНК-вакциной [2]. При обычной иммунизации уровень антител достигает максимума через 1–2 нед. [6]. D.E. Hassett и J.Т. Whitton (1996) объясняют это низким уровнем воспалительной реакции на введение ДНК-вакцины. В результате происходит ограниченная деструкция мышечных клеток, синтезирующих антиген, что создает для АПК длительный источник растворимых антигенов и побуждает их к иммунному ответу [12]. При повреждении мышечной ткани токсином или анестетиком перед введением ДНК иммунный ответ может усиливаться [14].
Высокий уровень антител отмечен после многократных инъекций плазмидной ДНК [3, 12]. Это явление может иметь два объяснения: более длительный период действия первоначально введенной ДНК; повышение иммунного ответа за счет регенерации мышечных клеток или привлечения АПК в участок первой инъекции [12]. В дальнейшем будут изучены детали механизма защиты от возбудителей инфекционных болезней. В настоящее время важно то, что при данном способе иммунизации протективный эффект установлен на разных экспериментальных моделях (см. табл. 1).
Эффективность иммунизации . J.J. Donnelly et al. (1995) наблюдали перекрестно-штаммовый (видоспецифический) иммунитет в отношении возбудителей гриппа. Самок мышей линии BALB/c в 4-, 7- и 10-недельном возрасте иммунизировали 100 мкг плазмидной ДНК с геном нуклеопротеина (NP), клонированным из генома вируса гриппа A/PR/8/34(H 1N1) (рис. 1, А, синие кружки). Мышам контрольной группы вводили по этой же схеме векторную плазмиду без клонированного гена (светлые кружки). В 13-недельном возрасте грызунов инфицировали интраназально 200 LD50вируса А/НК/68 (H3N2). Мышей другой экспериментальной группы вакцинировали по такой же схеме очищенным NP (рис. 1, В, синие квадраты), а контрольной — не иммунизировали (рис. 1, В, светлые квадраты). Животных инфицировали интраназально 200 LD50 вируса А/НК/68 (H3N2).
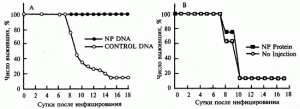 Рис. 1. Перекрестно-штаммовый защитный эффект ДНК-вакцинации в отношении вируса гриппа
Рис. 1. Перекрестно-штаммовый защитный эффект ДНК-вакцинации в отношении вируса гриппа
Защитный эффект при иммунизации ДНК-вакциной составлял 100%, а при использовании химической вакцины на основе этого же антигена он отсутствовал [10].
Интересную конструкцию плазмидного вектора для иммунизации животных против вируса клещевого энцефалита разработали Е.Э. Митрофанов и соавт. (1997). Вектор включает ген гликопротеина оболочки вириона и ген неструктурного гликопротеина NS1, который находится на поверхности инфицированных вирусом клещевого энцефалита (ВЭК) клеток. Защитный эффект ДНК-иммунизации исследовали на мышах линии BALB/c. Животных 5-кратно иммунизировали 80–100 мкг вектора pSVK3-ENS1 и через неделю после последней прививки инфицировали 100 LD50 ВЭК (штамм Софьин). В контрольной группе заболели все мыши и 43% из них погибли. Животные, иммунизированные ДНК-вакциной, оставались здоровыми в течение всего срока наблюдения [3].
При изучении длительности иммунного ответа Н.L. Davis et al. обнаружили, что после ДНК-иммунизации мышей геном поверхностного антигена вируса гепатита В уровень антител выходит на плато на 104 сут и остается стабильным 18 мес. Бустерная иммунизация через 7 мес увеличивала количество антител более чем в 10 раз. Теоретически с помощью ДНК-вакцины при однократном ее введении можно достичь пожизненной резистентности иммунизированных особей к одному или нескольким возбудителям инфекционных болезней.
Распространенная схема конструирования ДНК-вакцины. На рисунке 2 приведены последовательные операции, использованные С. Loper-Macias et al. (1995) при создании антисальмонеллезной ДНК-вакцины, экспрессирующей ген пориНового белка (ompC) S. typhi. ОтрС ген посредством полимеразной цепной реакции (ПЦР) амплифицировался с помощью плазмиды pST13 5 . При этом использовали 3 праймера. Праймер F73 включал EcoRI сайт, рибосомальный связывающий сайт (RBS), инициирующий кодон (1С) и лидерную последовательность ОтрС; праймер F72 — Hind III сайт, RBS, IS и концевую аминокислотную последовательность зрелого ОтрС; праймер, обозначенный как F74, — Ват HI сайт и стоп-кодон. Всего получили два синтетических гена, один из них содержал последовательность лидерного пептида (p-LompC), другой нет (р-отрС). Синтетические гены вставили в экспресси-рующий вектор pFM92. 1 под контроль промотора бета-актина. Исследование специфических антител у иммунизированных животных показало, что плазмида p-LompC индуцировала в 3 раза более высокий их титр, чем плазмида р-отрС [14].
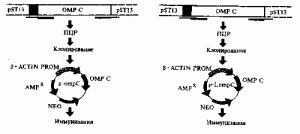 Рис.2. Схема конструирования антисальмонеллезной ДНК-вакцины
Рис.2. Схема конструирования антисальмонеллезной ДНК-вакцины
Экспрессионную библиотечную иммунизацию используют при отсутствии у исследователя охарактеризованного гена антигена возбудителя инфекционной болезни [17]. Способ основывается на введении в кожу с твердыми частицами очень небольшого количества ДНК. Теоретически ДНК в дозе 1 мкг способна доставить в кожу животного около 1000 разных генов. С помощью плазмидного экспрессирующего вектора были получены библиотеки генов возбудителя микоплазменной пневмонии Mycoplasma pulmonis, обладающего относительно небольшим геномом (106 пар оснований). Экспрессируется только небольшая часть генов микроорганизма, в основном это фрагменты белков, поэтому патогенного эффекта от «сборки» микоплазмы удается избежать. В то же время внутрикожная иммунизация разными библиотеками генов М. pulmonis позволила полностью защитить организм в отношении данного возбудителя [7].
Противодействие инфекционным болезням, не контролируемым в настоящее время средствами иммунопрофилактики . Мнение о полном контроле за инфекциями с помощью вакцин удерживалось до конца 80-х годов, пока его не поколебала пандемия СПИДа. ДНК-иммунизация также не является всеобщей панацеей. Со второй половины XX столетия все большее значение приобретают возбудители инфекций, которые невозможно контролировать средствами иммунопрофилактики. Персистирование этих микроорганизмов сопровождается феноменом антителозависимого усиления инфекции или интегрированием провируса в геном макроорганизма [1]. Для первых специфическая профилактика может основываться на торможении проникновения возбудителя в чувствительные клетки путем специфического блокирования рецепторов узнавания на их поверхности (вирусная интерференция; водорастворимые соединения, связывающие рецепторы) и ингибировании их внутриклеточного размножения (оли-гонуклеотидное и антисмысловое ингибирование генов возбудителя, каталитическое расщепление мРНК его отдельных белков, уничтожение инфицированных клеток специфическим цитотоксином и др.).
Решение проблемы провируса возможно при клонировании трансгенных животных, например, получение их линий, не содержащих провирус (по-видимому, тоже относится и к животным, пораженным прионными болезнями). Таким образом, ДНК-вакцины следует разрабатывать в отношении возбудителей, персистирование которых не сопровождается антителозависимым усилением инфекции или сохранением провируса в геноме хозяина.
Гены антигенов . Уникальность ДНК-иммунизации состоит в том, что, используя один и тот же вектор, можно создавать разные вакцины, меняя только последовательности ДНК, кодирующие антигены [2]. ДНК-вакцины должны индуцировать видоспецифический иммунитет и защиту от аэрогенного инфицирования — наиболее опасного в условиях интенсивного животноводства.
Из поверхностных оболочечных белков вирусов наиболее консервативны белки слияния, способствующие проникновению вируса через мембрану эукариотической клетки-мишени [1]. К консервативным антигенам относятся и внутренние (неструктурные) белки, присутствующие на поверхности инфицированных клеток (белок N 91 вируса клещевого энцефалита, е-белок вируса гепатита В, HP-белок вируса гриппа и др.) [1, 3]. Гликопротеиновая природа антигенов не лимитирует клонирование их генов в векторах экспрессии. Свою природную (третичную) структуру антиген принимает при гликозилировании в процессе синтеза в клетке млекопитающего [17]. Возможно воспроизведение и более сложной (четвертичной) конформационной структуры антигенов. М. S. Schnell (1994) сконструировал плазмиды, несущие полноразмерную кДНК (12 т. п. н.) аттенуированного вакцинного штамма вируса бешенства. При одновременной экспрессии в трансфицированных клетках белков вируса собираются и отпочковываются инфекционные вирионы или «пустые» капсиды, в зависимости от условий эксперимента [16].
Для профилактики инфекций, вызываемых грамположительными бактериями, в плазмидный вектор целесообразно включать гены иммуногенных производных белков, определяющих патогенез болезни (например, ген протективного антигена возбудителя сибирской язвы, гены нетоксических производных токсинов возбудителей клостридиозов и др.). Подавляющее большинство грамотрицательных бактерий в патогенезе болезней не имеют ведущего фактора. Поэтому оптимальным является клонирование в плазмидные векторы генов пориновых белков (то, что сделали С. Loper-Macias et al. при конструировании антисальмонеллезной ДНК-вакцины, см. рис. 2), регулирующих проницаемость наружной клеточной мембраны бактерий для веществ с невысокой молекулярной массой и играющих в инфекционном процессе, по-видимому, ту же роль, что и белки слияния вирусов [4]. Порообразующие белки имеют перед другими клеточными антигенами грамотрицательных бактерий преимущества: высокую иммуногенность и видоспецифичность иммунитета, приобретаемого животным; преобладание клеточного звена в иммунном ответе; способность защищать от аэрогенного инфицирования [5]. По данным литературы, гены порообразующих белков, по-видимому, можно использовать при конструировании ДНК-вакцин против возбудителей сапа, мелиоидоза, кампилобактериоза, псевдотуберкулеза, легионеллеза, сальмонеллеза, псевдомоноза, иерсиниоза, листериоза, гемофилеза и др.
Массовая иммунизация . Некоторые авторы говорят о дешевизне ДНК-вакцин [2, 12], однако исследователи, которые сами выделяли плазмидную ДНК, хорошо представляют, что получение в лабораторных условиях 100 мкг плазмид для иммунизации только одной мыши — процесс трудоемкий. Тем более что в любом препарате ковалентно замкнутая кольцевая (кзк) плазмида при хранении постепенно образует открыто кольцевые и линейные формы, трансфецирующая активность которых в 100 и более раз ниже, чем у кзк форм ДНК плазмид. Поэтому ДНК-вакцина, предназначенная для иммунизации животных в условиях хозяйств, должна быть разработана для внутрикожной инъекции, то есть представлять собой композицию, состоящую из мельчайших твердых частиц с сорбированными на них плазмидными ДНК. Внутрикожное введение ДНК-вакцины целесообразно осуществлять сжатым воздухом с помощью специального точно дозирующего аппарата. Альтернативным способом введения ДНК-вакцин могут быть саморазрушающиеся бактериальные векторы, применяемые перорально [9, 12].
Новые инфекции . ДНК-вакцины могут стать важным элементом мероприятий, направленных на ликвидацию вспышек новых инфекций среди сельскохозяйственных животных. Клонирование в плазмидный вектор с помощью ПЦР гена полноразмерного оболочечного гликопротеина вируса требует не более недели, после этого ДНК-вакцина готова для применения в очаге эпизоотии [17]. В экстренном случае, при неизвестности гена протективного антигена, можно использовать экспрессионную библиотеку генов [7]. Целесообразно заранее подготовить плазмиды, экспрессирующие гены протективных белков возбудителей африканской чумы свиней, везикулярного стоматита крупного рогатого скота, чумы рогатого скота, ящура и некоторых других.
Заключение. Преимущества ДНК-иммунизации перед распространенными способами иммунопрофилактики массовых инфекционных болезней животных заключаются в том, что ДНК-вакцины без персистирования в макроорганизме приближают искусственно вызываемый иммунный ответ к возможному при инфицировании природными возбудителями; иммунная реакция на введение генов антигенов сбалансирована и состоит из системного и местного ответов. Каждый из них включает иммуноглобулиновый и клеточный ответы. Иммунный ответ такого типа важен для противодействия инфекциям, вызываемым вирусами и грамотрицательными микроорганизмами.
ЛИТЕРАТУРА
1. Букринская А.Г., Жданов В. М. Молекулярные основы патогенности вирусов.— М., 1991.
2. Дебабов В.Г. // Молекулярная биология. 1997. 31. 2.
3. Митрофанов Е.Э. и др. // Молекулярная биология. 1997. 31. 9.
4. Супотницкий М.В. // Вестник Российской академии медицинских наук. 1996. 8.
5. Супотницкий М.В. // Ветеринария. 1996. 4.
6. Таточенко В.К., Озерецковский Н.А. Вакцинопрофилактика.— М., 1994.
7. Barry M.A. et al. // Nature. 1995. 377.
8. Chapman В.S. at al. // Nucleic Acids Res. 1991. 19. 10.
9. Cohen P. // New Sci. 1995. 148. 2000.
10. Donnelly J.J. et al. // DNA vaccines, N. Y. 1995.
11. Fynan E.F. et al. // Proc. Natl. Acad. Sci. USA. 1993. 90. 9.
12. Hassett D.E., Whitton J.T. // Trends Microbiol. 1996. 4.
13. Uu M. A. // DNA vaccines, N. Y., 1995.
14. Loper-Macias С et al. // DNA vaccines, N. Y., 1995.
15. Salmon J.H. et al. // West. J. Med. 1994. 160. 1.
16. Schnell M.S. // EMBO Journal. 1994. 13. 16.
17. Whalen R.G. // Emerging Infections Diseases. 1996. 2. 3.
18. Zhu N. et al. // Science. 1993. 261.
Супотницкий М.В. ДНК-иммунизация в профилактике инфекционных болезней сельскохозяйственных животных // Ветеринария. – 1998. - № 5. – С. 18-24

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 1998