Новый коронавирус SARS-CoV-2 в аспекте глобальной эпидемиологии коронавирусных инфекций
М.В. Супотницкий
Федеральное государственное бюджетное учреждение
«27 Научный центр» Министерства обороны Российской Федерации
(27 НЦ МО РФ), 105005, Российская Федерация,
Москва, Бригадирский переулок, д. 13
Поступила 30.03.2020 г. Принята к публикации 10.04.2020 г.
Кажущееся неожиданным появление в КНР и затем глобальное распространение SARS- CoV-2 заставляет задуматься о коронавирусной угрозе, исходящей из природных очагов, на территории нашей страны. Цель работы - рассмотреть SARS-CoV-2 в аспекте глобальной эпидемиологии коронавирусных инфекций. При подготовке статьи в основном использовались данные китайских ученых, опубликованные в англоязычных научных журналах. Их анализ показал широкое распространение вирусов данного таксона среди летучих мышей и ежей, в том числе в природных экосистемах Европы. До настоящего времени промежуточный между летучими мышами и человеком вид-хозяин SARS-CoV-2 и промежуточный вид коронавируса - прямой предшественник SARS-CoV-2, не обнаружены. Основная часть генома коронавирусов консервативна, однако он легко поддается генетическим рекомбинациям в естественных условиях, так что вирус может быть перенацелен как в естественных, так и в искусственных условиях с диких животных на человека путем изменения структуры белка S1. Патогенез коронавирусных инфекций у человека, вызывающих тяжелый острый респираторный синдром (SARS), складывается из этапов специфического узнавания вирусом рецепторов на клетках-мишенях в нижних отделах легких, проникновения в клетку-мишень, размножения, генерирования сначала цитокинового шторма, разрушающего нижние отделы легких, затем - феномена антитело-зависимого усиления инфекции, приводящего к изменению тропности вируса и его генерализации в организме человека. Вирулентность для человека у SARS-CoV-2 значительно ниже, чем у коронавирусов, вызвавших SARS в 2002-2003 гг. в Китае и ближневосточный респираторный синдром на Ближнем Востоке в 2012 г. Однако благодаря более высокой устойчивости при проникновении в эндосомы клетки и эффективной работе репликационно-транскрипционного комплекса, обеспечивается его размножение до количеств, позволяющих ему передаваться от больных людей здоровым. Разные этнические группы могут иметь разную чувствительность к SARS-CoV-2 и отличия в клинической симптоматике, что связано с количеством рецепторов ACE2 на поверхности пневмоцитов II типа, энтероцитов кишечника и сосудистого эндотелия других органов. В статье также приведены клинические наблюдения, сделанные китайскими исследователями во время вспышки коронавирусной инфекции, вызванной SARS-CoV-2. Ими высказано мнение, что эффективная и своевременная диагностика COVID-19 возможна при сочетании молекулярно-диагностических методов обнаружения SARS-CoV-2 с обнаружением характерных пневмонических очагов компьютерной томографией. Несмотря на все трудности борьбы с новой пандемией, она стала той встряской, которая сделала Россию более сильной в противоэпидемическом отношении.
Ключевые слова: альфакоронавирус; атипичная пневмония; бетакоронавирус; дыхательные пути; зооноз; компьютерная томография; коронавирус; межвидовая передача; патогенез; COVID-19; SARS-CoV-2.
Библиографическое описание: Супотницкий М.В. Новый коронавирус SARSCoV-2 в аспекте глобальной эпидемиологии коронавирусных инфекций // Вестник войск РХБ защиты. 2020. Т. 4. № 1. С. 32-65.https://doi.org/10.35825/2587-5728-2020-4-1-32-65
Кажущаяся внезапность эпидемии коронавирусной пневмонии в китайском городе Ухань в конце 2019 г., вызванная никому ранее не известным вирусом[1], ее масштаб и постепенное перерастание в пандемию, стали толчком к появлению различных апокалиптических слухов и подозрений в ее искусственном происхождении[2]. Однако проблема коронавирусных заболеваний дыхательных путей существовала и раньше, но из-за их легкого течения не считалась опасной. Вспышки тяжелого острого респираторного синдрома (SARS)[3] в 2002-2003 гг. и ближневосточного респираторного синдрома (MERS) в 2012 г. сопровождались большим количеством летальных исходов среди заболевших, но, все же, имели локальный характер. С пандемическим распространением SARS-CoV-2 ситуация радикально изменилась. Стало ясно, этот вирус является только частью опасного незнания как тех природных резервуаров, где поддерживаются, возможно, еще более опасные коронавирусы, так и механизмов, по которым они образуются, а затем вовлекаются в эпидемические процессы.
Цель работы - рассмотреть коронавирус SARS-CoV-2 в аспекте глобальной эпидемиологии коронавирусных инфекций. При подготовке статьи, в основном, использовались данные китайских ученых, опубликованные в англоязычных научных журналах. С 2002-2003 гг., т.е. после вспышки SARS, ученые КНР являются лидерами в изучении опасных для людей и животных коронавирусных инфекций.
Таксономия и происхождение коронавирусов. Коронавирусы (coronaviruses, CoVs) представляют собой сферические частицы размером 80-120 нм в диаметре. Они содержат позитивно-смысловую (positive-sense) одноцепочечную РНК (single-stranded RNA, ssRNA) протяженностью 27-32 т.п.н.[4], образующую нуклеокапсид. Нуклеокапсид окружен белковой мембраной и липосодержащей внешней оболочкой, от которой отходят булавовидные шиповидные отростки (спайки, spikes), предназначенные для взаимодействия с трансмембранными рецепторами клеток-мишеней. В 1960-х гг. первые обнаруженные коронавирусы относили к ортомиксо- и пара- миксовирусам на основании сходства их размера и общности выделения от пациентов с инфекциями дыхательных путей [1]. До начала 1980-х гг. оболочечные вирусы относили к коронавирусам по характерной морфологии, выявляемой электронно-микроскопическим исследованием - далеко отстоящими друг от друга шиповидными отростками, образующими вокруг вирусных частиц «корону» [2] (рисунок 1).
Выделение коронавирусов в отдельный таксон произошло благодаря работам S.G. Siddell с соавт. [3], L.S. Sturman и K.V. Holmes, установивших их характерные биохимические и таксономические особенности. В настоящее время Международный комитет по таксономии вирусов (International Committee on Taxonomy of Viruses, ICTV) на основе установленных филогенетических связей и структуры генома относит коронавирусы к подсемейству (subfamily) Coronavirinae семейства (family) Coronaviridae порядка (order) Nidovirales. Подсемейство включает в себя четыре рода (genera) - Alphacoronavirus, Betacoronavirus, Gammacoronavirus и Deltacoronavirus (рисунок 2)[5].
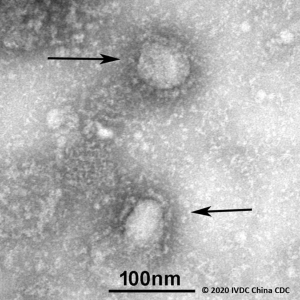
Рисунок 1 - Первое электронно-микроскопическое изображение коронавируса SARS-CoV-2, полученное учеными Китайского центра по контролю и профилактике заболеваний (Chinese Center for Disease Control and Prevention, CCDC). Он имеет круглую или эллиптическую и часто плеоморфную форму. Отчетливо видны шиповидные отростки длиной 9-12 нм, образующие вокруг вирусной частицы «корону». Диаметр вирусной частицы - приблизительно 60-140 нм. Его одноцепочечный РНК-геном содержит 29891 нуклеотидных последовательностей, кодирующих 9860 аминокислот (URL: https://amp.ibtimes.sg/chinas-cdc-releases-first-image-new-coronavirus-shares-genetic-info-japan-thailand-38238 ; дата обращения: 16.02.2020)
У млекопитающих инфекционные процессы вызывают альфакоронавирусы и бета- коронавирусы. Перед вспышкой в Ухани были известны шесть видов коронавирусов, вызывающих инфекционный процесс в дыхательных путях человека (human coronavirus, HCoV). Два высокопатогенных для человека вируса, SARS-CoV и MERS-CoV, как и SARS-CoV-2, относятся к бетакоронавирусам. Они инфицируют нижние отделы легких и вызывают тяжелый острый респираторный синдром. Остальные четыре (HCoV-NL63, HCoV-229E, HCoV-OC43 и HKU1) становятся причиной легких заболеваний верхних дыхательных путей у иммунокомпетентных взрослых людей и тяжелых у детей. Были идентифицированы случайно, как следствие активизации усилий по эпиднадзору.
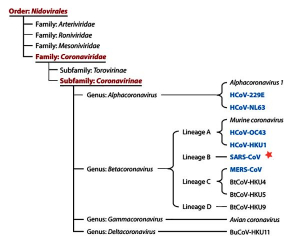
Рисунок 2 - Таксономия коронавирусов до обнаружения SARS-CoV-2. HCoVs выделены синим цветом [5] . В пределах рода Betacoronavirus были выделены линии (lineages) A, B, C и D. В 2018 г. их реклассифицировали в подроды (subgenera) и переименовали: Embecovirus (ранее - линия A), Sarbecovirus (ранее - линия B), Merbecovirus (ранее линия C) и Nobecovirus (ранее - линия D). Дополнительно выделен подрод Hibecovirus [8]. Положение SARS-CoV-2 показано звездочкой - новый вид в пределах известного подрода
Гаммакоронавирусы и дельтакоронавирусы в основном обнаруживают у птиц. Источником коронавирусов для людей считаются животные (рисунок 3). Основные патогенные для людей и животных коронавирусы перечислены в таблице 1.
Исследование генома SARS-CoV-2 не показало чего-то необычного. Первые 10 последовательностей генома SARS-CoV-2, полученные от 9 пациентов, оказались идентичными (99-98 %). При сравнении с геномами других коронавирусов наибольшее сходство с SARS-CoV-2 обнаружено у SARS-подобных вирусов летучих мышей bat-SL-CoVZC45 и bat-SL-CoVZXC21 (88 % идентичность), выделенных в 2018 г. в провинции Чжоушань (восточный Китай). При сравнении с геномами SARS-CoV и MERS-CoV, геномное сходство оказалось меньшим (~79 и 50 % соответственно). Филогенетический анализ также обнаружил сходство SARS-CoV-2 с bat-SL-CoVZC45 и bat-SL-CoVZXC21, а также его значительное отличие от SARS-CoV [9].
Таблица 1 - Основные патогенные коронавирусы*
|
Вирус |
Род |
Патогенность |
Симптомы |
|
Human CoV-229E |
alpha |
Человек |
Легкие инфекции верхнего респираторного тракта |
|
Human CoV-NL63 |
То же |
Человек |
Легкие инфекции верхнего респираторного тракта |
|
PRCV/ISU-1 |
|
Свиньи |
То же |
|
TGEV/PUR46-MAD |
-“- |
Свинья |
Диарея со 100 % летальностью среди поросят менее 2-х недельного возраста |
|
PEDV/ZJU-G1-2013 |
-“- |
То же |
Тяжело протекающая диарея |
|
SeACoV-CH/GD-01 |
|
|
Тяжелая и острая диарея, острая рвота |
|
SADS-CoV |
? |
-“- |
Синдром острой диареи у свиней (Swine acute diarrhea syndrome) |
|
Canine CoV/TU336/F/2008 |
-“- |
Собаки |
Респираторный коронавирус собак (Canine respiratory coronavirus). Диарея, легкие клинические признаки |
|
Camel alpha-coronavirus isolate camel/Riyadh |
-“- |
Верблюды |
Бессимптомно |
|
Feline infectious peritonitis virus |
-“- |
Кошки |
Лихорадка, васкулит и серозит, с выпотами или без них |
|
Human CoV-HKU1 |
beta |
Человек |
Пневмония |
|
Human CoV-OC43 |
То же |
Человек |
Легко протекающие инфекции респираторного тракта |
|
SARS-CoV |
-“- |
То же |
Тяжелый острый респираторный синдром (Severe acute respiratory syndrome). В 2002-2003 гг. заболело не менее 8 тыс. человек, 10 % летальность среди заболевших |
|
MERS-CoV |
-“- |
-“- |
Ближневосточный респираторный синдром (Middle East respiratory syndrome). Не менее 2249 лабораторно подтвержденным случаев инфекции в 27 странах. Первые случаи зарегистрированы в Саудовской Аравии в 2012 г. Летальность среди заболевших 37 % |
|
Bovine CoV/ENT |
|
Крупный рогатый скот |
Диарея |
|
Equine CoV/Obihiro12-1 |
-“- |
Лошади |
Лихорадка, анорексия, лейкопения |
|
MHV-A59 |
-“- |
Мыши |
Острая пневмония и тяжелая легочная недостаточность |
|
Beluga Whale CoV/SW1 |
gamma |
Белуги |
Легочная патология, острая печеночная недостаточность |
|
IBV |
То же |
Цыплята |
Вирус инфекционного бронхита (Infectious bronchitis virus). Острая пневмония |
|
Bulbul coronavirus HKU11 |
delta |
Короткопалые дрозды |
Пневмония |
|
Sparrow coronavirus HKU17 |
То же |
Воробьи |
То же |
|
Ea-HedCoV HKU31 |
beta |
Амурские ежи |
Бессимптомно. Коронавирус ежа Erinaceus amurensis HKU31 (Erinaceus amurensis hedgehog coronavirus HKU31), генетически тесно связан с MERS-CoV |
|
CHN-JS-2017 |
delta |
Свиньи |
Тяжело протекающая диарея у поросят менее 2-недельного возраста |
* За основу взята таблица из работы Yu. Chen с соавт. [7].
Молекулярное моделирование рецептор-связывающих доменов SARS-CoV-2 позволило отнести его к SARS-подобным вирусам летучих мышей, использующим в качестве рецептора для связывания с клетками-мишенями экзопептидазу - ангиотензинпревращающий фермент 2 (ACE2), имеющийся на поверхности эндотелиальных клеток капилляров легких у летучих мышей и у людей (рисунок 4)[6].
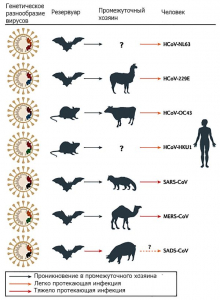
Рисунок 3 - Происхождение опасных для людей коронавирусов. SARS-CoV - новый коронавирус, появившийся в человеческих популяциях благодаря рекомбинации SARS-подобных коронавирусов, обитающих в летучих мышах (SARSr-CoVs). Вспышку атипичной пневмонии вызвал рекомбинантный вирус, инфицировавший циветт и людей и адаптировавшийся к этим хозяевам. MERS-CoV - вероятно, проник к одногорбым верблюдам почти 30 лет назад из резервуара, находящегося среди летучих мышей. HCoV-229E и HCoV-NL63 обычно вызывают легко протекающие инфекции у иммунокомпе- тентныхлюдей. Предки этих вирусов обнаружены среди африканских летучих мышей. Верблюды играли роль промежуточных хозяев для HCoV-229E. Вирусы HCoV-OC43 и HKU1 поддерживаются среди грызунов, для людей опасности они не представляют. В 2017г. от свиней был получен вирус, вызывающий синдром острой диареи у свиней (SADS). Его природным резервуаром считается подковообразная летучая мышь Rhinolophus bat. Пока доказательств его опасности для людей не получено. По Jie Cui с соавт. [6]
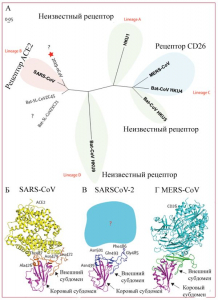
Рисунок 4 - Результаты филогенетического анализа (А) и молекулярного моделирования рецептор-связывающих доменов SARS-CoV (Б), SARS-CoV-2 (В) и MERS-CoV (Г). Звездочкой показан SARS-CoV-2. Внешний субдомен рецептор-связывающего домена SARS-CoV-2 более сходен с аналогичным SARS-CoV, что означает использование этим вирусом ACE2 как клеточного рецептора. Однако происхождение SARS-CoV-2 не выяснено, геномный анализ показывает, что, вероятно, он произошел от вируса летучих мышей. Потенциально усиливающий хозяин среди млекопитающих, промежуточный между летучими мышами и человеком, не известен. Поскольку мутации в исходном штамме могли напрямую вызвать вирулентность по отношению к людям, нет уверенности в том, что этот посредник существует [9]
В распространении таких коронавирусов доминирующую роль играют летучие мыши. Это многочисленная группа млекопитающих порядка Chiroptera, второй по величине отряд млекопитающих, на который приходится около пятой части всех видов млекопитающих[7].
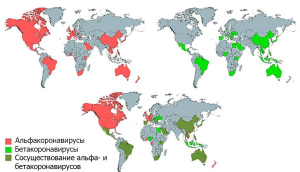
Рисунок 5 - Географическое распределение опасных для людей коронавирусов летучих мышей. Бетакоронавирусы территориально менее распространены, чем альфакоронавирусы. По А. Wong с соавт. [8]
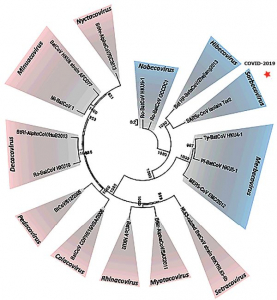
Рисунок 6 - Наиболее вероятная филогения альфа- и бетакоронавирусов летучих мышей. Составлена на основе анализа геномов 17 видов коронавирусов. Рода выделены различными цветами: розовый - Alphacoronavirus (подроды: Setracovirus, Myotacovirus, Rhinacovirus, Colacovirus, Pedacovirus, Decacovirus, Minunacovirus, Nyctacovirus); синий - Betacoronavirus (подроды: Nobecovirus, Hibecovirus, Sarbecovirus, Merbecovirus). ICTV Taxonomy History: Cornidovirineae (URL: https://talk.ictvonline.org/taxonomy/p/taxonomy-history?taxnode_id=20186105). SARS-CoV-2 занимает нишу среди бетакоронавирусов в подроде Sarbecovirus, т.е. относится к SARS-подобным вирусам летучих мышей [9,10]
Летучие мыши - единственная группа млекопитающих, способная к длительным перелетам, что позволяет им быть источником инфекции для других видов млекопитающих на огромных территориях. После установления в 2002 г. роли летучих мышей в распространении SARS-CoV, в различных регионах мира у них было обнаружено более 30 опасных для людей и животных вирусов, принадлежащих к родам альфа- и бетакоронавирусов (рисунок 5).
Разнообразие видов и высокая плотность поселений летучих мышей на юге Китая предопределяют разнообразие клеток и клеточных рецепторов, необходимых для размножения и рекомбинации вирусов, а также отбора их новых вариантов. Уникальные механизмы репликации вирусной РНК, сопровождающиеся высокой частотой вирусной рекомбинации, привели к большому генетическому разнообразию среди вирусов обоих родов, что, в свою очередь, потребовало их дальнейшего классифицирования на подроды (subgenus) (рисунок 6).
Опасные для людей инфекции у самих летучих мышей не приобретают острый характер. Причины такой устойчивости не ясны. P. Zhou с соавт. [19] считают, что летучие мыши вырабатывают а-интерферон в количествах, предотвращающих развитие у них вирусной инфекции. Поэтому летучие мыши - удобная экологическая ниша для поддержания в природе не только коронавирусов, но и вирусов других таксонов, например, филовирусов (лихорадки Марбург и Эбола) [11-15], лиссавирусов (бешенство) и др. [16]. Также они могут выполнять резервуарную роль в отношении нескольких вирусов одного семейства или нескольких видов из разных семейств. У летучих мышей рода Rhinolophus (подковоносы) обнаружены одновременно коронавирусы HKU2- CoVs (SADS-CoV) и SARSr-CoVs, вызывающие вспышки опасных болезней у свиней и у людей соответственно [17]. Установлено совместное сосуществование в резервуарах, образуемых летучими мышами рода Rousettus (летучие собаки или ночные крыланы), коронавируса HKU9- CoVs, а также обнаруженного в 2019 г. обладающего широким видовым тропизмом филовируса летучих мышей Mengla virus (MLAV), филогенетически связанного с вирусами - возбудителями лихорадок Эбола и Марбург [18]. Такое соседство в одной экологической нише предрасполагает к внутри- и межвидовому генетическому обмену среди вирусов и формированию опасных для людей реассортантов [8]. Коронавирусы можно выделить из носоглотки и фекалий летучих мышей. Заражение коронавирусами хищников (совы, ласки, ястребы, енотовидные собаки, циветты[8] и др.) происходит в результате поедания инфицированных летучих мышей [5] (рисунок 7).

Рисунок 7 - Источники коронавируса, вызвавшего вспышку SARS в 2002-2003 гг. А. Большой подковонос (лат. Rhinolophus ferrumequinum). Распространен в Северной Африке, Малой и Передней Азии, Китае, на Корейском полуострове и Японии. На территории России обитает на Северном Кавказе - от Краснодарского края до Дагестана (URL: https://Lbp.blogspot.com/-a0OT15OUfkw/WB0AccbCZcI/AAAAAAAAAjM/Bxs- WhcHJbw-NFtBVgQ4JeYYtml6M-mDACLcB/s1600/Rhinolophus%2Bferrumequinum.jpg; дата обращения: 01.02.2020).
Б. Азиатская циветта (лат. Viverra zibetha). Ареал охватывает Лаос, Малайский полуостров, Таиланд, Вьетнам, Камбоджу, южный Китай, северо-восточную Индию, Мьянму, Непал, Бутан, Сингапур (URL: https://zen.yandex.ru/media/jivotnyemira/civetta-zverek-poedaiuscii-daje-strihnin- 5d82455079c26e00adf29583; дата обращения: 01.02.2020)
Скрининг более 5 тыс. насекомоядных летучих мышей из Ганы, Украины, Румынии, Германии и Нидерландов показал, что MERSCoV-подобные вирусы встречаются у 24,9 % летучих мышей видов Nycteris bats (Щелеморды), обитающих в Африке, на Ближнем Востоке, в Юго-Восточной Азии; и у 14,7 % вида Pipistrelle bats (Нетопыри-карлики), обитающего на Европейском континенте [21]. Наиболее опасные бетакоронавирусы SARS-CoV и MERS-CoV попали в человеческие популяции от подковоносых летучих мышей (рисунок 8).

Рисунок 8 - Географическое распределение подковоносых летучих мышей - носителей SARS-подобных коронавирусов. Окрашенный квадрат соответствует географическому распределению вида летучих мышей. Красный - Rhinolophus affinis; оранжевый - Rhinolophus blasii; желтый - Rhinolophus euryale; зеленый - ferrumequinum; бирюзовый - Rhinolophus hildebrantii; индиго (сине-фиолетовый) - Rhinolophus hipposideros; пурпурный - Rhinolophus macrotis; коричневый - Rhinolophus mehelyi; розовый - Rhinolophus pearsonii; золотистый - Rhinolophus pusillus; серо-голубой - Rhinolophus rex; черный - Rhinolophus sinicus; светло-зеленый - Rhinolophus thomasi. Оранжевым кругом показана провинция Юхань. Красный круг обозначает регион вспышек SARS и SADS [7]
Приведенные выше данные показывают, что коронавирусные инфекции среди людей не появляются внезапно и из ниоткуда. Обычно их вспышкам предшествует период распространения HCoV среди летучих мышей и животных других промежуточных резервуаров, пропущенных эпидемиологами из-за отсутствия необходимых знаний и эпидемической настороженности. За пять лет до вспышки ближневосточного респираторного синдрома в 2012 г. в Гонконге от летучих мышей были выделены бетакоронавирусы Ty-BatCoV HKU4-1 (летучая мышь Tylonycteris pachypus) и Pi-BatCoV HKU5-1 (летучая мышь Pipistrellus abramus), имеющиетесную генетическую связь с MERS-CoV. Однако вспышка атипичной пневмонии, погубившая сотни людей на Ближнем Востоке, была воспринята, как неожиданная [20]. За год до появления SARS-CoV-2, в расположенной поблизости провинции Чжоушань (восточный Китай) были обнаружены почти идентичные ему (88 % идентичность) SARS-подобные вирусы летучих мышей bat-SL-CoVZC45 и bat-SL-CoVZXC21 [9].
Поиски более близкого вируса-предшественника SARS-CoV-2 ведутся в южных регионах Китая у животных, выращенных в больших количествах или пойманных в дикой природе для употребления в пищу человеком. По последним данным, опубликованным в марте Ch. Chahg с соавт.[9], таким хозяином может быть панголин Manis javanica (индокитайский ящер). Эти животные часто становятся жертвами китайских браконьеров из-за их чешуи, якобы имеющей медицинскую ценность. Используя метагеномные образцы Ch. Chahg с соавт. реконструировали геном коронавируса пангалионов - Manis-CoV и сопоставили его с SARS-CoV-2. Ими установлено, что вирусы на 91,2 % идентичны. Кроме того, рецепторсвязывающий домен белка S1 Manis-CoV имел только пять аминокислотных отличий от SARS-CoV-2. Такой же белок вируса летучей мыши RaTG13 имел 19 отличий от SARS-CoV-2. Это сходство, по их мнению, достаточно высоко, чтобы подтвердить эволюционную связь между Manis-CoV и SARS-CoV-2, но недостаточно для того, чтобы считать их одним и тем же вирусом. В качестве примера они привели сходство геномов SARS-CoV и MERS-CoV и тех вирусов, которые были обнаружены у промежуточных хозяев, 99,8 % и 99,9 % соответственно. Следовательно, дальнейший поиск других потенциальных промежуточных хозяев должен быть продолжен. И совсем необязательно, что у SARS-CoV-2 будет один промежуточный хозяин, так как известно, что другие опасные для человека коронави- русы имеют несколько промежуточных хозяев. Например, SARS-CoV, для которых пальмовая цивета (Paguma larvata) является наиболее известным промежуточным хозяином, использует енотовидную собаку (Nyctereutes procyonoides) и барсука-хорька (Melogale oschata) в качестве промежуточных хозяев.
Автор данной работы не исключает, что первичным резервуаром коронавирусов являются почвенные простейшие и гидробионты. При целенаправленном изучении природных резервуаров исследователи обнаруживают не только известные среди животных, но и неклассифицированные виды коронавирусов. X-Y. Ge с соавт. [22] в 2012-2013 гг. исследовали коронавирусы у летучих мышей, обитающих в заброшенной шахте в округе Мудзян китайской провинции Юньнань. Все шесть видов летучих мышей (Rhinolophus sinicus, Rhinolophus affinis, Hipposideros pomona, Miniopterus schreibersii, Miniopterus fuliginosus и Miniopterus fuscus), обнаруженные в шахте, были инфицированы охарактеризованными видами альфакоронавирусов и двумя ранее неизвестными видами бетакоронавирусов, оказавшихся SARS-подобными.
При обследовании методами молекулярной диагностики пациентов с воспалительными заболеваниями дыхательных путей можно обнаружить скрыто протекающие вспышки коронавирусных инфекций. Y. Zhu. с соавт. [23] в период с ноября 2014 г. по ноябрь 2016 г. обследовали в 13 больницах материкового Китая 2721 ребенка с признаками респираторной инфекции верхних дыхательных путей и пневмониями. У 42 из них (1,5 %) из носоглоточной области они выделили новый рекомбинант известного с 1960-х гг. бетакоронавируса HCoV-OC43.
На фоне провала мониторинга HCoV в Китае, произошедшего при серьезной эпидемической настороженности, удручающе выглядит изученность природных резервуаров корона- вирусов на территории Российской Федерации. Летучие мыши, обитающие непосредственно у российско-китайской границы, а также их вирусы, изучены плохо [12]. На картах, приведенных на рисунках 5 и 8, Россия выглядит как «территория без летучих мышей». Не менее актуальным источником опасных для населения России коронавирусов являются ежи, обитающие на всей территории страны. Бета-коронавирусы из рода Merbecovirus, к которому принадлежит MERS-CoV, обнаружены в фекалиях европейских ежей Erinaceus europaeus в Германии [24], Франции [25], на Британских островах [25], т.е. везде, где искали. Для изучения возможного происхождения MERS-CoV в резервуарах, поддерживающихся среди млекопитающих в Китае, а также для понимания разнообразия хозяев и эволюционного пути видов, относящихся к мербековирусам, S.K. Lau с соавт. [27] были взяты образцы от различных млекопитающих, обитающих на территории Китая. От двух амурских ежей (Erinaceus amurensis), эндемичных для российского Дальнего Востока и северного Китая, им удалось выделить ранее неизвестный бетакоронавирус - Ea-HedCoV HKU31 (рисунок 9).
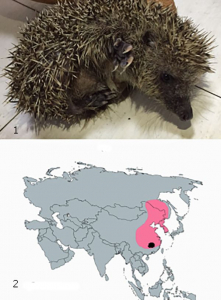 Рисунок 9 - Амурский еж. 1. Erinaceus amurensis, также известный как амурский еж или маньчжурский еж. 2. Географическое распространение Erinaceus amurensis в Азии. Цветная область представляет среду обитания Erinaceus amurensis. Обозначенная область соответствует местности, где был обнаружен Ea-HedCoV HKU31 [27]
Рисунок 9 - Амурский еж. 1. Erinaceus amurensis, также известный как амурский еж или маньчжурский еж. 2. Географическое распространение Erinaceus amurensis в Азии. Цветная область представляет среду обитания Erinaceus amurensis. Обозначенная область соответствует местности, где был обнаружен Ea-HedCoV HKU31 [27]
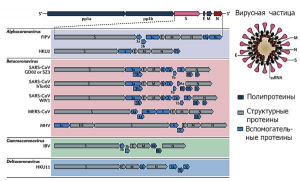
Рисунок 10 - Геномы коронавирусов типовых видов различных родов. Типовая структура генома CoV выстроена в направлении 5-ORF1a-ORF1b-S-E-M-N-3'. Перекрывающиеся открытые рамки считывания ORF1a и ORF1b занимают две трети генома CoV со стороны 5 -конца и кодируют 16 высококонсервативных неструктурных белков (Nsp), необходимых для репликации вирусной РНК в клетке хозяина. Треть генома, расположенная в направлении 3 -конца РНК, кодирует наборы общих для всех CoV структурных белков (шипы, S; оболочка, E; мембрана, M; нуклеокапсид, N) и вспомогательные белки, индивидуальные у разных CoV. По Jie Cui с соавт. [6]
Анализ генома Ea-HedCoV HKU31 показал принадлежность вируса к новому виду из рода Merbecovirus. Наиболее тесно он связан с коронавирусом европейского ежа EriCoV (с 79,6 % идентичностью последовательности генома), выделенного от ежей в Германии; и менее - с MERS-CoV (68,4 % идентичностью последовательности генома), выделенного от одногорбых верблюдов. Также показана его вовлеченность в естественную рекомбинацию с коронавирусами летучих мышей. S.K. Lau с соавт. [27] считают, что ежи в разных географических районах являются естественным резервуаром мербековирусов. И хотя не получено экспериментальных доказательств использования спайк-белком Ea-BatCoV HKU31 в качестве рецептора hDPP4, благодаря чему MERS-CoV вызывает тяжелый инфекционный процесс у людей, способность коронавирусов ежей преодолевать межвидовой барьер еще предстоит выяснить, поскольку рецептор, используемый этими вирусами для проникновения в клетки, остается неизвестным.
Геном коронавируса. Представляет собой несегментированную одноцепочечную плюс- цепь РНК[10], варьирующую от 27 до 32 т.п.н.[11] Это самый большой вирусный РНК-геном из известных на сегодняшний день. Коронави- русы имеют единый геном, кодирующий структурные, неструктурные и вспомогательные белки. Вспомогательные белки варьируют между коронавирусами даже в пределах одной клады. Геном и субгеномы типичного CoV содержат, по меньшей мере, 6 открытых рамок считывания[12]. Участок, прилегающий к 5'-концу генома вируса, кодирует 16 неструктурных протеинов (non-structural proteins, Nsp).
Таблица 2 - Функции неструктурных протеинов коронавирусов*
|
Неструктурный протеин |
Функция |
Неструктурный протеин |
Функция |
|
Nspl (гаммакоронавирусы ген nsp1 не содержат) |
Деградация клеточной мРНК, блокирование интерферонового сигнала |
Nsp9 |
Димеризация и связывание РНК |
|
Nsp2 |
Не имеет известных или прогнозируемых функций |
Nsp10 |
Каркасный белок (scaffold protein) для Nsp14 и Nsp16 |
|
Nsp3 |
PLP (протеаза), расщепление полипептидов, блокирование врожденного иммунного ответа хозяина, стимулирование экспрессии цитокинов |
Nsp11 |
Неизвестна |
|
Nsp4 |
Формирование двойной мембранной везикулы (DMV, double-membrane vesicles) |
Nsp12 |
Праймер-зависимая RdRp (РНК- зависимая РНК полимераза; RNA- dependent RNA polymerase) |
|
Nsp5 |
3CLpro, Mpro, расщепление полипептидов, ингибирование интерферона |
Nsp13 |
РНК-геликаза, |
|
Nsp6 |
Антагонист интерферона. Ограничение аутофагосомной экспансии, т.е. доставки вируса внутрь лизосом клетки и его последующей деградации, образование DMV |
Nsp14 |
Экзорибонуклеаза, N7-MTase (гуанин^7 метилтрансфераза - созревание и трансляция мРНК) |
|
Nsp7 |
Кофактор для Nsp8 и Nsp12 |
Nsp15 |
Эндорибонуклеаза, Уклонение от сенсоров двухцепочечной РНК (дцРНК), в результате клетка не воспринимает РНК-вирус как чужой, тем самым предотвращается ранняя индукция интерферона |
|
Nsp8 |
Кофактор для Nsp7 и Nsp12, праймаза (РНК-полимераза, которая создает праймер, необходимый для синтеза РНК) |
Nsp16 |
2'-О-МТаза (2'-O-methyltransferase); вирусная РНК избегает распознавания рецепторами типа MDA5 (англ. Melanoma Differentiation-Associated protein 5); снижает чувствительность вируса к интерферону |
* По работе Yu. Chen с соавт. [7].
Эти полипептиды процессируются[13] вирусной химотрипсинподобной протеазой (chymotrypsin-like protease, 3CLpro) или основной протеазой (main protease, Mpro), и одной или двумя папаин-подобными протеазами (papain-like protease, PLP). Участок генома, прилегающий к 3'-концу, кодирует структурные протеины, включающие оболочечные гликопротеиновые спайки, т.е. шипы (envelope glycoproteins spike, S), оболочку (E), мембрану (M) и нуклеокапсид (N). В дополнение к генам, кодирующим структурные протеины, в геноме вируса содержатся видоспецифичные гены-помощники (accessory genes), такие как белок HE (hemagglutinin esterase protein; найдена только у бетакоронавирусов подрода Embecovirus), белок 3a/b и белок 4a/b. Репликаза[14] коронавируса кодируется двумя большими перекрывающимися ORF (ORF1a и ORF1b), занимающими около двух третей генома, и напрямую транслируется из геномной РНК. Структурные и вспомогательные гены транслируются из субгеномных РНК (sgRNAs), генерируемых во время транскрипции/репликации генома (рисунок 10).
В таблице 2 приведены данные по известной функции 16 неструктурных протеинов, кодируемых участком генома, прилегающим к 5'-концу генома вируса.
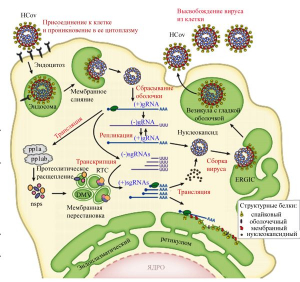
Рисунок 11 - Цикл репликации коронавирусов человека. Инфекционный процесс начинается с прикрепления HCoV к родственному рецептору на поверхности клетки-мишени, после чего запускается механизм рецепторного эндоцитоза и вирус поглощается эндосомой, затем происходит «разборка» вируса (левая верхняя часть рисунка). Оболочка вируса «сбрасывается» и геномная РНК (gRNA) высвобождается в цитоплазму клетки, где служит матрицей для трансляции РНКрепликазой полипротеинов pp1a и pp1ab, которые расщепляются с образованием неструктурных белков (Nsps), индуцирующих образование в клетке двухмембранных везикул (double-membrane vesicles, DMVs), где формируются транскрипционные комплексы вирусной репликации (replication transcription complexes, RTCs). Полноразмерная геномная РНК[(+)gRNA] реплицируется через промежуточные отрицательно-смысловые РНК[(-)gRNA (negative-sense intermediate)], служащие матрицей для синтеза новой субгеномной РНК (sgRNAs) с положительной цепью (центр рисунка). Эти sgRNAs кодируют вирусные структурные и вспомогательные белки. Сборка вирусных частиц происходит в промежуточном компартменте эндоплазматического ретикулюма (ER-Golgi, ERGIC), скрывающего их в своем пространстве от внутриклеточных механизмов, распознающих и уничтожающих чужеродную РНК. Зрелые вирионы высвобождаются из клетки по секреторному пути (правая верхняя часть рисунка) [5]
Цикл репликации коронавируса происходит в несколько этапов: прикрепление и проникновение в клетку, трансляция вирусной РНК-репликазы, транскрипция и репликация генома, трансляция структурных белков, сборка и высвобождение вириона (рисунок 11).
Репликация коронавируса в клетке хозяина начинается со связывания его спайк-белка S с рецептором(ами) поверхности клетки. Белок S состоит из двух функциональных субъединиц: подверженной мутационным изменениям S1 (bulb; луковица) для связывания с рецептором (receptor-binding subunit) и высококонсервативной S2 (stalk; ножка) для слияния вируса с мембраной (fusion subunit). Специфическое взаимодействие между S1 и родственным рецептором вызывает конформационное изменение в субъединице S2, приводящее к слиянию между вирусной оболочкой и клеточной мембраной и высвобождению нуклеокапсида в цитоплазму. Связывание с рецептором определяет для коронавируса возможный диапазон хозяина и тканевой тропизм. Расщепление S1/S2 S-белка коронавируса осуществляется одной или несколькими эндопротеазамиклетки-мишени.
После сбрасывания оболочки геномная РНК коронавируса служит транскриптом для трансляции ORF1a. Клеткой синтезируется полипротеин pp1a и благодаря сдвигу рамки считывания трансляция продолжается на ORF1b с образованием более длинного полипротеина pp1ab. При аутопротеолитическом расщеплении pp1a и pp1ab образуется 15-16 неструктурных белков (Nsps) с различными функциями. Все вместе они образуют гигантский репликазный комплекс, участвующий в репликации РНК-генома, процессинга субгеномной РНК и упаковки «зародышевых вирионов» (см. таблицу 2).
Активность РНК-зависимой РНК-поли- меразы кодируется в nsp12, тогда как активность папаин-подобной протеазы (PLPro) и основной протеазы (Mpro) кодируется в nsp3 и nsp5 соответственно. Белки Nsp3, 4 и 6 также индуцируют перестройку клеточной мембраны с образованием двухмембранных везикул (double-membrane vesicles, DMV) или сферул (spherules), где собирается транскрипционный комплекс репликации коронавируса (replication transcription complexes, RTCs) [5, 28].
Используя геномную РНК в качестве матрицы, РНК-репликаза синтезирует полноразмерный отрицательносмысловой антигеном (negativesense antigenome) коронавируса, который, в свою очередь, служит матрицей для синтеза новой геномной РНК. РНК-репликаза может переключать матрицу во время прерывистой транскрипции генома в специфических сайтах, называемых регулируемыми транскрипцией последовательностями. Большинство sgRNAs коронавируса являются функционально моноцистронными. Трансмембранные структурные белки (S, HE, M и E) и некоторые связанные с мембраной вспомогательные белки транслируются в эндоплазматическом ретикулюме (ER). Большинство структурных белков коронавируса подвергается посттранс- ляционным модификациям, определяющим их функции в жизненном цикле вируса [5].
Сборка частиц происходит в промежуточном компартменте ER-Golgi (ERGlC)[15] и управляется белком М. Гомотипическое взаимодействие белка М обеспечивает основу для морфогенеза вирионов, тогда как взаимодействия M-S и M-N облегчают рекрутирование структурных компонентов в место сборки. Белок Е способствует сборке частиц, взаимодействуя с белком М и вызывая изгиб мембраны. Наконец, частицы коронавируса, поступающие в ERGIC, транспортируются в везикулах с гладкой стенкой (smooth-walled vesicles) и переправляются по секреторному пути для высвобождения путем экзоцитоза [5].
Пластичность генома коронавирусов. Обеспечивается спонтанными мутациями, гомологичной рекомбинацией с другими геномами коронавирусов и искусственным путем. Скорость возникновения мутаций в геноме CoVs варьирует в тех же пределах, как и у других одноцепочечных РНК-вирусов ~10-4 замен в год/сайт (substitutions per year per site)[16] [29]. Наиболее гипервариабельным является ген белка S, отвечающего за межвидовую передачу, вирулентность и контагиозность HCoV. У разных видов CoVs скорость его мутирования различается. Для патогена птиц IBV гипервариабельность гена белка S оценивается в пределах - 0,3-0,6х10-2 замен в год/сайт [30]. Для гена белка S коронавируса 229E, вызывающего легко протекающие инфекции респираторного тракта у людей, 3х10-4 замен в год/сайт [29]. Такие мутации носят случайный характер и обеспечивают преимущество вирусу в экосистемах, если они будут «подхвачены» естественным отбором, что может произойти только при опять же случайном проникновении мутировавшего вируса в нового хозяина.
Наибольшую пластичность геному CoV, лежащую в основе проявления внутривидовой изменчивости, межвидового «прыжка хозяина» («host jump») и образования новых видов CoVs, создает возможность гомологичной рекомбинации[17] с геномами других коронавирусов, циркулирующих в одних и тех же хозяевах. В основе такой рекомбинации лежит сложный жизненный цикл коронавирусов, осуществляющийся через образование набора субгеномных РНК (см. рисунок 11) и возможность переключения матриц разных коронавирусов. По этой причине геном циркулирующих в природных резервуарах коронавирусов всегда является мозаичным, а сами коронавирусы поддерживаются в виде квазивидовых пулов.
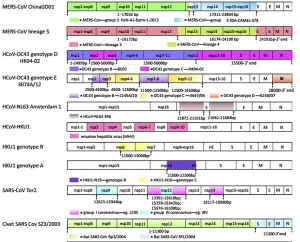
Рисунок 12 - Мозаичная структура генома коронавирусов, вызывающих заболевания у людей. Окрашенные области каждого коронавируса указывают на генетическую рекомбинацию в рекомбинационных сайтах с коронавирусами зоонозного происхождения. Определенные положения нуклеотидов, где произошла рекомбинация, показаны пунктирными линиями.
Например, вирус NL63 является рекомбинантом. Рекомбинационные сайты находятся в двух участка гена белка S и заняты вставками из коронавируса Amsterdam 496. Рекомбинационные события характерны для различных генотипов вируса HKU1. Рекомбинационные сайты обнаружены у вирусов генотипов B и C в генах nsp6-nsp7 и nsp16-HE соответственно. Также было показано, что HKU1 способен рекомбинировать в генах nsp3, nsp4, nsp6, nsp7, nps9 и nsp10 с бетакоронавирусами животных, такими как MHV. SARS-CoV имеет рекомбинантную историю с линиями альфа- и гамма-CoV. В РНК-зависимой РНК-полимеразе (RDRP, ген nsp12) были идентифицированы рекомбинационные сайты и большое количество рекомбинантных областей в следующих участках: нуклеотиды 13392-13610,15259-15342 и 15974-16108 на основе последовательностей штамма SARS-CoV TOR2. Участки рекомбинации были также определены в генах nsp9, nsp10 (в 12613-13344), nsp14 (18117-18980). Другое исследование, анализирующее геном штамма SARS-CoV CV7, показало семь предполагаемых мест рекомбинации между SARS-CoV и шестью другими коронавирусами: PEDV, TGEV, BCV, 229E, MHV и IBV. Это наблюдение говорит о том, что SARS-CoV возник через последовательную горизонтальную передачу и генетическую рекомбинацию, усиливая процесс адаптации к своему новому хозяину [31, приведен фрагмент схемы]
Точный механизм генетической рекомбинации у CoVs остается неясным: рекомбинационные сайты («breakpoints» - точечный разрыв при рекомбинации) кажутся расположенными по геному случайным образом, так как у корона- вирусов они различны [31] (рисунок 12).Варианты коронавирусов, образующихся в результате случайно происходящих процессов гомологичной рекомбинации и возникновения спонтанных мутаций, не нацелены на межвидовой «прыжок» и закрепляются в новой экологической нише как случайное событие (рисунок 13).
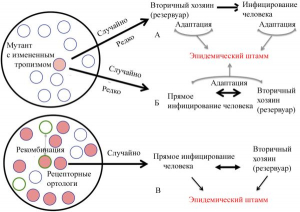
Рисунок 13 - Проникновение в человеческие популяции коронавирусов в результате случайных процессов и событий. Коронавирусы в популяциях летучих мышей циркулируют в виде квазивидовых пулов. (А и Б) Их мутанты, способные проникнуть в популяции других видов (красный круг), представлены редкими вариантами, случайно образовавшимися в результате спонтанных мутаций. Облегчает проникновение в популяции людей заражение вирусом какого-то промежуточного вида (формируется вторичный резервуар), обитающего в непосредственном контакте с людьми, имеющего сходные с человеческими рецепторы-мишени и последующая адаптация в этом хозяине.
Либо передача вируса происходит между летучими мышами и людьми без предварительной адаптации к промежуточному хозяину. Вспышка болезни среди людей происходит в обоих случаях после формирования эпидемического штамма, т.е. после адаптации вируса к новому хозяину.
(В) Предполагается, что образование химерных SARS-подобных вирусов происходит тогда, когда в квазивидовых пулах, циркулирующих в сообществах летучих мышей, содержатся вирусы, способные заражать клетки человека (красные кружки), но для своего поддержания в природе не нуждающиеся в человеке. Возникновение эпидемии, вызванной «новыми вирусами», происходит в результате случайной адаптации во вторичных резервуарах или человеческих популяциях их рекомбинантов с вирулентными для летучих мышей вирусами (кружки с зелеными контурами), приобретшими, благодаря мутации в гене, кодирующем субъединицу белка шипа S1, способность узнавать рецепторы-мишени (их ортологи) у человека [32]
Ускорить внутривидовую изменчивость и при этом достигнуть межвидового «прыжка хозяина» не случайным образом, а в выбранный экспериментатором вид, возможно путем вмешательства в геном коронавируса, используя методологию обратной генетики[18] [32].
В совместной американо-китайской работе[19], имеющей, по утверждению авторов, цель «предсказать и подготовиться к будущим возникающим вирусам», были внесены точечные изменения в ген субъединицы S1, циркулирующего среди летучих мышей коронавируса SHC014 – ближайшего «родственника» SARS-CoV.
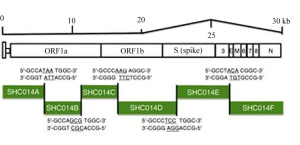
Рисунок 14 - Полная длина химерного вируса SHC014-CoV, способного к репликации в дыхательных путях человека и животных, имеющих рецептор ACE2 или его ортологи. Геномные последовательности и аминокислотные последовательности доменов S1 субъединицы шипа, репрезентативных CoV, были загружены из Genbank или Pathosystems Resource Integration Center (PATRIC). Синтезирован американскими (Северная Каролина) и китайскими (г. Ухань) исследователями путем последовательной сборки шести смежных кДНК, фланкированных уникальными сайтами BglI, обеспечивающих полноразмерную экспрессию кДНКSHC014-CoV[32]
Этот вирус не проявил себя в качестве патогена для людей из-за различия в 14 аминокислотных остатках в участке шипа, связывающегося с ACE2 рецептором человека. Из них пять являются критическими для изменения диапазона хозяев: Y442, L472, N479, T487 и Y491 [33]. Исследователи заменили нуклеотидную последовательность гена, кодирующего субъединицу S1 у SHC014, на аналогичную SARS-CoV. Остальные гены, т.е. те, которые определяют формирование транскрипционного комплекса вирусной репликации и сборку его частиц в клетке, изменениям не подвергались[20]. Новый химерный SARS-подобный коронавирус получил обозначение SHC014-MA15. Подобно SARS для инфицирования клеток легочного эпителия человека, циветты и летучей мыши, он может использовать ACE2 в качестве рецептора-мишени и его ортологи[21], и реплицироваться в них до высоких титров, сравнимых с таковыми у природного штамма SARS-CoV Urbani, оставаясь по остальным генам прежним SHC014. Эксперименты в условиях in vivo продемонстрировали репликацию химерного вируса в легких модельных мышей с выраженным патологическим процессом (рисунок 14).
Но на общности способности субъединиц S1 узнавать ACE2-рецептор человека сходство обоих вирусов закончилось[22], проявился собственный патогенный потенциал вируса SHC014, о котором до этих экспериментов не подозревали. Исследователи попытались в условиях in vitro определить нейтрализующую эффективность в отношении SHC014-MA15 моноклональных антител (мАТ) широкого защитного спектра (109.8, SHC014-MA15, 230.15 и 227.14)[23], показавших хороший нейтрализующий эффект против SARS-CoV. Влияние этих антител на репликацию SHC014-MA15 оказалось незначительным, тогда как репликация SARS-CoV Urbani ими подавлялась при относительно низких концентрациях. Только использование высокой концентрации (10 мкг/мл) мАТ 109.8 позволило в условиях in vitro достичь 50 % нейтрализации SHC014-MA15 [32].
Чтобы оценить эффективность существующих вакцин в отношении HC014-MA15, исследователи вакцинировали мышей (Balb/cAnNHsD) кандидатной двойной инактивированной цельной SARS-CoV (DIV)-вакциной. Предыдущая работа показала, что вакцина DIV может защитить мышей от заражения гомологичным вирусом [35]. Однако вакцинация от SARS-CoV не только не защищала животных от заражения HC014-MA15, но и утяжеляла течение вызванного им инфекционного процесса[24]. Сыворотка крови, полученная от мышей, вакцинированных DIV, не смогла нейтрализовать SHC014-MA15 в условиях in vitro [32].
Таблица 3 - Коронавирусы, опасные для людей; их клеточные рецепторы; способность инфицировать другие клетки*
|
Вирус |
Рецептор |
Год обнаружения/ дивергенции |
Инфицируемые клетки |
Инфекционный процесс |
|
OC43 |
9-О-ацетилированная сиаловая кислота |
Дивергировал от BCoV в 1890 г. |
Клетки реснитчатого эпителия дыхательного пути, макрофаги в культуре, нейроны |
Инфекция верхних дыхательных путей, инфекция желудочно-кишечного тракта, пневмония |
|
229E |
Аминопептидаза N |
Расхождение с NL63 в XI в. |
Не реснитчатый эпителий дыхательных путей, моноциты человека, нейроны |
То же |
|
NL63 |
ACE2 |
Расхождение между 1200 и 1500 гг. Открыт в 2004 г. |
Клетки реснитчатого эпителия дыхательного пути |
Инфекция верхних и нижних дыхательных путей, связанная с крупом у детей |
|
HKU1 |
9-О-ацетилированная сиаловая кислота |
Открыт в 2005 г. |
То же |
Инфекция верхних дыхательных путей и пневмония, кишечные симптомы |
|
SARS |
ACE2 |
Появился в 2002 г. |
Эпителиальные клетки, реснитчатые клетки, пневмоциты второго типа |
Инфекции нижних дыхательных путей, пневмония, диффузное повреждение альвеол (diffuse alveolar damage, DAD) и респираторный дистресс- синдром (respiratory distress syndrome, ARDS) ) |
|
MERS |
DPP4 |
Появился в 2012 г. |
Эпителиальные клетки дыхательных путей, эпителиальные клетки почек, дендритные |
|
|
SARS-CoV-2** |
ACE2 |
Появился в конце 2019 г. |
Клетки легочного эпителия, клетки Vero E6 и Caco-I I |
Инфекция нижних дыхательных путей, пневмония |
* L.E. Gralinski, R.S. Baric [32]; ** R. Lu, X. Zhao, J. Li с соавт. [9].
Попытка изготовить ослабленную живую вакцину на основе HC014-MA15 также оказалась неудачной. Ее использование давало незначительную перекрестную защиту от заражения SARS-CoV, что подтверждало наличие общих консервативных эпитопов, но возникли проблемы с безопасностью вакцинации. В тех дозах, которые обеспечивали некоторый защитный эффект от заражения SARS-CoV, вакцина сама вызывала патологический процесс у экспериментальных животных [32]. В целом эксперименты по получению из не представляющего опасности для людей коронавируса его генетически измененного варианта дали много эпидемиологической науке. Они позволили понять существующий в природе механизм межвидового «прыжка» коронавирусов от летучих мышей к людям. Пришлось избавиться и от иллюзии, что распространение в человеческих популяциях новых видов коронавирусов, образующихся в результате рекомбинаций, может быть сдержано вакцинами, созданными в отношении уже циркулирующих в природе[25].
Молекулярная патология коронавирусов.
Инфекционный процесс у человека начинается с прикрепления HCoV к родственному клеточному рецептору на поверхности клетки-мишени.
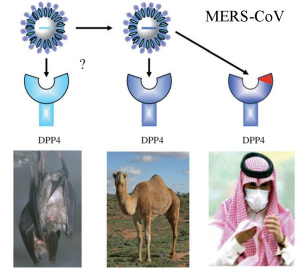
Рисунок 15 - Цепочка зоонозной передачи MERS- CoV от источника среди летучих мышей к людям. Облегчается наличием у летучих мышей, верблюдов и людей сходного рецептора (DPP4), используемого вирусом для проникновения в клетки [11]
Некоторые HCoV используют мембранные протеолитические ферменты клеточной поверхности в качестве рецепторов, такие как дипептидил- пептидаза 4 (DPP4) для MERS-CoV; аминопептидаза N (APN) для HCoV-229E; ангиотензинпревращающий фермент 2 (ACE2) для HCoV-NL63, SARS-CoV, NL 63, SHC014-MA15 и SARS-CoV-2. HCoV-OC43 и HCoV-HKU1 в качестве рецептора используют 9-О-ацетилированную сиаловую кислоту (таблица 3).
Для формирования цепочки зоонозной передачи HCoV от источника среди летучих мышей к людям необходимо, чтобы рецепторы-мишени у них и у промежуточных хозяев были общими. Клиника болезни зависит от локализации этих рецепторов. Проведенный W. Widagdo с соавт. [10] анализ последовательностей DPP4 летучих мышей и исследования инфекции in vitro с линиями клеток летучих мышей позволил предположить, что несколько видов летучих мышей чувствительны к MERS- и MERS-like-CoVs благодаря DPP4, имеющемуся и у людей (рисунок 15).
Этот рецептор по-разному распределяется в дыхательных путях человека и других восприимчивых домашних животных, включая одногорбых верблюдов. Экспрессия гена[26] DPP4 в носовом эпителии верблюда, ламы и свиньи позволяет развиться инфекции верхних дыхательных путей у животных при интраназальной инокуляции MERS-CoVs, делая их источником инфекции для людей.
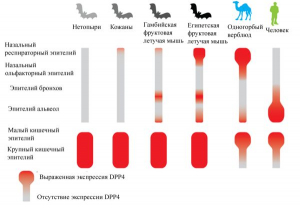
Рисунок 16 - Различное распределение экспрессии DPP4 в слизистой оболочке дыхательных путей и кишечном эпителии летучих мышей, одногорбого верблюда и человека. У нетопырей и кожанов DPP4 ограниченно обнаруживается в дыхательных путях и в основном экспрессируется в кишечном эпителии. У гамбийских и египетских фруктовых летучих мышей DPP4 обнаружен как в дыхательных путях, так и в кишечном эпителии. У одногорбого верблюда экспрессия DPP4 выражена в верхних дыхательных путях и эпителии тонкой кишки, что делает его распространителем MERS-CoVs воздушно-капельным путем, а также через воду и пищу, загрязненные фекалиями. У человека DPP4 преимущественно экспрессируется в нижних дыхательных путях и эпителии тонкой кишки. Его роль в распространении возбудителя инфекции чаще сводится к фекально-оральной передаче [10]
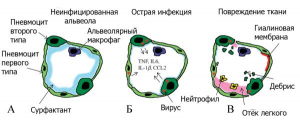
Рисунок 17 - Патологический процесс, вызванный SARS-CoVs в альвеолах легких. А. Пневмоциты типа I и типа II образуют альвеолярные стенки, в альвеолярном пространстве присутствуют альвеолярные макрофаги и легочные поверхностно-активные вещества (сурфактанты). Б. В острой фазе инфекции SARS-CoV пневмоциты типа I и типа II инфицируются и выделяют воспалительные цитокины, тогда как уровни сурфактанта снижаются. В. Во время поздней стадии инфекционного процесса на фоне снижения титров вируса нарастает повреждение паренхимы легких, развивается отек легких и в альвеолах формируются гиалиновые мембраны, нарастает дыхательная недостаточность [29]
У человека DPP4 экспрессируется исключительно в эпителии нижних дыхательных путей, что приводит к тяжелой острой пневмонии в нижних отделах легких, являющейся основным клиническим исходом инфицирования MERS-CoV, но значение заболевших людей для эпидемического распространения вируса не было однозначно установлено (рисунок 16).
SARS-CoVs, включая и SARS-CoV-2, используют в качестве рецептора проникновения в клетку трансмембранную экзопептидазу ACE2, локализованную в небольшой популяции хорошо дифференцированных альвеолярных клеток (пневмоцитов) типа II (AT2) и энтероцитах - клетках эпителия тонкого кишечника (поэтому симптомы со стороны дыхательных путей не менее чем в одной трети случаев сопровождают симптомы со стороны желудочно-кишечного тракта - тошнота, диарея и др.). S-белок MERS-CoV демонстрирует очень небольшую гомологию с гомологией SARS-CoV в домене RBD (РНК-связывающий домен, RNA-Binding Domain) из-за различий в мишенях связывания их S-белков (для MERS-CoV - белок DPP4). Штаммы SARS-CoV, выделенные из разных хозяев, различаются по сродству к связыванию с ACE2 человека и, следовательно, по их инфекционности для человека. Эпидемические штаммы обычно обладают высоким сродством к человеческому ACE2 и, следовательно, они обладают потенциалом для эффективной передачи между людьми [12, 14], однако механизм передачи далеко не в каждом случае понятен. Для тех SARSr-CoVs, для которых не установлена способность использовать ACE2 в качестве рецептора для проникновения в клетку, не установлена и патогенность для человека [13]. Так же, как и SARS-CoV, SARS-CoV-2 вызывает острый респираторный дистресс-синдром (acute respiratory distress syndrome, ARDS) и острую легочную недостаточность (acute respiratory failure, ARF), являющиеся основной причиной смерти пациентов [36].
Происходит это следующим образом[27]. Через альвеолы легких осуществляется газообмен. Кислородом эритроциты крови насыщаются в капиллярах альвеолярной мембраны. Стенки альвеолы формируются пневмоцитами типа I и типа II и альвеолярными макрофагами. Пневмоциты типа I (AT1) покрывают 95 % площади альвеолярной поверхности и обеспечивают газообмен с кровью в капиллярах легкого. Пневмоциты типа II (AT2) - предшественники пневмоцитов типа I. Они ответственны за образование легочного сурфактанта (pulmonary surfactant) - смеси липидов и белков, выстилающей легочные альвеолы изнутри (то есть находящийся на границе «воздух- жидкость»). Легочный сурфактант препятствует слипанию стенок альвеол при дыхании за счет снижения поверхностного натяжения пленки тканевой жидкости, покрывающей альвеолярный эпителий [29].
SARS-CoVs (и, соответственно, SARS-CoV-2), инфицировав пневмоциты I и II типов, вызывают десквамацию (отслоение) пневмоцитов в альвеолах, способствуя альвеолярной дисфункции, отеку и кровотечению, нарушающим газообмен в альвеолах и приводящим к дыхательной недостаточности. Одновременно происходит снижение уровня сурфактанта в тканевой жидкости, покрывающей альвеолярный эпителий, ее поверхностное натяжение увеличивается. Соответственно, способность легких расширяться и сжиматься во время нормального акта дыхания снижается (пациент это состояние ощущает как "хруст легких" при каждом вдохе). Этот процесс может привести к коллапсу легких во время выдоха. По мере заполнения альвеол жидкостью, нарастает дыхательная недостаточность. Смертельный исход наступает при нарушении целостности альвеолярной мембраны, что приводит к накоплению жидких экссудатов в альвеолярных пространствах, механическая вентиляция легких оказывается бесполезной [29].
Прогрессирование ARDS от отека альвеол до диффузного альвеолярного повреждения (diffuse alveolar damage) не зависит от интенсивности репликации вируса и достижения им высоких титров. Инфекция приводит к пиковым вирусным титрам через 1-2 суток после заражения, наряду с денудацией дыхательных путей и образованием клеточного дебриса, закупоривающего мелкие бронхи (одна из причин, затрудняющая обнаружение вируса в верхних дыхательных путях). Тяжелые поражения паренхимы легких, в том числе инфильтраты, кровоизлияния, альвеолярный отек и образование гиалиновой мембраны[28], типичные для экссудативной стадии диффузного альвеолярного повреждения, появляются на 4-7 сутки после заражения, когда вирусные нагрузки в паренхиме легких быстро падают и/или становятся ниже предела обнаружения (рисунок 17) [29].
Тяжелое воспаление легких развивается из-за индукции SARS-CoVs интенсивного цитокинового ответа. Провоспалительные цитокины и хемокины, в том числе IL-6, TNFa, IL-ip и CCL2, привлекают воспалительные клетки к месту инфекции. Нейтрофилы и цитотоксические Т-клетки, наряду с цитокинами, вызывают повреждение тканей легких, включая повышение проницаемости сосудов и стимулирование легочного фиброза. Профиброзные гены (pro-fibrotic genes) человека, включая Tgfpi, Ctgf и Pdgfa, а также и многочисленные транскрипты коллагена отвечают повышенной экспрессией на вторжение MA-SARS и накоплением экссудата, кровоизлияний и фибрина в альвеолярном пространстве. Активация каскада коагуляции приводит к накоплению сгустков фибрина в альвеолах - характерная особенность инфекции SARS-CoV у людей. Они ограничивают обмен кислорода в альвеолах и ставят под угрозу выживание пациента. Экспрессия генов коллагена также увеличивается после заражения SARS-CoV. Накопление коллагена, фибрина и фибриновых сгустков в альвеолах способствует развитию фиброзного легкого, одновременно стимулируя инфицированного хозяина активировать фибринолитические пути. Нарушение регуляции этих коагуляционных/антикоагулянтных каскадов приводит к ухудшению состояния больного и к его смерти [29, 37, 38].
Распознание коронавируса иммунной системой запускает еще один патогенетический механизм, ухудшающий состояние инфицированного и трудный для понимания российскими врачами, изучавшими иммунологию по отечественным руководствам - феномен анти-тело-зависимого усиления инфекции. Он более подробно описан в разделе «Особенности иммунитета при коронавирусных инфекциях».
Устойчивость коронавирусов в окружающей среде и в аэрозолированном состоянии. Для разных HCoV устойчивость на объектах окружающей среды и в аэрозоле изучены с разной детализацией. Стабильность MERS-CoV в окружающей среде изучали путем помещения капли, содержащей вирус, на пластмассовые и металлические поверхности. Затем их помещали в соответствующие условия. Параллельно проводился сравнительный эксперимент в аналогичных условиях с вирусом гриппа A/Mexico/4108/2009 (H1N1). Выживаемость вирусов определяли при t = 20 °С и 40 % относительной влажности; t = 30 °C и относительной влажности 30 %; t = 30 °C и относительной влажности 80 %. MERS-CoV показал значительно большую устойчивость в окружающей среде чем вирус гриппа. В условиях низкой температуры/низкой влажности MERS-CoV сохранял инфекционность через 48 ч. Тогда как вирус гриппа A/Mexico/4108/2009 (H1N1) погибал через 4 ч. MERS-CoV также показал высокую стабильность в аэрозоле при t = 20 °C и 40 % относительной влажности (аэрозольный генератор AeroMP, производитель Biaera Technologies, США; дисперсность частиц не указана). Быстрое снижение жизнеспособности вируса наблюдалось при t = 20 °C и 70 % относительной влажности, что было сопоставимо с таковым у вируса гриппа A/Mexico/4108/2009 (H1N1) [40].
Аналогичные результаты получены и в отношении SARS-CoV. Высушенный вирус на гладких поверхностях сохранял свою жизнеспособность в течение более 5 сут при t = 22-25 °C и относительной влажности 40-50 %, т.е. в типичныхкондиционированных помещениях. Однако жизнеспособность вируса быстро терялась при более высоких температурах и относительной влажности (например, t = 38 °C и относительной влажности >95 %). Стабильность SARS-CoV при низкой температуре и низкой влажности окружающей среды может способствовать его эпидемической передаче в субтропической зоне (например, в Гонконге) весной и в кондиционированных средах. Это обстоятельство объясняет, почему в некоторых азиатских странах в тропической зоне (таких, как Малайзия, Индонезия или Таиланд) с высокой температурой и высокой относительной влажностью окружающей среды не было крупных вспышек MERS-CoV [41].
Во время эпидемии SARS в Гонконге установлено, что аэрозолированные капельки кала стали причиной 420 случаев заражения SARS-CoV [42]. Коронавирусы длительно сохраняются в продуктах питания и в сточных водах. L. Mullis с соавт. [43] экспериментально показали, что в обычных условия хранения в домашнем холодильнике салат может сохранять жизнеспособный бычий коронавирус не менее 14 сут. Исследование выживаемости в окружающей среде вирусов трансмиссивного гастроэнтерита (transmissible gastroenteritis, TGEV) и гепатита мыши (MHV) позволило установить, что они оставались инфекционными в воде и сточных водах при t = 27 °C в течение нескольких недель, а при t = 4 °C - в течение года [44]. В отчете ВОЗ за 2008 г. SARS-CoV отнесен к вирусам, которые могут передаваться через пищу (viruses in food). Передача через пищу - это путь проникновения коронавирусов в человеческую популяцию и их последующего распространения посредством передачи от человека человеку. Долгосрочное выживание вируса особенно опасно, если загрязнение коронавирусами происходит в конце цепи обработки пищевых продуктов или в свежих продуктах [45].
Особенности ответа иммунной системы на коронавирусную инфекцию. Подходы к созданию вакцин в отношении таксономически и структурно сходных SARS-CoV и MERS-CoV в значительной степени похожи. И нет оснований считать, что при создании SARS-CoV-2-вакцины они будут чем-то отличаться. В целом кандидаты на вакцины против MERS-CoV и SARS-CoV основаны на использовании в качестве антигена белков S (его отдельных субъединиц и доменов, например, рецептор-связывающего домена, рекомбинантных тримеров и др.) и белка N, которые проявляют выраженный антигенный эффект[29] и способны вызывать кроме гуморальных еще и Т-клеточные ответы[30] [46]. Исследования в данном направлении также выполнялись с использованием в качестве антигенов белков оболочки (E) и неструктурного белка 16 (Nsp16), но без особого успеха [47]. Так как только белок S индуцирует нейтрализующие в условиях in vitro антитела, выбор антигенов у разработчиков вакцин не велик и не прост.
Потенциальные CoV-вакцины-кандидаты классифицированы на шесть типов: вакцина на основе вирусного вектора (обычно им являются аденовирус, вирус бешенства), ДНК-вакцина, субъединичная вакцина, вакцина на основе наночастиц, вакцина на основе инактивированного цельного вируса и вакцина на основе ослабленного штамма вируса. Среди них наибольшие надежды исследователи возлагают на вакцины на основе вирусного вектора и субъединичные вакцины [47].
Основным препятствием на пути создания CoV-вакцин, о котором их разработчики иногда стесняются упоминать, является феномен антитело-зависимого усиления инфекции (antibody-dependent enhancement, ADE), развивающийся в ответ на белок S коронавируса. Он заключается в усилении инфекционного процесса специфическими к возбудителю инфекционной болезни антителами. Такие антитела образуют комплексы с возбудителем инфекционной болезни посредством Fс-фрагмента антитела и взаимодействуют либо со специфическим к Fc-фрагменту рецептором (Fc- receptor, FcR), либо с рецептором комплемента (complement receptor, CR) на поверхности фагоцитирующих клеток. Происходит не только усиление инфекционного процесса в результате размножения микроорганизма в фагоцитирующих клетках, но и изменение тропности коронавируса. SARS-CoV на начальной стадии инфекционного процесса не инфицирует моноциты/макрофаги, связываясь с рецептором ACE2 в нижних отделах легких [32]. Но антитела к шипу (белок S) оболочки SARS-CoV, по-степенно вырабатываемые иммунной системой человека в ответ на инфекцию, способствуют проникновению SARS-CoV в моноциты и макрофаги через FcyRIIA-рецептор и утяжеляют течение болезни [48, 49].
Феномен ADE обнаружен M.S. Yip с соавт. [50] через 8 лет после идентификации SARS-CoV в 2003 г., когда исследования по созданию SARSCoV-вакцин уже свелись к демонстрации «принципиальной возможности» их создания. Еще через год M. Jaume с соавт. [51] продемонстрировали, что «не нейтрализующие антитела» (nonneutralizing antibodies, как их тогда деликатно называли), индуцированные полноразмерным S-белком SARS-CoV, в низких концентрациях облегчают проникновение вируса в клетки-хозяева через FcyR-зависимый путь. Отало понятно, почему спешно созданные в 2004-2005 гг. на основе полноразмерного S-белка кандидатные вакцины против SARS-CoV индуцировали выработку антител, не предотвращавших заражение этим вирусом экспериментальных животных. Напротив, они вызывали у них развитие гепатита и утяжеляли инфекционный процесс [52-54].
Таким образом, феномен ADE является критической проблемой при разработке CoV- вакцин, в том числе и против sARS-CoV-2. В условиях эксперимента путем оптимально подобранной схемы вакцинации и в контролируемых условиях можно добиться на короткое время протективного эффекта даже такими антителами, если их концентрация в сыворотке крови позволит блокировать большинство спайк-белков CoV[31]. Однако при падении со временем концентрации антител до субнейтрализующих, неизбежно проявит себя ADE. И те остаточные количества антител к эпитопам белка S, которые будут присутствовать в сыворотке крови на протяжении десятилетий, станут своего рода триггером, запускающим тяжелый инфекционный процесс при повторной встрече иммунной системы человека с CoV.
Несмотря на то, что с 2004 г. было сообщено о многих многообещающих CoV-вакцинах-кандидатах, на 2019 г. только три потенциальных кандидата на вакцины против MERS-CoV прошли I стадию клинических исследований[32] [47].
Деление проблемы создания вакцины против SARS-CoV-2 на множество мелких проблем (подбор адъюванта для субъединичной вакцины на основе домена S1; подбор условий инактивации вируса для создания цельнови- рионной инактивированной вакцины или условий выращивания вируса для получения ослабленной вакцины; разработка очередной системы экспрессии для получения вирусоподобных частиц; варьирование длиной внеклеточного домена белка S1 при создании ДНК- вакцин; замена рекомбинантного человеческого аденовируса типа 5 на собачий парвовирус при создании вакцины на основе вирусного вектора и др.) позволит изобразить видимость бурной работы и освоить немало бюджетных средств, но вакцина, защищающая от SARS-CoV-2, создана не будет из-за особенностей иммунного ответа на вирус, о которых сказано выше.
Кроме того, при разработке любой вакцины основной движущей силой является финансирование. Многие вакцины, демонстрирующие многообещающие результаты на доклинической стадии, на ней и остаются[33] из-за нехватки финансирования на клинические исследования. SARS-CoV-2 - это не возбудитель туберкулеза, ВИЧ/СПИДа или сывороточных гепатитов, объем рынка такой вакцины после окончания вспышки ограничится небольшим количеством пограничников, врачей и ученых-вирусологов. Поскольку на завершение полных клинических исследований вакцин уходит обычно 10 лет и более[34], они вряд ли будут коммерчески доступны в ближайшие 1,5 года, как об этом заявляют отдельные чиновники. Более целесообразно потратить эти деньги на изучение природной очаговости коронавирусов на территории Российской Федерации.
Эпидемиология. Первые случаи заражения SARS-CoV-2 людей в Китае произошли в ноябре 2019 г., но не были распознаны[35]. Китайские врачи осознали, что имеютдело с новой инфекционной болезнью только к концу декабря 2019 г. после того, как в госпиталь Цзинь Инь-Тан в Ухане (Jin Yin-tan Hospital of Wuhan) с 18 по 29 декабря 2019 г. поступили 5 пациентов, страдающих от лихорадки, кашля и одышки, сопровождающихся осложнениями острого респираторного дистресс-синдрома. Рентгенография грудной клетки показала диффузные помутнения и уплотнения в легочной ткани. Один из пациентов умер. Результаты исследования последовательностей РНК вируса, выделенных из бронхо-альвеолярного лаважа, показали наличие ранее не известного в-CoV у всех пяти пациентов с идентичностью нуклеотидов 99,8-99,9 %[36] [57].
Возбудитель таинственной пневмонии в Ухане по результатам секвенирования и этиологических исследований по крайней мере пятью независимыми лабораториями КНР[37] в начале января 2020 г. идентифицирован как новый коронавирус (SARS-CoV-2). Поскольку первые случаи болезни, вызванной SARS-CoV-2, были связаны с посещением оптового рынка морепродуктов Хуанань в Ухане, то передача вируса от человека к человеку не считалась основным механизмом распространения инфекции. Тем не менее, последующие случаи не были связаны с этим рынком. Поэтому китайскими эпидемиологами был сделан вывод о том, что вирус также может передаваться от человека к человеку, а люди с симптомами заболевания являются наиболее частым источником распространения SARS-CoV-2. Передачу вируса до появления симптомов можно только предполагать. Как и в случае с другими респираторными патогенами, включая грипп и риновирус, передача вируса происходит через капельки мокроты, возникающие при кашле и чихании в закрытых помещениях при тесном контакте между людьми.
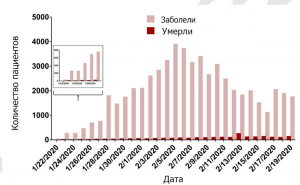
Рисунок 18 - Динамика вспышки COVID-19 в Китае за период с 22.01 по 19.02.2020 г. Максимальное количество заболевших (05.02.2020) пришлось на один инкубационный период болезни, что говорит о заражении SARS-CoV-2 большого количества людей за очень непродолжительный период времени, но не о заражении их от «нулевого пациента». Word Health Organization. Coronavirus Disease 2019(COVID-19). URL: https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200219-sitrep-30-covid-19.pdf?sfvrsn=6e50645_2 . Опубликовано 20 февраля 2020 г.
Его распространение в первую очередь ограничивается членами семьи, медицинскими работниками и другими близкими контактами. Инкубационный период - от 3 сут до 2 нед, самое длительное время от заражения до симптомов составляет 12,5 сут [58].
Перелом в распространении SARS-CoV-2 в Китае пришелся на начало февраля 2020 г.[38]
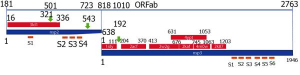
Рисунок 19 - Гомологичные и гетерологичные структуры на последовательности ORFlab SARS-CoV-2. Гомологичные последовательности показаны синей линией. Нумерация над линией относится ко всей ORF. Красные полосы представляют гетерологичные структуры, образованные PDB; синие - последовательности nsp2 и nsp3 соответственно. Коды PDB указаны внутри соответствующих красных полос. Нумерация ниже синей линии относится к отдельному nsp. Оранжевые линии указывают приблизительное положение трансмембранных спиралей [60]
Количество новых случаев COVID-19 стало неуклонно снижаться (рисунок 18)[39].
Анализ первых 425 случаев, зарегистрированных в Ухане, показал, что средний возраст пациентов составлял 59 лет, в диапазоне от 15 до 89 лет. При большой выборке не обнаружено существенных гендерных различий (56 % мужчин). Бессимптомные случаи болезни составляли не более 1 % от всех, диагноз ставился при обнаружении вирусной РНК. Общий коэффициент летальности (по подтвержденным случаям) составил 2,3 %. Смертельными исходами болезнь завершилась в основном у пожилых пациентов, в частности, тех, кто был старше 80 лет (около 15 % от умерших) и от 70 до 79 лет (8,0 %). Приблизительно половина (49,0 %) тяжелых пациентов страдали диабетом, хроническими респираторными, сердечно-сосудистыми и онкологическими болезнями. Около 1 % пациентов были в возрасте 9 лет или моложе, смертельных случаев в этой группе не было [58].
Само появление SARS-CoV-2 как результат мутаций в белке шипа вируса (S1) летучей мыши, придающих ему тропность к ACE2 в качестве рецептора-мишени и обеспечивающих его «перескок» в популяции людей [9, 59], объяснимо на основе уже имеющихся данных по генетической изменчивости коронавирусов (см. совместную американо-китайскую работу [32]). Построенное филогенетическое древо показало, что SARS-CoV-2 достоверно кластеризовался с SARS-подобным коронавирусом летучей мыши, выделенным в 2015 г., но не был ему идентичен[40]. Также были обнаружены мутации поверхностных белков, таких как белок S (шип) и белок N (нуклеокапсид), придающие устойчивость вирусной частице к факторам окружающей среды и способность заражать людей, проявляя при этом пониженную вирулентность в сравнении с SARS-CoV и MERS-CoV. Эти особенности могут объяснить зоонозную передачу SARS-CoV-2 [9, 59]. Но на их основе гораздо сложнее оказалось дать ответы на вопросы, почему контагиозность SARS-CoV-2 оказалась выше, чем у SARS-CoV и MERS-CoV, и почему вспышка болезни на ее начальном этапе проявила себя столь тяжелыми клиническими формами у китайского населения в сравнении с европейским.
Для ответа на первый вопрос S. Angeletti с соавт. [60] был проанализирован белок, кодируемый в пределах открытой рамки считывания ORF1ab SARS-CoV-2 (см. рисунок 10). Он обратил на себя внимание тем, что отличался от такого же у наиболее похожего на SARS-CoV-2 коронавируса летучей мыши SARS Bat (QHR63299) на 103 аминокислотных остатка, 64 из которых являются консервативными[41]. Исследователями было показано наличие аминокислотных изменений в Nsp2 и Nsp3, участвующих в механизме проникновения вируса в клетку и его размножении (репликации). Неструктурный белок 2 (Nsp2)[42] SARS-CoV-2 отличается от такого у SARS Bat на11 остатков, тогда как Nsp3 на 64 остатков, из которых 44 консервативные[43]. Ими установлено, что внутри областей nsp2 и nsp3 имеется негомологичный ORF1ab сегмент, который они идентифицировали как соответствующий такому же участку из вируса птичьего бронхита (avian infectious bronchitis virus, PDB 3ld1) (рисунок 19).
В положении 501 (положение 321 белка Nsp2), в соответствующем сайте в SARS-подобного коронавируса летучих мышей (т.е. возможного предка SARS-CoV-2), находится неполярная аминокислота треонин; SARS-Cov - полярная аминокислота аланин; у SARS-CoV-2 - полярная аминокислота глутамин (Gly). Благодаря большей, чем у аланина, длине боковой цепи, полярности и способности образовывать водородные связи, аминокислота глутамин повышает стабильность белка и эффективность проникновения вируса в эндосомы клетки и, соответственно, ее инфицирование[44].
Что касается положения 723 (543 в белке Nsp3), то у SARS-CoV-2 имеется сериновый остаток (Ser), но у коронавирусов SARS-like и SARS Bat, глициновый. Благодаря этому усилена локальная жесткость полипептидной цепи как для стерического эффекта, так и для способности образовывать водородные связи. Более того, Ser может действовать как нуклеофил[45] в определенных структурных средах, таких как среды активных сайтов фермента.
Аминокислота в положении 1010 (соответствующей положению 192 белка Nsp3) у SARS-CoV-2 представлена пролином; в гомологичной области Bat SARS-подобного корона- вируса находится гистидин; у SARS-Сov - изолейцин. Из-за стерической выпуклости (steric bulge) и жесткости (stiffness) пролина молекулярная структура SARS-CoV-2 может подвергаться большему локальному конформационному изменению в сравнении с аналогичными белками двух других вирусов. В Nsp3 мутация находится рядом с фосфатазаподобным белком (similar to a phosphatase), характерным для SARS-Сov и играющим ключевую роль в процессе размножения (репликации) вируса.
Таким образом, большая контагиозность (заразность) SARS-CoV-2 для людей, чем отмечена у SARS-Сov, может быть объяснена более стабильной структурой Nsp2, обеспечивающей эффективное проникновение вируса в эндосомы клетки; а также более эффективной работой репликационно-транскрипционного комплекса и системы противодействия врожденному защитному ответу клетки, обеспечиваемым белком Nsp3, совместно обеспечивающих высокое воспроизводства вируса клеткой.
Тяжесть течения инфекции у жителей Ухани, вызванной SARS-CoV-2, стала тем фактором, который обратил на нее внимание врачей в начале эпидемии, когда летальные исходы составляли 15 % от количества заболевших [14]. То, что вирус взаимодействует с рецептором ACE2 на поверхности пневмоцитов I и II типов человека, было установлено почти сразу, однако одновременно обнаружили и то, что сила связывания между SARS-CoV-2 и ACE2 была слабее, чем между SARS-Cov и ACE2, и она лишь намного превышала пороговое значение, требуемое для инфицирования клетки [64].
Чтобы лучше понять, что лежит в основе тяжелого течения COVID-19 у местных жителей, Y. Zhao с соавт. [14] с использованием технологии секвенирования РНК одной клетки (single-cell RNA sequencing technology, scRNA-Seq) проанализировали экспрессию ACE2 в 43 тыс. клеток 8 доноров разных рас и национальностей. Исследовались пневмоциты I (AT1) и II типов (AT2), эпителиальные клетки дыхательных путей, фи- бробласты, эндотелиальные клетки и макрофаги. Было установлено, что у всех доноров ACE2 экспрессируется в 0,64 % клеток легкого человека. Большинство клеток, экспрессирующих ACE2 (в среднем 83 %), являются клетками AT2. Экспрессия ACE2 сконцентрирована в особой популяции AT2, экспрессирующей многие другие гены, благоприятствующие процессу распространения вируса (приведены в рассматриваемой статье), т.е. вирус управляет этими клетками для своего размножения. AT1, эпителиальные клетки дыхательных путей, фибробласты, эндотелиальные клетки и макрофаги экспрессируют ACE2, но в значительно меньшем количестве.
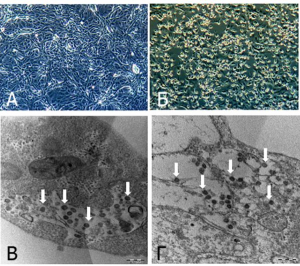
Рисунок 20 - Клетки Vero инфицированные SARS-CoV-2 под оптическим и электронным микроскопом. А. Исходная культура клеток Vero. Б. Цитопатические эффекты клеток Vero, вызванные SARS-CoV-2 (3-и сутки после инокуляции) В и Г. Электронные микрофотографии тонких срезов клеток Vero, инфицированных SARS-CoV-2. Блочное окрашивание с использованием 0,5 % уранилацетата. Срезы толщиной 70 нм. Белые стрелки указывают на агрегаты внутриклеточных вирионов. Вирус наблюдается в широком диапазоне внутриклеточных органелл, особенно в везикулах. Размер частиц варьирует от 70 до 90 нм [68]
Обильная экспрессия ACE2 в популяции AT2 объясняет тяжелое альвеолярное повреждение при инфицировании легких SARS-CoV-2[46]. Кроме того, было установлено, что ACE2 более широко распространен у мужчин-доноров, чем у женщин: по крайней мере 5 различных типов клеток в мужском легком экспрессируют этот рецептор, в то время как в женском легком только 2-4 типа клеток экспрессируют этот рецептор. Этот результат согласуется с данными эпидемического исследования, показывающего, что большинство подтвержденных пациентов, инфицированных на начальной стадии эпидемии в 2019 г. SARS-CoV-2, были мужчинами (30 против 11 на 2 января 2020 г.). Y. Zhao с соавт. [14] установлено, что донор-азиат (мужчина) имеет гораздо более высокое соотношение клеток, экспрессирующих АСЕ2, чем доноры белых и афроамериканцев (2,50 % против 0,47 % всех клеток, т.е. в 5,3 раза). Это объясняет сделанное наблюдение, что новая пандемия коронавируса и предыдущая пандемия SARS-Cov сконцентрированы в азиатском регионе и почему вспышка болезни проявила себя столь тяжелыми клиническими формами у местного китайского населения[47].
Выделение SARS-CoV-2. Для выделения SARS-CoV-2 использовали образцы секрета верхних и нижних дыхательных путей от предполагаемых больных COVID-19 (тяжело протекающая рентгенологически подтвержденная пневмония, кашель, лихорадка). Их инокулировали в клетки Vero E6 или Caco-II и наблюдали с 24-часовым интервалами. Цитопатические эффекты проявлялись через 3 суток после инокуляции. Инокулированные клетки собирали на 4-е сутки, когда более 80 % клеток проявляли цитопатические эффекты. Репликация вируса подтверждалась использованием обратной-транскриптазной полимеразной цепной реакции в реальном времени (real-time reverse transcriptase, RT-PCR)[48] с РНК, выделенной из среды для культивирования клеток (рисунок 20).
Идентификацию вируса проводили с использованием RT-PCR, полного секвенирования генома и электронной микроскопии. Работа с культурами SARS-CoV-2 осуществлялась в учреждениях, обеспечивающих уровень биобезопасности BSL3 [68].
Клиника COVID-19 и установление диагноза. Симптомы не характерны. Наиболее часто встречающимися симптомами были температура (91,7 %), затем кашель (75 %) и ощущение усталости (75 %). Более чем у 1/3 пациентов наблюдались стеснение в груди или одышка, а также желудочно-кишечные симптомы - тошнота, диарея и анорексия.
Рисунок 21 - Рентгенограмма и компьютерная томограмма (КТ) грудной клетки выздоровевшей пациентки. Женщина, 67лет, поступила в больницу № 7 г. Ухань 01.01.2020 г с кашлем с мокротой и прогрессирующей одышкой. А. Изображение поперечной компьютерной томографии от 9января, показывающее множественныелобу- лярные и сегментарные затемнения в сочетании с непрозрачностью типа «матовое стекло», диффузно распределенными в двухстороннем легочном поле. Б. Рентген грудной клетки от 12 января, показывающий расширенную двустороннюю консолидацию. В. Уменьшение консолидации на рентгенограмме грудной клетки от 17 января Г. КТ от 22 января, показывающая рассасывание двусторонней консолидации, рассеянные фиброзные изменения. Состояние пациентки улучшилось, она была выписана 24 января [70]
Наиболее информативными оказалось рентгенологическое исследование (рентгенография грудной клетки и компьютерная томография). У 99,3 % при рентгенологическом исследовании поступивших в госпиталь лихорадящих пациентов обнаруживали двусторонние множественные лобулярные и сегментарные затемнения в сочетании с непрозрачностью типа «матовое стекло» (ground-glass opacities)[49] и двухсторонней консолидацией[50]. Нарастание количества очагов затемнений, появление картины «белого легкого» обычно говорят о приближении летального исхода болезни (рисунки 21 и 22).
Возможно относительно бессимптомное состояние. Пожилые мужчины с сопутствующими заболеваниями чаще страдают дыхательной недостаточностью из-за тяжелого альвеолярного повреждения.
Рисунок 22 - Рентгенография грудной клетки и компьютерная томография 36-летнего некурящего мужчины, умершего после непродолжительного улучшения состояния. У пациента при поступлении 06.01.2020 г. в стационар были температура, кашель и диарея. A-В. Поперечные КТ-изображения от 9 января. A. Двусторонние множественные затемнения по типу «матового стекла», большинство из которых представляют собой нерегулярные небольшие круглые образования, рассеянные в верхней области легких. Б. Двусторонние множественные нерегулярные затемнения по типу «матового стекла» и затемнение в форме клина, расположенное в правой верхней доле под плеврой. В. Двустороннее множественное нерегулярное затемнение по типу «матового стекла» и небольшое узловатое затемнение, расположенное в левой нижней верхней доле под плеврой. Г. Состояние пациента ухудшились 12 января. Рентгенография грудной клетки показала двустороннее диффузное затемнение и так называемое «белое легкое». Д. Рентгенография грудной клетки после интубации и искусственной вентиляции легких 13 января, затемнения уменьшились. Е. 20 января, двусторонние поражения легких увеличились, плевральный выпот. Больной умер 21 января [70]
Начавшись, болезнь может быстро прогрессировать вплоть до развития шока, острого респираторного дистресс-синдрома, сердечной и почечной недостаточности, приводящих к смерти [68].
Результаты анализа клеток крови пациентов в день госпитализации обычно показывали норму у большинства пациентов. Лимфопения была распространена у 5,4 % пациентов.

Рисунок 23 - Временная шкала развития основных симптомов COVID-19. Первые симптомы неспецифичны, в среднем от их начала до помещения пациента в госпиталь проходит 7 сут, состояние пациента стремительно ухудшается, нарастает отдышка, на 8-е сутки у части пациентов может развиться острый респираторный дистресс-синдром, требующий механической вентиляции легких и помещения в реанимационную палату [70]
Было отмечено, что более половины этих пациентов страдало эозинопенией. Другие лабораторные данные включали более высокую концентрацию С-реактивного белка (91,9 %), сывороточного амилоида А (90,2 %) и D-димера (продукт распада фибрина) (43,2 %), в то время как повышенная концентрация сывороточного прокальцитонина (34,7 %) и креатинкиназы (6,7 %) встречались реже [67]. Постоянное снижение количества лимфоцитов крови (нарастание лимфопении), увеличение концентраций D-димера, амилазы являются негативными прогностическими признаками [58].
С. Huang с соавт. [69] на основе своих наблюдений за течением COVID-19 у 41 пациента составили временную шкалу развития основных симптомов болезни (рисунок 23).
Степень тяжести COVID-19 определяли на основании дыхательных функций при поступлении пациента по одному из следующих критериев: частота дыхания >30/ мин, насыщение кислородом <93 % в покое и индекс оксигенации <300 мм рт. ст. [51][70] (таблица 4).
Национальная комиссия здравоохранения КНР на основе рекомендаций ВОЗ[52] разработала Программу выявления случаев COVID-19 (таблица 5)
Таблица 4 - Критерии определения тяжести клинического течения COVID-19 (при подтверждении этиологии болезни RT-PCR)
|
Степень тяжести |
Основные признаки |
|
Легкая (Mild) |
Легкие клинические симптомы (лихорадка <38 0С (без лечения), с кашлем или без кашля, без одышки, без удушья, без хронических заболеваний). Нет рентгенологического подтверждения пневмонии |
|
Умеренная (Moderate) |
Лихорадка, респираторные симптомы, рентгенологическое обнаружение пневмонии |
|
Тяжелая (Severe) |
Любой из следующих признаков: А. Респираторный дистресс, частота дыхания >30 раз/мин. Б. SpO2 (насыщение кислородом) <93 % в состоянии покоя. В. PaO2/FiO2 < 300 мм рт. ст. (парциальное давление кислорода/фракция вдыхаемого кислорода) Пациентов с быстрым прогрессированием болезни (>50 %) на КТ в течение 24-48 ч следует считать тяжелыми |
|
Критическая (Critical) |
Любой из следующих признаков: А. Дыхательная недостаточность, требующая механической вентиляции легких. Б. Шок В. Внелегочная органная недостаточность, требующая помещения в блок интенсивной терапии |
Примечание. По Z. Zu с соавт. [71].
Таблица 5 - Программа выявления случаев COVID-19, принятая в КН
|
Тип диагноза |
Условия для постановки диагноза |
|
Предполагаемый |
Для предположения диагноза должны совпасть по крайней мере два условия из перечисленных: i. Лихорадка и/или симптомы со стороны респираторного тракта (например, кашель, тошнота, миалгия). ii. Рентгенологические признаки вирусной пневмонии. iii. Нормальное или низкое количество лейкоцитов в крови или сниженное количество лимфоцитов (на ранней стадии болезни) И один или более симптомов, которые развились в течение 14 сут после предполагаемого контакта с инфицированным: 1. В анамнезе - пребывание в Ухани или других регионах, где отмечено распространение COVID-19, или общение с пациентом, у которого уже установлен COVID-19. 2. Тесный контакт с пациентом с лабораторно подтвержденным диагнозом COVID-19 (положительный тест на нуклеиновую кислоту вируса). 3. Тесный контакт с людьми с лихорадкой и респираторными симптомами, прибывшими из Ухани, его региона или населенных пунктов. 4. Весь блок (Cluster onset) Пациенты без возможной экспозиции в анамнезе должны отвечать условиям, перечисленным i, ii и iii |
|
Клинически подтвержденный случай (убран из 6 издания) |
Типичная рентгенологическая картина пневмонии (только для пациентов из провинции Хубэй) |
|
Подтвержденный случай |
Имеется по крайней мере одно из следующих доказательств этиологии болезни: i. Положительный тест RT-PCR на нуклеиновую кислоту SARS-CoV-2 в пробе крови или выделениях из респираторного тракта. ii. Нуклеотидная последовательность вируса, выделенного из пробы крови или выделений из респираторного тракта, высоко гомологична SARS-CoV-2 |
Примечание. По Z. Zu с соавт. [71].
Таблица 6 - Дифференциальная диагностика COVID-19 от других инфекций легких
|
Болезнь |
Респираторные симптомы |
Общие симптомы |
Рентгенологические находки |
|
Обычная простуда (Common cold) |
Заложенный нос, насморк, чиханье |
Нет выраженного дискомфорта |
Нет |
|
Грипп (Influenza) |
Заложенный нос, насморк, боль в горле и сухой кашель |
Высокая температура, боли в мышцах, недомогание |
Небольшие области с непрозрачностью типа «матовое стекло» и затемнения, распределенные субплеврально или перибронхиально |
|
SARS |
Кашель, одышка |
Лихорадка, озноб, боли в мышцах, головная боль |
Субплевральная непрозрачность типа «матовое стекло», затемнения нижней доли легкого, интерлобулярные и интралобулярные септальные утолщения |
|
MERS |
Боль в горле, сухой кашель, одышка |
Лихорадка, озноб, оцепенение |
Билатетеральное,базилярное и субплевральное снижение прозрачности по типу «матовое стекло», редкие септальные утолщения и плевральные выпоты |
|
COVID-19 легкой степени тяжести |
Возможен кашель, боли в горле |
Лихорадка |
Мультифокальные затемнения типа «матовое стекло» с субплевральным распределением |
|
COVID-19 в тяжелом проявлении |
Пациент задыхается, респираторная недостаточность |
Лихорадка, ломота в мышцах, головная боль, спутанность сознания |
Диффузное гетерогенное затемнение по типу «матовое стекло» |
Примечание.
По Z. Zu с соавт. [71].
Пневмонию COVID-19 могут имитировать пневмонии другой этиологии. В таблице 6 приведены их типичные клинические и рентгенологические признаки.
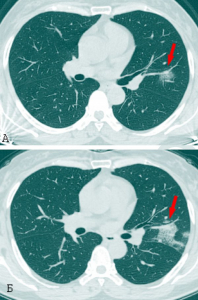
Рисунок 24 - Результаты КТ, подтвердившей пневмонию у 51-летней женщины без лихорадки, находившейся в контакте с пациентами с подверженным лабораторным путем диагнозом COVID-19. На верхней фотографии (А) единичный очаг типа «матовое стекло» (верхняя доля левого легкого - стрелка). КТ грудной клетки сделана за 6 сут до того, как был получен первый положительный тест RT-PCR. Внизу - контрольная КТ через 4 сут (Б) показала увеличение размера пневмонического очага (стрелка) [71]
По опыту китайских врачей рентгенография грудной клетки на ранней стадии инфекции не столь чувствительна к обнаружению очагов типа «матовое стекло», как КТ. Пневмония COVID-19 не имеет специфических особенностей при КТ грудной клетки. Обычно КТ грудной клетки обнаруживает мультифокальные двусторонние очаги типа «матовое стекло» с выраженным периферическим суб-плевральным распределением и склонностью располагаться в частях легких, близких к спине или в нижней доле. КТ позволяет обнаружить пневмонический очаг раньше, чем с помощью RT-PCR будет установлена этиология болезни и ярко проявятся клинические признаки болезни, однако без подтверждения RT-PCR диагноз COVID-19 не ставится (рисунок 24 и 25).
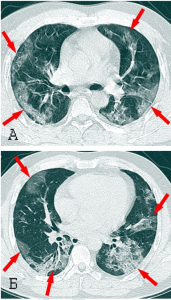
Рисунок 25 - Результат КТ, подтвердивший пневмонию одновременно с RT-PCR у 43-летнего мужчины, не имевшего лихорадки и не бывшего в Ухани. Осевая неусиленная КТ грудной клетки. А и Б. На двух тонких срезах аксиальной неусиленной компьютерной томографии грудной клетки показаны диффузно субплеврально распределенные затемнения типа «матовое стекло» (стрелки) [71]
Хотя результаты КТ грудной клетки неспецифичны для выявления COVID-19, этот метод диагностики был рекомендован Национальной комиссией по здравоохранению и здравоохранению Китая в качестве основного подтверждения клинического диагноза в провинции Хубэй. RT-PCR, положительная для COVID-19, остается эталонным стандартом этиологической диагностики, но на результаты RT-PCR могут влиять ошибки выборки и низкая вирусная нагрузка, недостаток чувствительности в течение первых пяти суток болезни. Опыт диагностики COVID-19 показал, что КТ грудной клетки обнаруживает пневмонию тогда, когда RT-PCR мазков из носоглотки или мазков из горла дают отрицательный результат. Тонкослойная КТ грудной клетки проста в исполнении и выявляет раннюю пневмонию COVID-19 с высокой чувствительностью, предоставляя ценную информацию для дальнейшей диагностики, помогая при профилактике и контроле COVID-19 [71].
Лечение. Лечение симптоматическое. Кислородная терапия представляет собой основное терапевтическое средство для пациентов с тяжелым течением COVID-19. Системные кортикостероиды для лечения вирусной пневмонии или острого респираторного дистресс-синдрома не рекомендуются. Кроме того, рекомендовано избегать неселективного или ненадлежащего применения антибиотиков. Хотя противовирусное лечение не было одобрено, была предложена комбинация из альфа-интерферона (например, 5 млн единиц при вдыхании аэрозоля два раза в день) и лопинавир/ритонавира (ингибитор ВИЧ-1 и ВИЧ-2 протеазы/ингибитор аспартилпротеаз ВИЧ-1 и ВИЧ-2). Доклинические исследования также показали, что нуклеозидный аналог ремдесивир (GS5734) - ингибитор РНК-полимеразы с активностью in vitro может быть эффективным как для профилактики, так и для терапии инфекций HCoVs. Этот препарат был протестирован на модели макаки-резуса с инфекцией MERS-CoV с положительным результатом [58].
Остается только сожалеть об отсутствии в прошлом внимания у российских ученых к столь важному и интересному направлению в эпидемиологии, вирусологии и иммунологии, каким является изучение возбудителей корона- вирусных инфекций и вмещающих их на территории России экосистем. Внезапная вспышка COVID-19 в КНР, где уже не менее 15 лет велся мониторинг резервуаров таких инфекций, показывает довольно хрупкое благополучие в нашей стране по подобным инфекциям, SARS-CoV-2 - не последний вирус семейства Coronaviridae, который нам может подбросить природа. Однако неожиданность пандемического распространения SARS-CoV-2 - это индикатор более опасного явления - несоответствия существовавших до этой пандемии знаний о природных резервуарах возбудителей инфекционных болезней и представлений об эпидемических процессах, накопленному в природе эпидемическому потенциалу. Такой сигнал не первый. Уже не менее 50 лет развивается ВИЧ/ СПИД-пандемия, и пока ей нечего противопоставить, кроме молчания. Эпидемическая ситуация для населения России ухудшается тем, что пандемия SARS-CoV-2 развивается на фоне ВИЧ/СПИД-пандемии, возможно, как ее часть. Вслед за ВИЧ/СПИД-пандемией по тем же механизмам передачи тянется пандемия Т-клеточного лейкоза, не отстают от них латентные герпетические инфекции, проявляющиеся патологией, воспринимаемой врачами как неинфекционная. Налицо не просто пандемия SARS-CoV-2, а кризис современной эпидемиологии. И этот кризис необходимо преодолеть, начиная с пересмотра многих представлений о причинах эпидемий и борьбе с ними, считающихся незыблемыми весь ХХ в. Что касается Российской Федерации, то уже по принятым правительством мерам ясно, что новая пандемия стала той встряской, которая сделала страну более сильной в противоэпидемическом отношении. Опыт и знания специалистов Министерства обороны Российской Федерации сыграли в этом далеко не последнюю роль.
Информация о конфликте интересов
Автор заявляет, что исследования проводились при отсутствии любых коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Сведения о рецензировании
Статья прошла открытое рецензирование двумя рецензентами, специалистами в данной области. Рецензии находятся в редакции журнала.
Список источников
1. Berry D.M., Cruicktank J.G., Chu H.P., Dells R.H.J. The structure of infectious bronchitis virus // Virology. 1964. V. 23. P. 403-408.
2. Tyrrell D.A.J., Almeida J.D. Direct electron microscopy of organ cultures for the detection and characterization of viruses // Arch. Gesamte Virusforsch. 1967. V.22. P. 417-425.
3. Siddell S.G., Wege H., ter Meulen V. The biology of coronaviruses // J. Gen. Virol. 1983. V. 64. P. 761-776.
4. Sturman L.S., Holmes K.V. The molecular biology of coronaviruses // Adv. Virus Res. 1983. V. 28. P. 35-112.
5. Fung S., Liu L.H. Human Coronavirus: Host- Pathogen Interaction // Annu. Rev. Microbiol. 2019. V. 73. P. 529-557. https://doi.org/10.1146/annurev-micro-020518-115759 .
6. Cui J., Li F., Shi Zheng-Li. Origin and evolution of pathogenic coronaviruses //Nature Reviews. MiCRobiology. 2019. V. 17. P. 181-192
7. Chen Yu., Liu O., Guo D. Emerging coronaviruses: genome structure, replication, and pathogenesis. 2020, 22 January. https://doi.org/10.1002/jmv.25681
8. Wong A.C.P., Li X., Lau S.K.P. et al. Global Epidemiology of Bat Coronaviruses // Viruses. 2019. V. 11. P. 174. https://doi.org/10.3390/v11020174
9. Lu R., Zhao X., Li J. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding // Published online January 29, 2020. https://doi.org/10.1016/S0140-6736(20)30251-8
10. Widagdo W., Begeman L., Schipper D. et al. Tissue distribution of the MERS coronavirus receptor in bats // Sci. Reports. 2017. 1193. https://doi.org/10.1038/s41598-017-01290-6
11. van den Brand J., Smits S.L., Haagmans B.L. Pathogenesis of Middle East respiratory syndrome coronavirus // J. Pathol. 2015. V. 235. P. 175-184. https://doi.org/10.1002/path.4458
12. Kuba K., Imai Y., Rao S. et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury // Nature Medicine. 2005. V. 11. P. 875-879.
13. Fan Y., Zhao K., Shi Z-L., Zhou P. Bat coronaviruses in China // Viruses. 2019. V. 11. 210. https://doi.org/10.3390/v11030210
14. Zhao Y., Zhao Z., Wang Y. et al. Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov // BioRxiv. 2020. Jan. 26. https://doi.org/10.1101/2020.01.26.919985
15. Towner J.S., Amman B.R., Sealy T.K. et al. Isolation of genetically diverse Marburg viruses from Egyptian fruit bats // PLoS Pathog. 2009. V. 5. № 7. e1000536. https://doi.org/10.1371/journal.ppat.1000536
16. Wang L.F., Cowled C. Bats and Viruses: A New Frontior of Emerging Infectious Diseases; John Wiley Sons Inc.: Hoboken, NJ, USA. 2015.
17. Lau S.K., Li K.S., Huang Y. et al. Ecoepidemiology and complete genome comparison of different strains of severe acute respiratory syndrome- related Rhinolophus bat coronavirus in China reveal bats as a reservoir for acute, self-limiting infection that allows recombination events // J. Virol. 2010. V. 84. P. 2808-2819.
18. Yang X.L., Tan C.W., Anderson D.E. et al. Characterization of a filovirus (Mengla virus) from Rousettus bats in China // Nature Microbiology. 2019. V. 4. P. 390-395. https://doi.org/10.1038/s41564-018-0328-y
19. Zhou P., Tachedjian M., Wynne J.W. et al. Contraction of the type I IFN locus and unusual constitutive expression of IFN-alpha in bats // Proc. Natl. Acad. Sci. USA. 2016. V. 113. P. 2696-2701.
20. Woo P.C., Lau S.K., Li K.S. et al. Genetic relatedness of the novel human group c betacoronavirus to tylonycteris bat coronavirus HKU4 and pipistrellus bat coronavirus HKU5 // Emerg. Microbes Infect. 2012. V. 1. https://doi.org/10.1038/emi.2012.45
21. Annan A., Baldwin H., Corman V.M. et al. Human Betacoronavirus 2c EMC/2012 - related Viruses in Bats, Ghana and Europe // Emerging Infectious Diseases. 2013. V. 19. № 3. P. 2456-2459. http://dx.doi.org/10.3201/eid1903.121503
22. Ge X-Y., Wang N., Zhang W. et al. Coexistence of multiple coronaviruses in several bat colonies in an abandoned mineshaft // Virologica Sinica. 2016. V. 31, № 1. P. 31-40. https://doi.org/10.1007/s12250-016-3713-9
23. Zhu Y., Li Ch., Chen L. et al. A novel human coronavirus OC43 genotype detected in mainland China // Emerging Microbes & Infections. 2018. V. 7. 173. https://doi.org/10.1038/s41426-018-0171-5
24. Corman V.M., Kallies R., Philipps H. et al. Characterization of a novel betacoronavirus related to middle East respiratory syndrome coronavirus in European hedgehogs // J. Virol. 2014. V. 88. P. 717-724.
25. Monchatre-Leroy E., Boue F., Boucher J.M. et al. Identification of alpha and beta coronavirus in wildlife species in France: Bats, rodents, rabbits, and hedgehogs // Viruses. 2017. V. 9. № 12. 364. https://doi.org/10.3390/v9120364
26. Saldanha I.F., Lawson B., Goharriz H. et al. Extension of the known distribution of a novel clade C betacoronavirus in a wildlife host // Epidemiology and Infection. 2019. V. 147, e169. P. 1-8. https://doi.org/10.1017/ S0950268819000207
27. Lau S.K.R., Luk H., Wong A.S.P. et al. Wong Identification of a Novel Betacoronavirus (Merbecovirus) in Amur Hedgehogs from China // Viruses. 2019. V. 11. 980. https://doi.org/10.3390/v11110980
28. Subissia L., Posthumab C.C., Collet A. et al. One severe acute respiratory syndrome coronavirus protein complex integrates processive RNA polymerase and exonuclease activities // Proc. Natl. Acad. Sci. USA. 2014. Published online. www.pnas.org/cgi/doi/10.1073/pnas.1323705111 .
29. Pyrc K., Dijkman R., Deng L. et al. Mosaic structure of human coronavirus NL63, one thousand years of evolution // J. Mol. Biol. 2006. V. 364. P. 964973. https://doi.org/10.1016/j.jmb.2006.09.074
30. Cavanagh D. Mawditt K., Adzharet A. al. Does IBV change slowly despite the capacity of the spike protein to vary greatly? // Adv. Exp. Med. Biol. 1998. V. 440. P. 729-734.
31. Su S., Wong G., Shi W. et al. Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses // Trends in Microbiology. 2016. V. 24, № 6. https://doi.org/10.1016/j.tim.2016.03.003
29. Gralinski L.E., Baric R.S. Molecular pathology of emerging coronavirus infections // J. Pathol. 2015. V. 235. P. 185-195. https://doi.org/10.1002/path.4454
30. Zhao J., Li K., Wohlford-Lenane C. et al. Rapid generation of a mouse model for Middle East respiratory syndrome // Proc Natl Acad Sci USA. 2014. V. 111. P. 4970-4975. https://doi.org/10.1073/pnas.1323279111
31. Su S., Wong G., Shi W. et al. Epidemiology, Genetic Recombination, and Pathogenesis of Coronaviruses // Trends in Microbiology. 2016. V. 24, №P. 490-502. http://dx.doi.org/10.1016/j-.tim.2016.03.003
32. Menachery V.D., Yount B.L., Debbink K. et al. SARS-like cluster of circulating bat coronavirus pose threat for human emergence // Nat. Med. 2015. V. 21, № 12. P. 1508-1513. https://doi.org/10.1038/nm.3985/
33. Sheahan T. Rockx B., Donaldson E. et al. Mechanisms of zoonotic severe acute respiratory syndrome coronavirus host range expansion in human airway epithelium // J. Virol. 2008. V. 82. P. 2274-2285. https://doi.org/10.1128/JVI.02041-07
34. Li F. Structure, Function, and Evolution of Coronavirus Spike Proteins // Annu Rev Virol. 2016. V. 29; P. 237-261. https://doi.org/10.1146/annurev-virology-110615-042301
35. Bolles M., Deming D., Long K. et al. A double-inactivated severe acute respiratory syndrome coronavirus vaccine provides incomplete protection in mice and induces increased eosinophilic proinflammatory pulmonary response upon challenge // J. Virol. 2011. V. 85. P. 12201-12215. https://doi.org/10.1128/JVI.06048-11
36. Chen N., Zhou M., Dong X. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study // www.thelancet.com Published online January 29, 2020 https://doi.org/10.1016/S0140-6736(20)30211-7
37. Fehrenbach H. Alveolar epithelial type II cell: defender of the alveolus revisited // Respir. Res. 2001. V. 2, № 1. P. 33-46. https://doi.org/10.1186/rr36
38. Chambers R.C., Scotton C.J. Coagulation cascade proteinases in lung injury and fibrosis // Proc. Am. Thorac. Soc. 2012. V. 9. P. 96-101.
39. Smits S.L., van den Brand J.M., de Lang A. et al. Distinct severe acute respiratory syndrome coronavirus- induced acute lung injury pathways in two different nonhuman primate species // J. Virol. 2011. V. 85. P. 4234-4245. https://doi.org/10.1128/JVI.02395-10
40. Van Doremalen N., Bushmaker T., Munster V.J. Stability of Middle East respiratory syndrome coronavirus (MERS-CoV) under different environmental conditions // Euro Surveill. 2013. V. 18, № 38. https://doi.org/10.2807/1560-7917.es2013.18.38.20590
41. Chan K.H., Peiris J.S.M., Lam S.V. et al. The Effects of Temperature and Relative Humidity on the Viability of the SARS Coronavirus // Adv. Virol. 2011. Published online 2011/ Oct 1. https://doi.org/10.1155/2011/734690
42. McKinney K.R., Gong Y.Y., Lewis T.G. Environmental transmission of SARS at Amoy Gardens // J. Environ. Health. 2006. V. 68, № 9. P. 26-30.
43. Mullis L, Saif L.J., Zhang Y. et al. Stability of Bovine Coronavirus on Lettuce Surfaces Under Household Refrigeration Conditions // Food Microbiol. 2012. V. 30, № 1. P. 180-186. https://doi.org/10.1016/j-fm.2011.12.009
44. Casanova L., Rutala W.A., Weber D.J., Sobsey M.D. Survival of surrogate coronaviruses in water // Water Res. 2009. V. 43, № 7. P. 1893-1898. https://doi.org/10.1016/j.watres.2009.02.002
45. FAO/WHO. Viruses in food: scientific advice to support risk management activities: Meeting Report. 2008.
46. Muthumani K., Falzarano D., Reuschel E.L. et al. A synthetic consensus anti-spike protein DNA vaccine induces protective immunity against middle east respiratory syndrome coronavirus in nonhuman primates // Sci. Trans. Med. 2015. V. 7. https://doi.org/10.1126/scitranslmed.aac7462
47. Yong C.Y., Ong H.K., Yeapetal. Recent S.K. et al. Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus // Front Microbiol. 2019. V. 10. 1781. Published online 2019. Aug 2. https://doi.org/10.3389/fmicb.2019.01781
48. Yip M.S., Leung N.H.L., Cheung C.Y. et al. Antibody-dependent infection of human macrophages by severe acute respiratory syndrome coronavirus // Virol. J. 2014. V. 11. 82 p. https://doi.org/10.1186/1743-422X-11-82
49. Jaume M., Yip M.S., Cheung C.Y. et al. Anti- Severe Acute Respiratory Syndrome Coronavirus Spike Antibodies Trigger Infection of Human Immune Cells via a pH- and Cysteine Protease-Independent FcR Pathway // J. Virol. 2011. V. 85, № 20. P. 10582-10597. https://doi.org/doi:10.1128/JVI.00671-11
50. Yip M.S., Cheung C.Y., Li P.H. et al. Investigation of antibody-dependent enhancement (ADE) of SARS coronavirus infection and its role in pathogenesis of SARS // BMC Proc. 2011. V. 5 (Suppl. 1). P. 80.
51. Jaume M., Yip M.S., Kam Y.W. et al. SARS CoV subunit vaccine: antibody-mediated neutralisation and enhancement // Hong Kong Med. J. 2012. V. 18 (Suppl. 2). P. 31-36.
52. Weingartl H., Czub M., Czub S. et al. Immunization with modified vaccinia virus ankara- based recombinant vaccine against severe acute respiratory syndrome is associated with enhanced hepatitis in ferrets // J. Virol. 2004. V. 78. P. 12672-12676. https://doi.org/10.1128/JVI.78.22.12672-12676
53. Czub M., Weingartl H., Czub S. et al. Evaluation of modified vaccinia virus ankara based recombinant SARS vaccine in ferrets // Vaccine. 2005. V. 23. P. 22732279. https://doi.org/10.1016/j-.vaccine.2005.01.033
54. Wang S.F., Tseng S.P., Yen C.H. et al. Antibody- dependent SARS coronavirus infection is mediated by antibodies against spike proteins // Biochem Biophys Res Commun. 2014. V. 451. P. 208-214. https://doi.org/10.1016/j.bbrc.2014.07.090
55. Takada A., Kawaoka Y. Antibody-dependent enhancement of viral infection: molecular mechanisms and in vivo implications // Reviews in medical virology. 2003. V. 13, № 6. P. 387-398. https://doi.org/10.1002/rmv.405
56. Kuba K., Imai Y., Rao S. et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury // Nature Medicine. 2005. V. 11. P. 875-879.
57. Ren L.L., Wang Y.M., Wu Z.Q. et al. Identification of a novel coronavirus causing severe pneumonia in human: a descriptive study // Chin. Med. J. (Engl). 2020. V. 30. https://doi.org/10.1097/CM9.0000000000000722 [Epub ahead of print]
58. Cascella M., Rajnik M., Cuomo A. et al. Features, Evaluation and Treatment Coronavirus (COVID-19) [Updated 2020 Mar 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. URL: https://www.ncbi.nlm.nih.gov/books/NBK554776/.
59. Benvenuto D., Giovannetti M., Ciccozzi A. et al. The 2019-new coronavirus epidemic: evidence for virus evolution // J. Med. Virol. 2020. V. 92, № 4. P. 455-459. https://doi.org/10.1002/jmv.25688
60. Angeletti S., Benvenuto D., Bianchi M. et al. COVID-2019: The role of the nsp2 and nsp3 in its pathogenesis // J. Med Virol. 2020. 1-5. https://doi.org/10.1002/jmv.25719
61. Gadlage M.J., Graham R.L., Denison M.R. Murine Coronaviruses Encoding nsp2 at Different Genomic Loci Have Altered Replication, Protein Expression, and Localization // J. Virol. 2008 V. 82. P. 11964-11969. https://doi.org/10.1128/JVI.01126-07
62. Saikatendu K., Joseph J., Subramanian V. et al. Structural Basis of Severe Acute Respiratory Syndrome Coronavirus ADP-ribose-1''-phosphate Dephosphorylation by a Conserved Domain of nsP3 // Structure. 2005. V. 13. № 11. P. 1665-1675. https://doi.org/10.1016/j.str.2005.07.022
63. Lei J., Kusov Y., Hilgenfeld R. Nsp3 of Coronaviruses: Structures and Functions of a Large Multi-Domain Protein // Antiviral Res. 2018. V. 149. P. 58-74. https://doi.org/10.1016/j-.antiviral.2017.11.001
64. Xu. X.-T., Chen P., Wang J. et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission // Science China Life Sciences. 2020. V. 63. № 3. Р. 457-460. https://doi.org/10.1007/s11427-020- 1637-5
65. Molecular Identification of Betacoronavirus in Bats From Sardinia (Italy): First Detection and Phylogeny // Virus Genes. 2019. V. 55. P. 60-67. https://doi.org/10.1007/s11262-018-1614-8
66. Rizzo F., Edenborough K.M., Toffoli R. et al. Coronavirus and Paramyxovirus in Bats From Northwest Italy // BMC Vet Res. 2017. V. 13, № 1. https://doi.org/10.1186/s12917-017-1307-x
67. Giovanetti M., Benvenuto D., Angeletti S., Ciccozzi M. The First Two Cases of 2019-nCoV in Italy: Where They Come From? // J. Med. Virol. 2020. V. 92, № 5. P. 518-521. https://doi.org/10.1002/jmv.25699
68. Kim J-M., Chung Y-S., Jo H.J. et al. Identification of Coronavirus Isolated from a Patient in Korea with COVID-19 // Osong Public Health and Research Perspectives. 2020. V. 11. № 1. P. 3-7. https://doi.org/10.24171/j.phrp.2020.11.1.02
69. Corman V.M., Landt O., Kaiser M. et al. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 2020. V.25. No 3:pii=2000045. https://doi.org/10.2807/1560-7917.
70. Zhang J-J., Dong X., Cao Y-Y. et al. Clinical characteristics of 140 patients infected with SARS- CoV-2 in Wuhan, China // Allergy. 2020. 00. P. 1-12 (17 Februar). https://doi.org/10.1111/all.14238
71. Zu Z., Jiang M-D., Xu P=P. et al. Coronavirus Disease 2019 (COVID-19): A Perspective From China // Radiology. 2020. Feb 21 [Online ahead of print]. https://doi.org/10.1148/radiol.2020200490
72. Huang С., Wang Y, Li X. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China // www.thelancet.com. Published online 2020. January 24. https://doi.org/10.1016/S0140-6736(20)30183-5
Об авторе
Федеральное государственное бюджетное учреждение «27 Научный центр» Министерства обороны Российской Федерации, 105005, Российская Федерация, г. Москва, Бригадирский переулок, д. 13. Супотницкий Михаил Васильевич. Главный специалист, канд. биол. наук, ст. науч. сотр.
Контактное лицо: Супотницкий Михаил Васильевич; 27nc_1@mil.ru
Novel coronavirus SARS-CoV-2 in the context of global epidemiology of coronavirus infections
M.V. Supotnitskiy
Federal State Budgetary Establishment «27 Scientific Centre» of the Ministry of Defence of the Russian Federation,
Brigadirskii Lane 13, Moscow 105005, Russian Federation
The seemingly unexpected appearance of SARS-CoV-2 in China and its subsequent rapid spread throughout the world make us think seriously about the coronavirus threat emanating from natural foci in the territory of our country. The aim of this work is to study SARS-CoV-2 in the context of real global epidemiology of coronavirus infections. The data of Chinese scientists, published in English- language scientific journals, has been used during the preparation of the article. Their analysis showed the vast spread of viruses of this taxon among bats and hedgehogs in the natural ecosystems of Europe as well. To date the host of SARS-CoV-2 virus, intermediate between bats and humans, as well as the intermediate coronavirus, the direct predecessor of SARS-CoV-2, have not been detected. The bulk of the coronavirus genome is conservative, but it appears to be extremely prone to genetic recombination in vivo, so the virus can be redirected both in natural and artificial conditions from wild animals to humans by changing the structure of the S1 protein. The pathogenesis of coronavirus infections in humans that causes severe acute respiratory syndrome (SARS), include the specific recognition of receptors on target cells in the lower parts of human lungs, the penetration of the virus into the target cells, viral replication, generation of cytokine responses, that destroy the lower parts of the lungs, and the appearance of the phenomenon of antibody-dependent enhancement of the infection, that results in generalized spread of the virus. The virulence of SARS-CoV-2 for humans is significantly lower than that of the coronaviruses that caused SARS in 2002-2003 in China and the Middle East respiratory syndrome in the Middle East in 2012. However, due to the higher stability of the virus when penetrating the endosomes of the cell and the effectiveness of the replication/transcription complex, the virus replicates to large enough numbers to transmit easily from ill people to healthy. Different ethnic groups have different sensitivity to SARS-CoV-2 because of the different amounts of ACE2 receptors on the surface of type II pneumocytes. The article also sketches certain clinical observations made by Chinese researchers during an outbreak of coronavirus infection caused by SARS-CoV-2. The author states, that effective and timely diagnosis of COVID-19 is possible only by the combination of molecular diagnostics of SARS-CoV-2 and the detection of characteristic pneumonic foci by computed tomography.
Key words: Alphacoronavirus; atypical pneumonia; Betacoronavirus; respiratory tract; zoonoses; computer tomography; coronavirus; interspecies transmission; pathogenesis; COVID-19; SARS-CoV-2.
For citation: Supotnitskiy M.V. Novel coronavirus SARS-CoV-2 in the context of global epidemiology of coronavirus infections // Journal of NBC Protection Corps. 2019. V 4. № 1. P. 32-65. https://doi. org/10.35825/2587-5728-2020-4-1-32-65
Conflict of interest statement
The authors declare that the research was conducted in the absence of any commercial or financial relationship that could be construed as a potential conflict of interest.
Peer review information
The article has been peer reviewed by two experts in the respective field. Peer reviews are available from the Editorial Board.
References
See P. 61-64.
Authors
Federal State Budgetary Establishment «27 Scientific Centre» of the Ministry of Defence of the Russian Federation. Brigadirskii Lane 13, Moscow 105005, Russian Federation.
Mikhail Vasilyevich Supotnitskiy. Senior Researcher. Chief Specialist. Candidate of Biological Sciences.
Contact person: Mikhail Vasilievich Supotnitskiy; 27nc_1@mil.ru
[1] Название новой болезни и вызвавшего ее вируса было определено ВОЗ 11.02.2020 г. следующим образом:
возбудитель болезни – коронавирус острого респираторного синдрома 2 (severe acute respiratory syndrome coronavirus 2, SARS-CoV-2). Болезнь – коронавирусное заболевание 2019 (Coronavirus Disease 2019, COVID-19). В тексте название вируса выделено жирным шрифтом. Распространение SARS-CoV-2 с указанием количества заболевших (с подтвержденным диагнозом), выздоровевших, находящихся на лечении и погибших по странам отражается в реальном времени на ресурсе Университета Джонса Хопкинса (США) – Coronavirus COVID-19 Global Cases by Johns Hopkins CSSE. URL: https://gisanddata.maps.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6 (дата обращения: 29.02.2020).
[2] Такой точки зрения придерживаются в Иране – см. Сoronavirus may be a product of US ‘biological attack'aimed at Iran & China, IRGC chief claims. URL: https://www.rt.com/news/482405-iran-coronavirus-us-biological-weapon/?utm_source=miximedia&utm_medium=miximedia&utm_campaign=Miximedia (дата обращения: 07.03.2020).
[3] Тяжелый острый респираторный синдром (Severe acute respiratory syndrome, SARS; «атипичная пневмония») – обнаруженное в 2002 г. в южно-китайской провинции Гуандун тяжелое заболевание легких человека. Источником заражения людей стали циветты – дикие хищные зверьки семейства виверровых, внешне похожие одновременно на кошку, енота и гиеновидную собаку. Масса животного достигает 12 кг. Мясо циветт широко употребляется в пищу в Южном Китае и странах Юго-Восточной Азии. Как новую и опасную инфекционную болезнь ТОРС описал итальянский врач Карло Урбани (итал. Carlo Urbani; 1956–2003), умерший 29 марта 2003 г. в Бангкоке от этой болезни.
[4] Спаренные основания – пара двух азотистых оснований нуклеотидов на комплементарных цепочках нуклеиновых кислот (противоположных ДНК или одинаковых РНК), соединенная с помощью водородных связей. Как единицы измерения название обычно сокращается до «bp» (от англ. base pair). В русскоязычной литературе иногда также используется сокращение п.н. – пара нуклеотидов. Кроме того, применяются производные единицы: т.п.о. (т.п.н.; kilobase, kb) – тысяча пар оснований.
[5] Когда эта статья версталась, вышла обстоятельная статья М.Ю. Щелканова с соавт. История изучения и современная классификация коронавирусов (Nidovirales: Coronaviridae). https://doi.org/10.15789/2220-7619-HOI-1412
[6] Ангиотензинпревращающий фермент 2 (аngiotensin converting enzyme 2, ACE2; АПФ2; КФ:3.4.17.23) – экзопептидаза, аналог АПФ-трансмембранного белка. Катализирует превращение ангиотензина I в ангиотензин 1-9 и ангиотензина II в ангиотензин 1-7, пептида, оказывающего действие, противоположное действию АПФ. АПФ – центральный компонент системы ренин-ангиотензин, регулирующей артериальное давление. Ингибиторы АПФ (эналаприл, каптоприл, лизиноприл, периндоприл, моноприл и др.) широко используются в качестве гипотензивных препаратов.
[7] Известно не менее 1,3 тыс. видов летучих мышей.
[8] Из-за развития промышленности в дельте Жемчужной реки в провинции Гуандун на юге Китая разведение циветт в последние годы увеличилось в 50 раз. Их покупают живыми и держат в подсобном помещении ресторанов с традиционной китайской кухней. И, видимо, они еще не раз станут источником новых коронавирусов для местного населения. URL: https://www.lefigaro.fr/sciences/l-emergence-du-nouveau-coronavirus-un-phenomene-naturel-favorise-par-les-activites-humaines-20200324 (дата обращения: 25.03.2020).
[9] Zhang Сh. et al. Protein Structure and Sequence Reanalysis of 2019-nCoV Genome Refutes Snakes as Its Intermediate Host and the Unique Similarity between Its Spike Protein Insertions and HIV-1 // J. Proteome Res. 2020. 20 марта. URL: https://pubs.acs.org/doi/abs/10.1021/acs.jproteome.0c00129 (дата обращения: 30.03.2020).
[10] Позитивно-смысловая (positive-sense) РНК - вирусная РНК, имеющая ту же последовательность оснований, что и мРНК; во время репликации она функционирует как мРНК и служит шаблоном для синтеза белка.
[11] Размер генома SARS-CoV-2, выделенного в КНР от первых больных, находится в пределах 29,8 т.п.н.
[12] Открытая рамка считывания (open reading frames, ORF) - последовательность нуклеотидов в составе ДНК или РНК, потенциально способная кодировать белок. Основным признаком наличия ORF служит наличие стартового кодона (в подавляющем большинстве случаев - AUG) и отсутствие стоп-кодона на достаточно длинном для синтеза белка участке нуклеотидной последовательности.
[13] Процессинг или посттрансляционная модификация белков - превращение полипептида в активный белок.
[14] РНК-зависимая РНК-полимераза (RdRP от англ. RNA-dependent RNA-polymerase) или РНК-репликаза - фермент, катализирующий репликацию РНК (синтез РНК по матрице РНК). РНК-зависимые РНК-полимеразы - важнейшие ферменты, закодированные в геноме всех РНК-содержащих вирусов, жизненный цикл которых протекает без стадии ДНК. Преимуществом данной схемы жизненного цикла вируса является отсутствие стадии вирусной ДНК, благодаря чему его репликация осуществляется быстрее.
[15] ER-Golgi-промежуточный компартмент (ER-Golgi intermediate compartment, ER-Golgi или ERGIC) - орга- нелла в эукариотических клетках. Обеспечивает транспортировку белков между эндоплазматическим рети- кулюмом и комплексом Гольджи.
[16] Имеются в виду точечные замены нуклеотидов. Сайт (в данном контексте) - местоположение точечной мутации.
[17] Гомологичная рекомбинация - тип генетической рекомбинации (т.е. перераспределения генетического материала путем разрыва и соединения разных молекул, приводящее к появлению новых комбинаций генов или других нуклеотидных последовательностей), во время которой происходит обмен нуклеотидными последовательностями между двумя похожими или идентичными геномами.
[18] Обратная генетика - исследователи манипулируют последовательностями генов, изменяя или выключая тот или иной ген, и анализируют, к каким изменениям это приводит. Это путь обратной генетики: от гена к признаку/фенотипу, а не наоборот (прямая генетика).
[19] Работа в конце 2015 г. вызвала дебаты по поводу безопасности описанных экспериментов. Саймон Уэйн- Хобсон (Simon Wain-Hobson), вирусолог из Института Пастера в Париже (Pasteur Institute in Paris), отметил, что исследователи создали новый вирус, который «замечательно хорошо растет» в клетках человека. «Если вирус вырвется, никто не сможет предсказать траекторию». См. URL: https://www.nature.com/news/engineered-bat-virus-stirs-debate-over-risky-research-1.18787 (дата обращения: 01.03.2020). Еще менее надежно можно «предсказать траекторию», если не проводить такие эксперименты. Однако участие китайского вирусологического центра в Ухани в этих исследованиях породило в США конспирологическую теорию, что якобы SARS-CoV-2 создан китайскими учеными и распространился по миру, «вырвавшись» из лаборатории в Китае. Первый англоязычный твит, в котором изложена эта «теория», был опубликован в американских социальных сетях 20.01.2020 г. См. URL: https://www.washingtonpost.com/outlook/2020/04/02/yes-russia-spreads-coronavirus-lies-they-were-made-america/ (дата обращения: 02.04.2020).
[20] Работы проводились в условиях уровня биобезопасности BSL3. Применяется для работы с микроорганизмами, которые могут вызвать потенциально смертельные заболевания при вдыхании аэрозоля. Более подробно об уровнях биобезопасности см. URL: https://en.wikipedia.org/wiki/Biosafety_levelfBiosafety_level_3 (дата обращения: 04.03.2020).
[21] Гомологичные последовательности называют ортологичными, если к их разделению привел акт видообразования.
[22] Более подробно о структуре, функции и эволюции белка S можно прочитать в работе F. Li [34].
[23] По уменьшению количества бляшек на клетках Vero E6 после совместного инкубирования мАТ и вируса.
[24] Почему это происходит, рассмотрим в разделе «Особенности ответа иммунной системы на коронавирус- ную инфекцию».
[25] Интересен и состав исследовательских организаций: Departments of Epidemiology, University of North Carolina at Chapel Hill, Chapel Hill, NC (США); Microbiology and Immunology, University of North Carolina at Chapel Hill, Chapel Hill, NC (США); National Center for Toxicological Research, Food and Drug Administration, Jefferson, AR (США); Department of Cell Biology and Physiology, University of North Carolina at Chapel Hill, Chapel Hill, NC (США); Marsico Lung Institute/Cystic Fibrosis Center, University of North Carolina at Chapel Hill, Chapel Hill, NC (США); Institute for Research in Biomedicine, Bellinzona, Switzerland Institute of Microbiology, ETH Zurich, Zurich (Швеция); Department of Cancer Immunology and AIDS, Dana-Farber Cancer Institute (США); Department of Medicine, Harvard Medical School, Boston Massachusetts (США); Key Laboratory of Special Pathogens and Biosafety, Wuhan Institute of Virology, Chinese Academy of Sciences (Юхань, КНР). Клетки Vero E6, использованные для конструирования химерного вируса SHC014-CoV, получены из USAMRIID (U.S. Army Medical Research Institute of Infectious Diseases, Форт Детрик, штат Мэриленд, США).
[26] Экспрессия гена - реализация генетической информации, закодированной в последовательности нуклеотидов молекулы ДНК.
[27] MERS-CoV вызывает у людей ARDS по аналогичному механизму, но взаимодействуя с рецептором DPP4 [29].
[28] Гиалин – это фибриллярный белок. При иммуногистохимическом исследовании в нем обнаруживают белки плазмы крови, фибрин, компоненты иммунных комплексов (иммуноглобулины, фракции комплемента), липиды.
[29] В работе не используется понятие «иммуногенный» применительно к антигенам коронавирусов из-за того, что термин «иммунитет» (лат. Immunitas – освобождение, избавление от чего-либо) означает невосприимчивость, сопротивляемость организма к инфекции. В данном случае ничего похожего в ответ на коронавирусную инфекцию не происходит.
[30] Т-клеточный ответ – иммунный ответ клеточного типа базируется на активности Т-лимфоцитов. Деструкцию и элиминацию чужеродного антигена осуществляют цитотоксические лимфоциты и активированные иммунной системой лейкоциты воспалительной реакции. В-клеточный ответ – гуморальный иммунный ответ, определяется участием сывороточных антител. Это два звена приобретенного иммунитета с разным составом участников и различным предназначением, но имеющие одну общую цель – устранение чужеродного антигена. Для противовирусных вакцин важно индуцировать оба звена иммунитета.
[31] Более подробно о зависимости феномена нейтрализации вирусов и усиления инфекции от концентрации специфических антител см. в работе A. Takada и Y. Kawaoka [55].
[32] Клинические исследования I фазы для проверки профиля безопасности вакцины против MERS-CoV осуществлялись на людях-добровольцах в Научно-исследовательском институте армии США им. Уолтера Рида (Walter Reed Army Institute of Research, United States). См. URL: https://clinicaltrials.gov/ct2/show/NCT02670187?term=GLS-5300 (accessed February 25, 2019). Что не удивительно, так как из-за высокой летальности среди заболевших (до 37 %) он рассматривается как потенциальный поражающий агент биологического оружия [56].
[33] Для CoV-вакцин и этот этап очень дорогостоящий, но так как недорогих экспериментальных моделей (мыши, хомяки) не существует, его провести можно только на специально созданных трансгенных животных (например, имеющих рецепторы ACE2 у пневмоцитов I и II типов), а завершить – на макаках.
[34] Клинические исследования вакцин включают 4 фазы. Более подробно см. URL: https://en.wikipedia.org/wiki/Clinical_trial и https://yaprivit.ru/o-vaccinah/control-nad-proizvodstvom-vaccin/ (дата обращения: 20.02.2020).
[35] Руководство КНР считает, что вспышка коронавирусной инфекции началась еще летом 2019 г. в США, что подтверждает выступление главы американского Центра по предупреждению и контролю заболева- ний Роберта Редфилда (Robert R. Redfield, 1951 г.р.) в Палате представителей Конгресса. Редфилд сообщил Конгресу, что у нескольких умерших американцев, которым диагностировали грипп, при посмертном обследовании был обнаружен коронавирус. Видео см. URL: https://twitter.com/zlj517/status/1238111898828066823?fbclid=IwAR1-J9ndyOxnzYer-RfnnLLqZbNUdzjJd9qKLhd1cxMwBf9k3CmNzzsCN8A (дата обращения: 20.03.2020). Однако доказательств того, что вспышки в США и Китае были вызваны одним вирусом, китайскими специалистами не было приведено.
[36] 31.12.2019 г. в региональное бюро ВОЗ в КНР было впервые сообщено об эпидемии случаев необъяснимых инфекций нижних дыхательных путей в Ухане. Поскольку китайские врачи не смогли сразу определить возбудителя, эти первые случаи были классифицированы как «пневмония неизвестной этиологии». Китайский центр по контролю и профилактике заболеваний (CDC) и местные CDC разработали программу интенсивного расследования вспышек.
[37] URL: http://virological.org/ и https://www.gisaid.org/ (дата обращения: 20.01.20).
[38] Первым днем, когда в Китае не было установлено ни одного нового заболевшего COVID-19, считается 18.03.2020 г. Новые заболевшие есть, но все они заразились за рубежом. Летальность зараженных снизилась до однозначных чисел. Общее число китайцев, заразившихся на эту дату SARS-CoV-2, составило 80 928 человек, более 70 тыс. выздоровели. China ‘still at risk of second wave of coronavirus cases' despite first day with no domestic cases/South China Morning Post. 19.03.2020. URL: https://www.scmp.com/news/china/society/article/3075872/zero-new-domestic-coronavirus-cases-china-first-time-epidemic (дата обращения: 19.03.2020). Однако вирус уже проник через границы страны, и большое количество подтвержденных случаев в других странах подтолкнуло ВОЗ 11.03.2020 г. объявить распространение COVID-19 глобальной пандемией. По состоянию на 23 марта в мире насчитывалось не менее 332 930 пациентов с подтвержденным диагнозом COVID-19, из них 14 510 умерли (~4,2 %).
[39] См. Coronavirus COVID-19 Global Cases by Johns Hopkins CSSE. URL: https://gisanddata.maps.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6 (дата обращения: 29.02.2020).
[40] См. раздел «Таксономия и происхождение коронавирусов».
[41] Все Nsp являются высококонсервативными белками [6].
[42] Nsp2 – белок с ММ 65 кДа, имеет минимальную идентичность или сходство последовательностей среди различных групп коронавирусов. Функция не понятна, но варианты SARS-CoV с нефункционирующим мутантным геном nsp2 демонстрируют снижение пикового титра на 90 % и снижение синтеза вирусной РНК на 50 % [61].
[43] Nsp2 – белок с ММ 65 кДа, имеет минимальную идентичность или сходство последовательностей среди различных групп коронавирусов. Функция не понятна, но варианты SARS-CoV с нефункционирующим мутантным геном nsp2 демонстрируют снижение пикового титра на 90 % и снижение синтеза вирусной РНК на 50 % [61].
[44] Аминокислоты, содержащие полярные группы, сильно взаимодействующие с водой, называют гидрофильными аминокислотами (Asp, Gly, Lis, His, Arg, Gly, Ser, Thr). Такие аминокислотные звенья обычно располагаются на поверхности частиц белка. Аминокислоты, имеющие неполярные боковые заместители, не несут парциальных зарядов и не сольватируются заметно водой (проявление гидрофобности) – глицин и аланин. Они преимущественно располагаются внутри белковой молекулы, сводя тем самым к минимуму их соприкосновение с водой. То есть замена полярной (гидрофильной) аминокислоты на неполярную (гидрофобную) серьезно сказывается на конформации белковой молекулы.
[45] Нуклеофил – реагент, образующий химическую связь с партнером по реакции (электрофилом) по донорно-акцепторному механизму, предоставляя электронную пару, образующую новую связь.
[46] Выборка Y. Zhao с соавт. [14] недостаточна для обнаружения связи между количеством клеток, экспрессирующих ACE2, и возрастом пациента. Возможно, что такая связь существует и более тяжелое течение инфекции SARS-CoV-2 у пожилых людей обусловлено большим количеством экспрессируемых в популяции AT2 рецепторов ACE2.
[47] Параллельно с Китаем, c 19.01.2020 г. злокачественная эпидемия коронавирусной инфекции развивается в Италии. В этой стране, особенно в ее северной части и в Сардинии, несколько лет назад были выявлены инфицированные коронавирусами летучие мыши: Rhinolophus ferrumequinum, Plecotus auritus и Tadarida teniotis. Филогенетические анализы, основанные на последовательностях РНК-зависимой РНК-полимеразы (RdRp), связывают обнаруженных CoV с SARS-подобными CoV летучих мышей [65]. Обнаружено и совместное сосуществование в летучих мышах Италии P. pipistrellus CoV и парамиксовирусов [66, 67]. Поэтому можно предположить, что причиной этой вспышки на Апеннинском полуострове и Сардинии могли стать собственные природные очаги коронавирусов.
[48] Детальное описание применения RT-PCR для диагностики SARS-CoV-2 см. в работе V.M. Corman с соавт. [69].
[49] Симптом «матового стекла» – неспецифический радиологический симптом, отражающий различные патологические изменения в легочной ткани на уровне альвеол. Визуализируется при компьютерной томографии как туманное, матовое снижение прозрачности легочной ткани с дифференцируемым рисунком сосудов и бронхов на этом фоне. Может быть обусловлен частичным снижением воздушности легочных альвеол (транссудативной, экссудативной или иной природы), их частичным спадением (гиповентиляцией) или утолщением их стенок.
[50] Легочная консолидация (легочное опеченение) – уплотнение легочной ткани за счет заполнения воздушных в норме альвеол жидкостями (экссудатом, транссудатом, кровью, водой и т.д.). При рентгенографии, или компьютерной томографии легочная консолидация представляет собой участки легких, непроницаемые для рентгеновских лучей, на фоне которых не прослеживается сосудистый рисунок легочной ткани (в отличие от менее выраженного снижения воздушности по типу «матового стекла»). Консолидация наиболее типична для сформировавшейся зоны пневмонического очага.
[51] Индекс оксигенации (oxygenation index, OI; респираторный индекс, PaO2/FiO2) -параметр, используемый в анестезиологии-реаниматологии и интенсивной терапии для оценки функции обмена кислорода в легких. Расчет OI производят по формуле - как соотношение PaO2/FiO2 (отношение парциального напряжения кислорода в артериальной крови к фракции кислорода на вдохе). Является качественным признаком для определения степени острой дыхательной недостаточности. В норме OI равен примерно 500. Снижение OI считается одним из главных критериев острого респираторного дистресс-синдрома.
[52] World Health Organization. Clinical management of severe acute respiratory infection when novel coronavirus (2019-nCoV) infection is suspected. 2019. URL: https://www.who.int/csr/disease/coronavirus_infections/InterimGuidance_ClinicalManagement_NovelCoronavirus_11Feb13u.pdf?ua=1&ua=1 . Accessed February 11, 2020. General Office of National Health Committee. Office of State Administration of Traditional Chinese Medicine. Notice

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.

