Перспективные методические подходы к доклиническому исследованию биомедицинских клеточных продуктов и возможные показатели их качества
(в соавторстве с Елаповым АА, Борисевичем ИВ, Климовым ВИ, Лебединской ЕВ, Мироновым АН, Меркуловым ВА)
Проведенный анализ патентной и научной литературы по получению биомедицинских клеточных продуктов (БМКП) показал, что основные патентоспособные разработки в данной области направлены на восстановление органов и тканей, предотвращение отторжения трансплантата и определение параметров жизнеспособности клеточной линии. Установлено, что в последние годы наметилась тенденция к вытеснению из клинической практики БМКП на основе немодифицированных клеток и линий клеток человека их генетически измененными производными. Основными разработчиками являются несколько десятков западных компаний, обладателей ключевых патентов в данной области. В то же время анализ их патентной активности показал, что технологии получения БМКП прошли через пик своего развития в 2000–2010 гг., но многие проблемы безопасного применения к клинической практике таких продуктов еще не преодолены. Среди них низкая эффективность управления дифференциацией имплантированных клеток; возможность контаминации БМКП инфекционными агентами; неспецифическое иммуносупрессивное действие на организм-реципиент; слабый контроль над экспрессией генов в линиях клеток-трансплантатов, дифференцировавшихся в органе-мишени и ряд других. Данное обстоятельство требует особого внимания со стороны экспертизы к полноте проведенных разработчиками БМКП доклинических исследований и показателям их качества. Проведенный анализ структуры изобретательских решений позволил сформулировать ряд общих требований к доклиническим исследованиям БМКП. Они включают критерии для исследования специфического механизма действия БМКП, эффективности и безопасности его клинического применения. Разработку таких методов целесообразно проводить по группам направлений, различающихся по решаемым разработчиком задачам (восстановление костной ткани, хряща и др.); по способу применения (парентеральное или местное); по сложности доклинического исследования (неизмененные или измененные методами генной инженерии), по происхождению клеток (гомологичные, негомологичные). Показатели качества БМКП, рекомендуемые для включения в нормативную документацию, должны характеризовать назначение БМКП в определенном диапазоне свойств, обеспечивающих эффективность их медицинского применения.
Библиографическое описание: Супотницкий МВ, Елапов АА, Борисевич ИВ, Климов ВИ, Лебединская ЕВ, Миронов АН, Меркулов ВА. Перспективные методические подходы к доклиническому исследованию биомедицинских клеточных продуктов и возможные показатели их качества. Биопрепараты 2015; (1): 36–44.
The analysis of patent and scientific literature on the production of biomedical cell-based products (BMCP) showed that the main patentable developments in this sphere are focused on organ and tissue recovery, preventing transplant rejection and characterization of cell line viability. The researchers have revealed recent tendency for replacing the clinical use of BMCP based on unmodified cells and human cell lines by their genetically modified derivatives. Several dozens of Western companies are the principal developers, holding key patents in this field. At the same time, the analysis of patent activity showed that the technology of BMCP reached its peak of the development in 2000–2010, but many issues related to their safety clinical practice has not been solved yet. The examples of the mentioned issues are low efficiency of implanted cell differentiation maintanance; the possibility of BMCP contamination with infectious agents; nonspecific immunosuppressive effect on recipient organism; poor control of gene expression in transplant cell lines differentiated in a target organ and some others. This fact requires special attention in terms of expert evaluation conducted by the developers of BMCP related to the completeness of preclinical studies and their quality characteristics. The analysis of the structure of inventive solutions allowed to develop a number of general requirements for BMCP preclinical studies. These include specific criteria for the study of BMCP mechanism of action, efficacy and safety of its clinical use. It is rational to develop the mentioned methods according to the groups of issues solved by a developer (bone and cartilage restoration, etc.); the method of administration (local or parenteral); the complexity of preclinical studies (unmodified or modified methods of somatic gene therapy cells); cell origin (homologous, non-homologous). BMCP quality characteristics recommended for inclusion in normative documentation should describe the role of BMCP within a certain range of properties providing their efficacy in clinical use.
Bibliographical description: Supotnickij MV, Elapov AA, Borisevich IV, Klimov VI, Lebedinskaja EV, Mironov AN, Merkulov VA. Promising methodological approaches to preclinical studies of biomedical cell-based products and their possible quality characteristics. Biopreparation (Biopharmaceuticals) 2015; (1): 36–44.
В настоящее время в Российской Федерации формируется научная и законодательная база, позволяющая начать разработку и внедрение в клиническую практику биомедицинских клеточных продуктов (БМКП) [1–3]. К ним относятся комплексы, состоящие из клеточной линии (клеточных линий) и вспомогательных веществ в сочетании с зарегистрированными в установленном порядке лекарственными препаратами и (или) медицинскими изделиями, произведенными и применяемыми для профилактики, диагностики и лечения заболеваний (состояний) пациента, сохранения беременности, а также медицинской реабилитации [3].
БМКП предполагается использовать для профилактики, диагностики и лечения заболевания (состояния), сохранения беременности, медицинской реабилитации пациента путем восстановления структур и функций тканей и органов человека, замещения клеток тканей и органов человека, активации собственных восстановительных процессов организма человека (регенеративная терапия), создания тканей и органов биоинженерными методами (тканевая инженерия), адресной доставки лекарственных препаратов в организм человека, а также путем коррекции иммунных реакций различного типа [3].
В работе использована методология логического системного анализа источников научно-технической и патентной информации. Основное внимание уделено исследованию патентных описаний фирм, ведущих в данной области техники [4, 5]. Патентный поиск проводился по патентным базам Европейского патентного ведомства (ЕП) и Всемирной организации интеллектуальной собственности.
Толчком к развитию технологий БМКП в медицинской практике послужили проблемы, неразрешимые в рамках технологии трансплантации. Несовместимость органов и тканей, отсутствие подходящих доноров, высокая стоимость операций и постоперационного ведения пациента ограничивают внедрение трансплантации в клиническую практику. Технология трансплантации стволовых клеток, как она виделась ее первым разработчикам, должна была составить реальную конкуренцию трансплантологии. Во многом эти надежды оправдались.
Анализ проекта Федерального закона № 717040-6 от 06.02.2015 г. «О биомедицинских клеточных продуктах» позволяет предположить, что в российской клинической практике будет разрешено использование трех видов БМКП: аутологичного, т.е. биомедицинского продукта, содержащего в своем составе клетки клеточной линии определенного человека и предназначенного для применения этим же человеком; аллогенного – биомедицинского продукта, содержащего в своем составе клетки клеточной линии определенного человека и предназначенного для применения другими людьми; комбинированного – биомедицинского клеточного продукта, содержащего в своем составе аутологичные и аллогенные клеточные линии. Сами клеточные линии будут формироваться из незрелых (недифференцированных или стволовых клеток) и ходе направляемой дифференцировки приобретать свойства и характеристики функционально зрелых клеток, обеспечивающие функции органов и тканей организма [3].
К настоящему времени накоплен положительный опыт использования БМКП в клинике. Вместе с тем накоплен и опыт неудач, показывающий, что дифференциацию клеток не всегда удается направлять в нужном направлении [6–8]; возможна обратная дифференцировка клеток [6]; технологии культивирования клеточных линий не исключают контаминацию другими типами клеток и компонентами питательной среды [7]; «приживление» клеток в пораженном органе может не сопровождаться трансдифференцированием [6]; приживляемые клеточные линии могут оказаться функционально малоактивными [9]; оказывать неспецифическое иммуносупрессивное действие [10]; обладать низкой способностью к миграции в поврежденную ткань, пролиферации и дифференцировке в нужном направлении на моделях in vivo [11, 12]. Эти неудачи одновременно являются обоснованием новых задач по разработке БМКП. Среди них первоочередными являются следующие:
- повышение эффективности управления дифференциацией имплантированных клеток;
- исключение контаминации БМКП другими типами клеток, инфекционными агентами (вирусами, бактериями, микоплазмами), прионными белками и компонентами питательной среды;
- управление трансдифференцированием имплантированными клетками и достижение их полного трансдифференцирования в пораженном органе;
- исключение неспецифического иммуносупрессивного действия имплантированных клеток;
- повышение способности имплантированных клеток к миграции в поврежденную ткань;
- управление экспрессией генов в дифференцировавшейся в органе-мишени линии клеток-трансплантатов.
Анализ релевантности основных классов МПК объекту поиска показал, что запатентованные технические решения по БМКП относятся к рубрикам в разделах А (удовлетворение жизненных потребностей человека), С (химия, биотехнология), G (физика, методы исследования). Результаты представлены на рисунке 1.
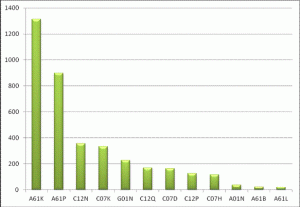 Рис. 1. Распределение по индексам МПК массива патентных документов, защищающих БМКП.
Рис. 1. Распределение по индексам МПК массива патентных документов, защищающих БМКП.
В разделе А основными классами являются A61K 35/28, A61K 35/22 – фармацевтические композиции, содержащие продукт неизвестного строения, в том числе происходящий из человека (отдельные клетки или ткани), A61P – индексы класса, определяющие назначение фармацевтических композиций.
В разделе С основными классами являются индексы класса С12N – биотехнология, непосредственно клетки и способы их получения, C12P – индексы класса, определяющие область применения клеток.
В разделе G основными классами являются G01N 33/53 и связанные с ним индексы – основные методы исследования биологических объектов.
Судя по тому, что большинство патентов, защищающих БМКП, относятся к рубрикам в разделе А, разработчики таких продуктов предпочитают не раскрывать инноваций в технологиях их получения и исследования.
На рисунке 2 представлена динамика патентования БМКП по годам публикаций патентных документов.
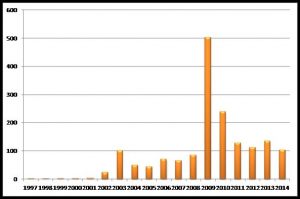 Рис. 2. Динамика патентования изобретений, защищающих БМКП (по годам публикаций).
Рис. 2. Динамика патентования изобретений, защищающих БМКП (по годам публикаций).
Исходя из общей логики развития технических объектов [4] можно предположить, что «пионерские» разработки имели место только на начальном этапе создания БМКП, т.е. до появления «пика» опубликованных патентов на изобретения, приходящегося на конец прошлого десятилетия, затем патентование объектов БМКП замедлилось. Патенты «послепикового периода» содержат описания частных технических решений. По своей сути – это сигнал исчерпания возможностей самой технологии создания БМКП и наличия ограничений, накладываемых на ее развитие владельцами ключевых патентов. Кроме того, надо ожидать появления принципиально новых технологий, решающих задачи, выходящие за рамки, предоставляемые современными технологиями создания БМКП.
Анализ распределения патентов по наименованию правообладателя, позволил установить ведущих разработчиков и правообладателей в данной области (рис. 3), и компании, лидирующие по различным направлениям создания БМКП (табл. 1).
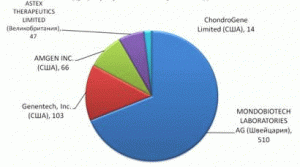 Рис. 3. Ведущие разработчики и правообладатели БМКП (число после названий фирм означает количество выявленных патентных документов).
Рис. 3. Ведущие разработчики и правообладатели БМКП (число после названий фирм означает количество выявленных патентных документов).
Таблица 1. Основные направления создания БМКП и их разработчики
|
Направление разработки |
Количество патентов |
Ведущий разработчик (страна) |
|
Восстановление тканей поджелудочной железы |
8 |
GARNET BIOTHERAPEUTICS, INC. (США) |
|
Восстановление кровотока в ишемизированных тканях |
6 |
GARNET BIOTHERAPEUTICS, INC. (США) |
|
Терапия отторжения трансплантата |
15 |
Genitrix, LLC (США) |
|
Восстановление суставного хряща |
8 |
Serono Genetics Institute SA (США) |
|
Восстановление ткани печени |
11 |
BIOCOMPATIBLES UK LTD. (Великобритания). |
|
Восстановление кожи или мягких тканей |
9 |
BIOCOMPATIBLES UK LTD. (Великобритания) |
|
Определение контаминации клеток вирусами или бактериями |
8 |
Serono Genetics Institute S.A. (США) |
|
Определение параметров жизнеспособности клеточной линии |
19 |
Genitrix, LLC (США) |
|
Комбинированные препараты, содержащие вспомогательные вещества или дополнительные активные ингредиенты |
7 |
BIOCOMPATIBLES UK LTD. (США) |
Установлено, что основные патентоспособные разработки направлены на восстановление тканей поджелудочной железы, печени, сосудов, кожи и мягких тканей, обнаружение контаминантов, предотвращение отторжения трансплантата и определение параметров жизнеспособности клеточной линии. БМКП чаще всего патентуются в форме фармацевтических композиций, содержащих мезенхимальные клетки в сочетании со вспомогательными веществами, или в сочетании со вспомогательными веществами и дополнительным активным ингредиентом.
Дополнительные активные ингредиенты выбираются из ростовых факторов, химических соединений для управления пролиферацией клеток, стабилизаторов. Они могут содержаться в других тканях, которые добавляют к БМКП в интактном состоянии, либо после разрушения (например, факторы роста из разрушенных тромбоцитов). Использование только линий клеток в патентных документах не встречается. Для практики отечественного патентования изобретений, относящихся к БМКП, характерно включение в формулу таких объектов, как «трансплантат», «биотрансплантат», «биоинженерная конструкция», т.е. то, что в России называется «медицинским изделием» (рис. 4).
Зарубежные разработчики БМКП в основном используют приемы широкой патентной защиты. Объектами их патентования становятся, как правило, фармацевтические композиции, включающие стволовые клетки различного происхождения. Для отечественных разработчиков характерна узкая и уязвимая в отношении действий со стороны «третьих лиц» патентная защита БМКП в рамках способа (получение БМКП или его применение).
Структурный анализ объектов патентования показал соответствие определения БМКП, содержащегося в проекте Федерального закона № 717040-6 от 06.02.2015 г. «О биомедицинских клеточных продуктах» [3], практике разработки, применения и патентования таких продуктов (рис. 4).
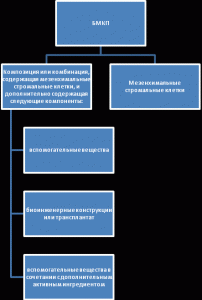 Рис. 4. Структура объектов патентования БМКП на основе линий стволовых клеток.
Рис. 4. Структура объектов патентования БМКП на основе линий стволовых клеток.
Описания к патентам оказались ценным источником информации для выявления подходов к доклинической оценке БМКП. В материалах описания заявки на выдачу патента заявителем должны быть подтверждены возможность осуществления изобретения (соответствие условиям «промышленной применимости») и наличие «изобретательского уровня» в созданном техническом решении. Поэтому они содержат значительное количество подробно описанных примеров выполнения различных вариантов технического решения, обосновывающих объем притязаний, указанный в формуле изобретения. Структурный анализ изобретательских решений при разработке отдельных биомедицинских клеточных продуктов приведен в таблице 2.
Таблица 2. Структурный анализ изобретательских решений при разработке отдельных биомедицинских клеточных продуктов
|
Линия клеток |
Задача |
Решение задачи |
Модель, используемая при доклиничес ком исследовании продукта |
Результат (биологический эффект) |
Источник |
|
–* |
Предотвращение отторжения трансплантата органа из-за иммунологической несовместимости с тканями реципиента |
Использование стволовых клеток пациента для их дифференциация стволовых клеток в пораженной ткани |
Млекопитающие |
Восстановление функции собственного органа пациента образованием новых функциональных элементов пораженной ткани |
[7] |
|
Использование мезинхимальных клеток для профилактики и лечения реакции «трансплантат против хозяина» |
То же |
Подавление пролиферации лимфоцитов, активации Т-клеток и клеток памяти, переключение Th1-ответа (воспалительного) на Th2-ответ (противовоспалительный) |
[10] |
||
|
Эмбриональные стволовые клетки (ЭСК) |
Предотвращение малопредсказуемой дифференциации клеток |
Использование вместо плюрипотентных ЭСК мультипотентных мезенхимальных стромальных клеток (ММСК) |
То же |
Устранение риска образования тератом |
[7, 9] |
|
ММСК |
Повышение ангиогенной активности ММСК |
Выделенные из жировой ткани ММСК перед трансплантацией инкубируют в среде, содержащей фактор некроза опухолей-альфа. Для культивирования ММСК используют среду, содержащую тромбоцитарный фактор роста и/или фактор стромальных клеток |
Мыши |
Увеличение хоуминга ММСК в участках ишемии, увеличение экспрессии молекул межклеточной адгезии на поверхности ММСК и активация матриксной металлопротеиназы 2 клеток, усиление васкуляризации ишемизированной ткани |
[14] |
|
Генетически модифицированные ММСК |
Восстановление васкуляризации ишемических поражений тканей. Предотвращение спонтанной дифференцировки части введенных в миокард ММСК в остеобласты и адипоциты |
Обкалывание ишемизированного участка мышцы сердца генетически модифицированными ММСК, сверхэкспрессирующими гены факторов ангиогенеза, в частности фактор роста эндотелия сосудов (VEGF) |
Кролики |
Увеличение количества капилляров в ишемизированной зоне. Формирование значительного числа анастомозов между новообразующимися сосудами в зоне ишемии и сосудистой сетью неповрежденной ткани (трансдифференцирование ММСК**) |
[6] |
|
Такое же, за исключением того, что экспрессия гена VEGF происходит под управлением промотора, экспрессирующе гося в условиях гипоксии |
Крысы |
То же |
[13] |
||
|
Генетически модифицированные ММСК |
Восстановление васкуляризации ишемических поражений тканей |
Обкалывание ишемизированного участка ткани смесью двух культур ММСК, одна из которых модифицирована генетической конструкцией на основе вирусного вектора, обеспечивающая гиперпродукцию VEGF; другая – на основе вирусного вектора, обеспечивающая гиперпродукцию ангиопоэтина (ANGPT) |
Мыши |
Более выраженная васкуляризация ишемизированной ткани, чем это имеет место при введении немодифицированных ММСК. Формирование стабильных сосудов с выраженным мышечным слоем |
[15] |
|
ММСК |
Сокращение сроков восстановления костной ткани. Исключение иммунного ответа на белки эмбриональной телячьей сыворотки |
ММСК подращивают на аутологичной сыворотке пациента, половину клеток дифференцируют в остеогенном направлении, другая половина остается недифференцированной. В качестве матрицы используется материал, близкий по составу к костной ткани человека |
Не указана |
Быстрое формирование костной ткани: 1) за счет ММСК, дифференцирован ной в остеогенном направлении; 2) активного формирования сосудистой сети за счет недифференцированной ММСК |
[16] |
|
ММСК |
Сокращение сроков восстановления костной ткани |
Используют имплантат на основе материала с повышенной адгезионной способностью к костной ткани, насыщенный аутологическими ММСК |
Крысы |
Быстрое формирование костной ткани и очагов гемопоэза в костной ткани |
[17] |
|
ММСК |
То же |
Используют имплантат на основе коралла Acropora cervicornes, насыщенный аутологическими ММСК |
То же |
То же |
[18] |
|
ММСК |
Повышение эффективности скрининга пластических материалов в условиях in vitro с целью определения их остеоинтегративных свойств |
В качестве тест-объекта на поверхности материалов культивировали ММСК с последующим изучением их качественных и количественных показателей |
Кролики |
Уменьшение объема экспериментов, выполняемых на животных |
[19] |
|
ММСК |
Замещение костной ткани без развития иммунных реакций и сокращение продолжительности перестройки костных аутотрансплантатов |
Аутотрансплантаты покрывают слоем обогащенной тромбоцитами аутоплазмы по типу «чулка». Под этот слой в костные аутотранплантаты инъецируют костный мозг пациента или ММСК |
Не указана |
Замещение зоны костного дефекта новообразованной костной тканью |
[20] |
|
ММСК |
То же применительно к нижней челюсти |
Аутотрансплантат обвивают нетканым пористым титановым материалом в объеме, соответствующем костному дефекту и равномерно наносят взвесь ММСК с костной стружкой |
То же |
То же |
[21] |
|
Аутологичные прогениторные клетки костного мозга (АПККМ) |
Пролонгирование сроков выживания и органоспецифической активности изолированных гепатоцитов |
Аутологичные клетки печени и АПККМ совместно культивируют in vitro на биодиградируемом пористом матриксе, после этого в специальном каркасе их трансплантируют в брыжейку тонкой кишки (технология создания «вспомогательной печени»). Повышение функциональной активности гепатоцитов достигается за счет факторов роста, выделяемых АПККМ. Одновременно происходит дифференцировка АПККМ в эндотелиоциты и быстрое формирование сосудов |
Собаки |
Уменьшение печеночной недостаточности по биохимическим показателям, гистологическое подтверждение формирования жизнеспособных аутологических гепатоцитов и новых сосудов в трансплантате |
[25, 26] |
|
ММСК |
Повышение иммуносупрессивных свойств ММСК |
ММСК активизируют культивированием в присутствии противовоспалительных факторов (фактор некроза опухолей-альфа и интерферон-гамма) |
Нет |
Нет |
[22] |
|
В условиях in vitro |
Уменьшение экспрессии HLA-DR на поверхности мембран ММСК и снижение уровня экспрессии в клетках молекул IDO, iNOS и COX-2 |
[23]
|
|||
|
*При трансплантации органов не использовались ** Трансдифференцирование (transdifferentiation) – дифференциация стволовых клеток в клетки ткани, в которые они были введены с формированием полноценной структуры ткани. |
|||||
Из данных, приведенных в таблице 2, следует:
1) разрабатываются в основном БМКП аутологичного происхождения, предназначенные для введения непосредственно в очаг поражения;
2) БМКП на основе немодифицированных клеток и линий клеток человека вытесняются из предполагаемой клинической практики БМКП с модифицированными клетками и линиями;
3) способ получения, состав и назначение БМКП определяют индивидуальную программу их доклинических исследований.
Проведенный анализ структуры изобретательских решений позволил сформулировать ряд общих требований к доклиническим исследованиям БМКП.
Исследование специфического механизма действия БМКП должно предполагать:
- обнаружение тех биологических эффектов, которые возникают в организме экспериментального животного в ответ на введение БМКП;
- выявление фенотипических и генетических маркеров, определение физических, морфологических и других свойств клеток, позволяющих в своей совокупности отличить их от немодифицированных клеток (клеточных линий) и других клеток, которые могут использоваться в БМКП;
- определение фармакодинамики и фармакокинетики (биораспределения) клеток, вспомогательных веществ и дополнительных активных ингредиентов, входящих в БМКП;
- установление биохимических и иных маркеров, позволяющих судить о функциональной активности приживляемых клеток и их выживаемости в процессе дифференциации в реципиентной ткани.
Исследование эффективности БМКП должно включать:
- предварительное обоснование критериев, позволяющих судить о положительном влиянии БМКП на течение, продолжительность заболевания или его предотвращение при дальнейшем проведении клинических исследований;
- предварительное обоснование безопасных, но при этом эффективных доз БМКП (всех входящих в него компонентов), которые в дальнейшем будут применяться в клинических исследованиях;
- получение доказательств трансдифференцирования клеточной линии, используемой в БМКП;
- определение оптимальных условий и времени хранения БМКП, при которых сохраняется его терапевтическое действие.
Исследование безопасности БМКП должно включать получение доказательств:
- отсутствия зараженности клеточной линии инфекционными агентами (вирусами, бактериями, микоплазмами) и прионными белками, ее контаминации клетками других линий, компонентами питательной среды и эндотоксинами;
- неспособности клеточной линии трансформироваться в опухолевые клетки или вызывать опухолеобразование в тех условиях, в которых она будет функционировать в пораженной ткани;
- отсутствия у БМКП тератогенного действия;
- иммунологической безопасности БМКП;
- иммунологической безопасности питательной среды, используемой для получения клеточной линии;
- отсутствия очагов клеток, несоответствующих ткани органа, в который вводили БМКП;
- безопасности и обоснованности включения в БМКП фармацевтических субстанций и вспомогательных веществ;
- биосовместимости и биодеградируемости материалов, из которых изготовлены медицинские изделия, входящие в состав БМКП.
Достоверность результатов доклинических исследований БМКП определяют использованные экспериментальные модели патологического процесса и (или) состояния. Для этого экспериментальным животным наносят повреждение соответствующей ткани или органа, максимально приближенное по своему характеру той патологии, которую предполагается лечить у человека [3, 6, 24]. Объем доклинических исследований зависит от способа получения и применения БМКП и происхождения входящих в его состав компонентов.
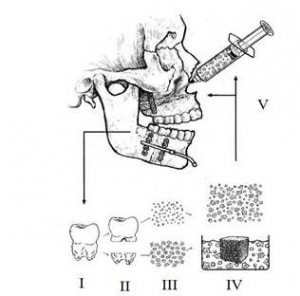
Качество – соответствие БМКП требованиям нормативной документации на БМКП [3]. Предварительный анализ описаний к патентам, защищающим БМКП, показал наличие в них детальных сведений по получению клеток (клеточных линий) и по таким показателям качества, как подлинность, специфическая активность, жизнеспособность клеток, стабильность, отсутствие контаминации (другие типы клеток, инфекционные агенты, прионные белки, компоненты питательной среды) и др. Такая подробность описания к патенту вызвана тем, что для доказательства критерия патентоспособности «промышленная применимость» заявители приводят всю последовательность этапов получения БМКП с указанием возможных продуктов, получаемых на каждом этапе (рис. 5), и способов его возможного применения (рис. 6 и 7).
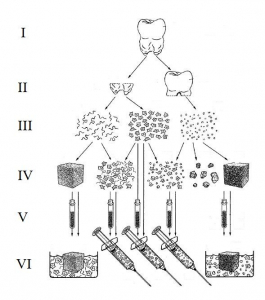 Рис. 5. Последовательность получения и получаемые БМКП, предназначенные для лечения повреждений костной ткани. I – сбор пульпы зуба; II – выделение аутологичных МСК; III – сортировка выделенных МСК; IV – формирование суспензии или матрицы, содержащей МСК; V – подращивание МСК; VI – создание формы для введения БМКП [27].
Рис. 5. Последовательность получения и получаемые БМКП, предназначенные для лечения повреждений костной ткани. I – сбор пульпы зуба; II – выделение аутологичных МСК; III – сортировка выделенных МСК; IV – формирование суспензии или матрицы, содержащей МСК; V – подращивание МСК; VI – создание формы для введения БМКП [27].
Формула изобретения содержит характеристики патентуемого объекта, которые можно рассматривать как исходную информацию для определения показателей подлинности продукта и его специфической активности. Причина наличия в формуле таких сведений обусловлена тем, что заявитель должен показать патентному эксперту существенные признаки своего изобретения, позволяющие отличать патентуемый им объект от других объектов подобного назначения, а совокупность таких признаков должна обеспечивать технический результат, что обычно основывается на примерах конкретного выполнения изобретения.
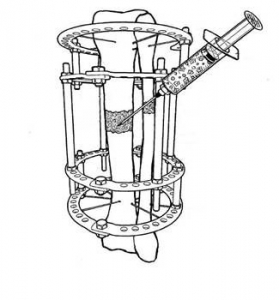 Рис. 6. Способ применения БМКП для лечения повреждений костей голени, зафиксированных в аппарате Илизарова. Суспензию МСК инъецируют в область поврежденного участка кости голени [27].
Рис. 6. Способ применения БМКП для лечения повреждений костей голени, зафиксированных в аппарате Илизарова. Суспензию МСК инъецируют в область поврежденного участка кости голени [27].
Рис. 7. Способ применения БМКП и продукты, используемые для лечения повреждений верхней челюсти. I – сбор пульпы зуба; II – выделение аутологичных МСК; III – сортировка выделенных МСК; IV – формирование суспензии или матрицы, содержащей МСК; V – введение суспензии или матрицы, содержащей МСК в область поврежденной костной ткани верхней челюсти [27].
Подлинность продукта – это набор характерных, специфических показателей, отличающих данный продукт от других. Для подтверждения подлинности БМКП используют генетические, биохимические, иммунофенотипические и морфологические характеристики клеточных линий. Генетические характеристики включают определение видовой принадлежности клеток гибридизацией in situ и молекулярно-генетическое подтверждение наличия в клетках плазмидного или иного вектора, содержащего экспрессирующие гены, если клетки (клеточные линии) были генетически модифицированы [15, 28]. Биохимические характеристики включают перечень биологически активных веществ, которые клеточная линия должна синтезировать в среду культивирования, фенотипические характеристики – перечень экспрессируемых клетками поверхностных антигенов, определяемых с помощью специфических моноклональных антител методом проточной цитофлуориметрии. Морфологические характеристики должны дать гистологическое описание клеток клеточной линии, использованной для получения БМКП [28, 29]. Особенностью показателей качества таких объектов является их «плавающий характер». Например, процентное соотношение клеточных маркеров стромальных клеток костного мозга, используемых для замещения костных дефектов, была следующей: более 90% клеток экспрессировали поверхностные маркеры CD73, CD90, CD105 и HLA A-B-C; менее 5% – CD3, CD34, CD45 и HLA DP, DQ, DR [29].
Специфическая активность. Подтверждение зависит от способа получения, состава и назначения БМКП. Например, специфическая активность БМКП, предназначенного для восстановления ишемизированного участка ткани, представляющего собой смесь двух линий ММСК, одна из которых модифицирована генетической конструкций на основе вирусного вектора, обеспечивающая гиперпродукцию фактора роста эндотелия сосудов, другая – на основе вирусного вектора, обеспечивающая гиперпродукцию ангиопоэтина, будет определяться по продукции этими линиями клеток фактора роста эндотелия сосудов и ангиопоэтина соответственно [15]. Установить биораспределение имплантированных клеток позволяет использование искусственных биомаркеров, в частности введение в геном клетки гена люциферазы [28].
Отсутствие всех видов микроорганизмов в БМКП. Подтверждают на специальных селективных средах в анаэробных и аэробных условиях роста при температурах 30 и 370С при инкубировании продолжительностью от 24 ч до 3 сут [27].
Жизнеспособность клеток. Подтверждают выявлением живых клеток в препарате. Наиболее распространенным методом является окрашивание клеток трипановым синим с последующим подсчетом окрашенных и неокрашенных клеток. Живые клетки с неповрежденной клеточной мембраной не окрашиваются этим красителем. Препарат считают надлежащего качества, если он содержит 70–90% живых клеток [27].
Стабильность. Соответствие по этому показателю определяется по многим показателям, в зависимости от назначения БМКП. Например, по спектру стволовых клеток (stem cell profile), среднему размеру клеток, их зернистости, жизнеспособности и наличию клеток на поздних стадиях апоптоза по окрашиванию с интеркалирующим красителем пропидиум иодидом и др. [27].
Проведенный анализ патентных источников показал, что разработка эффективных методов доклинических исследований БМКП должна проводиться на основе классификации БМКП, предполагающей их разделение на группы, различающиеся по решаемым разработчиком задачам (восстановление костной ткани, хряща, подавление реакции «трансплантат против хозяина» и др.); по способу применения (парентеральное или местное); по сложности доклинического исследования (неизмененные или измененные методами генной инженерии клетки), по происхождению клеток (аутологичные, аллогенные) и другим критериям. Наиболее перспективными методами доклинических исследований БМКП будут те, которые позволят предсказать биораспределение клеток в организме человека и их дальнейшую трансдифференцировку и функционирование в пораженной ткани.
Показатели качества БМКП, рекомендуемые для включения в нормативную документацию, способы определения этих показателей, должны характеризовать назначение БМКП в определенном диапазоне свойств, обеспечивающих эффективность и безопасность их медицинского применения.
При разработке методов доклинических исследований и определения показателей качества БМКП, необходимо учитывать следующее:
1) развитие технологий разработки и производства БМКП затормозилось в средине прошлого десятилетия, новые разработки представляют собой частные усовершенствования БМКП, созданных в прошлом десятилетии, при этом ряд проблем (низкая эффективность управления дифференциацией клеток в условиях in vivo и in vitro, неспецифическое иммуносупрессивное действие и др.), ограничивающих клиническое применение БМКП, остаются актуальными;
2) разработка БМКП проводится в двух направлениях: для парентерального (предполагается внутривенное введение продукта) и местного применения (продукт вводится в пораженную ткань или вокруг нее). В основном разрабатываются БМКП на основе аутологичных клеточных линий, предназначенные для введения в очаг поражения (в составе биоинженерных конструкций или трансплантата);
3) в настоящее время БМКП на основе немодифицированных клеточных линий, вытесняются БМКП с модифицированными клеточными линиями. Для их модификации используются либо биологически активные вещества, либо методы соматической генной терапии;
4) сформировалось направление получения БМКП, включающих вместо охарактеризованных вспомогательных веществ и дополнительных активных ингредиентов, вещества и ингредиенты, полученные из разрушенных тканей, например факторы роста из разрушенных тромбоцитов, что затрудняет определение точного состава продукта;
5) для показателей качества БМКП, таких как подлинность, специфическая активность, стабильность, жизнеспособность клеток, характерен «плавающий характер» показателей.
Исследование выполнено при финансовой поддержке Министерства образования и науки Российской Федерации (проект RFMEFI61014X0001).
Литература:
1. Об утверждении Стратегии развития медицинской науки в Российской Федерации на период до 2025 года. Распоряжение Правительства РФ № 2580-р от 28 декабря 2012 г. Собрание законодательства 2013; (2): ст. 111.
2. Об утверждении научных платформ медицинской науки. Приказ Минздрава России № 281 от 30 апреля 2013 г. Доступ из справочно-правовой системы «КонсультантПлюс» (дата обращения 01.11.2014).
3. Об обращении биомедицинских клеточных продуктов. Проект Федерального закона от 18 января 2013 г. Available from: http://www.rosminzdrav.ru/documents/6472-proekt-federalnogo-zakona-ot-18-yanvarya-2013-g (cited 2014 Nov 5).
4. Кольцова КЛ. Использование патентной документации на различных этапах научно-исследовательских и конструкторских разработок. Методическое пособие. М.: ИПКИР; 1984.
5. Александров ЛВ, Шепелев НП. Системный анализ при создании и освоении объектов техники. М.: НПО «Поиск»; 1992.
6. Семерин ЕН, Маликов АЯ, Шляхто ЕВ, Афанасьев БВ. Некоторые актуальные проблемы клинических исследований стволовых клеток. Качественная клиническая практика 2004; (2): 30–5.
7. Шуман ЕА, Коротков АВ, Макеев ОГ. Результаты доклинических исследований генно-клеточной терапии сердечной недостаточности. Вестник Уральской медицинской академической науки 2012; (3): 98–9.
8. Gruen L, Grabel L. Concise revive: scientific and ethical roadblocks to human embryonic stem cell. Stem Cells 2006; 24: 2162–9.
9. Смолянинов АБ, Жаров ЕВ, Мовчан КН, Новицкий АВ, Адылов ШФ. Основные направления научных исследований в области клеточных технологий и роль банков стволовых клеток в современной медицине России. АГ-инфо 2009; (1): 16–21.
10. Татаринова ОС, Осипова ЕЮ, Румянцев СА. Трансплантация мезинхимальных стволовых клеток в клинической практике. АГ-инфо 2011; (2): 24–31.
11. Hansel DE, Dintzis RZ. Lippincott's Pocket Pathology. Baltimore: Lippincott Williams & Wilkins; 2006.
12. Horwitz EM, Andreef M, Frassoni F. Mesenchymal stromal cells. Curr Opin Hematol. 2006; 13(6): 419–25.
13. Kim SH, Moon HH, Kim HA, Hwang KC, Lee M, Choi D. Hypoxiainducible vascular endothelial growth factor-engineered mesenchymal stem cells prevent myocardial ischemic injury. Mol Ther. 2011; 19(4): 741–50.
14. Зубкова ЕС, Макаревич ПИ, Цоколаева ЗИ, Болдырева МА, Меньшиков МЮ, Парфенова ЕВ. Способ повышения ангиогенной активности стромальных клеток жировой ткани. Патент Российской Федерации, № 2531502; 2014.
15. Зубкова ЕС, Макаревич ПИ, Цоколаева ЗИ, Болдырева МА, Меньшиков МЮ, Парфенова ЕВ. Средство для лечения ишемических поражений тканей и способ его применения. Патент Российской Федерации, № 2522778; 2014.
16. Чаусская ИЮ, Дробышев АЮ, Парфенова ЕВ, Ткачук ВА, Рубина КА, Калинина НИ и др. Биотрансплантат для восстановления объема костной ткани при дегенеративных заболеваниях и травматических повреждениях костей и способ его получения. Патент Российской Федерации, № 2530622; 2014.
17. Чиссов ВИ, Баринов СМ, Сергеева НС, Решетов ИВ, Свиридова ИК, Кирсанова ВА и др. Материал для закрытия костных дефектов при реконструктивно-пластических операциях. Патент Российской Федерации, № 2333010; 2008.
18. Чиссов ВИ, Сергеева НС, Свиридова ИК, Кирсанова ВА, Ахмедова СА, Франк ГА и др. Биоинженерная конструкция. Патент Российской Федерации, № 86455; 2009.
19. Лосев ФФ, Быков ВА, Денисов-Никольский ЮИ, Докторов АА, Матвейчук ИВ, Жилкин БА и др. Способ определения in vitro остеоинтегративных свойств пластических материалов для трансплантатов. Патент Российской Федерации, № 2259851; 2005.
20. Котельников ГП, Терсков АЮ, Кудашев ДС, Иванов ВВ, Долгушкин ДА, Николаенко АН и др. Способ пластики костных дефектов. Патент Российской Федерации, № 2517563; 2014.
21. Байриков ИМ, Щербовских АЕ. Способ костной пластики нижней челюсти. Патент Российской Федерации, № 2523353; 2014.
22. Ткачук ВА, Суздальцева ЮГ, Рубцов ЮП, Горюнов КВ. Способ повышения иммуносупрессивных свойств мезинхимальных стромальных клеток жировой ткани. Патент Российской Федерации, № 2526575; 2014.
23. Ткачук ВА, Суздальцева ЮГ, Рубцов ЮП, Горюнов КВ Способ оценки иммуносупрессивных свойств мезенхимальных стромальных клеток человека. Заявка Российской Федерации, № 2013115818; 2014.
24. Пинаев ГП. Необходимость соответствия нормативно-правового регулирования реальному процессу создания и применения биомедицинских клеточных технологий. Вестник биотехнологии 2012; 8(3): 61–4.
25. Готье СВ, Шагидулин МЮ, Онищенко НА, Крашенинников МЕ, Севастьянов ВИ. Способ и трансплантат для лечения печеночной недостаточности. Патент Российской Федерации, № 2425645; 2011.
26. Готье СВ, Шагидулин МЮ, Онищенко НА, Крашенинников МЕ, Севастьянов ВИ. Способ и трансплантат для лечения печеночной недостаточности. Патент Российской Федерации, № 2425648; 2011.
27. Wasielewski RC. Enhanced medical implant. Patent US, № 2777722; 2014.
28. Fernandez MMG, Garcia AM, De La Pena MAG, Olmo DG, Castro RAG. Identification and insolation of multipotent cells from non-osteochondral mesenchymal tissue. Patent ES, № 2583151; 2006.
29. Brennan MA, Renaud A, Amiaud J, Rojewski MT, Schrezenmeier H, Heymann D, et al. Pre-clinical studies of bone regeneration with human bone marrow stromal cells and biphasic calcium phosphate. Stem Cell Research Therapy 2014; (5): 114–29.
References
1. On approval of the Strategy of development of medical science in the Russian Federation for the period up to 2025. Russian Federation Government Decree № 2580-r dated December 28, 2012. Collection of the legislation 2013; (2): art. 111 (in Russian).
2. On approval of the scientific platform of medical science. Order of the Ministry of Health of Russia № 281 dated April 30, 2013. Access of reference and legal system «Consultant» (cited 2014 Nov 1) (in Russian).
3. On the treatment of biomedical cell products. Draft Federal Law of 18 January 2013. Available from: http://www.rosminzdrav.ru/documents/6472-proekt-federalnogo-zakona-ot-18-yanvarya-2013-g (cited 2014 Nov 5) (in Russian).
4. Koltsova KL. The use of patent documents at different stages of research and development. Toolkit. Moscow: IPKIR; 1984 (in Russian).
5. Alexandrov LV, Shepelev NP. System analysis in the creation and development of technical objects. Moscow: Poisk; 1992 (in Russian).
6. Semerin EN, Malikov AYa, Shlyakhto EV, Afanasiev BV. Some actual problems of clinical stem cell research. Kachestvennaya klinicheskaya praktika 2004; (2): 30–5 (in Russian).
7. Shuman EA, Korotkov AV, Makeev OG. The results of preclinical studies of gene-cell therapy of heart failure. Vestnik Uralskoy meditsinskoy nauki 2012; (3): 98–9 (in Russian).
8. Gruen L, Grabel L. Concise revive: scientific and ethical roadblocks to human embryonic stem cell. Stem Cells 2006; 24: 2162–9.
9. Smolyaninov AB, Zharov EV, Movchan KN, Novitsky AB, Adylov ShF. The main directions of research in the field of cell technology and the role of stem cell banks in modern medicine of Russia. AG-info 2009; (1): 16–21 (in Russian).
10. Tatarinova OS, Osipova EYu, Rumyantsev SA. Transplantation of mesenchymal stem cells in clinical practice. AG-info 2011; (2): 24–31 (in Russian).
11. Hansel DE, Dintzis RZ. Lippincott's Pocket Pathology. Baltimore: Lippincott Williams & Wilkins; 2006.
12. Horwitz EM, Andreef M, Frassoni F. Mesenchymal stromal cells. Curr Opin Hematol. 2006; 13(6): 419–25.
13. Kim SH, Moon HH, Kim HA, Hwang KC, Lee M, Choi D. Hypoxiainducible vascular endothelial growth factor-engineered mesenchymal stem cells prevent myocardial ischemic injury. Mol Ther. 2011; 19(4): 741–50.
14. Zubkova ES, Makarevich PI, Tsokolaeva ZI, Boldyreva MA, Menshikov MYu, Parfenova EV. The method of enhancing the angiogenic activity of adipose tissue-derived stromal cells. Patent of the Russian Federation, № 2531502; 2014 (in Russian).
15. Zubkova ES, Makarevich PI, Tsokolaeva ZI, Boldyreva MA, Menshikov MYu, Parfenova EV. The agent for treating ischemic tissue lesions and method of its application. Patent of the Russian Federation, № 2522778; 2014 (in Russian).
16. Chausskaya IYu, Drobyshev AYu, Parfenova EV, Tkachuk VA, Rubina KA, Kalinina NI, et al. Biograft for restoration of the capacity of bone tissue in degenerative diseases and traumatic injuries of bones and method for its preparation. Patent of the Russian Federation, № 2530622; 2014 (in Russian).
17. Chissov VI, Barinov SM, Sergeeva NS, Reshetov IV, Sviridova IK, Kirsanova VA, et al. Material for closing bone defects in reconstructive plastic surgery. Patent of the Russian Federation, № 2333010; 2008 (in Russian).
18. Chissov VI, Sergeeva NS, Sviridova IK, Kirsanova VA, Akhmedova SA, Frank GA, et al. Bioengineering design. Patent of the Russian Federation, № 86455; 2009 (in Russian).
19. Losev FF, Bykov VA, Denisov-Nikolsky YuI, Doktorov AA, Matveychuk IV, Zhilkin BA, et al. A method for determining in vitro osseointegration properties of plastic materials for transplants. Patent of the Russian Federation, № 2259851; 2005 (in Russian).
20. Kotelnikov GP, Terskov AYu, Kudashev DS, Ivanov VV, Dolgushkin DA, Nikolaenko AN, et al. Method of bone defects plastic. Patent of the Russian Federation, № 2517563; 2014 (in Russian).
21. Bayrikov IM, Scherbovskih AE. Method of mandibular bone plastic. Patent of the Russian Federation, № 2523353; 2014 (in Russian).
22. Tkachuk VA, Suzdaltseva YuG, Rubtsov UP, Gorunov KV. A method of increasing the immunosuppressive properties of mesenchymal stromal cells of adipose tissue. Patent of the Russian Federation, № 2526575; 2014 (in Russian).
23. Tkachuk VA, Suzdaltseva YuG, Rubtsov UP, Gorunov KV. A method of estimating the immunosuppressive properties of human mesenchymal stromal cells. Application of the Russian Federation, № 2013115818; 2014 (in Russian).
24. Pinaev GP. Need to comply with regulatory actual process of creation and application of biomedical cell technologies. Vestnik biotehnologii 2012; 8(3): 61–4 (in Russian).
25. Gotie SV, Shagidulin MYu, Onishchenko NA, Krasheninnikov ME, Sevastyanov VI. The method and graft for treating hepatic insufficiency. Patent of the Russian Federation, № 2425645; 2011 (in Russian).
26. Gotie SV, Shagidulin MYu, Onishchenko NA, Krasheninnikov ME, Sevastyanov VI. The method and graft for treating hepatic insufficiency. Patent of the Russian Federation, № 2425648; 2011 (in Russian).
27. Wasielewski RC. Enhanced medical implant. Patent US, № 2777722; 2014.
28. Fernandez MMG, Garcia AM, De La Pena MAG, Olmo DG, Castro RAG. Identification and insolation of multipotent cells from non-osteochondral mesenchymal tissue. Patent ES, № 2583151; 2006.
29. Brennan MA, Renaud A, Amiaud J, Rojewski MT, Schrezenmeier H, Heymann D, et al. Pre-clinical studies of bone regeneration with human bone marrow stromal cells and biphasic calcium phosphate. Stem Cell Research Therapy 2014; (5): 114–29.
Библиографическое описание: Супотницкий МВ, Елапов АА, Борисевич ИВ, Климов ВИ, Лебединская ЕВ, Миронов АН, Меркулов ВА. Перспективные методические подходы к доклиническому исследованию биомедицинских клеточных продуктов и возможные показатели их качества. Биопрепараты 2015; (1): 36–44.
Bibliographical description: Supotnickij MV, Elapov AA, Borisevich IV, Klimov VI, Lebedinskaja EV, Mironov AN, Merkulov VA. Promising methodological approaches to preclinical studies of biomedical cell-based products and their possible quality characteristics. Biopreparation (Biopharmaceuticals) 2015; (1): 36–44.

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2015, биомедицинский клеточный продукт