Антитела в инфекционных и эпидемических процессах
В учебной литературе, используемой для подготовки врачей в области иммунологии и эпидемиологии, читателю предлагается объяснение механизма работы иммунной системы, основанное на описании взаимодействия некого «идеального антигена» с идеальной иммунной системой. Этим пробелом в информации пользуются дельцы от науки, предлагающие под видом вакцин снадобья, которые вызывают образование специфических антител. Цель настоящей работы — обратить внимание врачей на научные данные по участию антител в инфекционных и эпидемических процессах, не вошедшие в учебники, по которым они получали базовые представления в области иммунологии и эпидемиологии. В статье приводятся примеры механизмов, используемых микроорганизмами для уклонения от иммунной системы, показывающие, что не любое их взаимодействие приводит к образованию специфических антител, обладающих протективным действием. Образовавшиеся же специфические антитела могут не только не обладать протективным действием, но и усиливать и, даже, изменять инфекционный и эпидемический процессы (феномены антигенного импринтинга и антителозависимого усиления инфекции), что требует более глубоких исследований на этапах доклинических и клинических исследований вакцин и более взвешенной политики по проведению массовых иммунизаций населения. Даются рекомендации по выявлению среди рекламных и научных источников тех, которые написаны либо специалистами без достаточной подготовки, что бы рекомендовать какие-либо мероприятия для миллионов людей, либо преследующих свои коммерческие выгоды.
Супотницкий М.В. Антитела в инфекционных и эпидемических процессах // Новости медицины и фармации. — 2013. — № 8 (456) .
В учебной литературе, используемой для подготовки врачей в области иммунологии и эпидемиологии, читателю предлагается объяснение механизма работы иммунной системы, основанное на описании взаимодействия некого «идеального антигена» с идеальной иммунной системой. В такой иммунной системе специфическим антителам отводится роль основного фактора гуморального иммунитета, способствующего освобождению организма человека от инфекционных агентов и чужеродных веществ антигенной природы [1, 2, 4, 5]. Это упрощенное объяснение взаимодействия иммунной системы с патогенными микроорганизмами позволяет создателям «вакцин» и всякого рода снадобий, обосновывать свой бизнес именно тем, что их продукт вызывает образование специфических антител[1]. Другая сторона, врачи, не могут воспринимать критически информацию бизнесменов от науки именно потому, что иные представления о роли антител им не известны. Цель настоящей работы — обратить внимание врачей на научные данные по участию антител в инфекционных и эпидемических процессах, не вошедшие в учебники, по которым они получали базовые представления в области иммунологии и эпидемиологии[2].
Иммуноглобулины и антитела. Иммуноглобулины и антитела — термины разного объема. Иммуноглобулины (Ig-SF) — это суперсемейство белков адгезии, поддерживающих целостность организма. Основными критериями включения белков в данное суперсемейство являются пространственная организация молекул и статистически достоверная гомология с известными иммуноглобулинами. Каждый домен, входящий в состав иммуноглобулина, представляет собой двухслойное молекулярное образование, построенное по принципу нескольких антипараллельных бета-структур, стабилизированных дисульфидными связями (—S—S—). Конформационная структура данного типа свойственна только белкам суперсемейства иммуноглобулинов. В англоязычной литературе она получила обозначение Ig-fold (иммуноглобулиновая складчатость). Свое начало такая конформационная структура берет еще в эпоху протоклеточных образований, когда каждый домен гистонового белка образовывался в результате ретротранспозиционной активности первых ретроэлементов. Сформировавшиеся на основе структур типа Ig-fold гидрофобные белки оказались востребованными эволюцией как строительный материал многоклеточности. Посредством дупликаций и перестановок генов, кодирующих Ig-fold, сформировалось суперсемейство иммуноглобулинов [5, 25].
К иммуноглобулинам относятся молекулы Т-клеточного антигенраспознающего комплекса, молекулы I и II классов МНС, корецепторы Т-клеток CD4 и CD8, однодоменные белки — Thy-1, b2-м, Р0, различные адгезины и рецепторные молекулы, способствующие контактному взаимодействию иммунокомпетентных клеток или адсорбции различных классов иммуноглобулинов на клеточной поверхности. На лимфоидных клетках одна треть поверхностных молекул — это члены суперсемейства иммуноглобулинов. В ходе эволюции иммуноглобулинов антитела сформировались последними. В-лимфоциты появились у первых позвоночных — круглоротых рыб, однако их антигензависимая дифференцировка до синтезирующих антитела плазмоцитов обнаружена только у хрящевых рыб, появившихся значительно позже. Своего максимального развития она достигла у млекопитающих [5].
Патогенные бактерии и вирусы не являются «идеальными антигенами», вписывающимися в типовую схему иммунного ответа: макрофаг поглощает (фагоцитирует) патогенный микроорганизм (бактерия, вирус) и инактивирует его → получив информацию об антигене, Т-хэлперы с помощью иммуноцитокинов передают сигнал, усиливающий пролиферацию Т- и В-лимфоцитов нужных клонов → В-лимфоциты дифференцируются до плазмоцитов, а Т-хэлперы превращаются в Т-эффекторы (Т-киллеры) → плазмоциты синтезируют специфические антитела, участвующие в иммунном ответе в трех формах: нейтрализации, опсонизации и активации системы комплемента; Т-эффекторы разрушают клетки-мишени при непосредственном контакте. После первичного контакта с антигеном остаются клоны Т- и В-клеток памяти, сохраняющие информацию о нем много лет. При вторичном попадании этого антигена в организм человека происходит стимуляция клонов, и они начинают быстро размножаться. В-клетки переходят в плазмоциты, продуцирующие антитела нужной специфичности. Т-клетки обеспечивают клеточную форму защиты (субпопуляции цитотоксических Т-клеток и Т-клеток воспаления) и участвуют в формировании гуморального иммунитета — хэлперные Т-клетки [4, 5].
Способность патогенных микроорганизмов атаковать иммунную систему как раз и связана с тем, что естественным отбором за ними закреплены возможности по уклонению от ее внимания. Сама же иммунная система не была сконструирована естественным отбором «полностью и окончательно» по заранее продуманному плану. Этот «план» известен только авторам учебных пособий, рисующих студентам простые схемы ее участия в элиминации патогенных микроорганизмов. Иммунная система человека сложилась в ходе эволюции, не имеющей никакого заранее заготовленного плана.
Механизмы, используемые микроорганизмами для уклонения от иммунной системы. Локальное взаимодействие патогенных микроорганизмов с тканями, как правило, вызывает большое количество системных реакций, посредством которых организм хозяина пытается контролировать течение инфекции. Иммунная система человека способна узнавать многие компоненты бактерий и вирусов, особенно токсины, ЛПС, пептидогликан (бактерии) и оболочечные белки (вирусы). Однако результат этого взаимодействия может сильно отличаться от канонического взаимодействия антигена с иммунной системой, приводящего к выработке антител, постепенно блокирующих инфекционный процесс по вышеописанной схеме[3].
Суперантигены. Эта такие антигены, на которые реакция иммунной системы чрезмерна. Токсины-суперантигены связывают антигенраспознающие рецепторы Т-лимфоцитов не в участках их активных центров, а в других участках рецепторов. Стафилококковый токсин В (SEB), токсин синдрома токсического шока (TSST-1) связываются с боковыми участками альфа-цепи Т-клеточного рецептора (TCR) Т-лимфоцитов и одновременно с V-областью MHC класса II. В результате они блокируют возможное связывание с TCR представляемых макрофагом специфических антигенов и вызывают активацию больших популяций Т-хелперных клеток при одновременном обходе обычного процессинга и представления антигена. Вместо специфических антител ими индуцируется выброс нефизиологического количества провоспалительных цитокинов, таких как IL-1, IL-2, IL-6, IFN-гамма, LT, TNF-альфа, вызывающих интенсивную воспалительную реакцию в месте аппликации токсина, гипотензию и интерстициальный отек легких [71].
«Суперантигенными» свойствами обладают отдельные антигены возбудителя псевдотуберкулеза и уропатогенных кишечных палочек [26].
Суперантигенные эффекты обнаружены при развитии инфекционных процессов, вызываемых вирусами, представителями семейств Herpesviridae, Rhabdoviridae и Filoviridae [41, 42, 64]. Но развиваются они более сложно, чем при бактериальных инфекциях. Отдельные вирусы, как и бактерии, содержат в своей оболочке белки-суперантигены, например, вирус Эбола [42]. Но вируса Эпштейна-Барра (EBV) таких белков не содержит. У большинства людей он вызывает типичную циклическую инфекцию, называемую инфекционным мононуклеозом. Болезнь начинается остро, проявляется ремитирующей лихорадкой, воспалением лимфатических узлов, поражением зева, гепато- и спленомегалией. Постепенно иммунная система блокирует инфекционный процесс и освобождает организма человека от EBV. У переболевших людей развивается стойкий иммунитет к вирусу.
Но так происходит не всегда. N. Sutkowski et al. [64] обнаружили связь между EBV-инфекцией и суперантигенной активностью присутствующих в геноме некоторых людей эндогенных ретровирусов К-семейства (HERV-K). Каждая аллель оболочечного гена HERV-K кодирует суперантигены. Когда EBV трансактивирует гены оболочечных белков HERV-K18, они, в свою очередь, вызывают активацию Т-лимфоцитов. Суперантигенный ответ HERV-K18 изменяет жизненный цикл EBV и ведет к патологии, ранее не считавшейся инфекционной. Так как T-лимфоциты хелперы необходимы для длительно живущих EBV-инфицированных B-лимфоцитов памяти (в отличие от других вирусов герпеса он не вызывает гибели В-клеток, а, напротив, активирует их пролиферацию), то именно экспрессия генов суперантигенов HERV-K18 предопределяет необратимое персистирование EBV в организме иммунокомпетентного человека. Инфекционный процесс приобретает характер нециклического, элиминации EBV не происходит. Вызванная HERV-K18 стимуляция Т-лимфоцитов является причиной B-лимфомагенеза (злокачественные лимфомы — болезнь Ходжкина, лимфосаркомы и др.) [49]. Суперантигенный эффект получается в результате транскрипции генов HERV-K, индуцированной ICP0 — ранним белком вируса герпеса первого типа [40].
Экранирование поверхности бактерий и вирусов. Механизмы экранирования структур бактерий (пептидогликан, поверхностные белки клеточной стенки и др.), опознаваемых иммунной системой хозяина, могут иметь как специфический, так и неспецифический характер. Из неспецифических «экранов» у бактерий наиболее изучены капсулы и капсулоподобные образования. Они покрывают основные компоненты клеточной стенки и препятствуют активации комплемента сыворотки, помогают бактериям уйти от распознавания иммунной системой, придают устойчивость к фагоцитозу и прикрывают их поверхность от лиганд-рецепторных взаимодействий.
Вирусы защищаются от антител сходным образом. Исследования структуры кора gp120 ВИЧ показали плотную локализацию N-гликанов на одной поверхности белка [76]. Плотность карбонгидратного щита такова, что он защищает вирус от взаимодействия с антителами. Такая структура на поверхности gp120 была названа «безмолвной поверхностью» (silent face), что означает ее невосприятие системой Т- и В-иммунитета [56].
К специфическому механизму экранирования клеточной стенки бактерий и вирусов, можно отнести их антигенную вариабельность. Многие поверхностные структуры бактерий, способные вызывать выработку специфических антител, одновременно способны к антигенному варьированию (жгутики, пили, ЛПС, капсулы, S-слой, секретируемые ферменты и отдельные белки клеточной стенки). Наиболее хорошо механизм антигенной вариации изучен у Neisseria (N. gonorrhoeae, N. meningitidis). Основной варьирующей антигенной структурой у представителей этого семейства являются пили. Гонококки располагают потенциально большим набором серологически различных пилей, однако всегда экспрессируется ген только одного из них. Это вызвано тем, что в бактериальной клетке постоянно экспрессируется только один функционально активный пилиновый локус (pil E). Но в хромосоме разбросаны еще более чем 50 усеченных нетранскрибируемых генов пилей. В случае генетической перестановки, происходящей по принципу «русской рулетки» (и посредством Rec А), экспрессируемый ген в pil Е заменяется одним из молчащих, с другими серологическими свойствами — антигенная структура гонококка меняется, уже циркулирующие антитела становятся неспецифичными [58].
Другой варьирующей структурой семейства являются их поверхностные белки Ора. Экспрессия гена каждого такого белка независима от других и реализуется через «двухпозиционный переключатель». Каждый ора-ген в регионе, кодирующем гидрофобную сигнальную последовательность, имеет серию повторов последовательности СТСТТ. Количество СТСТТ определено рамкой трансляции гена и, в итоге, один из двух полных белков Ора экспрессируется. Рекомбинация между СТСТТ-последовательностями меняет количество СТСТТ-повторов и антигенную специфичность белка Ора [63].
Многие бактериальные поверхностные компоненты варьируют от штамма к штамму. Вот только несколько примеров: ЛПС сальмонелл — более 60 типов; капсула S. pneumoniae — более 80 типов; IgA-протеаза H. influenzae — более 30 вариантов; М-белок стрептококков — более 80 серотипов. Большинство вариаций вызвано маленькими нуклеотидными заменами, вставками и делециями генов, которые кодируют эти факторы вирулентности, а в результате этих процессов мы наблюдаем антигенный дрейф у возбудителя инфекции [26].
Вирусы проявляют не меньшее антигенное разнообразие. Например, по связыванию со специфическими сыворотками, аденовирусы разделены на 51 серотип. На основе их способности агглютинировать эритроциты у людей, кроликов и мышей; и по онкогенности для грызунов их подразделяют еще на 6 подтипов или субгрупп (от A до F) [57]. Аденовирусы разных подгрупп поражают различные органы и ткани человека. Вирусы подгрупп B1, C и E, главным образом вызывают респираторные болезни; вирусы подгрупп B, D и E способны поражать ткани глаза; субгруппа вирусов F вызывает гастроэнтериты; B2-вирус инфицирует почки и уринарный тракт [54, 55].
Секреция факторов, инактивирующих защиту хозяина. У бактерий наиболее изучено образование трипсиноподобных ферментов, расщепляющих иммуноглобулины класса A (IgA). Продукция данных ферментов характерна для бактерий, инфицирующих слизистые оболочки. Большинство ДНК-вирусов, вызывающих циклический инфекционный процесс, используют стратегию, включающую синтез инфицированными фагоцитирующими клетками вирусных гомологов хемокинов или хемокиновых рецепторов и других белков, связывающих хемокины, синтезируемые фагоцитирующими клетками. Тем самым нарушается передача Т-хэлперами Т- и В-лимфоцитам информации об антигене нужных клонов и усиление их пролиферации. Специфические антитела в необходимых количества не образуются. Но, поскольку функции хемокиновых рецепторов, посредством которых вирус взаимодействует с клеткой, различаются, то воздействие на них вирусными белками на уровне макроорганизма приводит к разным, и даже, противоположным эффектам. Работа иммунной системы хаотизируется. Происходит истощение локальной хемокиновой активности. Одновременно индуцируются межклеточные сигналы, усиливающие вирусную репликацию [9, 17, 61, 63].
Приведенные примеры не охватывают всего многообразия во взаимодействии антигенов возбудителей опасных инфекций с иммунной системой человека. Они лишь иллюстрируют то, что далеко не любое их взаимодействие приводит к образованию специфических антител, обладающих протективным действием. Теперь проверим это положение на конкретных примерах.
Гуморальные иммунные ответы на возбудители опасных и особопасных инфекций. При их рассмотрении нужно понимать, что:
1) антитела образуются на эпитопы белков, играющих различную роль в инфекционном процессе. Поэтому одни могут обладать протективным эффектом, другие — нет. Например, в ответах на острую инфекцию, вызванную вирусом натуральной оспы (ВНО) вирусоспецифические антитела к белку L1 способны связывать инфицированные клетки хозяина, вызывая цитотоксические реакции со стороны клеток-киллеров и др. [77]. Антитела к так называемому раннему антигену (ES), реагируют с ним в РСК, но не нейтрализуют ВНО [9].
Но почему именно белок L1 вызывает образование антител, обладающих протективным действием? Потому что его роль в морфогенезе вируса является определяющей, и во время сборки вирусной частицы он досягаем для антител. Консервативная часть L1 в области N-конца формирует гидрофобную «каверну», необходимую для сборки вириона ВНО. После лизиса клетки этот эктодомен экспонируется клеткам иммунной системы и вызывает сильный ответ с их стороны [77] Эффективное лечебное и профилактическое действие оказывают антитела к ботулиническим токсинам, столбнячному и дифтерийному токсинам, взаимодействующим с иммунной система человека по тем же принципам, что обычно приводятся в учебниках;
2) сыворотка пациента с развившимся инфекционным процессом всегда содержит смесь антител не только с разными мишенями, но и с разным механизмом действия. Репертуар таких антител варьирует в зависимости от вируса, состояния иммунной системы и стадии инфекционного процесса:
нейтрализующих возбудитель инфекционной болезни в присутствии комплемента;
нейтрализующих возбудитель инфекционной болезни без комплемента;
усиливающих инфекционный процесс посредством увеличения адгезии возбудителя инфекционной болезни к фагоцитирующим клеткам через Fc-рецепторы[4] (для клеток, содержащих Fc-рецепторы; см. ниже «Феномен антителозависимого усиления инфекции»);
усиливающих инфекционный процесс FcR-независимым образом, однако зависимым от комплемента (см. ниже «Феномен антителозависимого усиления инфекции») — для клеток, содержащих рецепторы комплемента;
усиливающих активацию вирусных белков путем изменения их конформации;
супрессирующих антивирусные ответы клетки на транскрипционном уровне;
оказывающих токсическое воздействие на клетку [67].
Возбудитель сибирской язвы (Bacillus anthracis) — в нашем анализе это самый простой случай. B. anthracis синтезирует трехсоставной токсин типа A1-B-A2. Он состоит из В-субъединицы, называемой протективным антигеном (protective antigen, PA) и двух ферментативных субъединиц (А-субъединиц), одна из которых — отечный фактор (кальмодулинзависимая аденилатциклаза); другая — летальный фактор, является металлопротеазой. PA используют в качестве антигенного компонента химических сибиреязвенных вакцин типа американской вакцины AVA (Anthrax Vaccine Adsorbed). К PA антитела образуются «как описано в учебнике», но действие адсорбированной вакцины направлено лишь на предотвращение заключительного этапа инфекционного процесса — поражения организма человека сибиреязвенным токсином. Создание антитоксического иммунитета не исключает развития начальных стадий инфекционного процесса — колонизации B. anthracis в области входных ворот и инвазии во внутреннюю среду организма. О низкой защитной эффективности этой вакцины свидетельствует сложная схема ее применения. Вакцина используется следующим образом. Выполняется первичная иммунизация, включающая три подкожные инъекции по 0,5 мл вакцины с интервалом в две недели и затем три дополнительных подкожных инъекции по 0,5 мл вакцины через 6, 12 и 18 мес. При сформировании иммунитета рекомендуется выполнять ежегодно по одной бустерной подкожной инъекции по 0,5 мл [10].
Возбудитель чумы. Противочумные сыворотки различных типов исследовались с конца XIX в. В 1960-х гг. стало окончательно ясно, что в иммунитете к чуме основная роль принадлежит клеточным факторам. Антитела к Yersinia pestis у заболевшего чумой человека появляются на 7-е сутки от начала болезни, но они рассматриваются как показатель недавнего контакта с этим микроорганизмом [7, 11].
Туляремия. Протективная роль антител против Francisella tularensis, обнаруживаемых в сыворотке реконвалесцента, незначительна. Введение специфических антител экспериментальным животным показало, что они могут препятствовать развитию туляремии, но только если животное заражается маловирулентными штаммами туляремийного микроба [24, 39].
Сап. Многочисленные попытки воспроизвести пассивный иммунитет введением специфических сывороток, полученных от лошадей, коров, собак, не дали положительных результатов. Ведение специфического антигена обостряет инфекционный процесс, сопровождающийся инфекционной аллергией, и животные погибают от развившейся инфекции, несмотря на высокие титры антител в их сыворотке, специфических к возбудителю сапа — Burkholderia mallei [8].
Мелиоидоз. Гуморальное звено иммунитета включается в иммуногенез с самого начала инфекционного процесса. В организме человека и животных начинают вырабатываться антитела, уровень которых зависит от интенсивности течения инфекции. Антитела у переболевших мелиоидозом людей и животных не обладают протективным действием и не защищают от повторного заражения Burkholderia pseudomallei. К тому же они не обладают высокой специфичностью и дают перекрестные реакции с возбудителями сапа и легионеллеза Обнаружение специфических антител в сыворотке крови человека или животного позволяет сделать вывод только о наличии у них мелиоидоза в прошлом, а при росте титра антител за кроткий период времени (2–3 нед) — об активно развивающейся мелиоидозной инфекции [13].
Ку-лихорадка. В настоящее время установлена роль клеточного звена иммунной системы в предотвращении и контроле над инфекцией, вызванной Coxiella burnetii. Роль же гуморального звена в контроле над инфекцией остается недоказанной. Антитела к антигенам II фазы можно обнаружить в крови человека через несколько дней после его инфицирования. Сначала появляются иммуноглобулины M (IgM), затем IgA и IgG. Уже на стадии выздоровления в крови у пациента появляются IgM к антигенам I фазы. В низких концентрациях их можно обнаружить через 2 года после завершения острой формы болезни. Ни для одного типа специфических антител не установлен защитный титр [52, 59].
Специфические антитела играют важную роль в поглощении C. burnetii макрофагами и полиморфоядерными лейкоцитами, но это не означает, что поглощенные макрофагом коксиеллы будут им «переварены». В условиях in vitro показано, что микроорганизмы I фазы разрушаются макрофагами значительно хуже, чем микроорганизмы II фазы. При добавлении антител к культурам клеток, коксиеллы могут размножаться в макрофагах, причем антитела к микроорганизму I фазы стимулируют их размножение более эффективно, чем антитела к микроорганизму II фазы [52, 59]. Приведенные данные показывают, что антитела к C. burnetii играют важную роль в развитии инфекционного процесса. И здесь скорее наблюдается феномен антителозависимого усиления инфекции (см. ниже), а не протективный эффект.
Возбудители вирусных геморрагических лихорадок (ВГЛ). При филовирусных, флавивирусных и буньявирусных инфекциях ответы со стороны иммунной системы человека на возбудитель инфекции мало похожи на те, что описаны в учебниках по иммунологии для студентов. Основную роль в них играют описанные ниже феномены антителозависимого усиления инфекции и антигенного импринтинга.
Арбовирусные энцефалиты. Даже высокие титры нейтрализующих поликлональных и моноклональных антител не предотвращают заражение, если оно происходит интраназально или ингаляционно [50, 51, 80]. Лечение с помощью вируснейтрализующих антисывороток не способно остановить развитие болезни [18].
Выше мы рассмотрели механизмы и примеры уклонения патогенных микроорганизмов от «бдительного ока» иммунной системы[5], но что происходит, когда она все же их узнает? Рассмотрим никогда не включаемые в учебники иммунологические феномены.
Феномен антителозависимого усиления инфекции (antibody-dependent enhancement, ADE). Когда авторы учебных пособий описывают будущим врачам благостную картину «борьбы» вирусоспецифических антител с вирусом, они обычно акцентируют их внимание на том, что антитело нейтрализует вирус, блокируя его связывание с рецептором-мишенью, способность к слиянию с клеткой и т.п. Иногда даже упоминают об опсонизации вируса путем активации классического пути комплемента. Если верить этой схеме, то разработка вакцин является очень простым занятием. Непонятно только, почему их так мало и почему нет до сих пор многократно обещанной вакцины, позволяющей «покончить со СПИДом как когда-то с натуральной оспой»[6]. Но дело в том, что это описание не более чем схема. В скрываемой иммунологии конформация комплекса «специфическое антитело-вирусный белок» может позволить Fc-фрагментам антител[7] взаимодействовать с Fc-рецептором на поверхности микрофага, облегчая оболочечному вирусу проникновение в макрофаг — в этом состоит суть феномена ADE. Вирусоспецифические антитела усиливают проникновение вируса в фагоцитирующие клетки и в отдельных случаях его репликацию в этих клетках посредством взаимодействия с рецептором Fc(FcR) и/или рецепторами комплемента на поверхности фагоцитирующих клеток. Поэтому феномен наблюдается в двух вариантах: а) комплемент-опосредованное антителозависимое усиление инфекции (complement-mediated ADE; C-ADE); и б) независящее от комплемента и связанное с Fc-рецептором усиление инфекции (Fc-receptor-mediated ADE; FcR-ADE) [67, 70].
Безоболочечным вирусам, образовавшим комплекс с антителом, способным взаимодействовать с Fc-рецептором, специфические рецепторы на поверхности клетки-мишени не требуются [67].
Общие особенности вирусов, вызывающих феномен ADE, далеки от образа «идеального антигена»: а) обычно такие вирусы реплицируются в макрофагах; б) они индуцируют продукцию большого количества антител с плохой способностью к нейтрализации гомологичных вирусов; в) способны к персистентной инфекции, характеризующейся продолжительной виремией [70].
ADE при ВИЧ-инфекции. Феномен обнаружен W. E. Robinson et al. [53] и J. Homsy et al. [33]. Наиболее важным эпитопом оболочечного белка ВИЧ для развития C-ADE у ВИЧ-инфицированных людей является иммунодоминантный регион gp41. Развитие FcR-ADE происходит благодаря антителам к V3-петле gp120 [28]. У ВИЧ-инфицированных людей соблюдается очередность проявления вариантов развития ADE. На ранней стадии инфекции феномен реализуется через V3-петлю gp120 (по типу FcR-ADE). По типу C-ADE феномен начинает проявляться перед клиническим прогрессированием ВИЧ-инфекции [69].
G. Fust [28] кратко суммировал клиническое значение феномена ADE для ВИЧ-инфекции — это прогрессирование инфекции; и облегчение переноса вируса от матери к плоду.
ADE при инфекционной анемии лошадей. Инфекционная анемия лошадей — лентивирусная инфекция лошадей, вызываемая вирусом инфекционной анемии лошадей (equine infectious anemia virus, EIAV). Проявляется синдромами лихорадки, анорексией, анемией и имеет возвратное циклическое течение в первый год после инфицирования. В последующем болезнь приобретает асимптоматическое течение, или у животного развивается сидром хронической слабости. С целью моделирования стратегий вакцинации против ВИЧ были проведены исследования по оценке эффективности вакцин против EIAV. Они показали серьезное обострение болезни у вакцинированных лошадей и пони, как следствие присутствия антител, индуцированных введением вакцины. C. Issel at al. [35] использовали виремию как критерий тяжести болезни и продемонстрировали, что инактивированная цельновирионная вакцина не может предотвратить развитие виремии у животного, которому введен вирулентный штамм вируса. Такая вакцина не смогла предотвратить развитие клинических симптомов болезни у пони, инфицированных EIAV. В экспериментах по заражению гетерологичным штаммом вируса животных, вакцинированных высокоочищенным оболочечным гликопротеином вируса, не удавалось ни предотвратить виремию, ни развитие клинических симптомов болезни. В последующем S. Wang et al. [73] провели масштабные эксперименты на пони и лошадях по оценке защитной эффективности рекомбинантной вакцины, полученной на основе поверхностного гликопротеина EIAV. Результаты экспериментов показали усиление инфекции у всех вакцинированных животных.
ADE при лихорадке Эбола. Вирус Эбола (семейство Filoviridae) вызывает острую геморрагическую лихорадку у людей и обезьян. Известны четыре подтипа вируса: Zaire (наиболее вирулентный, летальность среди заболевших людей достигает 90%), Sudan, Ivory Coast, Reston (последний не является патогенным для человека). Причины высокой вирулентности отдельных подтипов вируса Эбола, до работ A. Takada et al. [65] были неясны. Этими исследователями обнаружена способность сыворотки реконвалесцентов, переболевших лихорадкой Эбола (Zaire), увеличивать инфекционность вируса в отношении клеток 293-й линии, клеток почек обезьян и эндотелиальных клеток пупочной вены человека. Ими показано, что основную роль в инфекционности вируса играют отдельные анти-IgM, специфичные к гликопротеину вирусу (GP), т.е. феномен ADE. Далее они показали, что выраженность феномена ADE различна у сывороток, взятых от разных пациентов, переболевших лихорадкой Эбола. Аналогичные данные получены A. Takada et al. [65] с сывороткой, взятой от мышей, иммунизированных ДНК-вакциной с клонированы геном gp вируса Эбола. В эксперименте феномен ADE был менее выражен для непатогенного субтипа вируса Reston, чем для вирусов субтипов Zaire и Sudan. Поэтому A. Takada et al. [65] предположили, что феномен ADE играет важную роль в патогенезе лихорадки Эбола (рисунок).
В дальнейшем A. Takada et al. [68] показали в условиях in vitro, что ADE при инфекционном процессе, вызванном вирусом Эбола (Zaire), развивается в результате взаимодействия вирусоспецифических антител с вирусом и Fc-рецептором, или компонентом комплемента C1q и его рецептором (C-ADE вариант феномена). Выраженность ADE GP-антисыворотки связана с уровнями IgG2a и IgM, но не с уровнями IgG1. Используя моноклональные антитела, авторы определили эпитопы GP вируса субтипа Zaire, отвечающие за индукцию антител, вызывающих ADE. Они также сконструировали химерные эпитопы, индуцирующие продукцию антител у мышей со сниженной способностью вызывать ADE, но обладающих нейтрализующей активностью в отношении вируса субтипа Zaire.
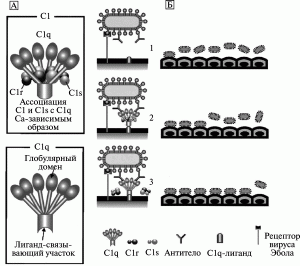 Модель C-ADE (C1q-ADE) при лихорадке Эбола. A. Схематическое изображение белков комплемента C1 и C1q. Молекула C1q включает глобулярный и лиганд-связывающий домены. Глобулярный домен состоит из шести глобулярных набалдашников (globular heads), связывающихся с Fc-участком антитела. Лиганд-связывающий домен C1q взаимодействует с лигандом на поверхности фагоцитирующей клетки. Аффинитет C1q к лиганду снижается при ассоциации с C1r и C1s (сериновые протеазы). Б. Механизм ADE при лихорадке Эбола. Вирус Эбола инициирует инфекционный процесс путем связывания со специфическими рецепторами на поверхности фагоцитирующей клетки (1). C1q связывает комплекс «вирус-антитело» с C1q-лигандами, расположенными на поверхности клеток, вызывая взаимодействие между вирусом и рецептором (2). Диссоциация C1r и C1s от C1q увеличивает связывающий аффинитет молекулы C1q с лигандами на поверхности фагоцитирующей клетки (3). По A. Takada et al. [66]
Модель C-ADE (C1q-ADE) при лихорадке Эбола. A. Схематическое изображение белков комплемента C1 и C1q. Молекула C1q включает глобулярный и лиганд-связывающий домены. Глобулярный домен состоит из шести глобулярных набалдашников (globular heads), связывающихся с Fc-участком антитела. Лиганд-связывающий домен C1q взаимодействует с лигандом на поверхности фагоцитирующей клетки. Аффинитет C1q к лиганду снижается при ассоциации с C1r и C1s (сериновые протеазы). Б. Механизм ADE при лихорадке Эбола. Вирус Эбола инициирует инфекционный процесс путем связывания со специфическими рецепторами на поверхности фагоцитирующей клетки (1). C1q связывает комплекс «вирус-антитело» с C1q-лигандами, расположенными на поверхности клеток, вызывая взаимодействие между вирусом и рецептором (2). Диссоциация C1r и C1s от C1q увеличивает связывающий аффинитет молекулы C1q с лигандами на поверхности фагоцитирующей клетки (3). По A. Takada et al. [66]
Для лихорадки Марбург феномен ADE описан в 2011 г. E. Nakayama et al. [46]. Так же как для вируса Эбола показана связь между ADE и вирулентностью штаммов вируса Марбург. Авторами сделан вывод, что феномен ADE лежит в основе патогенеза не только лихорадок Марбург и Эбола, но и других филовирусных лихорадок.
ADE при кори. Массовые вакцинации населения показали высокую защитную эффективность живых коревых вакцин, однако ежегодно в мире при наличии широких программ вакцинации, корью заболевают более чем 30 млн человек и из них от 0.5 до 0.7 млн погибают от этой болезни [50a]. C начала 1960-х гг., т.е. после начала массовых иммунизаций населения вакцинами, инактивированными формалином, среди вакцинированных людей отмечаются случаи так называемой атипичной кори (кори, протекающей в тяжелой форме). I. D. Iankov et al. [34] показали, что в основе ее развития может лежать феномен ADE, вызываемый антителами к гемагглютинину вируса (поверхностный белок Н).
ADE при лихорадке Денге. Вирус лихорадки Денге принадлежит к семейству Togaviridae и вызывает геморрагическую лихорадку Денге. Всего в мире ежегодно регистрируются до 50 млн случаев лихорадки Денге. Известно 4 серотипа вируса Денге (DV1–DV4). Впервые перенесенная инфекция чаще всего протекает бессимптомно и дает пожизненный иммунитет к вирусу серотипа, ее вызвавшего. Однако если переболевший человек сталкивается с вирусом другого серотипа, то благодаря FcR-ADE, болезнь протекает в тяжелой форме с большой вероятностью летального исхода (до 50%) [20].
Феномен ADE изучен фрагментарно. Кроме выше описанных инфекционных процессов, вызываемых вирусами, представителями семейств Retroviridae, Filoviridae, Paramyxoviridae, Togaviridae, он наблюдается при инфекциях, вызываемых отдельными представителями Picornaviridae (Human enterovirus 71) [31], Bunyaviridae (вирус Хантаан) [78] и Flaviviridae (вирусы энцефалита долины Мюррей Murray, энцефалита Западного Нила, гепатита С) [72, 44]. Так же феномен ADE обнаружен при инфекциях, вызываемых бактериальными патогенами [32, 79], но для них он изучен еще менее детально, чем для инфекций, вызываемых вирусами.
Феномен антигенного импринтинга (другое название —феномен первичного антигенного греха, phenomenon of original antigenic sin, OAS[8]). Авторы учебных пособий для врачей избегают этот иммунологический феномен не менее тщательно, чем феномен ADE. Его суть в следующем: иммунная система человека, иммунизированного одной антигенной детерминантой (первой), и позже экспонированная к другому антигену (второму), имеющему структурное сходство с первой детерминантой, отвечает не на вторую, а на первую.
Развитие OAS происходит по следующему механизму. Т- и В-клетки памяти, образовавшиеся из так называемых «наивных» клеток (см выше «Иммуноглобулины и антитела») в результате контакта с чужеродным для организма антигеном, представляют собой длительно живущую популяцию антигенспецифических покоящихся клеток, готовых реагировать на повторное введение антигена. Они хранят информацию о ранее действовавших антигенах и формируют вторичный иммунный ответ, осуществляющийся в более короткие сроки, чем первичный иммунный ответ. Как правило, этот материал есть в любом учебнике. Дальше идет объяснение феномена образования специфических антител с точки зрения существования в природе некого «идеального антигена». Но его может не оказаться при реальном инфекционном процессе.
В промежуток времени между первичной или вторичной инфекцией, в результате точечных мутаций могут меняться некоторые поверхностные белки, формирующие эпитопы вируса. Кроме того, отдельные карбонгидратные антигены и антигены со структурной и функциональной гомологией, и без дополнительных мутаций в кодирующих их генах индуцируют незначительно различающиеся иммунные ответы [21]. При повторном контакте иммунной системы с вирусом или вакциной, различия между старым вариантом эпитопа, и его новым вариантом, иммунной системой могут не восприниматься. В процессе антигенной стимуляции первыми активизируются В-клетки памяти, «запомнившие» предыдущий антиген, и выработка антител происходит в отношении этого антигена, хотя реально иммунная система с ним не контактирует. Образующиеся антитела не способны нейтрализовать вирус, вызвавший инфекционный процесс. Выработка же специфических антител к нему тормозится из-за подавления «наивных» В-клеток активизировавшимися В-клетками памяти [37].
Вирусы, вызывающие феномен OAS, также как и в случае с ADE, далеки от образа «идеального антигена». Для них характерны:
ограниченность антигенных эпитопов;
большое количество карбонгидратов, экранирующих эпитопы, и/или ограниченные иммунодоминантные эпитопы;
перекрестно-реактивные детерминанты у семейств малосвязанных патогенов;
выраженная и олигомерная презентация эпитопов иммунной системе;
незначительные различия в аминокислотных последовательностях или в форме антигена и гомологичных белков хозяина;
анамнестический ответ, наступающий вслед за введением гетерологичного антигена;
рекуррентная инфекция или бустинг вирусами или антигенами, увеличивающие гуморальный иммунный ответ к первоначальному инфекционному агенту или антигену;
пул длительно живущих клеток В-памяти;
олигоклональный сывороточный профиль (т.е. происходит ответ только на доминантные эпитопы);
преобладание клонально-производных В-клеток и популяций антител, специфичных для эпитопа [47].
Вопреки сложившейся практике замалчивания, OAS хорошо изучен для инфекций, вызываемых возбудителями малярии [75], лихорадки Денге [30, 45], ВИЧ/СПИДа [47] и гриппа [22, 23, 43, 37, 74].
OAS при ВИЧ-инфекции. То, что ВИЧ-инфекция сопровождается развитием феномена OAS, известно уже более 20 лет [47], но напоминать об этом не принято, так как можно остаться без финансирования на разработку очередной ВИЧ-вакцины, способной «покончить со СПИДом, как когда-то с натуральной оспой».
P. Nara et al. [47] обнаружили феномен OAS при ВИЧ-инфекции случайно. Видимо и они при создании ВИЧ-вакцины рассчитывали на некие «идеальные антигены», вызывающие идеальный штаммоспецифический гуморальный иммунный ответ к ВИЧ. Первоначальной целью их экспериментов было расширение иммунного ответа на ВИЧ-вакцину на основе gp120 таким образом, чтобы нейтрализации антителами подвергались вирусы различного географического происхождения. Введя экспериментальным животным gp120, полученный из штамма ВИЧ-1 IIIB, они исследовали кинетику, напряженность и продолжительность штаммо-специфического иммунного ответа. Через 175 сут исследователи начали вторую серию опытов по иммунизации животных gp120, выделенным из штамма ВИЧ-1 RF, и имеющим другое географическое происхождение. После примирующей иммунизации (7–14 сут) исследователи выявили рост титров антител к gp120 штамма IIIB. Проведенный ими ретроспективный анализ научной литературы показал, что феномен OAS уже был описан для других ретровирусных инфекций, в частности, вызываемых вирусом висны у овец [48] и вирусом инфекционной анемии у лошадей [38].
P. Nara et al. [47] также получили любопытные данные по развитию ВИЧ-инфекции и гуморальных иммунных ответов у шимпанзе, уже иммунизированных вакциной на основе gp120 IIIB: во-первых, у иммунизированных животных ВИЧ-инфекция все же развивается, но иммунная реакция на ВИЧ у них наступает быстрее и развивается более интенсивно; во-вторых, иммунная реакция на введение 6- и 16-недельных штаммов ВИЧ, имитирующих изменчивость вируса во время инфекционного процесса, развивается менее интенсивно, чем в контроле. При этом проявляется феномен OAS по отношению к штамму ВИЧ, gp120 которого был использован для иммунизации.
OAS при гриппе. Феномен OAS описан в 1953 г. F. M. Davenport et al. [23]. При исследовании образцов сывороток крови, взятых от детей во время вспышки гриппа, они обнаружили, что в сыворотке детей, переболевших гриппом до вакцинации, мало антител к вирусу, использованному для вакцинации, но много антител к вирусам гриппа, циркулирующим ранее. В последующие годы этот феномен нашел многократное подтверждение в работах других исследователей как для живых, так и убитых гриппозных вакцин [22, 43, 37]. Антигенное расстояние между штаммами вирусов гриппа, необходимое для индукции OAS, в настоящее время неизвестно. Известно только то, что этот феномен не наблюдается при последовательном заражении животных антигеннодалекими штаммами вируса гриппа [74].
Не включаемые в учебники иммунологические феномены в эпидемических процессах. Уже в силу замалчивания самого факта их существования их роль в эпидемических процессах изучена поверхностно. Однако краткую сводку все же можно сделать по имеющимся данным. Знание этих процессов определяет также и походы к доклиническому и клиническому исследованию вакцин.
Антигенный импринтинг. Глобальная профанация эпидемиологии гриппа под названием «пандемия свиного гриппа» не помешала отдельным ученым получить важные научные результаты. Четыре эпидемиологических исследования распространения вируса пандемического гриппа H1N1, выполненные в Британской Колумбии в 2009 г., показали повышенный риск развития гриппа у лиц, ранее вакцинированных тривалентной инактивированной гриппозной вакциной на основе штаммов вируса H1N1 (trivalent inactivated influenza vaccine, TIV), применяемой для профилактики «сезонного гриппа». Авторы связывают повышенный риск развития гриппа у вакцинированных людей с феноменами OAS, ADE и другими, еще неизвестными факторами, на необходимость изучения которых они обращают внимание исследователей [36, 60].
Тогда же не менее интересные данные, объясняющие приведенные выше, были получены J. H. Kim et al. [37]. В экспериментах на животных они показали, что после последовательной вакцинации мышей инактивированными вакцинами, полученными на основе разных штаммов вируса гриппа серотипа H1N1 (PR8 и FM1), мыши становятся более восприимчивыми к заражению адаптированным штаммом FM1. Титр вируса гриппа в легких мышей, вакцинированных сначала PR8, а затем FM1, был в 46 раз выше, чем у мышей, вакцинированных только инактивированным FM1. Мыши, вакцинированные сначала инактивированной вакциной, затем живой, также демонстрируют выраженный феномен OAS. По своей сути эти эксперименты моделируют ежегодные массовые вакцинации против так называемых сезонных серотипов вирусов гриппа.
Феномен OAS при одной инфекции может сопровождать человека всю его жизнь. A. Adalja и D. A. Henderson [16] обобщили данные разных авторов, показывающие значительно меньшую подверженность заболеванию гриппом у людей, родившихся до 1956 г., т. е. тех, чья иммунная система ранее уже контактировала с вирусом гриппа серотипа H1N1, объяснили это феноменом OAS. Это означает, что штамм вируса гриппа, объявленный в 2009 г. «новым», по антигенному составу был идентичен тому, что циркулировал среди населения вначале 1950-х гг. Он активизировал В-клетки памяти, «запомнившие» его более 60 лет назад, те дифференцировались в плазмоциты, продуцирующие антитела, оказавшие протективный эффект.
Роль OAS в эпидемических процессах следующая:
1) при полном антигенном совпадении с возбудителем инфекционной болезни, сформировавшем В-клетки памяти в некотором прошлом, ими вырабатываются специфические антитела, обладающие протективным действием, иммунный ответ носит выраженный протективный характер. Ретроспективным эпидемиологическим анализом будут обнаружены возрастные группы населения, оказавшиеся не вовлеченными в пандемию (см. работу A. Adalja и D. A. Henderson [16]);
2) если такого антигенного совпадения нет, но иммунная система не может «отличить»» штамм возбудителя инфекционной болезни от того, что сформировал В-клетки памяти в некотором прошлом, плазмоциты синтезируют антитела, специфичные к штамму возбудителя инфекционной болезни, распространявшегося в ту пандемию, когда сформировались В-клетки памяти, т.е. «отрабатывают ложную цель». При эпидемиологическом анализе будут выделены возрастные группы населения, понесшие наибольшие потери в данную пандемию. Возможно, феномен OAS внес свой «вклад» в массовую смертность, наблюдавшуюся во время пандемии «испанки» 1918 г., так как пандемия развивалась тремя волнами, каждая последующая была смертельней предыдущей, но ее жертвами становились в основном люди до 30 лет (более подробно о пандемии «испанки» см. в работе [12]);
3) если антигенная дистанция между штаммом, вызвавшим инфекционный процесс в прошлом, и вызвавшем новый инфекционный процесс настолько велика, что иммунная система его распознает, то иммунный ответ будет направлен на противодействие новому штамму. Одновременно сформируются новые В-клетки памяти, которые при последующих вспышках этой же инфекционной болезни будут реагировать с возбудителем болезни так как описано выше.
При массовых вакцинациях эти принципы соблюдаются, о чем, в частности свидетельствуют работы [36, 60].
Феномен антителозависимого усиления инфекции. В эпидемических процессах проявляется усилением тяжести инфекционного процесса, большим количество осложнений и летальных исходов. Наиболее детально феномен ADE изучен при эпидемических процессах, вызываемых вирусом геморрагической лихорадки Денге (Dengue virus). Известно четыре серотипа вируса Денге (DV1-DV4). Геморрагическая лихорадка развивается при перекрестном инфицировании любым из серотипов вирусов. Первая инфекция чаще всего протекает у человека бессимптомно и дает пожизненный иммунитет к вирусу серотипа, ее вызвавшего. Однако если он сталкивается с вирусом другого серотипа, то благодаря FcR-ADE, болезнь протекает в тяжелой форме с большой вероятностью летального исхода (до 50%) [20]. ADE рассматривается как основная причина нейровирулентности вируса желтой лихорадки (Viscerophilus tropicus) и тяжелого течения болезни. Показана связь ADE с антителами (нейтрализующими, не нейтрализующими и протективными) к гликопротеину Е вируса желтой лихорадки [19, 29].
M. J. Wallace et al. [72] предположили, что феномен ADE может способствовать замене одного эпидемического процесса другим. В опытах на мышах они установили, что антитела к вирусу японского энцефалита в субнейтрализующих концентрациях увеличивают вирусемию и смертность среди мышей, зараженных вирусом энцефалита долины Мюррей (MVEV). Исследователи считают, что программы по вакцинации населения к вирусу японского энцефалита, в тех районах, где одновременно с ним циркулирует и MVEV, могут способствовать развитию эпидемии энцефалита Долины Мюррей.
Приведенные выше данные (см. «Феномен антителозависимого усиления инфекции»), дают основание считать, что аналогичные процессы могут развиваться при массовых вакцинациях.
***
Современному врачу надо понимать, что учебные программы, по которым он получил подготовку по иммунологии и эпидемиологии, не содержат огромного массива информации о роли иммунной системы в инфекционных и эпидемических процессах, уже накопленной в научной литературе. Причем так называемое «академическое сообщество» показало себя не с лучшей стороны как в вопросах повышения качества образования, ограничившись начетническим переписыванием одних и тех же учебников, принципиально устаревших после обнаружения пандемии ВИЧ/СПИДА, так и в вопросах реагирования на ситуации, когда требуется принятие управленческих решений, обоснованных научными знаниями. В 2009 г. в разгар искусственно созданной паники по поводу «свиного гриппа» мы, рядовые медицинские работники, оказались в ситуации, когда коммерческие интересы производителей вакцин и научного истеблишмента совпали. Вместо реальных знаний об эпидемиологии гриппа нам навязали контагионистические представления средневековья об эпидемиях, в современной интерпретации представленные как появление нового вируса, который вызовет «испанку». Якобы вирус гриппа будет распространяться только потому, что он «новый», а вызовет «испанку» потому, что он «смешается с вирусом сезонного гриппа». И это все знания по эпидемиологии гриппа, которые нам тогда отдозировали! А единственный выход — вакцинация, вакцинация и еще раз вакцинация, несмотря ни на феномен антигенного импринтинга, описанный еще в 1953 г. [23] именно во время эпидемий гриппа; на ни то, что среди населения сотни тысяч людей имеют ВИЧ-статус, не подозревая о нем; ни даже на то, что «слухи о пандемии были явно преувеличены». Какой-то препарат, образующий антитела к вирусу гриппа, нам демонстрировали как вакцину. Этот примитивный рекламный трюк производителей вакцин, к сожалению, представляет собой основные знания врачей о вакцинах на основных рынках их сбыта. В самих же США ситуация не столь однозначна. M. J. Wallace et al. [72], S. Thomas et al. [69] и J-F Han et al. [31] уже прямо ставят вопрос о необходимости обязательного изучения феномена ADE в процессе разработки вакцин и при проведении массовых вакцинаций. Adalja A. и Henderson D. A [16] настаивают на изменении политики вакцинации с учетом феномен OAS.
Поэтому нам надо научиться самим разбираться в многообразии рекламных и научных источников, выделяя те, которые написаны либо специалистами без достаточной подготовки, что бы рекомендовать какие-либо мероприятия для миллионов людей, либо преследующих свои коммерческие выгоды.
При исследовании содержания публикации, прежде всего надо обращать внимание на ее вводную часть. Здесь сразу можно увидеть несколько «родовых меток», характеризующих низкую компетенцию специалиста:
утверждение, что вакцина вызывает выработку специфических антител, которые борются с инфекцией (типовая фраза: «…большинство вакцин против бактерий и вирусов стимулируют выработку антител, которые борются с инфекцией») — с учетом выше приведенных научных данных можно его не комментировать. Хочу только заметить, что основную защитную роль в поствакцинальном иммунитете играет все же его клеточное звено. Такие работы часто встречаются в контексте расширения применения отдельных вакцин на группы населения, которые ранее не вакцинировали из-за риска возникновения осложнений, например, ВИЧ-инфицированных детей или детей-инвалидов. Прямо так и пишут — у ребенка появились антитела, что, по мнению авторов, равно иммунитету. Дальнейшей судьбой ребенка обычно не интересуются;
утверждение, что с натуральной оспой покончили с помощью вакцинации — это ничем не замаскированная ложь. Действительно, вся стратегия Программы ликвидации натуральной оспы в глобальном масштабе, провозглашенной ВОЗ в 1959 г., на её первом этапе сводилась к массовой вакцинации населения. Но в реальных условиях ликвидации оспы в развивающихся странах использованием только массовых прививок оказалось недостаточным. Основным компонентом второго этапа Программы (октябрь, 1967 г.) во всех ее фазах экспертами ВОЗ был определен эпиднадзор. Проведение систематической вакцинации населения стало рассматриваться как поддерживающая мера. Новая для программы система оказалась более эффективной для прерывания трансмиссии оспы, чем «поголовная» вакцинация даже в тех случаях, когда было вакцинировано менее половины населения на данной территории. С учетом этих данных Комитет экспертов ВОЗ определил эпиднадзор, а не вакцинацию, как краеугольный камень стратегии ликвидации натуральной оспы [6, 10, 14];
утверждение, что вакцинация является единственным способом борьбы с эпидемиями — это тоже неправда. Классическая триада эпидемического процесса предполагает сцепку трех звеньев эпидемической цепи: источника возбудителя инфекции (например, эпизоотии среди диких животных), механизма передачи возбудителя инфекции (наличие инфицированных насекомых, способных паразитировать на людях и животных; например, блохи, как переносчики возбудителя чумы от больных чумой крыс к людям) и восприимчивости населения к данной инфекции [15]. Вакцинация направлена только на блокирование третьего звена эпидемической цепи, но эпидемиологи знают, как можно блокировать и два предыдущих.
По сути работ надо обращать внимание на систему доказательств протективного эффекта вакцины и ее безопасности. Если приведена только табличка с динамикой и титрами специфических антител, можно дальше не читать. Если приводятся доказательства протективного эффекта в опытах на животных (доклинические исследования) необходимо проверить по базе медицинской информации PubMed наличие публикаций по ADE, OAS и суперантигенному эффекту среди представителей вирусов данного семейства. Их наличие при отсутствии экспериментальных данных по этим феноменам в исследуемой публикации свидетельствует о неполном получении доказательств безопасности и эффективности вакцины ее разработчиками.
По личностям самих авторов таких публикаций обращайте внимание на то, в каких частных структурах они являются консультантам, интересы каких фармацевтических компаний и предприятий они выражают на научных конференциях, в каком бизнесе работают их родственники. Найдете много интересного. Меньше всего рассчитывайте на такое нематериальное понятие, как научная репутация.
Список сокращений, нераскрытых в тексте
IFN (Interferon) — интерферон
IL (Interleukin) — интелейкин
LT (lymphotoxin) — лимфотоксин
TNF (Tumor necrosis factor) — фактор некроза опухоли
ЛПС — липополисахарид
РСК — реакция связывания комплемента
Литература
1. Богомолов Б.П. Инфекционные болезни: неотложная диагностика, лечение и профилактика. — М., 2007.
2. Борисов Л.Б. Медицинская микробиология, вирусология, иммунология. — М., 2001.
3. Воробьев А.А. Не подводя черты. — М., 2003.
4. Воробьев А.А., Быков А.С., Пашков Е.П. с соавт. Микробиология, М., 1992.
5. Галактионов В.Г. Эволюционная иммунология. — М., 2005.
6. Глобальная ликвидация оспы. Заключительный доклад Глобальной комиссии по удостоверению ликвидации оспы. Женева, декабрь 1979 г. — ВОЗ, Женева, 1980.
7. Домарадский И.В. Чума. — М., 1998.
8. Кравченко А.Т., Руднев Г.П. Сап // Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. — М., 1966. — Т. VII, С. 327–346.
9. Маренникова С.С., Щелкунов С.Н. Патогенные для человека ортопоксвирусы. — М., 1998.
10. Садовой Н.В., Кравец И.Д., Селиваненко Г.М. с соавт. Патент 2115433 RU, МПК6 A61K39/07. Вакцина сибиреязвенная комбинированная / RU, MKИ A61K39/07/ патентообладатель НИИ микробиологии МО РФ (Россия); заявл. 1992.08.28; опубл. 1998.07.20.
11. Супотницкий М.В., Супотницкая Н.С. Очерки истории чумы. — М., 2006.
12. Супотницкий М.В. Пандемия «испанки» 1918–1920 гг. в контексте других гриппозных пандемий и «птичьего гриппа» // Медицинская картотека. — 2006. — № 11. — С. 31–34; № 12. — 15–25, 28–30; 2007. — № 1. — С. 16–22.
13. Тихонов Н.Г., Рыбкин В.С., Жукова С.И. с соавт. Иммунология мелиоидоза // Мелиоидоз. Сборник научных трудов. По ред. Н. Г. Тихонова. — Волгоград, 1995. — С. 119–142.
14. Хендерсон Д.А. Победа всего человечества // Здоровье мира. — 1980. — Май. — С. 3–5.
15. Черкасский Б.Л. Руководство по общей эпидемиологии — М., 2001.
16. Adalja A., Henderson D.A. Original antigenic sin and pandemic (H1N1) 2009 // Emerg. Infect. Dis. — 2010. — Vol. 16, № 6. — P. 1029–1029.
17. Alcami A. New insights into the subversion of the chemokine system by poxviruses // Eur. J. Immunol. — 2007. — Vol. 37. — P. 880–883.
18. Army FM 8-284. Navy NAVMED P-5042 Air Force AFMAN (I) 44-156 Marine Corps MCRP 4-11.1C, 2000.
19. Barrett A.D.T., Gould A. Antibody-mediated early death in vivo after infection with Yellow fever virus // J. Gen. Virol. — 1986, Vol. 67. — P. 2539–2542.
20. Boonnak K., Slike B., Timothy H. et al. Role of dendritic cells in antibody-dependent enhancement of Dengue Virus infection // J. Virol. — 2008. — Vol. 82, № 8. — P. 3939–3951.
21. Briles D.E., Davie J.M. Clonal nature of the immune response. II. The effect of immunization on clonal commitment // J. Exp. Med. — 1980 — Vol. 152. — P. 151–160.
22. Couch R.B., Webster R.G. Cate T.R. et al. Efficacy of purified influenza subunit vaccines and relation to the major antigenic determinants on the hemagglutinin molecule // J. Infect. Dis. — 1979. — Vol. 140. — P. 553–559.
23. Davenport F.M., Hennessy A.V., Francis T. Epidemiologic and immunologic significance of age distribution of antibody to antigenic variants of influenza virus // J. Exp. Med. — 1953. — Vol. 98. — P. 641–656.
24. Elkins K.L., Rhinehart-Jones T.R., Culkin S.J. et al. Minimal requirements for murine resistance to infection with Francisella tularensis LVS // Infect. Immun. — 1996. — Vol. 64. — P. 3288–3293.
25. Espinoza C., Feeney A. The extent of histone acetylation correlates with the differential rearrangement frequency of individual VH genes in Pro-B Cells // J. Immunol. — 2005. — Vol. 175. — P. 6668–6675.
26. Finlay B., Falkow S. Common themes in microbial pathogenicity // Microbiol Rev. — 1989. — Vol.53, № 2. — P. 210–230.
27. Francis T. Influenza: the new acquaintance // Ann. Intern. Med. — 1953. — Vol. 39, № 2 — P. 203–221.
28. Fust G. Enhancing antibodies in HIV infection // Parasitology. — 1997. — Vol. 115, Suppl: S 127–140.
29. Goulld E.A., Buckley A. Antibody-dependent enhancement of Yellow Fever and Japanese encephalitis virus neurovirulence // J. Gen. Virol. — 1989. — Vol. 70. — P. 1605–1608.
30. Halstead S.B., Rojanasuphot S., Sangkawibha N. Original antigenic sin in dengue // Am. J. Trop. Med. Hyg. — 1983 — Vol. 32, № 1. — P. 154–156.
31. Han J-F., Cao R., Deng Y. et al. Antibody dependent enhancement infection of Enterovirus 71 in vitro and in vivo // Virol. J. — 2011. — Vol. 8 .
32. He X., Sun X., Wang J. et al. Antibody-enhanced, Fc gamma receptor-mediated endocytosis of Clostridium difficile toxin A // Inf. Immunol. — 2009. — Vol. 77, № 6. — P. 2294–2303.
33. Homsy J., Meyer M., Tateno M. et al. The Fc and not CD4 receptor mediates antibody enhancement of HIV infection in human cells // Science. —1989. — Vol. 16, № 244. — P. 1357–1360.
34. Iankov I.D., Pandey M., Harvey M. et al. Immunoglobulin G antibody-mediated enhancement of measles virus infection can bypass the protective antiviral immune response // J. Virol. — 2006. — Vol. 80, № 17. — P. 8530–8540.
35. Issel C.J., Horohov D.W., Lea D.F. et al. Efficacy of inactivated whole-virus and subunit vaccines in preventing infection and disease caused by equine infectious anemia virus // J. Virol. — 1992. — Vol. 66. — P. 3398–3408.
36. Janjua N.Z., Skowronski D.M., Hottes T.S. et al. Seasonal influenza vaccine and increased risk of pandemic A/H1N1‐related illness: first detection of the association in British Columbia, Canada // Clin. Infect. Dis. — 2010. — Vol. 51, № 9. — Р. 1017–1027.
37. Kim J. H., Skountzou I., Compans R. et al. // Original antigenic sin responses to influenza viruses // J. Immunol. — 2009. — Vol. 183. — P. 3294–3301.
38. Kono Y., Kobayashi K., Fukunaga Y. Serological comparison among various strains of equine infectious anemia virus // Arch. Gesamte Virusforsch. — 1971. — Vol. 34. — P. 202–208.
39. Kroca M., Tarnvik A., Sjostedt A. The proportion of circulating gammadelta T cells increases after the first week of onset of tularaemia and remains elevated for more than a year // Clin. Exp. Immunol. — 2000. — Vol. 120. — P. 280–284.
40. Kwun H.J., Han H.J., Lee W.J. et al. Transactivation of the human endogenous retrovirus K long terminal repeat by herpes simplex virus type 1 immediate early protein 0 // Virus. Res. — 2002. — Vol. 86 . — P. 93–100.
41. Lafon M., Lafage M., Martinez-Arends A. et al. 1992. Evidence for a viral superantigen in humans // Nature. — 1992. — Vol. 358. — P. 507–510.
42. Leroy E., Becquart P., Wauquier N. et al. Activity evidence for Ebola virus superantigen // J. Virol. — 2011. — Vol. 85, № 8. — P. 4041–4042.
43. Marine W., Thomas J. Antigenic memory to influenza A viruses in man determined by monovalent vaccines // Postgraduate Medical J. 1979. Vol. 55. P. 98–108.
44. Meyer K., Ait-Goughoulte M., Keck Zhen-Yong et al. Antibody-dependent enhancement of hepatitis C virus infection // J. Virol. — 2008. — Vol. 82, № 5. — P. 2140–2149.
45. Mongkolsapaya J., Dejnirattisai W., Xiao-Ning X. et al. Original antigenic sin and apoptosis in the pathogenesis of dengue hemorrhagic fever // Nat. Med. — 2003. — Vol. 9. — P. 921–927.
46. Nakayama E., Tomabechi D, Matsuno K. et al. Antibody-dependent enhancement of Marburg virus infection // J. Infect. Dis. — 2011. — Vol. 204, Suppl. 3. — P. 978–985.
47. Nara P., Smit L., Dunlop et al . Evidence for rapid selection and deletion of HIV-1 subpopulations in vivo by V3-specific neutralizing antibody: a model of humoral-associated selection // In 21st Congress of the JABS on Progress in Animal Retroviruses, Annecy, France, 1989 and Dev. BioL Stand. — 1990. — Vol. 72. — P. 315–341.
48. Narayan O., Griffin D.E., Clements J.E. Virus mutation during «slow infection»: temporal development and characterization of mutants of visna virus recovered from sheep // J. Gen. Virol. — 1978. — Vol. 41. — P. 343–352.
49. Nelson P.N., Hooley P., Roden D. et al. Human endogenous retroviruses: transposable elements with potential? // Clin. Exp. Immunol. — 2004. — Vol. 138 . — P. 1–9
50. Paessler S., Yun N.E., Judy B.M. et al. Alpha-beta T cells provide protection against lethal encephalitis in the murine model of VEEV infection // Virology. — 2007. — Vol. 367, № 2. — P. 307–323.
50a Rall G.F. Measles virus 1998–2002: progress and controversy // Annu. Rev. Microbiol. — 2003. — Vol. 57. — P. 343–367.
51. Reed D.S., Lind C.M., Sullivan L.J. et al. Aerosol infection of cynomolgus macaques with еnzootic strains of Venezuelan equine encephalitis // J. Infect. Dis. — 2004. — Vol.189. — Р.1013–1017.
52. Reimer L.G. Q Fever // Clin. Microbiol. Rev. — 1993. — Vol. 6, № 3. — P. 193–198.
53. Robinson W.E., Montefiori D.C., Mitchell W.M. Will antibody-dependent enhancement of HIV-1 infection be a problem with AIDS vaccines? // Lancet. — 1988. — № 1(8589). — P. 830–831.
54. Russell W.C. Adenoviruses: update on structure and function // J. Gen. Virol. — 2009. — Vol. 90. — P. 1–20.
55. Sakural F. Development and evaluation of a novel gene delivery vehicle composed of adenovirus serotype 35 // Biol. Pharm. Bull. — 2008. — Vol. 31, № 10. — P. 1819–1825.
56. Scanlan C.N., Pantophlet R., Wormald M.R. et al. The broadly neutralizing anti-human immunodeficiency virus type 1 antibody 2G12 recognizes a cluster of alpha1-->2 mannose residues on the outer face of gp120 // J. Virol. — 2002. — Vol. 76. — P. 7306–7321.
57. Segerman A., Arnberg N., Erikson A. et al. There are two different species B adenovirus receptors: sBAR, common to species B1 and B2 adenoviruses, and sB2AR, exclusively used by species B2 adenoviruses // J. Virol. — 2003. — Vol. 77. — P. 1157–1162.
58. Seifert H.S. Molecular mechanisms of antigenic variation in Neisseria gonorrhoeae // Mol. Cell Biol. Hum. Dis. — 1992. — Vol. 1, № 1. — P. 1–22.
59. Shannon J., Heinzen R. Adaptive immunity to the obligate Intracellular pathogen Coxiella burnetii // Immunol. Res. — 2009. — Vol. 43, № 1–3. — P. 138–148.
60. Skowronski D.M., DeSerres G., Crowcroft N. et al. Association between the 2008–09 seasonal influenza vaccine and pandemic H1N1 illness during spring–summer 2009: four observational studies from Canada // PLoS Med. — 2010. — Vol. 7 — Is. 4 (e1000258. doi:10.1371/journal.pmed.1000258).
61. Smith S.A., Kotwal G.J. Immune response to poxvirus infections in various animals // Crit. Rev. Microbiol. — 2002. — Vol. 28, № 3. — P. 149–185.
62. Stanford M., McFadden G., Karupiah G. Immunopathogenesis of poxvirus infections: forecasting the impending storm // Immunology and Cell Biology. — 2007. — Vol. 85. — P. 93–102.
63. Stern A., Meyer T.F. Common mechanism controlling phase and antigenic variation in pathogenic neisseriae // Mol. Microbiol. — 1987. — Vol. 1, № 1. — P. 5–12.
64. Sutkowski N., Palkama T. Ciurli C. et al. An Epstein-Barr virus-associated superantigen // J. Exp. Med. —1996. — Vol. 184. — P. 971–980.
65. Takada A., Watanabe S., Okazak K. et al. Infectivity-Enhancing antibodies to Ebola virus glycoprotein // J. Virology. — 2001. — Vol. 75, № 5. — P. 2324–2330.
66. Takada A., Feldmann H., Ksiazek T.G. et al. Antibody-dependent enhancement of Ebola virus infection // J. Virol. — 2003. — Vol. 77, № 13. — P. 7539–7544.
67. Takada A., Kawaoka Y. Antibody-dependent enhancement of viral infection: molecular mechanisms and in vivo implications // Rev. Med. Virol. — 2003. — Voi. 13, № 6. — P. 387–398.
68. Takada A., Ebihara H., Feldmann H. et al. Epitopes required for antibody-dependent enhancement of Ebola virus infection // J. Infec. Dis. — 2007. — Vol. 196. — P. 347–356.
69. Thomas H.I., Wilson S., O”Tolle C.M. et al. Differential maturation of avidity of IgG antibodies to gp41, p24 and p17 following infection with HIV-1 // Clin. Exp. Immunol. — 1996. — Vol. 103. — P. 185—191.
70. Tirado S.M., Yoon K.S. Antibody-dependent enchancement of virus infection and disease // Viral. Immunol. — 2003. — Vol. 164, № 1. — P. 69–86.
71. Ulrich R.G., Sidell S., Taylor T. et al. Staphylococcal enterotoxin B and related pyrogenic toxins // Medical aspects of Chemical and Biological Warfare / Ed. F.R. Sidell, E.T. Tafuqi, D.R. Franz. — Washington, 1997. — P. 621–630.
72. Wallace M.J., Smith D.W., Broom A.K. et al. Antibody-dependent enhancement of Murray Valley encephalitis virus virulence in mice // J. Gen. Virol. — 2003. — Vol. 84, № 7. — P. 1723–1728.
73. Wang S.Z., Rushlow K.E., Issel C.J. et al. Enhancement of EIAV replication and disease by immunization with a baculovirus-expressed recombinant envelope surface glycoprotein // Virology — 1994. — Vol. 199. — P. 247–251.
74. Webster R.G. Original antigenic sin in ferrets: the response to sequential infections with influenza viruses // J. Immunol. — 1966. — Vol. 97. — P. 177–183.
75. Wipasa J., Xu Huji, Liu Xueqin et al. Effect of Plasmodium yoelii exposure on vaccination with the 19-kilodalton carboxyl terminus of merozoite surface protein 1 and vice versa and implications for the application of a human malaria vaccine // Infect. Immun. — 2009. — Vol. 77, № 2. — P. 817–824.
76. Wyatt R., Kwong P.D., Desjardins E. et al. Structure of an HIV gp120 envelope glycoprotein in complex with the CD4 receptor and a neutralizing human antibody // Nature. — 1998. — Vol. 393. — P. 705–711.
77. Xu R., Johnson A., Liggitt D. et al. Cellular and humoral immunity against vaccinia virus infection of mice // J. Immunol. — 2004. — Vol. 172. — P. 6265–6271.
78. Yao J.S., Kariwa H., Takashima I. et al. Antibody-dependent enhancement of hantavirus infection in macrophage cell lines // Arch. Virol. — 1992. — Vol. 122, № 1–2. — P. 107–118.
79. Yoong P. Enhancement of bacterial virulence by antibody neutralization of immune-activating toxins // Virulence. — 2010. — Vol. 1, № 5. — P. 409–413.
80. Yun N.E., Peng B.H., Bertke A.S. et al. CD4+ T cells provide protection against acute lethal encephalitis caused by Venezuelan equine encephalitis virus // Vaccine. — 2009. — Vol. 19, № 27. — Р. 4064–4073.
Библиографическое описание:
Супотницкий М.В. Антитела в инфекционных и эпидемических процессах // Новости медицины и фармации. — 2013. — № 8 (456) .
[1] Например, осенью 2009 г. в разгар псевдопандемии свиного гриппа, российские центральные телеканалы чуть ли не ежедневно навязывали зрителю сюжеты из одного НИИ, где героическими учеными испытывалась спасительная для человечества вакцина, способная вызывать у добровольцев образование антител к вирусу гриппа.
[2] В статье не рассматриваются клеточные механизмы иммунного ответа на микроорганизмы, так как в вакцинном бизнесе не принято утомлять этой темой воображение своих неоплачиваемых дилеров.
[3] Нужно понимать о каких антителах идет речь. Когда используют термин «протективные антитела» — это означает, что они обладают профилактическим или терапевтическим действием в условиях in vivo. Когда используют термин «нейтрализующие антитела», то обычно речь идет об антителах, способных нейтрализовать возбудитель инфекционной болезни в условиях in vitro. Совсем не обязательно, что «нейтрализующие антитела» будут обладать протективным действием. «Специфические антитела» — более широкое понятие. Оно означает, что антитело узнает определенный антиген. Но оно может не быть «нейтрализующим» или «протективным».
[4] Fc-рецепторы (Fc receptors, FcR) — представляют собой семейство молекул, каждый член которого распознает иммуноглобулин одного или нескольких родственных изотипов. Рецепторы этого типа входят в состав суперсемейства иммуноглобулинов. Fc-рецепторы для иммуноглобулинов присутствуют на поверхности мононуклеарных лейкоцитов, нейтрофилов, нормальных клеток-киллеров, эозинофилов, базофилов и тучных клеток. Взаимодействуя с Fc-областью иммуноглобулинов разных изотипов, эти рецепторы стимулируют, например, фагоцитоз, противоопухолевую цитотоксическую активность и дегрануляцию тучных клеток.
[5] Но «Руководство по общей эпидемиологии» академика РАМН Б. Л. Черкасского (2001) учит врачей, что любой инфекционный процесс по своему завершению должен оставлять хотя бы кратковременный иммунитет, т.е. невосприимчивость переболевшего организма к повторному инфицированию этим же микроорганизмом, и что именно он является «основным отличием инфекционной болезни от неинфекционной».
[6] Очень глубокая мысль академика РАМН А.А. Воробьева (2003).
[7] Fc фрагмент Ig (кристаллизующийся фрагмент иммуноглобулина, fragment crystallizable region, Fc region) — это концевая часть молекулы иммуноглобулина, которая взаимодействует с Fc-рецептором на поверхности клетки и с некоторыми белками системы комплемента. Другая часть антитела называется Fab (от англ. Fragment antigen binding), и состоит из двух вариабельных участков, определяющих специфичность мишени, которую связывает антитело. Fc всех антител одного класса консервативны.
[8] Для образования термина T. Francis (1955) использовал библейское выражение «original sin», означающее «первородный (прародительский, первичный) грех» Адама, отразившийся на всех его потомках. Более благозвучное название феномена — «antigenic imprinting» («антигенный отпечаток») используется редко [27].

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2012