Микроорганизмы, токсины и эпидемии. 2.1. «Природные резервуары» паразитических микроорганизмов
Исследование механизмов проникновения патогенов в человеческие популяции затруднено использованием терминологии, ставящей преждевременные заключения и дающей неверные представления о происхождении и циклах их природной трансмиссии [Wolfe N.D. et al., 1998]. Поэтому, прежде всего, рассмотрим определения нескольких связанных между собой терминов.
Определения. Природный резервуар — это совокупность биотических и абиотических объектов, являющихся средой естественной жизнедеятельности паразитического вида и обеспечивающих существование его в природе [Таршис М.Г., Черкасский Б.Л., 1997].
Природным очагом считают наименьшую часть одного или нескольких географических ландшафтов, где циркуляция возбудителя между животными способна осуществляться неопределенно долго без необходимости заноса его извне [Таршис М.Г., Черкасский Б.Л., 1997].
Второе определение по объему значительно меньше первого и относится к зоонозам. Оно в принципе не подходит для описания механизмов проникновения в человеческое общество антропонозов и сапронозов. В то же время, если человек является единственным хозяином ВИЧ, который, к тому же еще и передается, не попадая в окружающую среду, то он одновременно и «природный очаг» и «природный резервуар». Т. е. природный резервуар представляет собой первичную ячейку эпидемического (эпизоотического) процесса, создающую потенциальную опасность распространения возбудителя инфекционной болезни. А термин «природный очаг» отражает частный случай взаимодействия на конкретной территории определенных животных с природным резервуаром, в результате которого они становятся носителями микроорганизма, поддерживаемого в этом резервуаре. Как же отличить «природный очаг» от «природного резервуара»? Видимо, ответ на этот вопрос можно получить, исключая промежуточные резервуары из цепочек распространения возбудителя (трофических, эпидемических, эпизоотических), до резервуаров, без которых существование возбудителя инфекционной болезни станет невозможно. Их совокупность можно считать «природным резервуаром».
«Паразитарная система» — этот термин из концепции саморегуляции паразитарных систем [Беляков В. Д. и др., 1987] часто используют О. В. Бухарин и В. Ю. Литвин (1997), и на наш взгляд слишком расширительно. Реально существующим и действующим фактором любой биологической системы являются не отдельные живые организмы, а связи между ними — «система есть комплекс элементов, находящихся во взаимодействии» [Берталанфи Л., 1969]. Однако если для облигатных паразитов такие связи с их хозяевами почти всегда прослеживаются, то для случайных их определить можно только с определенной фантазией. Отсюда и такая сложность построения этих систем — «полузакрытые», «открытые» и т.д. Кроме того, когда такая связь образуется в какой-то экосистеме, то не всегда микроорганизм играет роль паразита во всех ее элементах. Например, возбудители мелиоидоза, сибирской язвы, столбняка и ряда других инфекций, находясь в почве, миллионы лет проявляют себя для позвоночных как обыкновенные сапрофиты. Паразитами мы их называем из-за способности после случайного проникновения в организм некоторых позвоночных, использовать их в качестве источника метаболитов и среды обитания. Учитывая то обстоятельство, что для поддержания этих микроорганизмов в природе паразитическая фаза их существования среди высших животных серьезного значения не имеет (а среди одноклеточных часто остается неизвестной), то такие «системы» с еще большим основанием можно называть сапрофитическими.
«Первичный резервуар», «вторичный резервуар», «промежуточный резервуар». Последние два термина предполагают наличие твердо установленной «совокупности биологических видов животных, являющихся естественными хозяевами данного паразита» [Жданов В.М., 1961]. Знание того, какой резервуар первичен, а какой нет, крайне важно для разработки мероприятий по разрыву эпидемической (эпизоотической) цепи от источника инфекции к реципиенту. В действительности, мы не знаем первичных резервуаров многих возбудителей опасных инфекций. Например, даже сегодня загадкой остается первичный резервуар очень опасного для людей вируса Эбола (рис. 37).
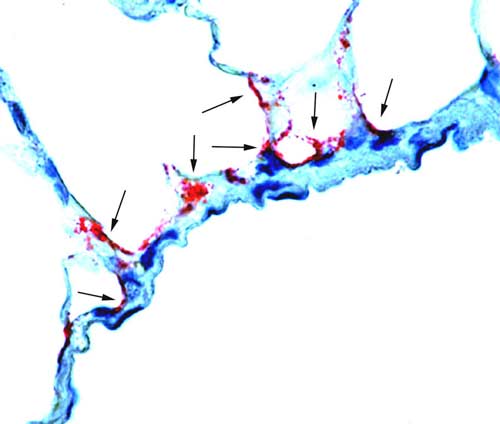
Рис. 37. Результаты поисков первичного резервуара вируса Эбола. Исследовано 24 вида растений, 19 видов позвоночных и беспозвоночных. Показано, что фруктовые и насекомоядные летучие мыши способны без развития болезни поддерживать репликацию и циркуляцию высоких титров вируса. На снимке легочной ткани иммунохимически окрашенные вирус-антигенпозитивные клетки (темные участки обозначены стрелкой; увеличение 250 раз). Однако являются ли эти мыши первичным резервуаром, осталось неясно. Поиск первичного резервуара вируса Эбола продолжается [Swanepoel R. et al., 1996].
Исследования экологии многих возбудителей, для которых первичный резервуар казался еще 10—20 лет назад вполне очевидным (возбудители чумы, псевдотуберкулеза, холеры, полиомиелита, туберкулеза, лепры и др.), показали условность этого термина. То, что считалось первичным резервуаром, оказалось только промежуточным. Первичный резервуар для эпидемиологии, это нечто вроде «квадратуры круга» для геометрии. Видимо «природный резервуар» и есть «первичный резервуар».
Типы природных резервуаров. Основываясь на исследованиях О.В. Бухарина и В.Ю. Литвина (1997) и избегая употребления термина «паразитарная система» для всех случаев взаимодействия паразитического микроорганизма с хозяином, считаем возможным выделить четыре типа природных резервуаров возбудителей инфекций.
Почвенный резервуар — возбудитель инфекционной болезни поддерживается в растениях и обитателях почв (простейшие), а так же в свободном состоянии.
Водный резервуар — патогенные микроорганизмы имеют в качестве хозяев различных представителей фито- и зоопланктона (водоросли, простейшие, низшие ракообразные), бентоса (черви, моллюски, членистоногие) и нектона (рыбы).
Техногенный — возбудитель существует в трансформированных человеком экосистемах.
Наземный резервуар — существование возбудителей инфекций связано с наземными животными, главным образом, млекопитающими и кровососущими членистоногими.
В первых трех резервуарах возбудители существуют в условиях необычайного размаха колебаний разнообразных факторов внешней среды и возможности их резкой смены при переходе из одного резервуара в другой. Отсюда общая черта этих микроорганизмов — высокая экологическая пластичность и способность сохранять свою жизнеспособность в широком диапазоне различных абиотических факторов — влажность, температура, органический состав, рН и др. [Бухарин О.В. и Литвин В.Ю., 1997].
Эти возбудители вступают в сложные отношения с другими обитателями экосистем, вмещающих их резервуары (конкуренция, симбиоз, отношение «хищник — жертва»). Отсюда их способность вырабатывать субстанции, которые мы по незнанию их настоящего предназначения в первичных резервуарах микроорганизмов называем «факторами патогенности». К ним относятся адгезины, используемые такими бактериями в любой среде обитания для колонизации поверхностей. Ферменты, например, гиалуронидаза, нейраминидаза и отдельные протеазы, используются ими в почве и воде для деполимеризации структур отмерших тканей. Капсула и другие механизмы блокирования активного фагоцитоза, позволяют таким микроорганизмам проникать и размножаться в амебах и инфузориях. Например, легионеллы, хорошо адаптированные к жизни в свободно живущих амебах, случайно попадая в легкие человека, проникают в легочные моноциты и макрофаги, принимая их за своих природных хозяев. Токсины в природных экосистемах обеспечивают защиту бактериям от хищников и антагонизм с другими микроорганизмами [Бухарин О.В., Литвин В.Ю., 1997].
Эти возбудители могут поддерживать свою вирулентность для млекопитающих без взаимодействия с ними. Например, удалось показать усиление вирулентности иерсиний, листерий, псевдомонад при пассировании их через инфузории [Бухарин О.В., Литвин В.Ю., 1997]. Возбудитель мелиоидоза, утративший вирулентность в результате пассирования на плотных питательных средах, быстро восстанавливает ее в определенных видах почв [Ларионов Г.М. и др., 1985].
Непосредственная эпидемическая опасность техногенного, почвенного и водного резервуаров невелика. Однако они могут «поставлять» возбудителей инфекций во вторичные резервуары — различные объекты непосредственно окружения человека, в том числе и медицинские стационары, где риск заболевания людей резко возрастает, создавая серьезные эпидемиологические проблемы [Бухарин О.В., Литвин В.Ю., 1997].
Облигатным паразитам наземного резервуара и паразитам из других резервуаров, имеющим циркуляцию в наземном резервуаре (как, например, возбудитель чумы) — возбудителям антропонозов и зоонозов — свойственна эстафетная передача среди людей и животных. Возбудители из техногенного, почвенного и водного резервуаров, которые не имеют циркуляции в наземном резервуаре, не способны образовывать эпидемическую цепочку. Инфицирование теплокровных хозяев происходит независимо, веерообразно из общего источника [Бухарин О.В., Литвин В.Ю., 1997].
Общие свойства природных резервуаров. Рассмотрим некоторые общие свойства этих резервуаров, определяющие их роль в поддержании эпидемически значимых микроорганизмов в среде, окружающей человека.
Природные резервуары всегда эшелонированы. Для наземных резервуаров — это множество популяций и видов хозяев возбудителя инфекции, живущих при относительно высокой плотности в различных и неоднородных местах обитания [Gage К., Ostfield В., Olson J., 1995].
Для патогенных бактерий из водных и почвенных резервуаров — это обширные связи с различными обитателями воды, почвы и наземного резервуара. Например, холерные вибрионы обнаруживаются не только у людей, но и у вислоногих ракообразных, устриц, инфузорий, рыб. Легионеллы — у дождевых червей, личинок насекомых, кузнечиков и др. Возбудитель псевдотуберкулеза у моллюсков, плоских и кольчатых червей, водных растений, а также у более чем 300 видов питающихся ими рыб, млекопитающих, птиц, рептилий [Бухарин О.В., Литвин В.Ю., 1997].
Эшелонированность резервуара может проявляться наличием в нем имеющих сходные экологические потребности близкородственных видов (например, возбудители коклюша и паракоклюша, бешенства и сходных с ним вирусов), видов-аналогов эпидемически значимого возбудителя инфекции (малярийные паразиты) или вообще не родственных видов (возбудители гепатитов В и С), использующих одинаковый механизм трансмиссии. В табл. 12 приведен пример глобальной эшелонированности природного резервуара вируса бешенства [Rupprecht С, Smith S., Fekadu M. et al., 1995].
Таблица 12
Глобальная эшелонированность природного резервуара вируса бешенства и подобных вирусов*
|
Лиссавирус |
Резервуар |
История |
|
Бешенство (Rabies) |
Распространен во всем мире, за исключением нескольких островов Австралии и Антарктики. Эндемичен и в тоже время эпизоотичен для самых различных видов млекопитающих, включая диких и домашних собак, пушных зверей, насекомоядных летучих мышей и летучих мышей — вампиров; более 25000 случаев среди людей в год. Почти все являются следствием бешенства среди собак |
Первые описания болезни есть в греческих и римских документах. В середине 1800-х годов Пастер получил ослабленный вирус серией пассажей и высушил его для вакцинации людей и животных. Патогномические включения в нервных клетках были описаны Негри в 1903 г. Иммунофлюоресцентный тест на антиген вируса бешенства разработан в 1950-х годах |
|
Лагосбат (Lagosbat) |
Неизвестен, но, вероятно, плодовые летучие мыши. На сегодня идентифицировано 10 случаев, включая 3 у домашних животных в Нигерии, Зимбабве, Центральной Африканской Республике, Сенегале и Эфиопии. Случаи смерти среди людей, неизвестны |
Изолирован в 1956 г. из мозга нигерийской плодовой летучей мыши. (Eidolon helvum), но не был охарактеризован до 1970 г.; 3 случая у домашних животных первоначально диагностировались как бешенство, но слабая реакция в тесте иммунофлюоресценции, позволила предположить наличие вируса, подобного вирусу бешенства. Впоследствии это было подтверждено типированием мАТ и анализом нуклеотидных последовательностей. Антирабическая вакцина не обладает перекрестной защитой |
|
Мокола (Mokola) |
Неизвестен, но вероятно насекомоядные или грызуны. Случаи бешенства зафиксированы в Нигерии, Южной Африке, Камеруне, ЦФР, Эфиопии; всего известно 17 случаев, включая 9 среди домашних животных и 2 среди людей |
Впервые выделен от землеройки семейства Crocidura, пойманной в лесу Mokola в Нигерии в 1968 г. Охарактеризован в 1970-м году. Подобен Lagosbat-вирусу. Зафиксировано 7 случаев среди домашних животных в Зимбабве в 1981 и в 1982 г. Антирабическая вакцина не обладает перекрестной защитой |
|
Дувенхейг (Duvenhage) |
Неизвестен, вероятно насекомоядные летучие мыши. Случаи распознаны в Южной Африке, Зимбабве и Сенегале; из 4 известных случаев, в одном отмечена гибель человека. Среди домашних животных случаев болезни не выявлено |
Впервые идентифицирован в 1970 г. у человека с энцефалитом, характерным для бешенства. Человек был укушен насекомоядной летучей мышью вблизи Претории (Южная Африка). Вирус назван по имени жертвы. Хотя тельца Негри выявлялись при гистологическом исследовании тканей мозга, отрицательные тесты иммунофлюоресценции привели к подозрению на инфицирование вирусом, подобным вирусу бешенства. В последующем это предположение подтверждено результатами антигенного и генетического типирования. Нет перекрестной защиты от антирабической вакцины |
|
Лиссавирус 1 европейских летучих мышей (EBLV1) |
Европейские насекомоядные летучие мыши (вероятно, Eptesicus serotinus); зафиксировано более 400 случаев у летучих мышей. Один подтвержденный случай у человека в 1985 г. и один предполагаемый в 1977 г. Среди домашних животных случаев болезни не выявлено |
Хотя случаи у европейских летучих мышей были известны с 1954 г., вирус не пытались идентифицировать до 1985 г., когда впервые 100 инфицированных летучих мышей были описаны в Германии и в Дании. Почти все случаи имели место у летучих мышей, обитающих в общественных домах в Европе — E. serotinus. Перекрестная защита антирабической вакцины незначительна |
|
Лиссавирус 2 европейских летучих мышей (EBLV2) |
Европейские летучие мыши (вероятно Myotis dasycneme); 5 случаев зафиксировано у людей, включая один со смертельным исходом. Среди домашних животных случаев болезни не выявлено |
Впервые идентифицирован в изоляте швейцарских летучих мышей биологом, который умер от бешенства в Финляндии. Перекрестная защита антирабической вакцины незначительна |
*Rupprecht С. et al., 1995
Патогенные виды «второго эшелона» не фиксируются в эпидемических вспышках из-за относительно небольшого количества вызываемых ими случаев инфекции и сходности ее клинических проявлений с вызываемой доминирующим возбудителем. Однако после «победы» над доминирующим возбудителем они постепенно занимают его место в этой же экологической нише.
Кумуляция резервуаров. Происходит тогда, когда небольшие по численности резервуары перекрывают друг друга и в совокупности ими достигается критический для развития эпидемического процесса или вспышки болезни размер популяции хозяев и переносчиков паразитических видов. Например, орангутаны (Pongo pygmaeus), даже когда плотность их популяций составляет две особи на км2, являются хозяевами двух различных видов плазмодий. Эти же плазмодии находят в небольших популяциях людей, проживающих «по соседству», которых также недостаточно для поддержания существования этих патогенов [Wolfe N.D. et al., 1998].
Наличие хозяев, выполняющих функцию усилителя. Как правило, это промежуточные хозяева, способствующие максимальному распространению возбудителя в среде, в которой возрастает его эпидемическая значимость или способствующих инфицированию переносчиков. Например, для возбудителя псевдотуберкулеза такими хозяевами будут домашние грызуны, которые вводят его в непосредственное окружение человека, но при этом сами инфицируются, поедая в хранилищах овощи, обсемененные иерсиниями. Другой, более сложный, пример — поддержание эпидемического потенциала R. rickettsii — риккетсии, вызывающей в США пятнистую лихорадку Скалистых гор. По данным K. Gage et al. (1995) для этой риккетсии весьма эффективны трансовариальный и трансстадийный пути передачи между клещами-переносчиками; по-видимому, она не может поддерживаться в природе без ее хозяев-млекопитающих. Экспериментальные исследования показали, что инфицирование самок клещей R. rickettsii оказывает вредное воздействие на их жизнеспособность и плодовитость. Существенные потери в инфицированных линиях клещей компенсируются паразитированием самок на риккетсиемичных млекопитающих-хозяевах, с передачей вновь приобретенной инфекции своему потомству путем трансовариальной трансмиссии.
Смещение резервуара. Примером такого явления может быть смещение в США природного резервуара вируса бешенства. Если 50 лет назад его находили среди домашних собак, то с 1980-х гг., по ряду причин (вакцинация домашних собак, размножение койотов и др.), он переместился в популяции контактировавших с собаками койотов. А затем распространился на популяции скунсов, енотов и летучих мышей [Rupprecht С, Smith S., Fekadu M. et al., 1995]. Другой пример — резервуар вируса полиомиелита. Источником возбудителя инфекции считается больной полиомиелитом или вирусоноситель. Высокая эффективность плановой иммунизации против полиомиелита позволила 41-й сессии Всемирной ассамблеи здравоохранения в мае 1988 г. принять резолюцию о ликвидации полиомиелита в мире [Болотовский В.М., 1993]. Однако антитела к вирусу и сам вирус уже давно находят у завозимых в США обезьян [Douglas J. et al., 1970], а отдельные шимпанзе, возможно, являются его бессимптомными носителями [Branck M., 1987]. Длительные исследования J. Goodal (1983), выполненные на диких танзанийских шимпанзе, задокументировали возможность заноса вируса в их популяции. Осталось неясным, была ли описанная им эпидемия частью природного цикла вируса в шимпанзе, либо вирус был занесен в их популяции из человеческого резервуара [Wolfe N. et al., 1998]. В связи с этим отметим следующее обстоятельство. Если резервуар возбудителя полиомиелита действительно переместился в популяции приматов, то после победы над ним в «глобальном масштабе» и отмены вакцинации (как это сделано в отношении вируса натуральной оспы), через местные человеческие популяции, контактирующие с приматами, он неожиданно вернется в глобальном масштабе.
«Вакуум вирулентности» в резервуаре. Понятие «вакуум вирулентности» предложено В.А. Лашкевичем и соавт. (1996) в отношении ситуации, сложившейся в человеческих популяциях в результате вытеснения из них вирулентного полиовируса невирулентными вакцинными штаммами. По их мнению, изменение существовавшего веками экологического баланса между людьми и вирулентными энтеровирусами породило ситуацию, при которой этот баланс восстанавливается за счет проникновения в чувствительную популяцию другого патогена, способного использовать ее как территорию для своего обитания и размножения. Этими вирусами стали вновь возникшие особо вирулентные варианты вирусов из других неполиомиелитных групп энтеровирусов, в частности ЕСН011 и ЕСН193, ранее считавшиеся малозначимыми патогенами, т. е. «вакуум вирулентности» в природном резервуаре образуется в случае вытеснения из него вирулентного возбудителя, если между ним и его хозяином существовали экологические связи. Данное явление находится в полном соответствии со вторым началом термодинамики. Оно не может долго терпеть существующего перепада ни в чем, даже в вирулентности. Однако будет неправильным ожидать появление во всех случаях вместо вытесненного возбудителя другого, но использующего туже стратегию паразитизма. Например, если возбудитель использует первую стратегию (вирус натуральной оспы), то совсем не обязательно, что его место займет возбудитель с этой же стратегией паразитизма (вирус оспы обезьян), если продолжают действовать те же факторы, которые привели к элиминации из природного резервуара паразита «первого эшелона» (см. выше). В первой части книги мы уже обратили внимание читателя на то, что о вирулентности мы судим через фактор времени, но у паразитических микроорганизмов время имеет совсем иное измерение, чем у людей. В этом причина того, что мы не всегда можем улавливать причинно-следственные связи между отдельными эпидемическими процессами, значительно отстоящими друг от друга во времени (в нашем восприятии) и даже в пространстве.
Почвенный резервуар. Почва и растения — единый резервуар. Растения в нем служат звеном, выносящим возбудителей из почвы, где они постоянно обитают; в наземные экосистемы, где растения служат источником инфицирования наземных животных [Бухарин О.В., Литвин В.Ю., 1997]. Эти же авторы обосновывают первичную резервуарную роль растений по отношению к теплокровным животным и человеку. В табл. 13 приведены результаты исследований микробных ассоциаций почв и диких грызунов в природных экосистемах, не затронутых деятельностью человека.
Таблица 13
Распространение потенциально патогенных бактерий в природных экосистемах и агроценозах*
|
Род бактерий |
Почвы |
Растения |
Дикие грызуны |
|
|
Кишечник |
Субстрат нор |
|||
|
Yersinia |
+ |
+ |
+ |
+ |
|
Salmonella |
+ |
|
+ |
+ |
|
Escherichia |
+ |
|
+ |
+ |
|
Enterobacter |
+ |
+ |
+ |
+ |
|
Klebsiella |
+ |
|
+ |
+ |
|
Proteus |
+ |
|
+ |
+ |
|
Citrobacter |
+ |
+ |
+ |
+ |
|
Hafnia |
+ |
+ |
+ |
+ |
|
Serratia |
+ |
+ |
+ |
+ |
|
Pseudomonas |
+ |
|
+ |
+ |
|
Acinetobacter |
+ |
|
+ |
+ |
* По обобщению О.В. Бухарина и В.Ю. Литвина (1997).
Они свидетельствуют о том, что практически все патогенные роды бактерий присутствуют в почвах, растениях, субстрате нор грызунов и в кишечнике грызунов. Ниже мы остановимся на эпидемической роли этого резервуара применительно к тем возбудителям инфекционных болезней человека, для которых его роль либо недавно доказана, либо остается спорной.
Чумной микроб (Yersinia pestis). Природный резервуар возбудителя чумы уже несколько десятилетий вызывает ожесточенные споры между чумологами. Их причиной послужила безрезультативность поисков возбудителя чумы среди грызунов и их блох в межэпидемические периоды, внезапность и одномоментность возникновения эпизоотий на разных очаговых территориях, независимые одиночные заражения грызунов при возрождении эпизоотии и ряд других [Дятлов А.И., 1988; Домарадский И.В., 1998]. Однако постепенно стали накапливаться сведения, позволяющие утверждать, что механизм энзоотии чумы носит сапронозный характер. По данным С.В. Никульшина и соавт. (1992), ряд амеб способны фагоцитировать чумной микроб и сохранять его в предцистах. По мнению И.В. Домарадского (1998), с эпидемиологической точки зрения этот факт особенно интересен, поскольку в инцистированном состоянии одноклеточные животные выдерживают низкие температуры, обезвоживание, жару, воздействие других абиотических факторов и могут сохраняться годами. Следовательно, внутри цист чумной микроб имеет шансы на выживание при самых неблагоприятных условиях окружающей среды и вместе с цистами может разноситься на огромные расстояния. И.В. Домарадский (1998) также считает, что сходство условий существования чумного микроба в одноклеточных организмах с таковыми в фагоцитах, объясняет то, каким образом слабовирулентные штаммы Y. pestis сохраняются в природе. О.В. Бухарин, В.Ю. Литвин (1997) описывают ряд собственных экспериментов, показывающих возможность резервуарной роли вегетативных органов растений. По их мнению, исчерпывающе полной можно признать следующую жизненную схему чумного микроба: «почва — растения (?)—грызуны—блохи—грызуны—почва». При этом устойчивое сохранение возбудителя обеспечивается, главным образом, почвой, а его циркуляция в наземной экосистеме природного очага в принципе конечна и может прерваться по разным причинам в любом звене (растения, грызуны, блохи). В отношении же человека растения и грызуны играют роль усилителя природного резервуара чумы.
Сибиреязвенный микроб (Bacillus anthracis) — типичный обитатель почв, который можно обнаружить в любом регионе планеты. Однако вопрос о том, в какой форме он в ней присутствует — вегетативной или споровой и способен ли он в ней размножаться или только сохраняться между эпизоотиями, порождает споры уже более столетия. Известна точка зрения Р. Коха (1876), что бациллы сибирской язвы в болотистых местах, на берегах рек в жаркие месяцы размножаются и образуют споры. При повышении уровня воды или при усиливающемся течении, споры вместе с илом могут разноситься водой и попадать в траву затапливаемых выпасов. В те же годы Л. Пастер и его последователи придерживались противоположной точки зрения, в соответствии с которой почва не является активной средой, и возбудитель сибирской язвы может лишь сохраняться в ней в споровой форме. В дискуссии одержала верх школа Пастера. В нашей стране сходную точку зрения на невозможность размножения в почве В. anthracis высказывал Л.И. Громашевский (1949). Он считал, что в почве паразит не может найти благоприятных условий для своего существования. Это противоречило даже уже сделанным ранее наблюдениям. Еще в 1946 г. Ф. А. Терентьев обнаружил обильное размножение B. anthracis на пастбищах в трех стационарно неблагополучных пунктах за 2–4 недели до вспышки инфекции. Но и тогда победил «сильнейший». Только в начале 1980-х гг., после многочисленных экспериментов, было признано, что в оптимальных условиях возбудитель пребывает в почве не в анабиотической споровой форме, а совершает определенный цикл: вегетативные клетки — споры — вегетативные клетки и т. д. [Ипатенко Н. Г. и др., 1996]. Способность к «сапрофитному существованию» в почве и к спорообразованию, позволила возбудителю сибирской язвы не зависеть от восприимчивых животных и, в какой-то степени, от неблагоприятных для него условий внешней среды. Установлено, что размножению и проникновению В. anthracis в верхние слои почвы, а также в организм животных, способствуют некоторые культивируемые человеком травы (житняк, картофель, хрен, редис, турнепс) и беспозвоночные [Ипатенко Н. Г. и др., 1996]. Т. е., они, так же как и могильники, в отношении человека и домашних животных играют роль усилителей природного резервуара.
Теперь вернемся к вопросу времени для паразитических организмов. Из представленных данных следует, что жизненный цикл сибиреязвенного микроба можно разделить на две стадии — паразитическую и сапрофитическую [Ипатенко Н. Г. и др., 1996]. Какая из них сколько занимает по продолжительности? Обычно первая у чувствительного животного тянется не дольше 5 суток по нашему восприятию времени. Вторая стадия — это длительное пребывание в почве, в нашем восприятии — десятки, а то и сотни лет, в действительности — не поддающиеся восприятию миллионы лет. Возбудитель в течение всего это времени, в отличие от теплокровных, не умирает, так как размножается делением вегетативных клеток. Соотношение между стадиями по времени (в нашем восприятии) не в пользу первой. Нужна ли она вообще В. anthracis? Какая системная связь может образоваться между погибшей от сибирской язвы овцой и человеком, если он не употреблял в пищу мясо этой овцы? И можно ли все это вместе назвать «системой», а тем более «паразитарной»? Видимо, нет.
Об участии простейших в поддержании природных резервуаров сибирской язвы, не известно. Однако есть косвенные признаки возможности и задействования их в этом процессе. Например, появление капсулы у вегетативной формы сибиреязвенного микроба, проникшего в организм животного или человека. Для теплокровных организмов он случайный паразит и эволюционно они не могли быть тем фактором естественного отбора, который бы закрепил такой важный адаптационный признак. Да этого и не могло произойти в принципе, так как В. anthracis представляет собой более древний организм, чем позвоночные животные. Капсула, это элемент стратегии защиты микроорганизма от переваривания при фагоцитозе простейшими. Другим косвенным признаком является странная и необъяснимая периодичность эпизоотии в отдельных регионах, когда ее не удается связать с климатическими или какими-то иными факторами. Возможно, их удастся связать с биологическими циклами простейших.
Возбудитель лепры (Mycobacterium leprae) — микобактерия, вызывающая болезнь, уже тысячи лет известную под названием проказа, имеет природный резервуар в сфагнуме мохового болота [Литвин В.Ю и др., 1995]. Больной же человек — это только усилитель природного резервуара.
Патогенные для людей эрвинии (E. carotovora), псевдомонады (Р. сераеае, P. fluorescens, P. putida, P. aeruginosa) одновременно являются фитопатогенами. Патогенные иерсинии, листерии, сальмонеллы постоянно присутствуют в почвах и растения. Последние инфицируют домашних животных и грызунов, которые становятся вторичными резервуарами этих возбудителей в окружении человека [Литвин В.Ю и др., 1995].
Водный резервуар. Вода, это та среда, в которой произошло зарождение жизни. Водный резервуар, видимо, необычайно богат неизвестными и патогенными для наземных животных микроорганизмами, имеющими уникальные механизмы адаптации в обеих средах.
Псевдотуберкулезный микроб (Yersinia pseudotuberculosis) существует в водном резервуаре в гидробионтах. Зоопланктон (дафнии, циклопы) и бентосные животные (кольчатые черви, моллюски, личинки насекомых) обеспечивают циркуляцию возбудителя псевдотуберкулеза в водной экосистеме и поддерживают его численность на более высоком уровне, чем в почве или в воде, откуда иерсинии быстро исчезают в отсутствие хозяев. Высшие водные растения способны инфицироваться иерсиниями через корневую систему и сохранять их в вегетативных органах [Бухарин О.В., Литвин В.Ю., 1997].
Патогенные микобактерии являются этиологическими агентами большого количества разнообразных болезней, называемых микобактериозами. Давно известно, что инфицирование ими возможно не только от человека (М. tuberculosis), но и от птиц (M. avium), и от крупно рогатого скота (M. bovis). Однако из какого резервуара инфицируются птицы и скот, не ясно. Частичный ответ на этот вопрос можно найти в работе P. M. Ермаковой и соавт. (1995). По их данным у личинок кровососущих комаров наблюдается трансфазовая передача атипичных микобактерий, а сами они являются хорошей средой для развития и сохранения микобактерий в природе. Поскольку личинки развиваются в водоемах, расположенных вблизи от животноводческих помещений и на пастбищах, то инфицированные личинки через воду могут попадать в организм животных и птиц. Полученные данные согласуются с сообщениями о выделении патогенных и атипичных микобактерий из проб воды, взятых из прудов, канав и луж, и используемой для поения крупно рогатого скота, а также из опилок, соломы и сена.
Холера. В России традиционно появление холеры связывают с «завозом» вибриона эль тор из эндемичных по холере стран паломниками или туристами. Остаются «незамеченными» многочисленные, приходящиеся на вторую половину лета, сообщения об обнаружении холерного вибриона в водоемах российских регионов, которые, как правило, туристы не посещают и «паломники» из них дальше своих 6 соток не ездят. По мнению О. В. Бухарина, В. Ю. Литвина (1997), существующие научные данные позволяют рассматривать возбудитель холеры и ряд близкородственных вибрионов как природноочаговые сапронозные инфекции, первично связанные с естественными водными экосистемами. Вибрионы, обитая в воде, имеют биоценотические связи с водными организмами, в том числе и растениями. Показано, что водный гиацинт способствует размножению холерных вибрионов. Их концентрация в его стеблях и листьях была в 300 раз выше, чем в воде. А. С. Марамович и М. И. Наркевич (1993) считают водный гиацинт природным резервуаром холеры эль тор, обеспечивающим существование вибрионов в межэпидемические периоды и способствующим реализации водного пути передачи возбудителя. К аналогичным выводам пришли Islam и соавт. (1990) при исследовании другого водного растения — ряски. Они также выявили активное размножение и длительную (до 15 мес!) персистенцию некультивируемых вибрионов эль тор в культуре сине-зеленых водорослей, которые также признаются ими возможным резервуаром в межэпидемические периоды. Высокую концентрацию холерного вибриона могут поддерживать низшие ракообразные [Голубев, 1993] и зоопланктон [Islam et al., 1990]. Эти и другие данные позволили В. И. Пушкаревой и В. Ю. Литвину [Пушкарева В. И., Литвин В. Ю., 1994; Пушкарева В. И., 1994], выдвинуть гипотезу о клонально-селекционном механизме изменения бактерий в почвенных и водных сообществах, способном обеспечивать формирование эпидемически значимых вариантов возбудителей сапронозов в их природных резервуарах. Гипотеза весьма интересная, поэтому ее стоит привести подробно.
В процессе естественной циркуляции холерных вибрионов среди гидробионтов — хозяев возбудителя в водоемах, имеет место селекция токсигенных клонов и их накопление в бактериальной популяции при благоприятных условиях (активном пассировании через хозяев). Всего же у холерных вибрионов в водной экосистеме формируется, как минимум, две экологические ниши. Одна из них (непосредственно водная среда), наиболее характерна для авирулентных штаммов. Вторую нишу (сообщество водных организмов) населяет преимущественно вирулентная часть микробной популяции, устойчивая к перевариванию в организме гидробионтов — первичная функция токсигенности холерных вибрионов, возможно, как раз и состоит в защите бактериальной популяции, обитающей в водоемах, от хищничества простейших и других гидробионтов. Их объем относительно друг друга меняется. Например, при изменении численности хозяев или сдвигах в структуре водного сообщества. В разных условиях и в разные сезоны в водной популяции вибрионов могут доминировать то токсигенные, то атоксигенные клоны холерных вибрионов. Изменение уровня токсигенности всей популяции вибрионов во времени происходит за счет выхода в водную среду нарастающего числа токсигенных вибрионов из организма погибших инфузорий, где они накапливаются благодаря селективному преимуществу перед атоксигенными и слаботоксигенными вибрионами. Прогревание воды до температуры 20°С и резкое увеличение трофности водоемов в июле—августе определяют пик численности холерных вибрионов, тесно сцепленный с пиком численности планктона. Интенсивно пассируясь среди гидробионтов, вибрионы окончательно выходят из покоящегося состояния (число бактериологически высеваемых культур максимально); численность и вирулентность водной популяции вибрионов резко возрастает, достигая эпидемически значимых показателей (рис. 38). Именно к этому периоду неизменно приурочен пик заболеваемости людей в очагах умеренных широт. Первичные и независимые случаи инфицирования холерой людей, связаны с водоемами, после чего распространение холеры может принять и вторичный (эстафетный) характер, в виде классической вспышки [Бухарин О. В., Литвин В. Ю., 1997].
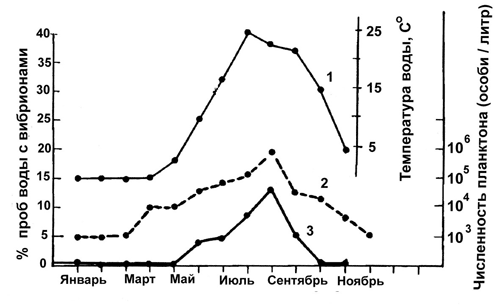
Рис. 38. Сопряженность сезонных колебаний температуры воды, численности планктона и концентрации холерных вибрионов в водоемах умеренных широт.
1. Температура воды оз. Огайо, США; 2. Численность (особи/литр) фито- и зоопланктона в водохранилище, Огайо; 3. Средняя частота (%проб) изоляции культур вибрионов эль тор из водоемов Поволжья, Россия, в 1970 — 1987 гг. [Бухарин О. В., Литвин В. Ю.,1997; по материалам разных авторов].
Техногенный резервуар. В урбоценозах возбудители инфекций занимают новые экологические ниши, часто не свойственные им в природных сообществах. О. В. Бухарин и В. Ю. Литвин (1997) выделяют несколько основных типов очагов, различающихся по условиям существования возбудителей, путям их циркуляции и закономерностям эпидемического появления инфекций.
Система водоснабжения кондиционированного воздуха, вентиляции, охлаждения вод, где существование возбудителей связано с водной средой, а инфицирование людей осуществляется водным или аэрозольным путем (легионеллез, ряд кишечных инфекций, псевдомонозы, микозы и др.).
Системы тепличных хозяйств, централизованного хранения и переработки продуктов общественного питания, где патогенные микроорганизмы могут накапливаться как в самих продуктах, так и на оборудовании или различных поверхностях, обуславливая инфицирование людей алиментарным путем (иерсиниозы, листериоз, кишечные инфекции и др.).
Системы медицинского обслуживания: стационары, родильные дома, амбулатории, в которых, помимо двух предыдущих каналов циркуляции возбудителей, создаются дополнительные условия для инфицирования людей, связанные с хирургическими и инвазивными процедурами, существованием бактерий в растворах и т. п. (стафилококковая и синегнойная инфекция, оппортунистические инфекции, гепатит В, ВИЧ и др.).
Системы замкнутого жизнеобеспечения человека: подводные лодки, бункеры ракетных установок, космические корабли и другие объекты, в которых создаются условия для длительной, самостоятельной циркуляции патогенных микроорганизмов.
Разумеется, техногенный резервуар черпает возбудителей инфекций из природных резервуаров. Однако люди, проживающие в больших городах, фактически имеют дело только с техногенными очагами инфекций, играющими роль усилителей природных резервуаров [Бухарин О.В., Литвин В.Ю., 1997].
Насколько сложна и опасна взаимосвязь между ними, можно увидеть на примере легионелл.
Легионеллы (Legionella pneumophila) и легионелло-подобные амебные патогены (Legionella-like amebal pathogens — LLAP). Наиболее часто встречаются в природных водоемах, населенных водорослями. Эксперименты выявили сателитный рост легионелл за счет продуктов метаболизма водорослей Fischerella sp., причем динамика размножения легионелл часто коррелировала с активностью фотосинтеза растений. Описано активное размножение легионеллл в биопленках водорослей в системах охлаждения воды [Литвин В. Ю. и др., 1996].
Механизм их поддержания в природных экосистемах, видимо, в общих чертах сходен с таковым для холерных вибрионов. В одной амебе может находиться более 1000 микробных клеток. Их контакт с человеком осуществляется, как правило, благодаря водоемам с водой, используемой в системах кондиционирования воздуха рециркуляционного типа. Механизм передачи — аспираторный. Большинство вспышек связано с замкнутыми системами охлаждения воды и технологическими циклами, при функционировании которых образуется высокодисперстный аэрозоль, содержащий легионеллы [Коротяев А. И., Бабичев С. А., 1998].
![Рис. 39. Легионелла-подобный патоген в цитоплазме амебы. Трансмисионная электронная микрография Sarcobium lyticum в цитоплазме амебы Acanthamoeba castellanii [Adenike A. et al., 1996]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-39.jpg)
Рис. 39. Легионелла-подобный патоген в цитоплазме амебы. Трансмисионная электронная микрография Sarcobium lyticum в цитоплазме амебы Acanthamoeba castellanii [Adenike A. et al., 1996]
В отличие от легионелл, легионелло-подобные агенты не культивируются на искусственных питательных средах. Единственной средой, в которой их можно культивировать, являются сами амебы. По этой причине их роль в развитии пневмоний длительное время недооценивалась. Первый легионелло-подобный амебный микроорганизм (Sarcobium lyticum), был найден в амебе Acanthamoeba castellanii в 1954 г., т. е. за 23 года до того как Дж Мак-Дейд и С. Шепард выделили из легочной ткани умерших людей L. pneumophilla (рис. 39). Однако их участие в развитии пневмоний у людей обнаружено значительно позже — в конце 1980-х гг. До сих пор эта группа микроорганизмов неклассифицирована, хотя филогенетический анализ показал формирование LLAP отдельного кластера среди других членов семейства Legionellaceae (табл. 14).
А. Adenike и соавт. (1996), считают, что их роль в развитии пневмоний, особенно у детей, большая, чем у L. pneumophilla. Легионелла-подобные агенты преподнесли своеобразный урок современному здравоохранению. Ведь даже открытие L. pneumophilla в 1977 г. было неожиданностью для специалистов. В те годы считались уже найденными и описанными все патогенные для людей бактерии. Однако оказалось, что в матрешке есть еще одна, а в ней еще и т. д. И каждую находили при каком-то методическом скачке в выделении и культивировании патогенов. До сих пор, приблизительно в 50% случаев пневмоний у детей, выявляемых в США, не удается установить их этиологию [Garibaldi R., 1985]. Видимо LLAP составляют только верхушку айсберга некультивируемых на питательных средах бактериальных патогенов различных семейств и родов, обитающих в природных экосистемах и урбоценозах.
Таблица 14
Источники легионелло-подобных амебных патогенов
|
Штамм |
Хозяин |
Температура (С) |
Источник |
Год |
|
S. lyticum |
АР |
35 |
Почвенный изолят |
1954 |
|
LLAP-1 |
АР |
30 |
Передвижная емкость для колодезной воды |
1981 |
|
LLAP-2 |
АР |
35 |
В смыве выпота со стены гаражной ямы |
1986 |
|
LLAP-3 |
API |
35 |
Слюна больного пневмонией |
1986 |
|
LLAP-4 |
АР |
30 |
Больничный вращающийся душ |
1986 |
|
LLAP-5 |
АР |
30 |
Спрей для ухода за домашними растениями |
1988 |
|
LLAP-6 |
АР |
35 |
Заводская башня с растворителем |
1988 |
|
LLAP-7 |
АР |
35 |
Минеральный источник в отеле |
1991 |
|
LLAP-8 |
HV |
35 |
Больничный душ |
1990 |
|
LLAP-9 |
АР |
35 |
Устройство для охлаждения воды |
1992 |
|
LLAP-10 |
АР |
35 |
Корабельная система кондиционирования воздуха |
1994 |
|
LLAP-11 |
АР |
30 |
Заводская башня для охлаждения воды |
1993 |
|
LLAP-12 |
АР |
30 |
То же |
1994 |
Примечание: АР — A. polyphaga; API — изолят получен после совместного культивирования с A. polyphaga; HV — H. vermiformis [Adenike A. et al., 1996].
Наземный резервуар. В наземном резервуаре возбудители отдельных инфекций, чувствительные к ним хозяева, переносчики возбудителей инфекций и носители этих инфекций, настолько тесно связаны между собой, что их можно условно объединять в системы. Основным системообразующим фактором наземных резервуаров, является облигатный характер паразитизма населяющих их микроорганизмов. Т.е. возбудитель инфекционной болезни на любой стадии популяционного цикла, должен быть связан со своими хозяевами, переносчиками или носителями, и единственной средой его обитания является чей-то организм. Если исходить из того, что количество таких организмов в данной экосистеме для конкретного микроорганизма конечно, и всегда меньше количества составляющих эту экосистему живых существ, то образующаяся между ними связь носит неслучайный, устойчивый характер, т. е. она является системообразующий.
О. В. Бухарин и В. Ю. Литвин (1997) классифицируют такие паразитарные системы на двучленные («возбудитель — носитель») и трехчленные («возбудитель — переносчик — носитель»). Первые характерны для нетрансмиссивных путей циркуляции возбудителя в наземных экосистемах (ВИЧ, гепатит В), вторые — для трансмиссивных (арбовирусы, лейшмании). Если паразит имеет двух хозяев в наземной экосистеме — теплокровного (носителя) и членистоного (переносчика), его популяция в любой момент представлена еще двумя частями — гостальной и векторной.
Трехчленная система. Гостальная и векторная популяции микроорганизма, как правило, образуют региональные эпизоотические комплексы (системы) «переносчик — носитель». Эти комплексы играют важную роль в распространении возбудителя инфекции среди собственной популяции и в его передаче хозяевам, обитающим в соседних регионах, или менее обычным и случайным хозяевам, таким как хищники или человек. Возбудитель циркулирует за счет сложных эпизоотических (усиливающих) и энзоотических (поддерживающих) циклов передачи, в которых участвуют определенные виды носителей и паразитирующие на них артроподы.
Считается, что в таких системах носителями становятся устойчивые популяции животных, находящиеся в контакте с переносчиками — они служат источниками инфицированной крови, которой питаются переносчики. Однако известно, что высоковирулентные микроорганизмы накапливаются в высоковосприимчивых организмах [Беляков В.Д. и др., 1987]. Тогда каким же образом среди них поддерживается вирулентность у возбудителя инфекции? Видимо, это связано с тем, что мелкие грызуны, как правило, очень гетерогенны по чувствительности к возбудителям инфекций, циркулирующим в природных резервуарах. А так как они обладают относительно высокой скоростью воспроизводства, то обеспечивается частое введение в популяцию неиммунных особей. Цикл отбора резистентных носителей повторяется, но одновременно поддерживается вирулентность возбудителя. Повторение таких циклов для возбудителей, использующих первую стратегию паразитизма, не бесконечно. Постепенно соотношение между резистентными и чувствительными особями, а также высоковирулентными и маловирулентными штаммами, станет не в пользу высоковирулентных штаммов.
В целом, эпизоотии происходят наиболее часто в тех местах, где имеется множество популяций и видов эпизоотических хозяев, живущих при относительно высокой плотности в различных и высоко неоднородных местах обитания. Виды хозяев, которые эффективно передают переносчикам возбудителей этих эпизоотии, рассматриваются как компетентные резервуары [Gege К. et al., 1995]. Наибольший риск для человека соприкоснуться с векторной частью такой системы возникает тогда, когда в результате эпизоотии в нее вовлекаются: 1) живущие рядом с ним синантропные грызуны и обитающие на них блохи (чума); 2) размножившиеся в местах обитания человека кровососущие насекомые (клещи, москиты, слепни), инфицированные из эпизоотического очага инфекции (желтая лихорадка, болезнь Лайма, пятнистая лихорадка Скалистых гор, моноцитарный эрлихоз, лихорадка Денге, Конго-Крымская лихорадка и др.).
Двучленная система. В такой системе человек может оказаться единственным носителем паразитического микроорганизма (такие антропонозы как ВИЧ, гепатит В, грипп, коклюш и др.) и его случайной жертвой (зооантропонозы: бешенство, лихорадка Эбола, оспа обезьян и др.).
При рассмотрении таких систем, не всегда можно определить четкую грань между наземным и другими резервуарами, между двучленными и трехчленными паразитарными системами. Человечество уже стало одним глобальным техногенным природным резервуаром ВИЧ и сывороточных гепатитов, в котором шприцевал игла, гемотрансфузии и трансплантации, заменяют переносчиков-артроподов в трехчленных системах. Кроме того, природные резервуары некоторых опасных возбудителей инфекций, неизвестны (например, лихорадки Эбола, сывороточных гепатитов и др.).
***
Природный резервуар возбудителя инфекционной болезни — это сложное и трудно познаваемое природное явление. Определение природного резервуара возбудителя инфекционной болезни целесообразно осуществлять путем исключения промежуточных резервуаров из цепочек распространения возбудителя (трофических, эпидемических, эпизоотических) до резервуаров, без которых существование возбудителя инфекционной болезни станет невозможно. Условно можно выделить четыре типа природных резервуаров возбудителей инфекций: почвенный, водный, техногенный и наземный. В первых трех резервуарах возбудители существуют в условиях колебаний разнообразных факторов внешней среды и возможности их резкой смены при переходе из одного резервуара в другой. Отсюда общая черта у входящих в них микроорганизмов — существование в «некультивируемом состоянии», а также высокая экологическая пластичность и способность сохранять свою жизнеспособность в широком диапазоне различных абиотических факторов (влажность, температура, органический состав, рН и др.). Клонально-селекционный механизм изменения бактерий в почвенных и водных сообществах, способен постоянно обеспечивать формирование эпидемически значимых вариантов возбудителей сапронозов (чумы, сибирской язвы, туберкулеза, псевдотуберкулеза, холеры, легионеллеза и др.). Облигатные возбудители инфекций, входящие в наземные резервуары, образуют сложные паразитарные системы, включающие чувствительных к ним хозяев, а так же носителей и переносчиков, способных неограниченно долго поддерживать их вирулентность и эпидемическую значимость. Природные резервуары устойчивы. Это достигается благодаря их эшелонированности, способности к кумуляции хозяев и переносчиков паразитических видов, наличия хозяев, выполняющих функцию усилителя, способности к смещению в другие экологические ниши.
