Микроорганизмы, токсины и эпидемии. 1.4. Патогенность микоплазм
Микоплазмы — это уникальные прокариотические организмы, имеющие лишь одну липопротеиновую мембрану, которая выполняет функции и клеточной стенки, и цитоплазматической мембраны. Они входят в класс Mollicutes, объединяющий также и ахолеплазмы, спироплазмы, уреаплазмы, анаэроплазмы [Прозоровский СВ. и др., 1995]. По форме и структурной организации молликуты очень близки к L-формам бактерий [Бухарин О.В., Усвяцов Б.Я., 1996]. Но в отличие от них, геном молликут крайне упрощен и экономен, что не предполагает возможность реверсии клеточной стенки. Микоплазмы являются самыми маленькими самореплицирующимися формами жизни и способны вызывать инфекционный процесс, используя вторую стратегию паразитизма. Болезни, вызываемые микоплазмами, называются микоплазмозами.
Происхождение микоплазм. Филогенетические связи класса Mollicutes и пути их эволюции обсуждаются специалистами в основном с двух точек зрения. Согласно одной из них микоплазмы являются выжившей ветвью примитивных организмов, из которых впоследствии произошли прокариоты и эукариоты. Они появились, как продукт прогрессивной эволюции еще до образования присущей бактериям клеточной стенки. Другая точка зрения состоит в том, что микоплазмы являются регрессивной ветвью эволюции некоторых грамположительных бактерий и (или) клостридий. Второе предположение находит экспериментальные подтверждения и рассматривается в двух возможных вариантах. Все микоплазмы происходят либо из одного предка, общего с грамположительными бактериями, либо от разных бактерий [Прозоровский СВ. и др., 1995].
Патогенность микоплазм. Так же как и бактерии, микоплазмы, что бы быть патогенными, должны инфицировать поверхности клеток хозяина. Поэтому многие патогенные микоплазмы имеют форму нитей или колбочек и на их поверхности, при электронной микроскопии, видны кончики выступающих полярных органелл, участвующих в процессе адгезии к клетке хозяина [Kirchhoff H. et al., 1984]. Эти концевые структуры имеют сложное строение. Они сплетены из интерактивных белков адгезинов и белков, участвующих в адгезии. Интересной особенностью адгезинов микоплазм является генетическое регулирование их антигенной структуры (рис. 14 и 15).
![Рис. 14. Концевая структура органеллы, участвующей в адгезии микоплазмы. Трансмиссионная электронная микрофотография М. pneumoniae: a) скрученная структура концевой части органеллы с пар (участок адгезии); b) кластированые цитоадгезиновые белки (Р1, В, С, Р30) в иммунолабильном участке концевой части органеллы (окрашивание ферритином и коллоидальным золотом); с) резистентная к Тритону Х-100 цитоскелетоподобная структура с отчетливыми пузырьками и параллельными нитями [Baseman J., Tully J., 1997]](https://www.supotnitskiy.ru/wp-content/uploads/2022/01/book1-14.gif)
Рис. 14. Концевая структура органеллы, участвующей в адгезии микоплазмы. Трансмиссионная электронная микрофотография М. pneumoniae: a) скрученная структура концевой части органеллы с пар (участок адгезии); b) кластированые цитоадгезиновые белки (Р1, В, С, Р30) в иммунолабильном участке концевой части органеллы (окрашивание ферритином и коллоидальным золотом); с) резистентная к Тритону Х-100 цитоскелетоподобная структура с отчетливыми пузырьками и параллельными нитями [Baseman J., Tully J., 1997]
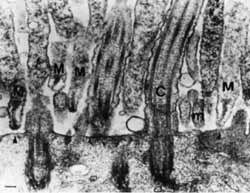
Рис. 15. Адгезия микоплазм к трахеальному эпителию хомячка.
Трансмиссионная электронная микрофотография М. pneumoniae: M — микоплазма; m — микроворсинки; С — реснички. Обращает на себя внимание ориентация микоплазмы, достигнутая с помощью специализированной адгезивной органнеллы [Baseman J., 1992]
Уклонение микоплазм от иммунной системы хозяина. На уклонении от иммунной системы хозяина построена вся стратегия паразитизма микоплазм. Один из механизмов такого уклонения заключается, в использовании множественных копий генов белков адгезии. В опероне адгезивного белка присутствует только одна полная копия гена адгезина со всеми регуляторными элементами. Однако в геноме микоплазмы присутствуют множество усеченных копий генов адгезинов, имеющих сходные (но не идентичные!) последовательности. Это дает возможность микоплазмам посредством гомологичной рекомбинации образовывать множество вариантов адгезинов, что приводит к изменению их специфичности и аффинитета. Однако иммунодоминантные эпитопы микоплазменных адгезинов не идентичны участкам, ответственным за адгезию [Jacobs E., 1991]. Последние закодированы через однокопийные регионы генов адгезии и высоко консервативны. Тем самым закрепляется роль таких участков (пар) в распознавании микоплазмами рецепторов клеток хозяина и их колонизации [Gerstenecker В., Jacobs Е., 1991]. Конформация иммунодоминантных эпитопов меняется благодаря пептидил-пролил изомеразе (циклофилину), воздействующей на складчатые участки адгезивных белков с повышенным содержанием пролина. Таким образом, иммунные ответы хозяина направлены на вариабельные регионы, не имеющие непосредственного отношения к адгезии. Это делает маловероятным образование антител, способных блокировать адгезию микоплазм и частично объясняет причину высокой величины реинфицирования больных [Baseman J., Tully J., 1997].
Другой механизм уклонения микоплазм от иммунной системы хозяина использует антигенную мимикрию. В ее основе лежит высокая гомология адгезинов и структурных белков млекопитающих [Tully J. et al., 1995]. Однако антигенная мимикрия используется микоплазмами не столько для маскировки, сколько для подавления иммунной системы хозяина и ее переключения на разрушение собственных органов и тканей [Biberfeld G., 1985]. У пациентов, с документированными микоплазменными респираторными инфекциями (М. pneumoniae), обнаруживали сероконверсию к миозину, кератину и фибриногену, а также экстрапульмональные проявления инфекции — экзантемы и кардиальные нарушения [Tully J. et al., 1995]. В дальнейшем были обнаружены признаки классического бактериального аутоиммунного процесса — острой ревматической лихорадки, сходной с вызываемой стрептококковой инфекцией [Cunningham M., 1993]. Антистрептококковые антитела, направленные против альфа-спирального кольцевого участка М-белка, перекрестно реагировали с сердечным миозином, тропомиозином и микоплазменными адгезинами [Cunningham M., 1993]. Установлена гомология аминокислотных последовательностей микоплазменных адгезинов, и человеческих CD4 и белков главного комплекса гистосовместимости II класса. Антитела к этим белкам запускают клеточную Гибель и иммуносупрессию. Одновременно микоплазмы выступают как митогены В- и Т-клеток, индуцируя аутоиммунное состояние Через активацию аутоиммунных Т-клеток и поликлональных В-клеток. Таким образом, разнообразные полиорганные проявления микоплазменной инфекции вызваны аутоиммунным характером их патогенеза [Baseman J., Tully J., 1997].
Для размножения во внутренней среде хозяина, противодействия его защитным механизмам и причинения ему вреда, микоплазмы используют ряд других, очень сложно действующих факторов патогенности. Они включают:
1) образование микоплазмами перекиси водорода и перекисных радикалов, вызывающих в участках адгезии повреждение мембраны клетки через окислительный;
2) конкуренцию и истощение микоплазмами питательных компонентов и прекурсоров клетки;
3) капсулоподобный материал и электронно-плотные поверхностностные слои, повышающие прочность микоплазмы и придающие им иммунорегулирующую активность;
4) секрецию в окружение клетки хозяина микоплазменных ферментов, таких как фосфолипазы, АТФазы, гемолизины, протеазы и нуклеазы, вызывающих локальное клеточное разрушение и хромосомные аберрации [Theiss P., 1996].
Болезни, вызываемые микоплазмами. У иммунокомпетентных людей ими наиболее часто вызываются респираторный микоплазмоз (M. pneumoniae) и болезни урогенитального тракта (M. hominis, M. genitalium, M. fermentans, M. primatum, M. urealyticum).
Микоплазмы являются кофакторами, способствующими развитию и активизации инфекций, использующих ту же стратегию паразитизма, например, ВИЧ-инфекции [Eisner R., 1990].
Длительное персистирование микоплазм в организме человека так же проявляется болезнями, инфекционная природа которых долгое время подвергалась сомнению (болезнь Крона, артриты, малигнизация и др.).
***
Микоплазмы являются самыми маленькими самореплицирующимися формами жизни и способны вызывать инфекционный процесс, используя вторую стратегию паразитизма. Микоплазмы вызывают локальное клеточное разрушение и хромосомные аберрации. Они не только уклоняются от иммунной системы хозяина, но, благодаря использованию антигенной мимикрии, переключают ее на разрушение собственных органов и тканей. Разнообразные полиорганные проявления микоплазменной инфекции вызваны аутоиммунным характером их патогенеза. Микоплазмы способствуют развитию и активизации инфекций, использующих ту же стратегию паразитизма, например, ВИЧ-инфекции