Пандемия COVID-19 как индикатор «белых пятен» в эпидемиологии и инфекционной патологии
Федеральное государственное бюджетное учреждение «27 Научный центр» Министерства обороны Российской Федерации, 105005, Российская Федерация, г. Москва, Бригадирский переулок, д. 13
Поступила 30.08.2020 г. Принята к публикации 26.09.2020 г.
Пандемия COVID-19 (Coronavirus Disease 2019) выявила множество «белых пятен» в эпидемиологической науке как раз тогда, когда у человечества появилась уверенность в том, что эпидемические катастрофы остались в далеком прошлом. Цель работы - рассмотреть пандемию COVID-19 как индикатор «белых пятен» в эпидемиологии и инфекционной патологии. В статье обосновывается, что эпидемия COVID-19 началась гораздо раньше, чем ее распознали в Китае. Неудачи установления первичного природного резервуара SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) среди позвоночных организмов предполагают расширение круга поисков на беспозвоночные организмы. Причинами глобального распространения SARS-CoV-2 могут быть наличие еще не установленных многочисленных первичных и вторичных природных очагов вируса среди животных в ближайшем окружении человека, высокая трансмиссивность вируса, а также его пресимптоматическая передача. Высокая трансмиссивность SARS-CoV-2 стала возможной благодаря: большей, чем у вирусов близкородственных видов, величине энергии связывания Sl-белка вируса с его рецептором ACE2; более эффективному проникновению вируса в эндосомы клетки; работе репликационно-транскрипционного комплекса, противодействующего врожденному защитному ответу клетки. Пресимптоматическая передача SARS-CoV-2, ставшая ключевой в пандемическом распространении SARS-CoV-2 - следствие позднего обнаружения вируса врожденной иммунной системой. Заболевший человек сначала становится заразным для окружающих, а потом у него появляются симптомы болезни. Высказано предположение, что пандемия COVID-19 - не самостоятельное событие, вызванное появлением «нового вируса» (вроде очередной пандемии гриппа), а проявление более сложного и опасного явления - смены фазы многовекового глобального пандемического цикла, когда из-за роста плотности иммуно- дефицитных и ослабленных различной патологией популяций (хронические болезни, накопление генетических дефектов, старение и др.) и обострившихся социальных проблем на смену нециклическим пандемиям и циклическим малоконтагиозным эпидемиям приходят циклические, вызываемые высококонтагиозными патогенами. SARS-CoV-2 - не последний в этих событиях. К тяжелому клиническому течению COVID-19 приводят такие еще малоизученные процессы, как «разбалансировка» ренин-ангиотензин-альдостероновой системы, цитокиновый шторм, септическое течение болезни, генетические факторы пациента и развившаяся в ходе инфекционного процесса иммунопатология (антитело-зависимое усиление инфекции, антигенный импринтинг, антифосфолипидный синдром, наличие антиинтерфероновых антител и др. факторы). Заполнение этих «белых пятен» станет катализатором исследовательской революции в эпидемиологии и инфекционной патологии.
Ключевые слова: атипичная пневмония; коронавирус; межвидовая передача; патогенез; пресимптоматическая передача; ренин-ангиотензин-альдостероновая система; сепсис; COVID-19; SARS-CoV-2.
Библиографическое описание: Супотницкий М.В. Пандемия COVID-19 как индикатор «белых пятен» в эпидемиологии и инфекционной патологии // Вестник войск РХБ защиты. 2020. Т. 4. № 3. С. 338-373. https://doi.org/10.35825/2587-5728-2020-4-3-338-373
Неизвестный ранее вирусологам и неизвестно когда начавший собирать свою смертельную жатву среди людей коронавирус, названный SARS-CoV-2[1], в научном информационном пространстве появился внезапно, на фоне убежденности в том, что глобальные эпидемические катастрофы - это явления далекого прошлого человечества. Поэтому его пандемический потенциал не был оценен сразу. Ожидалось, что он не выйдет за пределы Китая. Однако в Китае SARS-CoV-2 был только идентифицирован, его распространение началось на юге Европы как минимум на год раньше, а где он появился еще раньше - установить только предстоит. SARS-CoV-2 - не единственный возбудитель опасной инфекции, способный к пандемическому распространению. Но в отличие от катастрофических пандемий прошлого, вызванная им пандемия пришлась на совершенно иной, более высокий уровень эпидемиологии и смежных наук. Взрывной рост научного интереса к различным аспектам этой пандемии[2] позволяет создать научный задел для борьбы с инфекционными болезнями будущего. Цель работы - рассмотреть пандемию COVID-19 как индикатор «белых пятен» в эпидемиологии и инфекционной патологии. Для ее достижения мы провели системный анализ доступных источников на русском и английском языках, структурировав их по принципу «от общего к частному». В эпидемиологии COVID-19 объектом такого анализа стали природный резервуар SARS-CoV-2 и причины его глобального распространения. Патология, вызванная SARS-CoV-2, анализировалась с точки зрения ее значения для передачи вируса. Использовалось сравнение с аналогичной патологией, вызванной SARS-CoV и вирусом гриппа. Также предпринята попытка понять причины, по которым COVID-19 различается по клиническому течению у разных пациентов. Поиск источников информации проводился с использованием поисковых систем PubMed, Google Scholar, Научной электронной библиотеки eLIBRARY.RU, фондов Центральной научной медицинской библиотеки Первого МГМУ им. И.М. Сеченова Министерства здравоохранения Российской Федерации, научных специализированных изданий (Emerging Microbes & Infections, Emerging Infectious Diseases, Journal of Medical Virology, Nature, Viruses, Virus Genes и др.) и серверов препринтов (например, BioRxiv и MedRxiv).
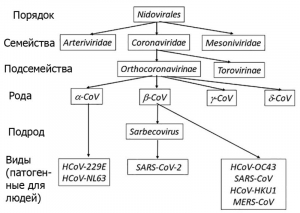
Рисунок 1 - Таксономия и классификация патогенных для людей коронавирусов. Легко протекающие заболевания вызывают 229E, OC43, NL63 и HKU1; тяжелые - SARS-CoV (обнаружен в 2002 г., 10 % летальных исходов), MERS-CoV (обнаружен в 2012 г., 35 % летальных исходов) и SARS-CoV-2 (обнаружен в 2019 г., 0,25-5 % летальных исходов) [5]. Случаев SARS среди людей не регистрировалось с 2004 г., а число случаев заболевания MERS у людей неуклонно снижалось с 2016 г. по июль 2019 г. [6]
Статья является продолжением работы, опубликованной в марте 2020 г. [1]. В предыдущей статье рассмотрены таксономия и происхождение коронавирусов, строение их генома, молекулярная патология коронавирусных инфекций, особенности иммунного ответа на вызванную ими инфекцию, эпидемиология и клиника COVID-19 по первым работам китайских исследователей, посвященным данной проблеме.
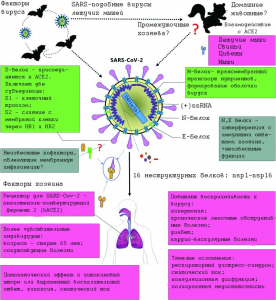
Рисунок 2 - Общие сведения о SARS-CoV-2, его геноме, установленных природных резервуарах, патогенезе и клинике вызываемой болезни. Летучие мыши считаются основным резервуаром многих видов коронавирусов, включая SARS-подобные (SARS-CoV), в их числе и SARS-CoV-2. Верхняя панель: SARS-CoV-2 представляет собой оболочечный вирус с несегментированной одноцепочечной плюс-цепью РНК (positive single-stranded RNA, ssRNA), благодаря чему вирус реплицируется в цитоплазме (а не в ядре клетки, как вирус гриппа с минус-цепью РНК), образовав органеллу репликации, чтобы скрыть свой вирусный репликационный аппарат от врожденных цитозольных сенсоров клетки. Две трети вирусной РНК, расположенной, в основном, в первой открытой рамке считывания (open reading frame, ORF 1a/b), кодирует 16 неструктурных белков (non-structure proteins, NSP). Остальная часть генома вируса кодирует четыре основных структурных белка: гомотримерный гликопротеин оболочки вируса (обычно его называют S-белком или спайком, spike, S) - шиповидный отросток оболочки, предназначенный для взаимодействия с трансмембранными рецепторами клеток-мишеней (1273 аминокислот); белок малой оболочки (small envelope, E) - группа относительно небольших высококонсервативных белков -(75 аминокислот), помогающих клетке в сборке и высвобождении вирионов, играет важную роль в морфогенезе и сборке вируса, действуя как виропорины, которые собираются в мембрану хозяина, образуя белково-липидные поры, участвующие в переносе ионов; белки матрикса (matrix, M) - структурные белки с общей архитектурой (222 аминокислоты), функционируют совместно с белками E, N и S и играют важную роль в упаковке РНК; белки нуклеокапсида (nucleocapsid, N) - играют важную роль в упаковке вирусной РНК в рибонуклеокапсид через свой РНК-связывающий домен, опосредуют сборку вируса, взаимодействуя с вирусным геномом и М-белком; несколько вспомогательных белков. Неструктурные белки этого вируса играют решающую роль в репликации вируса; структурные и вспомогательные белки участвуют в морфогенезе и влияют на иммунный ответ хозяина. S-гликопротеин (S glycoprotein) SARS-CoV-2 связывается с родственным рецептором на поверхности клетки-мишени - ангиотензинпревращающим ферментом 2 (angiotensin-converting enzyme 2, ACE2), что является критической стадией для запуска инфекционного процесса. Факторы хозяина (нижняя панель) также могут влиять на восприимчивость к SARS-CoV-2 и прогрессирование болезни. Пожилые люди и люди с хроническими болезнями более подвержены инфицированию SARS-CoV-2 и тяжелому течению COVID-19. RBD (receptor-binding domain) - рецептор-связывающий домен (область шипа, физически контактирующая с ACE2, 197 аминокислот), наиболее изменчивая часть SARS-CoV-2. Гидрофобные области, способствующие слиянию субъединицы S2 с клеточной мембраной: HR1 - гептадный повтор 1; HR2 - гептадный повтор 2 [7]
Молекулярное моделирование рецептор-связывающих доменов SARS-CoV-2 позволило ученым отнести его к SARS-подобным вирусам летучих мышей, использующим в качестве рецептора для связывания с клетками-мишенями экзопептидазу - ангиотен-зинпревращающий фермент 2 (ACE2), имеющийся на поверхности эндотелиальных клеток капилляров легких у летучих мышей и у людей [3] [2]. В отличие от них, бетакоронавирусы из рода Merbecovirus, к которому принадлежит вирус ближневосточного респираторного синдрома (Middle East respiratory syndrome, MERS-CoV), вызвавший вспышку атипичной пневмонии на Ближнем Востоке в 2012 г., используют мембранные протеолитические ферменты клеточной поверхности в качестве рецепторов, такие как дипептидилпептидаза 4 (DPP4) [4]. Общие сведения о SARS-CoV-2, его таксономии и геноме, предполагаемых природных резервуарах, из которых он проникает в популяции людей, патогенезе и клинике вызываемой болезни, возможные пути передачи в популяциях людей и целевые сайты для различных лекарств[4] приведены на рисунках 1 [5], 2 [7], 3 [8] и 4 [9] соответственно.
Пропуски в хронологии COVID-19. Коронавирусные инфекции не считались достойными внимания эпидемиологической науки в ХХ веке в такой же степени, как эпидемии, вызванные возбудителями гриппа, кори, геморрагических лихорадок и др. Только в КНР, накопившей в 2000-2003 гг. трагический опыт борьбы со вспышками тяжелого острого респираторного синдрома (severe acute respiratory syndrome, SARS) в южно-китайской провинции Гуандун, вызванными коронавирусом SARS-CoV, таксономически близким к SARS-CoV-2, систематически отслеживались возбудители коронавирусных инфекций в их природных резервуарах среди диких животных (летучие мыши, ежи, циветты, панголины, змеи, черепахи и др.) [10-14]. Многолетняя эпидемическая настороженность в отношении возбудителей таких инфекций позволила китайским исследователям в течение двух месяцев обнаружить появление нового, уже седьмого патогена людей из этого таксона. Поэтому считается, что эпидемия COVID-19 началась в ноябре 2019 г. в китайском городе Ухань, т.е. там, где в конце декабря 2019 г. она приобрела массовый характер и была распознана, как вызванная ранее не известным бета-коронавирусом (β-CoV)[5].
Генетический материал SARS-CoV-2 обнаружен в образцах сточных вод испанского города Барселоны, отобранных в марте 2019 г.[6] [17]. Это обстоятельство противоречит первоначальным оценкам, относящим появление этого вируса на конец января 2020 г. [18][7]. В Италии генетический материал SARS-CoV-2 в сточных водах Милана и Турина обнаружен в образцах, отобранных в декабре 2019 г.[8] Но первые два случая COVID-19 у китайских туристов в Италии установлены 31.01.2020 г.[9]
В Российской Федерации со вспышками «сезонного гриппа» совпали вспышки тяжелой легочной инфекции в Уральском регионе и на юге России в ноябре 2019 г.[10], когда о SARS-CoV-2 еще не было известно и, соответственно, не существовало тест-систем, позволяющих его обнаружить. Вспышка тяжело протекающей коронавирусной пневмонии имела место летом 2019 г. и в США, что подтверждает выступление главы американского Центра по предупреждению и контролю заболеваний Роберта Редфилда (Robert R. Redfield, 1951 г.р.) в Палате представителей Конгресса. Редфилд сообщил конгрессменам, что у нескольких умерших американцев, которым диагностировали грипп, при посмертном обследовании обнаружен коронавирус[11].
Таким образом, ретроспективный анализ образцов сточной воды, выполненный в Италии и Испании, а также собранные косвенные данные о вспышках атипичной пневмонии в США и России показали, что ноябрьская вспышка COVID-19 в Ухани была только одной из многих в 2019 г. SARS-CoV-2 распространялся среди европейского населения единичными случаями и локальными вспышками, и принимался врачами за грипп или тяжелую «внебольничную пневмонию»[12].
Поиск возможных природных резервуаров SARS-CoV-2.
Пропуски в хронологии пандемии COVID-19 при широком географическом распространении вспышек болезни - это сигнал о наличии многочисленных неизвестных природных очагов возбудителей коронавирусной инфекции. Упоминание SARS-подобных вирусов в связке с летучими мышами условно, так как они в силу своей многочисленности и распространенности более доступны для исследователей, чем, например, циветты, панголины или даже ежи. При эпидемическом мониторинге потенциальных природных резервуаров на наличие опасных для людей вирусов обнаруживаются ранее не известные как SARS-подобные, так и MERS-подобные вирусы. Среди них встречаются опасные для людей. Например, при обследовании в 2012-2013 гг. заброшенной шахты в округе Мудзян китайской провинции Юньнань на юге Китая отловлены подковообразные летучие мыши (Rhinolophus sinicus), инфицированные двумя ранее не известными видами бетакоронавирусов, оказавшихся SARS-подобными.
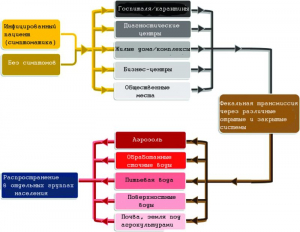
Рисунок 3 - Возможные пути передачи SARS-CoV-2. По [8]
Они получили обозначение RaTG13 и BtCoV/4991. Позже было установлено, что это один и тот же вирус, сейчас он известен как RaTG13. При удалении фекалий летучих мышей шесть рабочих этой шахты заболели тяжелой пневмонией, трое из них умерли [19, 20]. Обнаружено близкое сходство между шипами SARS-CoV-2 и RaTG13 и в механизме связывания с человеческим рецептором ACE2. В настоящее время этот вирус наиболее близок (из известных) по нуклеотидным последовательностям к SARS-CoV-2 - общая идентичность последовательности генома 96,2% [21, 22]. Однако эволюция RaTG13 в SARS-CoV-2 маловероятна, поскольку его геном примерно на 1,2 тыс. нуклеотидов (т.е. 3,8%) отличается от генома SARS-CoV-2, а шип RaTG13 не имеет сайта для расщепления фурином. Последняя особенность RaTG13 сдвигает его положение на эволюционном древе в сторону SARS-CoV, а не SARS-CoV-2. И хотя J. Latham [20] настаивает на том, что RaTG13 «доведен» в китайской лаборатории до SARS-CoV-2 и вызвал эпидемию, случайно попав за ее пределы в ноябре 2019 г.[13], с этой версией не согласуется обнаружение нуклеиновой кислоты SARS-CoV-2 в пробах воды, отобранных в Испании в марте 2019 г. Кроме того, J. Latham [20] не привел убедительногообъяснения того, каким образом SARS-CoV-2 «приобрел» идеальный сайт для расщепления фурином, необходимый для эффективной передачи вируса через контакты между людьми[14].
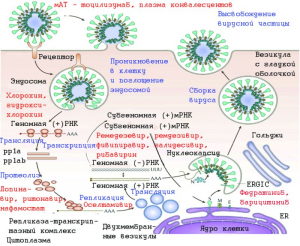
Рисунок 4 - Целевые сайты для лекарств в жизненном цикле коронавирусов. Белок S вируса связывается с рецептором ACE2 с последующим проникновением генома вирусной РНК в клетку-хозяин. После вхождения генома в клетку следует трансляция структурных и неструктурных белков (NSP). ORF1a и ORF1ab транслируются с образованием полипротеинов pp1a и pp1ab, которые далее расщепляются протеазами, кодируемыми ORF1a, с образованием 16 неструктурных белков (nsp1-nsp16). Затем следует сборка и погружение в просвет ERGIC (промежуточный отсек эндоплазматической сети Гольджи). Наконец, вирионы высвобождаются из инфицированной клетки посредством экзоцитоза. В этом жизненном цикле коронавируса несколько стадий рассматриваются как потенциальные мишени для лекарств: ингибиторы S-белка (мАТ, плазма конвалесцента); препараты, изменяющие эндосомный pH (хлорохин, гидроксихлорохин); ингибиторы РНК-зависимой РНК-полимеразы (рем- десивир, фивипиравир, галидесивир, рибавирин); ингибиторы протеазы (лопинавир, ритонавир, нафамостат); ингибиторы сигнального пути JAK-STAT- передает информацию от химических сигналов вне клетки к ядру клетки, что приводит к активации генов посредством транскрипции (федратиниб, барицитиниб) [9]
В Италии, особенно в ее северной части и в Сардинии, несколько лет назад были обнаружены инфицированные коронавирусами летучие мыши Rhinolophus ferrumequinum, Plecotus auritus и Tadarida teniotis. Филогенетический анализ показал их сходство с SARS-подобными коронавирусами [24], т.е. в этих регионах существуют экосистемы, вмещающие SARS-подобные вирусы. Не случайно в марте- апреле 2020 г. именно там пандемия COVID-19 достигла катастрофических размеров[15]. В центральной Италии и на юге страны эпидемии практически не было [25].
MERS-подобные вирусы выделены из фекалий европейских ежей (Erinaceus europaeus) в Германии [26], Франции [27], на Британских островах [28], а также амурских ежей на китайском Дальнем Востоке [29].
Для установления географии природных очагов опасных для людей коронавирусов нужно понять, в каких организмах может находиться их первичный резервуар, т.е. тот, без которого существование SARS-CoV-2 и других коронавирусов в природе невозможно, и откуда они проникают в популяции диких животных.
Постепенно накапливается информация, позволяющая поставить под сомнение способность SARS-CoV-2 длительно поддерживаться среди позвоночных животных. Результаты нового исследования коронавирусной инфекции у панголинов также предполагают, что они не являются естественным резервуаром корона- вирусов [30]. Кроме того, было обнаружено, что SARS-CoV-2 не реплицируется в клетках почек или легких летучих мышей (Rhinolophus sinicus) [32], что означает отсутствие у SARS-CoV-2 адаптации к летучим мышам.
Общая энергия связывания (англ. overall binding energy) с SARS-CoV-2 для человеческого ACE2 имеет большую величину (ккал/ моль), чем у ACE2 с вирусами других протестированных видов. Это открытие особенно удивительно, поскольку обычно ожидается, что вирус будет иметь самое высокое сродство к рецептору в своем исходном виде-хозяине, например, как предполагали на начальном этапе пандемии - летучей мыши; и меньшую аффинность связывания с рецептором любого нового хозяина, например, у человека. Однако оказалось наоборот [33]. Если считать такую энергию связывания результатом «преадап- тации» SARS-CoV-2 к человеку, как считают авторы процитированной работы, то надо найти ответ на вопрос, где и когда эта адаптация произошла.
SARS-CoV-2 не имеет «ближайших родственников» среди известных коронавирусов. В отличие от него, ACE, ACE2 и их аналоги - относительно неспецифические металл-за- висимые пептидазы[16], наоборот, широко распространены в природе. Ген ACE у человека расположен на хромосоме 17, фермент состоит из двух гомологичных и независимых каталитических доменов, образовавшихся в результате дупликации 700 млн лет назад (поздний протерозой) древнего гена[17] пептидазы у общего предка Arthropoda (членистоногих), Cnidaria (стрекающих) и Chordata (хордовых). Два каталитических домена ACE вносят вклад в широкое разнообразие субстратов ACE и, соответственно, в физиологическое воздействие и эволюционную устойчивость фермента[18]. У млекопитающих ACE отвечает, по крайней мере, за 90 % превращения ангиотензина I в ангиотензин II в крови, почках, сердце, легких и головном мозге и является центральным компонентом системы ренин-ангиотензин-альдостерон, регулирующей артериальное давление [34]. Однако поддержание сердечно-сосудистой функции не является критическим эволюционным признаком для самих ACE и его аналогов. Дуплицированные белки, связанные с ACE, биохимически охарактеризованы у насекомых (дрозофилы, домашние мухи, моль и комары), беспозвоночных (устрицы, мидии и раки), простейших (Leishmania) и бактерий [36].
Ген-гомолог ACE (с 40% идентичностью аминокислот), кодирующий ACE2, идентифицирован в 2000 г. на половой X-хромосоме (Xp22) человека. Его геномная последовательность имеет много общего со структурой генаACE. Из 18 экзонов[19] первые 17 сходны по размеру с экзонами человеческого ACE. Имеет большое подобие с ACEr и AnCE - цинковыми металлопептидазами, экспрессирующимися в куколках дрозофил. Неожиданно оказалось, что ACE2 действует специфически как карбоксипептидаза, а не как пептидилдипептидаза (ACE), поскольку он способен отщеплять исключительно C-концевые остатки как от ангиотензина I, так и от ангиотензина II [37]. То есть ACE, ACE2 и подобные ферменты (ACEr и AnCE) возникли задолго до того, как артериальное давление стало физиологически значимым у первых позвоночных. Такая хронология означает:
1) летучие мыши стали источником высокопатогенных для человека SARS-подобных коронавирусов не из-за их биологических особенностей (например, наличия у эндотелия капилляров легких летучих мышей рецептора ACE2 с высоким сродством к S1-белку SARS-CoV-2 или повышенной выработки интерферонов), а случайно, из-за нахождения источника заражения в экосистемах обитания их отдельных сообществ, и они не единственные позвоночные животные, которые могут стать вторичным резервуаром коронавирусов;
2) коронавирусы в процессе конвергентной эволюции[20] в их природных экосистемах за 700 млн лет накопили множество молекулярных решений, необходимых для связывания с ACE2 (с большей или с меньшей энергией) в разных организмах, и прошли вместе с ними «преадаптации», которые случайно оказались оптимальными для связывания SARS-CoV и SARS-CoV-2 с человеческим ACE2, и пока не известно, какие еще вирусы поддерживаются в природных резервуарах, которые способны связываться с человеческими ACE, ACE2, их аналогами или ортологами, но они могут дать о себе знать вспышками среди людей при разрушении включающих их экосистем.
Обнаружение нуклеиновой кислоты SARS-CoV-2 в сточных водах населенных пунктов не всегда можно связать с развитием вспышки COVID-19 среди их жителей. На наличие такой связи эпидемиологи обратили внимание только в разгар пандемии. Но первые положительные тесты получены с пробами, отобранными в Испании и Италии тогда, когда о COVID-19 еще не слышали. Следовательно, могут быть и другие причины нахождения нуклеиновой кислоты SARS-CoV-2 в сточных водах, одна из которых - древние симбиотические отношения коронавирусов с почвенными и водными простейшими и беспозвоночными.
Protozoa - эволюционные предшественники макрофагов и других фагоцитирующих клеток позвоночных организмов, включая человека [38]. Благодаря сходству поверхностных рецепторов макрофаги и простейшие реагируют с хемокинами и цитокинами сходным образом, воспринимая их как аттрактанты. Ответные реакции амеб на фактор некроза опухолей, отдельные интерлейкины и циклооксигеназу 2 аналогичны таковым у нейтрофилов и макрофагов позвоночных организмов [39]. Резервуарная роль простейших хорошо изучена для возбудителей туляремии, легионеллеза, сибирской язвы, лихорадки Ку, чумы [40, 42] и отдельных вирусов. Например, исследования А. Mattana с соавт. [43] показали, что вирус Коксаки b3 (Coxsackie virus b3) способен выживать и сохранять инфекционность внутри трофозоитов[21] амебы Acanthamoeba castellanii в течение 6 мес. Acanthamoeba spp. выполняют резервуарную роль и в отношении аденовирусов 2 типа. Их обнаруживают в 14,4 % культур амеб, выделенных из окружающей среды [44]. Свободноживущие амебы (англ. free-living amoebae, FLA) в качестве природного резервуара и переносчика аденовирусов человека рассмотрены в работе P. Scheid и R.Schwarzenberger [45], норовирусов - в работе T.-Y. Hsueh и K.E. Gibson [46]. Для гигантских ДНК-вирусов «Acanthamoeba polyphaga Mimivirus»[22], обитающих в Acanthamoeba, еще 15 лет назад установлена способность вызывать тяжелые пневмонии у людей [47]. Простейшие - резервуар патогенов в системах водоснабжения больниц. Простейшие обеспечивают им защиту от неблагоприятных условий и средство распространения, что позволяет им подготовиться к последующему выживанию в макрофагах человека [48].
В задачу данной статьи не входит рассмотрение взаимоотношений простейших с вирусами, литература по этой проблеме огромна. По аналогии с другими патогенами, экология которых хорошо изучена, можно в качестверабочей гипотезы принять, что именно простейшие являются первичным резервуаром SARS-CoV-2 и других коронавирусов. Тогда станет более понятно направление дальнейшего поиска источников инфицирования отдельных видов диких животных, от которых вирус проникает в популяции людей, а не загонять исследования «в тупик» после того, как выяснится, что эти животные «не являются естественным резервуаром коронавирусов»[23]. Разрушение экосистем, вмещающих первичные резервуары коронавирусов, через их проникновение в фагоцитирующие клетки позвоночных животных, привело к формированию многочисленных вторичных полигостальных очагов и к закреплению коронавирусов в новых экологических нишах. Один из них, SARS-CoV-2, инфицируя ACE2 на поверхности пневмоцитов и эндотелия капилляров человека, получил возможность пандемического распространения. В сточных водах, т.е. в среде, насыщенной органикой, условия для размножения простейших более оптимальны, чем в реках, и, соответственно, более благоприятны для размножения вирусов в клетках простейших. В свою очередь это привело к попаданию в водную среду нуклеиновой кислоты SARS-CoV-2 в количествах, доступных для определения имеющимися методами анализа.
2. Причины пандемического распространения SARS-CoV-2
Число заболевших и погибших от COVID-19 оказалось ошеломляющим даже при низком уровне летальности заболевших (0,25-5%). Наличие многочисленных вторичных полигостальных очагов способствует распространению SARS-CoV-2, но не объясняет, почему этот вирус распространяется пандемически, тогда как природноочаговые SARS-CoV и MERS-CoV вызывали только отдельные вспышки атипичной пневмонии. Необходимо приблизиться к пониманию, почему такое стало возможным.
Влияние взаимодействия «вирус-клетка» на распространение COVID-19. Инфекционный процесс начинается после распознания S-белком SARS-CoV-2 мембраносвязанной формы ACE2 на поверхности клеток-мишеней - пневмоциты второго типа легочных альвеол, клаб-клетки (club cells, Clara cells, клетки Клара) в ресничном эпителии бронхиол легких и др. Экспериментальные доказательства того, что повышенная аффинность связывания между S-белком коронавирусов и его рецептором коррелирует с повышенной трансмиссивностью вируса и тяжестью заболевания у людей, получены еще 15 лет назад при изучении динамики распространения первой вспышки опасной для людей коронавирусной инфекции - SARS [50].
Человеческий ACE2 представляет собой трансмембранную карбоксипептидазу, содержащую сильно гликозилированный N-концевой эктодомен, содержащий ферментативный активный сайт, гидрофобный трансмембранный домен и короткий внутриклеточный C-концевой хвост (рисунок 5).
Рассмотрим, чем отличается взаимодействие SARS-CoV-2 от SARS-CoV с ACE2. По сравнению с RBM S-белка SARS-CoV, аналогичный белок SARS-CoV-2 содержит структурные изменения в складке, связывающей S1-субъединицу с ACE2 (остатки 482-485: Gly- Val-Glu-Gly), позволяющие ей стать более компактной и лучше контактировать с N-концевым эктодоменом (спиралью) ACE2. Остаток Phe486 RBM SARS-CoV-2 из-за более протяженной боковой цепи более гидрофобен, чем лейцин RBM SARS-CoV, и образует более сильный контакт с гидрофобным карманом данного участка ACE2 [21]. S-белок SARS-CoV-2 обладает в 10-20 раз большей тропностью к ACE2, чем S-белок у SARS-CoV [33]. Благодаря этим особенностям его молекулярной структуры формируется более стабильный и термоустойчивый комплекс «S1-ACE2», чем у SARS-CoV.
Ген АСЕ2 экспрессируется в сосудистой системе (эндотелиальные клетки, мигрирующие ангиогенные клетки и клетки гладких мышц сосудов), сердце (кардиофибробласты, кардиомиоциты, эндотелиальные клетки, перициты и эпикардиальные жировые клетки), в почках (гломерулярные эндотелиальные клетки, подоциты и эпителиальные клетки канальцев), в локальных отделах печени (холангиоциты и гепатоциты), сетчатке глаза (пигментированные эпителиальные клетки, клетки фоторецепторов палочек и колбочек и глиальные клетки Мюллера), энтероцитах кишечника, органах желудочков центральной нервной системы, верхних отделах дыхательных путей (бокаловидные и реснитчатые эпителиальные клетки), в альвеолярных (тип II) и эпителиальных клетках легких и легочной сосудистой системы [51].Такая особенность связывания с клетками-мишенями при столь широком распространении экспрессирующегося гена АСЕ2 в органах и тканях снижает инфицирующую дозу SARS-CoV-2 по сравнению с другими коронавирусами и, соответственно, повышает его трансмиссивность при передаче от больного к здоровому человеку.
Результаты экспериментов, полученные в условиях in vitro и in vivo, демонстрируют, что ACE2 служит основным рецептором инфекции SARS-CoV. Но ACE2 - не единственные «ворота» для проникновения SARS-CoV-2 в организм человека. Накоплены экспериментальные доказательства его проникновения через рецептор CD147 (англ. Basigin; extracellular matrix metalloproteinase inducer, EMMPRIN)[24] [52].
Весьма вероятно, что SARS-CoV-2 распознает другие рецепторы/корецепторы, помимо ACE2 и CD147, что также способствует его трансмиссивности. N-терминальный домен S1-субъединицы S-белка (N-terminal domain of the S1 subunit, S1-NTD) содержит рецептор-связывающий мотив, отличный от такового у SARS-CoV, с некоторыми вставками, которые могут придавать SARS-CoV-2 новые рецепторные способности. В частности, мотивы, подобные вставке 72GTNGTKR78, были обнаружены в структурных белках других вирусов (вирус Менго, коронавирус инфекционного бронхита, вирус мышиного гепатита и др.); и эти мотивы были расположены в предполагаемых регионах, участвующих в распознавании рецепторов белков и сахаров, что позволяет предположить, что подобные связывающие способности могут проявляться и у SARS- CoV-2[25] [54].
Еще одно преимущество SARS-CoV-2, повышающее его инфекционность - сайт для расщепления фурином белка S на SЦS2-субъединицы, участвующие в процессе проникновения вируса в клетку уже после его взаимодействия с ACE2, что делает возможным слияние вирусной и клеточной мембран и последующее проникновение вируса в клетку [55] (рисунок 6).
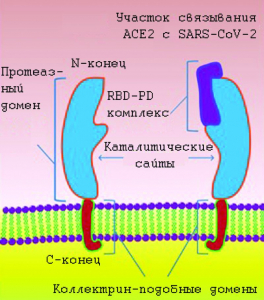
Рисунок 5 - Схематическое изображение рецептора ACE2 на поверхности клетки. Ген ACE2 охватывает 3998 т.п.н. геномной ДНК и содержит 18 экзонов. Он кодирует гликопротеин клеточной поверхности типа I (т.е. содержащий связь Ser (или Thr)-GalNAc) размером около 100 кДа, состоящий из 805 аминокислот. ACE2 имеет внеклеточный N-концевой домен и C-концевой трансмембранный домен с цитозольным хвостом. N-концевая часть белка содержит когтеобразный протеазный домен (claw-like protease domain, PD). С-концевой домен ACE2 называется коллектрино-подобным доменом (сollectrin-like domain), так как является гомологом почечного белка коллектрина, регулирующего перенос аминокислот в почечных канальцах и наделяющий ACE2 множеством физиологических функций, кроме поддержания давления крови в сосудистой системе. Рецептор-связывающий домен (RBD) SARS-CoV-2 взаимодействует с PD ACE2, образуя комплекс RBD-PD, каталитический сайт ACE2 инактивируется [51]
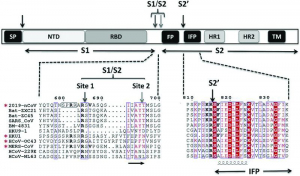 Рисунок 6 - Схематическое изображение S-белка SARS-CoV-2 с указанием предполагаемых сайтов созревания. После связывания S-белка с рецептором он подвергается дальнейшим конформационным изменениям, позволяя протеазам клетки последовательно расщеплять его на двух сайтах: сначала на границе S1/S2 (т.е. на сайте S1/S2), затем внутри субъединицы S2 (т.е. на сайте S2'). Домены S-белка ранее были охарактеризованы в SARS-CoV и MERS-CoV: сигнальный пептид (signal peptide, SP), N-концевой домен (N-terminal domain, NTD), рецептор-связывающий домен (receptor-binding domain, RBD), белок слияния (fusion peptide, FP), внутренний пептид слияния (internal fusion peptide, IFP), гептадный повтор 1/2 (heptad repeat 1/2, HR1/2) и трансмембранный домен (transmembrane domain, TM). Сайты расщепления SP, S1[S2 и S2'указаны стрелками. Фуриноподобный сайт расщепления окружен черной рамкой (левая табличка). Красные звездочки указывают на присутствие канонического фуриноподобного мотива расщепления в сайте S1/S2. Однобуквенные обозначения аминокислот (1L code) см. URL: http://humbio.ru/humbio/moldiagn/00023f88.htm (дата обращения: 10.09.2020) [55]
Рисунок 6 - Схематическое изображение S-белка SARS-CoV-2 с указанием предполагаемых сайтов созревания. После связывания S-белка с рецептором он подвергается дальнейшим конформационным изменениям, позволяя протеазам клетки последовательно расщеплять его на двух сайтах: сначала на границе S1/S2 (т.е. на сайте S1/S2), затем внутри субъединицы S2 (т.е. на сайте S2'). Домены S-белка ранее были охарактеризованы в SARS-CoV и MERS-CoV: сигнальный пептид (signal peptide, SP), N-концевой домен (N-terminal domain, NTD), рецептор-связывающий домен (receptor-binding domain, RBD), белок слияния (fusion peptide, FP), внутренний пептид слияния (internal fusion peptide, IFP), гептадный повтор 1/2 (heptad repeat 1/2, HR1/2) и трансмембранный домен (transmembrane domain, TM). Сайты расщепления SP, S1[S2 и S2'указаны стрелками. Фуриноподобный сайт расщепления окружен черной рамкой (левая табличка). Красные звездочки указывают на присутствие канонического фуриноподобного мотива расщепления в сайте S1/S2. Однобуквенные обозначения аминокислот (1L code) см. URL: http://humbio.ru/humbio/moldiagn/00023f88.htm (дата обращения: 10.09.2020) [55]
Фурин относится к конвертазам пропротеина (proprotein convertases, PCs)[26], секреторным сериновым протеазам[27], родственным бактериальному субтилизину. Фурин специфически расщепляет гликопротеины S-белка SARS-CoV-2 по сайту из четырех аминокислот (PRRA) между S1 и S2, S2'.
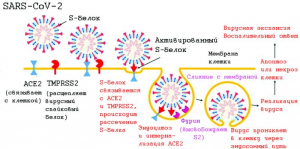
Рисунок 7 - Схематическое изображение взаимодействия SARS-CoV-2 с клеткой-мишенью. После связывания вируса с ACE2 протеазы TMPRSS2 и фурин расщепляют S-белок. Затем вирус проникает в клетку-хозяина по эндосомному пути [57]
Последовательность является консервативной у всех изолятов SARS-CoV-2, т.е. она не имеет вариантов, которые говорили бы о ее эволюции в ходе смены хозяев перед проникновением вируса в популяции людей или во время его пандемического распространения. Сайт для расщепления фурином отсутствует у S-белка RaTG13 и других близкородственных для SARS-CoV-2 коронавирусов. Но он есть у S-белка MERS-Cov (PRSV), однако фурин расщепляет его S-белок менее эффективно, чем у SARS-CoV-2. Как следствие, эпидемический потенциал этого вируса ограничен. Хотя фурин обычно связан с мембраной клетки, была описана его растворимая изо- форма[28], секретирующаяся в кровь и межклеточное пространство, способствуя активации S-белка SARS-CoV-2 в тканях, не экспрессирующих связанный фурин, но с мембраносвязанной формой ACE2, тем самым увеличивая заразность больного COVID-19 для окружающих [56].
Для эффективного проникновения вируса в клетку S-белку, кроме фурина, необходима активация трансмембранной сериновой протеазой TMPRSS2[29]. Активация S-белка с помощью TMPRSS2 возможна только в том случае, если он активирован фурином. В легочной ткани обнаружена коэкспрессия генов ACE2, TMPRSS2 и/или фурина, в любой комбинации. Выраженная одновременная экспрессия этих генов облегчает инвазию SARS-CoV-2 и приводит к тяжелой легочной патологии [56] (рисунки 7 и 8).
Экспрессия гена фурина и генов фурино- подобных протеаз обнаружена в других тканях организма (например, сердце, желудочно-кишечный тракт, дыхательные пути, семенники, почки, нейроны), что увеличивает тропизм клеток и тканей к SARS-CoV-2 по сравнению с SARS-CoV и объясняет не только контагиозность SARS-CoV-2, его летальность, разнообразие осложнений у выздоровевших пациентов[30] [60, 61], но и токсичность ингибиторов фуриновых протеаз (тенофовир, производные хлорметилкетонов, стрептамина и др.) [55].
Однако S-белок, высокоспецифичный к ACE2, и участок активации фурином - это еще не все, что облегчает SARS-CoV-2 инфицировать человека.
Внутриклеточная продукция SARS-CoV-2. Для коронавирусов, известных до 2019 г., механизмы внутриклеточного размножения изучены обстоятельно, см., например, обзорную работу M. Romano с соавт. [62]. Но исследования, объясняющие более высокую контагиозность больных COVID-19, чем больных с атипичной пневмонией, только начаты. Сравнивая эффективное количество кодонов (effective number of codons, ENc)[31], M. Kandeel с соавт. обнаружили более высокую экспрессию структурных генов, кодирующих белки S, E и M у SARS-CoV-2, чем у SARS-CoV и MERS-CoV [63]. S. Angeletti с соавт. [64] установлена роль двух неструктурных белков в повышении эффективности репликации вируса. Неструктурный белок 2 (Nsp2) SARS-CoV-2[32] отличается от такового у коронавируса летучих мышей SARS-Bat (QHR63299) на 11 остатков, тогда как Nsp3 - на 64 остатка, из которых 44 - консервативные[33]. Ими установлено, что внутри областей nsp2 и nsp3 имеется негомологичный ORF1ab-сегмент, идентифицированный ими как соответствующий такому же участку из вируса птичьего бронхита (avian infectious bronchitis virus, PDB 3ld1).

Рисунок 8 - Механизм инфицирования и поражения легочной ткани SARS-CoV-2.
(A. Схематическое изображение SARS-CoV-2, S-белка его оболочки и сайтов расщепления для фурина (зеленый, положение S1/S2; последовательность расщепления показана под структурой белка) и протеазы TMPRSS2 (оранжевый цвет, положение S2'). Б. Чтобы эффективно проникнуть в клетку, белок S должен быть активирован протеазой TMPRSS2. Активация с помощью TMPRSS2 возможна только в том случае, если белок S ранее был расщеплен фурином. Протеаза фурин разрезает S-белок по сайту S1/S2 в инфицированных клетках. Затем субъединица S2 обеспечивает прикрепление вируса к клетке-хозяину [59])
В положении 501 (положение 321 белка Nsp2), в соответствующем сайте SARS-подобного коронавируса летучих мышей, находится неполярная аминокислота треонин у SARSCoV - полярная аминокислота аланин; у SARS-CoV-2 - полярная аминокислота глутамин (Gly). Благодаря большей, чем у аланина,длине боковой цепи, полярности и способности образовывать водородные связи, аминокислота глутамин повышает стабильность белка и эффективность проникновения вируса в эндосомы клетки и, соответственно, ее инфицирование[34]. Что касается положения 723 (543 в белке Nsp3), то у SARS-CoV-2 имеется сери- новый остаток (Ser), а у коронавирусов SARS- like и SARS Bat - глициновый. Благодаря этому усилена локальная жесткость полипептидной цепи как для стерического эффекта, так и для способности образовывать водородные связи. Более того, Ser может действовать как нуклеофил в определенных структурных средах, таких как среды активных сайтов фермента. Аминокислота в положении 1010 (соответствующей положению 192 белка Nsp3) у SARS-CoV-2 представлена пролином; в гомологичной области Bat SARS-подобного ко- ронавируса находится гистидин; у SARS-СoV - изолейцин. Из-за стерической выпуклости (steric bulge) и жесткости (stiffness) пролина молекулярная структура Nsp3 SARS-CoV-2 может подвергаться большему локальному конформационному изменению по сравнению с аналогичными белками двух других вирусов. В Nsp3 мутация находится рядом с фосфата- заподобным белком (similar to a phosphatase), характерным для SARS^oV и играющим ключевую роль в процессе размножения (репликации) вируса. Таким образом, большая заразность SARS-CoV-2 для людей, чем отмечена у SARS-CoV, может быть объяснена и более стабильной структурой Nsp2, обеспечивающей эффективное проникновение вируса в эндосомы клетки; и более эффективной работой репликационно-транскрипционного комплекса и системы противодействия врожденному защитному ответу клетки, обеспечиваемым неструктурным белком Nsp3. Оба белка обеспечивают высокое воспроизводство вируса клеткой. Но высокое воспроизводство клетка обеспечивает и SARS-CoV, и MERS-CoV. Надо понять, почему инфекционный процесс, вызванный SARS-CoV-2 у отдельного человека, становится причиной эпидемической вспышки.
Продукция SARS-CoV-2 в легких человека. В отличие от тяжелого острого респираторного синдрома и ближневосточного респираторного синдрома, у которых пик вирусной нагрузки приходится на 7-10 сутки после появления первых симптомов болезни [68], пациенты с COVID-19 имели самую высокую вирусную нагрузку перед началом болезни, что объясняет быстро распространяющийся характер этой эпидемии [69]. H. Chu с соавт. [70], используя ex vivo эксплантаты ткани легких человека, экспериментально выяснили различия в инфекционных процессах в легких, вызванных SARS-CoV-2 и SARS-CoV. Они показали, что SARS-CoV-2 более способен инфицировать и реплицироваться в тканях легких человека, чем SARS-CoV. Оба вируса проникали в пневмоциты типа I и типа II, в альвеолярные макрофаги, но уровень экспрессии вирусного антигена N в тканях легких, зараженных SARS-CoV-2, был значительно выше и антиген накапливался интенсивнее, чем в тканях, инфицированных SARS-CoV. SARS-CoV-2 продуцировал в 3,2 раза больше инфекционных вирусных частиц, чем SARS-CoV в течение 48 ч (время наблюдения). В инкубационном периоде болезни размножение SARS-CoV-2 в легочной ткани человека не вызывает реакции врожденной системы иммунитета человека[35]. Уровни интерферонов (IFN) и большинства исследованных провоспалительных цитокинов/хемокинов, несмотря на то, что в легких накапливается большое количество вируса, остаются низкими, в отличие от пациентов с атипичной пневмонией, вызванной SARS-CoV. Низкая степень активации врожденного иммунитета объясняет легкие симптомы или даже отсутствие симптомов у многих пациентов с COVID-19[36], неосознанно распространяющих вирус в семьях, коллективах и больницах, что делает контроль над пандемией гораздо более сложным делом, чем над гриппом и даже SARS или MERS. Более того, большинство провосполительных цитокинов и хемокинов, за исключением IP10, хемоаттрактанта для моноцитов/ макрофагов, Т-клеток и естественных киллеров (NK), индуцировались SARS-CoV в большей степени, чем SARS-CoV-2. Это наблюдение объясняет более тяжелое течение болезни и более высокую летальность среди заболевших SARS, чем COVID-19.
K.P.Y. Hui с соавт. [71] получили сходные результаты. Они изолировали SARS-CoV-2 от пациента с подтвержденным COVID-19 и сравнили тропизм и его репликационную способность с SARS-CoV, MERS-CoV и пандемическим гриппом H1N1 2009 г. (H1N1pdm) в ex vivo полученных культурах бронхов, легких человека и эпителии конъюнктивы глаза. SARS-CoV-2 инфицировал пневмоциты 1 типа, реснитчатые, секретирующие слизь и булавовидные клетки бронхиального эпителия (клетки Клара). В бронхе репликационная способность SARS-CoV-2 была аналогична MERS-CoV и выше, чем SARS-CoV, но ниже, чем H1N1pdm. И это при том, что экспрессия ACE2 в бронхах человека относительно низкая по сравнению с таковой в паренхиме легких. В отличие от SARS-CoV, титры SARS-CoV-2 увеличились в сто раз при инкубировании до 96 ч как в бронхах человека, так и в тканях легких. В легких репликация SARS-CoV-2 была ниже, чем MERS-CoV. В эпителии конъюнктивы глаза репликация SARS-CoV-2 проходила более интенсивно, чем SARS-CoV. SARS-CoV-2 оказался менее мощным индуктором провоспали- тельных цитокинов, чем MERS-CoV и вирусы гриппа H5N1 и H1N1pdm.
Таким образом, результаты обеих групп исследователей, полученные в условиях ex vivo на культурах бронхов, легких человека и эпителии конъюнктивы глаза, подтверждают ранее сделанные наблюдения, что SARS-CoV-2 может передаваться от человека к человеку через капли, попадающие в дыхательные пути или глаза, а также через зараженные руки. Эффективную передачу SARS-CoV-2 между людьми объясняет его высокая репликационная способность в клетках легких (пневмоциты типа I и типа II, а также альвеолярные макрофаги) и бронхов (реснитчатые, секретирующие слизь клетки и булавовидные клетки бронхиального эпителия) человека, происходящая при слабой активации системы врожденного иммунитета.
Эти данные объясняют высокую вирусную нагрузку в респираторных секретах пациентов с COVID-19 в первые сутки после обращения к врачу или даже во время инкубационного периода болезни и, следовательно, высокую способность вируса передаваться от человека к человеку.
Пресимптоматическая передача. То, что больницы станут очагами распространения COVID-19, китайским эпидемиологам было ясно еще по опыту ликвидации вспышек SARS и MERS. Многие методы лечения тяжелобольных пациентов с поражением дыхательных путей считаются факторами высокого риска нозокомиальной передачи. Среди них интубация, ручная вентиляция с помощью реаниматолога, неинвазивная вентиляция, назальная канюля с высоким потоком, бронхоскопическое обследование, аспирация и транспортировка пациентов. Неожиданно выяснилось, что большая часть нозокомиальных передач произошла через контакты между клиницистами и посетителями без симптомов COVID-19 [72]. Передача SARS-CoV-2 здоровому человеку от бессимптомного пациента происходила за 1-3 суток до появления у него симптомов [73]. Врачи стали первой жертвой незнания реальной эпидемиологии COVID-19, отличающейся от таковой респираторных инфекционных болезней, изучаемых в медицинских ВУЗах[37].
Опыт противодействия респираторным инфекциям накапливался сотни лет в ходе борьбы с гриппом. Грипп до появления COVID-19 считался одним из самых заразных острых респираторных заболеваний (ОРЗ) человека. По оценке ВОЗ, сделанной в 2018 г., ежегодные эпидемии гриппа приводят к 3-5 млн случаев тяжелой болезни и к 290 тыс. - 650 тыс. случаев смерти[38]. Симптомы гриппа просты и понятны. У заболевшего внезапно появляются недомогание и высокая температура, за которыми следуют респираторные проявления (насморк и кашель), часто сопровождающиеся головной болью, миалгией и/или артралгией. Температура тела и симптомы со стороны верхних дыхательных путей, а также уровни назальных цитокинов при гриппе коррелируют с титрами вируса, а уровни IL-6 в плазме показали самую сильную корреляцию с общими симптомами.
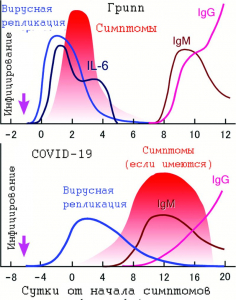 Рисунок 9 - Схематическое изображение кинетики инфекционных процессов, вызванных вирусом гриппа типа А (верхняя схема) и SARS-CoV-2 (нижняя схема) [75]
Рисунок 9 - Схематическое изображение кинетики инфекционных процессов, вызванных вирусом гриппа типа А (верхняя схема) и SARS-CoV-2 (нижняя схема) [75]
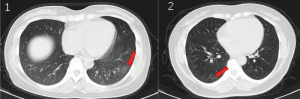
Рисунок 10 - Компьютерная томография грудной клетки двух бессимптомных пациентов.
1 - КТ 45-летней женщины, показывающая очаговые помутнения типа «матовое стекло» в нижней доле левого легкого (стрелка). 2 - КТ 50-летней женщины, показывающая помутнения типа «матовое стекло» и полосы, сосуществующие в нижней доле правого легкого (стрелки) [77]
Реакция гуморальной иммунной системы на гриппозную инфекцию вошла в учебники для врачей как единственно возможная - болезнь угасает с ростом титров антител, IgM сменяются на IgG, что обычно означает выздоровление. В отличие от гриппа, COVID-19 не проявляет себя острыми симптомами вскоре после заражения, инфекция прогрессирует медленнее, чем гриппозная, и на начальной стадии вызывает довольно легкие или даже незаметные местные и системные симптомы. Титры вирусов в мазках из зева - наивысшие в день появления симптомов и впоследствии быстро снижаются в течение 7 сут. Инфекционный процесс начинается за 2,3 сут до появления первых симптомов болезни, появление IgG говорит не о полном выздоровлении пациента, а о растянутости во времени инфекционного процесса (рисунок 9).
Разумеется, сведения о ключевой роли бессимптомных носителей SARS-CoV-2 в распространении COVID-19 были немедленно поставлены под сомнение учеными, «сидящими на литературе»[39]. Однако они продолжали накапливаться в практическом здравоохранении КНР, так что в феврале 2020 г. их уже невозможно было игнорировать [76]. В работе Long Q.-X. [77] обобщены результаты наблюдения над 37 пациентами, которым поставили диагноз COVID-19, подтвержденный ОТ-ПЦР[40], но без каких-либо соответствующих клинических симптомов в течение предшествующих 14 сут и во время госпитализации. Они хорошо согласуются с данными, полученными группами H. Chu с соавт. [70] и K.P.Y. Hui с соавт. [71] в условиях ex vivo.
Отсутствие симптомов не говорит об отсутствии у пациентов самой болезни, т.е. прогрессирующего повреждения органов или тканей, связанного с размножением патогена. При поступлении в стационар компьютерная томография (КТ) грудной клетки показала очаговые помутнения типа «матовое стекло» у 11 бессимптомных пациентов (11/37, 29,7%), полосатые тени (stripe shadow) и/или диффузную консолидацию у 10 человек (10/37, 27,0%). У пяти человек на КТ грудной клетки в течение пяти суток после поступления в больницу развились очаговые помутнения типа «матовое стекло» или полосатые тени. Рентгенологически патология, относящаяся к одному легкому, была выявлена у 66,7% (14/21) лиц без симптомов, тогда как у 33,3% (7/21) обнаружены аномалии в обоих легких (рисунок 10).
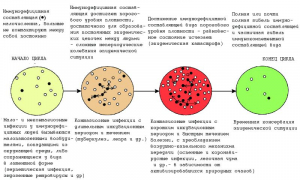
Рисунок 11 - Схема многовекового пандемического цикла циклических и нециклических инфекций. По мере совершенствования средств борьбы с эпидемиями и другими болезнями, сокращающими продолжительность жизни людей, такой цикл становится все более растянутым во времени, но последствия пандемий становятся все более губительными. • - иммунодефицитная составляющая вида (люди, инфицированные возбудителями нециклических инфекций, пожилые и престарелые, с избыточным весом, гипертонией, сахарным диабетом, врожденными нарушениями системы иммунитета, онкологией и др.) [81,82]
Средняя продолжительность обнаружения вируса в носоглотке в бессимптомной группе составила 19 сут (15-26 сут), что больше, чем у группы с легкими симптомами - 14 сут (9-22 сут). О том, что «бессимптомность» болезни является результатом слабой активации SARS-CoV-2 системы врожденного иммунитета, говорили низкие уровни 18 про- и противовоспалительных цитокинов. Антительная реакция на вирус формировалась медленно, уровни вирус-специфических IgG в этой группе были значительно ниже по сравнению с группой с симптомами в острой фазе [77].
Высокая вирусная нагрузка в верхних дыхательных путях пациента до развития явных клинических симптомов болезни, вызванная, с одной стороны, высокой способностью SARS-CoV-2 к размножению, с другой - замедленной реакцией врожденной иммунной системы человека на вирус, обеспечивает эффективную передачу вируса между людьми, о чем свидетельствует индекс репродукции вируса (R0)[41]. В разгар эпидемии в Китае (февраль) его оценивали как 3,28 [78], что было выше, чем R0 SARS (1,7-1,9), и значительно выше, чем у MERS (<1) [78][42]. Но уже в июне, на основании более полных данных, для этого периода эпидемии была вычислена R0 = 5,7 [79].
Бессимптомный период, длящийся несколько суток, является ключевым в эпидемическом распространении COVID-19 [80]. С получением новых знаний эпидемиология стала дополняться новыми понятиями. W.E. Wei с соавт. [73] ввели в научный оборот понятие «пресимптоматическая передача» (англ. presymptomatic transmission) - передача возбудителя инфекционной болезни (в их работе SARS-CoV-2) от инфицированного человека (исходного пациента) вторичному пациенту до того, как у исходного пациента развились симптомы, что подтверждается датами заражения и появлением симптомов, без каких-либо доказательств того, что вторичный пациент был в контакте с кем-либо еще из больных (в их случае - COVID-19).
Глобальный пандемический цикл.
Пандемия COVID-19 может и не быть самостоятельным событием, вызванным появлением «нового вируса» (вроде очередной пандемии гриппа), а проявлением более сложного явления - сменой фаз глобального пандемического цикла (рисунок 11).
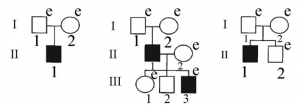
Рисунок 12 - Процесс популяционного накопления людей с недостаточностью иммунной системы. Исследовались родословные трех японских семей. Поколения обозначены римскими цифрами, индивидуумы - арабскими цифрами. Пациенты с доминирующей частичной недостаточностью IFN-гаммаR1, страдающие тяжелым BCG-остеомиелитом или подверженностью к микобактериальным инфекциям, показаны черными квадратами. e (examined) - проведено генетическое исследование на наличие мутации в гене IFN-гаммаR1. Только у одного родственника обнаружено аутосомно-доминантное наследование мутации, у остальных они возникали спонтанно. Накопление мутаций в гене IFN-гаммаR1 далеко не случайно. Ген располагается в участке хромосомы, участвующем в ее репликации, где высока вероятность возникновения спонтанных мутаций вследствие ошибок в спаривании нуклеотидов [83]
Предпосылки к такому развитию событий складывались на протяжении всего ХХ в. с появлением эффективных методов борьбы с циклически протекающими инфекциями. К ним можно отнести следующие:
- достижения современной цивилизации в борьбе с циклическими контагиозными инфекциями (чума, натуральная оспа, корь и др.), приведшие к их вытеснению из человеческого общества, привели к расширению его иммуно- дефицитной составляющей (распространение возбудителей нециклических инфекций - ВИЧ, Т-клеточного лейкоза, сывороточных гепатитов, герпетических инфекций и др.);
- из-за отсутствия селективного давления со стороны циклически протекающих контагиозных инфекций на генофонд вида запущена полиморфизация генов, отвечающих за эффективную работу иммунной системы (на рисунке 12 на примере накопления людей с недостаточностью системы интерферона, вызванной мутациями гена IFN-гаммаR1[43], показан процесс популяционной полиморфизации генов таких генов);
- население большинства развитых стран состарилось, в результате сформировались обширные популяции людей с хроническими болезнями, снижающими популяционную устойчивость к инфекционным болезням (онкология, атеросклероз, сахарный диабет, гипертония, массовое ожирение, деменция и др.);
- были исчерпаны возможности по созданию новых эффективных антибактериальных, противовирусных лекарственных средств и иммунобиологических препаратов (вакцин, специфических иммуноглобулинов, мАТ).
- «затачивание» медицины на извлечение прибыли из оказания медицинской помощи привело к исключению из противоэпидемической практики знаний, мешающих фарм-бизнесу (возврат к контагионистическим представлениям Фракосторо, подмена функциональной классификации антител физико-химической, замалчивание таких иммунологических феноменов как антитело-зависимое усиление инфекции, антигенный импринтинг, суперантигенный эффект и др.) и сужению доступного населению государственного сектора медицинских услуг (оптимизация здравоохранения, страховая медицина и пр.);
- глобальный рост бедности, нищеты, расовой и этнической дискриминации, глобализация, исключающие раннее прерывание эпидемических цепочек опасных инфекций (фавелы и трущобы больших городов, лагеря беженцев, неконтролируемая миграция населения из эпидемически неблагополучных регионов и др.).
В таких условиях пандемия, подобная нынешней COVID-19, не только не могла не появиться при активизации каких-то природных очагов инфекций, но она оказалась даже «востребована» отдельными популяциями людей. То, что ее вызывал SARS-CoV-2 - закономерная случайность. Так распространиться могла и другая циклически протекающая высококонтагиозная инфекция, вошедшая в иммунодефицитные и иммуноослабленные популяции, как «ключ в замок». Эта пандемия (либо та, которая придет ей на смену), будет носить упорный характер, десятилетиями разгораться и затухать, пока не прогорят все «сухие дрова», обеспечивающие цепочки передачи или не будут найдены эффективные подходы к их разрыванию.
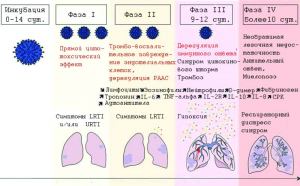
Рисунок 13 - Фазы течения COVID-19. Инкубационный период варьируется от 0 до 14 сут., затем 3-5 сут. - первые клинические симптомы, инфекция верхних дыхательных путей (upper respiratory tract infection, URTI) (ринит, потеря ощущения запаха и вкуса) и/или инфекция нижних дыхательных путей (lower respiratory tract infection, LRTI) (кашель, лихорадка, боли в грудной клетке, «счастливая гипоксия», т.е. при кислородном голодании больной чувствует себя нормально). Вторая фаза характеризуется стойкими LRTI и требует консультации с врачом и/или госпитализации. Во второй фазе болезни могут наблюдаться аномальные параметры крови, влияющие на тяжесть болезни. Затем с 9 по 12 сут. после появления симптомов (фаза III) - внезапное ухудшение, вызванное синдромом цитокинового шторма и легочной (макро- и микро) эмболией, острый респираторный дистресс-синдром (фаза IV) и смерть [87]
3. Причины тяжелого течения COVID-19
Анализ более чем 15 тыс. полногеномных сборок (англ. whole genome assemblies) SARS-CoV-2, взятых из 75 различных стран и основных континентальных регионов во время первой волны пандемии, обнаружил только линию вируса, не обладающего способностью к адаптивной эволюции к новому хозяину - человеку. У SARS-CoV-2 найдено 7 тыс. мутаций, но все они являются либо нейтральными, либо даже умеренно вредными (англ. weakly deleterious) для него. Ни одна из 273 повторяющихся мутаций, идентифицированных у циркулирующих на май 2020 г. вариантов SARS-CoV-2 (т.е. не менее 6 мес., если придерживаться первоначальной точки зрения на его появление в ноябре-декабре 2019 г. в Китае), не связана с его повышенной передачей среди людей. Такая модель геномного разнообразия говорит о том, что SARS-CoV-2 во время первой волны представлял собой единственную, по сути, клональную линию [86], однако клиническое течение болезни у людей различалось - от бессимптомного течения до летального исхода [87]. Наблюдались четкие возрастные, гендерные [88] и даже расовые различия в тяжести течения болезни [89-91]. К тому же COVID-19 проявил себя клиникой, о которой ранее не сообщалось при SARS и MERS. Это инсульт и кардиомиопатии, связанные с коагулопатией и васкулопатией, вызывающие внезапную смерть по разным патогенетическим механизмам [92], нарушения сердечного ритма, приводящие к внезапной остановке сердца[44] [93].
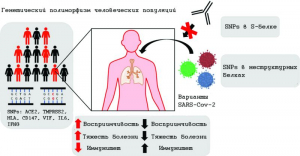
Рисунок 14 - Влияние генетического полиморфизма хозяина и вирусной изменчивости на инфицирование SARS-CoV-2 и тяжесть COVID-19. Люди в любой популяции имеют однонуклеотидные полиморфизмы (SNP, снипы) по множеству генов (например, ACE2, TMPRSS2, HLA, CD147, MIF, IFNG, IL6), участвующих в иммунопатологии SARS-CoV-2. Эти и другие генетические варианты могут модулировать восприимчивость к вирусу, увеличивать или уменьшать тяжесть болезни, изменять ряд симптомов и влиять на выраженность и/или качество иммунных ответов против SARS-CoV-2. Помимо генетической изменчивости хозяина, свою роль в тяжести эпидемического процесса могут сыграть генетические варианты SARS-CoV-2 (и других патогенных коронавирусов). Мутации одной аминокислоты в белке S могут модулировать связывание SARS- CoV-2 с ACE2 или способствовать его уклонению от иммунной системы, делая моноклональные антитела неэффективными, в то время как мутации в неструктурных/дополнительных белках могут способствовать развитию устойчивости к противовирусным препаратам [94]
Ход болезни можно разделить на четыре фазы - от инкубационного периода до критического состояния пациента, в котором прямые цитотоксические эффекты SARS CoV-2, коагулопатия и обострение иммунных реакций играют решающую роль, а генетические варианты вируса и хозяина определяют тяжесть течения болезни и ее исход (рисунки 13 и 14).
Ниже рассмотрим основные патогенетические механизмы развития COVID-19. Причины, по которым прогрессирование часто легкой или бессимптомной инфекции тяжелого острого респираторного синдрома, вызванного SARS-CoV-2, переходит в опасную для жизни человека пневмонию, проще понять, если сопоставить иммунопатологию COVID-19 и гриппа (таблица 1)[45].
«Разбалансировка» ренин-ангиотензин-альдостероновой системы.
Ренин-ангиотензин-альдостероновая система (rennin-angiotensin-aldosterone system, RAAS, РААС) - гормональная система человека и млекопитающих, посредством вазоактивных пептидов регулирующая кровяное давление, объем жидкости, баланс натрия и калия, свертываемость крови, играющая важную роль как в стимулировании и поддержании воспаления, так его подавления [95]. В настоящее время считается, что именно ее «разбалансировка», запускаемая инактивацией вирусом ACE2, лежит в основе патогенеза COVID-19 [88, 96, 97].
В самых общих чертах функционирование РААС выглядит следующим образом. От постоянно синтезируемого печенью ангио-тензиногена[46] под действием ренина плазмы[47] отщепляется не обладающий биологической активностью декапептид ангиотензин I (Ang I), под действием экзопептидазы - АПФ на поверхности эндотелиальных клеток сосудов легких он превращается в октапептид ангиотензин II (Ang II). Ангиотензин II действует на ангиотензиновый рецептор AT1 (angiotensin II receptor type 1, AT1R)[48] в почках и сосудистой сети - начинается активация РААС, что приводит к сужению сосудов и стимуляции секреции гормона альдостерона, который, в свою очередь, увеличивает реабсорбцию натрия, тем самым повышая кровяное давление.
Таблица 1 – Сравнительная иммунопатология гриппа и COVID-19*
<
|
Признак |
Грипп |
COVID-19 |
|
Геном вируса |
Отрицательно-смысловая РНК - реплицируется и транскрибируется в ядре инфицированных клеток, куда проникает по эндосомному пути и обнаруживается цитозольными сенсорами, что приводит к быстрым системным ответам на вирус со стороны системы врожденного иммунитета |
Положительно-смысловая РНК - реплицируются и транскрибируется в цитоплазме клетки- хозяина через образование органелл репликации, скрывает свой вирусный репликационный аппарат от многих врожденных цитозольных сенсоров и подавляет факторы защиты клетки |
|
Локализация инфекции |
Верхние дыхательные пути |
Нижние дыхательные пути с переходом в сепсис |
|
Основные клетки-мишени |
В основном - эпителий слизистой оболочки носа, реснитчатые эпителиальные клетки трахеи и бронхов и в меньшей степени - бронхиолярный эпителий. Патологические изменения бронхиального эпителия непродолжительны, процесс его восстановления начинается через двое суток после появления симптомов гриппа |
Вирус напрямую инфицирует альвеолярные эпителиальные клетки и макрофаги, формирует очаги поражения в легких, воспалительные поражения эндотелия сосудов |
|
Развитие симптоматики |
Вирус распознается клеткой практически сразу после ее инфицирования. Серьезные системные симптомы появляются вскоре после заражения и совпадают по времени с местными и системными ответами цитокинов. Также они соответствуют изменениям титров вирусов в верхних дыхательных путях |
Из-за того, что вирус клеткой распознается медленно, на начальной стадии инфекции воспалительный цитокиновый ответ может отсутствовать или быть не выраженным. Появляются (или могут вообще отсутствовать!) легкие местные и системные симптомы, не соответствующие титрам вируса в верхних дыхательных путях |
|
Рецептор |
Вирус связывается с а2-6 сиалированными гликанами, которые в основном экспрессируются на эпителиальных клетках верхних дыхательных путей человека. Инфекция в большинстве случаев носит локальный характер |
Вирус связывается с рецептором ACE2, экспрессирующимся в пневмоцитах I и II типов, в щеточных краях эпителиальных клеток тонкого кишечника, в эндотелиальных и гладкомышечных клетках артериол и крупных артерий, что придает инфекции характер сепсиса |
|
Т-система иммунитета |
Ранние Т-клеточные ответы связаны с окончательным очищением от вируса и способствуют предотвращению распространения инфекции в нижние дыхательные пути |
Т-клетки могут участвовать в индукции повреждения эндотелиальных клеток, что является уникальной характеристикой патологии COVID-19 |
|
В-система иммунитета |
Защита легких от инфекции, по крайней мере, частично обеспечивается IgG-антителами, специфичными для поверхностных гликопротеинов вируса |
Антитела в основном образуются в отношении S-белка вируса. Их функция точно не установлена. Есть информация об обнаружении IgG-антител, усиливающих инфекционный процесс и аутоантител |
|
* Составлена с использованием работы Masaaki Miyazawa [75] |
||
Поскольку ангиотензин II действует еще и как воспалительный цитокин, а также опосредует пролиферацию клеток, стимулируя различные цитокины (повышенная продукция ангиотензина II и активация AT1R сопровождаются провоспалительным ответом за счет активации каскада комплемента, включая C5a, C5b-9), его повышенный синтез увеличивает повреждение легких и сердца через развитие воспалительных и, соответственно, профибротических процессов[49]. Но в норме срабатывает «предохранитель», регулирующий синтез ангиотензина II, его количество в крови и, соответственно, артериальное давление - карбоксипептидаза ACE2. Ангиотензины I и II расщепляются ACE2 на два пептида: нонапептид с неизвестной функцией - ангиотензин (1-9) - от Ang I; и гептапептид - ангиотензин (1-7) (Ang-(1-7))[50] от обоих. Гептапептид Ang-(1-7) действует на рецептор Mas (MasR)[51], вызывая расширение сосудов, тем самым противодействуя эффектам ангиотензина II.
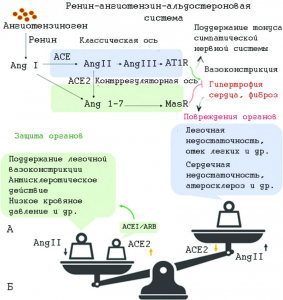
Рисунок 15 - «Чаши весов» РААС.
А. Путь ACE-AngII-AT1R называется классической осью РААС, которая играет решающую роль в регуляции, в то время как путь, основанный на ACE2-Ang 1-7-MasR, называется контррегуляторной осью РААС, играющей отрицательную роль в регулировании. Основная роль положительной оси РААС заключается в повышении напряжения симпатической нервной системы, сужении сосудов, повышении артериального давления, развитии воспаления, фиброза и гипертрофии миокарда. Отрицательная регуляторная ось, опосредованная ACE2, противодействует этим эффектам. В системе РААС один и тот же компонент может вызывать противоположные физиологические эффекты разными путями.
Б. Инфекция SARS-CoV-2 снижает активность ACE2, усугубляя состояние больного через дисбаланс регуляции Ang II/ACE2 [101]
Гептапептид также обладает антипро- лиферативной, антитромботической и противовоспалительной активностью. SARS-CoV-2, связываясь с ACE2, выключает этот «предохранитель» и тонко сбалансированная РААС переходит в неравновесное состояние, проявляющееся развитием цитокинового шторма [88] (рисунки 15 и 16).
Цитокиновый шторм. Опосредованное вирусом высвобождение воспалительных цитокинов приводит к цитокиновому шторму по четырем осям - за счет нарушения РААС (ось ACE/ангиотензин II/AT1R), ослабления рецептора Mas (ось ACE2/MasR), повышенной активации [дез-Arg9]-брадикинина (ось ACE2/брадикинин B1R/DABK) и активации системы комплемента, включая компоненты C5a и C5b-9. Подобно другим сложным сетям, элементы сложной сети цитокинового шторма COVID-19 могут испытывать много перекрестных взаимодействий с элементами из известных и неизвестных путей и сетей, что затрудняет лечение пациента в этом состоянии. Более подробно см. в работе [97].
Генетические факторы пациента, предрасполагающие к заражению SARS-CoV-2 и тяжелому течению COVID-19. В настоящее время такие исследования только начались, но они уже приобрели международный размах, способный очень быстро выявить ключевые генетические уязвимости человечества, причем не только к SARS-CoV-2[52]. С. Anastassopoulou с соавт. [102] считают, что степени тяжести COVID-19 зависят в основном от генов, определяющих факторы иммунного ответа хозяина на вирус, в то время как разная восприимчивость людей к SARS-CoV-2, в основном, связана с вариантами генов, кодирующих поверхностныерецепторы и имеющих отношение к начальной стадии инфекции.
Для SARS-CoV-2 рецептор ACE2 - первая мишень. На индивидуальном уровне полиморфизм гена ACE2 (вне инфекционного процесса, вызванного SARS-CoV-2) проявляется патологическими вариациями артериального давления [104], нарушением сердечной деятельности [105], дислипидемией[53] и/или сердечной недостаточностью [106]. Комбинации отдельных полиморфизмов ACE2 имеют отношение к высокой частоте гипертонической болезни среди бразильцев и афроамериканцев [107, 108].
Соответственно, количество рецепторов ACE2 в различных органах, полиморфизмы гена ACE2, различия в экспрессии мРНК ACE2, влияют на восприимчивость к SARS-CoV-2, преобладающие клинические проявления болезни и ее исход. Всесторонний анализ нескольких больших наборов геномных данных, включающих более 290 тыс. образцов, представляющих >400 популяционных групп, проведенный E.W. Stawiski с соавт. [109], обнаружил природные варианты ACE2, которые, как предполагается, изменяют взаимодействие вируса с хозяином и тем самым потенциально изменяют восприимчивость хозяина. В частности, предполагается, что варианты ACE2 человека S19P, I21V, E23K, K26R, T27A, N64K, T92I, Q102P и H378R увеличивают восприимчивость к вирусу через более высокую тропность к участку RBD S-белка (шипа) SARS-CoV-2. Варианты ACE2 K31R, N33I, H34R, E35K, E37K, D38V, Y50F, N51S, M62V, K68E, F72V, Y83H, G326E, G352V, D355N, Q388L и D509Y, наоборот, снижают ее (рисунок 17).
Два примера того, как влияют мутации ACE2 на развитие инфекции. Мутант T27A - замена в положении 27 нейтральной гидрофильной аминокислоты треонин на неполярную аланин, увеличивает локальную динамику спирали а1 ACE2 и способствует увеличению сродства связывания с вирусом за счет более тесного гидрофобного взаимодействия с RBD SARS-CoV-2 и, следовательно, инфицированию клетки. Наоборот, мутации H34R и D38V (замена гистидина на аргинин и аспарагиновой кислоты на валин, соответственно), приводят к потере интерфейсных полярных контактов, которые, как предполагается, уменьшают сродство ACE2 к домену RBD вируса и обеспечивают селективную защиту от SARS-CoV-2. Более подробно см. в работе E.W. Stawiski с соавт. [109].
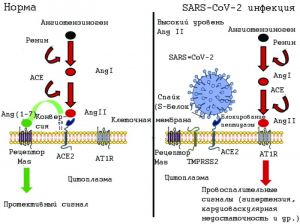
Рисунок 16 - Упрощенная схема ренин-ангио-тензиновой-альдостероновой системы в норме и в патологии, вызванной SARS-CoV-2. На левой панели показано преобразование пептидазой ACE2 Ang II в Ang (1-7). Он действует на рецептор Mas, вызывая расширение сосудов, тем самым противодействуя эффектам ангиотензина II, что приводит к защитному сигналу. Правая панель иллюстрирует возможную дисфункцию сигналов, когда SARS-CoV-2 присоединяется к его рецептору ACE2. В этом состоянии пептидазная активность ACE2 утрачивается и Ang (1-7) не синтезируется, Ang II накапливается и связывает AT1R, что приводит к провоспалительным сигналам, запускающим цитокиновый шторм и повреждение как тканей (в частности, легких и сердца), так и гипертонию [88]
Более выраженной экспрессией ACE2 в легких мужчин объясняются клинические наблюдения, показывающие, что на мужчин приходится от 66% до 75% наиболее тяжелых случаев COVID-19. Это согласуется с данными о том, что преобразование Ang II в Ang (1-7) под действием ACE2 выше у мужчин, чем женщин. Сверхэспрессия ACE2 в легких у мужчин объясняется тем, что у них ген ACE2 расположен на одной X-хромосоме, у женщин - на двух.
В уровне экспрессии гена ACE2 существуют этнические и даже расовые различия, влияющие на исход болезни. В самом начале эпидемии в Китае Y. Zhao с соавт. [110], пытаясь понять, что лежит в основе тяжелого течения COVID-19 у местных жителей, проанализировали экспрессию ACE2 в 43 тыс. клеток 8 доноров разных рас и национальностей [54].
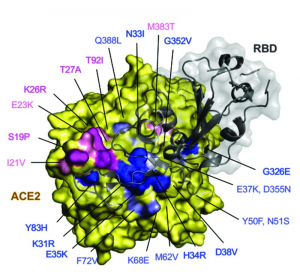
Рисунок 17 - Идентифицированные полиморфизмы человеческого ACE2, сопоставленные со структурой человеческого ACE2 в комплексе с участком RBDS-белка (шипа) SARS-CoV-2. Остатки в ACE2 окрашены в соответствии с их влиянием на предсказанное сродство между человеческим ACE2 и вирусным S-белком. Полиморфизмы, которые усиливают связывание между ACE2 и S-белком, окрашены в пурпурный цвет, если они расположены непосредственно на участке взаимодействия ACE2/SARS-CoV-2; участки светло-розового цвета не участвуют непосредственно в таком взаимодействии, но обеспечивают этот эффект путем конформационного влияния. Полиморфизмы, ослабляющие связывание между ACE2 и S-белком, окрашены в темно-синий цвет, если они расположены непосредственно на интерфейсе ACE2/SARS-CoV-2, или в голубой, если они не участвуют непосредственно в интерфейсных взаимодействиях. Буквы обозначают замены аминокислот, например, Y83H обозначает замену в положении 83 урацила (Y) на гистидин (H) [109]
Исследовались пневмоциты I (AT1) и II типов (AT2), эпителиальные клетки дыхательных путей, фибробласты, эндотелиальные клетки и макрофаги. Было установлено, что у всех доноров рецептор ACE2 экспрессируется в 0,64 % клеток легкого человека. Большинство клеток, экспрессирующих ACE2 (в среднем 83 %), являются клетками AT2. Экспрессия ACE2 сконцентрирована в особой популяции AT2, экспрессирующей многие другие гены, благоприятствующие процессу распространения вируса (приведены в рассматриваемой статье), т.е. вирус управляет этими клетками для своего размножения. AT1, эпителиальные клетки дыхательных путей, фибробласты, эндотелиальные клетки и макрофаги экспрессируют ACE2, но в значительно меньшем количестве. Обильная экспрессия ACE2 в популяции AT2 объясняет тяжелое альвеолярное повреждение при инфицировании легких SARS-CoV-2. Ими также было установлено, что ACE2 более широко распространен у мужчин-доноров, чем у женщин: по крайней мере 5 различных типов клеток в мужском легком экспрессируют этот рецептор, в то время как в женском легком только 2-4 типа клеток экспрессируют этот рецептор. Донор-азиат (мужчина) имеет гораздо более высокое соотношение клеток, экспрессирующих АСЕ2, чем доноры белых и афроамериканцев (2,50 % против 0,47 % всех клеток, т.е. в 5,3 раза). В таблице 2 представлены сведения по отдельным связям между генетическими особенностями человека и тяжестью клинического течения COVID-19 или восприимчивостью к инфекции[55].
Сепсис. COVID-19 имеет типичный «септический портрет». Болезнь сопровождается нарушениями гемостаза по типу ДВС-синдрома (диссеминированное внутрисосудистое свертывание крови), «цитокиновым штормом», оксидативным стрессом, тромбофилией, тромбоцитопенией, респираторным дистресс-синдромом, нарастающим каскадом полиорганной недостаточности, септическим шоком, требующим интенсивной терапии в условиях реанимационного отделения [111].
COVID-19, начавшись с нижних отделов легких, благодаря гематогенному разносу вируса и инфицированию клеток с ACE2, переходит в системное поражение органов и тканей. Биохимические показатели говорят о развившемся воспалительном синдроме (повышенные уровни интерлейкина-6 в сыворотке крови, аларминов[56] и воспалительных хемокинов), глубокой лимфопении, системной иммунопатологии (наличие антикардиолипи- нового IgA, анти-β2-гликопротеиновых IgA и антител IgG и холодового агглютинина) (рисунок 18).
Таблица 2 - Связь между генетическими особенностями человека и тяжестью клинического течения COVID-19 или восприимчивостью к инфекции*
|
Ген(ы) |
Полиморфизм(ы) |
Хромосомная локализация |
Описанная ассоциация с COVID-19 |
|
ACE2 |
p.Arg514-Gly |
Xp22.2 |
Тяжелые поражения сердечно-сосудистой системы и легких у африканцев/ афроамериканцев |
|
ApoE (ген аполипопротеина E) |
rs429358-C-C (e4e4) |
19q13.32 |
Гомозиготный генотип ApoE e4e4 увеличивает риск тяжелой формы COVID-19 независимо от предшествующей деменции, сердечнососудистых заболеваний и диабета 2 типа |
|
HLA (человеческий лейкоцитарный антиген) |
B*46:01, DRB1*15:01, DQB1*06:02, B*27:07, HLA-A*11:01, B*51:01C*14:02 |
6p21.33 |
Повышенная уязвимость к инфицированию SARS-CoV-2, тяжелое течение болезни |
|
IFITM3 (индуцированный интерфероном трансмембранный белок 3) |
rs12252-C/C |
11p15.5 |
Заболевание легкой и средней степени тяжести, требующее госпитализации. Распространенность этого SNP составляет 26,5 % в популяции Китая |
|
SLC6A20, LZTFL1, CCR9, FYCO1, CXCR6, XCR1 |
rs11385942-GA |
3p21.31 |
Тяжелое течение болезни (дыхательная недостаточность) |
|
TLR7 (Toll-Like Receptor 7) |
g.12905756_12905759del и g.12906010G>T (инактивация рецептора) |
Xp22.2 |
Нарушение ответов IFN I и II типов на вирус, тяжелое течение болезни, более тяжелое течение болезни у мужчин |
|
TMEM189-UBE2V1 (убиквитин- конъюгированный фермент E2 вариант 1; функция не определена) |
rs6020298-A |
20q13.13 |
Нарушаются сигнальные пути IL-1. Тяжелое течение болезни |
|
TMPRSS2 (трансмембранная протеаза, серин 2) |
p.Val160Met (rs12329760) |
21q22.3 |
Повышенная восприимчивость к SARS-CoV-2 |
|
* Составлена по обобщающей работе от С. Anastassopoulou с соавт. [103]. |
|||
Но наличие рецепторов ACE2 на эндотелии капилляров большого и малого кругов кровообращения приводит к развитию септического процесса со свойственным ему клиническим полиморфизмом[57]. Г.М. Бушманова с соавт. [113] считают, что в настоящее время имеют место как минимум два процесса - высоко специфический инфекционный процесс, вызванный SARS-CoV-2, и предшествующий ему по времени выявления, первично-хронический эндогенный сепсис со свойственной ему в наивысшей степени неспецифичностью воспаления. Клинически в обоих случаях речь идет о васкулите. КТ-проявления описанного в литературе легочного васкулита[58] и COVID-19 идентичны. Легочные инфильтраты в виде «матового стекла» - наиболее характерный симптом для обеих болезней. Непредсказуемость течения пандемии COVID-19 и пока не прогнозируемые варианты его исхода объяснимы фоном неспецифического сепсиса, проявляющего себя в широком диапазоне симптомов - от полного «клинического молчания» до угрожающего ургентного септического шока. SARS-CoV-2 может являться триггерным механизмом, запускающим на фоне васкулита, вызванного эндогенным сепсисом[59], процесс фибропластического преобразования не только легочных сосудов (малый круг кровообращения) но и в целом - всего сосудистого русла (большой круг кровообращения).
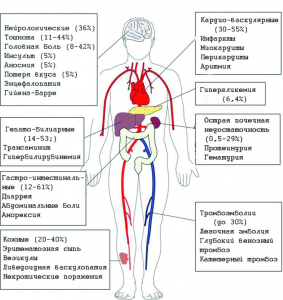
Рисунок 18 - Внелегочные проявления COVID-19, характерные для септического течения болезни. Выявлены у тяжелых и критических больных (% у госпитализированных пациентов). Наблюдаются у 25-30% госпитализированных пациентов.
В патофизиологию полиорганного повреждения вовлечены четыре механизма: 1) прямая вирусная токсичность; 2) нарушение регуляции РААС;
3) повреждение эндотелиальных клеток и тромбо-воспаление;
4) 4) нарушение регуляции иммунной системы и синдром высвобождения цитокинов, вызывающий диссеминированные поражения органов. Гистопатологический анализ выявил вирус в легких, почках, миокарде, головном мозге и тканях желудочно-кишечного тракта [87]
Ускорение темпа фиброзирования на различных уровнях сосудистой системы может быть реализовано в формирование клапанных стенозов сердца, а также стенозов коронарных, брахиоцефальных, ренальных, феморальных и др. патологий внутренних органов.
Приобретенная гуморальная иммунопатология. Выше мы рассмотрели ответы врожденной системы иммунитета на SARS-CoV-2, проявляющиеся выбросом фагоцитирующими клетками провоспалительных цитокинов и хемокинов, и развитием цитокинового шторма[60]. Не менее важно обратить внимание на «вклад» в тяжелое течение COVID-19 гуморальной иммунопатологии, развивающейся в ходе самого инфекционного процесса.
Антителозависимое усиление инфекции. О том, что иммунология COVID-19 не проста и одним повторением фразы «мы получили антитела» проблема пандемии не решается[61], а идея «иммунного паспорта» превращается в фикцию[62], говорит установленная в начале пандемии зависимость тяжести течения COVID-19 от повышенных ответов IgG. Тяжелые случаи чаще встречались у пациентов с высоким уровнем IgG по сравнению с пациентами с низким уровнем IgG (51,8 против 32,3%; p = 0,008). Этот противоречащий учебникам по иммунологии феномен был объяснен как проявление известного с начала 1960 гг. феномена антителозависимого усиления инфекции (англ. antibody-dependent enhancement, ADE)[63] [118] и даже предложен в качестве дополнительного признака для различения тяжелых и нетяжелых пациентов с COVID-19 и прогнозирования исхода болезни [126].
Подходы к созданию вакцин в отношении таксономически и структурно сходных SARS-CoV и MERS-CoV в значительной степени похожи. И нет оснований считать, что при создании SARS-CoV-2-вакцины они будут чем-то отличаться[64].
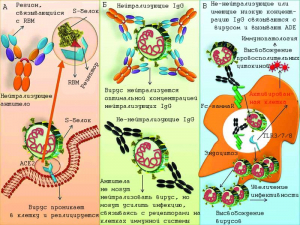
Рисунок 19 - Роль нейтрализующих и ненейтрализующих антител в вирусной инфекции и механизм развития ADE при SARS-CoV-2. А. Рецептор-вирусное распознание. S-белок SARS-CoV-2 связывается с рецептором ACE2, начинается инфекционный процесс. Если рецептор-связывающий мотив на S1-субъединице S-белка (RBM) распознается и связывается антителами, то проникновения вируса в клетку не происходит. Б. Нейтрализующие антитела в оптимальной концентрации нейтрализуют вирус, в то время как ненейтрализующие антитела могут усиливать инфекцию. В. Механизм ADE при SARS- CoV-2. Комплекс вирус-антитело (нейтрализующий или ненейтрализующий) связывается с рецептором Fcy на поверхности иммунных клеток, таких как моноциты или макрофаги, что приводит к проникновению вируса в клетки иммунной системы без использования рецептора ACE2 и его последующей репликации. Связывание вирус-антитело с FcyR также может вызывать провоспалительный ответ. Вирусная РНК в эндосомах передает сигнал через Toll-подобный рецептор 3 (TLR3), TLR7 или TLR8, активируя клетку-хозяин для высвобождения провоспалительных цитокинов, что приводит к иммунопатологии [117]
Обещания создать безопасную и эффективную вакцину против COVID-19 на основе S-белка SARS-CoV-2, которая будет являться таковой только потому, что вызывает выработку специфических к вирусу антител, требуют пояснения со стороны их разработчиков, о каких конкретно антителах идет речь. Полноразмерный S-белок коронавирусов содержит много иммунодоминантных сайтов, способных индуцировать как нейтрализующие, так ненейтрализующие антитела, в том числе связанные ADE (рисунок 19).
Например, антитела к доминирующему эпитопу S597-603, расположенному близко к карбоксиконцу RBD S1-субъединицы S-белка SARS-CoV, заметно усиливали инфицирование SARS-CoV клеток Vero E6 и инфекционный процесс у макак-резусов, используя механизм ADE (рисунок 20).
Рисунок 20 - Патоморфологическое (вверху) и патогистологическое (внизу) проявление ADE в легких обезьян, двукратно вакцинированных инактивированной вакциной SARS-CoV (окрашивание H&E, 200х) после ингаляционного заражения. Животных умерщвляли через 6 сут после заражения вирусом. А. Инфицированная невакцинированная макака: легочный интерстиций расширен, видна инфильтрация макрофагов с гиперплазией альвеолярного эпителия. Б. Вакцинированная макака: легочный интерстиций расширен, деформирован и инфильтрирован большим количеством макрофагов и лимфоцитов, виден фибрин и богатый белками отек в альвеолярной полости. B. Макака, получившая защитные мАТ. Легочный интерстиций слегка расширен, без видимых отклонений. Стрелки указывают поражения легких [123]
Но индуцированные расположенным рядом эпитопом S604-625 антитела способны нейтрализовать вирус, однако он распознается в тандеме с S597-603. Таким образом, у людей, инфицированных коронавирусами, формируется пул антител, как усиливающих инфекцию, так и нейтрализующих ее, и эти антитела могут противодействовать функциям друг друга и вызывать трудно прогнозируемые осложнения, зависящие от других факторов [123].
Участок RBD в субъединице S1 содержит основные эпитопы S-белка, способные индуцировать нейтрализующие антитела. Исследование A.Z. Wec с соавт. сывороток, полученных от пациентов с SARS, выявило восемь антител, нацеленных на RBD, которые нейтрализовали SaRS-CoV-2 и SARS-CoV в условиях in vitro [124]. Но антитела к RBD всегда вырабатываются в низком титре по сравнению с титрами тех, что индуцируются субъединицей S1 или полноразмерным S-белком [125].
Титр нейтрализующих антител, индуцированный вакциной, являющийся одним из важных показателей для оценки ее эффективности и безопасности, для COVID-19-вакцин не установлен. И даже если он будет установлен, это ничего не даст для борьбы с COVID-19, так как он постоянно меняется в зависимости от времени, прошедшего после вакцинации (в идеальном случае). Титр будет постепенно убывать до неопределяемых количеств антител после подъема бустером, но иммунная память не исчезнет. При столкновении иммунной системы вакцинированного с вирусом, В-клетки памяти, сохраняющие информацию об антигене, переходят в плазмоциты и начинают интенсивно размножаться, постепенно (!) нарабатывая антитела к вирусу (правило Бернета). Поэтому S. Su с соавт. справедливо обозначают проблему субоптимальной концентрации нейтрализующих антител, которые не только не смогут эффективно нейтрализовать вирус, но и усилят инфекцию SARS-CoV-2 [125].
Помимо ADE, образующиеся в ходе гуморального иммунного ответа комплексы антитело-антиген могут стимулировать путь комплемента посредством активации пути C1q (связывается с антителом), тем самым дополнительно усиливая воспалительные реакции в легких. Усиление тяжести болезни после вакцинации может включать иммунный ответ, связанный с клетками Th2. Активированные Th2 способствуют активации выработки антител. Однако они высвобождают интерлейкин-4 (IL-4), IL-13 и IL-5, а также хемоаттрактант эозинофилов, что приводит к инфильтрации эозинофилов и выработке провоспалительных цитокинов в легких [125].
Также в начале пандемии китайские исследователи пытались найти ответ и на вопрос, почему идет такое несоответствие количества серьезных случаев течения болезни и смертей между районами в провинции Хубэй, где началась вспышка, и другими провинциями Китая и остальным миром. Они пришли к тому, что люди, переносящие болезнь в тяжелой форме, ранее могли быть примированы одним или несколькими предшествующими контактами с коронавирусами близких к SARS-CoV-2 видов, которые прошли бессимптомными или были ошибочно приняты за ОРЗ. Из-за гетерогенности антигенных эпитопов этих вирусов, сохранившиеся в крови пациентов следовые количества специфических антител приводили к тяжелому инфекционному процессу по механизму АDE [127].
Антигенный импринтинг. Феномен, открытый почти 70 лет назад при изучении последствий гриппозной вакцинации[65] [128],может проявиться вместе с ADE и в отношении людей, вакцинированных или переболевших COVID-19, если в циркуляции среди людей появится мутировавший SARS-CoV-2 с небольшими и неразличимыми для иммунной системы антигенными изменениями в S-белке. В этом случае сформировавшимися ранее В-клетками памяти (вакцинация или перенесенная инфекция) будут вырабатываться специфические антитела, обладающие протективным действием в отношении того вируса, с которым они столкнулись ранее или были к нему провакцинированы, но не против вызвавшего инфекционный процесс[66].
Антифосфолипидный синдром - это приобретенная и потенциально опасная для жизни тромбофилия, при которой у пациентов вырабатываются гетерогенные аутоантитела, нацеленные на фосфолипиды и фосфолипид-связывающие белки (англ. autoantibodies targeting phospholipids and phospholipid-binding proteins, aPL). По крайней мере у половины пациентов, госпитализированных с COVID-19 в тяжелом состоянии, обнаружены восемь типов aPL: антикардиолипиновые IgG, IgM и IgA; анти-β2 гликопротеин I IgG, IgM и IgA; антифосфатидилсерин/протромбин (aPS/PT) IgG и IgM. Высокие титры aPL были связаны с гиперактивностью нейтрофилов, включая высвобождение внеклеточных ловушек нейтрофилов (neutrophil extracellular traps, NET)[67], более высокое количество тромбоцитов, более тяжелое течение легочного поражения и значительно сниженную скорость клубочковой фильтрации. Ключевая особенность антифосфолипидного синдрома при COVID-19 - это его способность способствовать тромбозу в сосудистых руслах любого размера, включая как артериальные, так и венозные. Местная иммуностимуляция, вызванная SARS-CoV-2, приводит к взаимодействию местных воспалительных процессов с циркулирующими aPL и, таким образом, тромбовоспалительное поражение легких у пациентов с COVID-19 значительно утяжеляется [131].
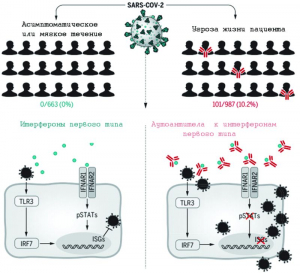
Рисунок 21 - Нейтрализация аутоантителами интерферонов I типа при COVID-19. Аутоантитела к IFN типа I (обозначены красным цветом) нарушают их связывание с рецепторами клетки и активацию нижестоящего ответного пути. IFN типа I (обозначен синим) исчезают из плазмы крови. ISG (IFN-stimulated genes) - гены, стимулированные IFN; TLR - Toll-подобный рецептор; IFNAR - рецептор IFN-a/fi; pSTAT - фосфорилированные преобразователи сигналов и активаторы транскрипции; IRF - регуляторный фактор интерферона [132].
Аутоантитела к интерферонам. Недостаточность системы интерферона (см. рисунок 12) - один из факторов, снижающих эффективность иммунного ответа пациента на SARS-CoV-2. Ее роль в течении COVID-19 пока-зана на примере погашения интерферонового ответа на инфекцию SARS-CoV-2 ранее образовавшимися аутоантителами. P. Bastard с соавт. [132] обнаружили, что, по меньшей мере, у 101 из 987 пациентов с пневмонией, угрожающей их жизни, в крови циркулируют IgG, нейтрализующие: IFN-w (13 пациентов), 13 типов IFN-a (36 пациентов) или оба IFN (52 пациента). Такие аутоантитела не обнаружены у 663 человек с бессимптомной или легкой инфекцией SARS-CoV-2 и присутствовали только у 4 из 1227 обследованных здоровых людей. Все протестированные пациенты с тяжелым течением болезни имели низкие или неопределяемые уровни IFN-a в сыворотке крови (рисунок 21).
P. Bastard с соавт. [132] считают, что аутоантитела к IFN присутствовали в крови пациента до заражения SARS-CoV-2 и стали причиной их избирательного заражения этим вирусом среди других людей, находившихся в контакте с больными COVID-19. Появление таких антител они объясняют лечением в прошлом препаратами на основе IFN-a2 или IFN-b; тяжело перенесенными вирусными инфекциями, вызвавшими выработку больших количество интерферонов; аутоиммунными заболеваниями и мутациями генов, участвующих в регулировании интерфе- роновых ответов (например, гипоморфными мутациями RAG1 или RAG2). Сам SARS-CoV-2 является слабым индуктором интерферонов I типа, поэтому их дефицит приводит к тяжелому течению COVID-19. Из своих наблюдений они делают следующие выводы: пациентов, инфицированных SARS-CoV-2, целесообразно на ранней стадии болезни обследовать на наличие аутоантитела к IFN с целью прогноза ее дальнейшего течения и корректировки схем лечения; пациентов с аутоантителами к IFN, выздоравливающих после COVID-19, исключить из доноров плазмы; в схему лечения таких пациентов целесообразно включить специфическое ингибирование IFN-реактивных В-клеток типа I и инъекции или ингаляции IFN-b.
***
Недооценка COVID-19 на начальном этапе пандемии вызвана тем, что такая разновидность инфекционного процесса, когда возбудитель болезни сначала накапливается в верхних дыхательных путях человека, а потом появляются симптомы болезни, ранее либо не встречалась клиницистам, либо не обращала на себя внимание из-за отсутствия серьезных последствий. Когда пресимптоматическая передача SARS-CoV-2 стала очевидной, в нее было трудно поверить самим врачам и адаптироваться населению, надо было менять весь уклад их жизни. Вводить карантины, как в Средние века, но для сотен тысяч людей и в условиях глобализации. Миллионы людей, привыкших к свободному перемещению с континента на континент, должны были отправиться на обсервацию. Для смягчения эпидситуации делалось многое, в том числе и то, что на современном жаргоне стали называть локдауном (англ. Lockdown, т.е. блокировка), однако пандемия продолжается, еще раз напоминая о несоответствии наших знаний в эпидемиологии реальным эпидемическим угрозам. Необходимо извлекать уроки и искать выход из сложившейся ситуации. Пока эпидемиология SARS-CoV-2, лечение болезни, прогнозирование ее исхода, отдаленные последствии болезни, это все "белые пятна". От того, как мы их заполним, зависит будущее эпидемиологии как науки. Накоплению нового знания меньше всего будет способствовать шаблонное мышление типа: «Создадим вакцину и покончим» или «Мы получили антитела!». Что это за антитела, в этой работе показано. Прошлые провалы с вакцинами к ВИЧ, вирусу гепатита С, SARS-CoV ничему и никого у нас не научили. Пандемия COVID-19 уже показала, что она станет катализатором исследовательской революции в эпидемиологии и инфекционной патологии, но только через отказ от старых догм и только «снизу», прежде всего в головах врачей и ученых, если, конечно, они им самим дороги.
Информация о конфликте интересов
Автор заявляет, что исследования проводились при отсутствии любых коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Сведения о рецензировании
Статья прошла открытое рецензирование двумя рецензентами, специалистами в данной области. Рецензии находятся в редакции журнала и в РИНЦе
.Список источников
1. Супотницкий М.В. Новый коронавирус SARS-CoV-2 в аспекте глобальной эпидемиологии коронавирусных инфекций // Вестник войск РХБ защиты. 2020. Т. 4. № 1. С. 32-65. https://doi.org/10.35825/2587-5728-2020-4-1-32-65
Supotnitskiy M.V. Novel coronavirus SARS-CoV-2 in the context of global epidemiology of coronavirus infections // Journal of NBC Protection Corps. 2019. V. 4. No 1. P. 32-65. https://doi.org/10.35825/2587-5728-2020-4-1-32-65 (in Russian)
2. Lu R., Zhao X., Li J. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding // Published online January 29, 2020. https://doi.org/10.1016/S0140-6736(20)30251-8
3. Щелканов М.Ю., Попова А.Ю., Дедков В.Г. с соавт. История изучения и современная классификация коронавирусов (Nidovirales: Coronaviridae) // Инфекция и иммунитет. 2020, Т. 10, № 2. С. 221-246. http://dx.doi.org/10.15789/2220-7619-HOI-1412
Shchelkanov M.Yu., Popova A.Yu., Dedkov V.G. et al. History of investigation and current classification of coronaviruses (Nidovirales: Coronaviridae) // Russian Journal of Infection and Immunity. 2020. Vol. 10, №. 2. P. 221-246. http://doi.org/10.15789/2220-7619-HOI-1412 (in Russian).
4. van den Brand J., Smits S.L., Haagmans B.L. Pathogenesis of Middle East respiratory syndrome coronavirus // J. Pathol. 2015. V. 235. P. 175-184. https://doi.org/10.1002/path.4458
5. Malik Y.A. Properties of Coronavirus and SARS- CoV-2 // Malaysian J. Pathol. 2020. V. 42(1). P. 3-11.
6. Donnelly C.A., Malik M.R., Elkholy A. et al. Worldwide Reduction in MERS Cases and Deaths since 2016 // Emerg. Infect. Dis. 2019. V. 25. P. 1758-1760. http://dx.doi.org/10.3201/eid2509.190143
7. Yan-Rong Guo, Qing-Dong Cao, Zhong-Si Hong et al. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak - an update on the status // Mil. Med. Res. 2020. V. 7(1). https://doi.org/10.1186/s40779-020-00240-0
8. Mohan S.M., Hemalatha M., Kopperi H. et al. SARS-CoV-2 in environmental perspective: Occurrence, persistence, surveillance, inactivation and challenges // Chem. Eng. J. 2021. V. 405: P. 126893 https://doi.org/10.1016/jxej.2020.126893
9. Abu A., Naqvia T., Fatimab K. et al. Insights into SARS-CoV-2 genome, structure, evolution, pathogenesis and therapies: Structural genomics approach // Biochim. Biophys. Acta (BBA) - Molecular Basis of Disease. 2020. V. 1866, Is. 10. https://doi.org/10.1016/j.bbadis.2020.165878
10. Lau S.K., Li K.S., Huang Y. et al. Ecoepidemiology and complete genome comparison of different strains of severe acute respiratory syndrome-related Rhinolophus bat coronavirus in China reveal bats as a reservoir for acute, self-limiting infection that allows recombination events // J. Virol. 2010. V. 84. P. 2808-2819.
11. Woo P.C., Lau S.K., Li K.S. et al. Genetic relatedness of the novel human group c betacoronavirus to tylonycteris bat coronavirus HKU4 and pipistrellus bat coronavirus HKU5 // Emerg. Microbes Infect. 2012. V. 1. https://doi.org/10.1038/emi.2012.45
12. Ge X-Y., Wang N., Zhang W. et al. Coexistence of multiple coronaviruses in several bat colonies in an abandoned mineshaft // Virologica Sinica. 2016. V. 31, № 1. P. 31-40. https://doi.org/10.1007/s12250-016-3713-9
13. Lau S.K.R., Luk H., Wong A.S.P. et al. Wong Identification of a Novel Betacoronavirus (Merbecovirus) in Amur Hedgehogs from China // Viruses. 2019. V. 11. 980. https://doi.org/10.3390/v11110980
14. Liu Z., Xiao X., Wei X. et al. Composition and divergence of coronavirus spike proteins and host ACE2 receptors predict potential intermediate hosts of SARS-CoV-2 // J. Med. Virol. 2020. V. 92(6). P. 595-601. doi: 10.1002/jmv.25726
15. Wu F., Zhao S., Yu B. et al. A new coronavirus associated with human respiratory disease in China // Nature. 2020. V. 579. P. 265-269. https://doi.org/10.1038/s41586-020-2008-3
16. Zhou P., Yang L.X., Wang G.X. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin // Nature. 2020. V. 579. P. 270-273. https://doi.org/10.1038/s41586-020-2012-7
17. Chavarria-Miro G., Anfruns-Estrada E., Guix S. et al. Sentinel surveillance of SARS-CoV-2 in wastewater anticipates the occurrence of COVID-19 cases // medRxiv preprint. 2020. June 13. doi: https://doi.org/10.1101/2020.06.13.20129627
18. van Dorp L., Richard D., Tan C. et al. No evidence for increased transmissibility from recurrent mutations in SARS-CoV-2 // bioRxiv preprint. Version posted May 21, 2020. https://doi.org/10.1101/2020.05.21.108506
19. Ge X-Y., Wang N., Zhang W. et al. Coexistence of multiple coronaviruses in several bat colonies in an abandoned mineshaft // Virologica Sinica. 2016. V. 31, № 1. P. 31-40. https://doi.org/10.1007/s12250-016-3713-9
20. Latham J. A Proposed Origin for SARS- CoV-2 and the COVID-19 Pandemic // Biotechnology, Commentaries. 2020. July 15, https://www.independentsciencenews.org/commentaries/a-proposed-origin-for-sars-cov-2-and-the-covid-19-pandemic/
21. Shang J., Ye G., Shi K. et al. Structural basis of receptor recognition by SARS-CoV-2 // Nature. 2020. V. 581(7807), P. 221-224. https://doi.org/10.1038/s41586-020-2179-y
22. Zhou P., Yang X., Wang X. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin // Nature. 2020. V. 579. P. 270-273. https://doi.org/10.1038/s41586-020-2012-7
23. Фракасторо Дж. О контагии и контагиозных болезнях и лечении. В трех книгах. М.: 1954.
Fracastoro J. About contagion and contagious diseases and treatment. In three books. Moscow. 1954. (in Russian)
24. Lecis R., Mucedda M., Pidinchedda E. et al. Molecular Identification of Betacoronavirus in Bats From Sardinia (Italy): First Detection and Phylogeny // Virus Genes. 2019. V. 55. P. 60-67. https://doi.org/10.1007/s11262-018-1614-8
25. Blangiardo M., Cameletti M., Pirani M. et al. Estimating weekly excess mortality at sub-national level in Italy during the COVID-19 pandemic // PLOS. 2020. https://doi.org/10.1371/journal.pone.0240286
26. Corman V.M., Kallies R., Philipps H. et al. Characterization of a novel betacoronavirus related to middle East respiratory syndrome coronavirus in European hedgehogs // J. Virol. 2014. V. 88. P. 717-724
27. Monchatre-Leroy E., Boue F., Boucher J.M. et al. Identification of alpha and beta coronavirus in wildlife species in France: Bats, rodents, rabbits, and hedgehogs // Viruses. 2017. V. 9. № 12. P. 364. https://doi.org/10.3390/v9120364
28. Saldanha I.F., Lawson B., Goharriz H. et al. Extension of the known distribution of a novel clade C betacoronavirus in a wildlife host // Epidemiology and Infection. 2019. V. 147, e169. P. 1-8. https://doi.org/10.1017/S0950268819000207
29. Lau S.K.R., Luk H., Wong A.S.P. et al. Wong Identification of a Novel Betacoronavirus (Merbecovirus) in Amur Hedgehogs from China // Viruses. 2019. V. 11. P. 980. https://doi.org/10.3390/v11110980
30. Lee J., Hughes T., Lee M-H. et al. No evidence of coronaviruses or other potentially zoonotic viruses in Sunda pangolins (Manis javanica) entering the wildlife trade via Malaysia // bioRxiv preprint https://doi.org/10.1101/2020.06.19.158717
31 Andersen K.G., Rambaut A., Lipkin W.I. et al. The proximal origin of SARS-CoV-2 // Nature medicine. 2020. V. 26(4). P. 450-452. https://doi.org/10.1038/s41591-020-0820-9
32. Chu H., Fuk-Woo Chan J., Wang Y. et al. Comparative Replication and Immune Activation Profiles of SARS-CoV-2 and SARS-CoV in Human Lungs: An Ex Vivo Study With Implications for the Pathogenesis of COVID-19 // Clinical Infectious Diseases. 2020. V. 71, Is. 6, P. 1400-1409, https://doi.org/10.1093/cid/ciaa410
33. Piplani S., Singh P.K., Winkler D.A., Petrovsky N. In silico comparison of spike protein- ACE2 binding affinities across species; significance for the possible origin of the SARS-CoV-2 virus // arXiv preprint arXiv. 2020. (https://www.researchgate.net/publication/341369358 , дата обращения: 20.09.2020)
34. Ng K.K.F., Vane J.R., Conversion of Angiotensin I to Angiotensin II // Nature. 1967. V. 216(5117). P. 762766. https://doi.org/10.1038/216762a0
35. Putnam N., Butts T. Ferrier D.K.E. et al. The amphioxus genome and the evolution of the chordate karyotype // Nature. 2008. V. 453. P. 1064-1071. https://doi.org/10.1038/nature06967
36. Bernstein K.E, Ong F., Blackwell W-L. et al. Modern Understanding of the Traditional and Nontraditional Biological Functions of Angiotensin- Converting Enzyme // Pharmacol. Rev. 2013. V. 65(1). P. 1-46. https://doi.org/10.1124/pr.112.006809
37. Sarah R., Tipnis A.R., Hooper N.M., Hyde R. et al. A Human Homolog of Angiotensin-converting Enzyme. Cloning and Functional Expression as a Captopril-Insensitive Carboxypeptidase // J. Biol. Chem. 2000. V. 275, No. 43. P. 33238-33243. https://doi.org/10.1074/jbc.M002615200
38. Cooper E.L. Comparative Immunology // Current Pharmaceutical Design. 2002. V. 8. P. 99-110. https://doi.org/10.1093/icb/25.3.649
39. Blazquez S., Zimmer C., Guigon G. et al. Human tumor necrosis factor is a chemoattractant for the parasite Entamoeba histolytica // Infect. Immun. 2006. V. 74, No. 2. P. 1407-1411.
40. Benavides-Montano J.A., Vadyvaloo V. Yersinia pestis resists predation by Acanthamoeba castellanii and exhibits prolonged intracellular survival // Appl. Environ. Microbiol. 2017. V. 83, Issue 13. P. e00593-17. https://doi.org/10.1128/AEM.00593-17
41. Markman D.W., Antolin M.F., Bowen R.A. et. al. Yersinia pestis survival and replication in potential ameba reservoir // Emerging Infectious Diseases. 2018. V. 24, № 2. P. 294-302.
42. Cateau E., Delafont V., Hechard Y., Rodier M.Y. Free-living amoebae: what part do they play in healthcare-associated infections? // J. Hospital Infection. 2014. V. 83. P. 131-140. https://doi.org/10.1016/j.jhin.2014.05.001
43. Mattana A., Serra C., Mariotti E. et al. Acanthamoeba castellanii promotion of in vitro survival and transmission of coxsackie b3 viruses // Eukaryot. Cell. 2006. V. 5. P. 665-671.
44. Lorenzo-Morales J., Coronado-Alvarez N., Martinez-Carretero E. Valladares B. Detection of four adenovirus serotypes within water-isolated strains of Acanthamoeba in the Canary Islands, Spain // Am. J. Trop. Med. Hyg. 2007. V. 77. P. 753-756.
45. Scheid P., Schwarzenberger R. Acanthamoeba spp. as vehicle and reservoir of adenoviruses // Parasitol. Res. 2012. V.111(1). P. 479-485. https://doi.org/10.1007/s00436-012-2828-7
46. Hsueh T-Y., Gibson K.E. Interactions between Human Norovirus Surrogates and Acanthamoeba spp. // Appl Environ Microbiol. 2015. V. 81(12). P. 4005-4013. https://doi.org/10.1128/AEM.00649-15
47. Raoult D., Renesto P., Brouqui P. Laboratory infection of a technician by mimivirus // Ann. Intern. Med. 2006. V. 144. P. 702-703. https://doi.org/10.7326/0003-4819-144-9-200605020-00025
48. Folkins M.A., Dey R., Ashbolt N.J. Interactions between Human Reovirus and Free-Living Amoebae: Implications for Enteric Virus Disinfection and Aquatic Persistence // Environ. Sci. Technol. 2020. V. 54(16). P. 10201-10206. https://doi.org/10.1021/acs.est.0c02896
49. Yoshikawa G., Blanc-Mathieu R., Song C. et al. Medusavirus, a Novel Large DNA Virus Discovered from Hot Spring Water // J. Virol. 2019. V. 93(8). P. e02130-e02118. https://doi.org/10.1128/JVI.02130-18
50. Li F., Li W., Farzan M., Harrison S.C. Structure of SARS coronavirus spike receptor-binding domain complexed with receptor // Science. 2005. V. 309. P. 1864-1868. https://doi.org/10.1126/science.1116480
51. Gheblawi M., Wang K., Viveiros A. et al. Angiotensin-Converting Enzyme 2: SARS-CoV-2 Receptor and Regulator of the Renin-Angiotensin System: Celebrating the 20th Anniversary of the Discovery of ACE2 // Circ. Res. 2020. V. 126(10). P. 14561474. https://doi.org/10.1161/CIRCRESAHA.120.317015
52. Wang K., Chen W., Zhou Y.-S. et al. SARS-CoV-2 invades host cells via a novel route: CD147-spike protein // BioRxiv. 2020. https://doi.org/10.1101/2020.03.14.988345
53. Yurchenko V., Constant S., Bukrinsky M. Dealing with the family: CD147 interactions with cyclophilins // Immunology. 2006. V. 117(3). P. 301-309. https://doi.org/10.1111/j.1365-2567.2005.02316.x
54. Behloul N., Baha S., Shi R., Meng J. Role of the GTNGTKR motif in the N-terminal receptor- binding domain of the SARS-CoV-2 spike protein // Virus Res. 2020. V. 286: 198058. https://doi.org/10.1016/j.virusres.2020.198058
55. Coutard B., Valle C., Lamballerie X. et al. The spike glycoprotein of the new coronavirus 2019-nCoV contains a furin-like cleavage site absent in CoV of the same clade // Antiviral Res. 2020. V. 176. P. 104742. http://dx.doi.org/10.1016/j-.antiviral.2020.104742
56. Lukassen S., Chua R., Trefzer T et al. SARS- CoV-2 receptor ACE2 and TMPRSS2 are primarily expressed in bronchial transient secretory cells // EMBO J. 2020. V. 39(10): P. e105114. https://doi.org/10.15252/embj.20105114
57. Gubernatorovaa O., Gorshkovaabc E.E., Polinovaab A.I., Drutskayaa M.S. IL-6: Relevance for immunopathology of SARS-CoV-2 // Cytokine Growth Factor Rev. 2020. V. 53. P. 13-24. https://doi.org/10.1016/j.cytogfr.2020.05.009
58. Iwata-Yoshikawa N., Okamura T. Shimizu Y. et al. TMPRSS2 Contributes to Virus Spread and Immunopathology in the Airways of Murine Models after Coronavirus Infection // J. Virol. 2019. V. 93(6). P. e01815- e01818. http://dx.doi.org/10.1128/JVI.01815-18
59. Rees V. Study finds activation sequence of COVID-19 S protein is cleaved by furin protease // Drug Target Review. 2020. 6 May 2020. https://www.drugtargetreview.com/news/61264/study-finds-activation-sequence-of-covid-19-s-protein-is-cleaved-by-furin-protease/
60. Walls A.C., Park Y-G., Tortorici A.M. et al. Structure, Function, and Antigenicity of the SARS- CoV-2 Spike Glycoprotein // Cell. 2020. V. 181(2). P. 281292. e6. https://doi.org/10.1016/j-.cell.2020.02.058
61. Hoffmann M., Kleine-Weber H., Pohlmann S. A multibasic cleavage site in the spike protein of SARS- CoV-2 is essential for infection of human lung cells // Mol. Cell. 2020. V. 78(4). P. 779-784.e5. http://dx.doi.org/10.1016/j.molcel.2020.04.022 . Epub 2020 May 1.
62. Romano M., Ruggiero A., Squeglia F. et al. A Structural View of SARS-CoV-2 RNA Replication Machinery: RNA Synthesis, Proofreading and Final Capping //Cells. 2020 May; 9(5): 1267. http://dx.doi.org/10.3390/cells9051267
63. Kandeel M., Ibrahim A., Fayez M., Al-Nazawi M. From SARS and MERS CoVs to SARS-CoV-2: Moving toward more biased codon usage in viral structural and nonstructural genes // J. Med. Virol. 2020. V.92(6). P. 660-666. https://doi.org/10.1002/jmv.25754
64. Angeletti S., Benvenuto D., Bianchi M. et al. COVID-2019: The role of the nsp2 and nsp3 in its pathogenesis // J. Med. Virol. 2020. 1-5. https://doi.org/10.1002/jmv.25719
65. Gadlage M.J., Graham R.L., Denison M.R. Murine Coronaviruses Encoding nsp2 at Different Genomic Loci Have Altered Replication, Protein Expression, and Localization // J. Virol. 2008 V. 82. P. 11964-11969. https://doi.org/10.1128/JVI.01126-07
66. Saikatendu K., Joseph J., Subramanian V. et al. Structural Basis of Severe Acute Respiratory Syndrome Coronavirus ADP-ribose-1''-phosphate Dephosphorylation by a Conserved Domain of nsP3 // Structure. 2005. V. 13. № 11. P. 1665-1675. https://doi.org/10.1016/j.str.2005.07.022
67. Lei J., Kusov Y., Hilgenfeld R. Nsp3 of Coronaviruses: Structures and Functions of a Large Multi-Domain Protein // Antiviral Res. 2018. V. 149. P. 58-74. https://doi.org/10.1016/j-.antiviral.2017.11.001
68. Chan J., Lau S., To K.K.W. et al. Middle East Respiratory Syndrome Coronavirus: Another Zoonotic Betacoronavirus Causing SARS-Like Disease // Clin. Microbiol. Rev. 2015. V. 28(2): P. 465-522. https://doi.org/10.1128/CMR.00102-14
69. Kai-Wang To E., Tak-Yin Tsang O., Leung W-S. et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study // Lancet Infect. Dis. 2020. V. 20, Is. 5. P. 565 - 574. https://doi.org/10.1016/S1473-3099(20)30196-1
70. Chu H., Fuk-Woo Chan J., Wang Y. et al. Comparative Replication and Immune Activation Profiles of SARS-CoV-2 and SARS-CoV in Human Lungs: An Ex Vivo Study With Implications for the Pathogenesis of COVID-19 // Clin. Infect. Dis. 2020. V. 71, Is. 6, P. 1400-1409, https://doi.org/10.1093/cid/ciaa410
71. Hui K.P.Y., Cheung M-С., Perera R. et al. Tropism, replication competence, and innate immune responses of the coronavirus SARS-CoV-2 in human respiratory tract and conjunctiva: an analysis in ex- vivo and in-vitro cultures // Lancet Respir. Med. 2020 V. 8(7). P. 687-695. https://doi.org/10.1016/S2213-2600(20)30193-4
72. Wang Y., Wang Y., Chen Y. et al. Unique epidemiological and clinical features of the emerging 2019 novel coronavirus pneumonia (COVID-19) implicate special control measures // J. Med. Virol. 2020. V. 92. P. 568-576. https://doi.org/10.1002/jmv.25748
73. Wei W., Li Z., ChiewC.J. et al. Presymptomatic Transmission of SARS-CoV-2 - Singapore, January 23-March 16, 2020 // MMWR Morb Mortal Wkly Rep. 2020. V. 69(14). P. 411-415. https://doi.org/10.15585/mmwr.mm6914e1
74. Stawicki S.P., Jeanmonod R., Miller A.C. et al. The 2019-2020 Novel Coronavirus (Severe Acute Respiratory Syndrome Coronavirus 2) Pandemic: A Joint American College of Academic International Medicine-World Academic Council of Emergency Medicine Multidisciplinary COVID-19 Working Group Consensus Paper // J. Glob. Infect. Dis. 2020V. 12(2). P. 47-93. https://doi.org/10.4103/jgid.jgid_86_20
75. Masaaki Miyazawa. Immunopathogenesis of SARS-CoV-2-induced pneumonia: lessons from influenza virus infection // Inflamm. Regen. 2020. V. 40. P. 39. https://doi.org/10.1186/s41232-020-00148-1
76. Huang L., Zhang X., Zhang X. et al. Rapid asymptomatic transmission of COVID-19 during the incubation period demonstrating strong infectivity in a cluster of youngsters aged 16-23 years outside Wuhan and characteristics of young patients with COVID-19: A prospective contact-tracing study // J. Infect. 2020. V. 80. e1-e13. https://doi.org/10.1016/jjinf.2020.03.006
77. Long Q-X., Tang X-J., Shi Q-J. et al. Clinical and immunological assessment of asymptomatic SARS- CoV-2 infections // Nature Medicine. 2020. V. 26. P. 1200-1204. https://doi.org/10.1038/s41591-020-0965-6
78. Liu Y., Gayle A.A., Wilder-Smith A.,Rocklov J. The reproductive number of COVID-19 is higher compared to SARS coronavirus // J. Travel. Med. 2020. V. 27(2). https://doi.org/10.1093/jtm/taaa021
79. Sanche S., Lin E.T., Xu C. et al. High Contagiousness and RapidSpread of Severe Acute Respiratory Syndrome Coronavirus 2 // Emerg. Infect. Dis. 2020. V. 26, № 7, P. 1470-1477. https://doi.org/10.3201/eid2607.200282
80. Борисевич С.В., Сизикова Т.Е., Лебедев В.Н. Пандемия COVID-19: анализ возможных сценариев развития эпидемии заболевания в России // Вестник войск РХБ защиты. 2020. Т. 4. No 2. С. 116-130. https://doi.org/10.35825/2587-5728-2020-4-2-116-130
Borisevich S.V., Sizikova Т.Е., Lebedev V.N. COVID-19 Pandemic: Analysis of Possible Scenarios for the Development of the Epidemic in Russia // Journal of NBC Protection Corps. 2020. V. 4. No 2. P. 116-130. https://doi.org/10.35825/2587-5728-2020-4-2-116-130 (in Russian)
81. Супотницкий М.В. Микроорганизмы, токсины и эпидемии. М.: 2000.
Supotnitsky M.V. Microorganisms, toxins and epidemics. Moscow: 2000 (in Russian).
82. Супотницкий М.В. Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/ СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов. М.: 2009.
Supotnitsky M.V. Evolutionary pathology. On the question of the place of HIV infection and HIV/ AIDS pandemic among other infectious, epidemic and pandemic processes. Moscow: 2009 (in Russian).
83. Sasaki Y., Nomura A., Kusuhara K. et al. Genetic basis of patients with bacille Calmette-Guerin osteomyelitis in Japan: identification of dominant partial interferon-y receptor 1 deficiency as a predominant type // J. Infect. Dis. 2002. V. 185. P. 706-709. https://doi. org/10.1086/339011
84. Newport M., Huxley C., Huston S. et al. A mutation in the interferon-g-receptor gene and susceptibility to mycobacterial infection // N. Engl. J. Med. 1996. V. 335. P. 1941-1949. https://doi.org/10.1056/NEJM199612263352602
85. Jouanguy E., Lamhamedi-Cherradi S., Lammas D. et al. A human IFNGR1 small deletion hotspot associated with dominant susceptibility to mycobacterial infection // Nat. Genet. 1999. V. 21. P. 370-378. https:// doi.org/10.1038/7701
86. Dorp L., Acman M., Richard D. et al., Emergence of genomic diversity and recurrent mutations in SARS- CoV-2. Infection, genetics and evolution // Infect. Genet. Evol. 2020. V. 83. 104351. https://doi.org/10.1016/j.meegid.2020.104351
87. Melenotte C., Silvin A., Goubet A-G., Lahmar I. Immune responses during COVID-19 infection // Oncoimmunology. 2020. V. 9(1): 1807836. . https://doi.org/10.1080/2162402X.2020.1807836
88. Devaux Ch., Rolain J-M., Raoulta D. et al. ACE2 receptor polymorphism: Susceptibility to SARS-CoV-2, hypertension, multi-organ failure, and COVID-19 disease outcome // J. Microbiol. Immunol. Infect. 2020. V. 53(3). P. 425-435. https://doi.org/10.1016/j.jmii.2020.04.015
89. Vepa A., Bae J.P., Ahmed F. et al. COVID-19 and ethnicity: A novel pathophysiological role for inflammation // Diabetes Metab. 2020. V. 14(5). P. 10431051. https://doi.org/10.1016/j.dsx.2020.06.056
90. Pana D., Szec S., Minhasc J.S. et al. The impact of ethnicity on clinical outcomes in COVID-19: A systematic review // Clinical. Medicine. 2020. V. 23. 100404. https://doi.org/10.1016/j.eclinm.2020.100404
91. Millett G.A., Jones A.T., Benkeser D. et al. Assessing Differential Impacts of COVID-19 on Black Communities // Ann. Epidemiol. 2020. V. 44. https://doi.org/10.1016/j.annepidem.2020.05.003
92. Labo N., Ohnuki H., Tosato G. Vasculopathy and Coagulopathy Associated with SARS-CoV-2 Infection // Cells. 2020 Jul; 9(7): 1583. https://doi.org/10.3390/cells9071583
93. Giudicessi G.R., Roden D.M Wilde A.A.M., Ackerman M.J. Genetic susceptibility for COVID-19- associated sudden cardiac death in African Americans // Heart Rhythm. 2020. V. 9. P. 1487-1492. https://doi.org/10.1016/j.hrthm.2020.04.045
94. Ovsyannikova I.G., Haralambieva I.N., Crooke S.N. et al. The role of host genetics in the immune response to SARS-CoV-2 and COVID-19 susceptibility and severity // Immunol. Rev. 2020. V. 296. P. 205-219. https://doi.org/10.1111/imr.12897
95. Pacurar M., Kafoury R., Tchounwou P. et al. The Renin-Angiotensin-Aldosterone System in Vascular Inflammation and Remodeling // Int. J. Inflam. 2014. 689360. https://doi.org/10.1155/2014/689360
96. Datta P.K. Liu F. Fischer F. et al. SARS- CoV-2 pandemic and research gaps: Understanding SARS-CoV-2 interaction with the ACE2 receptor and implications for therapy // Theranostics. 2020. V. 10(16). P. 7448-7464. https://doi.org/10.7150/thno.48076
97. Mahmudpour M., Roozbeh J., Keshavarz M. et al. COVID-19 cytokine storm: The anger of inflammation // Cytokine. 2020. V. 133:155151. https:// doi.org/10.1016/j.cyto.2020.155151
98. Lu H., Cassis L., Craig W. et al. Structure and functions of angiotensinogen // Hypertension Res. 2016. V. 39 (7). P. 492-500. https://doi.org/10.1038/hr.2016.17
99. Vickers Ch., Hales P., Kaushik V/ et al. Hydrolysis of biological peptides by human angiotensin- converting enzyme-related carboxypeptidase // J. Biol. Chem. 2002. V. 277(17). P. 14838-14843. https://doi.org/10.1074/jbc
100. Povlsen A.L., Grimm D., Wehland M. et al. The Vasoactive Mas Receptor in Essential Hypertension // J. Clin. Med. 2020, V. 9(1), 267; https://doi.org/10.3390/jcm9010267
101. Cheng H., Wang Y., Wang G-Q. Organ- protective effect of angiotensin-converting enzyme 2 and its effect on the prognosis of COVID-19 // J. Med. Virol. 2020. V. 92(7). P. 726-730. https://doi.org/10.1002/jmv.25785
102. The COVID-19 Host Genetics Initiative, a global initiative to elucidate the role of host genetic factors in susceptibility and severity of the SARS-CoV-2 virus pandemic // Eur. J. Hum. Genet. 2020. V. 28(6). P. 715-718. https://doi.org/10.1038/s41431-020-0636-6
103. Anastassopoulou C., Gkizarioti Z., Patrinos G.P., Tsakris A. Human genetic factors associated with susceptibility to SARS-CoV-2 infection and COVID-19 disease severity // Hum. Genomics. 2020. V. 14(1). P. 40. https://doi.org/10.1186/s40246-020-00290-4
104. Malard L., Kakinami L., O'Loughlin J. et al. The association between the angiotensin-converting enzyme-2 gene and blood pressure in a cohort study of adolescents // BMC Med. Genet. 2013. V. 14. https://doi.org/10.1186/1471-2350-14-117
105. Crackower M.A., Sarao R., Oudit G.Y. et al. Angiotensin-converting enzyme 2 is an essential regulator of heart function // Nature. 2002. V. 417. P. 822-828. https://doi.org/10.1038/nature00786
106. Velkoska E., Patel S.K., Burrell L.M. Angiotensin converting enzyme 2 and diminazene: role in cardiovascular and blood pressure regulation // Curr. Opin. Nephrol. Hypertens. 2016. V. 25. P. 384-395. https://doi.org/10.1097/MNH.0000000000000254
107. Pinheiro D.S., Santos R.S., Veiga Jardim P.C.B. et al. The combination of ACE I/D and ACE2 G8790A polymorphisms revels susceptibility to hypertension: a genetic association study in Brazilian patients // PLoS One. 2019. V. 14(8): e0221248. https://doi.org/10.1371/journal.pone.0221248
108. Duru K., Farrow S., Wang J.M. et al. Frequency of a deletion polymorphism in the gene for angiotensin converting enzyme is increased in african-Americans with hypertension // Am. J. Hypertens. 1994. V. 7(8). P. 759-762. https://doi.org/10.1093/ajh/Z8.759
109. Stawiski E.W., Diwanji D., Suryamohan K. et al. Human ACE2 receptor polymorphisms predict SARS-CoV-2 susceptibility // bioRxiv. 2020. https://doi.org/10.1101/2020.04.07.024752
110. Zhao Y., Zhao Z., Wang Y. et al. Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov // BioRxiv. 2020. Jan. 26. https://doi.org/10.1101/2020.01.26.919985
111. Poston J.T., Patel B.K., Davis A.M. Management of Critically Ill Adults with COVID-19 // JAMA. 2020. V. 323(18). P. 1839-1841. https://doi.org/10.1001/jama.2020.4914
112. Oppenheim J.J., Yang D. Alarmins: chemotactic activators of immune responses // Curr. Opin. Immunol. 2005. V. 17, № 4. P. 359-365. https://doi.org/10.1016/j.coi.2005.06.002
113. Bushmanova G.M., Supotnitsky M.V. The COVID-19 pandemic is one of the components of the multicomponent pandemic of the 21st century // J. Cardiovasc. Med. Cardiol. 2020. V. 7(2). P. 195-200. https://orcid.org/0000-0002-5012-5608
114. Карнаушкина М.А., Аверьянов А.В., Лесняк В.Н. Синдром «матового стекла» при оценке КТ-изображений органов грудной клетки в практике клинициста: патогенез, значение, дифференциальный диагноз // Архивъ внутренней медицины. 2018. Т. 8(3). С. 165-175. https://dx.doi.org/10.20514/2226-6704-2018-8-3-165-175
Karnaushkina M.A., Averyanov A.V., Lesnyak V.N. Ground glass opacities on KT of the chest in the practice of the clinician: pathogenesis, significance, differential diagnose. clinical observation // The Russian Archives of Internal Medicine. 2018. V. 8(3). P. 165-175. https://dx.doi.org/10.20514/2226-6704-2018-8-3-165-175 (In Russian).
115. Bushmanova G.M., Supotnitskiy M.V., Churin V. Primary chronic septic endocarditis as an alternative to acute rheumatic fever - the obligate component of the multicomponent noncyclic pandemic of the 21 st Century // J. Cardiovasc. Med. Cardiol. 2020. V. 7(3). P. 242-248. https://dx.doi.org/10.17352/2455-2976.000146
116. Бушманова Г.М., Зорина И.Г., Терлецкий А.В., Ахмерова Л.Т. «Новый» клинический феномен XX-XXI веков - первично-хронический септический эндокардит как аргумент против диагноза «ревматизм» // Терапия. 2020. Т. 2. С. 34-45. https://dx.doi.org/10.18565/therapy.2020.2.34-45
Bushmanova G.M., Zorina I.G., Terletskiy A.V., Akhmerova L.T. «New» clinical phenomenon of XX- XXI centuries - primary chronic septic endocarditis as an argument against the diagnosis of «rheumatism» // Therapy. 2020. V. 2. P. 34-45. https://dx.doi.org/10.18565/therapy.2020.2.34-45 (in Russian).
117. Karthik K., Senthilkumar T.M.A., Udhayavel S., Rajc G.D. Role of antibody-dependent enhancement (ADE) in the virulence of SARS-CoV-2 and its mitigation strategies for the development of vaccines and immunotherapies to counter COVID-19 // Hum. Vaccin. Immunother. 2020. P. 1-6. https://doi.org/10.1080/21645515.202
118. Зайчук Т.А., Нечипуренко Ю.Д., Аджубей А.А. с соавт. Проблемы создания вакцин против бетакоронавирусов: антителозависимое усиление инфекции и вирус сендай как возможный вакцинный вектор // Молекулярная биология. 2020. Т. 54, № 6. Р. 922-938. https://dx.doi.org/10.31857/S0026898420060154
Zaichuk T.A., Nechipurenko Yu.D., Adjubey A.A. Problems of creating vaccines against beta- coronaviruses: antibody-dependent intensification of infection and Sendai virus as a possible vaccine vector // Molecular Biology. 2020.Vol. 54, No. 6. P. 922-938. https://doi.org/10.31857/S0026898420060154 (in Russian)
119. Yip M.S., Leung N.H.L., Cheung C.Y. et al. Antibody-dependent infection of human macrophages by severe acute respiratory syndrome coronavirus // Virol. J. 2014. V. 11. 82 p. https://doi.org/10.1186/1743-422X-11-82
120. Jaume M., Yip M.S., Cheung C.Y. et al. Anti-Severe Acute Respiratory Syndrome Coronavirus Spike Antibodies Trigger Infection of Human Immune Cells via a pH- and Cysteine Protease-Independent FcR Pathway // J. Virol. 2011. V. 85, № 20. P. 10582-10597. https://doi.org/doi:10.1128/JVI.00671-11
121. Gao W., Tamin A., Soloff A. et al. Effects of a SARS-associated coronavirus vaccine in monkeys // Lancet. 2003. V. 362(9399). P. 1895-1896. https://doi.org/10.1016/S0140-6736(03)14962-8
122. Moore J.P., Klasse P.J. COVID-19 Vaccines: “Warp Speed” Needs Mind Melds, Not Warped Minds // J. Virol. 2020. V. 94(17). P. e01083-20. https://doi.org/10.1128/JVI.01083-20
123. Wang Q., Zhang L., Kuwahara K. et al. Immunodominant SARS Coronavirus Epitopes in Humans Elicited both Enhancing and Neutralizing Effects on Infection in Non-human Primates // ACS Infect. Dis. 2016. V. 2(5). P. 361-376. https://doi.org/10.1021/acsinfecdis.6b00006
124. Wec A.Z., Wrapp D., Herbert A.S. et al. Broad neutralization of SARS-related viruses by human monoclonal antibodies // Science. 2020. V. 369(6504). P. 731-736. https://doi.org/10.1126/science.abc7424
125. Su S., Du L., Jiangcorresponding S. Learning from the past: development of safe and effective COVID-19 vaccines // Nat. Rev Microbiol. 2020. 1-9. https://doi.org/doi:10.1038/s41579-020-00462-y
126. Zhang B., Zhou X., Zhu C. et al. Immune Phenotyping Based on the Neutrophil-to-Lymphocyte Ratio and IgG Level Predicts Disease Severity and Outcome for Patients With COVID-19 // Front. Mol. Biosci. 2020. V. 7. 157. https://doi.org/10.3389/fmolb.2020.00157
127. Tetro J.A. Is COVID-19 receiving ADE from other coronaviruses? // Microbes Infect. 2020. V. 22(2). P. 72-73. https://doi.org/10.1016/j.micinf.2020.02.006
128. Monto A.S., Malosh R.E., Petrie J.G., Martin E.T. The doctrine of original antigenic sin: separating good from evil // J. Infect. Dis. 217. V. 215. P. 1782-1788. https://doi.org/10.1093/infdis/jix173
129. Kim J.H., Skountzou I., Compans R., Jacob J. Original antigenic sin responses to influenza viruses // J. Immunol. 2009. V. 183. P. 3294-301. https://doi.org/10.4049/jimmunol.0900398
130. Супотницкий М.В. Слепые пятна вакцинологии. М.: 2016.
Supotnitsky M.V. Blind spots of vaccinology. Moscow: 2006. (in Russian).
131. Zuo Y., Estes S., Ali R.A. et al. Prothrombotic autoantibodies in serum from patients hospitalized with COVID-19// Sci Transl Med. 2020. eabd3876. https://doi.org/10.1126/scitranslmed.abd3876
132 Bastard P., Rosen L.B., Zhang Q. et al. Autoantibodies against type I IFNs in patients with life- threatening COVID-19 // Science. 2020. V. 370, Is. 6515., eabd4585. https://doi.org/10.1126/science.abd4585
Об авторе
Федеральное государственное бюджетное учреждение «27 Научный центр» Министерства обороны Российской Федерации, 105005, Российская Федерация, г. Москва, Бригадирский переулок, д. 13. Супотницкий Михаил Васильевич. Главный специалист, канд. биол. наук, ст. науч. сотр.
Контактная информация: 27nc_1@mil.ru
Контактное лицо: Супотницкий Михаил Васильевич; 27nc_1@mil.ru
COVID-19 Pandemic as an Indicator of «Blank Spots» in Epidemiology and Infectious Pathology
Federal State Budgetary Establishment «27 Scientific Centre» of the Ministry of Defence of the Russian Federation, Brigadirskii Lane 13, Moscow 105005, Russian Federation
The COVID-19 (Coronavirus Disease 2019) pandemic revealed many «blank spots» in epidemiology at that very moment when humanity became confident that all epidemic disasters had remained in the distant past. The aim of this article is to study COVID-19 pandemic as an indicator of «blank spots» in epidemiology and infectious pathology. The article substantiates that the COVID-19 epidemic started much earlier than it was identified and recognized in China. The failure to establish the primary natural reservoir of SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) among vertebrates suggests an expansion of searches for invertebrates. The reasons for the global spread of SARS-CoV-2 may be the presence of numerous unidentified primary and secondary natural foci of the virus among animals living close to humans, the high transmissibility of the virus and its presymptomatic transmission. High transmissibility of SARS-CoV-2 is possible because: the binding energy of S1 protein of the virus with its receptor ACE2 is higher than that of viruses of closely related species; the virus penetrates into the endosomes of the cells more efficiently; because of the work of the replication-transcription complex, which counteracts the innate protective response of cells. The presymptomatic transmission of SARS- CoV-2, which has become the main reason for the pandemic spread of SARS-CoV-2, is a consequence of the late detection of the virus by the innate immune system. Infected individual becomes contagious first, and then the specific symptoms of the disease appear. It is suggested in the article, that the COVID-19 pandemic is not an independent event caused by the emergence of a «new virus» (like one more flu pandemic), but a manifestation of a more complex and dangerous phenomenon, i.e. a change of the phase of the centuries-old global pandemic cycle, when, due to the increase in the density of immunodeficient populations weakened by various pathologies (chronic diseases, accumulation of genetic defects, aging, etc.) and aggravated social problems, non-cyclic pandemics and cyclical low-contagious epidemics are replaced by cyclical ones caused by highly contagious pathogens. SARS-CoV-2 is not the last in these events. The severe clinical course of COVID-19 is caused by such poorly understood phenomena as «imbalance» of renin-angiotensin-aldosterone system, cytokine storm, septic course of the disease, the patient's genetic factors and immunopathology, developed during the infectious process (antibody- dependent enhancement enhancement of infection, antigenic imprinting, antiphospholipid syndrome and other factors). Filling these «blank spots» will catalyze a research revolution in epidemiology and infectious pathology.
Keywords: Atypicalpneumonia; coronavirus; interspecies transmission; pathogenesis; presymptomatic transmission; rennin-angiotensin-aldosterone system, RAAS; sepsis; COVID-19; SARS-CoV-2.
For citation: Supotnitskiy M.V. COVID-19 Pandemic as an Indicator of «Blank Spots» in Epidemiology and Infectious Pathology // Journal of NBC Protection Corps. 2019. V. 4. № 3. P. 338-373. https://doi.org/10.35825/2587-5728-2020-4-3-338-373
Conflict of interest statement
The author declares that the research was conducted in the absence of any commercial or financial relationship that could be construed as a potential conflict of interest.
Peer review information
The article has been peer reviewed by two experts in the respective field. Peer reviews are available from the Editorial Board and from Russian Science Citation Index database.
References
See P. 366-372
Author
Federal State Budgetary Establishment «27 Scientific Centre» of the Ministry of Defence of the Russian Federation. Brigadirskii Lane 13, Moscow 105005, Russian Federation.
Mikhail Vasilyevich Supotnitskiy. Senior Researcher. Chief Specialist. Candidate of Biological Sciences.
Contact information: 27nc_1@mil.ru Contact person: Mikhail Vasilievich Supotnitskiy; 27nc_1@mil.ru
[1] Название нового вируса и вызванной им болезни определено ВОЗ 11.02.2020 г. следующим образом: возбудитель болезни - коронавирус тяжелого острого респираторного синдрома 2 (severe acute respiratory syndrome coronavirus 2, SARS-CoV-2). Болезнь - коронавирусное заболевание 2019 (Coronavirus Disease 2019, COVID-19). Распространение SARS-CoV-2 с указанием количества заболевших (с подтвержденным диагнозом), выздоровевших, находящихся на лечении и погибших по странам отражается в реальном времени на ресурсе Университета Джонса Хопкинса (США) - Coronavirus COVID-19 Global Cases by Johns Hopkins CSSE. URL: https://gisanddata.maps.arcgis.com/apps/opsdashboard/index.html%23/bda7594740fd40299423467b48e9ecf6 (дата обращения: 29.02.2020).
[2] Согласно англоязычной текстовой базе данных медицинских и биологических публикаций «PubMed», только за март-июнь было опубликовано 47762 научные статьи, которые прямо или косвенно имеют отношение к нынешней пандемии COVID-19. Ничего подобного в научном и медицинском сообществах никогда ранее не наблюдалось (Богин В. Неразгаданные загадки COVID-19: чего ученые по-прежнему не знают о корона- вирусе // Forbes. 15.07.2020. URL: https://yandex.ru/turbo/s/forbes.ru/tehnologii/404811-nerazgadannye-zagadki-covid-19-chego-uchenye-po-prezhnemu-ne-znayut-o-koronaviruse ; дата обращения: 20.07.2020).
[3] Подробно об истории изучения коронавирусов и их таксономии можно прочитать в работе М.Ю. Щелканова с соавт [3].
[4] Временные рекомендации Минздрава России по профилактике и лечению COVID-19 приведены на сайте ведомства и постоянно обновляются. См. URL: https://minzdrav.gov.ru/news/2020/10/26/15277-minzdravom-rossii-utverzhdeny-obnovlennye-vremennye-metodicheskie-rekomendatsii-profilaktika-diagnostika-i-lechenie-novoy-koronavirusnoy-infektsii-covid-19-devyataya-versiya-dokumenta-soderzhit-ryad-vazhnyh-izmeneniy-v-tom-chisle-kasayuschiesya-diagnostiki-marshrutizatsii-patsientov-s-covid-19-i-organizatsii-ambulatornogo-lecheniya. (дата обращения: 10.08.2020).
[5] Более подробно об обнаружении SARS-CoV-2 можно прочитать в работах китайских ученых, открывших вирус [15, 16]. Эти ученые дали ему первоначальные названия WH-Human 1 и 2019-nCoV соответственно.
[6] См. Detectan el SARS-CoV-2 en aguas residuales recogidas en Barcelona el 12 marzo de 2019. URL: https://www.ub.edu/web/ub/es/menu_eines/noticies/2020/06/042.html (дата обращения: 10.08.2020).
[7] См. Nieves J.N. Un cientifico britanico afirma que el coronavirus no vino de China, sino que «ha estado aqui siempre» // ABC ciencia. 2020. 07.07. URL: https://www.abc.es/ciencia/abci-cientifico-britanico-afirma-coronavirus-no-vino-china-sino-estado-aqui-siempre-202007062051_noticia.html?ref=https:%2F%2Finosmi.ru%2Fsocial%2F20200710%2F247734996.html (дата обращения: 10.08.2020).
[8] Kelland K. Italy sewage study suggests COVID-19 was there in December 2019. Reuters. Health News. June 19, 2020. URL: https://www.reuters.com/article/us-health-coronavirus-italy-sewage/italy-sewage-study-suggests-covid-19-was-there-in-december-2019-idUSKBN23Q1J9 (дата обращения: 10.08.2020).
[9] Coronavirus, primi due casi in Italia «Sono due cinesi in vacanza a Roma» Sono arrivati a Milano il 23 gennaio. URL: https://www.corriere.it/cronache/20_gennaio_30/coronavirus-italia-corona-9d6dc436-4343-11ea-bdc8-faf1f56f19b7.shtml (дата обращения: 10.08.2020).
[10] «Первый канал» российского телевидения в ноябре 2019 г. сообщил о вспышках тяжелой пневмонии сразу во Владимирской, Самарской и Оренбургской областях, в Ростове-на-Дону, Ульяновске и Красноярске, из-за которых были закрыты школы на карантин. В представленном сюжете, по крайней мере, один пациент подключен к аппарату экстракорпоральной мембранной оксигенации (ЭКМО). URL: https://www.1tv.ru/news/2019-11-19/375932-vspyshka_pnevmonii_zafiksirovana_v_orenburgskoy_oblasti (дата обращения: 12.08.2020). Почти в каждой российской семье известны случаи быстро развивающихся и не поддающихся лечению смертельных пневмоний у родственников или знакомых, произошедших в этот период. Их тогда невозможно было объяснить иначе, как в рамках диагноза «внебольничная пневмония».
[11] Ситуация была очень серьезной, если Редфилда «вызвали на ковер» в Конгресс. Редфилд не углублялся в детали, что понятно, тогда SARS-CoV-2 еще не был идентифицирован. Но после его идентификации в КНР в эту историю вмешалась антикитайская политика. В США возникла конспирологическая теория, что якобы SARS-CoV-2 создан китайскими учеными и распространился по миру, «вырвавшись» из лаборатории в Китае. Первый англоязычный твит, в котором она изложена, опубликован в американских социальных сетях 20.01.2020 г. См. URL: https://www.washingtonpost.com/outlook/2020/04/02/yes-russia-spreadscoronavirus-lies-they-were-made-america/ (дата обращения: 02.04.2020). Позже эти обвинения были предъявлены КНР официально. См. Walcott J. How the Trump-China Rivalry Has Hampered U.S. Intelligence on COVID-19 // Time. 2020. May 1. URL: https://time.com/5830420/trump-china-rivalry-coronavirus-intelligence/ (дата обращения 10.05.2020). В самих же США постарались о летней вспышке не вспоминать. Но в глобальной сети сохранилась видеозапись выступления Редфилда перед конгрессменами: URL: https://twitter.com/zlj517/status/1238111898828066823?fbclid=IwAR1-J9ndyOxnzYer-RfnnLLqZbNUdzjJd9qKLhd1cxMwBf9k3CmNzzsCN8A (дата обращения: 20.03.2020).
[12] Внебольничная (внегоспитальная) пневмония (ВП) – собирательный термин, означающий пневмонию, развившуюся вне лечебного учреждения или в течении 48 ч после госпитализации.
[13] В западной эпидемиологии широко распространено представление, что эпидемии начинаются с «нулевого пациента». Оно основывается на популярном в позднем средневековье учении о контагии, изложенном в 1546 г. Джироламо Фракасторо (1483–1553) в книге «О контагии, контагиозных болезнях и лечении». Фракасторо считал, что единственная причина чумы – «специфический яд (контагий), который выходит вроде испарины из тела больных, распространяется в воздухе только на самых малых расстояниях; но взамен того, прилипает ко всем вещам и предметам; что некоторые из них могут сохранять в себе чумной яд до тридцати и больше лет и, следовательно, такие вещи и предметы могут быть переносимы на безграничные пространства, и послужить к заражению целых городов» [23]. Открытые в XIX в. и в начале ХХ в. Патогенные бактерии и вирусы прекрасно «состыковывались» с учением о контагии. Психологически они воспринимались учеными как тот же контагий, но теперь стало ясно, что это живой организм («contagium vivum»), а не «яд», и что его можно получать в большом количестве и изучать в лабораторных условиях. По этой причине учение о природной очаговости возбудителей инфекционных болезней, развиваемое в России, а потом и в СССР Д.К. Заболотным (1866–1929), Е.Н. Павловским (1884–1965) и другими русскими учеными, на Западе долгое время не воспринималось серьезно, «contagium vivum» объяснял все или почти все в эпидемиологии.
[14] Подробно критика искусственного происхождения SARS-CoV-2 представлена в работе K.G. Andersen et al. [31].
[15] См. карту. URL: https://en.wikipedia.org/wiki/COVID-19_pandemic_in_Italy (дата обращения: 01.09.2020).
[16] Пептидаза – протеолитический фермент, катализирующий гидролитическое отщепление концевых аминокислот от молекул белков; по механизму действия различают дипептидазу, карбоксипептидазу, аминопептидазу и т.п. ACE2 – это карбоксипептидаза, аналог ACE, случайно выполняющий роль рецептора для SARS-CoV-2.
[17] С помощью удвоения генов появляется новая информация в геноме вида и меняется его эволюционная траектория. Удвоение генов сыграло ключевую роль в развитии позвоночных на Земле [35].
[18] И ACE, и ACE2 действуют как цинковые металлопептидазы, но обладают различной субстратной специфичностью, определяя их различные и уравновешивающие роли в работе ренин-ангиотензиновой системы.
[19] Экзоны (от англ. ex(pressi)on – выражение) – первичные генетические единицы, перекомбинация которых приводит к возникновению в ходе эволюции новых генов и, соответственно, новых белков.
[20] Конвергентная эволюция – появление в ответ на сходно направленное селективное давление одинаковых специализаций в независимых друг от друга эволюционных линиях. В качестве примера можно привести положение глаз у полуводных животных разных таксонов: бегемотов, крокодилов и лягушек.
[21] Трофозоит (англ. Trophozoite) – вегетативная метаболически активная форма амебы.
[22] См. Морозов А. Последняя ниша для смертельных вирусов // Независимая газета. 2015. No 221 (6552), 14 октября. URL: http://www.ng.ru/science/2015-10-14/9_nisha.html (дата обращения: 10.09.2020).
[23] Неконструктивно отрицать как «умозрительную идею» возможность поддержания и распространения коронавирусов простейшими организмами только на основании того, что «в литературе это не описано». Целесообразно самим смоделировать эти процессы в лабораторных условиях по аналогии с экспериментами с реовирусом человека, опубликованными M. Folkins с соавт. [48], а не ожидать, когда такие эксперименты проведут и опишут в США, как это получилось с возбудителем чумы [см. 40 и 41]. О том, какие фундаментальные открытия обещает данное направление в эпидемиологии, можно узнать из работы G. Yoshikawa с соавт. [49].
[24] CD147 –внеклеточная металлопротеиназа матрикса, продукт гена человека BSG. Представляет собой белок плазматической мембраны, экспрессируемый во многих типах клеток, включая гематопоэтические, эпителиальные, эндотелиальные клетки и лейкоциты. Входит в суперсемейство иммуноглобулинов, члены которого играют важную роль в межклеточном распознавании, которое принимает участие в активации и функциональном истощении Т-клеток при COVID-19 [53].
[25] Более вероятно, что у SARS-CoV-2 они проявятся под действием направленного отбора (например, применения лекарственных препаратов, нацеленных на взаимодействие ACE2 с S-белком вируса). В генетике растений такое явление называется фенологическим полиморфизмом. Применительно к пандемии COVID-19 оно может проявиться снижением доминирования в эпидемических цепочках штаммов SARS-CoV-2, взаимодействующих с ACE2, и ростом эпидемической значимости штаммов вируса, предпочитающих другие рецепторы.
[26] Конвертазы пропротеина – это семейство белков, активирующих другие белки. Многие белки неактивны, когда они впервые синтезируются, потому что они содержат цепочки аминокислот, блокирующих их активность. Конвертазы пропротеина удаляют эти цепи и активируют белок. Типичной конвертазой пропротеина является фурин.
[27] Сериновые протеазы (сериновые эндопептидазы, КФ 3.4.21) – группа ферментов, катализирующих процесс деградации (протеолиз) белков на составляющие их молекулы α-аминокислот посредством гидролиза пептидной связи. Основное отличие от других протеаз – наличие в своем активном центре аминокислоты серина.
[28] Связанный с мембраной фурин подвергается посттрансляционному процессингу с образованием растворимой формы фермента.
[29] TMPRSS2 экспрессируется в легочной ткани и субсегментарных ветвях бронхов. Снижение синтеза TMPRSS2 в дыхательных путях снижает тяжесть патологии легких после инфицирования SARS-CoV и MERS-CoV. TMPRSS2 более широко экспрессируется в тканях человека, чем ACE2 [58].
[30] В активации S-белка предполагаются участие еще не установленных протеаз, так как блокирование известных полностью блокирует проникновение в клетку SARS-CoV, но не SARS-CoV-2 [56].
[31] Величина ENc у структурных генов SARS-CoV-2 была ниже, чем у таких же генов SARS-CoV и MERS-CoV. Более подробно о данном методе см.: Codon usage bias. https://en.wikipedia.org/wiki/Codon_usage_bias (дата обращения: 10.09.2020).
[32] Nsp2 – белок с ММ 65 кДа, имеет минимальную идентичность или сходство последовательностей среди различных групп коронавирусов. Функция не понятна, но варианты SARS-CoV с нефункционирующим мутантным геном nsp2 демонстрируют снижение пикового титра на 90 % и снижение синтеза вирусной РНК на 50 % [65].
[33] Nsp 3 – самый крупный белок, кодируемый геномом CoV. Средняя ММ ~200 кД, состоит из 1922 аминокислот, формирует восемь независимых доменов. Организация доменов различна для разных родов CoV [66]. Nsp3 является ключевым компонентом репликационно-транскрипционного комплекса. Из мембран эндоплазматического ретикулума он формирует двухмембранные везикулы, противодействующие врожденному защитному ответу хозяина, высвобождает Nsp1, Nsp2 и др. Более подробно см. в работе J. Lei с соавт. [67].
[34] Аминокислоты, содержащие полярные группы, сильно взаимодействующие с водой, называют гидрофильными аминокислотами (Asp, Gly, Lis, His, Arg, Gly, Ser, Thr). Такие аминокислотные звенья обычно располагаются на поверхности частиц белка. Аминокислоты, имеющие неполярные боковые заместители, не несут парциальных зарядов и не сольватируются заметно водой (проявление гидрофобности) – глицин и аланин. Они преимущественно располагаются внутри белковой молекулы, сводя тем самым к минимуму их соприкосновение с водой. То есть замена полярной (гидрофильной) аминокислоты на неполярную (гидрофобную)серьезно сказывается на конформации белковой молекулы.
[35] Врожденный иммунитет – способность организма обезвреживать чужеродный и потенциально опасный биоматериал (микроорганизмы, трансплантат, токсины, опухолевые клетки, клетки, инфицированные вирусом), существующая изначально, до первого попадания чужеродного биоматериала в организм. Система врожденного иммунитета намного более эволюционно древняя, чем система приобретенного иммунитета,и присутствует у всех видов растений и животных.
[36] Вернее, правильное понимание этих симптомов, например, чувство усталости в конце рабочего дня, боли в мышцах и др.
[37] Процент заразившихся SARS-CoV-2 медицинских работников с самого начала пандемии был необычно высок: от 5,2% в Китае, до 13,5% в Испании (данные на середину марта 2020 г.) [74]. В России, по официальным данным на 23.09.2020 г., заразилось более 71 тыс. российских медицинских работников, погибли 258 медработников, болевших COVID-19 (URL: https://vademec.ru/news/2020/09/23/minzdrav-ot-covid-19-umerli-258-medrabotnikov/ ; дата обращения: 24.09.2020). По неофициальным – погибло 733 медработника (URL:https://www.sites.google.com/view/covid-memory/home; дата обращения: 15.10.2020).
[38] Грипп // ВОЗ. Информационный бюллетень от 31 марта 2018 г. См. URL: https://www.who.int/ru/news-room/fact-sheets/detail/influenza-seasonal (дата обращения: 25.08.2020).
[39] См. Kupferschmidt K. Study claiming new coronavirus can be transmitted by people without symptoms was flawed // Science. 2020. Feb. 3, 5:30 PM. URL: https://www.sciencemag.org/news/2020/02/paper-non-symptomatic-patient-transmitting-coronavirus-wrong (дата обращения: 09.10.2020). Однако в Китае решили не полагаться на западных авторитетов и уже 6 февраля 2020 г. Национальная комиссия здравоохранения Китая обновила План профилактики и контроля COVID-19 (4-е издание) для управления близкими контактами, сделав упор на выявление и карантин бессимптомных лиц (COVID-19 Prevention and Control Plan, 4th edition (National Health Commission of the People's Republic of China, 2020). URL: https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf (дата обращения: 09.10.2020).
[40] Полимеразная цепная реакция с обратной транскрипцией (англ. reverse transcription polymerase chain reaction) - представляет собой метод амплификации специфического фрагмента РНК.
[41] R0 – показатель передаваемости вируса, представляющий собой среднее количество новых случаев передачи инфекции, вызванных инфицированным человеком в неимунной популяции. При R0>1 число инфицированных, вероятно, увеличится, а при R0 <1 передача, вероятно, прекратится. Индекс репродукции – это центральное понятие в эпидемиологии инфекционных заболеваний, указывающее на риск инфекционного агента в отношении распространения эпидемии.
[42] Petrosillo N., Viceconte G., Ergonul O. et al. COVID-19, SARS and MERS: are they closely related? // Clin. Microbiol. Infect. 2020. V. 26(6). P. 729–734. См. https://pubmed.ncbi.nlm.nih.gov/32234451/ (дата обращения: 10.09.2020).
[43] Ген IFN-гаммаR1 кодирует рецептор гамма-интерферона 1. Ген расположен в регионе хромосомы 6q22q23. Мутантный ген IFN-гаммаR1 обычно обнаруживают у родственников в семьях больных туберкулезом [84]. В зависимости от типа наследования (рецессивного и доминантного) и этнической принадлежности человека, носителя мутации, меняется клиника инфекционной болезни и уменьшаются шансы на возможность эффективной терапии. Установлено, что полная инактивация гена IFN-гаммаR1 приводит к развитию летальной лепроматоидной BCG-инфекции после вакцинации вакциной BCG [85].
[44] Когда эта статья готовилась к печати, появились сообщения, что пациенты, заболевшие COVID-19 во время второй волны, умирают быстрее: с начала пандемии и до августа смерть пациента в среднем наступала через 13 сут после появления первых симптомов коронавируса. Сейчас этот срок сократился до одной недели. См. Chalmers V. The SAGE files: Papers presented to Government claim Covid-19 is mutating, London ISN'Tseeing a spike in cases but patients are dying FASTER in the second wave than they did in the first. URL: https://www.dailymail.co.uk/news/article-8873281/SAGE-files-Covid-19-mutating-London-ISNT-seeing-spike-cases-like-cities.html (дата обращения: 24.10.2020).
[45] Вначале пандемии многие врачи считали, что COVID-19 - просто очередная разновидность ОРЗ и сравнивали его с гриппом по симптомам и летальности, но, как оказалось, это совсем не одно и то же.
[46] Ангиотензиноген -α-2-глобулин, состоит из 453 аминокислот, постоянно присутствует в крови, субстрат РААС, но сам в этой системе физиологически неактивен. Имеются экспериментальные доказательства его участия в регулировании ожирения и стеатоза печени [98].
[47] Ренин (от лат. ren - почка) - эндопептидаза (протеолитический фермент, расщепляющий пептидную связь внутри пептидной цепи). Вырабатывается юкстагломерулярными клетками в стенках артериол почечных клубочков, откуда поступает в кровь и лимфу. Расщепляет пептидную связь «-Лейцин-|-Х-(где Х - любая другая аминокислота)». Ангиотензин расщепляется ренином на N-конце молекулы.
[48] Рецептор AT 1 участвует в реализации наибольшего числа установленных физиологических и патофизиологических функций Ang II (вазоконстрикция, повышение давления крови, повышение сократимости сердца, сосудистая и сердечная гипертония, реабсорбция Na+, ингибирование выделения ренина, стимуляция синтеза альдостерона, клеточный рост, пролиферация, воспалительные реакции и оксидативный стресс).
[49] Фиброз – патологический процесс, характеризующийся ускоренным процессом выработки коллагена и разрастанием соединительных тканей в любых органах тела вследствие воспалительного процесса.
[50] ACE2 гидролизует только Ang II. Каталитическая эффективность ACE2 в 400 раз выше в отношении ангиотензина II в качестве субстрата, чем в отношении ангиотензина I. Другие пептиды – Ang I, Ang 1–9, Ang 1–7 и Ang 1–5 – плохо гидролизуются или вообще не гидролизуются ACE2. ММ Ang-(1–7)= 899,02 г/моль; H-Asp-Arg-Val-Tyr-Ile-His-Pro-OH [99]. Но есть еще один гептапептид, образующийся из Ang II под действием аминопептидазы А – Ang III. Он образуется путем отщепления от Ang II N-концевого аспарагилового остатка: H-Arg-Val-Tyr-lle-His-Pro-Phe-OH (MМ 931 г/моль). Ang III обладает меньшим сосудосуживающим эффектом, чем Ang II, не более 40% от его активности, но сохраняет 100%-ю активность в отношении альдостерона. Под действием фермента аминопептидазы Ang III расщепляется до 6 аминокислот и образует Ang IV. Он менее активен, чем Ang III как сосудопрессор, но имеет широкий спектр активности в ЦНС.
[51] Рецептор Mas экспрессируется в эпителии и гладких мышцах бронхов, в коре головного мозга, базальных ганглиях, в дофаминергических нейронах и глиальных клетках и др. Более подробно о его роли в РААС можно прочитать в работе A. Povlsen с соавт. [100].
[52] Для прозрачного обмена данными между странами и научными коллективами (так декларируется) о роли генома человека в развитии клинических проявлений COVID-19 и распространении самой эпидемии, в США начаты несколько программ сбора генетической информации:
«COVID-19 Платформа генетической инициативы» (англ. «COVID-19 Host Genetics Initiative») – объединяетгенетическое сообщество для генерирования, обмена и анализа данных для изучения генетических детерминант восприимчивости, тяжести и исхода COVID-19. Более подробно см. [102];
«COVID Генетические усилия человека» (англ. «COVID Human Genetic Effort») – должна выявить критические цепи, вовлеченные в патогенез тяжелой формы COVID-19 и искать, регистрировать и изучать людей, которые не были инфицированы SARS-CoV-2, несмотря на неоднократное воздействие (например, в семье пациента с тяжелым пневмонитом), что подтверждается отсутствием как заболевания, так и специфических титров антител против вируса. Более подробно см. https://www.covidhge.com/about (дата обращения: 20.09.2020).
[53] Дислипидемия – патологическое состояние, обусловленное нарушением обмена жиров в организме и приводящее к развитию атеросклероза. Сосудистые стенки уплотняются, просвет сосудов сужается, нарушается кровообращение во внутренних органах, что заканчивается ишемией сердечной мышцы или мозга, гипертонией, инсультом или инфарктом.
[54] Ими использовалась технология секвенирования РНК одной клетки (single-cell RNA sequencing technology, scRNA-Seq). См. URL: https://en.wikipedia.org/wiki/Single_cell_sequencing (дата обращения: 25.05.2020).
[55] Таблица, разумеется, неполная даже с позиций уже имеющихся данных. Помещая ее в эту работу, я стремился только обратить внимание на проблему связи генетических особенностей человека и тяжестью течения COVID-19. Желающим получить более полные сведения по данному направлению исследований рекомендую работы С. Ovsyannikova [94] и С. Anastassopoulou с соавт. [103].
[56] Алармины («предсмертные записки клетки») - это группа эндогенных молекул с различной структурой, пассивно высвобождающихся из некротизированных клеток или активно секретирующихся нейтрофилами. Это мощные иммуностимуляторы, включая дефенсины, кателицидин, нейротоксин, полученный из эозинофилов, и белок 1 с высокой мобильностью. По первоначальным представлениям, служили в качестве сигналов раннего предупреждения для активации врожденной и адаптивной иммунной систем, отсюда такое название [112].
[57] В России предложили рассматривать COVID-19 как составляющую многокомпонентного нециклического, пандемически протекающего, перманентного инфекционного процесса, не контролируемого иммунной системой, см. Г.М. Бушманова с соавт. [115].
[58] См. работу М.А. Карнаушкиной с соавт. [114].
[59] Имеется в виду скрыто протекающая пандемия эндогенного сепсиса, вызванного герпесвирусами – пандемии эндогенного, первично-хронического сепсиса (П-ХС) [116].
[60] Такая реакция характерна для простейших, реагирующих на вторжение патогенов в их сообщества. Она предполагает призыв на помощь, так как среди простейших организмов те сигнальные молекулы, которые с антропоцентрической точки зрения мы рассматриваем как провоспалительные цитокины и хемокины, играют роль аттрактантов [39].
[61] Трактовка иммунитета на уровне учебника для четвертого класса «Окружающий мир» (М.: 2017. С. 58) хороша для школьников начальных классов, но она не должна нас устраивать в связи с уже очевидной опасностью этой эпидемии.
[62] Определять IgG в крови и включать в «иммунологический паспорт» какие-то количественные показатели (например, титр антител), конечно, можно, но как быть с тем, что эти буквенные обозначения (от G до D) отражают не их функции, а всего лишь физико-химические свойства?
[63] Феномен ADE заключается в усилении инфекционного процесса специфическими к возбудителю инфекционной болезни IgG. Такие антитела образуют комплексы с возбудителем инфекционной болезни посредством Fс-фрагмента антитела и взаимодействуют либо со специфическим к Fc-фрагменту рецептором (Fc- receptor, FcR), либо с рецептором комплемента (complement receptor, CR) на поверхности фагоцитирующих клеток. Происходит не только усиление инфекционного процесса в результате размножения микроорганизма в фагоцитирующих клетках, но и изменение тропности коронавируса. SARS-CoV на начальной стадии инфекционного процесса не инфицирует моноциты/макрофаги, связываясь с рецептором ACE2 в нижних отделах легких [117-120].
[64] Они пока и не отличаются. Еще в 2003 г. Gao W. с соавт. создали три вектора на платформе Ad5, экспрессировавшие оптимизированные по кодонам структурные антигены штамма SARS-CoV Urbani, включая фрагмент S1 S-белка, мембранный белок и нуклеокапсидный белок. Вакцины показали хорошие сероконверсию и протективный эффект на 6 обезьянах [121]. Таких оптимистичных работ было опубликовано много, но к 2020 г. ни одной вакцины ни против SARS-CoV, ни против MERS-CoV зарегистрировано не было [122].
[65] Cуть феномена антигенного импринтинга заключается в следующем. При повторном контакте иммунной системы с патогенным микроорганизмом и/или антигенами вакцины, различия между старым вариантом эпитопа антигена и его новым вариантом могут быть «незамеченными» иммунной системой примерно так, как в оптический прибор не различаются детали, выходящие за пределы его разрешающей способности. И тогда в процессе антигенной стимуляции первыми активизируются В-клетки памяти, «запомнившие» предыдущий антиген. Далее они дифференцируются в плазмоциты, продуцирующие антитела в отношении этого антигена, хотя иммунная система с ним не контактирует. Образующиеся антитела не способны эффективно нейтрализовать возбудитель инфекционной болезни, выработка же специфических к нему антител тормозится из-за подавления «наивных» В-клеток активизировавшимися В-клетками памяти. Как заметили J. H. Kim с соавт. [129], в данном случае В-клетки памяти формируют «слепое пятно» («blind spot») иммунной системы. Правило Бернета соблюдается, но при антигенной дистанции между штаммами (серотипами,серовариантами) возбудителя инфекционной болезни, превышающей размеры «слепого пятна» иммунной системы [120].
[66] В России в 2012 г. было издано «Руководство по проведению доклинических исследований лекарственных средств (иммунобиологические лекарственные препараты): В 2 частях. Ч. 2 / Под ред. А. Н. Миронова; ФГБУ «НЦЭМСП» Минздравсоцразвития России. М.: Гриф и К, 2012. 536 с. В разделе «Феномен антителозависимого усиления инфекции при доклиническом изучении иммунобиологических лекарственных препаратов» приведён алгоритм исследования феномена ADE в клеточной культуре и в экспериментах с животными. Аналогичный раздел есть и по антигенному импринтингу. Это первое в мире руководство по доклиническим исследованиям иммунобиологических препаратов, рассматривающее данные проблемы.
[67] Внеклеточные ловушки нейтрофилов (англ. Neutrophil extracellular traps, NET) представляют собой сети внеклеточных волокон, в основном состоящие из ДНК нейтрофилов, которые связывают патогены. Образуются в результате нетоза (англ. NETosis) – вид программируемой клеточной гибели, происходящей у нейтрофилов.

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2020, covid-19, эпидемиология

