Генотерапевтические векторные системы на основе вирусов
Основным объектом при проведении экспертизы на возможность медицинского применения генетических конструкций на основе вирусов, предназначенных для введения генов в геном человека, являются получаемые биотехнологическим путем структуры, имитирующие в организме человека поведение вирусной частицы, но не вызывающие инфекционный процесс. В их состав входят: белки вируса, формирующие оболочку частицы, способную к узнаванию клеток-мишеней и к интернализации в цитоплазму; и трансген-экспрессирующая кассета, осуществляющая после доставки в клетку длительную экспрессию одного или нескольких генов. Распространение в практике генной терапии наследственных и инфекционных болезней приобрели векторные системы на основе лентивирусов, аденовирусов, аденоассоциированных вирусов, ортопоксвирусов, герпесвирусов и отдельных РНК-вирусов, не относящихся к ретровирусам. Достигнутый уровень генной инженерии позволяет создавать векторные системы, нацеленные на разные типы клеток и участки генома человека (векторы на основе ВИЧ). Векторные системы, полученные на основе лентивирусов и аденоассоциированных вирусов, способны интегрировать трансген-экспрессирующую кассету с геномом клеток-мишеней. Псевдотипирование векторов с гликопротеинами оболочки вируса бешенства придает им способность ретроградно транспортировать трансгены по нейрональным аксонам в ЦНС. Для изменения тропизма векторных систем исследователями используются несколько приемов: физический таргетинг, заключающийся в покрытии вирусной частицы специальной оболочкой, изменяющей ее природный тропизм и делающей ее неузнаваемой для иммунной системы человека; и генетическая модификация вируса, предполагающая модификацию белков оболочки вектора. Повышение эффективности транскрипции трансгена в клетке-мишени достигается путем транскрипционального таргетинга, предполагающего введение в трансген-экспрессирующую кассету специфических для данных тканей промоторных последовательностей.
Библиографическое описание: Супотницкий М.В. Генотерапевтические векторные системы на основе вирусов // Биопрепараты. - 2011. - № 3. - С. 15-26.
The main objects of performing the expertise of the possibility of medical application of genetic constructions based on viruses, developed for inserting genes into human genome, are structures derived by biotechnologies, imitating virus particle behavior, but not causing infectious process. They content of viral proteins, forming the particle's coat, able to recognize target-cells and to internalize into cytoplasm; and transgene expression cassettes, performing longtime expression of one or more genes after being delivered to a cell. In gene therapy of hereditary and infectious diseases vector systems based on lentiviruses, adenoviruses, adeno-associated viruses, orthopoxvirus, herpesviruses and single RNA- viruses, which do not relate to retroviruses are widespread. The achieved level of gene engineering allows to create vector systems, aimed at different cell types and parts of human genome (vectors, based on HIV). Vector systems, derived based on lentiviruses and adeno-associated viruses are able to integrate transgene expression cassette into target cells genome. Pseudotyping of vectors with lyssavirus glycoproteins coat provides them with a capability to retrograde transportation of transgenes to CNS by neuronal axons. For the purpose of changing vector systems tropism the scientists use few methods: physical targeting, which means covering virus particle with a special coat, changing it's natural tropism and making it incognoscible for human immune system; and virus genetic modification, which means modifying proteins of vector cover. Increasing of transgene transcription efficacy in a target-cell is performed by transcriptional targeting, which means inserting specific for the given tisues promotor sequences into transgene expression cassette.
Bibliographical description: Supotnitskiy M.V. Genotherapeutic vector systems based on viruses // Biopreparats (Biopharmaceuticals). - 2011. - No. 3. - P. 15-26.
Генная терапия наследственных и инфекционных болезней предполагает доставку генов в клетки-мишени. Но ни ДНК, ни РНК не могут быть использованы в «голом виде» для достижения этой цели. Сахарофосфатный остов молекул нуклеиновых кислот располагается по их периферии полярными группами наружу, придавая им анионные свойства. При физиологических значениях рН нуклеиновая кислота несет отрицательный заряд, отталкивающий ее от отрицательно заряженной наружной поверхности клеточной мембраны. Еще одно ограничение при проникновении в клетку нуклеиновой кислоте создает ее гидро- фильность. Все ее гидрофобные основания «повернуты» вовнутрь молекулы, поэтому она не может проникнуть через гидрофобный барьер клетки-мишени. В сыворотке крови нуклеиновая кислота быстро деградирует под воздействием нуклеаз. Период полужизни немодифицированной интерферирующей РНК в сыворотке крови укладывается в 5 - 60 мин, для ДНК - он составляет не более 10 мин. Кроме того, нуклеиновые кислоты не способны специфически узнавать клетки-мишени [25]. Поэтому для доставки генов в эукариотические клетки, с начала 1980-х гг. разрабатываются векторные генетические конструкции. В настоящее время сформировалось два альтернативных направления их создания - на основе вирусов и на основе искусственных векторных систем. Цель работы - анализ подходов к конструированию генотерапевтических векторных систем на основе вирусов. Данная публикация представляет собой начало цикла статей, посвященных способам и средствам, используемым при доставке генов в геном человека в рамках технологий генной терапии наследственных и инфекционных болезней.
Ретровирусные векторные системы. Ретровирусы относятся к группе вирусов, РНК-геном которых в инфицированных клетках конвертируется в ДНК. Геном ретровирусов включает три структурных гена, обозначенные как gag, pol и env, фланки- рованых элементами, названными длинными терминальными повторами (LTR, viral long terminal repeat). В LTR содержатся регуляторные элементы, выполняющие важные функции в жизненном цикле ретровируса. Эти повторы необходимы для интеграции ДНК копии генома вируса с геномом хозяина. Они определяют, где начало и где конец вирусного генома. LTR также служат энхансер-промоторными последовательностями, т.е. они контролируют экспрессию генов вируса. Большой геном ретровирусов облегчает генетические манипуляции.
После инфицирования клетки-мишени копия ретровирусной ДНК интегрируется с ее геномом строго определенным образом. Практически все инфицированные клетки способны экс- прессировать гены, привнесенные вирусом. Мощные транскрипционные энхансеры существенно повышают уровень экспрессии генов, клонированных в клетках различных типов. С их помощью можно переместить до 8 т.п.о., что в большинстве случаев более чем достаточно для синтеза крупномолекулярных белков. Весьма удобным для исследователя является то обстоятельство, что ретровирусные векторы можно размножать, достигая их высокой концентрации в небольшом объёме - более 109 вирусных частиц/см3. В опытах по инфицированию ретровирусами мозга, печени, мышц, глаз или клеток панкреатических островков грызунов показана устойчивая экспрессия трансгенов в течение более 6 мес. [9]. Ранние этапы жизненного цикла ретровирусов и векторов на их основе показаны на рис. 1.
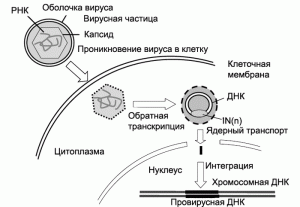 Рис. 1. Ранние этапы жизненного цикла ретровирусов и векторов на их основе. Проникновение ретровируса в клетку сопровождается освобождением капсида от его оболочки и началом синтеза двуцепочечного ДНК-генома (провируса) на матрице вирусной РНК с помощью РНК-зависимой ДНК-полимеразы (обратной транскриптазы), входящей в состав вирусного нуклеокапсида. Затравкой (праймером) этой многоступенчатой реакции служит клеточная тРНК (для большинства MuLV - пролиновая тРНК), комплементарная PBS- участку, расположенному в 5'-концевой части вирусной РНК. Конечным продуктом полимеразной реакции является двуцепочечный ДНК-провирус, содержащий все вирусные гены и фланкированный 3'- и 5'-LTR. Вирусная ДНК, интеграза (IN) и отдельные вирусные и клеточные белки образуют вирусный преинтеграционный комплекс, который импортируется во внутрь ядра. IN катализирует интеграцию вирусной ДНК с ДНК генома клетки. По [18].
Рис. 1. Ранние этапы жизненного цикла ретровирусов и векторов на их основе. Проникновение ретровируса в клетку сопровождается освобождением капсида от его оболочки и началом синтеза двуцепочечного ДНК-генома (провируса) на матрице вирусной РНК с помощью РНК-зависимой ДНК-полимеразы (обратной транскриптазы), входящей в состав вирусного нуклеокапсида. Затравкой (праймером) этой многоступенчатой реакции служит клеточная тРНК (для большинства MuLV - пролиновая тРНК), комплементарная PBS- участку, расположенному в 5'-концевой части вирусной РНК. Конечным продуктом полимеразной реакции является двуцепочечный ДНК-провирус, содержащий все вирусные гены и фланкированный 3'- и 5'-LTR. Вирусная ДНК, интеграза (IN) и отдельные вирусные и клеточные белки образуют вирусный преинтеграционный комплекс, который импортируется во внутрь ядра. IN катализирует интеграцию вирусной ДНК с ДНК генома клетки. По [18].
Векторы на основе ретровирусов с самого начала их разработки предназначались для введения через неповрежденные клетки за счет механизмов слияния, обеспечиваемых поверхностными белками оболочки вируса. Чувствительность дыхательного эпителия к ретровирусным инфекциям подразумевает возможность ингаляционного пути введения в организм человека векторных конструкций на основе ретровирусов. Сравнение свойств наиболее распространенных генотерапев- тических векторных систем приведено в табл. 1.
Таблица 1. Сравнение свойств наиболее распространенных генотерапевтических векторных систем
|
Характеристика |
Гамма- ретровирусные (MLV, FLV и др.) |
Лентивирусные (ВИЧ-1 и ВИЧ-2, FIV, CAEV, EIAV, JDV, MVV и др.) |
Аденовирусные (Ad) |
Вирус герпеса первого типа (HSV-1) |
Адено- ассоциированный вирус (AAV) |
Плазмидная ДНК (в искусственной векторной системе) |
|
Максимальный размер вставки, т.п.о. |
7-7,5 |
7-7,5 |
До 30 |
До 30 (на основе рекомбинантного вируса), до 150 т.п.о на основе ампликона |
3,5-4,0 |
Неограничен |
|
Концентрация (количество вирусных частиц в мл) |
>108 |
>108 |
>1011 |
До 108(на основе ампликона) |
>1012 |
Неограничена |
|
Схема доставки генов |
Ex vivo |
Ex/in vivo |
Ex/in vivo |
In vivo |
Ex/in vivo |
Ex/in vivo |
|
Интеграция с ДНК реципиента |
Возможна |
Возможна |
Невозможна |
Невозможна для ампликонов |
Возможна/ Невозможна |
Маловероятна |
|
Продолжительность экспрессии in vivo |
Короткая |
Продолжительная |
Короткая |
Короткая |
Продолжительная |
Короткая |
|
Стабильность |
Хорошая |
Не проверялась |
Хорошая |
Нестабилен |
Хорошая |
Очень хорошая |
|
Легкость приготовления |
Пилотные установки размером 20-50 л |
Неизвестно |
Легко масштабируется |
Неизвестно |
Трудно очищать от клеточных фрагментов и масштабировать производство |
Легко получать в больших количествах |
|
Иммунологические проблемы |
Незначительны |
Незначительны |
Серьезны |
Незначительны для ампликонов |
Неизвестны |
Нет |
|
Наличие иммунитета у реципиента |
Маловероятно |
Маловероятно, за исключением больных СПИДом |
Возможно |
Возможно |
Возможно |
Невозможно |
|
Проблемы безопасности |
Инсерционный мутагенез? |
Инсерционный мутагенез? |
Воспалительный ответ, токсичность |
Незначительны для ампликонов |
Воспалительный ответ, токсичность |
Преодолимы в рамках подбора нетоксичных компонентов системы |
Критическим ограничением использования гамма- ретровирусных векторов в генотерапевтических процедурах является их неспособность инфицировать неделящиеся клетки, т.е. ткани мышц, мозга, лёгких и печени. Вирусный преинте- грационный комплекс этих векторов, ответственный за интеграцию вирусной кДНК в геном клетки, имеет слишком большие размеры, чтобы проникать через поры в оболочке клеточного ядра. Такая возможность ему предоставляется только при дезагрегации оболочки клеточного ядра во время митоза. В качестве других недостатков специалисты отмечают генетическую нестабильность гамма-ретровирусных векторов, проявляющуюся делециями или точковыми мутациями. Способностью проникать через поры мембраны ядра без митоза, обладают представители другого семейства ретровирусов - лентивирусы [14].
Лентивирусы инфицируют как делящиеся, так и не делящиеся клетки. Наиболее изученным лентивирусом является ВИЧ. Он рассматривается как потенциальный вектор для переноса генов в условиях in vivo. Подобно простым ретровирусам, геном ВИЧ включает гены структурных белков gag, pol и env, и гены шести регуляторных белков, названных tat, rev, vpr, vpu, nef и vif. Гены отдельных белков могут быть убраны из генома вируса без снижения его способности к размножению и инфицированию клеток. Концепция построения современных лентивирусных векторных систем доставки генов в организм млекопитающих, представлена на рис. 2.
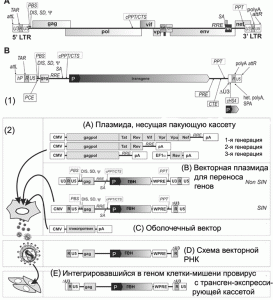 Рис. 2. Лентивирусная векторная система для доставки генов в организм млекопитающих. 1. Лентивирусный вектор в сравнении с ВИЧ. А. Схематическое изображение провируса ВИЧ-1. B. Лентивирусный вектор. Типичные для ВИЧ cis-активирующиеся элементы маркированы выше схематического изображения вектора. Ниже приведены примеры дополнительных модификаций вектора, позволяющих повысить титр вируса и/или экспрессию его отдельных генов.
Рис. 2. Лентивирусная векторная система для доставки генов в организм млекопитающих. 1. Лентивирусный вектор в сравнении с ВИЧ. А. Схематическое изображение провируса ВИЧ-1. B. Лентивирусный вектор. Типичные для ВИЧ cis-активирующиеся элементы маркированы выше схематического изображения вектора. Ниже приведены примеры дополнительных модификаций вектора, позволяющих повысить титр вируса и/или экспрессию его отдельных генов.
2. Пакующая система. A. Плазмида, несущая пакующую кассету (packaging vector plasmid). B. Векторная плазмида для переноса генов (transfer vector plasmids). C. Оболочечный вектор (envelope vector). D. Схема векторной РНК. E. Интегрировавшийся с геномом клетки-мишени провирус с трансген-экспрессирующей кассетой. По [17].
Сборка (упаковка) лентивирусного вектора происходит в так называемых упаковывающих клетках. Они представляют собой перевиваемые клетки, в которых осуществляется синтез вирусспецифических белков. Пакующая система таких клеток включает как минимум три типа экспрессирующих кассет (пакующая, векторная и оболочечная), ни одна из которых без участия других кассет не может «собрать» вирусную частицу, способную проникать в клетку-мишень. В то же время их одновременная экспрессия не приводит к образованию ретровирусных частиц, вызывающих инфекционный процесс у человека.
Пакующая система работает следующим образом. Введенная в пакующие клетки в составе плазмиды (packaging vector plasmid) пакующая кассета под контролем промотора цитоме- галовируса (CMV-промотора) экспрессирует гены ВИЧ, необходимые для формирования инфицирующей вирусной частицы. Но из кассеты исключен ген env, кодирующий белки-предшественники оболочки ВИЧ (Env), определяющие его способность выходить за пределы клетки. Первые лентивирусные векторные системы, разработанные в 1996 г, содержали в пакующих кассетах гены регуляторных белков ВИЧ (Vpu, Vpr, Vif, Nef, Rev, Tat). При дальнейшем усовершенствовании векторной системы из пакующих кассет были удалены гены регуляторных белков ВИЧ, LTR, а также последовательности, кодирующие пакующий сигнал (у) и праймерсвязывающий сайт (PBS). Это позволяло избежать случайную упаковку полной мРНК ВИЧ в вирусную частицу. Векторы второй генерации включали только гены Tat- и Rev-белков. Третья (современная) генерация пакующих систем включает обычно две плазмиды: одна кодирует Gag- и Gag-pol-белки (Gag формируют сердцевину ВИЧ, Pol - его ферментную систему соответственно); вторая - Rev-белок (избирательно активирует синтез структурных белков вируса и обеспечивает экспорт из ядра длинных молекул вирусной РНК).
Векторная плазмида (transfer vector plasmids) содержит кассету, экспрессирующую мРНК, включающую все cis- активирующиеся элементы и последовательности, кодирующие пакующий сигнал. Такие плазмиды содержат трансген-экспрессирующую кассету с геном, предназначенным для экспрессии в новом хозяине, и находящимся под контролем внутреннего промотора, обычно позиционированного между 3'-Tat/Rev SA-сайтом и 3'-LTR. Для формирования оболочки векторной вирусной частицы в систему включен оболо- чечный вектор (envelope vector). Он содержит кассету, определяющую синтез гликопротеинов оболочки вируса. Образующиеся в таких системах вирусные частицы являются своего рода инфекционным ретровирусом одноразового действия. При заражении ими клеток-мишеней, не содержащих экспрессирующийся ретровирусный провирус, способный выполнять транс-функции, осуществляется тот же порядок событий, что и при заражении обычным вирусом вплоть до образования интегрировавшегося провируса. Однако, так как вектор не содержит структурных вирусных генов gag, pol и env, образования вирусных частиц не происходит. Клетки-мишени, содержащие экспрессирующийся интегрированный вектор, не могут передавать незараженным клеткам гены по горизонтали, приобретенные в составе вектора. В то же время интегрировавшийся вектор передается дочерним клеткам по наследству, т.е. по вертикали. Поскольку процесс переноса генов с помощью рекомбинантных ретровирусных частиц заканчивается на клетках-мишенях, а вирусный вектор не распространяется дальше, подобно тому, как это происходит в случае репликационно-компетентных вирусов, то принято говорить не об инфекционном переносе, а о трансдукции генов в составе вектора [1]. Схема переноса генов с использованием ретровирусных векторов показана на рис. 3.
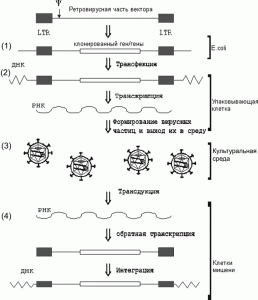 Рис. 3. Схема переноса генов с использованием ретровирусных векторов. 1. Клонирование гена в ДНК ретровирусного вектора (transfer vector plasmids - см. рис. 2) с помощью стандартных генно- инженерных методов. На данном этапе вектор ведет себя как обычный плазмидный вектор. Амплификация ДНК вектора и селекция осуществляются в клетках E. rnli. 2. Перенос высокоочищенной ДНК ретровирусного вектора в упаковывающие клетки. 3. Формирование ретровирусных частиц и их выход в культу- ральную среду. Сбор культуральной среды упаковывающих клеток, концентрирование ретровирусов. 4. Трансдукция гена в составе ретровирусного вектора в клетки-мишени. По [1].
Рис. 3. Схема переноса генов с использованием ретровирусных векторов. 1. Клонирование гена в ДНК ретровирусного вектора (transfer vector plasmids - см. рис. 2) с помощью стандартных генно- инженерных методов. На данном этапе вектор ведет себя как обычный плазмидный вектор. Амплификация ДНК вектора и селекция осуществляются в клетках E. rnli. 2. Перенос высокоочищенной ДНК ретровирусного вектора в упаковывающие клетки. 3. Формирование ретровирусных частиц и их выход в культу- ральную среду. Сбор культуральной среды упаковывающих клеток, концентрирование ретровирусов. 4. Трансдукция гена в составе ретровирусного вектора в клетки-мишени. По [1].
Ретровирусные (лентивирусные) векторы можно перенацеливать на разные типы клеток и разные участки генома человека. Первая задача решается благодаря псевдотипированию вируса. Смысл этого методического приема в следующем. Так как из лентивирусной векторной системы удален ген env ВИЧ, то оболочечный вектор (см. выше) может содержать ген, направляющий синтез гетерологичного гликопротеина. Он включается в частицы вируса пакующей системой вместо собственного гликопротеина. Такие вирусы называют псевдотипированными (pseudotyping) или вирусами-обманщиками. Они имеют ряд преимуществ перед ВИЧ, если рассматривать их с точки зрения использования в качестве векторных систем: 1) увеличивают безопасность вектора вследствие удаления последовательностей, гомологичных вирусу дикого типа; 2) расширяют или изменяют тропизм векторного вируса в отношении клеток- мишеней; 3) улучшают стабильность синтезированных вирусных частиц на этапах концентрирования, хранения и применения. В зависимости от используемого в пакующей системе гликопротеина, формируются различные псевдотипы вируса [17].
Например, химерный гликопротеин RD114, полученный благодаря слиянию трансмембранного и внеклеточного доменов гликопротеина эндогенного ретровируса кошачьих (feline endogenous virus RD114) с цитоплазматическим доменом гликопротеина амфотропного вируса MLV 4070A[1], позволяет псевдотипированному вектору эффективно трансдуцировать мезенхимальные стволовые клетки (mesenchymal stem cells, MSCs) с очень низкой цитотоксичностью [31].
Лентивирусные векторы, псевдотипированные с гликопротеинами оболочки вируса бешенства (PV-штамм), приобретают тропность к нейрональной ткани и способность к ретроградному транспорту в условиях in vivo. Введенный в периферическом участке нервной системы псевдотипированный лентивирусный вектор по нейрональным аксонам доставил трансгены в ЦНС [6]. Подробно стратегия использования таких векторов для целей генотерапии, описана в работах [4, 7, 17, 27]. В табл. 2 обобщены сведения по мишеням псевдотипированных лентивирусов.
Таблица 2. Клетки и органы — мишени для псевдотипированных лентивирусов*
|
Мишень |
Гликопротеин |
Преимущество |
|
Печень |
VSV-G |
Снижена токсичность вектора |
|
LCMV |
Снижена токсичность вектора, уменьшена воспалительная реакция на его введение |
|
|
RRV |
Приобретен тропизм к клеткам печени, не являющимся гепатоцитами — Купферовым клеткам |
|
|
SeV-F |
||
|
Легкие |
Гликопротеины вируса Эбола |
Трансдукция апикальной поверхности эпителия дыхательных путей |
|
Гликопротеины вируса Марбурга |
||
|
SeV-F и HN |
||
|
JSRV |
||
|
Островки Лангерганса поджелудочной железы |
LCMV |
Снижена токсичность вектора |
|
ЦНС |
VSV-G |
Нацеливание вектора преимущественно на нейроны |
|
LCMV |
Нацеливание вектора на астроциты |
|
|
Вирус бешенства |
Нацеливание вектора на предшественники/стволовые клетки нейрональной ткани |
|
|
Вирус Mokola (один из членов семейства Lyssavirus, вызывающих бешенство) |
Ретроградный транспорт вектора из периферической нервной системы в ЦНС |
|
|
Ретроградный (от синапса к телу нейрона) и антиретроградный (от тела нейрона к синапсу) транспорт вектора в пределах ЦНС |
||
|
Сетчатка глаза |
VSV-G |
Трансдукция фоторецепторов и ретинального пигментного эпителия |
|
Вирус Mokola |
Специфичность ограничена ретинальнальным пигментным эпителием |
|
|
Миоциты/мышцы |
Вирус Mokola |
Трансдукция кардиомиоцитов плода (in utero) |
|
Вирус Эбола |
То же |
|
|
Гематопоэтическая система |
RD114 |
Более эффективен и менее токсичен, чем VSV-G |
|
GALV |
Увеличение стабильности вектора в сыворотке |
|
|
Раковые клетки |
GALV |
Веретенообразный (fusogenic) гликопротеин |
|
LCMV |
Избирательность для клеток глиомы |
* По [4].
Нацеливание вектора на клетку еще не означает транскрипции доставленного в эту клетку гена. Для того чтобы транскрипция трансгена в клетке-мишени была эффективной, генотерапевтами разработаны методы транскрипционального таргетинга (transcriptional targeting), предполагающие введение в такие векторы специфических для данных тканей промоторных последовательностей. Примеры таких промоторов, используемых в тканеспецифических лентивирусных векторах, приведены в табл. 3.
Таблица 3. Селективные тканеспецифические промоторы, используемые в лентивирусных векторах*
|
Ткань-мишень |
Промотор |
Источник промотора |
Свойство, приобретенное вектором |
|
Ретинальная ткань |
Мышиный CD44 |
Ген, кодирующий трансмембранный гликопротеин и клеточный поверхностный рецептор для гиалуроновой кислоты |
Активен в глиальных мюллеровских клетках (glial Muller cells) |
|
Человеческий и мышиный GFAP |
Ген, кодирующий человеческий и мышиный глиальный фибриллярный кислый белок |
Активен в глиальных мюллеровских клетках |
|
|
Мышиный VIM |
Ген, кодирующий виментин (vimentin) — главный субъединичный белок промежуточных нитей соединительных тканей и других тканей мезодермального происхождения |
То же |
|
|
IRPB1783 |
Ген, кодирующий интерфоторецепторретиноидсвязывающий белок |
Активен в колбочках сетчатки глаза |
|
|
GCAP292 |
Ген, кодирующий гуанилциклазоактивирующий белок 1 |
То же |
|
| Нервная ткань |
m0P500 |
Ген родопсина |
Активен в палочках сетчатки глаза |
|
CamKII |
Ген, кодирующий кальций/кальмодулин-зависимую протеинкиназу II |
Активен в нейронах переднего мозга взрослого человека |
|
|
SYN |
Ген синапсин 1-фосфопротеина |
Активен в отдельных регионах гиппокампа |
|
|
NSEp |
Ген, кодирующий нейронспецифическую энолазу |
Активен в стриатуме (полосатое тело) и гиппокампе | |
|
GfaABC1D |
Ген глиального фибриллярного кислого белка |
Активен в глии ЦНС |
|
|
Бета-клетки |
Инсулин |
Ген инсулина человека |
Активен в бета-клетках и линиях клеток мышиной инсулиномы |
|
Печень |
ALB |
Ген альбумина |
Активен в гепатоцитах |
|
ЕТ |
Синтетический промотор |
Более активен, чем ALB; минимальная активность в селезенке |
|
|
ApoA-II |
Ген человеческого аполипопротеина А-II |
Индуцибелен |
|
|
альфа1-AT |
Ген человеческого альфа1-антитрипсина |
Активен в гепатоцитах |
|
|
Система кроветворения |
WASp |
Ген, кодирующий белок Wiskott-Aldrich-синдрома |
Активен в Т-клетках, В-клетках дендритных клеток |
|
Tie2 |
Ген, кодирующий расположенный на поверхности клетки рецептор ангиопоэтина |
Активен в эндотелиальных клетках и моноцитах |
|
|
Промоторы: анкирин-1, альфа-спектрин, бета-глобин, дзета-глобин; энхансеры: GATA-1, бета-глобин LCR, интрон I8, альфа-глобин HS40, гамма-глобин интрон |
Эритроид-специфические гены |
Активен в эритроидных линиях |
|
|
HLA-DRальфа |
Ген, кодирующий альфа-субъединицу человеческого лейкоцитарного антигена DR |
Активен в антигенпрезентирующих клетках |
|
|
proximal lck |
Ген, кодирующий специфический Т-клеточный протоонкоген, lck |
Активен в Т-клетках |
|
|
Сердце |
ANF |
Ген, кодирующий человеческий атриальный натрийуретический фактор |
Активен в кардиомиоцитах |
|
MLC2v |
Ген, кодирующий легкую цепь человеческого вентрикулярного миозина |
Активен в кардиомиоцитах | |
|
Легкие |
SP-C |
Ген сурфанктантного белка С второго типа альвеолярных эпителиальных клеток (АТ-2 клетки) |
Активен в АТ-2 клетках |
|
Простата |
PSAp |
Ген, кодирующий специфический антиген простаты |
Не известно |
*По [17].
Перенацеливание ретровирусных векторов с одних участков генома человека на другие стало возможным благодаря выяснению механизмов интеграиии провируса с геномом человека. Интеграция ретровирусной ДНК с геномом клетки-мишени катализируется вирусным ферментом — интегразой (см. рис. 1). Однако этот фермент не специфичен и интеграция провируса не носит специфический характер. Тем не менее, у различных ретро- вирусов обнаружены «предпочтения» в сайтах для интеграции провирусной ДНК. По таким предпочтениям ретровирусы можно разделить на три группы. К первой относятся ВИЧ-1, ВИЧ-2, SIV и FIV. До 70% ДНК их провирусов интегрируются с функционирующими генами (transcription units). Вторая группа включает MLV и FV. Они «предпочитают» 5'-концы транскрипционных единиц и CpG-островки. Третья группа представлена ретрови- русами ASV, HTLV-1 и MMTV - у них не обнаружено никаких «предпочтений» [18].
О том, какое значение имеет участок интеграции провируса в развитии неинфекционной патологии, говорит накопленный опыт применения ретровирусных векторов для лечения детей с Х-связанным тяжелым комбинированным иммунодефицитом (X-linked severe combined immunodeficiency, SCID-X1). Например, у четырех детей из одиннадцати, которым в терапевтических целях вводили вектор на основе MLV, развилась Т-клеточная лейкемия. В последующем было установлено, что, по крайней мере, у двух детей клональная экспансия Т-клеток была вызвана вставкой вектора в Lin-1 -, Isl-1-, Mec-3(LIM)- домены протоонкогена only-2 (LMO2) и его активацией через энхансеры вектора, содержащиеся в LTR [8].
В первом десятилетии текущего века наиболее распространенным подходом к нацеливанию ретровирусного вектора на участки в геноме человека было использование в составе вирусной частицы слитых белков, образующих вирусный преинтеграционный комплекс, импортирующийся во внутрь нуклеуса. Такие белки включают IN-белок, полученный из ВИЧ-1 или ASV; и ДНК-связывающие последовательности клеточных и бактериальных белков, слитых с N- или C-концом IN. Что бы вирус не утратил инфекционности, слитые белки вводят в вирион ВИЧ-1 вместе с исходным IN (wild-type IN). Одна из используемых моделей нацеливания ретровирусных векторов на конкретные участки ДНК в геноме человека (таргетинговой интеграции), показана на рис. 4.
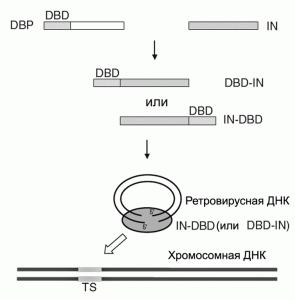 Рис. 4. Модель таргетинговой интеграции ретровирусных векторов. Интеграция осуществляется посредством использования модифицированной интегразы, слитой с гетерологичными ДНК-связывающими доменами. DBD -ДНК-связывающий домен (DNA-binding domain); IN - интеграза. TS - белок, образовавшийся в результате слияния DBD и IN. Преинтеграционный комплекс интегрируется с участком хромосомной ДНК (target site, TS), узнаваемым DBD. По [18].
Рис. 4. Модель таргетинговой интеграции ретровирусных векторов. Интеграция осуществляется посредством использования модифицированной интегразы, слитой с гетерологичными ДНК-связывающими доменами. DBD -ДНК-связывающий домен (DNA-binding domain); IN - интеграза. TS - белок, образовавшийся в результате слияния DBD и IN. Преинтеграционный комплекс интегрируется с участком хромосомной ДНК (target site, TS), узнаваемым DBD. По [18].
Для увеличения специфичности геномного таргетинга, белок интегразы (IN) был слит с полидактил-цинк-пальчиковым белком E2C (polydactyl zinc finger protein E2C), связывающимся с уникальной последовательностью в геноме человека размером 18 т.п.о. Вирус, содержащий белок E2C, слитый с C-концом IN, в семь раз чаще интегрировался с хромосомой вблизи E2C- связывающего сайта, чем исходный. Этот же белок, слитый с N-концом IN, показал более чем десятикратное предпочтение в интеграции с E2C-связывающим сайтом, чем исходный IN [18]. И хотя эффективность таргетинговой интеграции пока ниже, чем у вирусов с диким типом IN, эти эксперименты свидетельствуют о сформировавшемся направлении таких исследований, способном серьезно повлиять на технологии соматической генотерапии.
В последние годы в практике генной терапии стали использовать лентивирусные векторы, дефицитные по интегразе (integration-deficient lentiviral vectors, IDLVs). Их геном содержит мутантный ген IN, продукт которого не способен обеспечить интеграцию лентивируса с геномом человека. Вектор поддерживается в трансдуцированной клетке в виде кольцевой эписомы, не имеющей репликационного сигнала. В процессе деления клетки эписома утрачивается, однако стабильно сохраняется в неделящихся клетках. Такие векторы считаются более безопасными, чем интегрирующиеся (рис. 5).
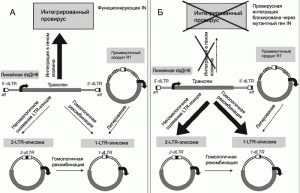 Рис. 5. Образование эписомы из лентивирусного вектора. В результате обратной транскрипции РНК-вектора в клетке формируется линейная двуцепочечная ДНК (linear double- stranded DNA, dsDNA) с LTR на обоих концах. У самоинактиви- рующихся векторов LTR содержат делеции в и3-регионе (на схеме показана как dLTR). Эта ДНК импортируется в ядро как часть вирусного преинтеграционного комплекса. А. Традиционный лентивирусный вектор, включающий функционирующую IN, интегрируется с геномом как провирус. Однако в клетке он может поддерживаться и в кольцевой форме. Для этого у линейной двуцепочечной ДНК провируса есть, по крайней мере, две возможности: через негомологичное сшивание LTR-концов, образуя 2-ЦТО-эписому; или через лигирование «ников» (молекул с однонитевыми разрывами - показаны стрелками с кружками) - образуя 1-LTR-эписому. В. Когда провирусная интеграция блокирована через мутантный IN, в ядре клетке возрастает количество векторных эписом. По [28].
Рис. 5. Образование эписомы из лентивирусного вектора. В результате обратной транскрипции РНК-вектора в клетке формируется линейная двуцепочечная ДНК (linear double- stranded DNA, dsDNA) с LTR на обоих концах. У самоинактиви- рующихся векторов LTR содержат делеции в и3-регионе (на схеме показана как dLTR). Эта ДНК импортируется в ядро как часть вирусного преинтеграционного комплекса. А. Традиционный лентивирусный вектор, включающий функционирующую IN, интегрируется с геномом как провирус. Однако в клетке он может поддерживаться и в кольцевой форме. Для этого у линейной двуцепочечной ДНК провируса есть, по крайней мере, две возможности: через негомологичное сшивание LTR-концов, образуя 2-ЦТО-эписому; или через лигирование «ников» (молекул с однонитевыми разрывами - показаны стрелками с кружками) - образуя 1-LTR-эписому. В. Когда провирусная интеграция блокирована через мутантный IN, в ядре клетке возрастает количество векторных эписом. По [28].
Однако вызывает серьезное опасение неоднозначность целей подобных исследований. Помимо изощренности в «нацеливании» лентивирусных векторов на клетки и органы-мишени, и, даже, на участки генома человека, критические для его здоровья, для получения псевдотипированных лентивирусов, используются гликопротеины оболочки вирусов, считающиеся потенциальными агентами биологического оружия (вирусы геморрагических лихорадок Эбола, Марбурга, Росс-Ривер и др.). Последнее свидетельствует о том, что работа с лентивирусными векторами, предназначенными для лечения редких наследственных болезней у обывателей-инвалидов, ведется в лабораториях по уровню биологической безопасности пригодных для исследования традиционных агентов биологического оружия. Одновременно проводятся эксперименты по изучению возможности массового применения таких конструкций, например, путем их использования в аэрозолированном состоянии (см. опыты по трансдукции апикальной поверхности эпителия дыхательных путей; табл. 2).
К июню 2011 г. 20,5% протоколов экспериментов по генной терапии в мире (из 1714) предполагали использование векторов на основе ретровирусов. Их по популярности среди генных терапевтов «перегнали» только векторы на основе аденовирусов - 23,7% (www.wiley.co.uk/genmed/clinical/).
Векторные системы на основе аденовирусов. Аденовирусы - ДНК-вирусы, способные инфицировать оба типа клеток (делящиеся и неделящиеся), включая клетки печени, легких и эпителия. Они реплицируются в ядре инфицированной клетки как эписомные (экстрахромосомные) элементы. По связыванию со специфическими сыворотками аденовирусы разделены на 51 серотип. На основе их способности агглютинировать эритроциты у людей, кроликов и мышей; и по онкогенности для грызунов их подразделяют еще на 6 подтипов или субгрупп (от A до F). Исследование филогении аденовирусов дает дополнительные основания для их деления внутри субгрупп. Субгруппа В дополнительно разделена на субгруппы B1 и B2 [23]. Аденовирусы разных субгрупп поражают различные органы и ткани человека. Например, вирусы субгрупп B1, C и E главным образом вызывают респираторные болезни. Вирусы субгрупп B, D и E способны поражать ткани глаза. Субгруппа вирусов F вызывает гастроэнтериты. Вирус субгруппы B2 инфицирует почки и уринарный тракт [21]. В табл. 4 обобщены сведения по тропизму аденовирусов различных субгрупп.
Таблица 4. Тропизм аденовирусов различных субгрупп *
|
Субгруппа |
Серотип |
Преобладающий тропизм |
Известные рецепторы узнавания |
|
А |
12, 18, 31 |
ЖКТ |
CAR |
|
B1 |
3, 7, 16, 21, 50 |
Респираторная система |
CD46, CD80/86, рецептор X, HSPG |
|
B2 |
11, 14, 34, 35 |
Почка |
CD46, CD80/86, рецептор X, HSPG |
|
C |
1, 2, 5, 6 |
Респираторная система |
CAR, HSPG, MHC-I, VCAM-I, интегрины |
|
D |
8, 9, 10, 13, 15, 17, 19, 20, 22 - 30, 31, 33, 36 - 39, 42 - 49, 51 |
Ткани глаза |
CAR, сиаловые кислоты, CD46 |
|
E |
4 |
Респираторная система, ткани глаза |
CAR |
|
F |
40, 41 |
ЖКТ |
CAR |
Исследования по созданию на основе аденовирусов векторов, предназначенных для использования в целях генотерапии, активизировались с начала 1990-х гг. Этому способствовали следующие обстоятельства:
1) ДНК-вирусы рассматривались исследователями как более простые объекты для генно-инженерных манипуляций, чем вирусы с РНК-геномом;
2) ДНК-вирусы реплицируются в неделящихся клетках, например, клетках мышц.
Конструирование векторов на основе аденовирусов во многом повторяло путь, пройденный создателями лентивирусных векторов. Дефектные по репликации аденовирусы получали посредством замены гена Е1, который необходим для репликации, на ген, представляющий интерес для исследователя и энхансер-промоторный элемент. Такие рекомбинантные векторы способны эффективно размножаться в пакующих клетках, экспрессирующих продукт гена Е1, давая более 1011-1012 аденовирусных частиц/см3 [9]. Аденовирусные векторы, неспособные к репликации вне пакующих клеток с геном Е1, используют для введения трансгенов в условиях in vivo. Они обеспечивают очень высокую экспрессию клонированных генов, но на непродолжительное время (5-10 сут) из-за противодействия иммунной системы реципиента. Возможно также и то, что клетки- мишени содержат факторы, которые усиливают синтез аденовирусных белков, приводящих к иммунному ответу. Для того чтобы обойти эту проблему, было предложено второе поколение аденовирусных векторов, у которых дополнительно к гену Е1 удалили гены, обеспечивающие репликацию вируса. Такие векторы способны к более длительной экспрессии генов, доставленных в клетку - до 40 сут [9]. Это направление исследований получило дальнейшее развитие созданием третьего поколения аденовирусных векторов («third generation») - «выпотрошенных (gut-less)» векторов, из которых были делетированы все вирусные гены и оставлены только элементы, определяющие начало и конец генома, и вирусную пакующую последовательность. Их емкость для клонируемой ДНК - до 35 т.п.о. [26]. Трансгены, переносимые такими векторами, экспрессировались в течение 84 сут [9]. При экспрессии аденовирусными векторами чужеродных генов могут использоваться эукариотные промоторы, такие как аденовирусный Ela-промотор, прямой ранний промотор цитомегаловируса, или LTR-промотор вируса саркомы Рауса [21]. Основные усилия разработчиков таких векторов направлены на:
1) преодоление иммунитета к аденовирусам, имеющегося практически у каждого взрослого человека;
2) изменение тропизма вектора и более точное его нацеливание на клетки-мишени.
При разработке аденовирусных векторов, способных преодолевать иммунитет к аденовирусам, обычно исследователями учитывается то, что у людей наиболее часто встречаются антитела к аденовирусу пятого серотипа (Ad5-антитела). Векторы, производные от аденовирусов других серотипов, способны избегать нейтрализацию этими антителами (см. табл. 4). Реже всего у людей обнаруживают антитела к аденовирусу 35-го серотипа. Гены, трансдуцированные экспериментальным животным векторами на основе вируса 35-го серотипа, способны длительно экспрессироваться, несмотря на присутствие антител к вирусу 5-го серотипа [29].
В связи с тем, что вектор в любом случае должен формировать вирусную частицу, способную узнавать «нужный» рецептор на поверхности клетки-мишени, бесконечно «упрощать» вирус и пакующую систему невозможно. Поэтому в последние годы для снижения «заметности» вируса иммунной системе, стали использовать более тонкие подходы. Например, введение точечной мутации в петлю гексонового белка AdC-вектора, отвечающую за эпитоп доминирующих нейтрализующих антител. Мутация значительно снижала способность вектора связываться с нейтрализующими антителами в условиях in vitro, но в условиях in vivo он блокировался специфическими антителами [16]. Замена всей гексо- новой петли вируса AdHu5 на такую же петлю из вируса AdHu48, предотвращает связывание вектора AdHu5- нейтрализующими антителами и позволяет эффективно использовать этот вектор для переноса генов в геном животных, в крови которых уже имеются антитела к AdHu5 [19].
Для изменения тропизма аденовирусных векторов исследователями используются две стратегии: физический таргетинг(physical targeting) и генетическая модификация вируса. Кратко они обобщены в табл. 5.
Таблица 5. Стратегии изменения тропизма аденовирусных векторов*
|
Вектор |
Модификация вектора |
Причины изменения тропизма вируса |
Тип клеток, использованных в экспериментах |
Результат |
|
Ad5-pk7 |
Введение полилизинового мотива (pK7) в «набалдашник» капсида HAd5 |
Повышенное содержание SPG на поверхности раковых клеток, способствует повышению трансдукции |
Клетки глиомы человека, пересаженные мышам |
Повышенные трансдукция и экспрессия маркера |
|
Ad5/3-RGD |
Введение в набалдашник капсида HAd5, последовательности из «набалдашника» HAd3, содержащей RGD-домен |
Повышение трансдуцирующей способности вектора в отношении раковых клеток с высоким уровнем экспрессии трансдуцированного гена |
То же |
1000-кратное увеличение инфективности |
|
CAV-2 (Ad собак) |
Изменение тропизма вектора |
Использование альтернативных рецепторов |
In vivo - респираторный тракт мышей, ex vivo - пульмонарный эпителий человека |
Эффективная трансдукция пульмонарного эпителия, «ускользание» от антител к HAd5, незначительная воспалительная реакция вместе введения вектора |
|
HAd5 |
mEGF-полимерная оболочка |
Селективная трансдукция раковых клеток, богатых EGFR |
Перитонеальная модель ксенотрансплантантов овариальных раковых клеток человека у мышей |
Ограниченные векторный тропизм и токсичность. Повышенная антираковая эффективность |
|
HAd5 |
Биспецифические антитела (Ab), нацеливающие «набалдашник» капсида Had на эндолгин человека |
Биспецифические антитела соединяют Ad с васкулярным эндолгином в ангиогенных зонах опухолей |
Преимущественно эндотелиальные клетки и HUVEC- клеточные линии |
Повышенная селективность и CAR-независимая трансдукция HUVEC |
* По [26].
Физический таргетинг заключается в том, что вирусная частица покрывается специальной оболочкой, изменяющей ее природный тропизм и делающей ее неузнаваемой для иммунной системы. В качестве такой оболочки используют полимеры (полиэтиленгликоль или poly-[N-(2-hydroxypropyl) methacrylamide, pHPMA]) или вирусную частицу включают в биодеградируемую альгинатную микрочастицу. Природный тропизм вектора заменяется селективным таргетингом (selective targeting), т.е. в эти полимеры вводятся различные таргетирующие лиганды (пептиды, белки или антитела). Другой эффективной стратегией для физического таргетинга аденовирусного вектора стало использование биспецифических адапторных молекул (биспецифические антитела или белки слияния), состоящих из двух компонентов - один из них с высокой специфичностью связывается волокнистым набалдашником (fiber knob) капсида аденовируса, другой - с высокой специфичностью связывает рецептор клетки-мишени. Однако оба подхода дают плохо воспроизводимые результаты. Поэтому физическому таргетингу исследователи сегодня предпочитают генетические модификации аденовируса, т.е. генетический таргетинг [26].
В экспериментах по генетическому таргетингу объектом модификации генно-инженерными способами обычно является волокнистый «набалдашник» капсида, играющий основную роль в специфическом узнавании Ad клеток-мишеней, и, в частности, расположенные на нем два участка: C-конец и HI-петля. Вставка в эти участки RGD или полилизина ведет к повышению инфективности аденовирусного вектора в отношении широкого круга клеток-мишеней, экспрессирующих на своей поверхности интегрины или HSPG. Кроме модификации волокнистого «набалдашника» капсида, для изменения тропизма вектора модифицируются другие оболочечные белки аденовирусов: гексон, пентон, pIX или pIII. Другой удачной схемой изменения тропизма аденовирусных векторов, производных от HAd5, стала замена волокнистого «набалдашника» капсида на аналогичную структуру, взятую из вирусов других серотипов, использующих для интернализации иные рецепторы, чем CAR. Этот прием изменения антигенной специфичности вируса близок к псевдотипированию, описанному выше на примере лентивирусных векторов [26].
Серьезным недостатком аденовирусных векторов, ограничивающих их использование в генотерапии, является неспособность к интеграции с хромосомой реципиента, в результате вектор утрачивается по мере продолжения деления клеток. Этот недостаток частично устраняется использованием векторов на основе адено-ассоциированного вируса.
Адено-ассоциированные вирусные векторы. Относительно недавно используемый для генотерапии адено-ассоциированный вирус (AAV) является простым непатогенным одноцепочечным ДНК-вирусом. Два его гена (cap и rep) расположены между двумя терминальными инвертированными повторами, определяющими начало и конец вируса, и содержат пакующую последовательность. Ген cap кодирует оболо- чечные белки вирусного капсида, а продукт гена rep обеспечивает репликацию вируса и его последующую интеграцию с геномом клетки-реципиента. AAV нуждается в дополнительных генах для своей репликации в пакующих клетках. Они обеспечиваются хэлперными вирусами (обычно это аденовирусы или вирус простого герпеса) [9] (рис. 6).
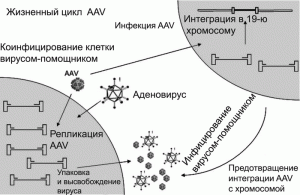 Рис. 6. Жизненный цикл AAV. AAV размножается в клетках, коинфицированных аденовирусом. В отсутствие аденовируса AAV поддерживается в латентном состоянии, интегрировав- шись с хромосомой-19 (AAVS1). Латентный AAV может стать репликационно-активным при условии суперинфицирования клетки аденовирусом. По [5].
Рис. 6. Жизненный цикл AAV. AAV размножается в клетках, коинфицированных аденовирусом. В отсутствие аденовируса AAV поддерживается в латентном состоянии, интегрировав- шись с хромосомой-19 (AAVS1). Латентный AAV может стать репликационно-активным при условии суперинфицирования клетки аденовирусом. По [5].
Трансдукция вектора в клетку-мишень происходит различными путями, включающего интеграцию с геномом хозяина, экспрессию трансдуцированных генов с линейных и кольцевых форм вируса [11], гомологичную [20] и негомологичную рекомбинацию ДНК-вектора с хромосомной ДНК [10]. Для изменения тропизма AAV используют те же приемы, что и для изменения тропизма аденовирусных векторов [5]. Исследования «предпочитаемых» сайтов интеграции AAV с геномом человека показали, что в основном они располагаются в пределах CpG- островков и в начале генов, а его рекомбинация с хромосомной ДНК человека в основном носит негомологичный характер. В отличие от ретровирусного вектора, вектор на основе AAV не содержит интегразу, и он может интегрироваться с хромосомой только при наличии в ее участках одно- и двунитевых разрывов. CpG-островки проявляют себя измененной структурой хроматина и имеют повышенную чувствительность к нуклеа- зам. В репликации ДНК они участвуют в качестве участков начала репликации с высокой вероятность появления разрывов в цепи ДНК. Этот феномен объясняет интеграционное предпочтение AAV к CpG-островкам [10].
AAV может инфицировать различные типы клеток. В присутствии продукта гена rep вирусная ДНК способна интегрироваться преимущественно с хромосомой-19 человека. В векторах, создаваемых на основе AAV, rep и cap гены замещаются на трансгены. Выход вирусных частиц составляет (1011-1012) см3. Емкость AAV-векторов не превышает 3,5-4,0 т.п.о. чужеродной ДНК, что исключает их использование для клонирования крупных генов. AAV-вектор, содержащий ДНК человеческого фактора IX, был использован исследователями для трансфецирования печени и мышц иммунокомпетентных мышей. Трансфецированные клетки продуцировали в кровь мышей терапевтические количества белка фактора IX более 6 мес. [9].
Векторные системы на основе вируса герпеса простого. Клонирующие векторы на основе вируса герпеса простого (herpes simplex virus type 1, HSV-1) имеют простую конструкцию и разработаны хуже, чем векторы на основе аденовирусов. Вирус включает более чем 80 генов, один из которых (IE3) может быть замещен с целью создания вектора. Делетированы могут быть и некоторые другие гены, что позволяет использовать вектор для клонирования нескольких трансгенов. Выход вирусных частиц составляет приблизительно (108-109) см3. Развитие таких векторов затормозили такие препятствия как:
1) непродолжительная экспрессия клонированных генов (от нескольких суток до недель);
2) их способность вызывать цито- патические эффекты и ответы со стороны иммунной системы.
Поэтому развитие получили ампликоны[2], многократно повторяющиеся последовательности HSV, включающие мономерные последовательности, организованные по типу «голова к хвосту» (конкатемеры). Мономеры включают, по крайней мере, один участок начала репликации вирусной ДНК (oriS или oriL) и последовательность для упаковки ДНК в вирусную частицу (pac). Клонирование этих двух последовательностей в бактериальную плазмиду, позволяет создать вектор, в пакующих системах упаковывающий ДНК в HSV-1 вирион. Такие векторные системы способны упаковывать до 150 т.п.н. чужеродной ДНК, что позволяет одним вектором доставлять в клетку-мишень десятки транскрипционных единиц, и в их числе гены других вирусов, не вызывая иммунных ответов и цитопатических эффектов на сам вектор. Продолжительность экспрессии клонированных генов достигает года. HSV-1 рассматривается специалистами как основной при конструировании вирусных векторов, предназначенных для генотерапии мозга [24].
Векторные системы на основе ортопоксвирусов. Ортопоксвирусы - крупные вирусы, содержащие двунитевую ДНК. Отдельные виды могут иметь либо очень широкий, либо очень ограниченный круг хозяев. Емкость поксвирусного вектора позволяет включить 25 т.п.н. чужеродной ДНК без делеций генома самого вируса Векторные системы на их основе не имеют широкого применения из-за того, что эукариотические промоторы неэффективно распознаются транскрипционными механизмами поксвирусов, и для эффективной экспрессии рекомбинантных генов в клетке-реципиенте должны быть использованы поксвирусные промоторы. Кроме того, поксви- русные транскрипты не подвергаются сплайсингу, поэтому генетический материал, клонированный в поксвирусах, должен быть в форме кДНК. Вследствие большого размера и неинфекционной природы поксвирусной ДНК, чужеродные гены клонируются в поксвирусах путем рекомбинации в условиях in vivo [2].
Неожиданным для вирусологов стало открытие у ортопоксви- русов природного тропизма к опухолевой ткани. Поэтому в настоящее время их рассматривают в качестве векторов для доставки генов в опухолевую ткань. И в этом аспекте вирус вакцины (vaccinia virus) имеет значительные преимущества перед другими вирусами, на основе которых конструируют векторы для генотерапии:
1) у него эффективный жизненный цикл; уже через 6 ч в инфицированной клетке формируются зрелые вирионы;
2) в условиях in vivo он быстро распространяется от клетки к клетке;
3) несет свои строгие промоторы, способные обеспечивать высокий уровень экспрессии трансгенов;
4) может инфицировать различные ткани человека, не вызывая патологических процессов [30].
Векторные системы на основе РНК-вирусов, не принадлежащих к семейству ретровирусов. Разрабатываются со второй половины 1990-х гг. в рамках создания новых технологий иммунизации. Для конструирования вакцин используются векторы на основе вирусов гриппа, бешенства, везикулярного стоматита, кори, респираторно-синтициальной болезни, лихорадок Синдбис, Сендай, ВЭЛ и др. Основными преимуществами таких векторных систем являются следующие:
1) в условиях in vitro возможно использовать легко селектируемые нецитопатические РНК-векторы;
2) векторы данного типа, содержащие репликон, могут длительное время экспрессировать высокие уровни гетерологичных белков и поэтому они могут рассматриваться как эффективная вакцинная векторная система;
3) векторы данного типа не содержат полного набора вирусных генов и благодаря этому не могут образовывать вирусные частицы, способные вызвать генерализованную инфекцию в других тканях; т.е. эти векторы могут удовлетворять строгим требованиям безопасности;
4) так как компоненты вектора, являющиеся производными вируса, имеют небольшой размер и не экспрессируют структурные белки, то ответ иммунной системы на вектор, вероятно, будет ограниченным. Следовательно, продолжительная экспрессия чужеродных белков, не будет приводить к цитолизу клеток;
5) благодаря тому, что РНК-вирусы утратили ДНК-фазу, они не могут интегрировать чужеродные гены в хромосомную ДНК. Это делает невозможной трансформацию клеток векторами на основе РНК-вирусов [15].
Проведенный анализ подходов к конструированию генотерапевтических конструкций (векторных систем) на основе вирусов показывает, что основным объектом при проведении экспертизы на возможность медицинского применения являются получаемые биотехнологическим путем структуры, имитирующие в организме человека поведение вирусной частицы, но не вызывающие инфекционный процесс. В их состав входят: белки, формирующие оболочку вируса, способную к узнаванию клеток-мишеней и к интернализации в цитоплазму; и трансген- экспрессирующая кассета, осуществляющая длительную экспрессию в клетке одного или нескольких генов. Наибольшее распространение в практике генной терапии наследственных и инфекционных болезней приобрели векторные системы на основе лентивирусов, аденовирусов, аденоассоциированных вирусов, ортопоксвирусов, герперсвирусов и отдельных РНК - вирусов, не относящихся к ретровирусам. Наибольшей емкостью по клонируемой ДНК обладают векторы-ампликоны на основе вируса герпеса простого (до 150 т.п.о), наименьшей (до 4 т.п.о.) - векторы на основе аденоассоциированного вируса.
Достигнутый уровень генной инженерии позволяет перенацеливать векторные системы на разные типы клеток и участки генома человека (векторы на основе ВИЧ). Векторные системы, полученных на основе лентивирусов и аденоассоциированных вирусов, способны интегрировать трансген-экспрессирующую кассету в геном клеток-мишеней. Псевдотипирование векторов с гликопротеинами оболочки вируса бешенства придает им способность ретроградно транспортировать трансгены по нейрональным аксонам в ЦНС. Для изменения тропизма векторных систем исследователями используются: физический таргетинг, заключающийся в покрытии вирусной частицы специальной оболочкой, изменяющей ее природный тропизм и делающей ее неузнаваемой для иммунной системы человека; и генетическая модификация вируса, предполагающая модификацию белков оболочки вектора. Для повышения эффективности транскрипция трансгена в клетке- мишени, разработаны методы транскрипционального тарге- тинга, предполагающие введение в трансген-экспрессирующую кассету специфических для данных тканей промоторных последовательностей. Отдельные клинические исследования терапевтической эффективности генотерапевтических конструкций на основе ретровирусов закончились гибелью пациентов из-за развившейся Т-клеточной лейкемии.
Список сокращений
AAV - аденоассоциированный вирус.
att - сайт присоединения интегразы в концевых участках про- вирусной ДНК.
attL, attR - левый и правый присоединяющие сайты.
CAEV - вирус артрита и энцефалита коз.
CAR - рецептор коксакивирусов и аденовирусов.
CD46 (белок мембранного кофактора) - повсеместно экспрес- сирующийся трансмембранный гликопротеин первого типа. Его биологическая функция заключается в предотвращении активации комплемента на аутологичные ткани через связывание и инактивацию компонентов системы комплемента.
CD80/CD86 - гликопротеины первого типа и члены Ig-суперсемейства. Экспрессируются на поверхности антиген- презентирующих клеток, включая дендритные клетки и В-лимфоциты, и действуют как костимуляторные сигналы для активации клеточно-зависимого иммунного ответа.
cHS4 - инсулятор (инсуляторы - особые регуляторные элементы, которые обладают способностью блокировать сигналы, исходящие от окружения) куриного в-глобина.
CMV - немедленный ранний промотор цитомегаловируса.
cPPT - центральный полипуриновый тракт.
CTE - конститутивный транспортный элемент.
CTS - центральная терминационная последовательность.
DBD - ДНК-связывающий домен.
DBP - ДНК-связывающий белок.
DIS - димеризационный сигнал.
DIS - димеризационный сигнал.
EGFR - рецептор эпидермального фактора роста.
EIAV - вирус инфекционной анемии лошадей.
FIV - вирус иммунодефицита кошачьих.
GALV - вирус лейкемии гиббонов.
hP - гибридный промотор.
HSPG - гепаринсульфатпротеогликаны, могут служит рецепторами для отдельных вирусов.
HSV 1 - вирус герпеса простого первого типа.
HUVEC - эндотелиальные клетки пупочной вены человека.
IN - интеграза.
JDV (Jembrana disease virus, вирус болезни Джембрана) - лентивирус, вызывающий иммунодефицит у крупного рогатого скота.
JSRV - ретровирус овец Jaagsiekte.
JSRV - ретровирус овец Jaagsiekte; вызывает у овец эпизоотический лёгочный аденоматоз.
LCMV - вирус лимфоцитарного хорименингита.
mEGF - эпидермальный фактор роста мышей.
MHC-I - главный комплекс гистосовместимости I типа, обеспечивает координацию действий различных клеток иммунной системы в подавлении инфекции.
MLV - вирус лейкемии мышей.
MVV - вирус Висна-Маэди.
P - внутренний промотор для экспрессии трансгена.
PBS - сайт связывания праймера.
PCE - пострансляционный контролирующий элемент.
polyA - гетерологичный polyA-сигнал.
polyA - полиаденилационный сигнал.
polyA (pA) - сигнал полиаденилации.
PPT - полипуриновый тракт.
PRE - посттранскрипционный регуляторный элемент.
RD114 - эндогенный ретровирус кошек, не связанный с болезнью.
RRE - Rev-отвечающий элемент.
RRV - вирус Росс Ривер.
SD - сплайсингдонорный сайт.
SeV - Сендай вирус.
SIN - самоинактивирующийся вектор.
SPA - синтетический polyA-сигнал.
SPG - сиаловые протеогликаны.
TAR - элемент трансактивационного ответа.
U3, R, и U5 установлены по последовательности РНК. Уникальная последовательность U3 расположена вблизи З'-конца РНК, U5 - в близи 5'-конца РНК. R представляет собой повтор 5' и 3' концов РНК. Сайт инициации транскрипции находится на стыке U3 и R в 5' LTR, сайт полиаденилирования находится на стыке R и U5 в 3' LTR.
VCAM-1 (васкулярная молекула клеточной адгезии 1) - белок, входящий в суперсемейство иммуноглобулинов, участвует в адгезии лейкоцитов и эндотелиальных клеток, и в передаче сигналов.
VSV-G - гликопротеин вируса везикулярного стоматита.
WPRE - постранскрипционный регуляторный элемент вируса гепатита сурка.
AU3 - SIN-делеция в и3-регионе 3'-LTR. упакующий сигнал.
Литература:
1. Прасолов В. С., Иванов Д. С. Ретровирусные векторы в генной терапии // Вопр. мед. хим. - 2000. - № 3 .
2. Bienkowska-Szewczyk K., Szewczyk B. Expression of genes coding for viral glycoproteins in heterologous systems // Acta Biochimica Polonica. - 1999. - Vol. 46, № 2. - P. 325 - 339.
3. Boeckle S., Wagner E. Optimizing targeted gene delivery: chemical modification of viral vectors and synthesis of artificial virus vector systems // AAPS J. - 2006. - Vol. 8, № 4. - P. 731-742.
4. Cronin J., Zhang X. Y., Reiser J. Altering the tropism of lentiviral vectors through pseudotyping // Curr. Gene. Ther. - 2005. -Vol. 5. - P. 387 - 398.
5. Daya S., Berns K. I. Gene therapy using adeno-associated virus vectors // Clin. Microbiol. Rev. - 2008. - Vol. 21, № 4. - P. 583-593.
6. Federici T., KutnerR., ZhangX.Y. etal. Comparative analysis of HIV-1-based lentiviral vectors bearing lyssavirus glycoproteins for neuronal gene transfer // Genet. Vaccin. Ther. - 2009. - Vol. 7, № 1 .
7. Frecha C., Szecsi J., Cosset F. L. et al. Strategies for targeting lentiviral vectors // Curr. Gene Ther. - 008. - Vol. 8.-P. 449 - 460.
8. Hacein-Bey-Abina, S., Von Kalle C., Schmidt M. et al. LMO2- associated clonal T-cell proliferation in two patients after gene therapy for SCIDX1 [see comment] // Science. -2003. - Vol. 302.- P. 415 - 419.
9. Inder M. V., Nikunj S. Gene therapy promises, problems and prospects // Nature. - 997. - Vol. 389. - P. 239-242.
10. Miller D. G., Trobridge G. D., Petek L. M. Large-scale analysis of adenossociated virus vector integration sites in normal human cells // J. Virol. -2005. - Vol. 79. - № 17. - P. 11434 - 11442.
11. NakaiH., Storm T. A., KayM. A. Recruitment of single-stranded recombinant adeno-associated virus vector genomes and intermolecular recombination are responsible for stable transduction of liver in vivo // J. Virol. - 2000. - Vol. 74. - P. 9451 - 9463.
12. Nemunaitis J., Edelman J. Selectively replicating viral vectors // Cancer Gene Therapy. - 2002. - Vol. 9. - P. 987-1000.
13. Nemunaitis J., Edelman J. Selectively replicating viral vectors // Cancer Gene Therapy. - 2002. - Vol. 9. - P. 987-1000.
14. NienhuisA. W. Development of gene therapy for blood disorders // Blood. - 2008 - Vol. 111. - P. 4431 - 4444.
15. Palese P. RNA virus vectors: where are we and where do we need to go? // Proc. Natl. Acad. Sci. USA. - 1998. - Vol. 95, № 22. - P. 12750-12752.
16. Pichla-Gollon S. L., Lin S. W., Hensley S. E. et al. Effect of preexisting immunity on an adenovirus vaccine vector: in vitro neutralization assays fail to predict inhibition by antiviral antibody in vivo // J. Virol. - 2009. - Vol. 83. - P. 5567-5573.
17. Pluta K., KacprzakM. M. Use of HIV as a gene transfer vector // Act. Biochim. Pol. - 2009 - Vol. 56, № 4. - P. 531 - 595.
18. Rene D., Smith J. A. Integration site selection by retroviral vectors: molecular mechanism and clinical consequences // Hum. Gen. Ther. - 2008. - Vol. 19. - P. 557-568.
19. Roberts D. M., Nanda A., Havenga M.J. et al. Hexon-chimaeric adenovirus serotype 5 vectors circumvent pre-existing anti- vector immunity // Nature. - Vol. 441. - P. 239-243.
20. Russell D. W., Hirata R. K. Human gene targeting by viral vectors // Nat. Genet. - 1998. - Vol. 18. - P. 325 - 330.
21. Russell W. C. Adenoviruses: update on structure and function // J. Gen. Virol. - 2009. - Vol. 90. - P. 1 - 20.
22. Sakural F. Development and evaluation of a novel gene delivery vehicle composed of adenovirus serotype 35 // Biol. Pharm. Bull. - 2008. - Vol. 31, № 10. - P. 1819 - 1825.
23. Segerman A., Arnberg, N., Erikson A. et al. There are two different species B adenovirus receptors: sBAR, common to species B1 and B2 adenoviruses, and sB2AR, exclusively used by species B2 adenoviruses // J. Virol. - 2003. - Vol. 77. - P. 1157 - 1162.
24. Sena-Esteves M., Saeki Y., Fraefel C. et al. HSV-1 amplicon vectors - simplicity and versatility // Mol. Ther. - 2000. - Vol. 2, № 1. - P. 9 - 15.
25. Seow Y., Wood M. J. Biological gene delivery vehicles: beyond viral vectors // Molecular. Therapy. - 2009. - Vol. 17, № 5. - P. 767 - 777.
26. Sharma A., Lia X., Bangari D. S. et al. Adenovirus receptors and their implications in gene delivery // Virus. Res. - 2009. - Vol. 143, № 2. - P. 184 - 194.
27. Verhoeyen E., Cosset F. L. Surface-engineering of lentiviral vectors // J. Gene Med. - 2004. - Vol. 6 (Suppl 1). - P. 83 - 94.
28. Wanisch K., Ynez-Mucoz R. J. Integration-deficient lentiviral vectors: a slow coming of age // Molecular Therapy (www. moleculartherapy.org). - 2009. - Vol. 17, № 8. - P. 1316 - 1332.
29. Zaiss A. K., Machado H., Herschman H. R. TheQ1 influence of innate and pre-existing immunity on adenovirus therapy // J. Cell. Biochem. - 2009. - Vol. 108, № 4 (778. doi:10.1002/ jcb.22328).
30. Zeh H. J., Bartlett D. L. Development of a replication-selective, oncolytic poxvirus for the treatment of human cancers // Cancer Gene Therapy. - 2002. - Vol. 9. - P. 1001 - 1012.
31. Zhang X. Y., La Russa V. F., Reiser J. Transduction of bonemarrow-derived mesenchymal stem cells by using lentivirus vectors pseudotyped with modified RD114 envelope glycoproteins // J. Virol. - 2004. - Vol. 78. - P. 1219 - 1229.
[1] Амфотропный вирус — вирус, для которого характерен более широкий круг хозяев, чем это в норме свойственно вирусам данного вида.
[2] Термин «ампликон» в генетической литературе имеет и другое значение — «амплификат», т. е. ПЦР-продукт, наработанный в процессе реакции.
Библиографическое описание:
Супотницкий М.В. Генотерапевтические векторные системы на основе вирусов // Биопрепараты. - 2011. - № 3. - С. 15-26.

Михаил Васильевич Супотницкий
Российский микробиолог, полковник медицинской службы запаса, изобретатель, автор книг и статей по истории эпидемий чумы и других особо опасных инфекций, истории разработки и применения химического и биологического оружия. Заместитель главного редактора научно-практического журнала «Вестник войск РХБ защиты» Министерства обороны РФ.
Метки: 2011

